波纹龙虾Panulirus homarus隶属于十足目Decapoda龙虾科Palinuroidea龙虾属Panulirus,主要分布于印度洋-西太平洋海域。波纹龙虾是中国及世界主要的养殖龙虾品种之一,以小型鱼、虾、贝和藻类为食,其营养丰富、味道鲜美和经济价值较高[1-3]。中国主要在南方沿海地区养殖波纹龙虾,养殖产量逐年增加。与其他养殖虾类相比,波纹龙虾具有生长快、耐亚硝酸盐和抗病害等特点。在波纹龙虾集约化养殖过程中,饵料残余、粪便积累、水温和天气异常变化均会引起水质恶化[4-5],导致虾体产生应激反应,出现行动缓慢、摄食量减少和蜕壳不遂等现象,进而引起免疫力下降,严重时会导致龙虾中毒、死亡[6]。亚硝酸盐是波纹龙虾养殖中最常见的污染物,由水体环境中有机物分解和转化产生,其![]() 离子会破坏虾体鳃和血淋巴等组织结构,导致虾体免疫功能下降[7-8],进而使波纹龙虾的发病率、致死率升高,对其养殖生产带来较大损失。
离子会破坏虾体鳃和血淋巴等组织结构,导致虾体免疫功能下降[7-8],进而使波纹龙虾的发病率、致死率升高,对其养殖生产带来较大损失。
近年来,应用转录组技术分析甲壳动物在恶劣环境胁迫下的分子机制研究越来越受到人们的重视。周钱森[9]对锦绣龙虾Panulirus ornatus在氨氮质量浓度为20 mg/L胁迫下进行转录组学分析,筛选出一系列免疫和代谢相关基因,并推测高浓度氨氮导致锦绣龙虾机体产生严重的氧化应激。董丽君等[10]对凡纳滨对虾Litopenaeus vannamei进行低温胁迫转录组分析,发现低温能够影响凡纳滨对虾的免疫系统和相关代谢途径, 推测谷氨酰胺合成酶(glutamine synthetase, GS)和 C-型凝集素等差异表达基因参与了低温胁迫应答反应。Li等[11]对凡纳滨对虾进行低pH胁迫转录组分析,筛选出57个与酸碱渗透压有关基因。此外,也有文献报道了日本囊对虾Marsupenaeus japonicus[12]、日本沼虾Macrobrachium nipponense[13]和凡纳滨对虾[14]等甲壳动物对亚硝酸盐胁迫响应的转录组学分析,挖掘了较多功能基因,为基因功能的进一步研究提供了大量的数据。
目前,关于波纹龙虾的研究主要集中在繁殖生物学[2]、微生物学[15]、群体遗传学[16]和养殖[17]等方面,对其免疫、代谢等在转录组水平上进行的亚硝酸盐胁迫响应机理研究未见报道。本研究中,分析了亚硝酸盐胁迫下波纹龙虾转录组表达差异,探讨了环境胁迫对波纹龙虾重要调控基因的影响,以期为进一步挖掘相关功能基因、开发分子标记等提供支持。
1 材料与方法
1.1 材料
试验用波纹龙虾幼虾购自海南琼海市青葛村,体质量为(39.00±5.31) g,采用干运法运回广东海洋大学东海岛生物研究基地,在20 m3水泥池中暂养,用黑色幕布遮光,24 h不间断充气。试验海水取自自然海区,盐度为26~30,pH为8.1~8.3,每天换水50%,投喂菲律宾蛤仔Ruditapesp hilippinarum等鲜活饵料,暂养3周后开始正式试验。
反转录试剂盒、RNA提取试剂盒和实时荧光定量试剂盒均购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 亚硝酸盐胁迫试验 对照组用盐度为28的沙滤海水养殖![]() 亚硝酸盐胁迫组将NaNO2(分析纯)用沙滤海水配制成质量浓度为80 mg/L的
亚硝酸盐胁迫组将NaNO2(分析纯)用沙滤海水配制成质量浓度为80 mg/L的![]() 溶液,设置3个平行试验桶,每桶放3尾波纹龙虾。在该浓度下进行胁迫试验,每天更换相同浓度
溶液,设置3个平行试验桶,每桶放3尾波纹龙虾。在该浓度下进行胁迫试验,每天更换相同浓度![]() 的海水,7 d后分别从亚硝酸盐胁迫组各取3尾波纹龙虾的肝胰腺,另外从对照组取3尾波纹龙虾的肝胰腺,迅速置入RNA later中保存,送北京诺禾致源科技股份有限公司进行测序。
的海水,7 d后分别从亚硝酸盐胁迫组各取3尾波纹龙虾的肝胰腺,另外从对照组取3尾波纹龙虾的肝胰腺,迅速置入RNA later中保存,送北京诺禾致源科技股份有限公司进行测序。
1.2.2 RNA提取与质控 利用Trizol法分别对建库及定量试验所用波纹龙虾组织进行RNA提取,采用10 g/L琼脂糖凝胶电泳分析RNA纯度和完整性,采用Agilent 2100软件检测RNA的完整性,采用Qubit 2.0软件定量RNA浓度,采用Nanodrop软件检测RNA的纯度,并选择符合测序标准的RNA等量混合用于文库建设。
1.2.3 生物信息学分析 采用SMRTlink 7.0软件(https://www.pacb.com/support/software-downloads)分析和处理原始数据;采用LoRDEC 0.7软件(http://atgc.lirmm.fr/lordec)校正转录本;采用Cd-hit 4.6.8软件(https://github.com/weizhongli/cdhit)进行转录本去冗余;采用Bowtie2 2.3.4软件(http://bowtie-bio.sourceforge.net/bowtie2/index.shtml)进行转录本比对;采用RSEM 1.3.0软件(http://deweylab.github.io/RSEM/)进行转录本定量分析;采用DESeq 2软件(http://www.bioconductor.org/packages/release/bioc/html/DESeq.html)进行差异表达分析,以显著性差异P<0.05且差异倍数|log2(fold change)|>1作为筛选标准;采用GOseq 1.10.0软件(http://www.bioconductor.org/packages/release/bioc/html/goseq. html)对亚硝酸盐胁迫组和对照组差异表达基因进行GO富集分析;采用KOBAS 3.0软件(http://kobas.cbi.pku.edu.cn/download.php)进行KEGG富集分析。
1.2.4 荧光定量PCR(qRT-PCR)验证 从差异表达基因中随机挑选碳酸酐酶(carbonic anhydrase,CA)、细胞分裂周期蛋白42(cell division control protein 42,cdc42)等9个差异基因进行qRT-PCR 分析,以验证转录组数据的可靠性。采用Primer 5.0软件设计验证引物(表1),引物送生工生物工程(上海)股份有限公司合成。
表1 qRT-PCR引物序列
Tab.1 Primer sequences used in qRT-PCR experiments

基因 gene引物序列 primer sequence (5'-3')内参基因(β-actin)beta-actinF:CCATCCAGGCTGTGCTCTCTR:GCGGTGGTTGTTGAAGGTG组织蛋白酶1(catC1)cathepsin C1F:TCCTGGAGACGGAACGCTTR:CCCTGGGATAACACTGAACACG组织蛋白酶2(catC2)cathepsin C2F:CGACCTCCTATTGTGACCGCR:TGACCAACGCCTCCAGCATβ-葡萄糖醛酸酶(β-G)beta-glucuronidaseF:TGTGGGTCTCAGTGGTTTT-GGR:GGTCTGGTTGGATCTGCT-TCTT丝氨酸/苏氨酸蛋白磷酸酶(S/T-P-P) serine/threonine-protein phosphataseF:CGTAGGAGCAGGAA-CAGAACTR:CTAAGGGACGTGCAGCAAA肌动蛋白3(actin-3)actin-3F:AACTGGGACGACATGGAGAAR:AGGATGGCGTGAGGAAGAC肌球蛋白(MS)myosinF:CGGCACTATTACGACCAAGGR:CGGCACTATTACGACCAAGG碳酸酐酶(CA)carbonic anhydraseF:CATTTCCACTGGGGCTCTGR:GTCCTCACGCTCATAATCCT-TC细胞分裂周期蛋白42(cdc42)cell division control protein 42F: ACAAGGTGACAAGTTGAGC-CGR:CGTTTCTGGGGTTCTGGTGNF-kappa-B抑制剂α(NF-K-B) NF-kappa-B inhibitor alphaF:AACACCTCGGGCAGCACATR:CCAACAGCAAGTTAGC-CAGAC
1.3 数据处理
采用2-△△Ct法计算亚硝酸盐胁迫组、对照组基因的相对表达量,采用SPSS 25.0软件进行差异统计分析。
2 结果与分析
2.1 转录组测序数据分析
正常水质条件和亚硝酸盐胁迫下波纹龙虾肝胰腺的转录组测序数据见表2。从表2可见:测序获得的原始数据总量为137.22 G,过滤后得到的数据量为128.57 G;碱基GC含量为33.76%~48.26%,各组织样品Q20碱基百分比≥97.86%,Q30碱基百分比≥93.22%。这表明,测序产出质量符合要求,可用于后续组装分析。
表2 转录组数据统计情况
Tab.2 Data statistics of transcriptome
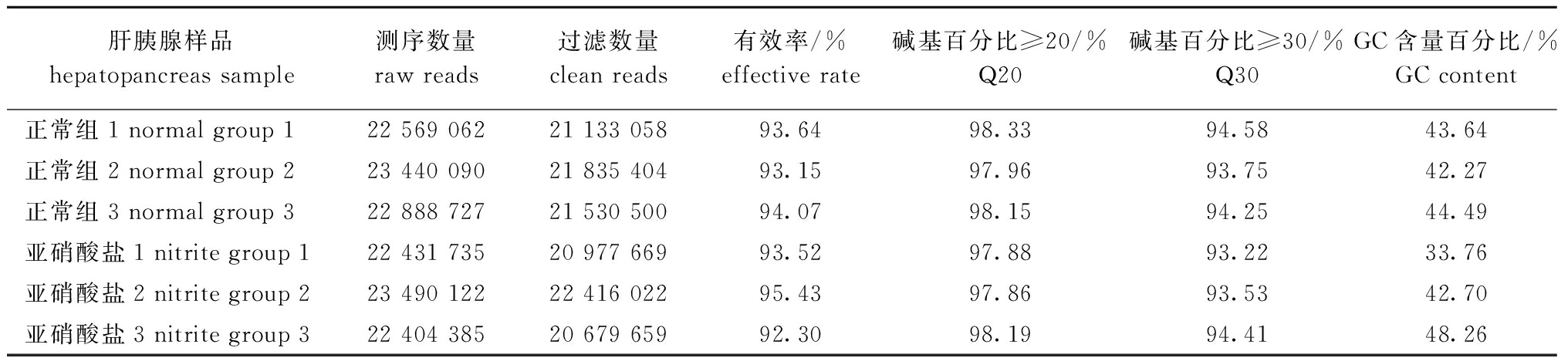
肝胰腺样品hepatopancreas sample测序数量raw reads过滤数量clean reads有效率/%effective rate碱基百分比≥20/%Q20碱基百分比≥30/%Q30GC含量百分比/%GC content正常组1 normal group 122 569 06221 133 05893.6498.3394.5843.64正常组2 normal group 223 440 09021 835 40493.1597.9693.7542.27正常组3 normal group 322 888 72721 530 50094.0798.1594.2544.49亚硝酸盐1 nitrite group 122 431 73520 977 66993.5297.8893.2233.76亚硝酸盐2 nitrite group 223 490 12222 416 02295.4397.8693.5342.70亚硝酸盐3 nitrite group 322 404 38520 679 65992.3098.1994.4148.26
2.2 差异表达基因分析
在P<0.05 且|log2(foldchange)|>1条件下,使用DESeq 2软件进行亚硝酸盐胁迫的差异表达分析,结果发现,差异表达基因(differentially expressed genes,DEG)数量共有264个,其中,表达上调的基因有86个,表达下调的基因有178个,并对差异表达基因分析结果绘制火山图(图1)。
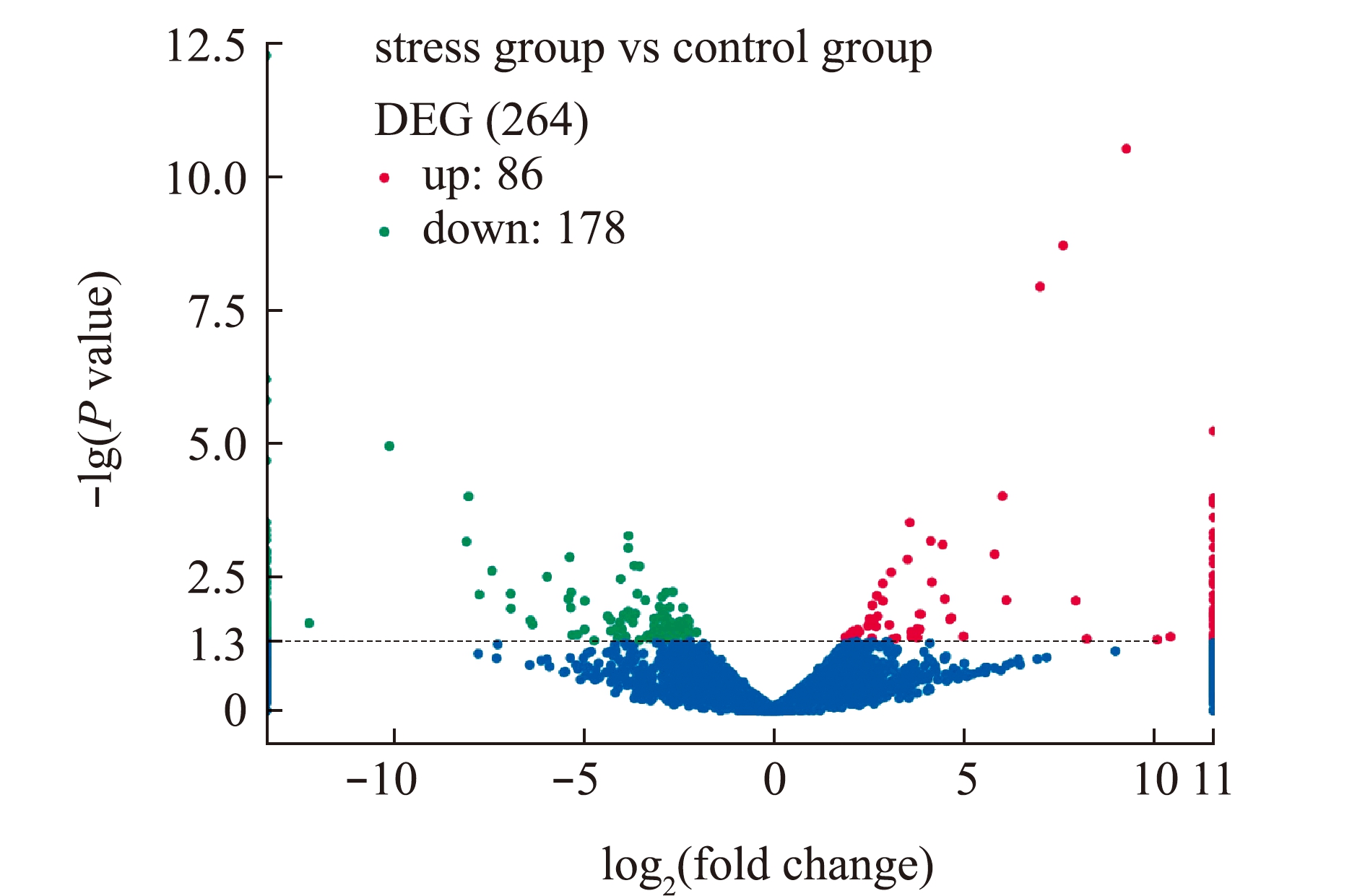
图1 差异表达基因数目统计
Fig.1 Number of differentially expressed genes (DEG)
2.3 差异表达基因的GO功能富集分析
为深入了解波纹龙虾在亚硝酸盐胁迫下的调控机制,对差异表达基因进行GO功能富集分析,将所有差异基因归类3大分支:细胞组分、生物学过程和分子功能。从图2可见:细胞组分以膜、细胞部分和细胞为主;生物学过程以代谢过程、细胞过程和单一生物体过程等功能为主;分子功能以结合、催化活性和蛋白结合为主。在亚硝酸盐胁迫下,结合、催化活性和代谢过程等调控过程中差异基因富集较为显著,这表明波纹龙虾肝胰腺组织中产生了大量参与机体细胞活动和代谢等过程的基因。
2.4 差异表达基因的KEGG注释和富集分析
将波纹龙虾亚硝酸盐胁迫组与对照组的差异表达基因(264个)进行KEGG注释,结果显示,有445个差异表达基因被注释在181个代谢通路中,这是某些差异基因被注释到多个通路的结果。其中,黏着斑、癌症蛋白多糖、细菌对上皮细胞的侵袭、癌症通路、紧密连接和志贺氏病等被注释到的基因数量较多(表3)。
表3 差异表达基因KEGG 通路分析(前8)
Tab.3 KEGG pathway analysis of differentially expressed genes (top eight)
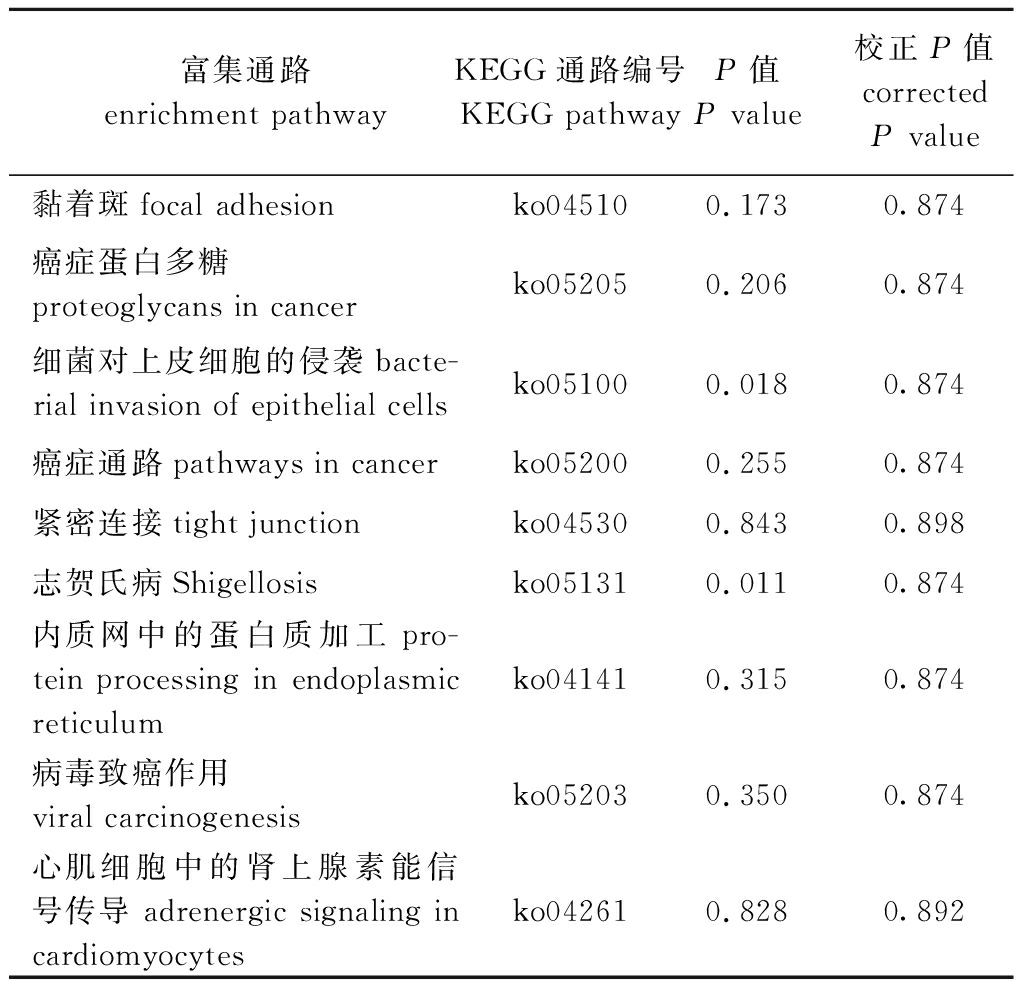
富集通路 enrichment pathwayKEGG通路编号 KEGG pathwayP值 P value校正P值corrected P value黏着斑focal adhesionko045100.1730.874癌症蛋白多糖 proteoglycans in cancerko052050.2060.874细菌对上皮细胞的侵袭bacte-rial invasion of epithelial cellsko051000.0180.874癌症通路pathways in cancerko052000.2550.874紧密连接tight junctionko045300.8430.898志贺氏病Shigellosisko051310.0110.874内质网中的蛋白质加工pro-tein processing in endoplasmic reticulumko041410.3150.874病毒致癌作用viral carcinogenesisko052030.3500.874心肌细胞中的肾上腺素能信号传导 adrenergic signaling in cardiomyocytesko042610.8280.892
通路的富集程度由富集因子和P值共同决定,富集因子值越大富集程度就越高,P值越小富集显著性就越显著。在KEGG所有代谢通路中筛选出20条显著富集通路,其中,富集程度最为显著的是黏着斑、白细胞跨内皮层迁移、胰岛素抵抗、淀粉与蔗糖代谢等代谢通路(表4)。
2.5 KEGG显著富集的信号通路展示
对显著富集的癌症通路进行展示,部分如图3所示,在该通路中标红色的基因表示差异显著基因。其中,Filamin(菲拉明)和paxillin(茯苓素)基因有两个亚型,KEGG通路编号分别为ko4337和ko5760,其余α2β1(集成素α2)、α5β1(集成素α5)、cdc42(细胞分裂周期蛋白42)、F-actin/actin(肌动蛋白β)、HIFIα(低氧诱导因子1α)和casp3(卡西普酶3)分别只有一个亚型基因。

图2 差异表达基因GO富集分析
Fig.2 GO enrichment analysis of differentially expressed genes
表4 KEGG富集部分结果
Tab.4 Partial results of KEGG enrichment
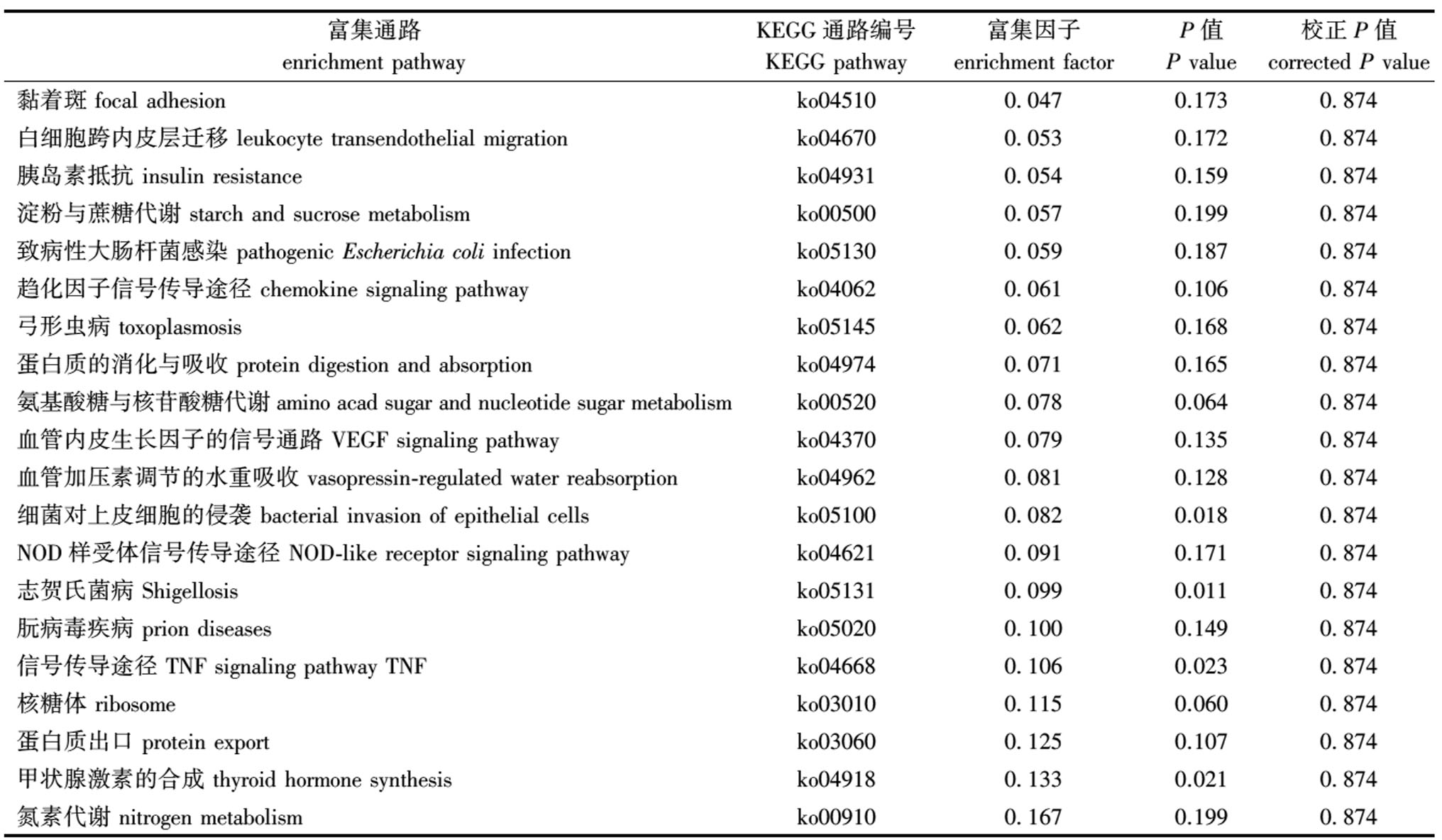
富集通路 enrichment pathwayKEGG通路编号KEGG pathway富集因子 enrichment factorP值 P value校正P值corrected P value黏着斑 focal adhesionko045100.0470.1730.874白细胞跨内皮层迁移 leukocyte transendothelial migrationko046700.0530.1720.874胰岛素抵抗 insulin resistanceko049310.0540.1590.874淀粉与蔗糖代谢 starch and sucrose metabolismko005000.0570.1990.874致病性大肠杆菌感染 pathogenic Escherichia coli infectionko051300.0590.1870.874趋化因子信号传导途径 chemokine signaling pathwayko040620.0610.1060.874弓形虫病 toxoplasmosisko051450.0620.1680.874蛋白质的消化与吸收 protein digestion and absorptionko049740.0710.1650.874氨基酸糖与核苷酸糖代谢 amino acad sugar and nucleotide sugar metabo-lismko005200.0780.0640.874血管内皮生长因子的信号通路 VEGF signaling pathwayko043700.0790.1350.874血管加压素调节的水重吸收 vasopressin-regulated water reabsorptionko049620.0810.1280.874细菌对上皮细胞的侵袭 bacterial invasion of epithelial cellsko051000.0820.0180.874NOD样受体信号传导途径 NOD-like receptor signaling pathwayko046210.0910.1710.874志贺氏菌病 Shigellosisko051310.0990.0110.874朊病毒疾病 prion diseasesko050200.1000.1490.874信号传导途径 TNF signaling pathway TNFko046680.1060.0230.874核糖体 ribosomeko030100.1150.0600.874蛋白质出口 protein exportko030600.1250.1070.874甲状腺激素的合成 thyroid hormone synthesisko049180.1330.0210.874氮素代谢 nitrogen metabolismko009100.1670.1990.874
2.6 荧光定量 PCR验证
从差异表达基因中随机选取catC1、catC2、β-G、S/T-P-P、actin-3、MS、CA、cdc42、NF-K-B共9个基因进行qRT-PCR 验证,比较结果如图4所示,荧光定量PCR分析结果与转录组测序结果基本一致,这表明转录组测序数据具有一定的可信度。

图3 部分癌症蛋白多糖通路图
Fig.3 Part picture of cancer proteoglycan pathway
3 讨论
3.1 波纹龙虾转录组差异基因表达分析
近年来,随着养殖产业规模的扩大,环境因子的改变已成为影响甲壳动物养殖产生的主要因素,亚硝酸盐是环境变化的一个主要污染物,给养殖中的虾类带来许多不良的影响[6]。转录组学技术已在水产甲壳动物的发育、免疫和生长研究中发挥着重要作用[18]。本研究中,亚硝酸盐胁迫下波纹龙虾肝胰腺组织中参与胁迫响应相关的差异基因涉及能量代谢、生长及免疫等多个生物学过程。
沈晔等[19]对脊尾白虾Exopalaemon carinicauda低盐胁迫度响应的转录组学分析发现,最显著变化的GO通路为水解酶活性、脂质转运蛋白活性和跨膜转运蛋白活性等,显著变化的KEGG通路有赖氨酸生物合成、溶酶体、血管内皮生长因子信号通路和色氨酸代谢等。曹梅等[20]对脊尾白虾低氧胁迫响应的转录组学分析发现,显著变化的KEGG通路有核糖体、RNA转运和内质网中蛋白质加工等。周钱森[9]对锦绣龙虾氨氮胁迫响应的转录组分析发现,显著变化的KEGG通路有精氨酸生物合成、溶酶体通路、Toll样受体通路、丙氨酸代谢及天冬氨酸与谷氨酸代谢等。Guo等[21]对凡纳滨对虾进行亚硝酸盐胁迫转录组学分析,得到 1 922个差异表达基因,这些基因主要富集在免疫防御、异种生物的生物降解与代谢、氨基酸与核碱代谢过程和细胞凋亡等通路。本研究中,对波纹龙虾响应亚硝酸盐胁迫的转录组测序发现,显著差异的GO通路为结合、催化活性、代谢过程、细胞过程和单一生物过程等,显著变化的KEGG通路有黏着斑、癌症蛋白多糖、细菌对上皮细胞侵袭、癌症通路和紧密连接等,其中,注释到紧密连接通路的差异表达基因最多(9条)。物种差异和胁迫的条件及时间不同,导致对其影响的方式、作用部位和相对应的通路也有所差异,也有可能是不同测序公司对差异表达基因的筛选标准不同,导致不同研究者得出的结果有所差异。
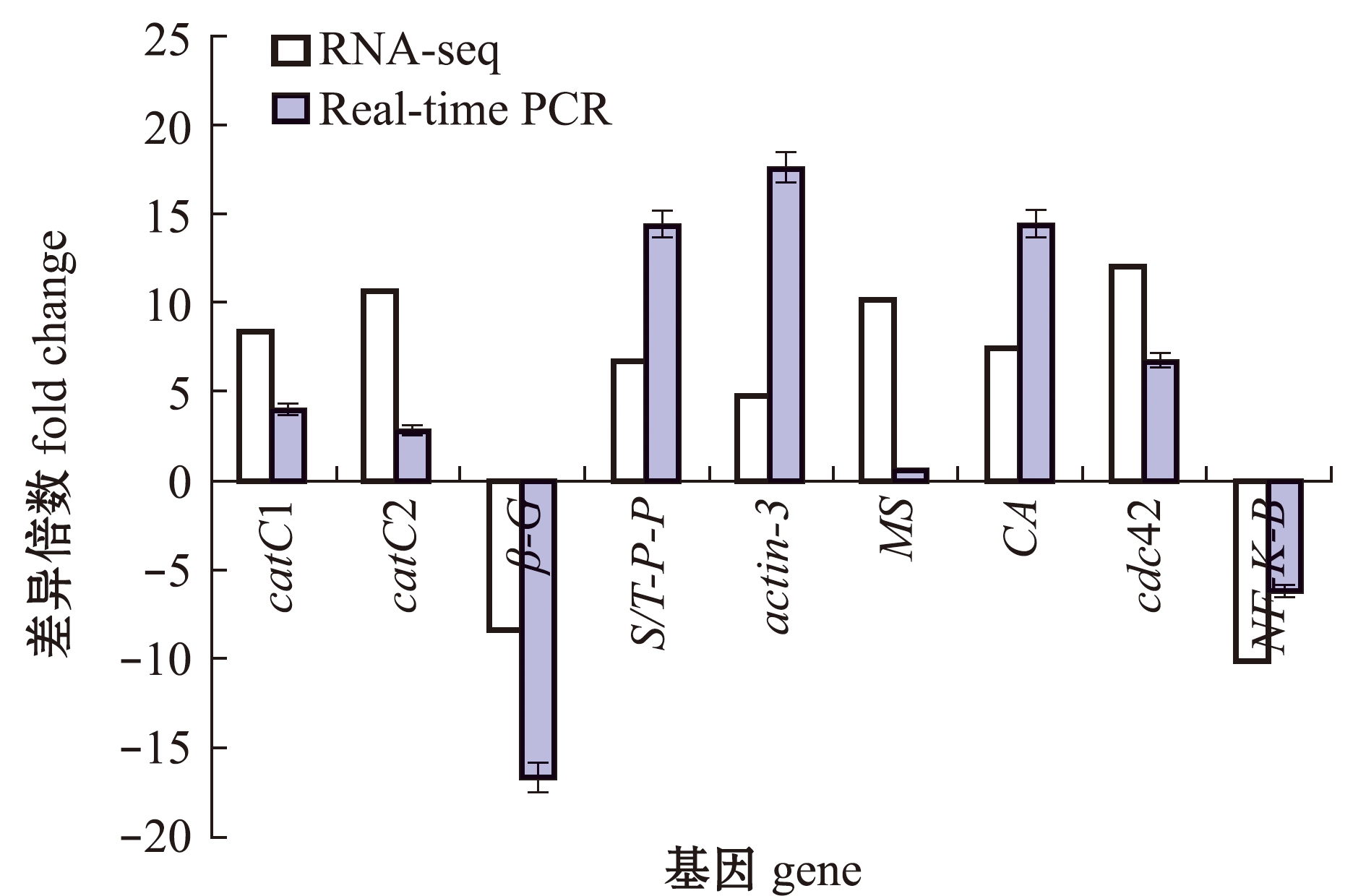
图4 转录组测序的qRT-PCR 验证
Fig.4 Verification of transcriptome sequencing by qRT-PCR
3.2 波纹龙虾对亚硝酸盐胁迫响应的相关基因分析
3.2.1 波纹龙虾的代谢响应 本研究中KEGG富集显示,波纹龙虾在亚硝酸盐胁迫下所产生的差异基因在代谢相关的通路被显著富集,如淀粉与蔗糖代谢、氨基酸糖与核苷酸糖代谢及氮素代谢等通路,GO 功能富集分析也显示,细胞代谢和有机生物代谢等过程被富集。这与对锦绣龙虾氨氮胁迫转录组的富集结果相似[9]。其中,具有代表性的差异基因是谷氨酰胺和碳酸酐酶基因,谷氨酰胺基因在胁迫下显著上调,推测其在机体的排毒机制中起着重要作用;而碳酸酐酶基因是维持机体酸碱平衡的重要成员,能够排除体内多余的CO2[22], 这说明亚硝酸盐胁迫影响了波纹龙虾机体的渗透压平衡和呼吸排泄作用。此外还发现,亚硝酸盐胁迫下差异基因在甘油酯代谢和脂肪酸降解等通路中富集。对锦绣龙虾和日本囊对虾转录组分析也发现,差异基因在甘油酯代谢和脂肪酸降解等通路富集[9,12]。推测在亚硝酸盐胁迫下,脂类代谢活动增强,通过不断提供能量以便机体响应亚硝酸盐胁迫。
3.2.2 波纹龙虾的生长响应 本研究中通过对波纹龙虾亚硝酸盐胁迫差异表达基因KEGG富集分析发现,胰岛素分泌、胰岛素抵抗和胰岛素信号等通路显著富集,主要参与了波纹龙虾的生长调控,参与生长调控的基因有丝氨酸/苏氨酸、肌动/肌球蛋白和细胞分裂周期蛋白42(cdc42)等。丝氨酸/苏氨酸基因具有一种独特的作用,不仅能够连接肌动/肌球蛋白骨架和cdc42[23],而且还能够调节胰岛素样生长因子1(IGF)的分泌,对促进细胞生长具有重要作用[24]。此外,丝氨酸/苏氨酸基因还参与了细胞凋亡、细胞迁移和肿瘤形成等过程[23-25]。cdc42基因对细胞生长、增殖和黏附有重要作用,参与了机体的生长过程[26]。波纹龙虾的生长调控受到多种基因的共同作用,相关验证还需要进一步开展。
3.2.3 波纹龙虾的免疫响应 本研究中,部分差异表达基因在白细胞跨内皮层迁移、癌症蛋白多糖、细菌对上皮细胞的侵袭、Toll样受体通路、血小板活化和溶酶体通路等与机体免疫和损伤相关的通路得到显著富集,相关基因数量较多,且这些基因显著富集到较多的应激相关通路,这说明波纹龙虾在胁迫下产生强烈的应激反应。组织蛋白酶是溶酶体中天冬氨酸蛋白酶家族的重要成员之一,可降解溶酶体中各种各样的蛋白质[27]。本研究中,β-葡萄糖醛酸酶基因在溶酶体通路中显著下调,组织蛋白酶和β-葡萄糖醛酸酶基因是波纹龙虾免疫信号传导通路中的关键性成员;癌症蛋白多糖通路在亚硝酸盐胁迫下,参与该通路的差异基因数目最多,且差异基因表达明显上调,其中,参与波纹龙虾体内相关免疫的茯苓素基因显著上调,据相关文献记载,茯苓素基因具有特异性杀伤肿瘤细胞而对正常细胞无害的作用[28],茯苓素基因还具有细胞信息传递和细胞周期调节等作用。此外,富集在这些免疫通路的差异基因还有cdc42、集成素β1、Filamin和肌动蛋白β等,它们均为波纹龙虾亚硝酸盐胁迫响应下的重要免疫分子。
4 结论
1)通过分析波纹龙虾肝胰腺组织在亚硝酸盐胁迫下的转录表达差异,发现亚硝酸盐影响波纹龙虾肝胰腺组织基因表达水平,差异基因主要富集在能量代谢、生长及免疫等多个通路。
2)通过荧光定量PCR验证差异基因的表达情况,结果与转录组测序结果相似,这说明转录组测序结果具有一定可行度。
3)亚硝酸盐对波纹龙虾的能量代谢、生长及免疫具有显著影响,本试验结果为解析波纹龙虾亚硝酸盐胁迫响应的分子机制提供了数据资料。
[1] 卓宏标,郑秋耀,梁华芳,等.波纹龙虾蜕壳周期的呼吸排泄和血淋巴生理学[J].广东海洋大学学报,2019,39(5):24-30.
ZHUO H B,ZHENG Q Y,LIANG H F,et al.Respiration,excretion and physiological changes of hemolymph of Panulirus homarus during molt cycle[J].Journal of Guangdong Ocean University,2019,39(5):24-30.(in Chinese)
[2] 罗嘉俊,卓宏标,陈俊涛,等.波纹龙虾性腺抑制激素(GIH)基因克隆、表达及其对光周期的响应[J].大连海洋大学学报,2021,36(5):727-735.
LUO J J,ZHUO H B,CHEN J T,et al.Cloning,expression and photoperiodic response of gonad-inhibiting hormone (GIH) gene in scalloped spiny lobster Panulirus homarus[J].Journal of Dalian Ocean University,2021,36(5):727-735.(in Chinese)
[3] ZHUO H B,LIANG H F,CAI C X,et al.Molecular cloning,characterization and expression analysis of the ecdysone receptor from the spiny lobster Panulirus homarus (Linnaeus,1758) (Decapoda,Palinuridae)[J].Crustaceana,2020,93(7):769-783.
[4] 刘莎,黄小丽,李良玉,等.氨氮、亚硝酸盐胁迫对小龙虾的影响[J].水产养殖,2021,42(1):56-57.
LIU S,HUANG X L,LI L Y,et al.Effects of ammonia nitrogen and nitrite stress on Procambarus clarki[J].Journal of Aquaculture,2021,42(1):56-57.(in Chinese)
[5] 江苏绿科生物技术有限公司技术部.虾塘亚硝酸盐偏高的原因及处理方法[J].科学养鱼,2014(3):86.
Technical Department of Jiangsu Greentech Biotechnology Company.Causes and treatment methods of high nitrite in shrimp pond[J].Scientific Fish Farming,2014(3):86.(in Chinese)
[6] 余苗苗,江敏,吴昊,等.亚硝酸盐和氨对日本沼虾肝胰腺代谢的影响[J].生态毒理学报,2019,14(3):99-111.
YU M M,JIANG M,WU H,et al.Effects of nitrite and ammonia on the hepatopancreas metabolism of Macrobrachium nipponensis [J].Asian Journal of Ecotoxicology,2019,14(3):99-111.(in Chinese)
[7] 陈亭君,刘建勇,申玉春,等.亚硝酸盐氮对日本囊对虾幼虾的急性毒性研究[J].渔业现代化,2019,46(3):35-40.
CHEN T J,LIU J Y,SHEN Y C,et al.Study on acute toxicity of nitrite to juvenile shrimp Marsupenaeus japonicus[J].Fishery Modernization,2019,46(3):35-40.(in Chinese)
[8] 潘训彬,张秀霞,鲁耀鹏,等.氨氮和亚硝酸盐对红螯螯虾幼虾和亚成虾的急性毒力[J].生物安全学报,2017,26(4):316-322.
PAN X B,ZHANG X X,LU Y P,et al.Acute toxicity of ammonia and nitrite on juvenile and subadult redclaw crayfish(Cherax quadricarinatus)[J].Journal of Biosafety,2017,26(4):316-322.(in Chinese)
[9] 周钱森.锦绣龙虾对氨氮胁迫的生理响应机制研究[D].上海:上海海洋大学,2021.
ZHOU Q S.Research on physiological response mechanism of Panulirus ornatus to ammonia nitrogen stress[D].Shanghai:Shanghai Ocean University,2021.(in Chinese)
[10] 董丽君,孟宪红,孔杰,等.基于转录组分析筛选凡纳滨对虾低温胁迫下的差异表达基因[J].中国水产科学,2019,26(1):161-171.
DONG L J,MENG X H,KONG J,et al.Screening of differentially expressed genes related to the cold tolerance in Litopenaeus vannamei based on high-throughput transcriptome sequencing[J].Journal of Fishery Sciences of China,2019,26(1):161-171.(in Chinese)
[11] LI H M,MENG Q L,CHEN T,et al.Transcriptomic response to low pH stress in gills of the Pacific white shrimp,Litopenaeus vannamei[J].Aquaculture Research,2020,51(1):175-186.
[12] 陈亭君.低盐、高亚硝酸盐胁迫日本囊对虾转录组分析及MjTPS基因克隆和功能研究[D].湛江:广东海洋大学,2020.
CHEN T J.Transcriptome analysis and MjTPS gene cloning and function of Marsupenaeus japonicus under low salinity and high nitrite stress[D].Zhanjiang:Guangdong Ocean University,2020.(in Chinese)
[13] 于杰伦.日本沼虾免疫应答相关基因的筛选与鉴定[D].泰安:山东农业大学,2019.
YU J L.Identification and characterization of immune response related genes of Macrobrachium nipponense[D].Taian:Shandong Agricultural University,2019.(in Chinese)
[14] GUO H,XIAN J N,WANG A L.Analysis of digital gene expression profiling in hemocytes of white shrimp Litopenaeus vannamei under nitrite stress[J].Fish & Shellfish Immunology,2016,56:1-11.
[15] SUDEWI S,WIDIASTUTI Z,WARDANA I K,et al.The occurrence and sequence analysis of milky hemolymph disease in lobster Panulirus homarus from different locations in Indonesia[J].Journal of Aquaculture and Fish Health,2020,9(1):48.
[16] PERMANA G N,SLAMET B,PERMANA B A,et al.Population genetic structure of spiny lobsters,Panulirus homarus and Panulirus ornatus,in the Indian Ocean,coral triangle,and South China Sea[J].Indonesian Aquaculture Journal,2019,14(1):7.
[17] 黄东科,梁华芳.盐度和体质量对波纹龙虾耗氧率和排氨率的影响[J].广东海洋大学学报,2012,32(4):8-11.
HUANG D K,LIANG H F.Effects of salinity and body weight on oxygen consumption rate and ammonia excretion rate of Panulirus homarus[J].Journal of Guangdong Ocean University,2012,32(4):8-11.(in Chinese)
[18] 江红霞,刘慧芬,马晓,等.转录组测序筛选克氏原螯虾卵巢发育、免疫和生长相关基因[J].水产学报,2021,45(3):396-414.
JIANG H X,LIU H F,MA X,et al.Transcriptome analysis of Procambarus clarkii to screen genes related to ovary development,immunity and growth[J].Journal of Fisheries of China,2021,45(3):396-414.(in Chinese)
[19] 沈晔,王兴强,曹梅,等.脊尾白虾对低盐胁迫响应的转录组学分析[J].南方水产科学,2020,16(5):19-32.
SHEN Y,WANG X Q,CAO M,et al.Transcriptome analysis of Exopalaemon carinicauda under low salinity stress[J].South China Fisheries Science,2020,16(5):19-32.(in Chinese)
[20] 曹梅,王兴强,秦传新,等.脊尾白虾对低氧响应的转录组学分析[J].渔业科学进展,2021,42(2):112-123.
CAO M,WANG X Q,QIN C X,et al.Transcriptome analysis of Palaemon carincauda subjected to hypoxic stress[J].Progress in Fishery Sciences,2021,42(2):112-123.(in Chinese)
[21] GUO H,XIANG J A,WANG A L.Analysis of digital gene expression profiling in hemocytes of white shrimp Litopenaeus vannamei under nitrite stress[J].Fish and Shellfish Immunology, 2016, 56:1-11.
[22] 刘亚茹.细胞表面展示碳酸酐酶及其酶学性质研究[D].天津:天津大学,2020.
LIU Y R.Cell surface display of carbonic anhydrase and its enzymology properties[D].Tianjin:Tianjin University,2020.(in Chinese)
[23] 胡元庆,张宏权.丝氨酸/苏氨酸蛋白激酶4生物学特性的研究进展[J].癌变·畸变·突变,2010,22(1):75-77.
HU Y Q,ZHANG H Q.Research progress on biological characteristics of serine/threonine protein kinase4[J].Carcinogenesis,Teratogenesis & Mutagenesis,2010,22(1):75-77.(in Chinese)
[24] 陆迪菲,白歌,马晓伟,等.丝氨酸/苏氨酸蛋白激酶11研究进展与糖尿病的关系[J].中国糖尿病杂志,2018,26(1):80-83.
LU D F,BAI G,MA X W,et al.Research progress of serine-threonine protein kinase 11 and its relationship with diabetes[J].Chinese Journal of Diabetes,2018,26(1):80-83.(in Chinese)
[25] 金星.磷脂酰肌醇-3激酶-丝氨酸/苏氨酸蛋白激酶信号通路调节钠碘转运体表达的研究进展[J].中华地方病学杂志,2015,34(3):232-234.
JIN X.Research progress on phosphatidylinositol-3 kinase serine/threonine protein kinase signaling pathway regulating the expression of sodium iodine transporter[J].Chinese Journal of Endemiology,2015,34(3):232-234.(in Chinese)
[26] 胡颖,梁涛,张骏.细胞分裂周期蛋白42在神经系统疾病中机制的研究进展[J].医学综述,2019,25(6):1076-1080,1089.
HU Y,LIANG T,ZHANG J.Research progress of mechanism of cell division cycle 42 in common nervous system diseases[J].Medical Recapitulate,2019,25(6):1076-1080,1089.(in Chinese)
[27] WANG S,SHI L J,LIUN,et al.Involvement of Fenneropenaeus chinensis cathepsin C in antiviral immunity[J].Fish & Shellfish Immunology,2012,33(4):821-828.
[28] 周立,张玮,蔺惠颜,等.茯苓素诱生肿瘤坏死因子(TNF)的作用[J].中国抗生素杂志,1994,19(5):376-380.
ZHOU L,ZHANG W,LIN H Y,et al.Potentiation of inductive secretion of tumor necrosis factor by poriatin[J].Chinese Journal of Antibiotics,1994,19(5):376-380.(in Chinese)