凡纳滨对虾Litopenaeus vannamei又称南美白对虾,在盐度为0.5~35时均可生长,生长适宜温度为22~35 ℃,具有抗病力强、生长快和肉质鲜美等优点[1]。鱼粉作为配合饲料中不可或缺的原料,其蛋白质、必需氨基酸含量高且易被水产动物消化吸收,然而,由于自然条件恶化,导致全球鱼粉产量下降,价格飞涨[2]。因此,寻找鱼粉替代品以降低成本,是饲料企业和营养学者关注的热点[3]。
鱼肽是把低值海杂鱼及水产加工副产物经过复合生物酶解并低温干燥制备的活性肽产品,其应用于幼龄动物,容易被消化吸收,适口性好且具有一定的诱食效果,可显著提高摄食量,降低饲料成本。研究表明,肽类产品具有促进鱼类生长的作用[4],在饲料中添加适量的肽能够节省部分鱼粉,对大西洋鲑Salmo salar[5]、鮸状黄姑鱼Nibea miichthioides[6]和南亚野鲮Labeo rohita等[7]的研究表明,肽产品替代部分鱼粉是可行的。贾高旺等[8]研究表明,酶解肽替代饲料鱼粉比例超过8%时,会降低大菱鲆Scophthalmus maximus的生长性能,超过16%时严重影响大菱鲆的脂肪吸收代谢机能。因此,高比例酶解肽替代鱼粉会对动物机体产生影响。
目前,由于植物蛋白价格低廉、产量高,因此,其已成为鱼粉的良好替代品。在植物蛋白饲料中添加酶制剂,可以将大分子蛋白水解成小分子,利于幼鱼消化,还可以分解抗营养因子[9]。有研究报道,蛋白酶可显著改善虹鳟Oncorhynchus mykiss的表观消化率[10],也可以降低鲤Cyprinus carpio饲料系数,促进鲤和青鱼Mylopharyngodon piceus[11-12]的生长。
肠道菌群是肠道中多种微生物共同作用的结果,能够调节肠道结构,对机体健康发挥着重要的作用[13]。本试验中,研究了饲料中添加鱼肽和蛋白酶对凡纳滨对虾生长、消化酶及肠道菌群产生的影响,探讨了鱼肽与蛋白酶替代部分鱼粉的效果,以期为水产饲料的制备提供新的思路。
1 材料与方法
1.1 材料
虾苗购自唐山禾丰科技有限公司。鱼肽和蛋白酶制剂购自秦皇岛益尔生物科技有限公司。
1.2 方法
1.2.1 试验饲料的配制 鱼肽制剂的主要营养成分:粗蛋白质含量为35%,粗脂肪含量为3%,小肽含量为5%,酸溶蛋白含量为25%。蛋白酶制剂的酶含量为175 mg/kg(60万活力单位)。以含25%的鱼粉饲料作为基础饲料(对照),在基础饲料中,分别添加5%的鱼肽和0.3%的蛋白酶替代5%的鱼粉(均为质量分数)作为试验饲料。将原料粉碎过198 μm孔径的筛,按配方比例混合,用双螺杆压条机制成1.2 mm直径的颗粒饲料,置于-20 ℃冰箱中保存备用。鱼肽分子质量分布见表1,饲料配方及营养水平见表2。
表1 鱼肽的分子质量分布
Tab.1 Molecular weight distribution of enzymatic peptides

相对分子质量 relative molecular weight分布 distribution/%<18028.82180~50033.03501~1 00014.841 001~5 00023.31
表2 饲料组成及营养水平(干物质基础)
Tab.2 Ingredient and proximate nutrient composition of experimental diets (dry mass basis) w/%
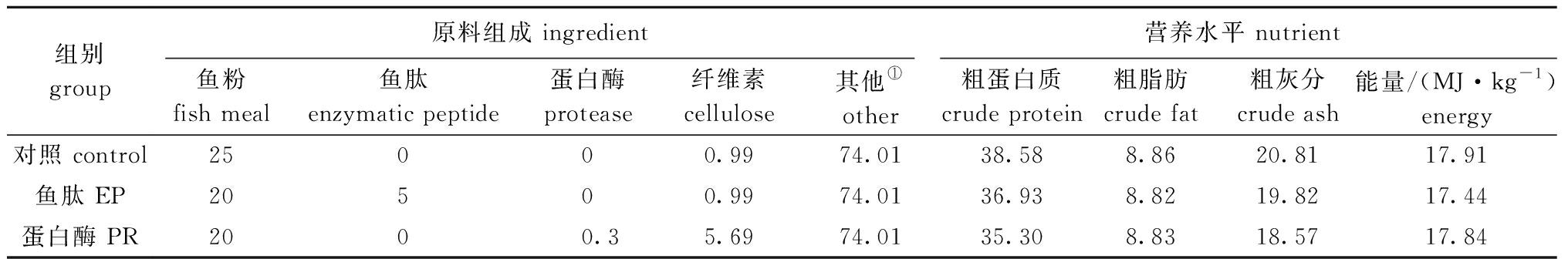
组别group原料组成 ingredient营养水平 nutrient鱼粉fish meal鱼肽enzymatic peptide蛋白酶protease纤维素cellulose其他①other粗蛋白质crude protein粗脂肪crude fat粗灰分crude ash能量/(MJ·kg-1)energy对照 control25000.9974.01 38.588.8620.8117.91鱼肽 EP20500.9974.01 36.938.8219.8217.44蛋白酶 PR2000.35.6974.01 35.308.8318.5717.84
注:① 其他包含面粉 22.5%、虾粉 10.0%、花生粕 5.0%、豆粕 23.0%、鱼油 2.5%、玉米油 2.0%、卵磷脂 1.0%、磷酸酯 0.5%、氯化胆碱 0.5%、复合维生素 2.0%、复合矿物盐 1.0%、Ca(H2PO4)2 2.0%、羧甲基纤维素 2.0%和三氧化二钇 0.01%。
Note:① others include 22.5% of wheat flour,10.0% shrimp meal, 5.0% peanut meal, 23.0% soybean meal, 2.5% fish oil, 2.0% corn oil, 1.0% lecithin, 0.5% phosphate, 0.5% choline chloride, 2.0% compound vitamin, 1.0% compound mineral salt, 2.0% Ca(H2PO4)2, 2.0% CMC, and 0.01% Y2O3.
1.2.2 试验设计与饲养管理 将凡纳滨对虾苗在水族箱中暂养两周后进行分组,挑选规格均匀、体质健康、体质量为(0.32±0.01)g的虾苗360尾进行试验,试验设置鱼肽组(EP)、蛋白酶组(PR)和对照组,每组设3个平行,每个平行放40尾虾苗,分别投喂对应3种饲料。试验过程中,每日早晨检测水质,水温保持在28 ℃左右,溶解氧含量为(7.6±0.7)mg/L,氨氮含量为(0.48±0.13)mg/L,pH为8.0~8.6。每天上午替换1/3的新鲜海水,每天8:00、14:00、20:00定时喂食[14-15],两周称重一次。 养殖试验共进行56 d。
1.2.3 样品采集与指标测定 最后一次投喂1 h后,从每缸取3尾对虾,使用灭菌的解剖工具,将饱食后的虾肠道取出,置于-80 ℃超低温冰箱中保存,并送至上海元莘生物有限公司测序。养殖结束后空腹24 h采集样品。首先,对每个水族箱内的虾进行称重,用于计算生长指标;从每个水族箱随机取3尾虾,用纱布吸干表面水分,采集血液并加入抗凝剂,血液与抗凝剂体积比为1∶2,4 ℃下以3 000 r/min离心10 min,沉淀后取上清液,送至秦皇岛海港医院测定血清生化指标;再从水族箱随机取10尾虾,用于测定体营养成分,采用烘干失重法、索氏抽提法、凯氏定氮法和马弗炉灰化法(550 ℃,9 h)分别测定水分、粗脂肪、粗蛋白质和灰分含量;再从水族箱随机取8尾虾,取出其肠道,采用南京建成生物有限公司试剂盒测定肠道胃蛋白酶、脂肪酶含量;在每次投喂饲料1 h后,用吸管吸出新鲜、饱满、成型的粪便,置入-80 ℃超低温冰箱中冷冻保存待测,采用酸消化比色法测定饲料和粪便中的三氧化二钇(Y2O3)含量。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 17软件进行单因素方差分析(one-way ANOVA),若差异显著,则用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 鱼肽和蛋白酶对凡纳滨对虾生长性能的影响
从表3可见:饲料中添加鱼肽和蛋白酶,对凡纳滨对虾的增重率、终末体质量、含肉率和肝体比有显著性影响(P<0.05),而对存活率、饲料系数和特定生长率则无显著性影响(P>0.05);与对照组相比,鱼肽、蛋白酶组的终末体质量、增重率显著提高(P<0.05),存活率和特定生长率也有所提高,但无显著性差异(P>0.05),饲料系数有所降低(P>0.05)。
2.2 鱼肽和蛋白酶对凡纳滨对虾体成分组成的影响
从表4可见:与对照组相比,鱼肽、蛋白酶组全虾和肌肉中的粗蛋白质含量显著提高(P<0.05),粗脂肪和灰分含量显著降低(P<0.05);两组肝脏中粗脂肪含量也显著提高(P<0.05)。
表3 鱼肽和蛋白酶对凡纳滨对虾生长性能的影响
Tab.3 Effects of enzymatic peptide and protease on growth performance of Pacific white shrimp Litopenaeus vannamei

组别group初始体质量/gIBW终末体质量/gFBW增重率/%WGR特定生长率/(%·d-1)SGR饲料系数FCR存活率/%SR肝体比/%HSI含肉率/%MR对照 control0.32±0.015.92±0.05c1 733.38±53.65c5.19±0.051.47±0.0993.67±6.113.32±0.06a63.06±0.80b鱼肽 EP0.32±0.016.50±0.03a1 854.05±43.20a5.29±0.031.36±0.2097.33±2.083.08±0.05c64.82±0.41a蛋白酶 PR0.33±0.016.10±0.03b1 778.91±33.89b5.23±0.031.41±0.0398.00±1.003.22±0.06b62.87±0.47b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
表4 鱼肽和蛋白酶对凡纳滨对虾体成分组成的影响(干物质基础)
Tab.4 Effects of enzymatic peptide and protease on body composition of Pacific white shrimp Litopenaeus vannamei (dry matter basis)w/%
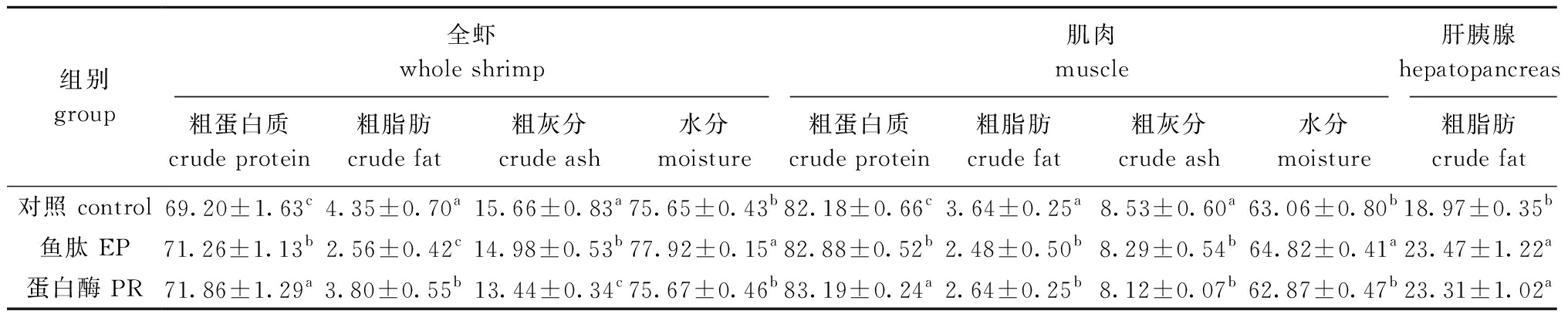
组别group全虾whole shrimp肌肉muscle肝胰腺hepatopancreas粗蛋白质crude protein粗脂肪crude fat粗灰分crude ash水分moisture粗蛋白质crude protein粗脂肪crude fat粗灰分crude ash水分moisture粗脂肪crude fat对照 control69.20±1.63c4.35±0.70a15.66±0.83a75.65±0.43b82.18±0.66c3.64±0.25a8.53±0.60a63.06±0.80b18.97±0.35b鱼肽 EP71.26±1.13b2.56±0.42c14.98±0.53b77.92±0.15a82.88±0.52b2.48±0.50b8.29±0.54b64.82±0.41a23.47±1.22a蛋白酶 PR71.86±1.29a3.80±0.55b13.44±0.34c75.67±0.46b83.19±0.24a2.64±0.25b8.12±0.07b62.87±0.47b23.31±1.02a
2.3 鱼肽和蛋白酶对凡纳滨对虾表观消化率的影响
从表5可见,鱼肽、蛋白酶组的干物质和粗蛋白质的表观消化率均显著高于对照组(P<0.05),且各组间均有显著性差异(P<0.05)。
表5 鱼肽和蛋白酶对凡纳滨对虾表观消化率的影响
Tab.5 Effects of enzymatic peptide and protease on apparent digestibility of Pacific white shrimp Litopenaeus vannamei %
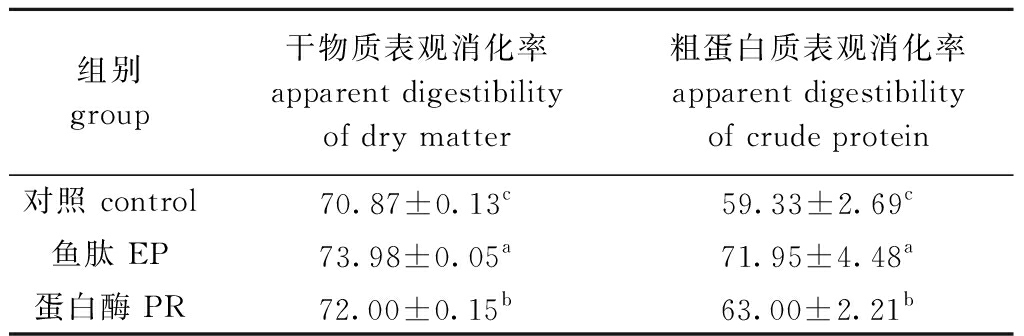
组别group干物质表观消化率apparent digestibility of dry matter粗蛋白质表观消化率apparent digestibility of crude protein对照 control70.87±0.13c59.33±2.69c鱼肽 EP73.98±0.05a71.95±4.48a蛋白酶 PR72.00±0.15b63.00±2.21b
2.4 鱼肽和蛋白酶对凡纳滨对虾血清生化指标和肠道消化酶活性的影响
从表6可见,蛋白酶组血清葡萄糖含量显著高于其他两组(P<0.05),鱼肽、蛋白酶组总胆固醇、甘油三酯含量均显著低于对照组(P<0.05)。
从表7可见,各组间脂肪酶、胃蛋白酶活性有显著性差异(P<0.05),且鱼肽、蛋白酶组脂肪酶和胃蛋白酶活性显著高于对照组(P<0.05)。
表6 鱼肽和蛋白酶对凡纳滨对虾血清生化指标的影响
Tab.6 Effects of enzymatic peptide and protease on plasma biochemical indices of Pacific white shrimp Litopenaeus vannamei mmol/L
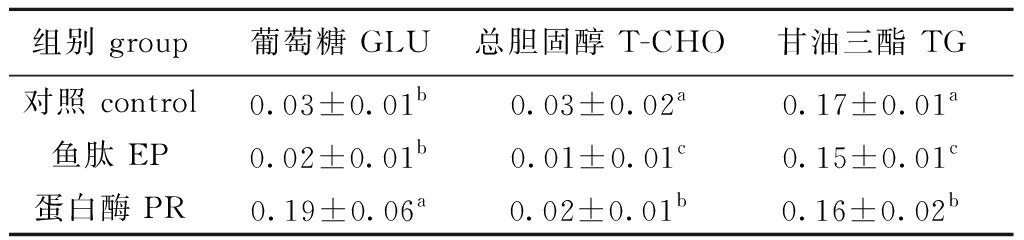
组别 group葡萄糖 GLU总胆固醇 T-CHO甘油三酯 TG对照 control0.03±0.01b0.03±0.02a0.17±0.01a鱼肽 EP0.02±0.01b0.01±0.01c0.15±0.01c蛋白酶 PR0.19±0.06a0.02±0.01b0.16±0.02b
2.5 鱼肽和蛋白酶对凡纳滨对虾肠道菌群结构的影响
从表8可见,对虾肠道中OTU数量各组间无显著性差异(P>0.05),对虾肠道菌群丰度Ace、Chao1指数各组间无显著性差异(P>0.05),但Shannon、Simpson指数各组间有显著性差异(P<0.05),其中,鱼肽、蛋白酶组Shannon指数显著高于对照组(P<0.05),Simpson指数则显著低于对照组(P<0.05)。
表7 鱼肽和蛋白酶对凡纳滨对虾肠道消化酶活性的影响
Tab.7 Effects of enzymatic peptide and protease on digestive enzyme activity in the intestines of Pacific white shrimp Litopenaeus vannamei

组别group脂肪酶/(U·g-1 prot)lipase胃蛋白酶/(U·mg-1 prot)protease对照 control2.18±0.17c0.02±0.00c鱼肽 EP7.00±0.40a0.52±0.04a蛋白酶 PR6.12±0.37b0.26±0.14b
从图1可见,在门水平上,各组对虾肠道中相对丰度较大的菌门主要有变形菌门Proteobacteria、拟杆菌门Bacteroidetes、疣微菌门Verrucomicrobia和放线菌门Actinobacteria,在对照组中分别占比44.75%、47.68%、2.02%和2.64%,在鱼肽组中分别占比46.35%、44.03%、3.33%和5.90%,在蛋白酶组中分别占比38.03%、56.37%、2.30%和2.96%。
表8 鱼肽和蛋白酶对凡纳滨对虾肠道中OTU数量、菌群丰度和α多样性指数的影响
Tab.8 Effects of enzymatic peptide and protease on OTU number,flora abundance and α diversity index in intestines of Pacific white shrimp Litopenaeus vannamei
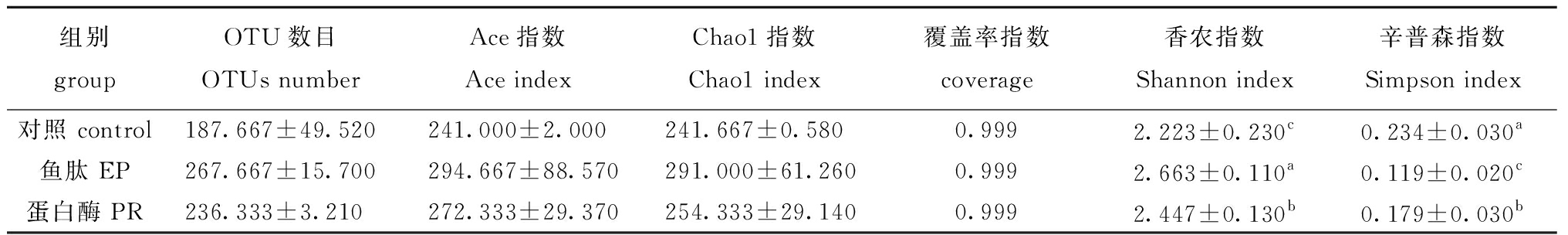
组别groupOTU数目OTUs numberAce指数Ace indexChao1指数Chao1 index覆盖率指数coverage香农指数Shannon index辛普森指数Simpson index对照 control187.667±49.520241.000±2.000241.667±0.5800.9992.223±0.230c0.234±0.030a鱼肽 EP267.667±15.700294.667±88.570291.000±61.2600.9992.663±0.110a0.119±0.020c蛋白酶 PR236.333±3.210272.333±29.370254.333±29.1400.9992.447±0.130b0.179±0.030b
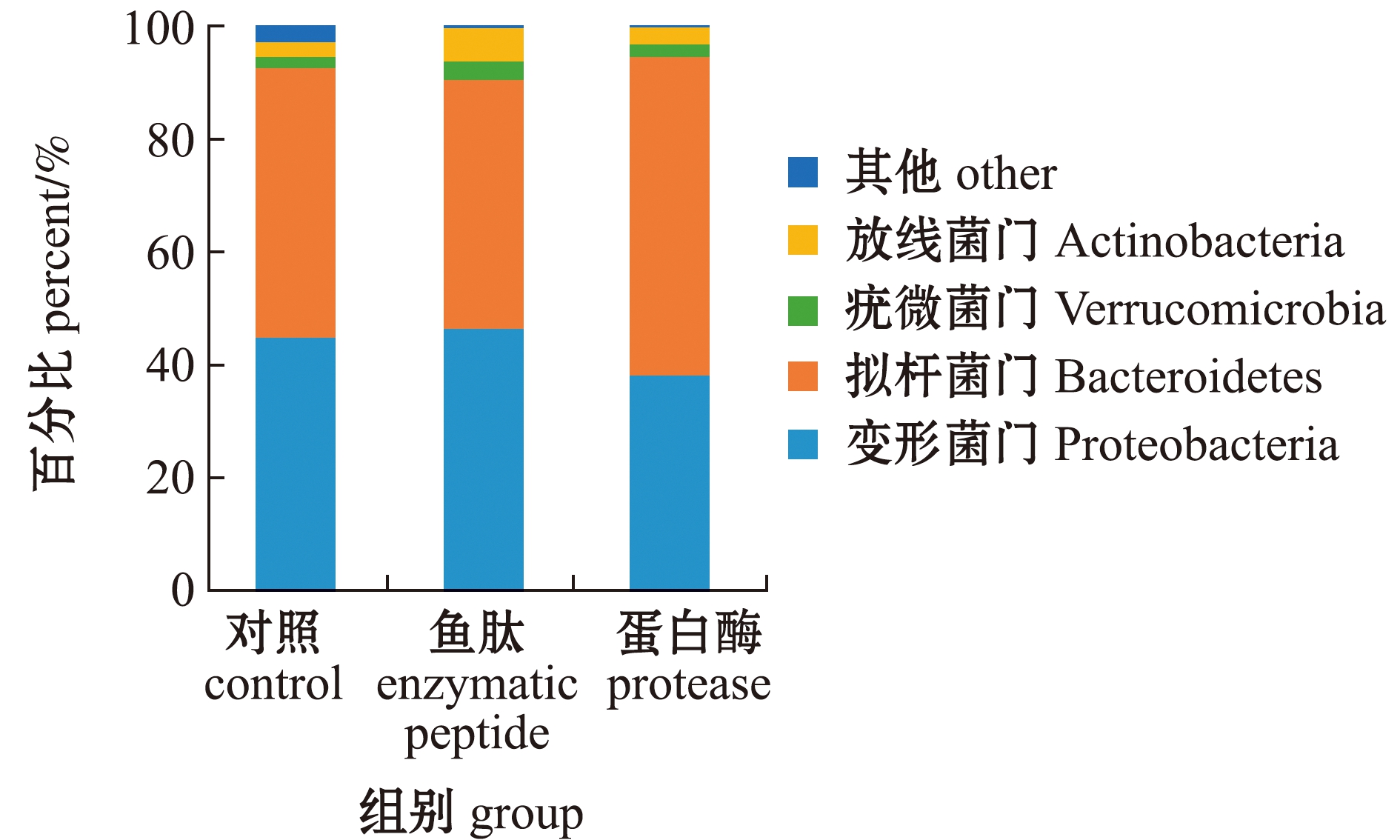
图1 门水平上菌群相对丰度
Fig.1 Relative abundance of bacteria at phylum level
从图2可见:在纲水平上,对虾肠道中相对丰度较大的菌纲主要有梭菌纲Clostridia、疣微菌纲Verrucomicrobiae、放线菌纲Actinobacteria、γ变形菌纲Gammaproteobacteria、α变形菌纲Alphaproteobacteria和黄杆菌纲Flavobacteria等,在对照组中占比分别为1.3%、2.02%、2.96%、6.56%、37.82%和45.65%,在鱼肽组中占比分别为1.04%、3.30%、6.09%、8.02%、32.29%和49.01%,在蛋白酶组中占比分别为1.47%、1.30%、3.64%、6.87%、36.99%和46.56%。
从图3可见:在属水平上,对虾肠道中相对丰度较大的菌属有未分类红杆菌属Rhodobacteraceae_unclassified、未分类黄杆菌属Flavobacteriaceae_unclassified、Hoppeia属、黄杆菌属Flavobacteriaceae、去甲基醌菌属Demequina、黏着杆菌属Tenaci-baculum、盐蕨属Haloferula 、希瓦氏菌属Shewanella、弧菌属Vibrio、鲁杰氏菌属Ruegeria、玫瑰杆菌属Roseobacter、济州岛古名菌属Tamlana、海球菌属Halioglobus、未分类海仙菌属Halieaceae_unclassified、微杆菌属Microbacterium、 Marinilabiaceae_uncultured菌属等。
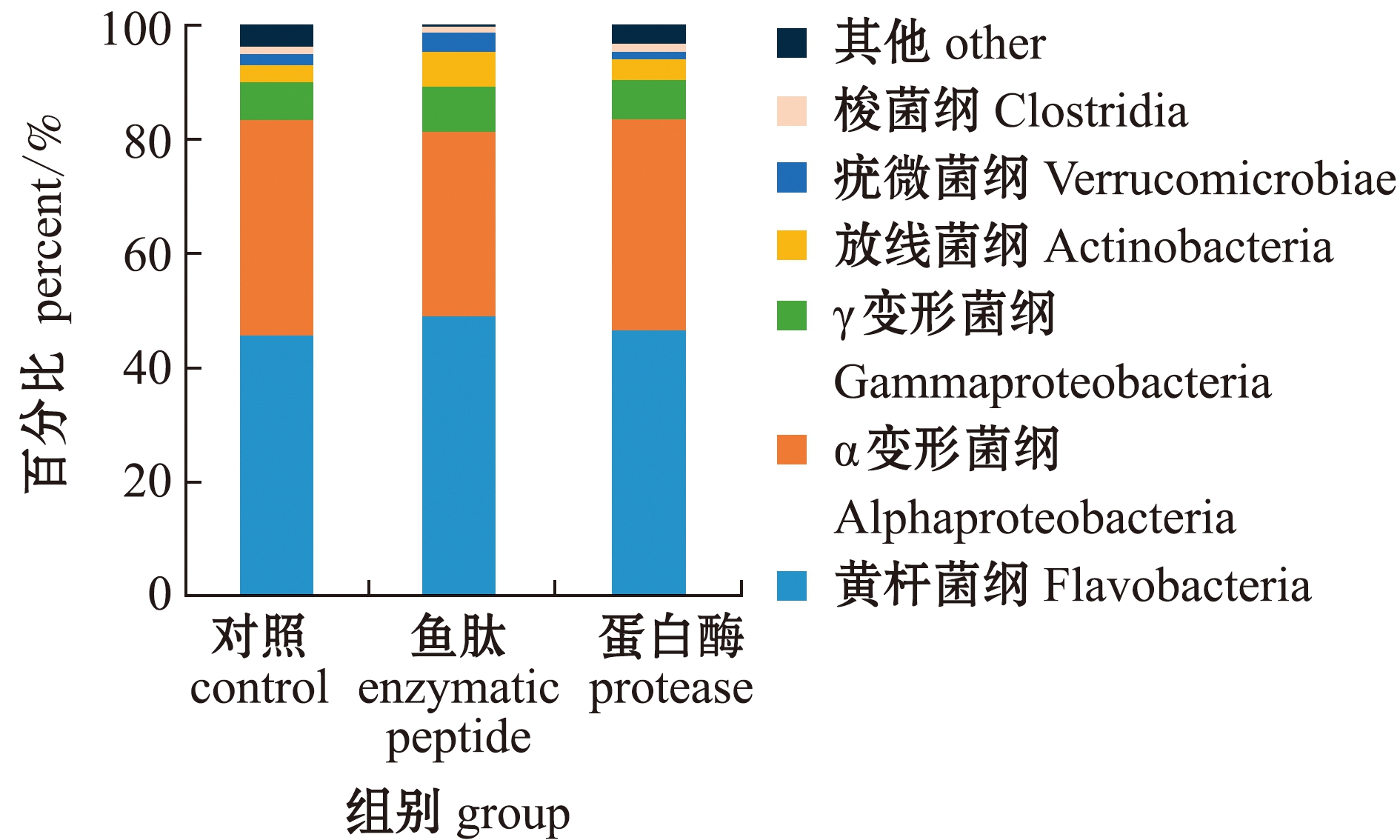
图2 纲水平上菌群相对丰度
Fig.2 Relative abundance of bacteria at class level
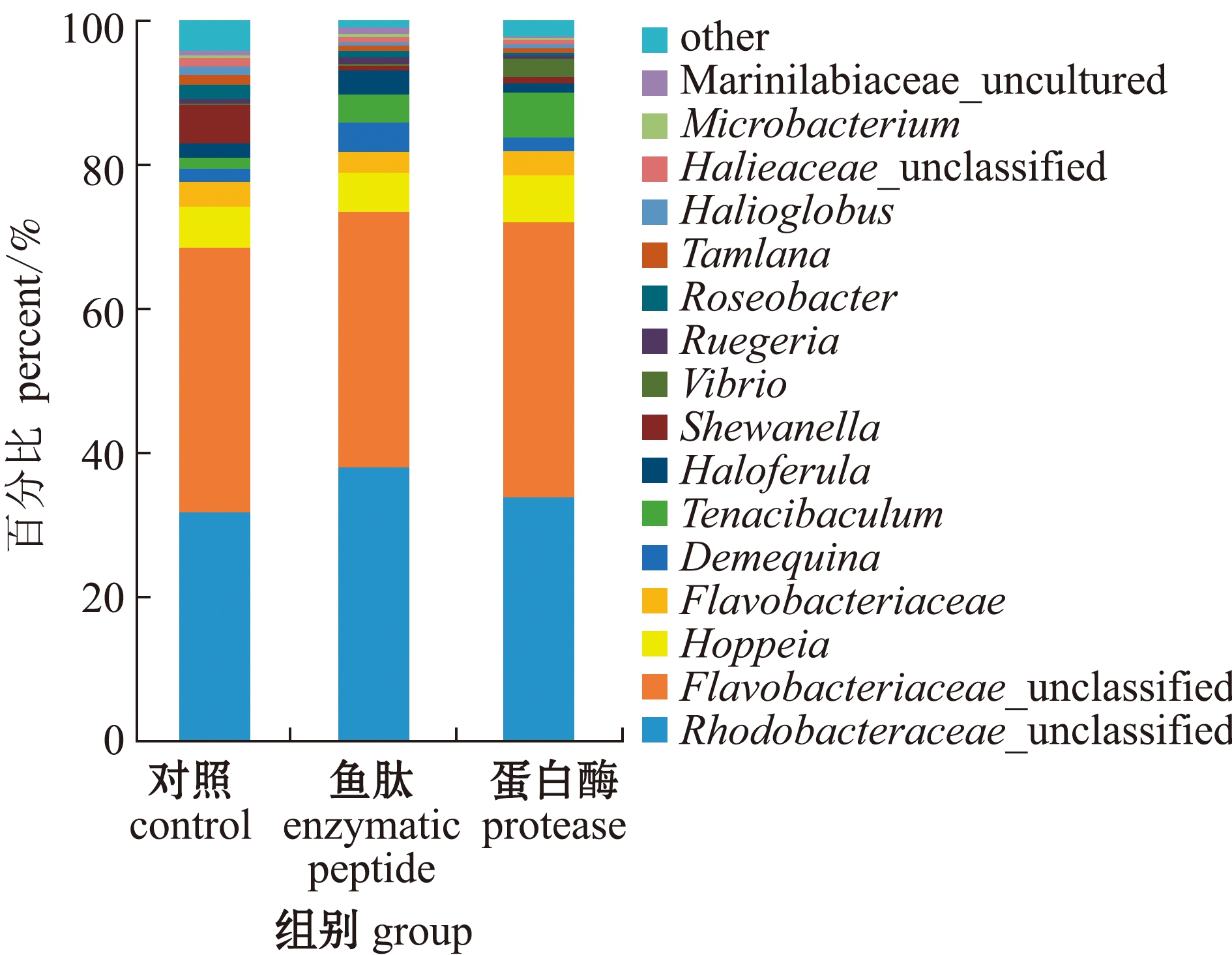
图3 属水平上菌群相对丰度
Fig.3 Relative abundance of bacteria at genus level
3 讨论
3.1 鱼肽和蛋白酶对凡纳滨对虾生长及体成分的影响
姜柯君[16]研究发现,饲料中适量添加小肽,可以改善星斑川鲽Platichthvs stellatus幼鱼的蛋白质吸收率。Drew等[10]研究发现,在饲料中添加蛋白酶,可以提高虹鳟的营养物质表观消化率。与此相似,本试验中,将鱼肽和蛋白酶分别添加到饲料中并降低鱼粉的添加量,虾的干物质和粗蛋白质表观消化率显著提高,虽然各组间饲料系数、特定生长率无显著性差异,但鱼肽、蛋白酶组的饲料系数低于对照组。由此可知,饲料中添加鱼肽和蛋白酶能提高饲料的利用率。Teshima等[17]研究发现,小肽产品可以显著促进虾幼体的生长,Zambonino等[18]也认为,添加小肽不仅可以促进虾苗生长,还能够降低饲料成本。与上述研究结果一致,本试验中,鱼肽组的增重率最高。
本试验中,鱼肽和蛋白酶替代鱼粉时,显著降低了对虾肌肉粗脂肪的含量,显著提高了粗蛋白质的含量,这与张改改等[19]对大口黑鲈Micropterus salmoides的试验结果相符,这对于高蛋白食品的凡纳滨对虾来说较有益处。由对虾肝胰脏脂肪含量检测结果推测,替代鱼粉组的对虾肝胰脏脂肪含量增加,可能会影响虾体本身对脂肪的吸收代谢,最后导致虾体脂肪含量降低,肝胰腺脂肪含量升高。
3.2 鱼肽和蛋白酶对凡纳滨对虾血清生化指标和肠道消化酶的影响
葡萄糖含量能反映凡纳滨对虾对饵料营养适宜度及肝脏机能情况[20-22]。本试验中,鱼肽组血清葡萄糖含量较低,说明葡萄糖合成代谢的影响小于葡萄糖分解代谢,以加速糖的使用并降低体内葡萄糖含量。总胆固醇是机体重要的脂质代谢组成部分,其含量受高低密度脂蛋白的调控,含量高表示肝脏细胞出现障碍,脂质代谢发生紊乱[23]。甘油三酯反映脂肪代谢的能力,其水平升高表示机体肝脏积累了更多的脂肪,导致脂肪肝和肝肥大[24-25]。若体内脂质运输受阻,血浆中的甘油三酯水平也会升高。本试验中,鱼肽、蛋白酶组的总胆固醇和甘油三酯含量均显著低于对照组,表明鱼肽和蛋白酶的添加可以提高机体脂质代谢的能力,降低血脂。
水产动物的消化能力和生长发育均与消化酶活性有关,营养素的吸收在很大程度上取决于酶的水平[26]。食物的消化和营养吸收均在肠道中进行,这与肠道消化酶的活性密切相关[27-28]。胡先勤等[29]认为,小肽能提高鲫鱼体消化酶活性。与此结果相似,本试验中鱼肽组脂肪酶高于对照和蛋白酶组。有研究表明,凡纳滨对虾饲料中添加蛋白酶可提高肠道蛋白酶活性[30],且对虾肠道消化酶活性与对虾生长指标间存在相关性[31]。本试验结果证实了这一点,鱼肽和蛋白酶组的肠道消化酶(脂肪酶、蛋白酶)活性和试验组的生长指标(增重率、特定生长率)也呈现了一定的相关性,鱼肽、蛋白酶组均高于对照组。此外,袁春营等[32]对凡纳滨对虾消化酶和肠道菌群研究发现,肠道内优势微生物菌落对消化酶活性也存在影响。
3.3 鱼肽和蛋白酶对凡纳滨对虾肠道菌群的影响
肠道菌群影响着宿主营养吸收、免疫反应和肠黏膜形态,并以直接接触、代谢产物等方式与肠道黏膜联系在一起,构成复杂的微生物系统[33]。对虾肠道寄居着结构复杂的菌群,能增加宿主的消化效率,这与宿主的健康生长息息相关[34]。本试验中,鱼肽和蛋白酶对凡纳滨对虾肠道菌群丰度有一定影响,鱼肽、蛋白酶组的Shannon指数显著高于对照组,而Simpson指数则显著低于对照组,Shannon指数越高,表明群落多样性越高,而Simpson指数越小,表明群落多样性越丰富。这说明鱼肽和蛋白酶提高了对虾肠道菌群多样性。
Huang等[35]发现,凡纳滨对虾肠道中优势菌群是变形菌门、拟杆菌门和放线菌门。本试验中,试验组间对虾肠道的菌群数量在门水平上差异较大,其中,鱼肽组的变形菌门、放线菌门、疣微菌门相对丰度高于对照组,且拟杆菌门也占较大比例。孙振丽等[36]研究表明,对虾肠道中拟杆菌门占比较大,与水产养殖的水体有关。水环境中最多的菌是变形菌,该结果也与Stevens等[37]的研究结果相符。纲水平上,放线菌具有参与新陈代谢、分解许多有机物和维持肠道平衡等重要功能,放线菌数量越多,表明肠道健康状况越好[38-39]。γ变形菌具有的一些特性可以促进生物生长[40],斑节对虾Penaeus monodon[41]和罗氏沼虾Macrobrachium rosenbergii[42]不同生长阶段的肠道优势菌均为γ变形菌纲,其在营养物质含量高的水域普遍存在,多样性及数量均较大。与此相似,本试验中,鱼肽、蛋白酶组的放线菌纲和γ变形菌纲菌群丰度占比大于对照组。属水平上,本研究中各组间菌群丰度差异较大,说明鱼肽和蛋白酶对凡纳滨对虾的肠道菌群结构及菌群多样性产生了一定程度的影响,但仍需要更深层次地研究。
4 结论
1)在配合饲料中添加鱼肽和蛋白酶替代部分鱼粉在一定程度上提高了对虾的生长性能,且虾体蛋白质含量升高,粗脂肪含量降低,这对水产品来说是一个好的现象,可起到积极的作用,并能降低饲料成本。
2)对虾摄食添加鱼肽和蛋白酶的饲料后,血糖及甘油三酯和胆固醇的含量显著降低,反映了虾体健康和生理状态较好,一定程度上可避免高脂血症带来的疾病。
3)饲料中添加鱼肽和蛋白酶可显著提高对虾消化酶活性,促进机体对食物的消化和营养吸收。
4)饲料中添加鱼肽和蛋白酶,可提高对虾肠道菌群丰度,对凡纳滨对虾肠道菌群结构有正面效应。
综上所述,从凡纳滨对虾的生长、消化性能及肠道菌群多样性等指标来看,鱼肽和蛋白酶均可作为新资源替代对虾配合饲料中5%的鱼粉。
[1] 农业部渔业渔政管理局.中国渔业统计年鉴2017[M].北京:中国农业出版社,2017:22-24.
Fisheries Administration of the Ministry of Agriculture.China fishery statistics yearbook 2017[M].Beijing:China Agriculture Press,2017:22-24.(in Chinese)
[2] 陈丽纯.全球鱼粉市场回顾与供求现状分析[J].中国水产,2018(6):67-71.
CHEN L C.Global fishmeal market review and analysis of supply and demand[J].China Fisheries,2018(6):67-71.(in Chinese)
[3] 刘运正.高植物蛋白替代饲料不同水平鱼粉后添加羟脯氨酸对大菱鲆(Scophthalmus maximus L.)幼鱼生长性能的影响[D].青岛:中国海洋大学,2014.
LIU Y Z.Hydroxyproline supplementation on the performances of high plant protein source based diet in turbot(Scophthalmus maximus L.) [D].Qingdao:Ocean University of China,2014.(in Chinese)
[4] 李日美,申光荣,黄放,等.小肽对凡纳滨对虾幼虾生长、体成分、非特异性免疫力及抗病力的影响[J].动物营养学报,2018,30(8):3082-3090.
LI R M,SHEN G R,HUANG F,et al.Effects of small peptides on growth,body composition,non-specific immunity and disease resistance of juvenile Litopenaeus vannamei[J].Chinese Journal of Animal Nutrition,2018,30(8):3082-3090.(in Chinese)
[5] BRANSDEN M P,CARTER C G,NOWAK B F.Effects of dietary protein source on growth,immune function,blood chemistry and disease resistance of Atlantic salmon (Salmo salar L.) parr[J].Animal Science,2001,73(1):105-113.
[6] WANG Y,GUO J L,BUREAU D P,et al.Replacement of fish meal by rendered animal protein ingredients in feeds for cuneate drum (Nibea miichthioides)[J].Aquaculture,2006,252(2/3/4):476-483.
[7] HASAN M R,HAQ M S,DAS P M,et al.Evaluation of poultry-feather meal as a dietary protein source for Indian major carp,Labeo rohita fry[J].Aquaculture,1997,151(1/2/3/4):47-54.
[8] 贾高旺,郭冉,张宇,等.家禽副产物酶解肽部分替代鱼粉对大菱鲆生长性能、消化指标和特异性免疫指标的影响[J].动物营养学报,2019,31(5):2201-2211.
JIA G W,GUO R,ZHANG Y,et al.Effects of partial replacement of fish meal by peptides hydrolyzed from poultry by-products on growth performance,digestive indices and specific immune indices of turbot[J].Chinese Journal of Animal Nutrition,2019,31(5):2201-2211.(in Chinese)
[9] CAINE W R,VERSTEGEN M W A,SAUER W C,et al.Effect of protease treatment of soybean meal on content of total soluble matter and crude protein and level of soybean trypsin inhibitors[J].Animal Feed Science and Technology,1998,71(1/2):177-183.
[10] DREW M D,RACZ V J,GAUTHIER R,et al.Effect of adding protease to coextruded flax:pea or canola:pea products on nutrient digestibility and growth performance of rainbow trout (Oncorhynchus mykiss) [J].Animal Feed Science and Technology,2005,119(1/2):117-128.
[11] 冷向军,刘鼎云,李小勤,等.饲料中添加蛋白酶AG对鲤鱼鱼种生长和蛋白质消化酶活性的影响[J].动物营养学报,2008,20(3):268-274.
LENG X J,LIU D Y,LI X Q,et al.Effects of protease AG on growth and digestive protease activities of common carp (Cyprinus carpio L.) fingerling[J].Chinese Journal of Animal Nutrition,2008,20(3):268-274.(in Chinese)
[12] 陈建明,叶金云,许尧兴,等.饲料中添加中性蛋白酶对青鱼生长、消化及鱼体组成的影响[J].水生生物学报,2009,33(4):726-731.
CHEN J M,YE J Y,XU Y X,et al.Effect of adding neutral protease to diets on growth performance,digestion,and body composition of fingerling black carp (Mylopharyngodon piceus)[J].Acta Hydrobiologica Sinica,2009,33(4):726-731.(in Chinese)
[13] 宋月,李娜,岳莹雪,等.膳食中的主要成分对肠道微生物组成及代谢影响的研究进展[J].食品工业科技,2019,40(18):354-360.
SONG Y,LI N,YUE Y X,et al.Research progress on the effects of main components in diet on intestinal microbial composition and metabolism[J].Science and Technology of Food Industry,2019,40(18):354-360.(in Chinese)
[14] CHOUBERT G,DE LA NOÜE J,LUQUET P.Digestibility in fish:improved device for the automatic collection of feces[J].Aquaculture,1982,29(1/2):185-189.
[15] CHO C Y,KAUSHIK S J.Nutritional energetics in fish:energy and protein utilization in rainbow trout (Salmo gairdneri) [J].World Review of Nutrition and Dietetics,1990,61:132-172.
[16] 姜柯君.小肽对星斑川鲽(Platichthys stellatus)幼鱼生长、肌肉品质和生理生化指标的影响[D].上海:上海海洋大学,2013.
JIANG K J.Effects of dietary small peptides levels on growth performance,muscle quality,physiological and biochemical indexes in juvenile starry flounder (Platichthvs stellatus) [D].Shanghai:Shanghai Ocean University,2013.(in Chinese)
[17] TESHIMA S,KANAZAWA A,KOSHIO S.Recent developments in nutrition and microparticulate diets of larval prawns[J].Israeli Journal of Aquaculture-Bamidgeh,1993,45(4):175-184.
[18] ZAMBONINO J L,CABU C L,PERES A.Partial substitution of dipeptides and tripeptides for native proteins in sea bass diet improves Dicentrarchus labrax larval development[J].The Journal of Nutrition,1997,127(4):608-614.
[19] 张改改,李向,蔡修兵,等.酶解豆粕替代鱼粉对大口黑鲈的生长性能、消化酶活性、肝脏功能及代谢的影响[J].水生生物学报,2019,43(5):1001-1012.
ZHANG G G,LI X,CAI X B,et al.Effects of enzymatic hydrolyzed soybean meal on growth performance,liver function and metabolism of largemouth bass (Micropterus salmoides) [J].Acta Hydrobiologica Sinica,2019,43(5):1001-1012.(in Chinese)
[20] DREVON C A.Fatty acids and expression of adipokines[J].Biochimica et Biophysica Acta (BBA):Molecular Basis of Disease,2005,1740(2):287-292.
[21] SIMMONS L,MOCCIA R D,BUREAU D P,et al.Dietary methionine requirement of juvenile Arctic charr(Salvelinus alpinus L.)[J].Aquaculture Nutrition,1999,5(2):93-100.
[22] 赵万鹏,刘永坚,潘庆,等.草鱼摄食后血糖和肝糖原质量分数的变化[J].中山大学学报(自然科学版),2002,41(3):64-67.
ZHAO W P,LIU Y J,PAN Q,et al.Changes of blood sugar and liver glycogen levels after feeding in grass carp[J].Journal of Sun Yat-sen University(Natural Science Edition),2002,41(3):64-67.(in Chinese)
[23] LEE S Y,SÖDERH LL K.Early events in crustacean innate immunity[J].Fish & Shellfish Immunology,2002,12(5):421-437.
LL K.Early events in crustacean innate immunity[J].Fish & Shellfish Immunology,2002,12(5):421-437.
[24] 林小植,罗毅平,谢小军.饲料碳水化合物水平对南方鲇幼鱼餐后糖酵解酶活性及血糖浓度的影响[J].水生生物学报,2006,30(3):304-310.
LIN X Z,LUO Y P,XIE X J.Effects of dietary carbohydrate level on glycolytic enzymes and serum glucose concentrations in the juvenile southern catfish after feeding[J].Acta Hydrobiologica Sinica,2006,30(3):304-310.(in Chinese)
[25] 文远红,曹俊明,黄燕华,等.蝇蛆粉替代鱼粉对黄颡鱼幼鱼生长性能、体组成和血浆生化指标的影响[J].动物营养学报,2013,25(1):171-181.
WEN Y H,CAO J M,HUANG Y H,et al.Effects of fish meal replacement by maggot meal on growth performance,body composition and plasma biochemical indexes of juvenile yellow catfish (Peltobagrus fulvidraco) [J].Chinese Journal of Animal Nutrition,2013,25(1):171-181.(in Chinese)
[26] 孙育平,裘金木,王国霞,等.低蛋白质饲料中添加色氨酸对凡纳滨对虾饲料表观消化率、消化酶活和全虾氨基酸组成的影响[J].水生生物学报,2016,40(4):720-727.
SUN Y P,QIU J M,WANG G X,et al.Effects of tryptophan supplemented in low protein diets on apparent digestibility coefficients,digestive enzyme activity and amino acids composition of Litopenaeus vannamei[J].Acta Hydrobiologica Sinica,2016,40(4):720-727.(in Chinese)
[27] 米海峰,孙瑞健,张璐,等.鱼类肠道健康研究进展[J].中国饲料,2015(15):19-22.
MI H F,SUN R J,ZHANG L,et al.Review on the intestinal health of fish[J].China Feed,2015(15):19-22.(in Chinese)
[28] 董兰芳,张琴,许明珠,等.不同糖源对卵形鲳鲹(Trachinotus ovatus)日增重、饲料利用和消化酶活性的影响[J].渔业科学进展,2016,37(3):42-48.
DONG L F,ZHANG Q,XU M Z,et al.Effect of different carbohydrate sources on daily weight growth,feed utilization and digestive enzyme activities of Trachinotus ovatus[J].Progress in Fishery Sciences,2016,37(3):42-48.(in Chinese)
[29] 胡先勤,韩继宏.大豆小肽在鲫鱼鱼苗中的应用[J].科学养鱼,2005(2):67-68.
HU X Q,HAN J H.Application of soybean small peptide in crucian carp fry[J].Scientific Fish Culture,2005(2):67-68.(in Chinese)
[30] LI X Q,CHAI X Q,LIU D Y,et al.Effects of temperature and feed processing on protease activity and dietary protease on growths of white shrimp,Litopenaeus vannamei,and tilapia,Oreochromis niloticus × O.aureus[J].Aquaculture Nutrition,2016,22(6):1283-1292.
[31] 陈晓瑛,王国霞,孙育平,等.饲料中添加低聚木糖对凡纳滨对虾幼虾消化酶活力、肠道形态及细菌数量的影响[J].动物营养学报,2018,30(4):1522-1529.
CHEN X Y,WANG G X,SUN Y P,et al.Effects of dietary xylo-oligosaccharides on digestive enzymes activities,intestinal morphology and bacteria numbers of juvenile Litopenaeus vannamei[J].Chinese Journal of Animal Nutrition,2018,30(4):1522-1529.(in Chinese)
[32] 袁春营,孟阳,毕建才,等.发酵饲料对南美白对虾消化酶活性与肠道菌群的影响[J].饲料工业,2018,39(24):24-28.
YUAN C Y,MENG Y,BI J C,et al.Effects of fermented feed on digestive enzyme activities and intestinal microflora of Penaeus vannamei[J].Feed Industry,2018,39(24):24-28.(in Chinese)
[33] SHA Y J,LIU M,WANG B,et al.Bacterial population in intestines of Litopenaeus vannamei fed different probiotics or probiotic supernatant[J].Journal of Microbiology and Biotechnology,2016,26(10):1736-1745.
[34] ZHENG Y F,YU M,LIU J W,et al.Bacterial community associated with healthy and diseased Pacific white shrimp (Litopenaeus vannamei) larvae and rearing water across different growth stages[J].Frontiers in Microbiology,2017,8:1362.
[35] HUANG Z B,LI X Y,WANG L P,et al.Changes in the intestinal bacterial community during the growth of white shrimp,Litopenaeus vannamei[J].Aquaculture Research,2016,47(6):1737-1746.
[36] 孙振丽,宣引明,张皓,等.南美白对虾养殖环境及其肠道细菌多样性分析[J].中国水产科学,2016,23(3):594-605.
SUN Z L,XUAN Y M,ZHANG H,et al.Bacterial diversity in the Penaeus vannamei Boone intestine and aquaculture environment[J].Journal of Fishery Sciences of China,2016,23(3):594-605.(in Chinese)
[37] STEVENS H,TÜBNER M,SIMON M,et al.Phylogeny of Proteobacteria and Bacteroidetes from oxic habitats of a tidal flat ecosystem[J].FEMS Microbiology Ecology,2005,54(3):351-365.
[38] 吴金凤,熊金波,王欣,等.肠道菌群对凡纳滨对虾健康的指示作用[J].应用生态学报,2016,27(2):611-621.
WU J F,XIONG J B,WANG X,et al.Intestinal bacterial community is indicative for the healthy status of Litopenaeus vannamei[J].Chinese Journal of Applied Ecology,2016,27(2):611-621.(in Chinese)
[39] 孙玉宇,贾晓慧.动物肠道放线菌的研究展望[J].天津农业科学,2014,20(7):25-28.
SUN Y Y,JIA X H.Prospect of research on animal intestinal actinomycetes[J].Tianjin Agricultural Sciences,2014,20(7):25-28.(in Chinese)
[40] GHOSH P K,BHATTACHARYYA P K,KUMAR D E T,et al.Ascorbic acid production in root,root nodule and in culture by Rhizobium undicola isolated from the aquatic legume Neptunia oleracea Lour[J].International Journal of Pharma and Bioences,2014,5(3):B9-B18.
[41] RUNGRASSAMEE W,KLANCHUI A,CHAIYAPECHARA S,et al.Bacterial population in intestines of the black tiger shrimp (Penaeus monodon) under different growth stages[J].PLoS One,2013,8(4):e60802.
[42] MENTE E,GANNON A T,NIKOULI E,et al.Gut microbial communities associated with the molting stages of the giant freshwater prawn Macrobrachium rosenbergii[J].Aquaculture,2016,463:181-188.