牡蛎隶属于瓣鳃纲Lamellibranchia珍珠贝目Pterioida牡蛎科Ostreidae,又称蚝,是一种在全球沿海海域广泛分布的海洋经济贝类。与其他海洋贝类相比较,牡蛎具有地理分布广、食物链短、生长快和产量高等特点,是人类可利用的重要海洋生物资源之一。目前,在全球各大海域共分布着 100 多种牡蛎,在中国也分布有20余种,常见的品种有香港牡蛎Crassostrea hongkongensis、近江牡蛎Crassostrea ariakensis、大连湾牡蛎Crassostrea talienwhanensis、长牡蛎Crassostrea gigas和褶牡蛎Ostrea plicatula等[1]。中国是牡蛎养殖大国,牡蛎产量占养殖海洋贝类的近40%,也是产量最大的海洋贝类,资源极为丰富。根据2021年渔业统计年鉴数据显示,2020年中国牡蛎海水养殖产量已达542.46万t,同比2019年增长3.81%[2]。
牡蛎肉质鲜美,含有丰富的蛋白质、牛磺酸、多不饱和脂肪酸、多糖和微量元素锌,素有“海洋牛奶”“根之源”之美誉,是国家卫生健康委员会第一批批准的药食同源食品之一[3]。人类食用牡蛎的历史久远,中国许多药用典籍对牡蛎的药用价值多有记载,最早的药用专著《神农本草经》始载牡蛎:“味咸,平,无毒。主伤寒寒热、温疟洒洒、惊恚怒气,除拘缓、鼠瘘、女子带下赤白。久服强骨节、杀鬼、延年”[4]。唐代《本草拾遗》中写道:“肉煮食,主虚损,妇人血气,调中,解丹毒。肉于姜、醋中生食之,主丹毒,酒后烦热,止渴”[5]。此外,明代中医典籍《本草纲目》亦记载“生蚝,治虚损,壮阳,解毒,补男女气血,令肌肤细嫩,防衰劳”。
现代研究亦表明,牡蛎具有较高的营养价值及多种功能活性。目前,牡蛎不仅是深受消费者喜爱的优质食品,也是制造食品、营养保健品和医药产品的重要原料。本文根据近年来国内外有关牡蛎的文献报道,对牡蛎的营养组成、营养特性及功能活性物质研究进行了综述,以期为牡蛎资源的深度开发利用提供科学参考。
1 牡蛎的营养组成
1.1 蛋白质和氨基酸
牡蛎为海栖双壳贝类,外表为坚硬的外壳,壳内部为可食部位,根据功能不同,可食部位的牡蛎全脏器大致可以分为鳃、外套膜、内脏团和闭壳肌4个部分(图1)[6]。牡蛎是优质蛋白质的重要来源,其含量最高的营养成分为蛋白质,平均含量占干质量的39.1%~53.1%[7]。牡蛎分离蛋白质中,水溶性蛋白质占总蛋白质的37.79%,盐溶性蛋白质占31.10%,不溶性蛋白质占26.44%[8];牡蛎分离蛋白质中的必需氨基酸含量均超过或接近40%,必需氨基酸之间的比例适宜,各分离蛋白质中的呈味氨基酸含量均超过40%,其中不溶性蛋白质的呈味氨基酸含量高达48.64%[8]。相关研究中,方玲等[9]分析了华南地区近10个地区近江牡蛎的营养成分和氨基酸组成,发现近江牡蛎含量最高的氨基酸均为谷氨酸和天冬氨酸,其平均含量分别高达 0.86、0.60 g/100 g(牡蛎肉)。谷氨酸和天冬氨酸作为动物蛋白质主要的呈味氨基酸,在近江牡蛎中占到总氨基酸含量的 38.42%~43.25%,是牡蛎味道鲜美的主要原因。
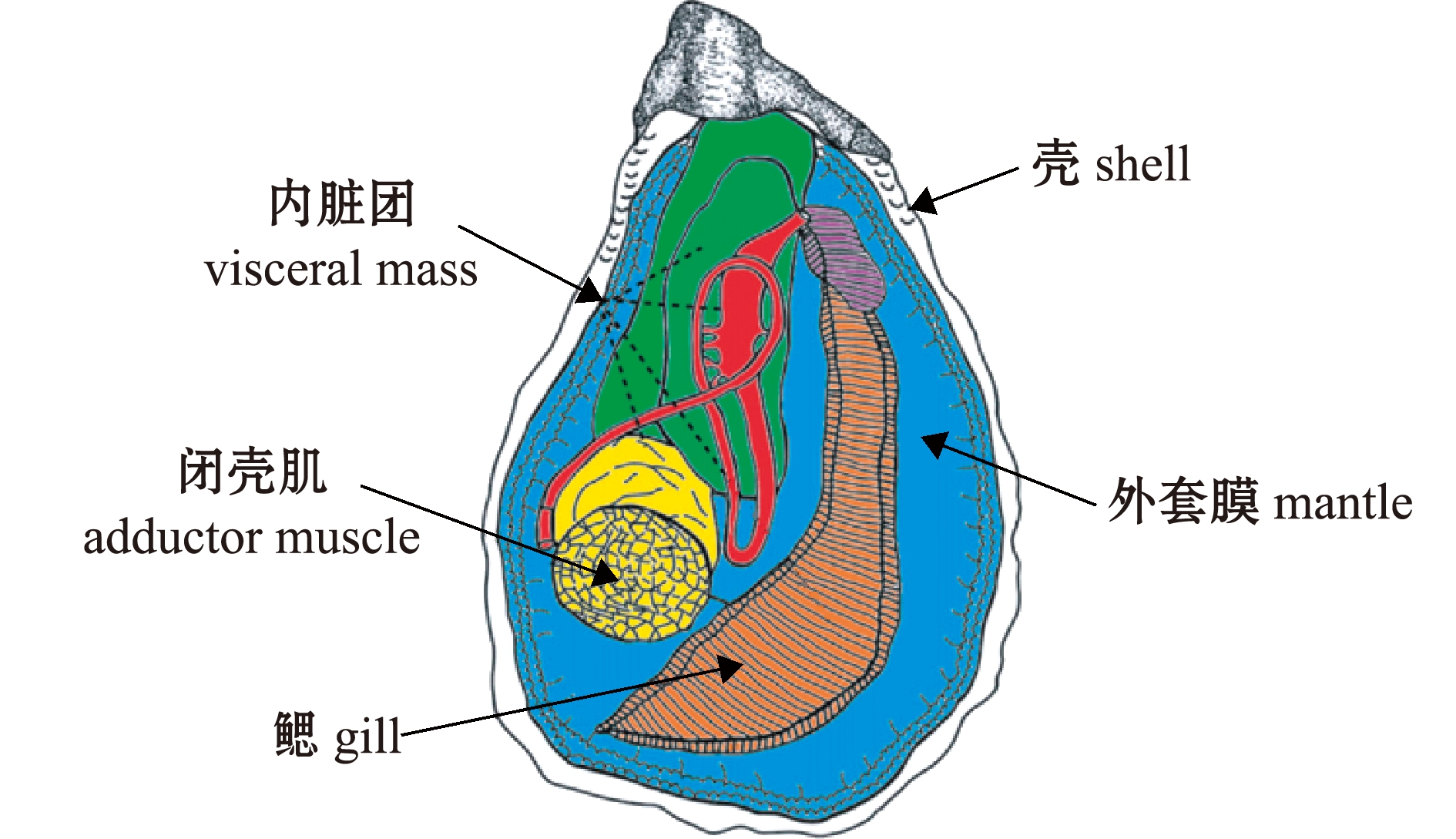
图1 牡蛎肉的组织结构[6]
Fig.1 Organs of the edible part of oyster[6]
牡蛎蛋白质中含有种类齐全的氨基酸,其中含量较高的是甘氨酸、丙氨酸、天冬氨酸、谷氨酸和脯氨酸。牡蛎蛋白质中8种人体必需氨基酸,占总氨基酸含量约40%,是一种完全蛋白质[10]。与其他20余种海洋生物(主要为鱼类、贝类)相比较,新鲜牡蛎中牛磺酸的含量较高,可达8~12 g/kg(牡蛎肉),仅次于马氏珠母贝[11]。不同产地牡蛎的牛磺酸含量存在差异,总体上,湛江、钦州、北海、阳江等地海域的牡蛎牛磺酸含量要高于汕头、汕尾、深圳、台山等地海域的牡蛎[12]。牛磺酸虽然不参与蛋白质合成,但能明显促进神经系统的生长发育和细胞增殖、分化,是一种人类极为重要的必需营养元素。研究发现,牡蛎肉中含有丰富的牛磺酸可能是其能降血糖、醒酒和保护酒精性肝损伤的重要原因[13]。
1.2 糖类化合物
牡蛎除含有丰富的蛋白质外,还含有大量的糖类化合物,其中主要为多糖的糖原[14]。牡蛎肉中的糖类化合物占其干质量的18%~39%[15]。多糖是由10个以上单糖通过糖苷键联结在一起的大分子,广泛存在于动物、植物、微生物和真菌中,具有多种生物学功能。贝类(尤其是双壳贝)的主要能源贮藏形式是糖原,其糖原含量往往比鱼类高。鱼类糖原的代谢产物为乳酸,贝类糖原的代谢产物为琥珀酸。值得注意的是,贝类的糖原含量具有显著的季节性变化,其含量在产卵期最少,产卵后急剧增加。贝类的糖原具有调和浸出物成分的滋味、增强浓厚感,并使之产生贝类特有风味的作用[14]。除糖原外,牡蛎肉中还分离出其他多糖类物质。如杨大俏等[16]从近江牡蛎中分离纯化出 3个多糖CRP-1、CRP-2和CRP-3,相对分子质量分别为124 500、67 000和8 300。其中,CRP-1为多醛基吡喃环糖苷的多糖化合物,是组分均一的多糖;CRP-2为多酮基不饱和多糖化合物,由氨基葡萄糖、半乳糖醛酸、葡萄糖组成;CRP-3为多酮基含羧基多不饱和多糖化合物。刘良伟等[17]从近江牡蛎中分离到一种相对分子质量为623 240的杂多糖,由葡萄糖、甘露糖、核糖、半乳糖、木糖、阿拉伯糖和岩藻糖组成,其中,葡萄糖含量为 95.35%,是通过β-糖苷键将葡萄糖连接而成的多聚糖。
1.3 脂质及脂肪酸组成
相对于蛋白质和糖类化合物,牡蛎肉中脂肪含量较低,以干基计仅占牡蛎肉的7.8%~8.7%[7]。与其他动物食品相比较,牡蛎属于典型的高蛋白质、低脂肪类食品。目前,国内外学者对牡蛎脂肪及其脂肪酸组成和开发研究的报道较少。研究发现,北部湾海区的熊本牡蛎Crassostrea sikamea、香港牡蛎和近江牡蛎含有超过33种以上的脂肪酸,其中,多不饱和脂肪酸(PUFA)占总脂肪酸含量的41.02%~50.79%,且二十碳五烯酸(EPA)、二十二碳六烯酸(DHA) 的含量之和占比最高,占脂肪酸总量的 27.13%~38.65%,n-3/n-6的PUFAs比值合理[18]。佟蕾等[19]提取的大连湾牡蛎脂质脂肪酸中EPA含量亦高于DHA,分别占总脂肪酸的20.4%和9.1%。刘书成等[20]发现,近江牡蛎脂质中磷脂含量为 14.51%,远高于大豆磷脂。由此可见,牡蛎脂肪酸含量种类非常丰富,PUFA占比最高,且以DHA和EPA为主,具有良好的开发潜力。
1.4 牡蛎的微量元素组成
在牡蛎的营养组成成分中,微量元素也是非常重要的营养要素。微量元素在生物体中以两种形式存在,一种是游离的无机态,另一种则是有机态,可作为生物大分子的重要组成成分或辅助成分,对维持机体正常的生命活动具有重要意义。赵艳芳等[21]发现,牡蛎肉中含有大量的铜、铁、锰、锌等微量元素,其中,铜和锌含量最高,分别达到311、51.9 μg/g(牡蛎肉)。牡蛎是目前已知的锌含量最高的海洋贝类,可达 124 mg/kg(牡蛎肉),远高于一般的水产品和陆生肉类[22]。韩蓉[23]研究发现,牡蛎的锌元素主要分布在内脏团中,全脏器中无机态与有机态的锌元素比例约为1.55∶1,牡蛎肉水提液中有机态的锌元素主要存在于水溶性多糖组分中。
综上所述,牡蛎的营养组成特点是:蛋白质含量高,氨基酸种类齐全且组成合理;牛磺酸、糖原含量高;脂肪含量虽低,但其脂肪酸组成中不饱和脂肪酸占比高;锌元素含量丰富。
2 牡蛎的功能活性物质
对牡蛎功能活性的研究主要集中在活性肽、多糖和锌等方面。牡蛎蛋白质的开发和利用,特别是功能活性多肽的提取和活性开发一直是研究的热点,研究中也获得了一系列具有抗氧化、抗炎、免疫调节、降血压、抗凝血、抗皮肤光老化和改善学习记忆等功能的活性肽。另外,牡蛎多糖研究也逐渐引起了学者们的注意,一些牡蛎多糖具有独特的活性,如抗氧化、免疫调节、改善肠道菌群和抗肝损伤等。同时,随着微量元素对人体健康的重要性越来越受重视,关于牡蛎中锌元素特别是生物大分子结合锌的结构解析和活性研究也逐渐引起关注。
2.1 牡蛎肽的功能活性
功能活性肽是一类能调节机体生命活动或参与生理活动的小分子肽的总称,一般由 2~20个氨基酸组成,其功能主要由组成的氨基酸序列和结构特征决定,对人体健康有着重要的意义[24]。由于牡蛎是一种高蛋白质的水产品,因此,对牡蛎蛋白质的研究主要是对牡蛎功能活性肽的研究。获得牡蛎肽的方法主要有化学提取法、化学合成法及酶解制备法等。化学提取法要用到酸和碱,易破坏多肽的空间结构且得率低,故较少使用。化学合成的多肽费用昂贵,分离纯化成本较高,多用于多肽的药理功能验证,以及在大型药企中用于大规模生产或中试使用。
酶解制备法是目前获得功能活性肽最常用和最有效的方法,它是一种通过适当的蛋白酶水解蛋白质制备功能活性肽的方法。该方法的优势在于制备条件温和、反应高效、蛋白质回收率高、易于控制,且具有一定的专一性[25]。蛋白酶的选择是影响酶解过程至关重要的因素,由于不同酶的酶切位点各不相同,在不同酶解工艺条件下可以得到功能活性各异的牡蛎蛋白肽。因此,针对牡蛎肽的研究多是通过酶解法先获得酶解产物,再利用葡聚糖凝胶过滤色谱及多种高效液相色谱柱对产物进行分离纯化,结合质谱分析氨基酸序列以确定多肽的序列和分子量,最后针对多肽的功能活性进行评价。
2.1.1 抗氧化活性 氧化是所有活生物体中必不可少的过程,在氧化代谢过程中自由基和其他活性氧化物(ROS)的形成难以避免,ROS会破坏细胞中的脂质、蛋白质和核酸等生物大分子,且与多种疾病的发生发展有着密切联系。抗氧化剂可以清除自由基,减少氧化应激损伤,对人体健康有着重要意义。一些研究发现,牡蛎的蛋白酶解产物具有抗氧化活性。如近江牡蛎肉的碱性蛋白酶酶解产物中相对分子质量小于5 000的超滤组分被证实具有较强的自由基清除能力[26]。僧帽牡蛎Saccostrea cucullata的蜡样芽孢杆菌蛋白酶酶解产物也具有较好的体外抗氧化能力,从中分离出的3个抗氧化活性肽LANAK、PSLVGRPPVGKLTL、VKVLLEHPVL 均具有较强的1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力[27]。此外,从大连湾牡蛎中分离出的2个短肽PVMGD和QHGV对羟基自由基和DPPH自由基亦具有较好的清除活性[28]。
2.1.2 抗炎和免疫调节活性 牡蛎酶解产物,以及从中分离的活性肽也具有较好的抗炎和免疫功能。如长牡蛎的酶解产物能够显著抑制脂多糖(LPS)诱导的人巨噬细胞RAW264.7的激活及一氧化氮 (NO) 的产生,降低结肠炎小鼠血清中免疫球蛋白E(IgE)的水平,提高小鼠脾中 CD4(+)/CD8(+)的水平,且从中分离纯化出抗炎活性肽,其序列为QCQCAVEGGL[29]。从水牡蛎中提取出来的β-胸腺素能通过下调核因子κB(NF-κB)信号通路,抑制前列腺E(PGE)的产生及一氧化氮合酶 (iNOS) 和环氧化物酶-2(COX-2)的表达,并抑制LPS诱导的RAW 264.7的激活,从而起到抗炎的作用[30]。也有研究表明,来源于长牡蛎的多肽YA能通过抑制炎症、细胞凋亡和铁死亡,来抑制LPS及D-半乳糖诱导的肝损伤[31]。此外,香港牡蛎动物蛋白酶酶解产物中相对分子质量小于5 000的超滤组分可促进小鼠脾淋巴细胞增殖和腹腔巨噬细胞吞噬中性红和生成NO的能力;动物试验表明,该组分可提高小鼠的免疫功能,具有较好的免疫调节作用,且从中分离出了2个氨基酸序列分别为DNSIAMESMK和LLQLSER的免疫调节肽[32]。
2.1.3 降血压活性 目前,关于牡蛎及其相关产物降血压作用的研究报道较多。如用胃蛋白酶水解大连湾牡蛎肉获得的一个酶解液组分,在以20 mg/kg剂量口服给药自发性高血压大鼠时,表现出了较好抗高血压活性,并从中分离纯化出一个氨基酸序列为VVYPWTQRF且具有血管紧张素转化酶(ACE)抑制活性的降血压肽,该降血压肽具有良好的热稳定性和pH稳定性,对胃肠道蛋白酶具有较强的抵抗性[33]。相比较肽合成,酶解牡蛎是有效且廉价的生产手段。用胰酶水解长牡蛎肉,也分离出一个氨基酸序列为DLTDF的降血压肽,并证实了其中的DY为体内活性受体的结合位点[34]。采用复合酶(6种酶)和中性蛋白酶两步法对长牡蛎蛋白质进行水解得到的牡蛎蛋白酶解物,其ACE酶半抑制浓度为0.40 mg/mL,能显著且快速持久地降低自发性高血压大鼠的收缩压,并从中分离纯化出5个氨基酸序列为TAY、VL、KY、FYN和YA的降血压短肽[35]。牡蛎ACE抑制肽以二肽和三肽居多,这可能与活性短肽更有利于消化系统完整吸收有关。
2.1.4 抗菌和抗病毒活性 牡蛎蛋白酶解多肽被证实具有抗病毒活性。长牡蛎的酶解产物具有较强的体外抗氧化活力,同时对人类致病菌和海洋弧菌等致病菌也具有较强的抑制作用[36]。利用嗜热菌蛋白酶水解长牡蛎,从酶解产物中分离纯化得到的2个氨基酸序列分别为LLEYSI和LLEYSL的活性肽能够抑制HIV病毒蛋白酶的活性,这2个活性肽经过人工合成发现,其对HIV病毒蛋白酶的抑制活性比抑肽素(Pepstain)更强[37]。
牡蛎抗菌肽多为牡蛎肉体内存在的天然活性肽,这些多肽的分子量往往较大。如从酸化的美洲牡蛎鳃提取物中分离纯化出一种相对分子质量约为4 265.0的抗菌肽,对革兰氏阳性菌和革兰氏阴性菌均有显著的抑制作用[38]。从长牡蛎中分离到另一种新型富含半胱氨酸的抗菌肽CgPep33,对革兰氏阳性菌(枯草芽孢杆菌和金黄色葡萄球菌)、革兰氏阴性菌(大肠杆菌和绿脓杆菌)和真菌(灰霉病菌和扩展青霉菌)均有非常强的抗菌活性,对所有供试细菌和真菌的半数抑制浓度(IC50)为18.6~48.2 μg/mL,对革兰氏阳性菌的最低抑菌浓度(MIC)为40~60 μg/mL[39]。此外,从美洲牡蛎Crassostrea virginica中分离纯化出一种抗菌肽,能显著抑制革兰氏阳性菌的生长和繁殖[40]。从牡蛎软体部也分离出的一种抗菌蛋白,对革兰氏阴性菌和革兰氏阳性菌的生长均具有较强的抑制作用,同时能抑制致病性白色念珠菌的生长[41]。
2.1.5 抗凝血活性 血栓栓塞性疾病在世界范围内已经对人类的生命健康造成严重威胁,抗凝血是防治血栓栓塞性疾病的重要途径,食源性抗血栓活性肽作为安全、高效的新型抗凝剂,一直是抗血栓药物和保健产品研究的热点。Cheng等[42]通过生物信息学与酶解方法相结合,从长牡蛎胃蛋白酶水解物中分离、纯化和鉴定出3个新型抗凝肽:第1个是肽序列为IEELEEELEAER的抗凝胶肽,在质量浓度为5 mg/mL时,能将凝血时间从9.6 s延长到23.3 s;第2个是相对分子质量为1 264.36的抗凝肽,有类似于水蛭素(一种有效的凝血酶抑制剂)C末端片段(DFEEIPEEYLQ)的氨基酸序列,能靶向抑制重要的血液凝血因子——凝血酶,从而有效延长凝血酶时间[43];第3个是抗凝血七肽(P-3-CG),主要通过熵驱动的自发放热反应竞争性地抑制纤维蛋白原凝血酶活性区域[44]。
2.1.6 抗皮肤光老化活性 皮肤光老化是长期过度紫外线(UV)辐照积累所导致的皮肤早衰现象,其主要临床特征表现为皮肤干燥、增厚、晒斑、色素沉着、皱纹形成、皮肤塌陷甚至癌变[45]。Han等[46]通过碱性蛋白酶酶解近江牡蛎底物,获得牡蛎酶解产物,发现小分子量的超滤组分(OP-Ⅰa)能显著提升UV辐照后的人类永生化表皮(HaCaT)细胞活力,并呈现较好的剂量相关性,且组分OP-Ⅰa 通过丝裂素活化蛋白激酶(MAPKs)信号传导通路减轻HaCaT 细胞的光老化损伤。Bang等[47]研究发现,长牡蛎水提物能抑制黑色素细胞瘤细胞(B16F10)黑色素的生成量,抑制UVB诱导的小鼠黑色素的生成及皱纹的形成,并且分离出一个具有抗皮肤光老化活性且相对分子质量为 554.72的五肽IVVPK。彭志兰[45]亦发现,用香港牡蛎相对分子质量小于3 000的酶解超滤组分涂抹小鼠背部皮肤,能明显地改善UVB辐照引起的晒斑、皱纹及皮肤粗糙等光老化特征;同时能提高皮肤含水量,抑制皮肤表皮厚度的增加,减轻UVB辐照导致的胶原蛋白和弹性纤维含量减少及胶原纤维胶断裂堆积(图2);从其中分离纯化和鉴定出2个具有抗皮肤光老化活性的牡蛎肽,它们的序列分别为RKNEVLGK、WNLNP[45,48]。
2.1.7 改善学习与记忆活性 近年的研究发现,牡蛎酶解产物具有改善学习与记忆的功效。如大连湾牡蛎酶解产物可缩短小鼠在水迷宫试验中空间探索试验的上台时间,延长小鼠在目标象限的时间及小鼠在黑白箱试验中白箱的停留时间,其改善小鼠学习与记忆的机制可能与降低白细胞介素-1β (IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子(TNF-α) 的水平,以及减轻氧化应激,降低乙酰胆碱酯酶(AChE)水平,升高胆碱乙酰转移酶(ChAT)水平,减轻炎症反应并上调脑源性神经营养因子(BDNF)和神经细胞黏附分子 (NCAM) 的表达有关[49]。香港牡蛎酶解产物对正常小鼠、东莨菪碱诱导记忆障碍小鼠、D-半乳糖(D-gal) 致早衰小鼠均具有良好的改善学习记忆的功效作用,其改善小鼠学习记忆的机制可能与其抗氧化、修复胆碱能系统相关[50-51]。香港牡蛎蛋白酶解产物相对分子质量5 000~8 000的超滤组分还可改善老年斑马鱼认知功能障碍,其改善功效可能是通过调节胶质细胞功能减少氧化应激和炎症,上调 BDNF、酪氨酸激酶B (Trk B)、神经递质的水平,增强突触功能,起到神经元保护作用;从香港牡蛎蛋白酶解产物相对分子质量5 000~8 000的超滤组分中分离鉴定出14条活性肽,其中,IDYER和IAFIMDESNVLDSGFLER具有较好的激活环磷酸腺苷反应元件结合蛋白(CREB)活性,均可显著抑制LPS激活的BV2细胞内ROS及NO的生成,有效干预D-gal诱导的人神经母细胞瘤细胞(SH-SY5Y)老化,其分子作用机制可能是通过抑制NF-κB/IκB信号通路及凋亡通路,激活ERK-CREB信号通路来发挥改善老年认知功能障碍的功效[52]。
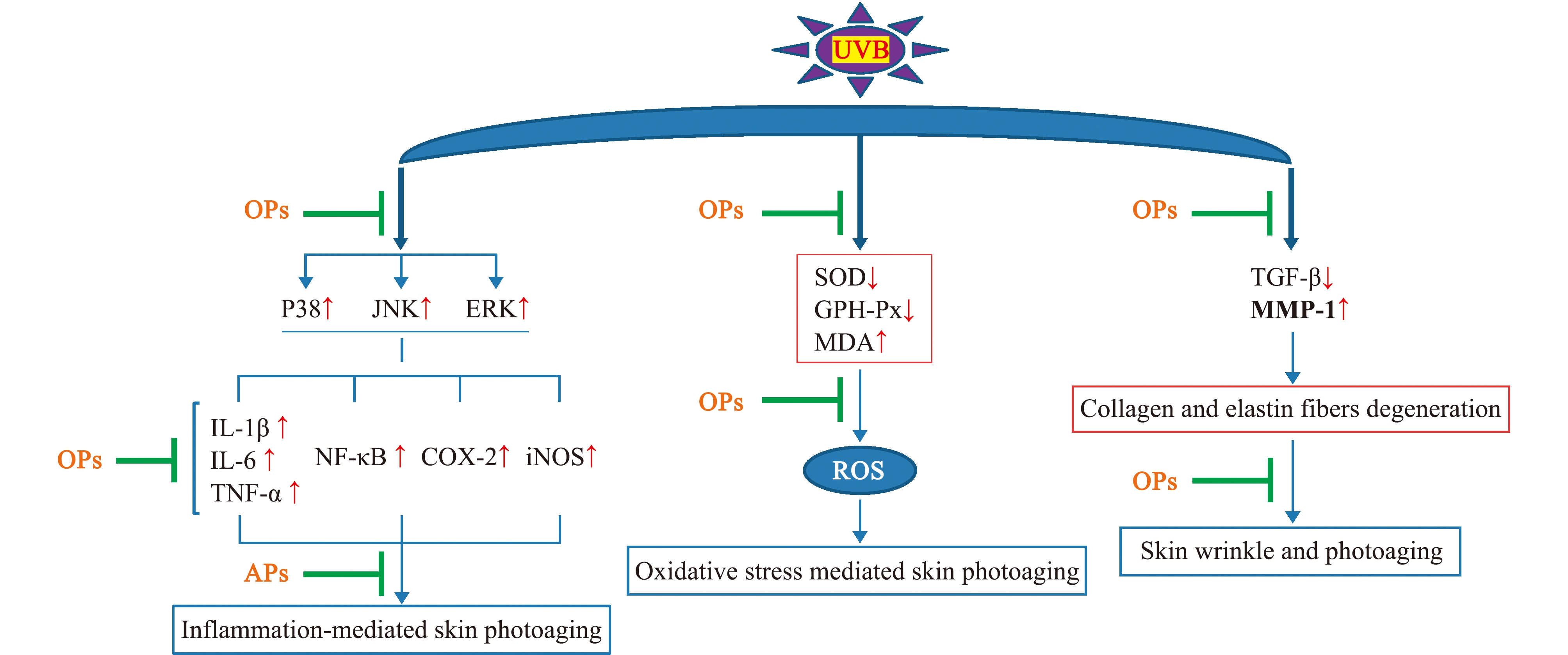
↑—水平增加;↓—水平下降。绿色代表有效。
↑—level is increased;↓—level is decreased.Green color represents effective.
图2 牡蛎肽(OPs)减轻UVB诱导的皮肤光老化的可能机制[48]
Fig.2 Possible mechanism by which OPs attenuated UVB-induced skin photoaging[48]
2.1.8 抗疲劳活性 牡蛎肽具有显著的抗疲劳活性。有研究证实,给小鼠灌胃褶牡蛎肽,可使小鼠游泳至筋疲力尽的时间延长78%,并使其血清乳酸和血尿素氮水平分别降低24.8%和11.2%,肝糖原增加1.0倍,腓肠肌糖原增加55.6%[53]。近江牡蛎酶产物相对分子质量大于6 000的超滤组分可显著延长小鼠游泳时间(67.79%),提高其肌糖原(45.65%) 和肝糖原(49.01%)含量,并显著降低血尿素氮含量(18.44%)(P<0.05),推测其抗疲劳功效可能与其富含支链氨基酸有关[54]。Xiao等[55]评估了牡蛎多肽(OP)的抗疲劳作用及其对小鼠肠道微生物群的调节作用,力竭游泳试验表明,与对照组相比,OP低、中、高剂量组小鼠的游泳时间分别增加了1.82、2.18和2.44倍,肝糖原水平分别升高19.3%、42.02%和65.07%,而血乳酸水平则分别降低18.85%、21.18%和28.74%;服用OP的小鼠磷酸烯醇丙酮酸羧激酶(PEPCK)和AMP活化蛋白激酶(AMPK)的表达上调,但TNF-α的表达下调;进一步对肠道微生物菌群分析发现,粪杆菌、脱硫弧菌和肠道杆菌与游泳时间、血乳酸、血尿素氮、肝糖原和肌糖原呈负相关,而亚尼尔菌和罗姆布茨菌则与之呈正相关。这表明,OP组分具有抗疲劳作用,可以调节肠道微生物群的丰度并维持其平衡。
2.1.9 醒酒及抗酒精性肝损伤活性 用长牡蛎和葛根为原料配制的牡蛎醒酒液,可使小鼠醉酒率降低60%,能有效防止醉酒,同时能延长醉酒小鼠睡眠潜伏期并缩短睡眠时间,具有良好的醒酒效果[56]。长牡蛎提取物可有效抑制肝损伤引起的谷草转氨酶和谷丙转氨酶升高,对肝脏具有一定的保护作用[57]。Siregar等[31]证实,长牡蛎水解物对注射脂多糖/D-氨基半乳糖(LPS/D-GalN)诱导的急性肝衰竭(ALF)小鼠模型具有肝保护作用,用牡蛎酶解产物中分离的酪氨酸-丙氨酸(YA)肽注射给药(剂量10 mg/kg或50 mg/kg),能显著降低肝损伤因子,其主要机理是通过减少炎症和细胞凋亡起到保肝作用。Wang等[58]研究发现,灌胃牡蛎肽OP(相对分子质量小于3 500),在小鼠模型中可以逆转乙醇带来的肝损伤指标,如天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、γ-谷氨酰转移酶(GGT)活性增强,活性氧(ROS)、丙二醛(MDA)、甘油三酯(TG)、IL-1β、IL-6和TNF-α含量增加,超氧化物歧化酶(SOD)和谷胱甘肽(GSH)含量降低;同时,OP不同剂量组核因子elythroid 2相关因子2(Nrf2)、血红素加氧酶-1(HO-1)和醌氧化还原酶1(NQO1)的 mRNA表达显著上调,但B细胞的核因子κ轻链增强子(NF-κB)和TNF-α显著降低。因此,OP可能是通过增强体内抗氧化能力和抑制炎症反应的机制从而起到对酒精性肝损伤的保护作用。
2.1.10 其他活性 牡蛎肽主要是通过生物技术(如酶解、发酵)将牡蛎肉加工而制得的酶解产物,其主要成分是蛋白肽和氨基酸,但也含有维生素、微量元素和牛磺酸等功能成分;此外,由于牡蛎肽分子量较小,容易被吸收并发挥其生物活性。因而牡蛎酶解产物被挖掘出具有广泛的生物活性,除上述活性外,牡蛎肽还具有抗抑郁、补肾壮阳、促进泌乳、抗肿瘤及成骨等功能活性。香港牡蛎酶解物可以有效改善斑马鱼抑郁样行为,并能有效改善应激后斑马鱼体质量减小的现象,同时可降低斑马鱼外周皮质醇的水平及TNF-α在脑部的表达[59]。香港牡蛎酶解产物相对分子质量小于3 000的超滤组分,可改善雷公藤甲素引起的睾丸损伤和生精功能障碍[60];香港牡蛎肉酶解产物对半去势大鼠性功能具有良好的改善作用,可提高半去势大鼠精囊腺-前列腺、睾丸系数、血清睾酮(T)、黄体生成素(LH)、促卵泡激素(FSH) 水平,以及精子数量和存活率,也能提高大鼠的性活力,具有较强的雄激素样作用和生精特性[61]。香港牡蛎酶解产物还可提高超负荷哺乳母鼠的泌乳量,增强哺乳期母鼠的脏器负荷能力,促进超负荷哺乳母鼠乳腺发育并改善其乳腺结构[62]。僧帽牡蛎酶解产物对非洲绿猴Saccostrea cucullata肾上皮细胞(Vero)和人结肠癌(HT-29)细胞具有细胞毒性,有较强的抗癌活性[63]。从长牡蛎中鉴定出一种新肽YRGDVVPK,对前成骨细胞(MC3T3-E1)有显著的增殖作用[64]。已发现的牡蛎功能活性肽序列和功能活性详见表1。
表1 牡蛎功能活性肽
Tab.1 Bioactive peptides derived from oyster protein
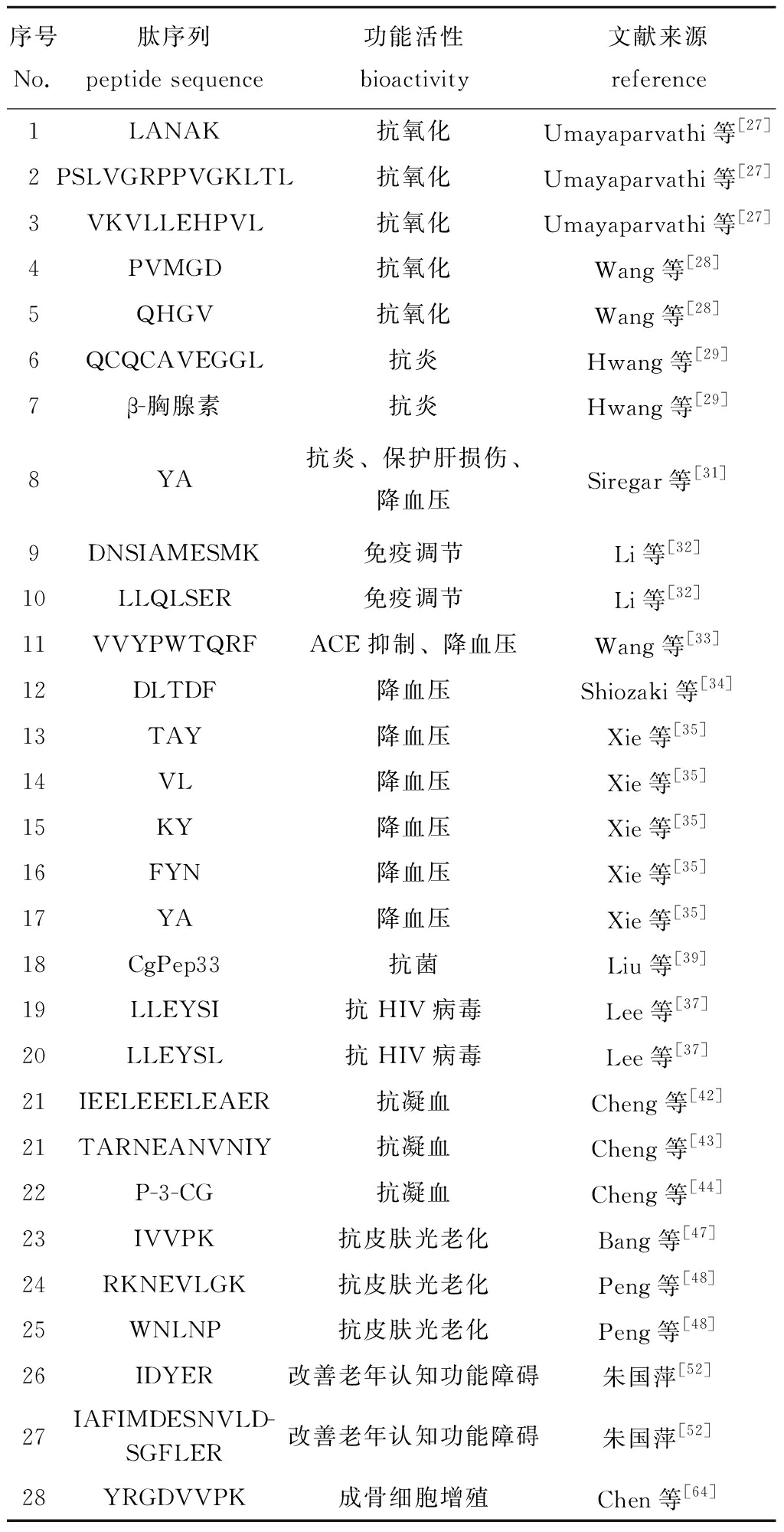
序号No.肽序列 peptide sequence功能活性 bioactivity文献来源 reference1LANAK抗氧化Umayaparvathi等[27]2PSLVGRPPVGKLTL抗氧化Umayaparvathi等[27]3VKVLLEHPVL抗氧化Umayaparvathi等[27]4PVMGD抗氧化Wang等[28]5QHGV抗氧化Wang等[28]6QCQCAVEGGL抗炎Hwang等[29]7β-胸腺素抗炎Hwang等[29]8YA抗炎、保护肝损伤、降血压Siregar等[31]9DNSIAMESMK免疫调节Li等[32]10LLQLSER免疫调节Li等[32]11VVYPWTQRFACE抑制、降血压Wang等[33]12DLTDF降血压Shiozaki等[34]13TAY 降血压Xie等[35]14VL降血压Xie等[35]15KY降血压Xie等[35]16FYN降血压Xie等[35]17YA降血压Xie等[35]18CgPep33抗菌Liu等[39]19LLEYSI抗HIV病毒Lee等[37]20LLEYSL抗HIV病毒Lee等[37]21IEELEEELEAER抗凝血Cheng等[42]21TARNEANVNIY抗凝血Cheng等[43]22P-3-CG抗凝血Cheng等[44]23IVVPK抗皮肤光老化Bang等[47]24RKNEVLGK抗皮肤光老化Peng等[48]25WNLNP抗皮肤光老化Peng等[48]26IDYER改善老年认知功能障碍朱国萍[52]27IAFIMDESNVLD-SGFLER改善老年认知功能障碍朱国萍[52]28YRGDVVPK成骨细胞增殖Chen等[64]
2.2 牡蛎多糖的功能活性
多糖广泛存在于动植物和微生物中。贝类种属、习性及生存环境的差异导致了贝类多糖组成及结构的复杂性,促成了贝类多糖生物活性和功能的独特性和多样性[65]。牡蛎多糖具有抗氧化、免疫调节、改善肠道菌群、抗肿瘤等生物活性,以及降血压、降血糖、降血脂、溶血栓、缓解动脉硬化、降低肝脏损伤、抗菌、抗病毒等作用。牡蛎多糖功能活性多样,安全无毒副作用,是功能性食品、特膳食品和创新药物的良好来源,具有广阔的开发利用前景[66-67]。
2.2.1 抗氧化活性 牡蛎多糖表现出良好的抗氧化活性,且其抗氧化活性与其他功能活性有密切关系。刘良伟等[17]研究了近江牡蛎多糖的体外抗氧化活性,发现DPPH自由基、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)阳离子自由基、亚铁离子螯合能力和羟自由基的IC50质量浓度分别为0.36、2.71、4.15、1.21 mg/mL。Cai等[68]研究表明,香港牡蛎多糖CHP2-3为硫酸酯杂多糖,主要由葡萄糖、半乳糖和阿拉伯糖组成,平均相对分子质量为41 810,用CHP2-3能显著提高经H2O2处理的小肠上皮细胞IEC-6的存活率,降低细胞内活性氧(ROS)水平,CHP2-3还能显著降低H2O2介导的IL-1β和IL-6分泌的增加,并减弱NF-κB p65的激活。这些结果表明,CHP2-3可能通过清除自由基、减少促炎因子分泌和抑制NF-κB通路,减少细胞凋亡,从而在减少IEC-6细胞氧化损伤中发挥重要作用。Li等[69]从近江牡蛎中分离纯化到一种平均相对分子质量为118 000的多糖类物质ORPp,主要由葡萄糖(76.3%)和半乳糖(23.7%)组成,ORPp能显著抑制大鼠血清MDA的形成,提高抗氧化酶活性和总抗氧化能力水平,并能显著增加雄性大鼠性器官质量,促进精子运动,提高附睾精子数。
2.2.2 免疫调节活性 牡蛎多糖能增强免疫功能,其机理可能是通过激活巨噬细胞、淋巴细胞,从而增强机体特异性免疫引起的,可能由于其对人体肠道菌群的调节功能, 有助于肠道生态系统的稳定性和功能多样性。杨大俏等[16]从近江牡蛎中分离纯化出3个多糖CRP-1、CRP-2、CRP-3,其中,CRP-1为同多糖,CRP-2、CRP-3则为杂多糖,以小鼠巨噬细胞系RAW264.7为模型,发现这3个多糖均具有较好的免疫调节活性,能显著诱导巨噬细胞生成TNF-α、IL-6和IL-1β。李萌等[70]研究了牡蛎多糖对Ⅰ型单纯疱疹病毒感染小鼠腹腔巨噬细胞免疫功能的影响,发现牡蛎多糖能显著提高Ⅰ型单纯疱疹病毒感染小鼠的胸腺指数和脾脏指数,增强腹腔巨噬细胞吞噬能力,具有免疫增强作用。江长优等[71]探讨了牡蛎多糖对小鼠体外、体内免疫功能的影响,体外试验发现,当牡蛎多糖质量浓度为50 μg/mL时,牡蛎多糖能显著促进巨噬细胞增殖和吞噬;而体内试验发现,牡蛎多糖质量浓度为100 μg/mL时,能在一定程度上提高小鼠脏器系数和淋巴细胞增殖能力,从而提高变态反应强度。
2.2.3 改善肠道菌群 人体肠道正常微生物菌群能合成多种人体生长发育必需的维生素,能利用蛋白质残渣合成必需氨基酸,并参与糖类和蛋白质的代谢,同时还能促进铁、镁、锌等矿物元素的吸收。因此,肠道菌群失衡易导致多种疾病的发生。Cai等[72]研究了用5-氟尿嘧啶(5-FU)治疗S180荷瘤小鼠后香港牡蛎多糖(CHP)在保护其肠道屏障和改善营养代谢方面的潜在作用,发现CHP能提高绒毛高度、隐窝深度、黏膜厚度、绒毛表面积和V/C比,降低IL-1β、IL-6和TNF-α的表达,甚至使总蛋白(TP)、白蛋白(ALB)、前白蛋白(PA)、转铁蛋白(TRF)及免疫球蛋白IgA、IgM和IgG恢复到正常水平。所有这些因素均与CHP增加产丙酸和丁酸的细菌,以及减少Bacteroides、Prevotellaceae_UCG-001和Rikenellaceae_RC9_gut_group的菌产生有关,从而影响Toll样受体(TLRs)信号通路。因此,CHP可通过调节肠道微生物群减轻5-FU引起的肠道黏膜炎和营养不良,并可以改善接受化疗患者的预后。Ma等[73]使用模拟消化(唾液、胃和小肠)和体外发酵模型,评估了长牡蛎多糖(OPS)的消化和发酵特性及其对肠道微生物群落的影响,结果显示,OPS可在唾液消化过程中被部分降解,不可消化的OPS(OPSI)可以被肠道微生物进一步降解和利用。因此, OPSI可以调节微生物群落的组成和多样性,特别是增加有益细菌的丰度,如拟杆菌、普氏杆菌和粪杆菌。此外,发酵24 h后,OPSI促进了短链脂肪酸(SCFA)的产生,乙酸、丙酸和正丁酸是主要的代谢产物(图3)。这些结果提示,OPS可能是一种潜在的益生元,可通过改善肠道健康来预防疾病。
2.2.4 抗酒精性肝损伤活性 酒精性肝损伤是由于长期大量饮酒所导致的肝脏损伤,继而出现了肝功能异常。Shi等[74]从长牡蛎中分离出一种水溶性多糖CGPS-1,这是一种均匀的葡萄糖聚体,用CGPS-1治疗可降低血清中AST、ALT和MDA水平,增加SOD活性,从而改善小鼠急性和慢性肝损伤。Jiang等[75]发现,口服给药长牡蛎多糖(RPS)或其蒸蚝多糖(SPS)(剂量为282 mg/kg体质量),可显著减轻小鼠的酒精性肝损伤。经RPS 和SPS 处理后,通过显著增强紧密连接蛋白的表达和抑制炎症反应来保护肠道功能,显著增加了罗伊氏乳杆菌和罗斯布里亚菌数量,降低了大肠杆菌数量,小鼠微生物代谢产物特别是丙酸盐和丁酸盐显著增加。相关分析表明,RPS和 SPS 的有利作用与微生物组成和 SCFAs 密切相关。由此可见,牡蛎多糖通过介导肠-肝-代谢轴减轻酒精性肝损伤。
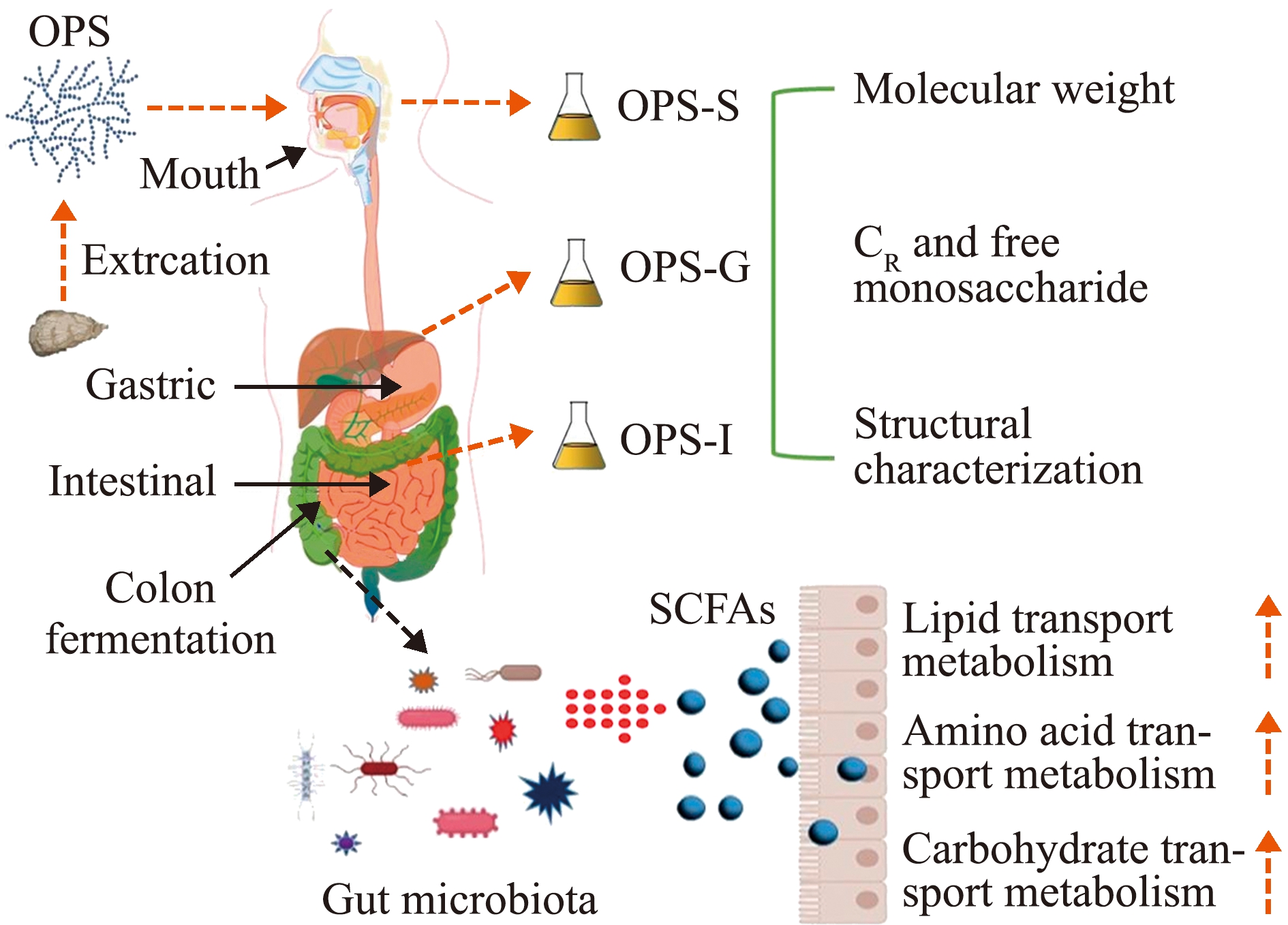
图3 长牡蛎多糖(OPS)改善肠道菌群的作用机制[73]
Fig.3 Mechanism of Pacific oyster polysaccharide (OPS) improving intestinal flora[73]
2.2.5 其他功能活性 牡蛎多糖的功能活性远不止上述这些。牡蛎多糖还被证实具有抗高血压[76]、降血糖[77]、抗肿瘤[78]和抗食物过敏性炎症[79]等作用。目前,牡蛎多糖的研究多集中于牡蛎多糖混合物的提取及活性研究方面。对于单一牡蛎多糖的结构解析还比较欠缺,且纯多糖的功能活性相对较低,据报道,硒化和硫酸脂化能够提高其活性。以硝酸作为催化剂,采用亚硒酸钠和近江牡蛎多糖反应合成硒化牡蛎多糖,硒化后可提高牡蛎多糖对Hela和HepG2细胞生长的抑制作用[80]。采用氯磺酸-吡啶法硫酸化近江牡蛎多糖,硫酸酯化的牡蛎多糖对酒精所致的小鼠肝损伤具有保护作用,能改善小鼠受损的肠道功能和减少小鼠体内氧化应激反应[81]。
2.3 牡蛎锌元素的活性
锌是哺乳动物正常生殖功能和胚胎发育的重要营养物质。研究发现,给缺锌小鼠喂养富含锌元素的牡蛎提取物,可恢复其血清锌浓度到正常水平,改善雌性缺锌小鼠出现的生殖衰竭、胚胎缺陷等问题,提高雄性小鼠精子活力[82]。牡蛎中锌元素能够促进动物生长,补充牡蛎多糖锌配合物可有效提高断奶仔猪血清抗氧化能力和免疫耐受能力,提高空肠黏膜二糖酶的活性,促进断奶仔猪的生长性能[83]。此外,牡蛎锌结合蛋白还可通过恢复线粒体的膜电位和抑制氧化应激,来保护神经元细胞免受D-半乳糖的损伤[84]。
3 牡蛎营养与功能活性成分开发应用现状
牡蛎营养价值高且具有广泛的功能活性,是开发营养及功能食品的优质原料,在国内外受到了广泛的关注。研究者把生物酶解技术、现代高效萃取技术应用于牡蛎营养及功能成分的开发利用中,成功开发出以牡蛎营养功能成分为主要基料的一系列营养及功能食品。牡蛎营养及功能食品具有营养滋补及功能保健的双重作用,可满足当前人们因亚健康问题困扰而对营养健康食品的巨大需求,市场前景十分广阔。
3.1 牡蛎肽基料类产品
牡蛎肽是开发牡蛎营养及功能食品的主要基料。通过生物酶解技术将牡蛎蛋白质降解成蛋白肽,所得牡蛎肽产品含有各种生物活性的功能肽,同时牡蛎的其他功能成分如锌元素、牛磺酸和多糖等在酶解过程中亦被释放出来。因此,实际生产的牡蛎肽具有广泛的生理功效,并作为基料被应用于营养及功能食品的开发。近年来,中国出现了众多专业生产牡蛎肽的厂家,为牡蛎功能食品企业的生产提供了充足的原料。
3.2 营养补充剂类产品
牡蛎肽营养成分十分丰富,易消化吸收。以牡蛎肽为主要基料开发的固体饮料、口服液和压片等产品,往往会添加植物类基料或辅料,如大豆蛋白、果粉等,不仅可降低生产成本,同时亦可改良牡蛎肽的风味特性,满足大众的口味嗜好。此类产品具有较好的补充蛋白质、氨基酸和锌元素的作用。
3.3 功能保健类产品
以牡蛎肽为基料开发最多的产品是功能保健类产品,主要有以下几种功能:1)补肾壮阳。牡蛎补肾壮阳类的功能保健产品最多,国内大多是近几年开发上市,销售情况良好。2)解酒护肝。国外的牡蛎解酒护肝产品主要以牡蛎提取物为基料制成,仅以保护肝脏为卖点,不宣传、不标识解酒作用;国内的同类产品主要以牡蛎肽为基料,辅以葛根、大豆肽、玉米肽等植物性提取成分制成。3)补锌。补锌类产品主要面向备孕的男性消费者。4)抗疲劳。牡蛎功能食品均具有一定的抗疲劳功效,单纯以抗疲劳为卖点的牡蛎保健产品目前尚不多见。值得注意的是,许多牡蛎功能食品尚未获得保健食品批文,仅能以普通营养食品的方式上市,且产品的标识、说明书等不能宣传其功效。
在美国,以牡蛎为原料的功能食品和疗效品等营养辅助食品已经形成了一个巨大的产业,欧洲也出现了以牡蛎中的牛磺酸、谷胱甘肽等物质开发的功能性食品。日本早在20世纪60年代就开始研究牡蛎功能食品,日本市场上的牡蛎功能食品和疗效品的品种达70多种。中国近年来上市了较多的牡蛎肽及以其为基料的营养健康食品和保健食品,如“海王金牡蛎”“海王金樽”“牡蛎全营养片(EXT)”“阿胶牡蛎口服液”“东海三豪”等。牡蛎具有广泛的生理保健功效,但在许多功能活性的产业开发方面还存在一些技术难题和瓶颈,除牡蛎肽已少量开发成营养及功能产品外,其他功能成分特别是牡蛎多糖的开发仍停留在实验室研究阶段。
4 存在问题及展望
4.1 牡蛎营养特性及功能活性研究中存在的问题
目前,国内外学者已针对牡蛎的蛋白肽、多糖及生物锌的营养和功能活性进行了大量报道,但这些研究多集中于粗蛋白质和粗多糖等混合物成分和功能的阐述,对单一多糖或单一蛋白质的结构研究报道较少,对不同海域、不同季节、不同品种、不同养殖模式的牡蛎营养组成及功能活性比较研究也较少。另外,功能活性成分在人体消化系统的不稳定性也极大地影响了其实用价值。总体而言,对牡蛎的营养、功能活性成分研究虽然较多,但研究缺乏深度,且开发应用仍然非常有限。
4.2 未来重点研究方向
针对牡蛎营养及功能活性的研究及开发现状,未来的研究应聚焦并攻克以下几个方面的课题:
1)研发高效的分离纯化及制备技术手段。牡蛎生物组织组成十分复杂,生物大分子、小分子彼此吸附、交织、缠绕甚至结合在一起,从中分离制备目标活性成分需要集成运用一些先进的分离纯化鉴定手段和方法,采用多种活性示踪方法,分离出高纯度的具有特定生理功能的活性成分,才能为后续构效机制研究奠定基础,并为其功能产品的精准开发提供试验依据。
2)深度挖掘牡蛎功能活性及因子。根据中国古典药籍的记载及国内外对牡蛎的众多研究报道,牡蛎具有较多的保健和药用价值,但大多数功能活性因子不明确,或在药理机制方面研究尚不够深入,未能使牡蛎的功能活性及药用价值得到更细致且全面的应用。未来可利用现代药理学研究方法及生物学模型阐明牡蛎功能因子在体内吸收、分布、生物转化和排泄等过程,以及药物效应和血药浓度随时间消长的规律,揭示其对机体的作用及原理。
3)突破功能活性改良技术。牡蛎功能活性肽、活性多糖具有广泛的生理功能,但其功效尚不能达到药用水平。因此,需突破功能活性改良技术,对构效机制清晰、药理明确的牡蛎功能活性肽和多糖,采取结构优化、化学修饰和金属离子螯合等策略进一步增强其功能活性,提高其实用性。
4)开发功能活性成分稳态化技术及产品。牡蛎功能肽、活性多糖的功能活性与其结构密切相关,在人体消化系统中易被降解从而降低或失去活性,不仅能降低其生物利用率,而且还限制其在功能食品中的应用。针对人体消化系统的特点,在产品设计上可采取模拟消化制备、微乳化、微胶囊包埋、水凝胶包埋和生物转化修饰等开发思路。
5)探究功能活性成分的相互作用及协同配伍增效机制。从目前所有牡蛎功能活性的研究报道看,牡蛎功能肽与活性多糖具有一些相似的功能活性,如抗氧化、抗肝损伤、抗炎、抗肿瘤和抗高血压等。这对牡蛎功能保健产品的开发是有益的,因为在实际开发应用中较难将蛋白质、碳水化合物、锌等成分彻底分开,牡蛎提取物或酶解产物往往含有蛋白质类和糖类两种主要成分,同时也含有锌元素等矿物质元素。牡蛎功能肽、活性多糖、锌在复合体系中的相互作用,以及对功能活性的影响机制有待深入研究。目前,许多保健食品尚缺乏创新,仅将原料、辅料简单复配,因此,明确功能肽、活性多糖、锌的相互作用及协同配伍增效机制,可使研究者能更精准地实现功能食品产品的开发。
总之,牡蛎是优质的海洋水产品,含有丰富的蛋白质及功能活性成分,研究开发营养食品和功能食品市场前景广阔。目前,随着生物制备技术、分离鉴定方法、计算机辅助药物研究及活性机制研究的不断发展,越来越多的牡蛎活性物质被报道,也将会有更多牡蛎功能活性成分被开发成深受市场欢迎的营养及功能食品。
[1] 巫旗生,王晓清,曾志南,等.中国牡蛎分类方法研究进展[J].福建水产,2011,33(1):67-72.
WU Q S,WANG X Q,ZENG Z N,et al.Advances in the classification of oysters in China[J].Journal of Fujian Fisheries,2011,33(1):67-72.(in Chinese)
[2] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会编制.2021中国渔业统计年鉴[M].北京:中国农业出版社,2021.
Fishery Administration Bureau of Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Station,China Society of Fisheries.2021 China fisheries statistical yearbook[M].Beijing:China Agriculture Press,2021.(in Chinese)
[3] 张联怡.近江牡蛎糖原提取、纯化及化学结构研究[D].湛江:广东海洋大学,2013.
ZHANG L Y.Study on extraction,purification and structure identification of glycogen from Crassostrea rivularis[D].Zhanjiang:Guangdong Ocean University,2013.(in Chinese)
[4] 马继兴.神农本草经辑注[M].北京:人民卫生出版社,2013.
MA J X.Notes to the collection of Shennong materia medica[M].Beijing:People’s Medical Publishing House,2013.(in Chinese)
[5] 陈藏器.《本草拾遗》辑释[M].合肥:安徽科学技术出版社,2002.
CHEN Z Q.Compilation and interpretation of materia medica[M].Hefei:Anhui Science and Technology Press,2002.(in Chinese)
[6] ULAGESAN S,KRISHNAN S,NAM T J,et al.A review of bioactive compounds in oyster shell and tissues[J].Frontiers in Bioengineering and Biotechnology,2022,10:913839.
[7] LINEHAN L G,O’CONNOR T P,BURNELL G.Seasonal variation in the chemical composition and fatty acid profile of Pacific oysters (Crassostrea gigas)[J].Food Chemistry,1999,64(2):211-214.
[8] 张晶晶.牡蛎蛋白的组成及其功能特性的研究[D].湛江:广东海洋大学,2014.
ZHANG J J.Study on composition and functional properties of oyster protein[D].Zhanjiang:Guangdong Ocean University,2014.(in Chinese)
[9] 方玲,马海霞,李来好,等.华南地区近江牡蛎营养成分分析及评价[J].食品工业科技,2018,39(2):301-307,313.
FANG L,MA H X,LI L H,et al.Analysis and evaluation of nutrient composition in Ostrea rivularis from South China Sea coast[J].Science and Technology of Food Industry,2018,39(2):301-307,313.(in Chinese)
[10] MURATA Y,TOUHATA K,MIWA R.Correlation of extractive components and body index with taste in oyster Crassostrea gigas brands[J].Fisheries Science,2020,86(3):561-572.
[11] 谭乐义,章超桦,薛长湖,等.牛磺酸的生物活性及其在海洋生物中的分布[J].湛江海洋大学学报,2000,20(3):75-79.
TAN L Y,ZHANG C H,XUE C H,et al.Bioactivity of taurine and its distribution in marine organisms[J].Journal of Zhanjiang Ocean University,2000,20(3):75-79.(in Chinese)
[12] 高加龙,章超桦,邱伟佳,等.南海不同产地近江牡蛎中牛磺酸含量检测[J].食品科学,2013,34(10):164-168.
GAO J L,ZHANG C H,QIU W J,et al.Determination of taurine in Ostrea rivularis from different parts of the South China Sea[J].Food Science,2013,34(10):164-168.(in Chinese)
[13] TANAKA K,NISHIZONO S,KUGINO K,et al.Effects of dietary oyster extract on lipid metabolism,blood pressure,and blood glucose in SD rats,hypertensive rats,and diabetic rats[J].Bioscience,Biotechnology,and Biochemistry,2006,70(2):462-470.
[14] 章超桦,薛长湖.水产食品学[M].3版.北京:中国农业出版社,2018.
ZHANG C H,XUE C H.Aquatic food science[M].3rd ed.Beijing:China Agriculture Press,2018.(in Chinese)
[15] 赵强,魏祥玲,孙建安,等.牡蛎资源的综合开发利用研究进展[J].中国食品添加剂,2021,32(7):150-159.
ZHAO Q,WEI X L,SUN J A,et al.Research progress on comprehensive utilization of oyster resources [J].China Food Additives,2021,32(7):150-159.(in Chinese)
[16] 杨大俏,王锦旭,李来好,等.近江牡蛎多糖的结构鉴定及免疫调节能力分析[J].食品科学,2020,41(10):38-46.
YANG D Q,WANG J X,LI L H,et al.Structural analysis and immunoregulatory activity of polysaccharides from Crassostrea rivularis[J].Food Science,2020,41(10):38-46.(in Chinese)
[17] 刘良伟,任杰,侯俊财,等.牡蛎多糖结构特征、理化特性及抗氧化活性研究[J/OL].食品与发酵工业,2022.https://doi.org/10.13995/j.cnki.11-1802/ts.031936.
LIU L Y,REN J,HOU J C,et al.Structural characteristics,physicochemical properties and antioxidant activity of oyster polysaccharides[J/OL].Food and Fermentation Industries,2022.https://doi.org/10.13995/j.cnki.11-1802/ts.031936.(in Chinese)
[18] 王允茹,蔡秋杏,张晨晓,等.北部湾海区几种常见牡蛎基础营养及脂肪酸成分比较分析[J].食品安全质量检测学报,2021,12(7):2849-2854.
WANG Y R,CAI Q X,ZHANG C X,et al.Comparative analysis of basic nutrition and fatty acid composition of several common oysters in Beibugulf[J].Journal of Food Safety & Quality,2021,12(7):2849-2854.(in Chinese)
[19] 佟蕾,朱蓓薇,周大勇,等.牡蛎脂质的超临界CO2萃取及气相色谱-质谱分析[J].大连工业大学学报,2011,30(4):242-245.
TONG L,ZHU B W,ZHOU D Y,et al.Supercritical carbon dioxide extraction and GC-MS analysis of lipid from oyster (Crassostrea talienwhanensis)[J].Journal of Dalian Polytechnic University,2011,30(4):242-245.(in Chinese)
[20] 刘书成,李德涛,高加龙,等.近江牡蛎等3种贝类的脂类成分分析[J].水产学报,2009,33(4):666-671.
LIU S C,LI D T,GAO J L,et al.Lipid components of Ostrea rivularis,Paphia undulata and Pinctada martensi[J].Journal of Fisheries of China,2009,33(4):666-671.(in Chinese)
[21] 赵艳芳,宁劲松,尚德荣,等.牡蛎、缢蛏和菲律宾蛤仔中微量元素的分析研究[J].广东微量元素科学,2009,16(9):50-54.
ZHAO Y F,NING J S,SHANG D R,et al.Determination of trace elements in oyster,razor clam and Manila clams[J].Guangdong Trace Elements Science,2009,16(9):50-54.(in Chinese)
[22] 韩蓉,曹文红,章超桦,等.香港牡蛎中锌元素的分布及存在形态[J].广东海洋大学学报,2021,41(4):120-127.
HAN R,CAO W H,ZHANG C H,et al.Distribution and existential forms of zinc in Crassostrea hongkongensis[J].Journal of Guangdong Ocean University,2021,41(4):120-127.(in Chinese)
[23] 韩蓉.香港牡蛎锌元素的分布、存在形态及锌多糖的结构研究[D].湛江:广东海洋大学,2021.
HAN R.Study on the distribution and existing forms of zinc in Crassostrea hongkongensis and the structure of zinc polysaccharides[D].Zhanjiang:Guangdong Ocean University,2021.(in Chinese)
[24] LI Y,WEI G Y,CHEN J.Glutathione:a review on biotechnological production[J].Applied Microbiology and Biotechnology,2004,66(3):233-242.
[25] DE CASTRO R J S,SATO H H.Biologically active peptides:processes for their generation,purification and identification and applications as natural additives in the food and pharmaceutical industries[J].Food Research International,2015,74:185-198.
[26] 叶昱辉.近江牡蛎多肽的分离纯化及其抗氧化、抗光老化活性研究[D].广州:华南理工大学,2018.
YE Y H.Purification of Ostrea rivularis peptides and their antioxidant,antiphotoaging activities[D].Guangzhou:South China University of Technology,2018.(in Chinese)
[27] UMAYAPARVATHI S,MEENAKSHI S,VIMALRAJ V,et al.Isolation and structural elucidation of antioxidant peptides from oyster (Saccostrea cucullata) protein hydrolysate[J].Protein and Peptide Letters,2014,21(10):1073-1083.
[28] WANG Q K,LI W,HE Y H,et al.Novel antioxidative peptides from the protein hydrolysate of oysters (Crassostrea talienwhanensis)[J].Food Chemistry,2014,145:991-996.
[29] HWANG J W,LEE S J,KIM Y S,et al.Purification and characterization of a novel peptide with inhibitory effects on colitis induced mice by dextran sulfate sodium from enzymatic hydrolysates of Crassostrea gigas[J].Fish & Shellfish Immunology,2012,33(4):993-999.
[30] HWANG D,KANG M J,JO M J,et al.Anti-inflammatory activity of β-thymosin peptide derived from Pacific oyster (Crassostrea gigas) on NO and PGE2 production by down-regulating NF-κB in LPS-induced RAW264.7 macrophage cells[J].Marine Drugs,2019,17(2):129.
[31] SIREGAR A S,NYIRAMANA M M,KIM E J,et al.Oyster-derived Tyr-Ala(YA) peptide prevents lipopolysaccharide/D-galactosamine-induced acute liver failure by suppressing inflammatory,apoptotic,ferroptotic,and pyroptotic signals[J].Marine Drugs,2021,19(11):614.
[32] LI W,XU C,ZHANG C H,et al.The purification and identification of immunoregulatory peptides from oyster (Crassostrea hongkongensis) enzymatic hydrolysate[J].RSC Advances,2019,9(56):32854-32863.
[33] WANG J P,HU J N,CUI J Z,et al.Purification and identification of a ACE inhibitory peptide from oyster proteins hydrolysate and the antihypertensive effect of hydrolysate in spontaneously hypertensive rats[J].Food Chemistry,2008,111(2):302-308.
[34] SHIOZAKI K,SHIOZAKI M,MASUDA J,et al.Identification of oyster-derived hypotensive peptide acting as angiotensin-I-converting enzyme inhibitor[J].Fisheries Science,2010,76(5):865-872.
[35] XIE C L,KIM J S,HA J M,et al.Angiotensin I-converting enzyme inhibitor derived from cross-linked oyster protein[J].Bio Med Research International,2014,2014:379234.
[36] ZHANG L,LIU Y Z,TIAN X,et al.Antimicrobial capacity and antioxidant activity of enzymatic hydrolysates of protein from Rushan Bay oyster (Crassostrea gigas)[J].Journal of Food Processing and Preservation,2015,39(4):404-412.
[37] LEE T G,MARUYAMA S.Isolation of HIV-1 protease-inhibiting peptides from thermolysin hydrolysate of oyster proteins[J].Biochemical and Biophysical Research Communications,1998,253(3):604-608.
[38] SEO J K,CRAWFORD J M,STONE K L,et al.Purification of a novel arthropod defensin from the American oyster,Crassostrea virginica[J].Biochemical and Biophysical Research Communications,2005,338(4):1998-2004.
[39] LIU Z Y,DONG S Y,XU J,et al.Production of cysteine-rich antimicrobial peptide by digestion of oyster (Crassostrea gigas) with alcalase and bromelin[J].Food Control,2008,19(3):231-235.
[40] MOUNTZ A C,ANGERSON R S.Purification of a novel antimicrobial peptide from the astern oyster (Crassostrea virginica) [J].Journal of Shellfish Research,2002,21(1):405-406.
[41] 兰晓明,牟茜,王春波.牡蛎软体中抗菌蛋白对白色念珠菌超微结构的影响[J].中国海洋药物,2008,27(1):55-57.
LAN X M,MU Q,WANG C B.Ultrastructural observation of the effect of oyster antibiosis protein on Candida albicans[J].Chinese Journal of Marine Drugs,2008,27(1):55-57.(in Chinese)
[42] CHENG S Z,WU D,LIU H X,et al.A novel anticoagulant peptide discovered from Crassostrea gigas by combining bioinformatics with the enzymolysis strategy:inhibitory kinetics and mechanisms[J].Food & Function,2021,12(20):10136-10146.
[43] CHENG S Z,TU M L,CHEN H,et al.Identification and inhibitory activity against α-thrombin of a novel anticoagulant peptide derived from oyster (Crassostrea gigas) protein[J].Food & Function,2018,9(12):6391-6400.
[44] CHENG S Z,TU M L,LIU H X,et al.A novel heptapeptide derived from Crassostrea gigas shows anticoagulant activity by targeting for thrombin active domain[J].Food Chemistry,2021,334:127507.
[45] 彭志兰.牡蛎蛋白源抗皮肤光老化活性肽的分离纯化、鉴定及其作用机理研究[D].湛江:广东海洋大学,2021.
PENG Z L.Purification and identification of anti-skin photoaging peptides from oyster (Crassostrea hongkongensis) protein and their antiphotoaging mechanisms[D].Zhanjiang:Guangdong Ocean University,2021.(in Chinese)
[46] HAN J H,BANG J S,CHOI Y J,et al.Anti-melanogenic effects of oyster hydrolysate in UVB-irradiated C57BL/6J mice and B16F10 melanoma cells via downregulation of cAMP signaling pathway[J].Journal of Ethnopharmacology,2019,229:137-144.
[47] BANG J S,JIN Y J,CHOUNG S Y.Low molecular polypeptide from oyster hydrolysate recovers photoaging in SKH-1 hairless mice[J].Toxicology and Applied Pharmacology,2020,386:114844.
[48] PENG Z L,CHEN B B,ZHENG Q S,et al.Ameliorative effects of peptides from the oyster (Crassostrea hongkongensis) protein hydrolysates against UVB-induced skin photodamage in mice[J].Marine Drugs,2020,18(6):288.
[49] WANG X Q,YU H H,XING R E,et al.Effect and mechanism of oyster hydrolytic peptides on spatial learning and memory in mice[J].RSC Advances,2018,8(11):6125-6135.
[50] 林海生.牡蛎蛋白肽的酶法制备及其改善小鼠学习记忆功能的研究[D].湛江:广东海洋大学,2013.
LIN H S.Preparation of peptides from oyster protein by enzymatic approach and their improving effects on the learning and memorizing ability of mice[D].Zhanjiang:Guangdong Ocean University,2013.(in Chinese)
[51] 徐成.牡蛎肉对东莨菪碱诱导学习记忆障碍的改善作用及其活性组分的研究[D].湛江:广东海洋大学,2016.
XU C.The study of effects of oyster on attenuating learning and memory impairment induced by scopolamine and its effective components[D].Zhanjiang:Guangdong Ocean University,2016.(in Chinese)
[52] 朱国萍.改善老年斑马鱼认知功能障碍的牡蛎活性肽筛选及其作用机制研究[D].湛江:广东海洋大学,2021.
ZHU G P.Screening of bioactive peptide from oysters and its mechanism of ameliorating cognitive impairment of aged-zebrafish[D].Zhanjiang:Guangdong Ocean University,2013.(in Chinese)
[53] HAO G X,CAO W H,HAO J,et al.In vitro antioxidant activity and in vivo anti-fatigue effects of oyster (Ostrea plicatula Gmelin) peptides prepared using neutral proteinase[J].Food Science & Technology Research,2013,19(4): 623-631.
[54] MIAO J Y,LIAO W W,KANG M,et al.Anti-fatigue and anti-oxidant activities of oyster (Ostrea rivularis) hydrolysate prepared by compound protease[J].Food & Function,2018,9(12):6577-6585.
[55] XIAO M F,LIN L,CHEN H P,et al.Anti-fatigue property of the oyster polypeptide fraction and its effect on gut microbiota in mice[J].Food & Function,2020,11(10):8659-8669.
[56] 张洁.牡蛎制品的研发及其生物活性评价[D].青岛:中国海洋大学,2009.
ZHANG J.Research on preparation of oyster’s functional products and evaluation of their biological activity[D].Qingdao:Ocean University of China,2009.(in Chinese)
[57] KIMURA Y,OHMINAMI H,OKUDA H.Effects of extract of oyster on lipid metabolism in rats[J].Journal of Ethnopharmacology,1998,59(3):117-123.
[58] WANG X Q,YU H H,XING R E,et al.Hepatoprotective effect of oyster peptide on alcohol-induced liver disease in mice[J].International Journal of Molecular Sciences,2022,23(15):8081.
[59] 陈贝贝,彭志兰,章超桦,等.牡蛎酶解物对慢性不可预知温和应激斑马鱼抑郁行为改善作用研究[J].食品科学技术学报,2021,39(4):55-63.
CHEN B B,PENG Z L,ZHANG C H,et al.Study on improving effect of oyster hydrolysate on depressive behavior of zebrafish under chronic unpredictable mild stress[J].Journal of Food Science and Technology,2021,39(4):55-63.(in Chinese)
[60] ZHANG X Y,PENG Z L,ZHENG H N,et al.The potential protective effect and possible mechanism of peptides from oyster (Crassostrea hongkongensis) hydrolysate on triptolide-induced testis injury in male mice[J].Marine Drugs,2021,19(10):566.
[61] 黄艳球.牡蛎肉及其酶解产物对半去势雄性大鼠性功能的影响[D].湛江:广东海洋大学,2019.
HUANG Y Q.Effects of oyster meal and its enzymatic hydrolysate on sexual function in hemi-castrated malerats[D].Zhanjiang:Guangdong Ocean University,2019.(in Chinese)
[62] CHEN S H,QIN X M,ZHANG C H,et al.Lactation activity and mechanism of milk-protein synthesis by peptides from oyster hydrolysates[J].Nutrients,2022,14(9):1786.
[63] UMAYAPARVATHI S,ARUMUGAM M,MEENAKSHI S,et al.Purification and characterization of antioxidant peptides from oyster (Saccostrea cucullata) hydrolysate and the anticancer activity of hydrolysate on human colon cancer cell lines[J].International Journal of Peptide Research and Therapeutics,2014,20(2):231-243.
[64] CHEN H,XU Z,FAN F J,et al.Identification and mechanism evaluation of a novel osteogenesis promoting peptide from Tubulin Alpha-1C chain in Crassostrea gigas[J].Food Chemistry,2019,272:751-757.
[65] LIU B,LIU H M,AI C Q,et al.Distribution of uronic acid-containing polysaccharides in 5 species of shellfishes[J].Carbohydrate Polymers,2017,164:195-199.
[66] 刘志芳,赵前程,刘志东,等.贝类多糖研究进展[J].食品与发酵工业,2021,47(9):299-306.
LIU Z F,ZHAO Q C,LIU Z D,et al.Research progress of polysaccharides derived from shellfish[J].Food and Fermentation Industries,2021,47(9):299-306.(in Chinese)
[67] XIONG Q P,SONG Z Y,HU W H,et al.Methods of extraction,separation,purification,structural characterization for polysaccharides from aquatic animals and their major pharmacological activities[J].Critical Reviews in Food Science and Nutrition,2020,60(1):48-63.
[68] CAI B N,WAN P,CHEN H,et al.Composition characterization of oyster polysaccharides from Crassostrea hongkongensis and their protective effect against H2O2-induced oxidative damage in IEC-6 cells[J].International Journal of Biological Macromolecules,2019,124:246-254.
[69] LI S J,ZHANG D Y,WU J,et al.Purification,preliminary characterization and bioactivities of polysaccharides from Ostrea rivularis Gould[J].International Journal of Biological Macromolecules,2015,80:16-22.
[70] 李萌,王磊,张立,等.牡蛎多糖对小鼠腹腔巨噬细胞免疫功能的影响[J].中国药业,2013,22(17):15-16.
LI M,WANG L,ZHANG L,et al.Effect of oyster polysaccharide on immunologic function of peritoneal macrophage in mice[J].China Pharmaceuticals,2013,22(17):15-16.(in Chinese)
[71] 江长优,张健,赵江贺.牡蛎多糖增强小鼠免疫功能作用研究[J].中成药,2013,35(5):1062-1065.
JIANG C Y,ZHANG J,ZHAO J H.Study on the effect of oyster polysaccharide on enhancing immune function in mice[J].Chinese Traditional Patent Medicine,2013,35(5):1062-1065.(in Chinese)
[72] CAI B N,PAN J Y,CHEN H,et al.Oyster polysaccharides ameliorate intestinal mucositis and improve metabolism in 5-fluorouracil-treated S180 tumour-bearing mice[J].Carbohydrate Polymers,2021,256:117545.
[73] MA Y Y,JIANG S S,ZENG M Y.In vitro simulated digestion and fermentation characteristics of polysaccharide from oyster (Crassostrea gigas),and its effects on the gut microbiota[J].Food Research International,2021,149:110646.
[74] SHI X,MA H H,TONG C Q,et al.Hepatoprotective effect of a polysaccharide from Crassostrea gigas on acute and chronic models of liver injury[J].International Journal of Biological Macromolecules,2015,78:142-148.
[75] JIANG S S,MA Y Y,LI Y T,et al.Mediation of the microbiome-gut axis by oyster (Crassostrea gigas) polysaccharides:a possible protective role in alcoholic liver injury[J].International Journal of Biological Macromolecules,2021,182:968-976.
[76] WANG T,DING J,LI H B,et al.Antihypertensive activity of polysaccharide from Crassostrea gigas[J].International Journal of Biological Macromolecules,2016,83:195-197.
[77] GETACHEW A T,LEE H J,CHO Y J,et al.Optimization of polysaccharides extraction from Pacific oyster (Crassostrea gigas) using subcritical water:structural characterization and biological activities[J].International Journal of Biological Macromolecules,2019,121:852-861.
[78] CHEONG K L,XIA L X,LIU Y.Isolation and characterization of polysaccharides from oysters (Crassostrea gigas) with anti-tumor activities using an aqueous two-phase system[J].Marine Drugs,2017,15(11):338.
[79] CHENG C H,WU H Y,WU C F,et al.Pacific oyster-derived polysaccharides attenuate allergen-induced intestinal inflammation in a murine model of food allergy[J].Journal of Food and Drug Analysis,2016,24(1):121-128.
[80] 丁佳玉.硒化牡蛎多糖制备及其生物活性研究[D].大连:大连海洋大学,2019.
DING J Y.Study on the preparation and biological activities of selenized Crassostrea gigas polysaccharides[D].Dalian:Dalian Ocean University,2019.(in Chinese)
[81] 赵冠华,曲敏,胡斯杰,等.硫酸酯化牡蛎多糖对四氯化碳所致小鼠急性肝损伤的影响[J].大连海洋大学学报,2018,33(1):72-76.
ZHAO G H,QU Min,HU Sijie,et al.Hepatoprotective effects of sulfated polysaccharide from Pacific oyster Crassostrea gigas against hepatic injury induced by carbon tetrachloride (CCl4) in mice[D].Journal of Dalian Ocean University,2018,33(1):72-76.(in Chinese)
[82] MATSUDA Y,WATANABE T.Effects of oyster extract on the reproductive function of zinc-deficient mice:bioavailability of zinc contained in oyster extract[J].Congenital Anomalies,2003,43(4):271-279.
[83] 马茂涛,林少伟,殷光文,等.牡蛎多糖锌配合物对脂多糖刺激断奶仔猪生长性能和肠道健康的影响[J].动物营养学报,2017,29(4):1359-1366.
MA M T,LIN S W,YIN G W,et al.Effects of oyster polysaccharide-zinc complex on growth performance and intestinal health of weaned piglets induced by lipopolysaccharide[J].Chinese Journal of Animal Nutrition,2017,29(4):1359-1366.(in Chinese)
[84] HSU W H,LIN Y C,CHEN B R,et al.The neuronal protection of a zinc-binding protein isolated from oyster[J].Food and Chemical Toxicology,2018,114:61-68.