香螺Neptunea cumingii Crosse隶属于软体动物门Mollusca腹足纲Gastropoda新腹足目Neogastropoda蛾螺科Buccinidae香螺属Neptunea,是一种具有增养殖潜力的经济贝类。主要分布于中国、朝鲜和日本北部等海域[1]。香螺营养丰富、味道鲜美,市场需求量巨大[2]。目前,香螺主要依靠采捕野生资源,但近年来,随着对香螺捕捞强度的增加及环境破坏压力的增大,其资源量衰退严重,尤其是香螺大规模人工增养殖技术尚未突破,致使其资源量恢复难度较大。因此,开展香螺繁殖发育方面的研究,探明香螺的最适生长环境,对于尽快实现香螺的全人工增养殖具有重要的意义。
溶解氧(dissolved oxygen,DO)是非常重要的海水理化因子,其浓度大小对水产动物的行为、存活等相关生理生态指标均会产生显著影响[3],因此,研究不同DO浓度下香螺生理生态指标的变化规律,明确香螺的最适DO浓度范围,对实现香螺全人工增养殖尤为重要。目前,国内外对于香螺的研究报道较少,主要对香螺的肌肉营养成分[2]、胚胎发育过程[4]、遗传多样性[5]、DNA多态位点[6],以及对香螺贝壳成分[7]和生殖系统[8-10]进行了一些研究。Zhang等[11]研究发现,香螺的最适养殖温度为8~16 ℃。但关于不同DO浓度对香螺存活、行为等相关生理生态影响的研究鲜见报道。本研究中,采用行为学、组织学和生理学等手段,研究了不同DO浓度下香螺的行为、组织结构及抗氧化酶活性的变化规律,以期明确香螺最适DO环境及其对DO的耐受范围,从而为实现香螺的全人工增养殖提供科学参考。
1 材料与方法
1.1 材料
试验用香螺采自辽宁省大连市旅顺口海域,潮湿低温环境下运回农业农村部北方海水增养殖重点实验室,暂养于15个50 L水族箱中,香螺湿体质量为(85.3±9.3)g,暂养温度为(9±1)℃,盐度为30±1,DO为7.5 mg/L。
1.2 方法
1.2.1 试验设计及饲养管理 资料显示,2008—2017年,渤海海域海水的平均DO为7.7 mg/L[12]。因此,本试验中设置了0、2、4、6、8 mg/L 5个DO质量浓度(以下简称为浓度),每个浓度设置3个平行,每个平行放置100只健康香螺。
不同DO浓度的维持方法参照江天棋等[13]的方法,略有改动。具体如下:
8 mg/L DO组(对照组):通过持续通入空气的方法维持DO为8 mg/L。
0 mg/L DO组:先将试验水体煮沸冷却,后通入纯氮气以排净氧气,从而维持DO为0 mg/L。
2、4、6 mg/L DO组:通过持续通入氮气和空气混合气体的方法,保持试验需要的DO浓度。
通入气体后,待水体DO浓度稳定,表面用液体石蜡密封,防止水面与空气进行气体交换,导致局部DO浓度不一致。
香螺于试验前断食2 d,以减小香螺食欲对试验的影响,后将香螺从暂养水体直接放到对应试验水体,观察其在不同DO浓度下的存活和行为特征,6 h后取样,从每个平行取20只香螺,进行组织学和相关抗氧化酶指标的测定。剩余香螺继续留在试验水体直至试验结束。
1.2.2 行为特征观察 香螺有4种行为状态:正常状态、活跃状态、脱吸状态和死亡状态。具体判断标准:正常状态是指运动较少,长时间静止吸附在池底或池壁;活跃状态是指香螺静止时间较短,移动时间较长;脱吸状态是指香螺足部水肿,吸附池壁能力下降,吸不住池壁;死亡状态是指软体部无法完全缩入壳中。
1.2.3 组织学观察 参照Chen等[14]的组织切片制作方法。取香螺新鲜鳃和嗅检器组织,用Bouin液固定24 h以上,再进行常规伊红(H.E)染色,并在Leica显微镜(型号DM4 B)下观察并拍照。
1.2.4 抗氧化酶活性测定 采用南京建成生物工程研究所试剂盒,测定香螺鳃和肝胰腺组织的总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力,具体参照说明书。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 22.0软件进行单因素方差分析,采用Tukey’s法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 行为特征
从表1可见:香螺进入低DO浓度(0、2、4 mg/L)的水体后,会出现应激反应;当DO为4 mg/L时,香螺12 h内出现脱吸现象,24 h内出现死亡现象,96 h内全部死亡;当DO为2 mg/L时,香螺6 h内出现脱吸现象,48 h内全部死亡;当DO为0 mg/L时,香螺24 h内全部死亡。
表1 不同DO浓度下香螺死亡率及行为特征
Tab.1 Mortality and behavior of whelk Neptunea cumingii under different DO concentrations
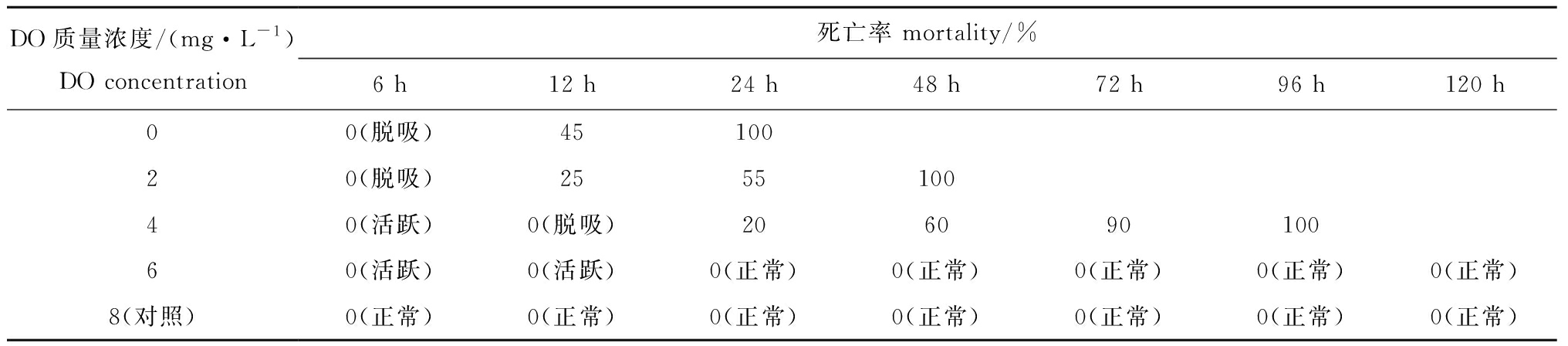
DO质量浓度/(mg·L-1)DO concentration死亡率 mortality/%6 h12 h24 h48 h72 h96 h120 h00(脱吸)4510020(脱吸)255510040(活跃)0(脱吸)20609010060(活跃)0(活跃)0(正常)0(正常)0(正常)0(正常)0(正常)8(对照)0(正常)0(正常)0(正常)0(正常)0(正常)0(正常)0(正常)
注:括号内状态表示香螺未死亡时的行为特征。
Note: The contents in brackets indicate the behavior characteristics of the whelk N.cumingii before death.
2.2 香螺鳃和嗅检器组织结构
2.2.1 鳃结构 不同DO浓度下,香螺鳃丝结构变化见图1,对照组香螺鳃丝表面褶皱不明显,组织结构完整,鳃小片呼吸上皮细胞排列有序(图1E),随着DO浓度的降低,鳃丝呼吸上皮细胞肿大脱落明显,因脱落形成的细胞凹陷亦愈显著,最终呈锯状(图1A~D)。

A~E—不同DO浓度下的鳃组织结构,A、B、C、D、E,DO浓度分别为0、2、4、6、8 mg/L。GF—鳃丝,MC—黏液细胞,GFI—鳃丝间隔,PVC—呼吸上皮细胞,CC—泌氯细胞。
A-E—gill histological structure under different dissolved oxygen concentration, A, B, C, D and E are 0, 2, 4, 6 and 8 mg/L respectively.GF—gill filament, MC—mucous cells, GFI—gill filament interval, PVC—respiratory epithelial cells, CC—secretory chloride cell.
图1 不同DO浓度下香螺鳃的组织结构
Fig.1 Gill histological structure of whelk Neptunea cumingii under different DO concentrations
不同DO浓度下,香螺鳃丝间隔变化显示:随着DO浓度的降低,鳃丝间隔总体上呈先增大后减小的变化趋势;DO为4 mg/L时,鳃丝间隔最大,之后逐渐减小,DO为0 mg/L时丝间隔虽再次增大,但与DO为4 mg/L时无显著性差异(P>0.05)(表2)。不同DO浓度下,香螺鳃黏液细胞数量变化显示:随着DO浓度的降低,鳃的黏液细胞数量总体上呈先增加后降低的变化趋势;DO为6 mg/L时,鳃黏液细胞数量最多,对照组(8 mg/L)黏液细胞数量最少,且低DO浓度组(0~6 mg/L)鳃黏液细胞数量均显著高于对照组(P<0.05)(表3)。
2.2.2 嗅检器结构 不同DO浓度下,香螺嗅检器组织结构变化见图2,嗅检器细胞结构完整且排列有序,变化不显著。

A~E—不同DO浓度下嗅检器的组织结构,A、B、C、D、E,DO浓度分别为0、2、4、6、8 mg/L。OF—嗅检器丝,MC—黏液细胞,OFI—嗅检器丝间隔。
A-E—osphradiuml histological structure under different dissolved oxygen concentration, A, B, C, D and E are 0, 2, 4, 6 and 8 mg/L respectively. OF—osphradium filament, MC—mucous cells, OFI—osphradium filament interval.
图2 不同DO浓度下香螺嗅检器的组织结构
Fig.2 Osphradium histological structure of whelk Neptunea cumingii under different DO concentrations
不同DO浓度下,香螺嗅检器丝间隔变化显示,DO浓度对香螺嗅检器丝间隔的影响显著,当DO为4 mg/L时,香螺嗅检器丝间隔最大,且显著大于其他组(P<0.05)(表2)。不同DO浓度下,香螺嗅检器黏液细胞数量变化显示:随着DO浓度的降低,嗅检器黏液细胞数量呈先上升后下降的变化趋势;DO为6 mg/L时黏液细胞数量最多,DO为0 mg/L时黏液细胞数量最少;0、2 mg/L DO处理组黏液细胞数量显著低于对照组(P<0.05),4、6 mg/L DO处理组黏液细胞数量则显著高于对照组(P<0.05)(表3)。
表2 不同DO浓度下香螺鳃丝和嗅检器丝间隔
Tab.2 Gill filament and osphradium filament spacing of whelk Neptunea cumingii under different DO concentrations
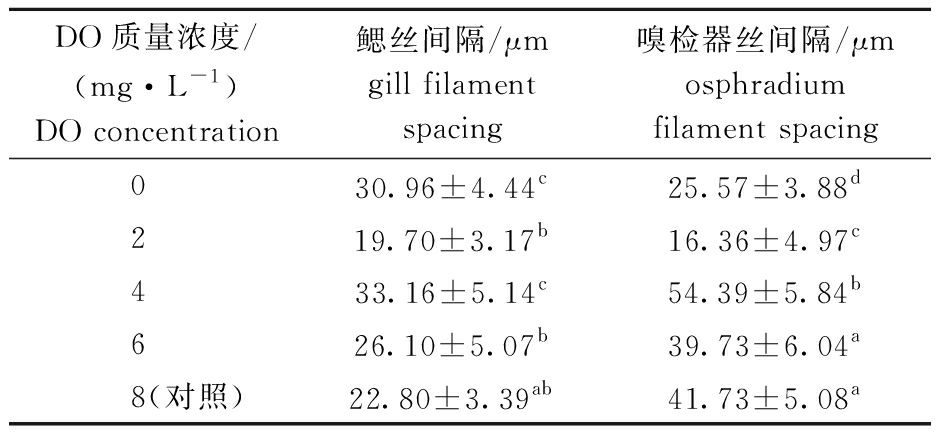
DO质量浓度/(mg·L-1)DO concentration鳃丝间隔/μmgill filament spacing嗅检器丝间隔/μmosphradium filament spacing 030.96±4.44c25.57±3.88d 219.70±3.17b16.36±4.97c 433.16±5.14c54.39±5.84b 626.10±5.07b39.73±6.04a 8(对照)22.80±3.39ab41.73±5.08a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note: The means with different letters within same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
相同DO浓度下,不同组织间的黏液细胞数量相比,除0 mg/L DO组外,其他DO浓度下,鳃和嗅检器黏液细胞数量均有显著性差异(P<0.05)(表3)。
表3 不同DO浓度下香螺鳃和嗅检器的黏液细胞数量
Tab.3 Number of mucus cells in gill and osphradium of whelk Neptunea cumingii under different DO concentrations
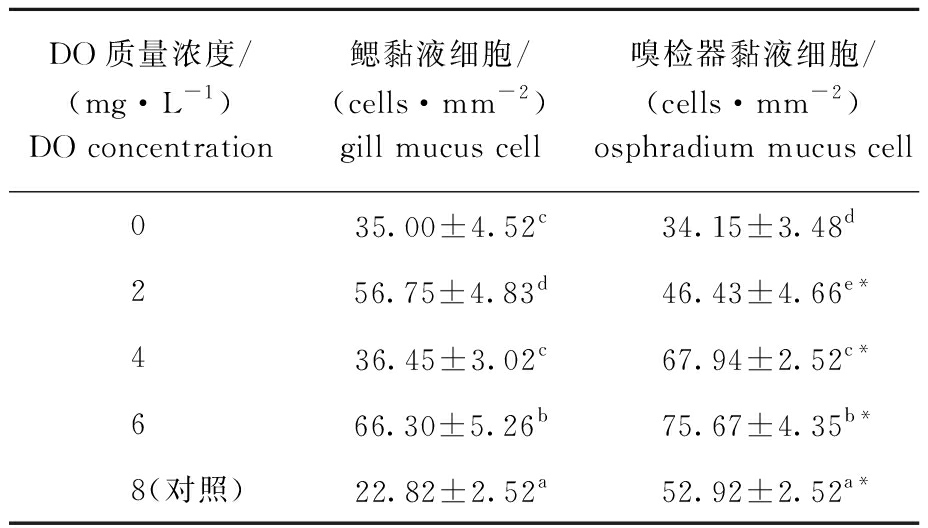
DO质量浓度/(mg·L-1)DO concentration鳃黏液细胞/(cells·mm-2)gill mucus cell嗅检器黏液细胞/(cells·mm-2)osphradium mucus cell 035.00±4.52c34.15±3.48d 256.75±4.83d46.43±4.66e* 436.45±3.02c67.94±2.52c* 666.30±5.26b75.67±4.35b* 8(对照)22.82±2.52a52.92±2.52a*
注:*表示相同DO浓度下,同一指标在不同组织间有显著性差异(P<0.05),下同。
Note:* indicates that under the same DO concentration, there is significant difference in different tissues in same index (P<0.05),et sequentia.
2.3 鳃和肝胰腺组织的抗氧化酶活性变化
从表4可见:随着DO浓度的下降,香螺鳃和肝胰腺组织的T-AOC、SOD活性总体上均呈先下降后升高再下降的变化趋势,鳃和肝胰腺中T-AOC活性在4 mg/L DO组、对照组中较高,且二者显著高于其他组(P<0.05),SOD活性则在4 mg/L DO组最高且显著高于其他组(P<0.05)(除2 mg/L DO组肝胰腺外),T-AOC、SOD活性均在6 mg/L DO组较低;随着DO浓度的下降,香螺鳃中CAT活性呈先上升后下降再上升的变化趋势,而香螺肝胰腺中CAT活性则呈下降趋势,鳃中CAT活性在4 mg/L DO组最高且显著高于其他组(P<0.05),肝胰腺中CAT活性则在对照组最高且显著高于其他DO浓度组(P<0.05)。
相同DO浓度下,不同组织间抗氧化酶活性相比,鳃中SOD活性在各DO浓度下均显著高于肝胰腺(P<0.05),而鳃和肝胰腺中T-AOC、CAT活性在多数DO浓度下也达到了显著性差异(P<0.05)(表4)。
表4 不同DO浓度下香螺鳃和肝胰腺的抗氧化酶指标
Tab.4 Changes in T-AOC in gills and hepatopancreas of whelk Neptunea cumingii under different DO concentrations U/mg prot
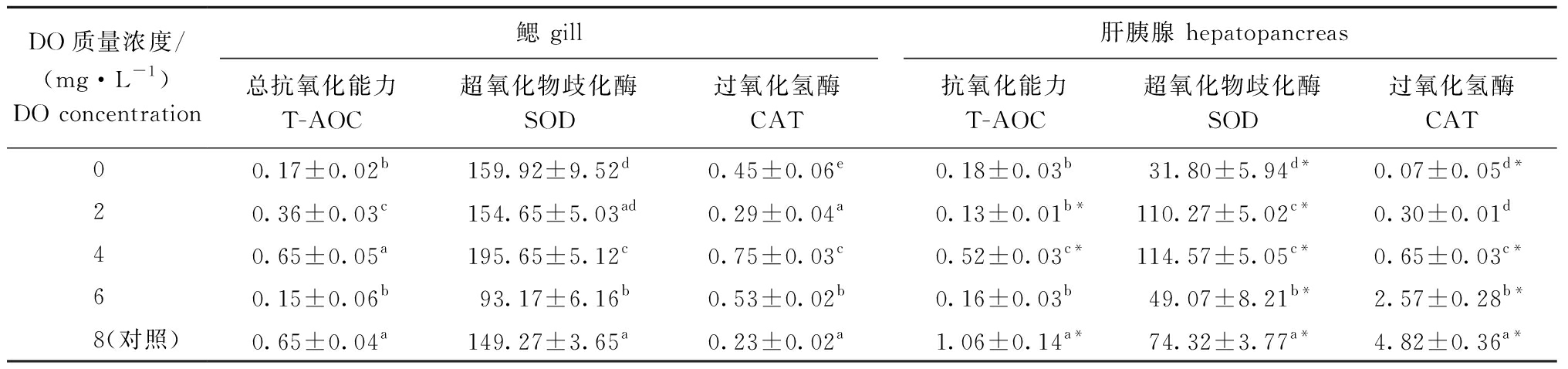
DO质量浓度/(mg·L-1)DO concentration鳃 gill肝胰腺 hepatopancreas总抗氧化能力T-AOC超氧化物歧化酶SOD过氧化氢酶CAT抗氧化能力T-AOC超氧化物歧化酶SOD过氧化氢酶CAT 00.17±0.02b159.92±9.52d0.45±0.06e0.18±0.03b31.80±5.94d*0.07±0.05d* 20.36±0.03c154.65±5.03ad0.29±0.04a0.13±0.01b*110.27±5.02c*0.30±0.01d 40.65±0.05a195.65±5.12c0.75±0.03c0.52±0.03c*114.57±5.05c*0.65±0.03c* 60.15±0.06b93.17±6.16b0.53±0.02b0.16±0.03b49.07±8.21b*2.57±0.28b* 8(对照)0.65±0.04a149.27±3.65a0.23±0.02a1.06±0.14a*74.32±3.77a*4.82±0.36a*
3 讨论
3.1 低氧胁迫对香螺行为特征的影响
对水产动物而言,DO是一个重要的环境因子,它会影响水产动物的行为、存活等相关生理生态的变化,严重时造成水产动物生理损伤甚至死亡[15]。魏若飞等[16]发现,大瓶螺Ampullaris gigas spix在短期低氧胁迫阶段,行为比较活跃,持续低氧后活动减弱,出现闭厣和死亡现象。除腹足类外,许多学者在其他软体动物中也发现类似结果。Sen等[17]发现,DO浓度越低,太平洋鲍鱼Pacific abalone的半致死时间越短。Li等[18]和Chen等[14]发现,栉孔扇贝Chlamys farreri 在低氧环境下比较活跃,且其存活率会随DO浓度下降而出现显著下降。本研究中结果与上述研究结果相似,DO浓度对香螺的行为特征影响显著,初始阶段,香螺移动活跃,后随低氧胁迫时间延长,香螺出现闭厣和死亡现象。分析原因可能是:当短期低氧胁迫时,香螺移动较活跃,说明香螺试图通过快速移动寻找高浓度DO区域;随着胁迫时间的延长,香螺身体各组织机能下降,导致足部吸附能力减弱,以至于最后无法吸附住池壁;随着低氧胁迫时间的进一步延长,香螺相关组织结构遭到不可逆式破坏,香螺开始出现闭厣和死亡现象。
3.2 低氧胁迫对香螺鳃和嗅检器组织结构的影响
在海洋软体动物体内,鳃不仅是气体交换的呼吸器官,还是滤食浮游生物以摄取营养的过滤器官,且由于鳃直接暴露于水体中,它还是感知周围环境变化的早期感知器官[19]。Zhang等[20]研究发现,缺氧环境会严重破坏菲律宾蛤仔Ruditapes philippinarum鳃组织结构,导致其鳃丝上皮不完整,层间结构消失,鳃丝间连接不规则。除无脊椎动物外,脊椎动物中也存在类似现象,如团头鲂Megalobrama amblycephala在低氧水体中鳃丝尖端膨大,凹陷形成褶皱[21]。线纹海马Hippocampus erectus幼鱼受到低氧胁迫时,鳃呼吸上皮细胞肿大脱落,鳃组织坏死[22]。本试验中发现,低氧会破坏香螺鳃的组织结构,导致其鳃丝尖端显著膨大,间距变大,表面细胞凹陷形成褶皱。有研究表明,水产动物可通过改变鳃组织结构形态,缓解外界环境变化对其产生的不利影响[23-24]。由此推测,本研究中,缺氧初始阶段,香螺通过改变鳃丝形态,扩大鳃丝表面积,进而增大鳃与水的接触面积,加大对氧的吸收,满足机体所需;当持续低氧时,香螺的鳃组织结构遭到严重破坏,致使其相关功能丢失,最终导致其死亡。在腹足类的一些研究中,嗅检器通常被作为一个特有的化学感受器,用于研究各种环境因子对腹足类的影响[25]。但在本研究中,水中DO浓度变化时,香螺嗅检器的组织结构并没有显著的改变。其原因可能是嗅检器对DO这一指标不敏感造成的。
贝类无特异性免疫系统,黏液细胞是其重要的腺细胞,贝类黏液可以在贝类体表形成一个致密的保护层,是贝类抗感染的第一道屏障。因此,黏液免疫作用显得尤为重要,黏液细胞的数目是反映贝类黏液免疫对环境变化适应的一个重要指标[26]。本研究中,香螺鳃和嗅检器在DO为8 mg/L(对照)、6 mg/L时黏液细胞数最高,且显著高于其他处理组。作者推测认为:DO为8、6 mg/L时,香螺处于最适DO环境,身体各组织机能较佳,黏液免疫屏障较强,故黏液细胞数量较高;而在低氧环境下,香螺机体出现损伤,黏液细胞分泌不畅,导致黏液细胞数量降低。
3.3 低氧胁迫对香螺抗氧化酶活性的影响
活性氧自由基(ROS)是由氧转变而成,化学性质十分活泼,易与机体的其他物质发生反应,形成新的自由基或氧化物[27]。生物进行新陈代谢活动时会产生ROS,当机体受到不良环境胁迫时,会导致机体聚集更多ROS,ROS水平升高起着重要的信号作用,但过量的ROS产生会导致细胞损伤,并对生物体的健康、性能和生存产生负面影响[28]。经过漫长的进化,生物具备了一套有效清除ROS的免疫体系,可使体内ROS生成与清除形成动态平衡,而CAT和SOD等抗氧化酶可保护生物体免受自由基的侵害,它们可以将ROS分解成对机体无害的H2O和O2,因此,SOD和CAT活性的高低可作为评估香螺抵抗环境变化能力的重要指标[29-30]。而T-AOC则可以反映生物的抗氧化能力,是评定生物健康状况的重要指标[31]。
目前,国内外很多学者开展了不同DO浓度下水产动物抗氧化酶活性的研究。Chen等[31]研究发现,马氏珠母贝Pinctada fucata martensii在低氧环境中其肝胰腺的T-AOC和CAT活性较对照组显著降低。Marcus等[32]研究发现,扁卷螺Biomphalaria tenagophila在低氧条件下,其体内CAT活性较对照组下降了31%。本研究中发现,随着DO浓度下降,香螺鳃和肝胰腺组织的T-AOC和SOD活性总体呈先下降后升高再下降的趋势,CAT活性总体呈先升高后下降的趋势。这与Chen等[31]和Marcus等[32]的结果存在差异,作者分析认为,出现差异的原因可能与试验物种不同及胁迫时间长短有关。另外,通过本试验结果,笔者推测,轻微的低氧胁迫可能会使机体内的ROS浓度升高,为了维持ROS生成和清除之间的平衡,机体抗氧化防御体系被激发,表现为抗氧化酶活力上升,随着低氧胁迫的加深,机体调节和免疫保护压力过大,体内生理功能紊乱,表现为抗氧化酶活力显著下降,随着低氧环境的进一步加深,机体出现严重损伤,进而出现闭厣和死亡现象。
4 结论
1)香螺最适DO为6~8 mg/L,当养殖水体DO≤4 mg/L、胁迫时间≥96 h时,香螺存活率为0。
2)低DO对香螺的行为特征、相关组织病理损伤和抗氧化酶活性影响显著,在短期低氧环境下,香螺会通过改变自身行为和相关组织结构形态,以及通过调节内分泌等方式来适应低氧环境。
[1] 周学家,张玉玺,刘信艺,等.山东近海香螺资源的分布研究[J].齐鲁渔业,1995,12(1):8-10.
ZHOU X J,ZHANG Y X,LIU X Y,et al.On distributing characteristics of Neptunea arthritica cumingii Crosse in Shandong coastal waters[J].Shandong Fisheries,1995,12(1):8-10.(in Chinese)
[2] 郝振林,王煜,于洋洋,等.香螺肌肉营养成分分析及评价[J].大连大学学报,2016,37(6):66-70.
HAO Z L,WANG Y,YU Y Y,et al.Analysis and evaluation of nutritive composition in the muscle of Neptunea arthritica cumingii Crosse (Gastropoda:Buccinidae)[J].Journal of Dalian University,2016,37(6):66-70.(in Chinese)
[3] WU C B,ZHENG G D,ZHAO X Y,et al.Hypoxia tolerance in a selectively bred F4 population of blunt snout bream (Megalobrama amblycephala) under hypoxic stress[J].Aquaculture,2020,518:734484.
[4] HAO Z L,LIU H Y,YU Y Y,et al.Reproductive characteristics and variations in the biochemical composition of Neptunea arthritica cumingii Crosse through embryonic development[J].Aquaculture Research,2021,52(1):1-11.
[5] HAO Z L,YANG L M,ZHAN Y Y,et al.The complete mitochondrial genome of Neptunea arthritica cumingii Crosse(Gastropoda:Buccinidae)[J].Mitochondrial DNA Part B:Resources,2016,1(1):220-221.
[6] AZUMA N,MIRANDA R M,GOSHIMA S,et al.Polymorphic microsatellite markers isolated from the Neptune whelk Neptunea arthritica[J].Molecular Ecology Resources,2009,9(1):120-121.
[7] 赵杰,丁晓非,高山,等.香螺壳体的结构特征分析[J].材料科学与工程学报,2004,22(5):644-646.
ZHAO J,DING X F,GAO S,et al.Structure characteristics of the shell of the conch Naptunea cmingii Crosse[J].Journal of Materials Science and Engineering,2004,22(5):644-646.(in Chinese)
[8] 高岩.香螺卵子发育超微结构的研究[J].吉林师范大学学报(自然科学版),2008,29(2):102-104.
GAO Y.The study on the ultrastructure of oogenesis on Naptunea cumingii Crosse(Gastropoda:Prosobranchia)[J].Jilin Normal University Journal (Natural Science Edition),2008,29(2):102-104.(in Chinese)
[9] 高岩,侯林,周革.香螺卵母细胞营养方式的研究[J].安徽农学通报,2008,14(11):36-38.
GAO Y,HOU L,ZHOU G.Study on nutritional mode of oogenesis in Naptunea cumingii Crosse(Gastropoda:Prosobranchia)[J].Anhui Agricultural Science Bulletin,2008,14(11):36-38.(in Chinese)
[10] 侯林,高岩,邹向阳,等.香螺精子发生及精子超微结构[J].动物学报,2006,52(4):746-754.
HOU L,GAO Y,ZOU X Y,et al.Ultrastructure of spermatogenesis and sperm morphology of Naptunea cumingii Crosse(Gastropoda)[J].Acta Zoologica Sinica,2006,52(4):746-754.(in Chinese)
[11] ZHANG D D,DONG X Y,ZHU J Y,et al.Effect of water temperature on the behavior of Neptunea cumingii and the histology,immune enzyme activity,and transcriptome of its gills and kidneys[J].Invertebrate Survival Journal,2022,19:1-12.
[12] CHEN Y Z,ZHAI F G,GU Y Z,et al.Seasonal variability in dissolved oxygen in the Bohai Sea,China[J].Journal of Oceanology and Limnology,2022,40(1):78-92.
[13] 江天棋,张扬,姜亚洲,等.不同溶解氧水平下厚壳贻贝的贝壳开放行为和呼吸代谢[J].中国水产科学,2021,28(10):1329-1336.
JIANG T Q,ZHANG Y,JIANG Y Z,et al.Shell valve opening behavior and metabolism of Mytilus coruscus under different oxygen concentrations[J].Journal of Fishery Sciences of China,2021,28(10):1329-1336.(in Chinese)
[14] CHEN J H,MAI K S,MA H M,et al.Effects of dissolved oxygen on survival and immune responses of scallop (Chlamys farreri Jones et Preston)[J].Fish & Shellfish Immunology,2007,22(3):272-281.
[15] 周莹.水生生物对水体溶解氧日变化规律影响[D].沈阳:沈阳师范大学,2016.
ZHOU Y.Effect of aquatic organisms on the diurnal variation of dissolved oxygen in water[D].Shenyang:Shenyang Normal University,2016.(in Chinese)
[16] 魏若飞,吕豪,张俭波.大瓶螺对几种理化因子的耐性试验[J].水产科学,1991,10(4):9-12.
WEI R F,LÜ H,ZHANG J B.Tolerance test on several physical and chemical factors of Ampullalirs gigas spix [J].Fisheries Science,1991,10(4):9-12.(in Chinese)
[17] SEN A,MNHA B,JSL C,et al.Prolonged exposure to hypoxia inhibits the growth of Pacific abalone by modulating innate immunity and oxidative status[J].Aquatic Toxicology,2020,227:105596.
[18] LI Q,ZHANG F,WANG M X,et al.Effects of hypoxia on survival,behavior,and metabolism of Zhikong scallop Chlamys farreri Jones et Preston 1904[J].Journal of Oceanology and Limnology,2020,38(2):351-363.
[19] FARCY E,VOISEUX C,LEBEL J M,et al.Transcriptional expression levels of cell stress marker genes in the Pacific oyster Crassostrea gigas exposed to acute thermal stress[J].Cell Stress & Chaperones,2009,14(4):371-380.
[20] ZHANG Y,WU H F,WEI L,et al.Effects of hypoxia in the gills of the Manila clam Ruditapes philippinarum using NMR-based metabolomics[J].Marine Pollution Bulletin,2017,114(1):84-89.
[21] 钱辰颖.低氧和高氧对团头鲂F5新品系鳃组织形态变化及各组织酶活性的影响[D].上海:上海海洋大学,2020.
QIAN C Y.Effects of hypoxia and hyperoxia on the morphological changes of gill and enzyme activity of tissues in the new strain F5 of Megalobrama amblycephala[D].Shanghai:Shanghai Ocean University,2020.(in Chinese)
[22] 罗辉玉,吴水清,郑乐云,等.溶解氧对线纹海马幼鱼氨氮耐受性的影响及氨氮胁迫下鳃、肝脏组织结构的变化[J].生态学杂志,2020,39(3):872-879.
LUO H Y,WU S Q,ZHENG L Y,et al.Effects of dissolved oxygen on tolerance of juvenile Hippocampus erectus to ammonia-N and histopathology of gill and liver under ammonia-N stress[J].Chinese Journal of Ecology,2020,39(3):872-879.(in Chinese)
[23] 王怡,胡婉彬,李家祥,等.急性盐度胁迫对紫石房蛤(Saxidomus purpurata)鳃组织结构及4种酶活性的影响[J].中国农业科技导报,2016,18(5):178-186.
WANG Y,HU W B,LI J X,et al.Effects of acute salinity stress on gill structure and four enzyme activities in Saxidomus purpurata[J].Journal of Agricultural Science and Technology,2016,18(5):178-186.(in Chinese)
[24] 任爽.贝氏高原鳅(Trilophysa bleekeri)鳃组织形态学及呼吸面积的研究[D].重庆:西南大学,2011.
REN S.Study of gill histomorphology and respiratory area of Trilophysa bleekeri[D].Chongqing:Southwest University,2011.(in Chinese)
[25] KAMARDIN N N,LUBIMTSEV V A,KORNIENKO E L,et al.Osphradial chemosensory organ as a probable trigger of the cardiac system adaptive reaction to the effect of heavy metals in aquatic mollusks[J].Zh Evol Biokhim Fiziol,2015,51(1):43-51.
[26] 王宜艳,孙虎山,孙修勤,等.海湾扇贝消化系统黏液细胞的类型与分布[J].中国水产科学,2003,10(3):254-257.
WANG Y Y,SUN H S,SUN X Q,et al.Types and distribution of mucous cells in the digestive system of scallop Argopecten irradians[J].Journal of Fishery Sciences of China,2003,10(3):254-257.(in Chinese)
[27] 石宝明,迟子涵.自由基对动物的危害及消除技术研究进展[J].饲料工业,2021,42(9):1-6.
SHI B M,CHI Z H.Research progress on harm of free radical to animals and its elimination technology[J].Feed Industry,2021,42(9):1-6.(in Chinese)
[28] WEI S S,XIE Z,LIU C H,et al.Antioxidant response of the oyster Crassostrea hongkongensis exposed to diel-cycling hypoxia under different salinities[J].Marine Environmental Research,2022,179:105705.
[29] PANNUNZIO T M,STOREY K B.Antioxidant defenses and lipid peroxidation during anoxia stress and aerobic recovery in the marine gastropod Littorina littorea[J].Journal of Experimental Marine Biology and Ecology,1998,221(2):277-292.
[30] LI Q,ZHANG F,SUN S.The survival and responses of blue mussel Mytilus edulis to 16-day sustained hypoxia stress[J].Marine Environmental Research,2022,176:105601.
[31] CHEN J Y,HUANG J,PENG J Q,et al.Effects of hypoxic stress on the digestion,energy metabolism,oxidative stress regulation,and immune function of the pearl oyster (Pinctada fucata martensii)[J].Aquaculture Reports,2022,25:101246.
[32] FERREIRA M V R,ALENCASTRO A C R,HERMES-LIMA M.Role of antioxidant defenses during estivation and anoxia exposure in the freshwater snail Biomphalaria tenagophila(Orbigny,1835)[J].Canadian Journal of Zoology,2003,81(7):1239-1248.