贝类属软体变温动物,其生理状态易受外界环境特别是温度的影响,而脂肪酸在贝类的免疫应答过程、温度适应性、生长发育和繁殖等生理过程中均起着关键的作用[1-3]。在适宜温度范围内,贝类可进行正常的生理活动,但超出该范围可能会发生生理紊乱甚至死亡[4-6]。应对低温胁迫的能力对于自然条件下水生生物的生存非常重要。低温会引起贝类的冷应激反应,贝类可通过调节与低温耐受、低温胁迫的相关基因,翻译合成抗寒相关蛋白,从而减少低温对其造成的损伤。脂肪酸去饱和酶(fatty acid synthase,FADs)引入双键,调节生物膜膜脂不饱和脂肪酸的水平,改变生物膜的流动性,从而响应和适应低温。在脂肪酸合成代谢过程中,乙酰辅酶A羧化酶(acetyl coenzyme a carboxylase,ACC)是脂肪酸合成中的限速酶,在脂肪酸合成和代谢中起着重要作用。
菲律宾蛤仔Ruditapes philippinarum是中国重要的海洋经济贝类,广泛分布于中国、日本和韩国沿海。冬季低温造成蛤仔存活率低的问题严重影响了北方蛤仔养殖产业,造成这种现象的原因之一就是南苗北养[7-9]。菲律宾蛤仔“斑马蛤2号”(以下简写为斑马蛤2号),是以辽宁省大连市石河菲律宾蛤仔野生群体为基础群体,以壳色和生长速度为目标性状,采用群体选育技术,经连续4代选育而成,由于斑马蛤2号耐低温,有望培育成适合在北方滩涂养殖的新品种 [10]。本试验中,选取斑马蛤2号群体、辽宁大连群体(以下简称为大连群体)和广西北海群体(以下简称为北海群体)进行低温胁迫试验,比较3个不同群体菲律宾蛤仔急性低温胁迫后的死亡率及其脂肪酸代谢相关基因(SCD、FAD和ACC)的表达变化,从mRNA水平初步揭示了脂肪酸代谢相关基因在菲律宾蛤仔应对低温胁迫过程中的重要作用,以期为深入研究斑马蛤2号的耐低温分子机制提供科学参考。
1 材料与方法
1.1 材料
试验用菲律宾蛤仔野生群体分别采自辽宁省大连市金州区、广西壮族自治区北海市,斑马蛤2号是辽宁省贝类良种繁育工程技术研究中心选育的蛤仔新品种,采自辽宁省盘锦市,不同群体蛤仔的采样信息见表1。试验于2019年12月进行,在正式试验前将所有蛤仔暂养3周,水温为(12 ℃±1 ℃),通过水循环系统设定温度并保持稳定。暂养期间,每天全量换水1次,每天投饵2次,持续充氧,试验正式开始前一天停止投饵。试验用海水取自大连市黑石礁海区,海水盐度为 31±1,pH为8.1±0.2,经沉淀、沙滤后贮存备用。
表1 不同群体蛤仔采样信息与规格
Tab.1 Sampling information and size of Manila clam in different groups
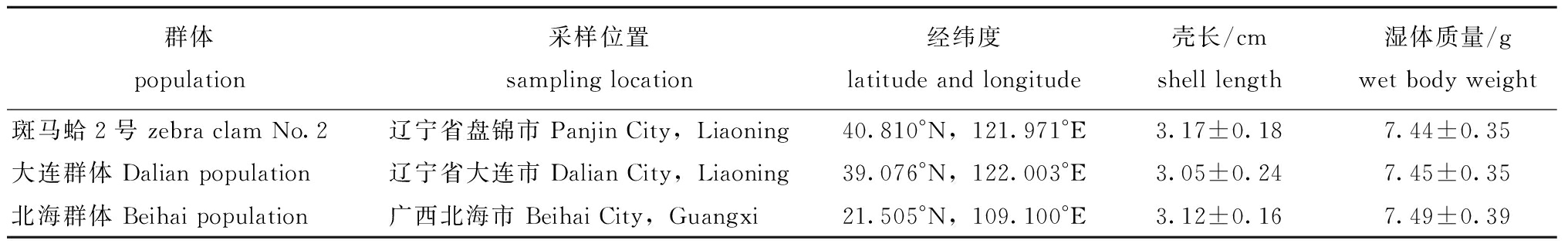
群体population采样位置sampling location经纬度latitude and longitude壳长/cmshell length湿体质量/gwet body weight斑马蛤2号 zebra clam No.2辽宁省盘锦市 Panjin City,Liaoning40.810°N,121.971°E3.17±0.187.44±0.35大连群体 Dalian population辽宁省大连市 Dalian City,Liaoning39.076°N,122.003°E3.05±0.247.45±0.35北海群体 Beihai population广西北海市 Beihai City,Guangxi21.505°N,109.100°E3.12±0.167.49±0.39
1.2 方法
1.2.1 试验设计 将试验蛤仔随机分成2个试验组(-1、4 ℃)和1个对照组(12 ℃),在每个温度水槽中放置不同群体蛤仔各100枚,每个温度下设置3个平行。其中,-1 ℃组水槽置于冰箱中,4 ℃组水槽置于水循环箱中,12 ℃组水槽置于室温环境中,通过空调控温保持温度稳定。试验期间不投喂,持续充气,每两天全量换水1次。为了评估急性低温胁迫对基因的影响,分别在0、6、12、24、48、72 h时从每个群体中随机选择3枚蛤仔,取其鳃组织,放入液氮中速冻后置于-80 ℃超低温冰箱中保存备用。
1.2.2 RNA提取与引物设计 采用Trizol法提取不同温度下3个群体蛤仔鳃组织的总RNA,并用20 μL DEPC水溶解。使用10 g/L琼脂糖凝胶电泳检测所提RNA的完整性,使用NanoDrop紫外分光光度计检测RNA的纯度和浓度。
采用Primer Premier 5.0软件设计3个基因(硬脂酰辅酶A去饱和酶基因SCD、脂肪酸去饱和酶基因FAD和乙酰辅酶A羧化酶基因ACC)。荧光定量引物见表2。
表2 荧光定量引物
Tab.2 Fluorescent quantitative primers
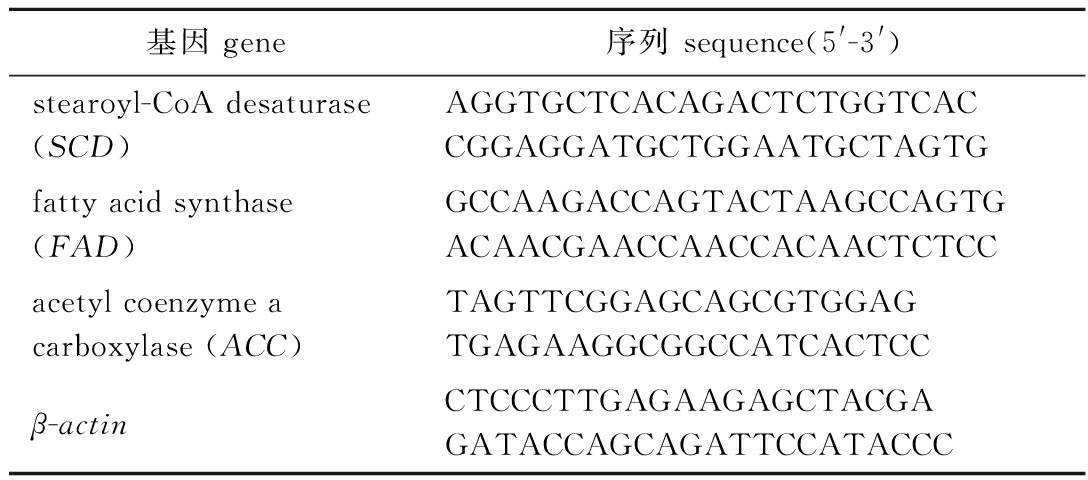
基因 gene序列 sequence(5'-3')stearoyl-CoA desaturase (SCD)AGGTGCTCACAGACTCTGGTCACCGGAGGATGCTGGAATGCTAGTGfatty acid synthase (FAD)GCCAAGACCAGTACTAAGCCAGTGACAACGAACCAACCACAACTCTCCacetyl coenzyme a carboxylase (ACC)TAGTTCGGAGCAGCGTGGAGTGAGAAGGCGGCCATCACTCCβ-actinCTCCCTTGAGAAGAGCTACGAGATACCAGCAGATTCCATACCC
1.2.3 荧光定量PCR 采用qRT-PCR法检测不同温度下蛤仔鳃组织中温度适应性相关基因的时序表达。PCR 反应体系(共20 μL):cDNA 2 μL,上、下游引物各1 μL,TBGreen 10 μL,ddH2O 6 μL。反应条件:94 ℃下预变性5 min;94 ℃下变性 30 s,60 ℃下退火30 s,72 ℃下延伸30 s,共进行40个循环。通过观察每个反应后的熔解曲线确认PCR 产物的特异性。以β-actin为内参,使用2-ΔΔCt方法计算基因表达量。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,利用SPSS 23.0软件进行单因素方差分析(ANOVA),采用Tukey HSD法和Duncan法进行两组和多组间的多重比较,显著性水平设为0.05。
2 结果与分析
2.1 低温胁迫对不同群体蛤仔存活率的影响
从表3可见:在-1 ℃胁迫下,第1天时北海群体和斑马蛤2号开始出现死亡,第2天时大连群体开始出现死亡个体,第7天时3个群体蛤仔累计死亡率均在20%以上,死亡率最高为北海群体;4、12 ℃下,3个蛤仔死亡率均在10%以下。试验结束(第9天)时,在-1 ℃胁迫下,北海群体的死亡率最高(51.85%),而斑马蛤2号的死亡率最低(25.94%);4 ℃下,3组的死亡率相差不大,均在10%以下;12 ℃下,斑马蛤2号的死亡率为0。
表3 不同群体在低温胁迫下的累计死亡率
Tab.3 Cumulative mortality of different populations exposed to low temperature stress
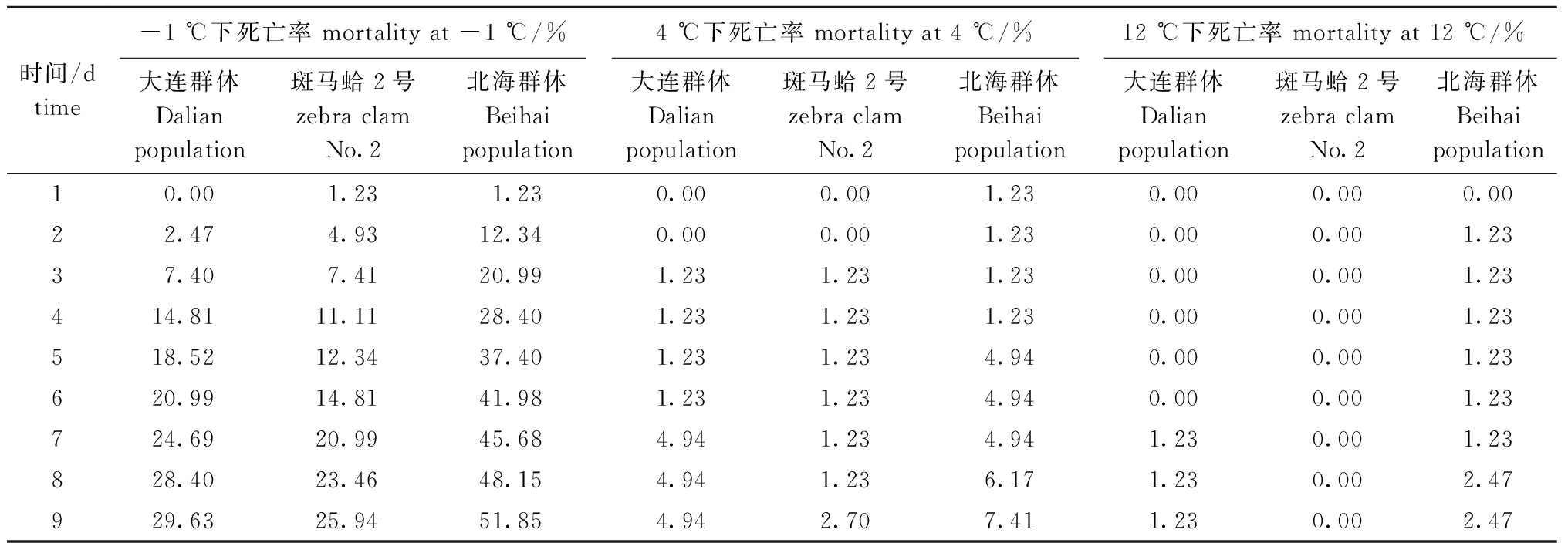
时间/dtime-1 ℃下死亡率 mortality at -1 ℃/%4 ℃下死亡率 mortality at 4 ℃/%12 ℃下死亡率 mortality at 12 ℃/%大连群体Dalian population斑马蛤2号zebra clam No.2北海群体Beihai population大连群体Dalian population斑马蛤2号zebra clam No.2北海群体Beihai population大连群体Dalian population斑马蛤2号zebra clam No.2北海群体Beihai population10.001.231.230.000.001.230.000.000.0022.474.9312.340.000.001.230.000.001.2337.407.4120.991.231.231.230.000.001.23414.8111.1128.401.231.231.230.000.001.23518.5212.3437.401.231.234.940.000.001.23620.9914.8141.981.231.234.940.000.001.23724.6920.9945.684.941.234.941.230.001.23828.4023.4648.154.941.236.171.230.002.47929.6325.9451.854.942.707.411.230.002.47
2.2 低温胁迫下3个群体蛤仔鳃组织中SCD基因的表达变化
为探究低温胁迫对不同群体蛤仔鳃组织SCD、FAD、ACC基因表达的影响,本研究中检测了-1 ℃低温胁迫下,3个群体在不同时间点鳃组织中3个基因mRNA的表达变化,以及不同温度下胁迫72 h时基因的表达水平。
从图1(a)可见:在-1 ℃低温胁迫下,不同时间点3个蛤仔群体鳃中SCD基因相对表达量较胁迫前(0 h)均显著升高(P<0.05);在12~72 h内,斑马蛤2号的SCD表达量显著高于其他2个群体(P<0.05)。从图1(b)可见:在4、-1 ℃低温胁迫下,3个蛤仔群体鳃组织中SCD表达水平较12 ℃时显著上升(P<0.05);4 ℃下,3个蛤仔群体的SCD表达水平无显著性差异(P>0.05);-1 ℃下,斑马蛤2号SCD表达水平显著高于其他2个群体(P<0.05)。
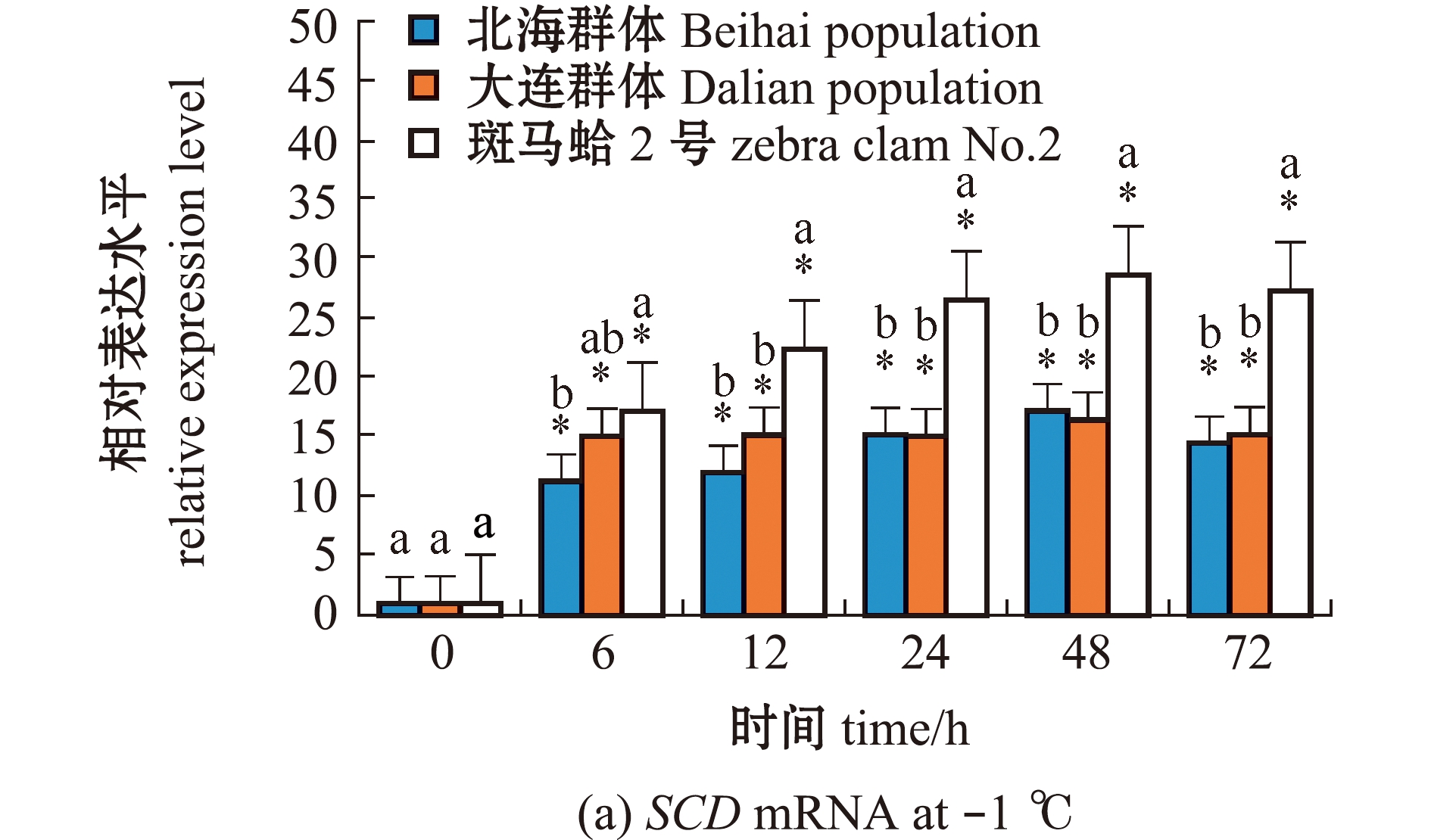
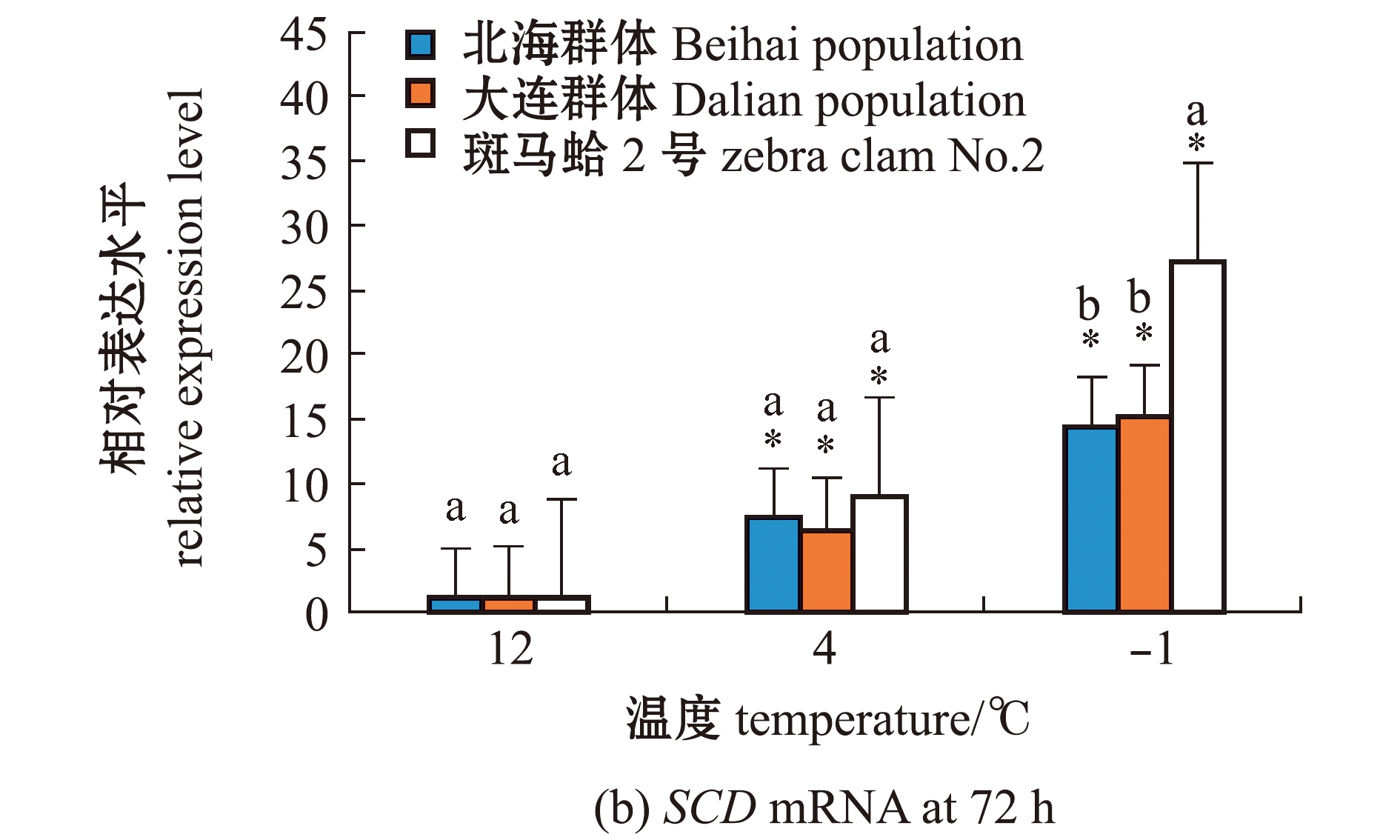
标有不同字母者表示同一时间下不同群体基因表达量间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05); *表示同一群体不同时间点(或不同低温点)基因表达量与0 h(或12 ℃)相比有显著性差异(P<0.05),下同。
The means with different letters in same time are significantly different in different population gene expression levels at the 0.05 probability level, and the means with the same letter are not significant differences; * indicates the significant difference in the expression levels in the same group at different time(or different low temperature) compared with 0 h (or 12 ℃)(P<0.05),et sequentia.
图1 低温胁迫下3个群体蛤仔鳃组织中SCD mRNA的表达变化
Fig.1 Changes in expression level of SCD mRNA in the gill of Manila clam in three populations exposed to low temperature stress
2.3 低温胁迫下3个群体蛤仔鳃组织中FAD基因的表达变化
从图2(a)可见:在-1 ℃低温胁迫下,不同时间点3个蛤仔群体鳃中FAD基因相对表达量较0 h均显著升高(P<0.05);3个蛤仔群体FAD表达量总体上呈先升高后降低的趋势;北海群体FAD表达量在 48 h时最高,是0 h的10.62倍,大连群体FAD表达量在12 h时最高,是0 h的14.22倍,斑马蛤2号FAD表达量在24 h时最高,是0 h的16.18倍。从图2(b)可见:在4、-1 ℃低温胁迫下,3个蛤仔群体FAD表达水平较12 ℃时显著上升(P<0.05);4 ℃下,北海群体FAD表达量显著高于大连群体(P<0.05);-1 ℃下,斑马蛤2号FAD表达量显著高于其他群体(P<0.05)。
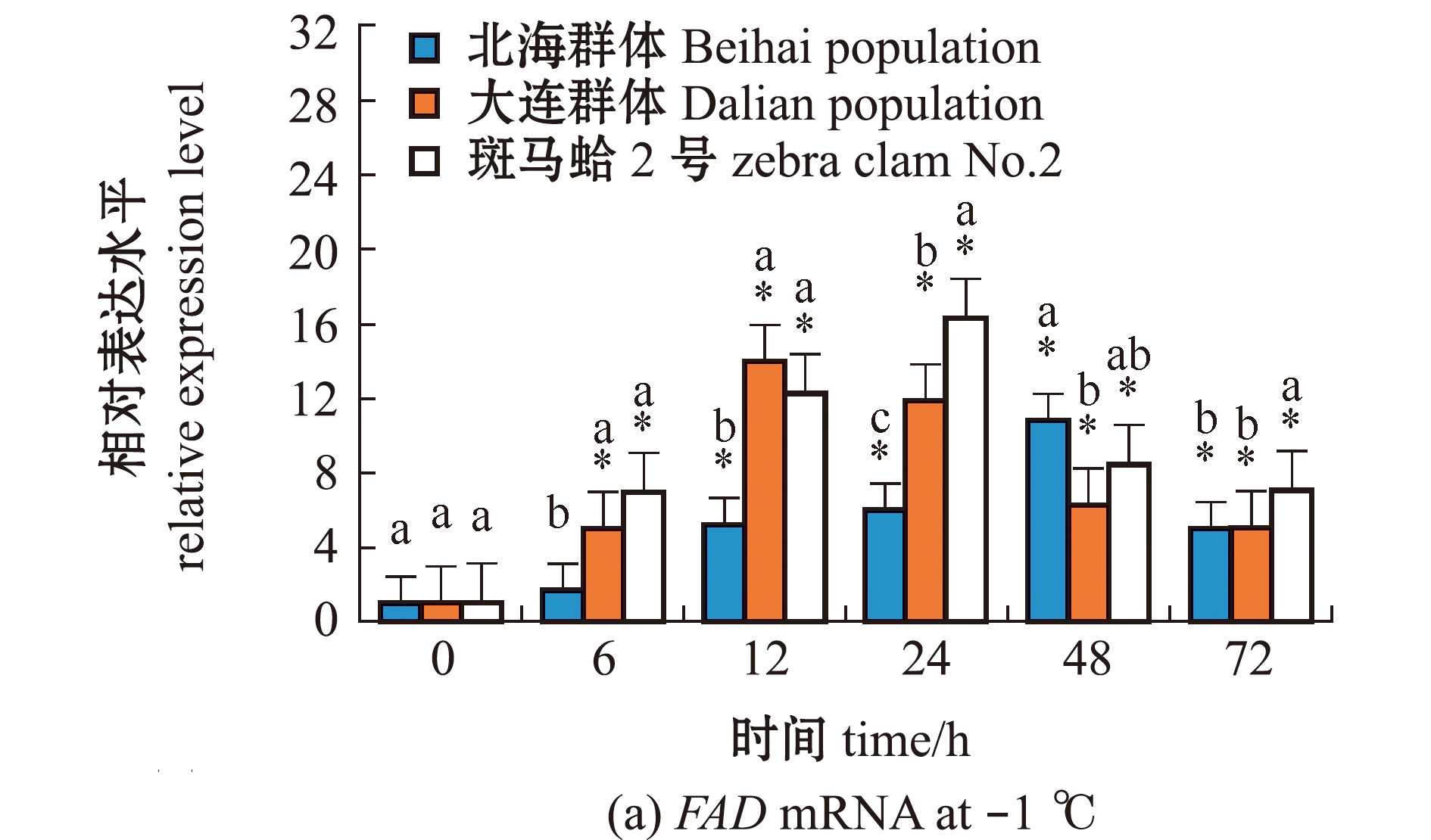
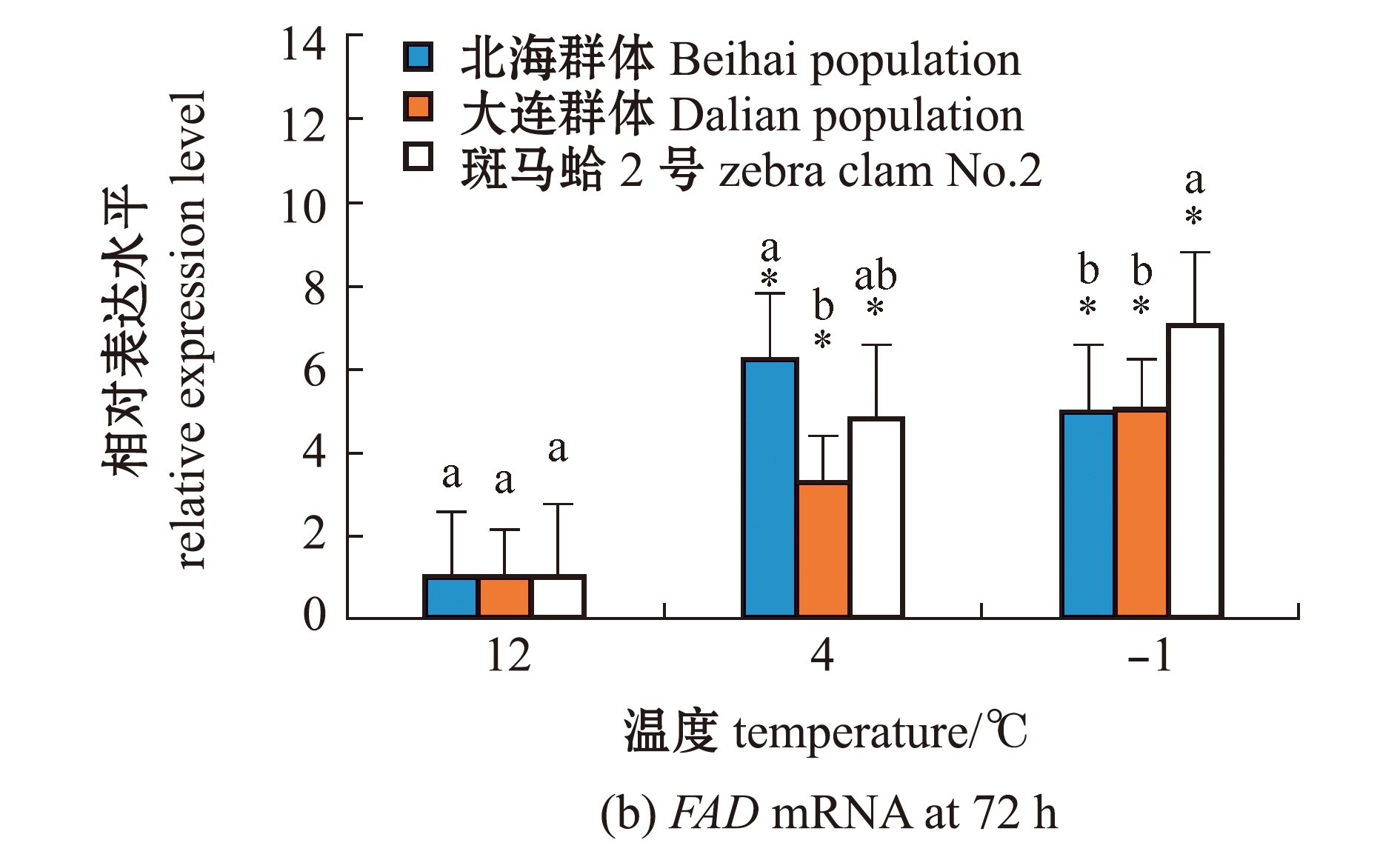
图2 低温胁迫下3个群体蛤仔鳃组织中FAD mRNA的表达变化
Fig.2 Changes in expression level of FAD mRNA in the gill of Manila clam in three populations exposed to low temperature stress
2.4 低温胁迫下3个群体蛤仔鳃组织中ACC基因的表达变化
从图3(a)可见:3个蛤仔群体鳃中ACC基因表达量总体上呈先升高后降低的趋势;在-1 ℃低温胁迫下,与0 h相比,北海群体蛤仔ACC表达量在24、48 h时显著上调(P<0.05);大连群体蛤仔ACC表达量在12 h时显著上调(P<0.05);斑马蛤2号ACC表达量在6~48 h时显著上调(P<0.05),且在6~24 h时显著高于其他2个群体(P<0.05)。从图3(b)可见:在-1 ℃低温胁迫下,3个蛤仔群体ACC表达水平较12 ℃时无显著性变化(P>0.05),3个群体间ACC表达量也无显著性差异(P>0.05);4 ℃下,北海群体和大连群体ACC表达水平较12 ℃时均显著上升(P<0.05),斑马蛤2号的ACC表达水平则无明显变化,且显著低于其他2个群体(P<0.05)。
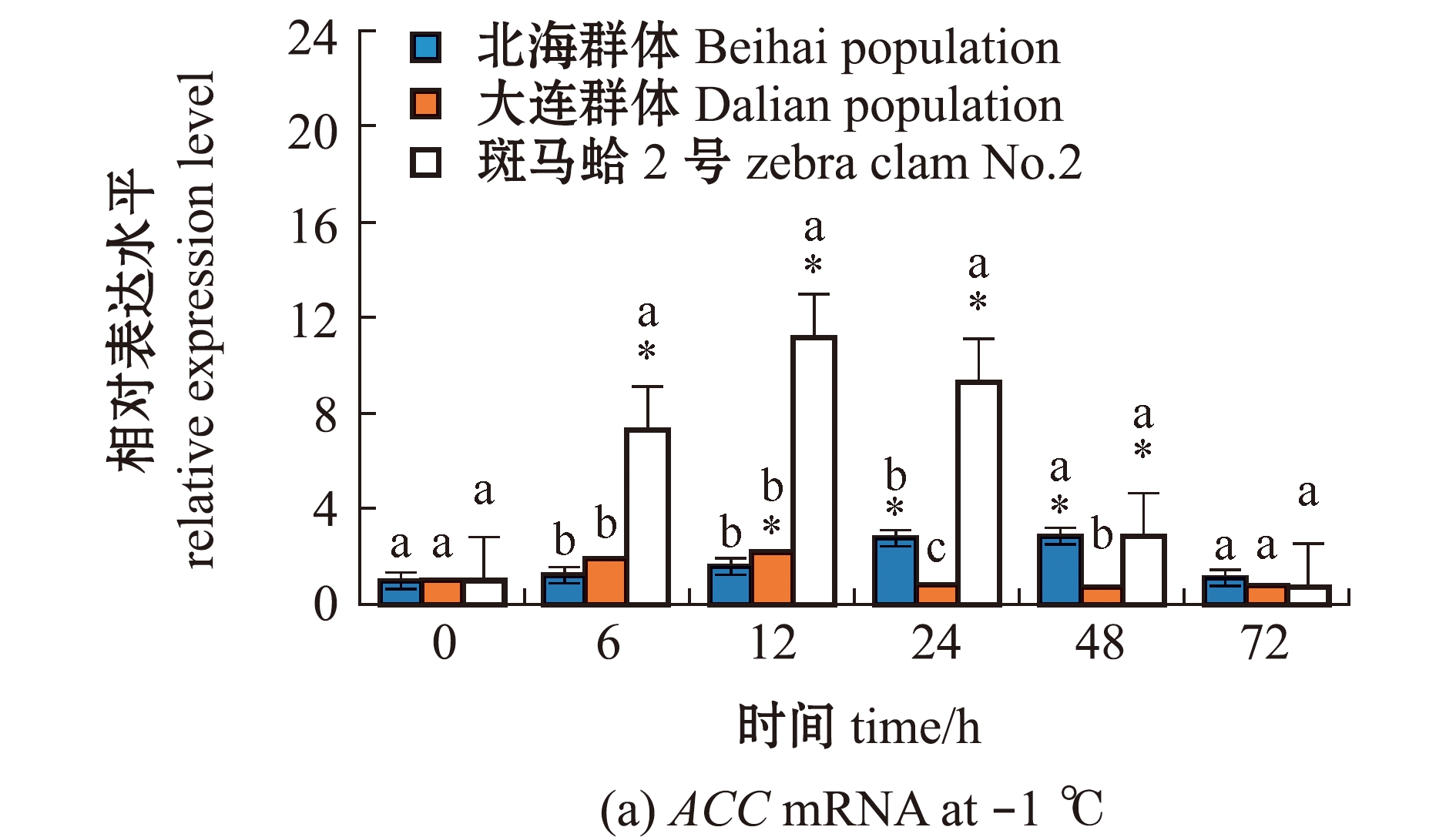
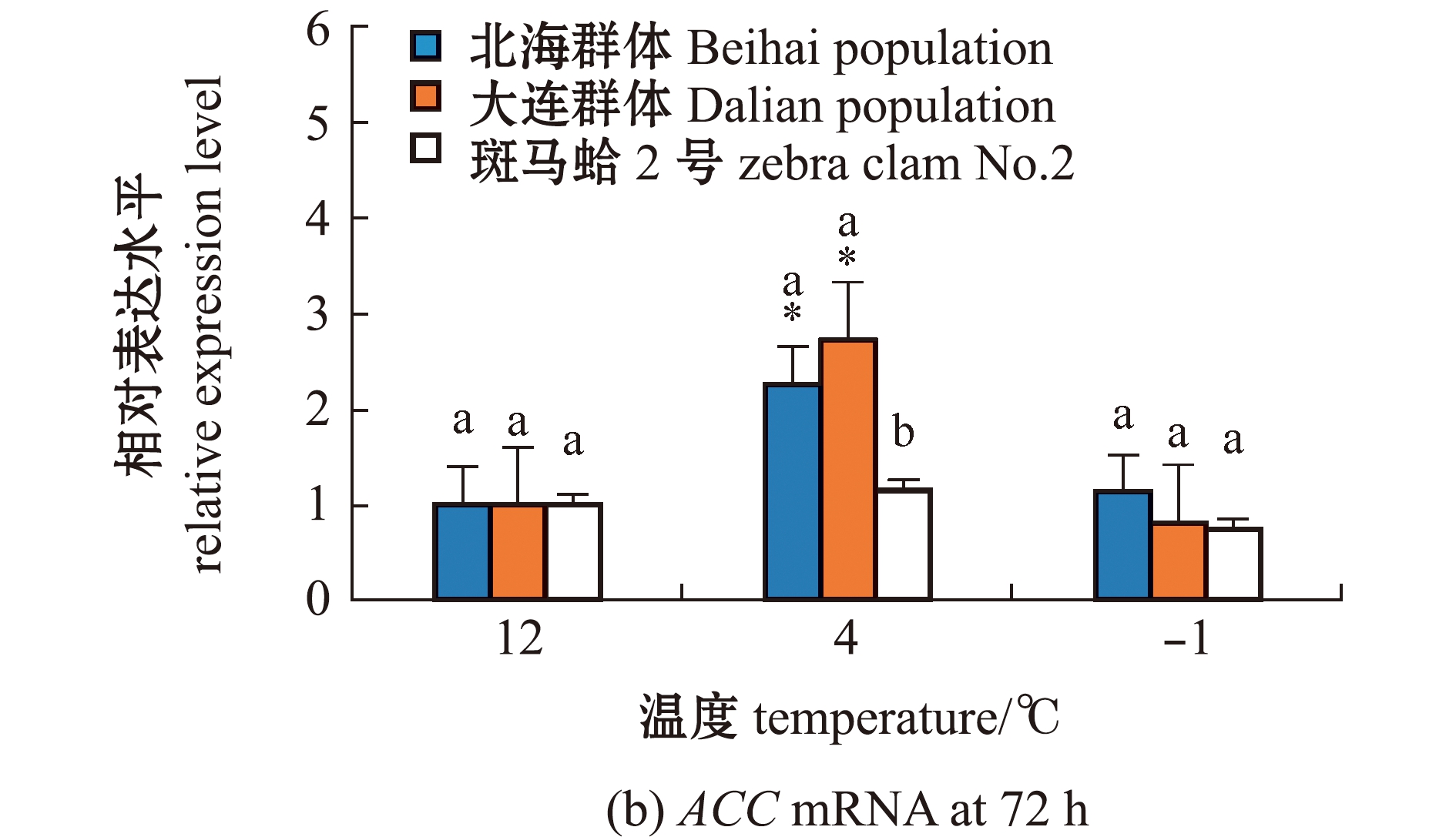
图3 低温胁迫下3个群体蛤仔鳃组织中ACC mRNA的表达变化
Fig.3 Changes in expression level of ACC mRNA in the gill of Manila clam in three populations exposed to low temperature stress
3 讨论
3.1 低温对蛤仔脂肪酸代谢相关基因表达的影响
温度能够影响贝类生理代谢[11]、酶活性[12-13]和存活[14-17]。温度不仅可以改变贝类体内酶的活性,影响贝类代谢,还可以通过改变贝类能量收支从而影响贝类存活。当温度变化超出贝类生存范围时,贝类生理代谢紊乱,细胞受到不可修复的损伤,进而导致贝类死亡。超出其最适温度范围的温度也会导致蛤仔死亡[18]。张永普等[19]和郑怀平等[20]研究指出,贝类体内的脂肪酸种类和含量受季节和水温等变化的影响显著,并且脂肪酸的种类和含量与贝类肉质的肥满度有着密切关系。
脂肪酸去饱和酶(FAD)是多不饱和脂肪酸合成途径中的关键酶之一,其催化脂肪酸酰基链特定位置C.C脱氢形成C![]() C[21]。除了少数微生物之外,几乎所有的生物体中都含有脂肪酸去饱和酶,其分布范围较广[22-23]。生物的膜脂中都含有一定种类的不饱和脂肪酸。在恒温动物和部分变温动物中,能通过对膜脂脱饱和来适应温度的降低,从而保护细胞活性。细胞改变膜脂主要通过脂肪酸去饱和酶的脱饱和作用来改变细胞膜的物理特性,因此,脂肪酸去饱和酶在生物体内参与生物膜的形成和改变其物理性质、调节膜脂中脂肪酸的形成等方面起重要的调节作用。硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase, SCD)是合成单不饱和脂肪酸的限速酶,是调节肝脏脂肪生成和脂类氧化的关键控制点[24]。动物通过脂肪酸合成酶和乙酰辅酶A羧化酶(ACC)两种胞质酶进行脂肪酸合成,随后在脂肪酸延长酶和脂肪酸去饱和酶的作用下对脂肪酸进行进一步延长和去饱和,进而获得拥有较长肽链的不饱和脂肪酸。脂肪酸合成代谢第一步反应的限速酶是由乙酰辅酶 A 羧化酶来催化。
C[21]。除了少数微生物之外,几乎所有的生物体中都含有脂肪酸去饱和酶,其分布范围较广[22-23]。生物的膜脂中都含有一定种类的不饱和脂肪酸。在恒温动物和部分变温动物中,能通过对膜脂脱饱和来适应温度的降低,从而保护细胞活性。细胞改变膜脂主要通过脂肪酸去饱和酶的脱饱和作用来改变细胞膜的物理特性,因此,脂肪酸去饱和酶在生物体内参与生物膜的形成和改变其物理性质、调节膜脂中脂肪酸的形成等方面起重要的调节作用。硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase, SCD)是合成单不饱和脂肪酸的限速酶,是调节肝脏脂肪生成和脂类氧化的关键控制点[24]。动物通过脂肪酸合成酶和乙酰辅酶A羧化酶(ACC)两种胞质酶进行脂肪酸合成,随后在脂肪酸延长酶和脂肪酸去饱和酶的作用下对脂肪酸进行进一步延长和去饱和,进而获得拥有较长肽链的不饱和脂肪酸。脂肪酸合成代谢第一步反应的限速酶是由乙酰辅酶 A 羧化酶来催化。
本研究表明,3个脂肪酸代谢相关基因在菲律宾蛤仔鳃组织中的表达与温度显著相关(P<0.05),在12、4和-1 ℃下,随着温度的降低,SCD、FAD和ACC基因上调,表达量总体呈升高趋势;在-1 ℃低温胁迫下,斑马蛤2号、大连群体和北海群体蛤仔鳃组织中SCD、FAD基因表达量均显著上调,斑马蛤2号(6~48 h)、大连群体(12 h)和北海群体(24~48 h)蛤仔ACC基因分别在不同时间点显著上调,但3个群体蛤仔的3个脂肪酸代谢相关基因表达的上调程度及时间点有所不同,其中,斑马蛤2号的3个基因上调幅度最大,而低温胁迫下的存活率试验表明,斑马蛤2号的存活率和耐低温能力明显高于大连群体和北海群体,这表明,蛤仔的耐低温能力可能与其SCD、FAD和ACC基因表达水平有关。杨东敏等[25]报道了越冬期后蛤仔不饱和脂肪酸含量显著上升,初步证明蛤仔体内脂肪酸组成及含量对其耐低温有重要作用。由此推测,蛤仔脂肪酸代谢相关基因可能在其适应低温过程中发挥重要作用[1-2]。
3.2 菲律宾蛤仔斑马蛤2号新品种的耐寒机制
脂肪酸合成酶系是由Wakil等[26]在1957年提出的。贝类属变温动物,低温会影响贝类各种生命活动,而脂肪酸在贝类的免疫应答过程、温度的适应性、生长发育和繁殖等生理过程中均起着关键的作用,所以研究贝类在低温胁迫下脂肪酸相关基因表达的变化,对于了解贝类的抗寒机制有重要的意义[27-29]。研究表明,扁玉螺Neverita didyma与泥蚶Tegillarca granosa软体部脂肪酸种类和含量受水温和季节影响[19-20]。Su等[30]研究发现,进入冬季时随温度降低,鲍n-3脂肪含量升高,饱和脂肪酸(SFA)含量下降,说明n-3脂肪酸对于维持细胞膜的流动性具有重要作用。杨东敏等[25]报道了蛤仔越冬期前后脂肪酸含量发生显著变化,在蛤仔体内共检测出18种脂肪酸,其中,C18∶0、C20∶4n-6、C22∶5n-6、C22∶5n-3在越冬期后含量均显著降低,C20∶5n-3(EPA)在越冬后期显著高于越冬前。本研究中,通过对低温下3个群体蛤仔鳃组织中FAD、ACC和SCD mRNA表达分析发现,在 -1 ℃胁迫下,斑马蛤2号的FAD(24、72 h)、SCD(12~72 h)和ACC(6~24 h)基因表达水平分别在不同时间点显著高于其他2个群体。而在 -1 ℃低温胁迫后,斑马蛤2号的死亡率明显低于大连群体和北海群体。由此推测,在低温胁迫下,菲律宾蛤仔斑马蛤2号可能通过提高FAD、SCD和ACC基因的表达,促进脂肪酸及不饱和脂肪酸合成,改变细胞膜UFA与SFA比值,维持细胞膜正常流动,从而具有更强的低温适应能力[31-32]。斑马蛤2号耐低温能力强的原因可能与抗逆、免疫及代谢等多方面因素有关,脂肪酸合成与代谢可能是原因之一[1,33-34]。作者推测,脂肪酸合成代谢过程相关基因的表达水平可能影响生物体的脂肪酸组合及含量的变化,从而影响斑马蛤2号的耐低温能力,但具体机制还有待进一步研究。
综上,本试验条件下,菲律宾蛤仔斑马蛤2号存活率明显高于大连群体和北海群体,脂肪酸代谢相关基因在菲律宾蛤仔应对低温胁迫过程中起重要作用。
4 结论
1)菲律宾蛤仔斑马蛤2号对低温的耐受能力强于大连群体和北海群体,说明斑马蛤2号具有较强的耐寒能力,这在北方蛤仔养殖产业中具有较大的生产潜力和较高的经济价值。
2)脂肪酸代谢相关基因的表达是菲律宾蛤仔应对低温环境的重要生存策略。脂肪酸代谢相关基因在斑马蛤2号中的高表达可能是斑马蛤具有出色耐寒能力的原因之一,这也证明脂肪酸在贝类对温度的适应过程中起着重要作用。本试验中对3个菲律宾蛤仔群体低温耐受能力的差异和分子机制的研究结果,对菲律宾蛤仔健康养殖和对贝类抗逆性相关研究具有参考意义。
[1] 董莎莎,聂鸿涛,闫喜武.贝类低温胁迫响应机制研究进展[J].大连海洋大学学报,2019,34(3):457-462.
DONG S S,NIE H T,YAN X W.Research progresses on mechanisms of cold stress responses in shellfish:a review[J].Journal of Dalian Ocean University,2019,34(3):457-462.(in Chinese)
[2] NIE H T,JIANG L W,HUO Z M,et al.Transcriptomic responses to low temperature stress in the Manila clam,Ruditapes philippinarum[J].Fish & Shellfish Immunology,2016,55:358-366.
[3] ZHANG Y,SUN J,MU H W,et al.Proteomic basis of stress responses in the gills of the Pacific oyster Crassostrea gigas[J].Journal of Proteome Research,2015,14(1):304-317.
[4] PLACE S P,O’DONNELL M J,HOFMANN G E.Gene expression in the intertidal mussel Mytilus californianus:physiological response to environmental factors on a biogeographic scale[J].Marine Ecology Progress Series,2008,356:1-14.
[5] DONG S,NIE H,LI D,et al.Molecular cloning and characterization of Y-box gene (Rpybx) from Manila clam and its expression analysis in different strains under low-temperature stress[J].Animal Genetics,2020,51(3):430-438.
[6] NIE H T,CHEN P,HUO Z M,et al.Effects of temperature and salinity on oxygen consumption and ammonia excretion in different colour strains of the Manila clam,Ruditapes philippinarum[J].Aquaculture Research,2017,48(6):2778-2786.
[7] 闫喜武,张国范.蛤仔育种学[M].北京:科学出版社,2018.
YAN X W,ZHANG G F.Manila clam breeding study[M].Beijing:Science Press,2018.(in Chinese)
[8] NIE H T,LIU L H,HUO Z M,et al.The HSP70 gene expression responses to thermal and salinity stress in wild and cultivated Manila clam Ruditapes philippinarum[J].Aquaculture,2017,470:149-156.
[9] LI D D,NIE H T,JAHAN K,et al.Expression analyses of C-type lectins (CTLs) in Manila clam under cold stress provide insights for its potential function in cold resistance of Ruditapes philippinarum[J].Comparative Biochemistry and Physiology Toxicology & Pharmacology:CBP,2020,230:108708.
[10] 马倩颖,杨凤,霍忠明,等.总氨态氮和pH对菲律宾蛤仔“斑马蛤2号”品系幼贝潜沙的影响[J].大连海洋大学学报,2021,36(2):289-294.
MA Q Y,YANG F,HUO Z M,et al.Effects of total ammonia nitrogen content and pH on burrowing of juvenile “zebra 2” strain of Manila clam Ruditapes philippinarum[J].Journal of Dalian Ocean University,2021,36(2):289-294.(in Chinese)
[11] GAGNAIRE B,FROUIN H,MOREAU K,et al.Effects of temperature and salinity on haemocyte activities of the Pacific oyster,Crassostrea gigas (Thunberg)[J].Fish & Shellfish Immunology,2006,20(4):536-547.
[12] BRAGA A C,CAMACHO C,MARQUES A,et al.Combined effects of warming and acidification on accumulation and elimination dynamics of paralytic shellfish toxins in mussels Mytilus galloprovincialis[J].Environmental Research,2018,164:647-654.
[13] WANG Q H,LIU Y,ZHENG Z,et al.Adaptive response of pearl oyster Pinctadafucata martensii to low water temperature stress[J].Fish & Shellfish Immunology,2018,78:310-315.
[14] TETTELBACH S T,RHODES E W.Combined effects of temperature and salinity on embryos and larvae of the northern bay scallop Argopecten irradians irradians[J].Marine Biology,1981,63(3):249-256.
[15] 李世英,鲁男,蒋双,等.温度、盐度对滑顶薄壳鸟蛤面盘幼虫存活和生长的影响[J].大连水产学院学报,1999,14(2):66-69.
LI S Y,LU N,JIANG S,et al.Effect of temperature and salintty on survival and growth of the veliger of head clam (Fulvia mutica Reeve)[J].Journal of Dalian Fisheries University,1999,14(2):66-69.(in Chinese)
[16] 王丹丽,徐善良,尤仲杰,等.温度和盐度对青蛤孵化及幼虫、稚贝存活与生长变态的影响[J].水生生物学报,2005,29(5):495-501.
WANG D L,XU S L,YOU Z J,et al.The effects of temperature and salinity on the incubation of Cyclina sinensis and survival,growth and metamorphosis of C.sinensis larvae and juveniles[J].Acta Hydrobiologica Sinica,2005,29(5):495-501.(in Chinese)
[17] 桑士田,闫喜武,杨鹏,等.菲律宾蛤仔稚贝最适生长环境条件的响应面法分析[J].水产学报,2012,36(9):1410-1417.
SANG S T,YAN X W,YANG P,et al.Response surface methodology for optimization of growth condition in juvenile Ruditapes philippinarum[J].Journal of Fisheries of China,2012,36(9):1410-1417.(in Chinese)
[18] 马绍赛,周诗赉,陈聚法,等.滩涂养殖菲律宾蛤仔死亡及生态环境效应调查研究[J].海洋水产研究,1997,18(2):1-8.
MA S S,ZHOU S L,CHEN J F,et al.On the death of the short-necked clam(Ruditapes philippinarum Adams et Reeve) in the intertide zone and ecologic environment effect[J].Marine Fisherries Reseach,1997,18(2):1-8.(in Chinese)
[19] 张永普,应雪萍,贾守菊.泥蚶肥满度、含水量和生化成分的周年变化[J].河南科学,2004,22(1):57-59.
ZHANG Y P,YING X P,JIA S J.Yearlong changes of the meat condition index,water contents,and biochemical compositions of blood clam (Tegillarca granosa)[J].Henan Science,2004,22(1):57-59.(in Chinese)
[20] 郑怀平,高健.扁玉螺蛋白质、脂肪含量的季节变化[J].海洋科学,2002,26(4):52-55.
ZHENG H P,GAO J.Seasonal changes of protein and fat of Nevertia didyma[J].Marine Sciences,2002,26(4):52-55.(in Chinese)
[21] ALONSO D L,GARC A-MAROTO F,RODR
A-MAROTO F,RODR GUEZ-RUIZ J,et al.Evolution of the membrane-bound fatty acid desaturases[J].Biochemical Systematics and Ecology,2003,31(10):1111-1124.
GUEZ-RUIZ J,et al.Evolution of the membrane-bound fatty acid desaturases[J].Biochemical Systematics and Ecology,2003,31(10):1111-1124.
[22] LOS D A,MURATA N.Structure and expression of fatty acid desaturases[J].Biochimica et Biophysica Acta (BBA)-Lipids and Lipid Metabolism,1998,1394(1):3-15.
[23] Stumpf P K.Biosynthesis of saturated and unsaturated fatty acid[J]. Biochemistry of Plants,1980,4:177-204.
[24] 张蕊,张宜辉,邵丹,等.硬脂酰辅酶A去饱和酶基因的功能与调控[J].生命科学,2013,25(4):378-382.
ZHANG R,ZHANG Y H,SHAO D,et al.The function and regulation of stearoyl-CoA desaturase gene[J].Chinese Bulletin of Life Sciences,2013,25(4):378-382.(in Chinese)
[25] 杨东敏,王化敏,丁鉴锋,等.越冬期前后菲律宾蛤仔体成分变化研究[J].大连海洋大学学报,2017,32(6):694-699.
YANG D M,WANG H M,DING J F,et al.Changes in biochemical composition of Manila clam Ruditapes philippinarum before and after overwintering[J].Journal of Dalian Ocean University,2017,32(6):694-699.(in Chinese)
[26] WAKIL S J,PORTER J W,GIBSON D M.Studies on the mechanism of fatty acid synthesisⅠ.Preparation and purification of an enzymes system for reconstruction of fatty acid synthesis[J].Biochimica et Biophysica Acta,1957,24(3):453-461.
[27] 时少坤.环境因子对贝类几种免疫因子影响的研究[D].上海:上海海洋大学,2013.
SHI S K.Studies on the immune parameters of mollusc stimulated by environmental factors[D].Shanghai:Shanghai Ocean University,2013.(in Chinese)
[28] 韩洪波,王忠良,陈刚,等.卵形鲳鲹耐低温候选基因△6FAD全长cDNA序列的克隆与表达分析[J].生物技术通报,2015,31(7):115-123.
HAN H B,WANG Z L,CHEN G,et al.Cloning and expression analysis of full-length cDNA sequence of a low temperature resistant candidate gene △6FAD in Trachinotus ovatus[J].Biotechnology Bulletin,2015,31(7):115-123.(in Chinese)
[29] 刘文广,李琪,高凤祥,等.长牡蛎繁殖周期、生化成分的季节变化与环境因子的关系[J].热带海洋学报,2011,30(3):88-93.
LIU W G,LI Q,GAO F X,et al.Seasonal variation in reproductive cycle and biochemical composition in relation to environmental factors in the Pacific oyster Crassostrea gigas[J].Journal of Tropical Oceanography,2011,30(3):88-93.(in Chinese)
[30] SU X Q,ANTONAS K,LI D,et al. Seasonal variations of total lipid and fatty acid contents in the muscle of two Australian farmed abalone species[J].Journal of Food Lipids, 2006,13(4):411-423.
[31] BELL M V,TOCHER D R.Biosynthesis of polyunsaturated fatty acids in aquatic ecosystems:general pathways and new directions[J].Lipids in Aquatic Ecosystems,2009,334(12):75-85.
[32] MOHD-YUSOF N Y,MONROIG O,MOHD-ADNAN A,et al.Investigation of highly unsaturated fatty acid metabolism in the Asian sea bass,Lates calcarifer[J].Fish Physiology and Biochemistry,2010,36(4):827-843.
[33] DONG S,NIE H,YE J,et al.Physiological and gene expression analysis of the Manila clam Ruditapes philippinarum in response to cold acclimation[J].Science of the Total Environment,2020,742:140427.
[34] JAHAN K,NIE H,YIN Z,et al.Comparative transcriptome analysis to reveal the genes and pathways associated with adaptation strategies in two different populations of Manila clam (Ruditapes philippinarum) under acute temperature challenge[J].Aquaculture,2022,552:737999.