厚壳贻贝Mytilus coruscus是中国重要的海水养殖贝类之一,分布于黄海、渤海和东海沿岸海域。厚壳贻贝个体肥大、味道鲜美,且富含人体所必需的氨基酸、微量元素和矿物质,深受广大消费者和养殖业者的喜爱[1-2]。营浮游生活的厚壳贻贝幼虫发育到眼点阶段后会附着变态为稚贝,开始营附着生活[3-4]。幼虫附着变态率低会造成苗种数量不足、质量不佳等问题,直接影响厚壳贻贝人工养殖产业的发展和经济效益的提升。通过细菌生物被膜定向附着技术可显著提高厚壳贻贝幼虫的附着变态率,从而改善养殖产业中的苗种繁育问题[5-6]。
在海洋环境中,细菌主要以生物被膜形式存在。细菌在形成生物被膜过程中产生的胞外多聚物是其影响幼虫附着变态的因素之一。在大多数生物被膜中,胞外多聚物的生物量比细菌含量高,其中多糖占大部分[7-8]。细菌生物被膜的胞外多糖种类繁多,主要包括藻酸盐、纤维素和可拉酸等[9]。研究发现,细菌藻酸盐作为一种胞外多糖物质,参与多种细菌生物被膜的形成和结构功能的发挥。陈菲等[10]发现,百花丹素通过调节大肠埃希菌10389(E.coli 10389)中rpoE和rseA基因的表达量,影响藻酸盐的正常合成量,进而影响生物被膜的形成。本团队前期研究发现,在生物被膜形成过程中,外源性添加纤维素会抑制生物被膜的形成及厚壳贻贝幼虫的附着变态[11];而添加脂多糖则会促进生物被膜的形成及厚壳贻贝幼虫的附着[12]。由此可见,添加不同种类的细菌生物被膜胞外多糖物质对生物被膜形成及厚壳贻贝附着具有不同的效果。
藻酸盐根据来源不同,可分为藻类来源的海藻藻酸盐和细菌来源的细菌藻酸盐。这两种藻酸盐具有相同的基本结构,均是由β-D-甘露糖醛酸(β-D-mannuronic acid)和α-L-古洛糖醛酸(α-L-guluronic acid)两种单糖成分构成,不同的是细菌藻酸盐中C2或C3上的羟基常常发生不同程度的乙酰化[13]。市场上在售的藻酸盐多为从大型藻类中提取的杂多糖。细菌藻酸盐对生物被膜形成有一定作用,但来源于大型藻类且结构相似的海藻藻酸盐是否对海洋细菌生物被膜的形成产生影响尚不可知。本研究中,从生物被膜的细菌密度、膜厚和胞外产物等生物学特性角度,首次探讨了在海假交替单胞菌Pseudoalteromonas marina生物被膜形成过程中添加海藻藻酸盐对生物被膜形成及厚壳贻贝幼虫附着变态的影响,以期为进一步研究生物被膜定向诱导海洋贝类的附着变态机制提供基础数据,也为利用生物被膜提高贻贝育苗成功率提供科学参考。
1 材料与方法
1.1 材料
试验用厚壳贻贝幼虫于2021年5月取自浙江省舟山市嵊泗县(30°72′N、122°77′E),均为眼点时期的厚壳贻贝幼虫,运回上海海洋大学贝类分子实验室后,在水温18 ℃、盐度30的海水中避光充气培养,养殖密度为1.0×104 cells/L,每日投喂湛江等鞭金藻Isochrysis zhanjiangensis,每2 d换水一次。暂养一周后随机取样,用肾上腺素(EPI)进行幼虫变态检验,若幼虫附着变态后的稚贝率达到标准,则进行后续试验。
1.2 方法
1.2.1 菌株和生物被膜制备 试验用菌种均为海洋细菌P.marina,分离于自然生物被膜,置于-80 ℃超低温冰箱中保存。采用梯度稀释和平板划线法分离纯化,得到纯种单菌落用于后续试验。
参照杨金龙等[14-15]的方法,取保存的菌种于ZoBell2216平板划线后,挑取单菌落于液体培养基中扩大培养,用灭菌过滤海水(autoclaved filtered seawater,AFSW)重复清洗菌体3次,直至上清液呈现清澈状态,加入AFSW均匀混合至细菌悬浮,取混合菌液稀释100倍后进行细菌密度计数,根据计数结果确定需要添加的菌液和AFSW体积。
1.2.2 P.marina与海藻藻酸盐共同形成生物被膜的制备 称取1 g从大型藻中提取的海藻藻酸盐(以下简称藻酸盐)标准品[默克生命科学(上海)有限公司],用500 mL AFSW溶解后调pH至7.6,制成母液待用。参照杨金龙等[15]的方法,计算20 mL体系需要添加的细菌悬浮液、藻酸盐母液和AFSW,细菌终浓度为5.0×108 cells/mL,藻酸盐终质量浓度为0、0.1、0.5、1.0、1.5、2.0 mg/L,以灭菌后的玻片为载体,放入无菌玻璃培养皿中,加入上述相应体积海水与藻酸盐标准品溶液,18 ℃下避光培养48 h。
1.2.3 幼虫附着变态试验 制备不同质量浓度藻酸盐与P.marina的共同生物被膜,每个浓度设置9个平行。用AFSW轻轻润洗附有生物被膜的玻片,再置于装有20 mL AFSW的无菌玻璃培养皿中,加入20只眼点幼虫,18 ℃下避光培养,记录12、24、48、96 h 时幼虫附着变态个体数,变态个体数占眼点幼虫的比例即为变态率[16]。
1.2.4 生物被膜细菌密度计数 制备不同质量浓度藻酸盐与P.marina的共同生物被膜,每个浓度设置3个平行。参照杨金龙等[15]方法,使用体积分数为5%的福尔马林溶液固定生物被膜24 h后,再用体积分数为0.1%的吖啶橙染色5 min,晾干后在荧光显微镜(Olympus BX51,1 000放大倍率)下随机挑选10个均匀视野计数。
1.2.5 生物被膜细菌胞外产物染色及生物量的测定 制备0、0.5 mg/L藻酸盐与P.marina的共同生物被膜。参照Gonz lez-machado等[17]的染色方法,具体染料见表1。将生物被膜用质量分数为0.9%的生理盐水清洗后,添加相应染料,避光染色20 min,再用生理盐水去除染料,避光晾干后制片。在激光扫描共聚焦显微镜CLSM(Leica TCS SP8,德国)(63倍镜)下,以单色激光作为光源,通过LASX软件(1 024×1 024像素、单位厚度0.20 μm)逐层扫描生物被膜,每个视野获得多张图片,采集得到的图片使用Image J软件计算阈值(美国国立卫生研究院),再将阈值转换为生物量(μm3),生物量即为生物被膜胞外产物的含量。每种染料设置3个生物学重复,每个生物被膜随机选择3个视野。用于膜厚拍摄的生物被膜需要提前置入体积分数为5%的福尔马林中固定0.5 h。
lez-machado等[17]的染色方法,具体染料见表1。将生物被膜用质量分数为0.9%的生理盐水清洗后,添加相应染料,避光染色20 min,再用生理盐水去除染料,避光晾干后制片。在激光扫描共聚焦显微镜CLSM(Leica TCS SP8,德国)(63倍镜)下,以单色激光作为光源,通过LASX软件(1 024×1 024像素、单位厚度0.20 μm)逐层扫描生物被膜,每个视野获得多张图片,采集得到的图片使用Image J软件计算阈值(美国国立卫生研究院),再将阈值转换为生物量(μm3),生物量即为生物被膜胞外产物的含量。每种染料设置3个生物学重复,每个生物被膜随机选择3个视野。用于膜厚拍摄的生物被膜需要提前置入体积分数为5%的福尔马林中固定0.5 h。
表1 试验用激光共聚焦荧光染料
Tab.1 Laser confocal microscopy fluorescence dye in this study
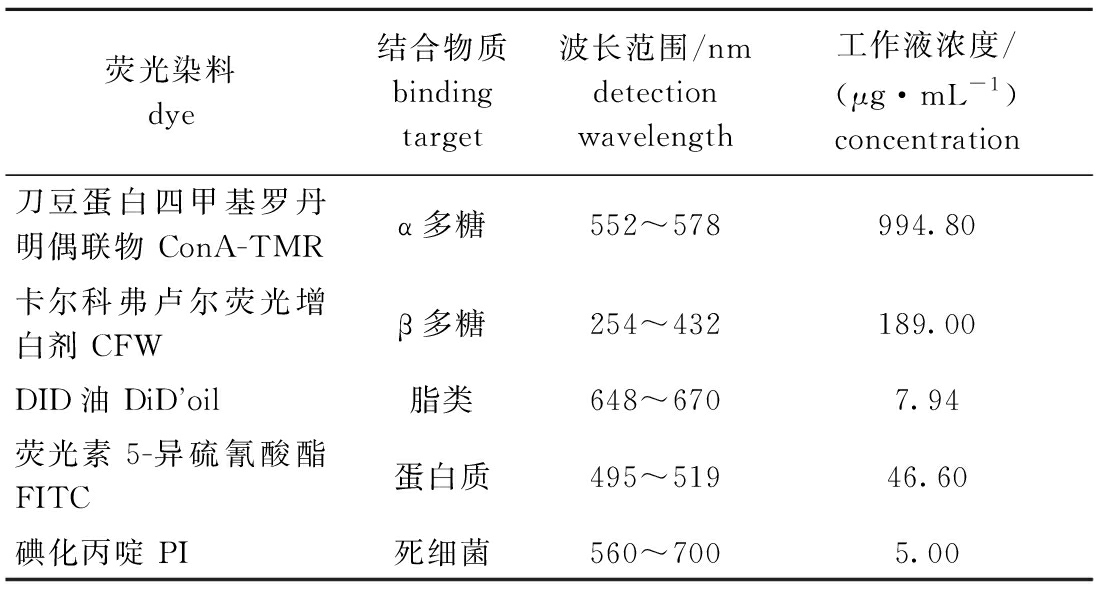
荧光染料dye结合物质binding target波长范围/nmdetection wavelength工作液浓度/(μg·mL-1)concentration刀豆蛋白四甲基罗丹明偶联物 ConA-TMRα多糖552~578994.80卡尔科弗卢尔荧光增白剂 CFWβ多糖254~432189.00DID油 DiDoil脂类648~6707.94荧光素5-异硫氰酸酯 FITC蛋白质495~51946.60碘化丙啶 PI死细菌560~7005.00
1.2.6 可拉酸定量 可拉酸定量参考Obadia等[18]的方法。制备0、0.5 mg/L藻酸盐与P.marina的共同生物被膜,试验共设4组,每组从12个生物被膜中收集细菌细胞悬浮于1 mL蒸馏水中,100 ℃下煮沸10 min,以13 000 g离心15 min后,丢弃细菌细胞,收集上清液。向1 mL上清液中加入4.5 mL H2SO4和H2O的混合溶液(二者体积比为6∶1),混合物在100 ℃下反应20 min。冷却至 25 ℃后,取2 mL混合物用于检测396、427 nm处的吸光度(分别记为A396 nm、A427 nm)。将100 μL 质量分数为3%的半胱氨酸盐酸盐溶液与剩下的混合物在25 ℃下避光孵育1 h后,在396、427 nm处测定吸光度(分别记为![]() 将
将![]() 的值,代入L-岩藻糖浓度标准曲线方程,计算可拉酸的含量。
的值,代入L-岩藻糖浓度标准曲线方程,计算可拉酸的含量。
1.3 数据处理
CLSM图像经Image J软件处理后再计算体积,稚贝率、细菌密度、胞外产物生物量和可拉酸含量均用Prism作图。试验结果采用JMP10.0.0软件进行统计分析和相关性检验,显著性水平设为0.05。
2 结果与分析
2.1 藻酸盐对P.marina生物被膜诱导厚壳贻贝幼虫附着变态的影响
对12、24、48、96 h幼虫附着变态观察发现,48 h已全部完成变态,故本研究中统计了48 h的幼虫变态情况。从图1可见:当藻酸盐质量浓度为0.1 mg/L时,藻酸盐与P.marina共同形成生物被膜诱导的稚贝率与单一细菌生物被膜相比无显著性差异(P>0.05);当藻酸盐质量浓度≥0.5 mg/L时,共同形成生物被膜对幼虫附着变态有诱导作用(P<0.05),但各浓度间无显著性差异(P>0.05)。
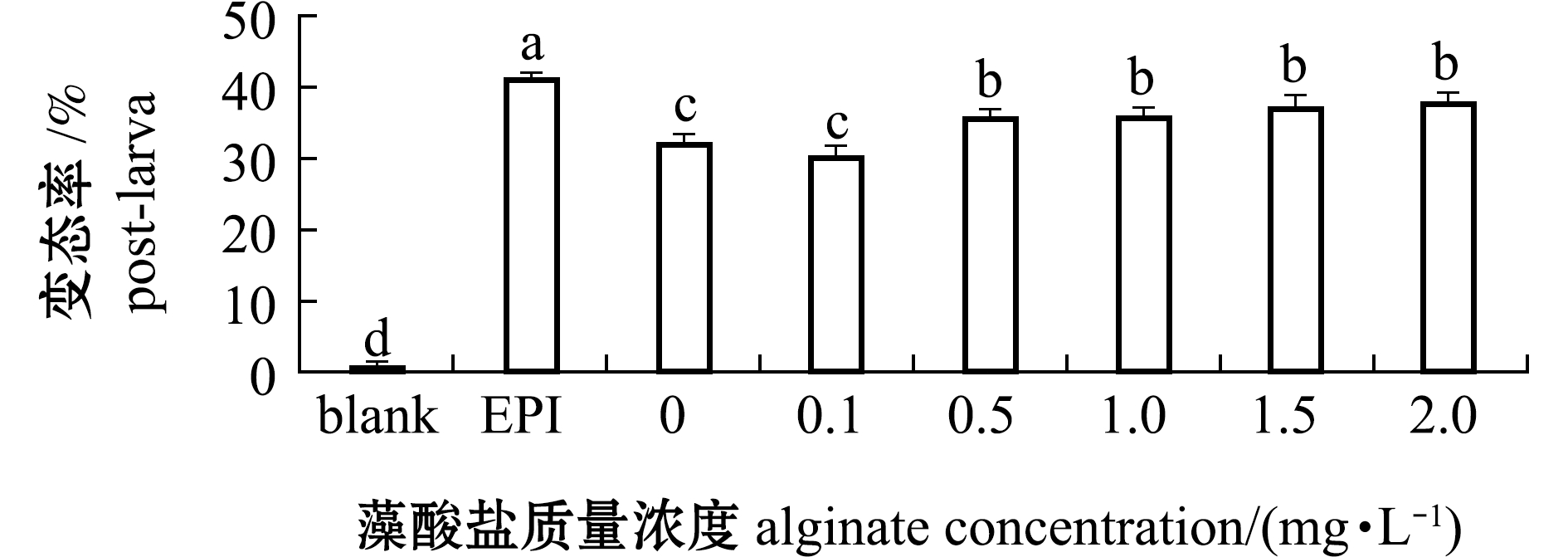
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.
图1 藻酸盐与P.marina共同形成生物被膜对厚壳贻贝幼虫附着变态的影响
Fig.1 Effects of P.marina biofilms formed with alginate on larval settlement and metamorphosis of mussel Mytilus coruscus
2.2 藻酸盐对P.marina生物被膜细菌密度的影响
从图2可见:添加不同质浓度藻酸盐共同形成的生物被膜的细菌密度较单一细菌生物被膜显著升高(P<0.05);生物被膜细菌密度随藻酸盐浓度的增加而增加;当藻酸盐质量浓度为1.5 mg/L时,生物被膜的细菌密度达到最高值,之后无显著变化。
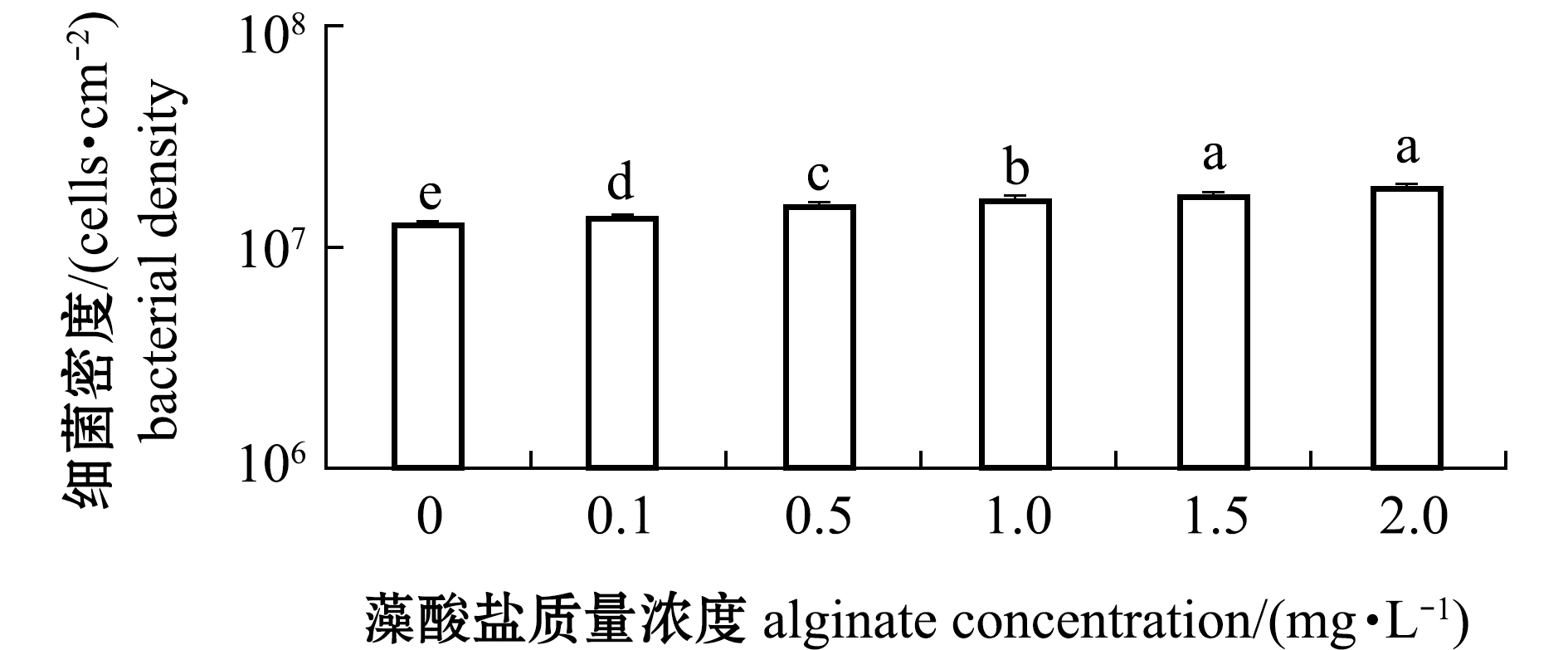
图2 藻酸盐与P.marina共同形成生物被膜的细菌密度变化
Fig.2 Change in the density of P.marina biofilms formed with alginate
2.3 藻酸盐对P.marina生物被膜细菌分布和膜厚的影响
从图3可见,添加质量浓度为0.5 mg/L的藻酸盐溶液共同形成细菌生物被膜的膜厚(6.44 μm±0.09 μm)较单一细菌生物被膜的膜厚(5.36 μm±0.08 μm)增加20.15%,膜厚间有显著性差异(P<0.05),且细菌聚集程度更高。
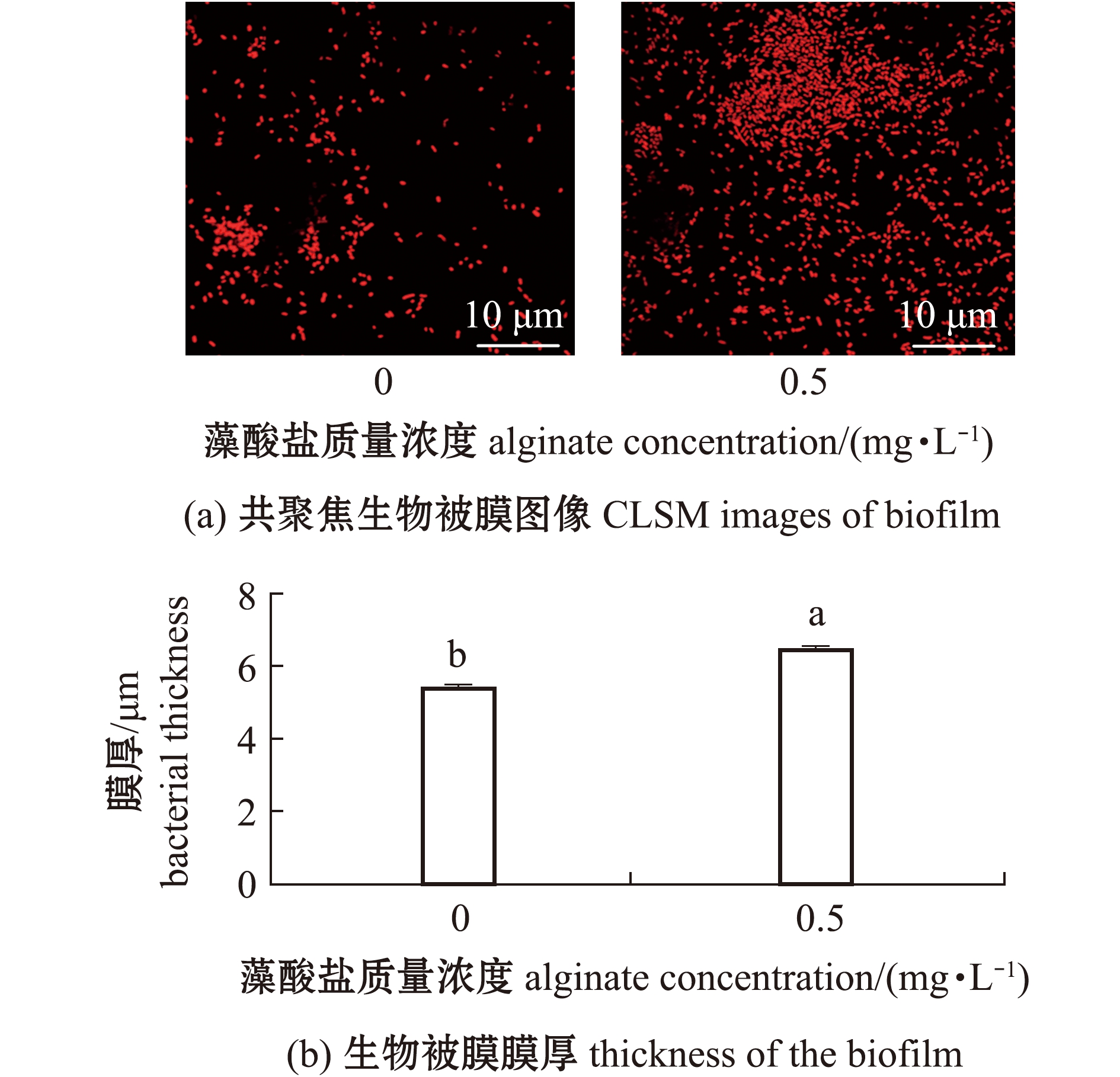
图3 藻酸盐对P.marina生物被膜形态与膜厚的影响
Fig.3 Effects of alginate on images and thickness of P.marina biofilms
2.4 藻酸盐对P.marina生物被膜胞外多糖的影响
在形成生物被膜的过程中,添加质量浓度为0.5 mg/L的藻酸盐溶液时,生物被膜上α多糖和β多糖含量明显增加,聚集程度更高(图4(a、c))。比较生物量发现,添加藻酸盐后形成生物被膜的胞外α多糖和β多糖是单一细菌生物被膜的1.26倍和1.19倍(P<0.05)(图4(b、d))。
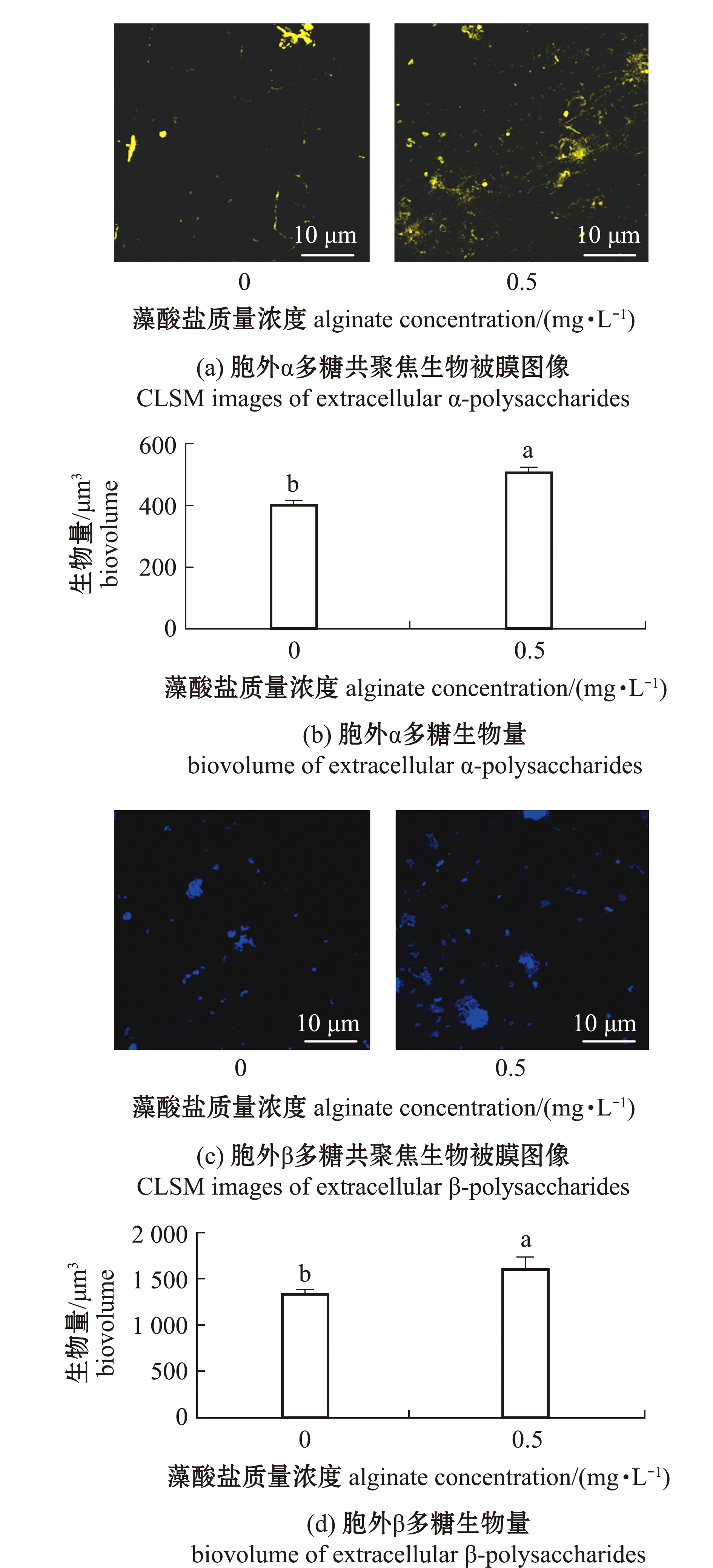
图4 藻酸盐与P.marina共同形成生物被膜的胞外多糖形态和生物量
Fig.4 Images and biovolume of extracellular polysaccharides of P.marina biofilms formed with alginate
2.5 藻酸盐对P.marina生物被膜胞外蛋白的影响
添加质量浓度为0.5 mg/L藻酸盐溶液共同形成生物被膜的胞外蛋白分布均匀(图5(a)),与单一生物被膜的胞外蛋白含量无显著性差异(P>0.05)(图5(b))。
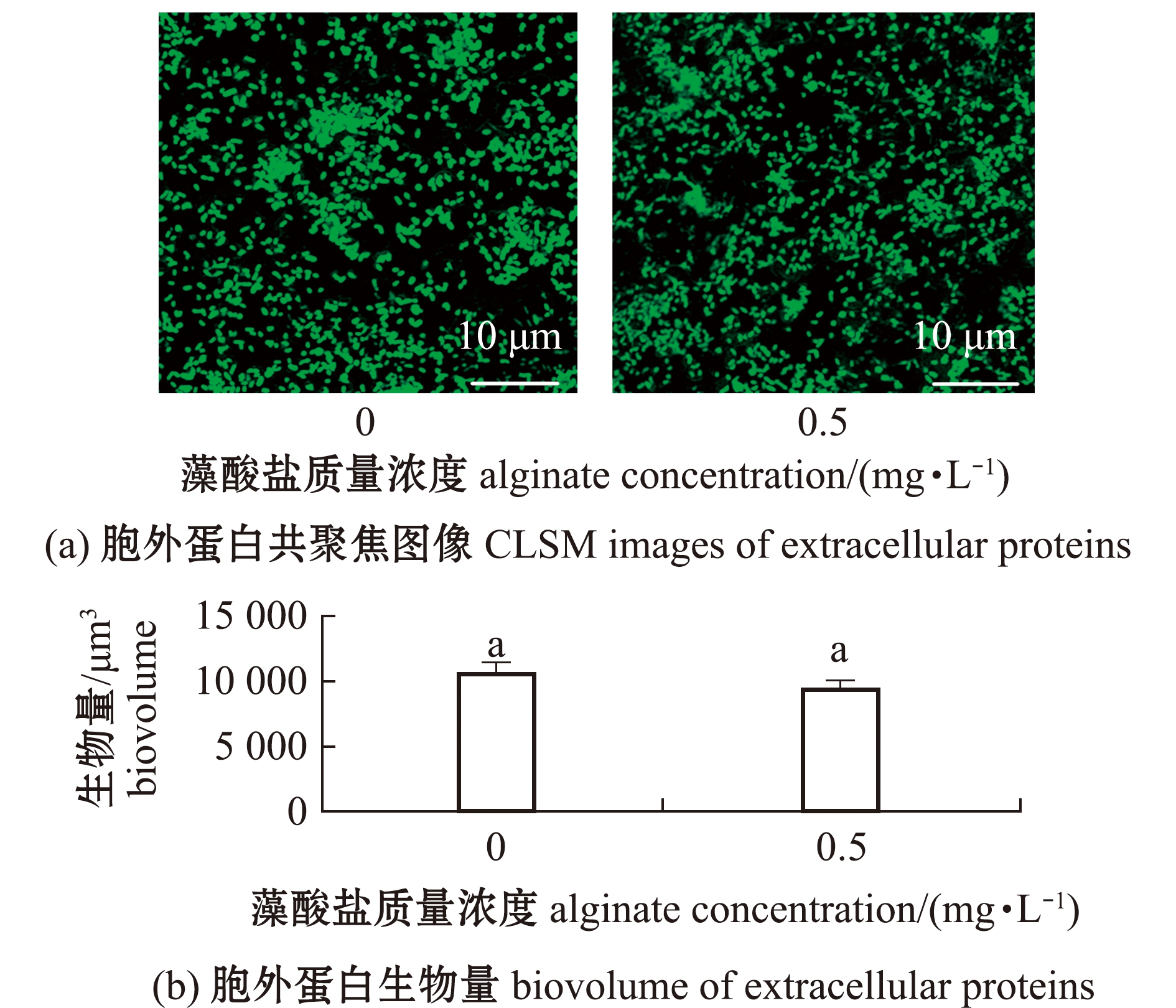
图5 藻酸盐与P.marina共同形成生物被膜的胞外蛋白形态和生物量
Fig.5 Images and biovolume of extracellular proteins of P.marina biofilms formed with alginate
2.6 藻酸盐对P.marina生物被膜胞外脂类的影响
添加质量浓度为0.5 mg/L藻酸盐溶液共同形成生物被膜的胞外脂呈颗粒状分散分布(图6(a)),与单一生物被膜胞的胞外脂含量无显著性差异(P>0.05)(图6(b))。
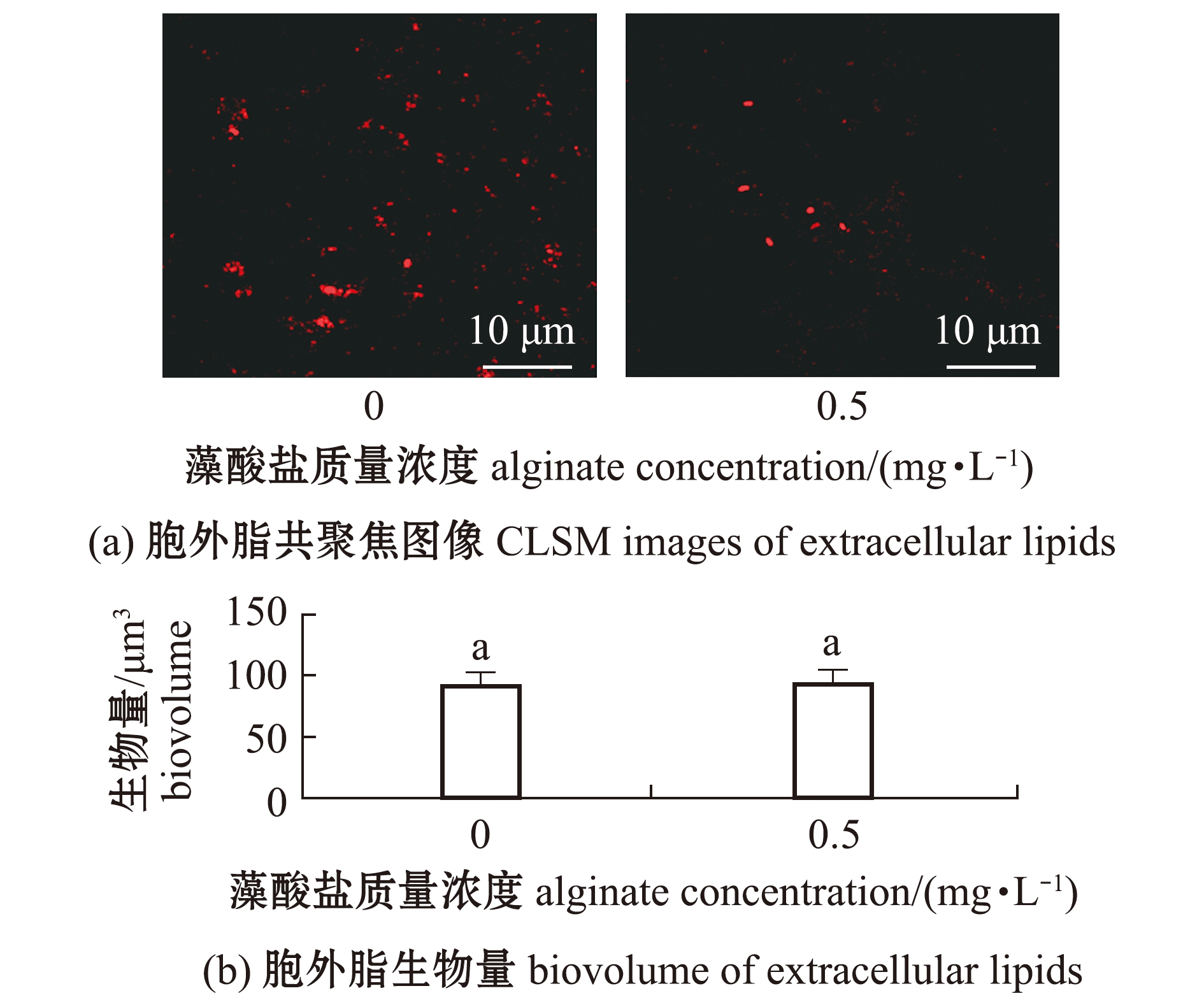
图6 藻酸盐与P.marina共同形成生物被膜的胞外脂形态和生物量
Fig.6 Images and biovolume of extracellular lipids of P.marina biofilms formed with alginate
2.7 藻酸盐对P.marina生物被膜可拉酸的影响
经过0.5 mg/L藻酸盐处理的生物被膜有更高含量的可拉酸 (225.16 μg/mL±14.16 μg/mL),较单一细菌生物被膜的可拉酸含量(151.40 μg/mL±16.16 μg/mL)增加了48.72%(P<0.05)(图7)。
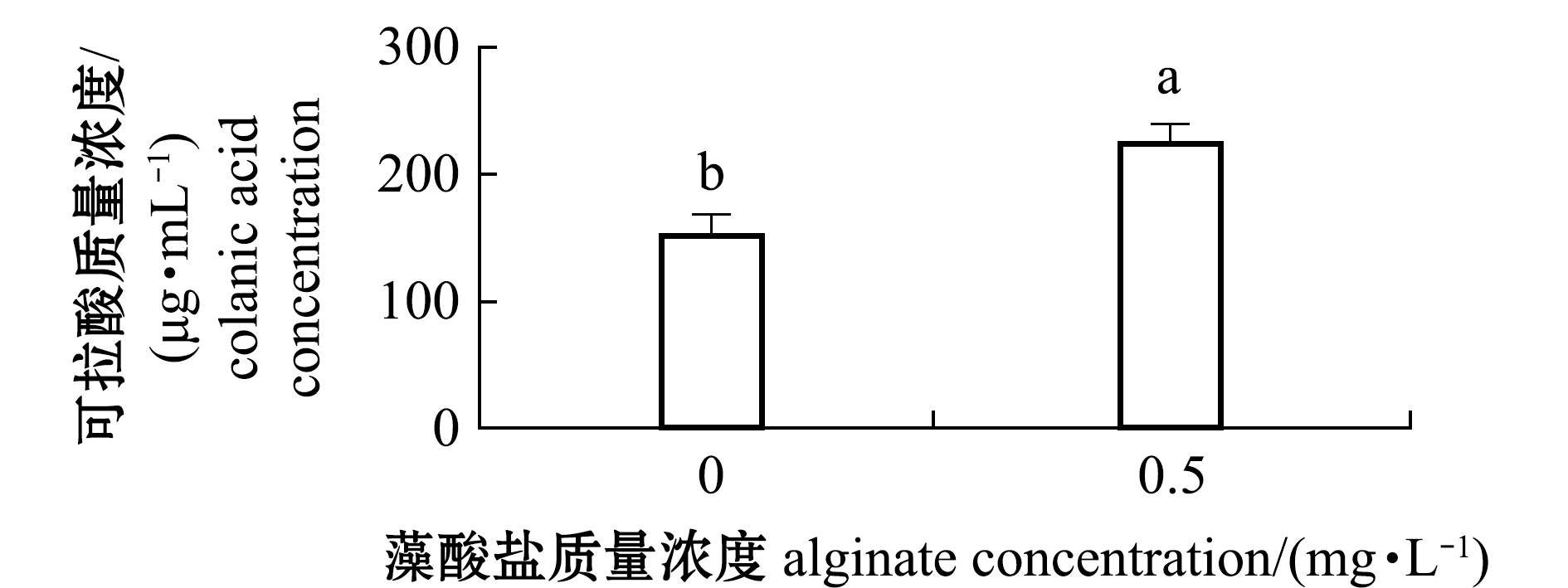
图7 藻酸盐与P.marina共同形成生物被膜的可拉酸含量
Fig.7 Concent of colanic acid of P.marina biofilms formed with alginate
3 讨论
附着变态是海洋无脊椎动物生存的必经阶段,细菌生物被膜定向附着技术可以显著提高厚壳贻贝幼虫的附着变态率。目前,关于藻酸盐对生物被膜形成及对厚壳贻贝幼虫附着变态的影响研究鲜有报道。因此,本研究中首次在P.marina生物被膜的形成过程中添加藻酸盐,以探讨其对生物被膜生物学特性及厚壳贻贝幼虫附着变态的影响。
3.1 藻酸盐促进生物被膜的形成
胞外多糖是细菌胞外产物的主要部分,也是形成生物被膜不可或缺的条件[19-20]。藻酸盐作为一种重要的胞外多糖,其含量的增多或减少均能不同程度地影响生物被膜的结构[21-23]。本研究中,藻酸盐与P.marina共同形成生物被膜的细菌密度、膜厚、胞外α多糖和β多糖含量显著增加,而胞外蛋白与胞外脂类的含量无明显变化。对铜绿假交替单胞菌的研究显示,细菌藻酸盐可能通过促进细菌间的连接从而形成较厚的生物被膜[24-25],而本研究中添加海藻藻酸盐同样能使生物被膜的膜厚增加,这说明其可能具有与细菌藻酸盐相似的功能。藻酸盐是由β-D-甘露糖醛酸及其同分异构体α-L-古洛糖醛酸两种结构组成的一种线性多糖[26],本试验中,添加海藻藻酸盐后形成生物被膜的胞外α多糖和β多糖分别为单一细菌生物被膜的1.26倍和1.19倍。为了明确生物被膜胞外α多糖和β多糖的变化是否与添加的藻酸盐有关,本研究中比较分析了添加藻酸盐前后生物被膜胞外多糖中的可拉酸含量。可拉酸与藻酸盐虽同属细菌胞外多糖物质,均含有α多糖和β多糖,但组成两者的单糖并不相同,可拉酸由二磷酸尿苷葡萄糖(UDP-α-D-Glc)、二磷酸鸟苷岩藻糖(GDP-β-L-Fuc)、二磷酸尿苷半乳糖(UDP-α-D-Gal)和二磷酸尿苷葡萄糖醛酸(UDP-α-D-Glca)组成[27-28]。本试验结果显示,与藻酸盐共同形成的生物被膜胞外产物中可拉酸的含量显著增加。因此,在生物被膜形成过程中添加藻酸盐,可促进生物被膜中其他胞外多糖的合成,从而促进生物被膜的形成。
3.2 藻酸盐与P.marina共同形成的生物被膜促进厚壳贻贝幼虫附着变态
生物被膜的生物学特征如细菌密度、膜厚等是影响海洋无脊椎动物幼虫附着变态的诱因之一[29-30]。已有研究显示,细菌密度能够影响华美盘管虫Hydroides elegans[31]、紫贻贝Mytilus galloprovincialis[32]等海洋无脊椎动物幼虫的附着变态。然而,并非所有细菌所形成生物被膜的细菌密度都与厚壳贻贝幼虫附着变态有关。Peng等[33]以7株不同假交替单胞菌生物被膜为研究对象,发现仅有3株假交替单胞菌生物被膜的细菌密度与幼虫附着变态率相关,且用不同酶处理生物被膜发现,诱导幼虫附着变态的诱导因子可能包括多糖、蛋白和脂类。Zeng等[34]研究发现,解脂假交替单胞菌Pseudoalteromonas lipolytica自发突变菌株所形成的生物被膜,因其荚膜多糖减少或纤维素含量过量抑制了厚壳贻贝幼虫的附着变态。Peng等[35]研究发现,P.marina中多糖合成基因01912的缺失导致胞外多糖可拉酸含量增加,从而促进了厚壳贻贝幼虫的附着变态。本研究中,不同质量浓度的藻酸盐与P.marina共同形成的生物被膜,诱导幼虫附着变态的能力并未呈现出与细菌密度一样的上升趋势,由此推测,生物被膜细菌密度并不是诱导幼虫附着变态的主要因素。与单一细菌生物被膜相比,添加藻酸盐形成的生物被膜胞外α多糖和β多糖的含量显著增加,可拉酸含量也显著增加。因此,在生物被膜形成过程中添加藻酸盐,能够促进生物被膜胞外多糖的产生,尤其是可拉酸的产生,进而促进了厚壳贻贝幼虫的附着变态。
综上所述,在P.marina生物被膜的形成过程中添加藻酸盐,有利于形成较厚的生物被膜;同时,生物被膜细菌密度、膜厚的改变,以及胞外多糖可拉酸含量的增多,促进了厚壳贻贝幼虫的附着变态。因此,海藻藻酸盐在细菌生物被膜形成过程中具有与细菌藻酸盐相似的功能。本研究结果为解析多糖物质在海洋细菌生物被膜形成中的作用机制,以及进一步探究生物被膜与海洋贝类附着变态间的互作关系具有积极意义。本研究结果可为利用生物被膜提高厚壳贻贝育苗成功率、推动厚壳贻贝人工养殖产业的发展提供科学参考。
4 结论
1)添加藻酸盐能够增加P.marina生物被膜的细菌密度、膜厚、胞外α多糖和β多糖含量,促进生物被膜的形成。
2)添加藻酸盐使P.marina生物被膜中可拉酸等其他胞外多糖含量显著增加,从而促进生物被膜对厚壳贻贝幼虫附着变态的诱导能力。
[1] 常亚青.贝类增养殖学[M].北京:中国农业出版社,2007.
CHANG Y Q.Shellfish aquaculture[M].Beijing:China Agriculture Press,2007.(in Chinese)
[2] 苏秀榕,李太武,丁明进.紫贻贝和厚壳贻贝营养成分的研究[J].中国海洋药物,1998,17(2):30-32.
SU X R,LI T W,DING M J.Studies on the nutritive contents of the mussel Mytilus edulis and Mytilus coruscus[J].Chinese Journal of Marine Drugs,1998,17(2):30-32.(in Chinese)
[3] 李太武.海洋生物学[M].北京:海洋出版社,2013.
LI T W.Marine biology[M].Beijing:Ocean Press,2013.(in Chinese)
[4] 杨金龙,李响,王冲,等.低盐度形成的微生物膜对厚壳贻贝稚贝附着的影响[J].海洋科学,2013,37(8):107-113.
YANG J L,LI X,WANG C,et al.Settlement of the mussel Mytilus coruscus plantigrades in response to biofilms formed on low salinities[J].Marine Sciences,2013,37(8):107-113.(in Chinese)
[5] 高伟,郭行磐,徐嘉康,等.微生物被膜形成因子及其对厚壳贻贝附着的影响[J].大连海洋大学学报,2017,32(4):405-409.
GAO W,GUO X P,XU J K,et al.Effects of environmental factors on formation of bacterial biofilms and settlement of plantigrades of mussel Mytilus coruscus[J].Journal of Dalian Ocean University,2017,32(4):405-409.(in Chinese)
[6] 杨金龙,段志鸿,丁文扬,等.维生素B7和B12对细菌生物被膜形成及厚壳贻贝幼虫变态的影响[J].渔业科学进展,2021,42(5):113-123.
YANG J L,DUAN Z H,DING W Y,et al.Effects of VB7 and VB12 on biofilm formation and larval metamorphosis of the mussel Mytilus coruscus[J].Progress in Fishery Sciences,2021,42(5):113-123.(in Chinese)
[7] HALL-STOODLEY L,COSTERTON J W,STOODLEY P.Bacterial biofilms:from the natural environment to infectious diseases[J].Nature Reviews Microbiology,2004,2(2):95-108.
[8] FLEMMING H C,WINGENDER J.The biofilm matrix[J].Nature Reviews Microbiology,2010,8(9):623-633.
[9] REHMB H A.Bacterial polymers:biosynthesis,modifications and applications[J].Nature Reviews Microbiology,2010,8(8):578-592.
[10] 陈菲,熊晓宇,谢明杰.白花丹素对E.coli藻酸盐合成的抑制作用[J].微生物学杂志,2018,38(3):47-51.
CHEN F,XIONG X Y,XIE M J.Inhibitory effects of plumbagin on alginate synthesis in E.coli[J].Journal of Microbiology,2018,38(3):47-51.(in Chinese)
[11] 梁箫,童欢,彭莉华,等.纤维素对海洋细菌生物被膜形成及厚壳贻贝幼虫附着变态的调控[J].大连海洋大学学报,2020,35(1):75-82.
LIANG X,TONG H,PENG L H,et al.Regulation of formation of biofilms and larval settlement and metamorphosis of mussel Mytilus coruscus by cellulose[J].Journal of Dalian Ocean University,2020,35(1):75-82.(in Chinese)
[12] 吴静娴,李嘉政,胡晓梦,等.脂多糖对细菌生物被膜形成及厚壳贻贝幼虫变态的影响[J/OL].水产学报,2022.https://kns.cnki.net/kcms/detail/31.1283.S.20211012.2032.018.html.
WU J X,LI J Z,HU X M,et al.Effects of lipopolysaccharide on biofilm formation and larval metamorphosis of the mussel Mytilus coruscus[J/OL].Journal of Fisheries of China,2022.https://kns.cnki.net/kcms/detail/31.1283.S.20211012.2032.018.html.(in Chinese)
[13] BERKELEY R C W,GOODAY G W,ELLWOOD D C.Microbial polysaccharides and polysaccharases[M].London:Academic Press,1979.
[14] YANG J L,SHEN P J,LIANG X,et al.Larval settlement and metamorphosis of the mussel Mytilus coruscus in response to monospecific bacterial biofilms[J].Biofouling,2013,29(3):247-259.
[15] 杨金龙,郭行磐,陈芋如,等.中湿度表面的海洋细菌对厚壳贻贝稚贝附着的影响[J].水产学报,2015,39(3):421-428.
YANG J L,GUO X P,CHEN Y R,et al.Effects of bacterial biofilms formed on middle wettability surfaces on settlement of plantigrades of the mussel Mytilus coruscus[J].Journal of Fisheries of China,2015,39(3):421-428.(in Chinese)
[16] 梁箫,杨丽婷,彭莉华,等.不同温度下形成的深海菌膜对厚壳贻贝幼虫变态的影响[J].水产学报,2020,44(10):1728-1741.
LIANG X,YANG L T,PENG L H,et al.Effects of biofilms of deep-sea bacteria at varying temperatures on larval metamorphosis of Mytilus coruscus[J].Journal of Fisheries of China,2020,44(10):1728-1741.(in Chinese)
[17] GONZ LEZ-MACHADO C,CAPITA R,RIESCO-PEL
LEZ-MACHADO C,CAPITA R,RIESCO-PEL EZ F,et al.Visualization and quantification of the cellular and extracellular components of Salmonella Agona biofilms at different stages of development[J].PLoS One,2018,13(7):e0200011.
EZ F,et al.Visualization and quantification of the cellular and extracellular components of Salmonella Agona biofilms at different stages of development[J].PLoS One,2018,13(7):e0200011.
[18] OBADIA B,LACOUR S,DOUBLET P,et al.Influence of tyrosine-kinase wzc activity on colanic acid production in Escherichia coli K12 cells[J].Journal of Molecular Biology,2007,367(1):42-53.
[19] SUTHERLAND I W.The biofilm matrix—an immobilized but dynamic microbial environment[J].Trends in Microbiology,2001,9(5):222-227.
[20] WINGENDER J,STRATHMANN M,RODE A,et al.Isolation and biochemical characterization of extracellular polymeric substances from Pseudomonas aeruginosa[J].Methods in Enzymology,2001,336:302-314.
[21] POLI A,ANZELMO G,NICOLAUS B.Bacterial exopolysaccharides from extreme marine habitats:production,characterization and biological activities[J].Marine Drugs,2010,8(6):1779-1802.
[22] ZENG Z S,GUO X P,CAI X S,et al.Pyomelanin from Pseudoalteromonas lipolytica reduces biofouling[J].Microbial Biotechnology,2017,10(6):1718-1731.
[23] CZACZYK K,MYSZKA K.Biosynthesis of extracellular polymeric substances (EPS) and its role in microbial biofilm formation[J].Polish Journal of Environmental Studies,2007,16:799-806.
[24] HOLMQVIST K,CROSS M J,ROLNY C,et al.The adaptor protein shb binds to tyrosine 1175 in vascular endothelial growth factor (VEGF) receptor-2 and regulates VEGF-dependent cellular migration[J].Journal of Biological Chemistry,2004,279(21):22267-22275.
[25] 梁歌宏,祁伟.藻酸盐与铜绿假单胞菌生物被膜形成及耐药关系[J].国际流行病学传染病学杂志,2007,34(2):139-141.
LIANG G H,QI W.Research progress of alginate in the biofilm biosynthesis and antibiotic resistance of Pseudomonas aeruginosa[J].International Journal of Epidemiology and Infectious Disease,2007,34(2):139-141.(in Chinese)
[26] URTUVIA V,MATURANA N,ACEVEDO F,et al.Bacterial alginate production:an overview of its biosynthesis and potential industrial production[J].World Journal of Microbiology & Biotechnology,2017,33(11):198.
[27] SHUGAR S,SANDERSON K E.Characterization of a mucoid Escherichia coli K12 strain,and chemical analysis of the exopolysaccharide[J].Canadian Journal of Microbiology,1972,18(7):969-973.
[28] GRANT W D,SUTHERLAND I W,WILKINSON J F.Exopolysaccharide colanic acid and its occurrence in the Enterobacteriaceae[J].Journal of Bacteriology,1969,100(3):1187-1193.
[29] TRAN C,HADFIELD M G.Larvae of Pocillopora damicornis (Anthozoa) settle and metamorphose in response to surface-biofilm bacteria[J].Marine Ecology Progress Series,2011,433:85-96.
[30] TEBBEN J,TAPIOLAS D M,MOTTI C A,et al.Induction of larval metamorphosis of the coral Acropora millepora by tetrabromopyrrole isolated from a Pseudoalteromonas bacterium[J].PLoS One,2011,6(4):e19082.
[31] HUANG S,HADFIELD M G.Composition and density of bacterial biofilms determine larval settlement of the polychaete Hydroides elegans[J].Marine Ecology Progress Series,2003,260:161-172.
[32] YANG J L,SATUITO C G,BAO W Y,et al.Larval settlement and metamorphosis of the mussel Mytilus galloprovincialis on different macroalgae[J].Marine Biology,2007,152(5):1121-1132.
[33] PENG L H,LIANG X,XU J K,et al.Monospecific biofilms of Pseudoalteromonas promote larval settlement and metamorphosis of Mytilus coruscus[J].Scientific Reports,2020,10:2577.
[34] ZENG Z S,GUO X P,LI B Y,et al.Characterization of self-generated variants in Pseudoalteromonas lipolytica biofilm with increased antifouling activities[J].Applied Microbiology and Biotechnology,2015,99(23):10127-10139.
[35] PENG L H,LIANG X,CHANG R H,et al.A bacterial polysaccharide biosynthesis-related gene inversely regulates larval settlement and metamorphosis of Mytilus coruscus[J].Biofouling,2020,36(7):753-765.