糖类物质的主要生理功能是为动物机体提供能量,在动物养殖过程中,通常作为廉价的能量来源添加到饲料当中。相较于陆生动物,鱼类特别是肉食性鱼类对糖类物质的利用能力较差[1],甚至部分鱼类先天性地具有糖尿病患者的某些生理特征[2]。饲料中添加过高的糖类物质,会导致鱼类抗病力下降、生长速度减缓、死亡率增加等症状[3]。研究表明,鲤Cyprinus carpio即便在空腹状态下,胰岛素含量也远高于陆生哺乳动物[4];在葡萄糖耐受试验中,葡萄糖灌喂后绝大多数的鱼都表现为持久的高血糖症状发生[5]。通常来说,肠促胰岛素具有促进胰岛素分泌和抑制胰高血糖素分泌的功能,从而可以达到降血糖的作用,但是肠促胰岛素易被二肽基肽酶-Ⅳ(DDP-Ⅳ)降解失去活性而无法起效。具有产DDP-Ⅳ抑制剂的菌株能够抑制二肽基肽酶,延长肠促胰岛素胰高血糖素样肽(GLP-1)和胰岛素释放肽(GIP)的半衰期,从而间接达到降低血糖的目的[6-10]。
近年来,随着人们对水产品需求的日益增加,水产养殖业规模不断扩大,人们更加关注提高水生生物品质及其对自身健康的影响。鱼类因摄食过多糖类,在体内无法分解而造成大量糖尿病的情况至今无法彻底解决,而具有产DDP-Ⅳ抑制剂的菌株能够间接降低血糖含量,从而成为抑制水生生物血糖含量的一种新途径。相关文献报道的具有产DDP-Ⅳ抑制剂的细菌主要有芽孢杆菌属Bacillus、假单胞菌属Pseudomonas、变形杆菌属Proteus、梭状芽孢杆菌属Clostridium、小球菌属Micrococcus、葡萄球菌属Staphylococcus、八叠球菌属Sporosarcina、无色杆菌属Achromobacter、产碱杆菌属Alcaligenes、黄杆菌属Flavobacterium、赛氏杆菌属Serratia、肠细菌属Enterobacter和埃希氏杆菌属Escherichia等[11-16]。
目前,关于从鱼自身筛选出具有产DDP-Ⅳ抑制剂功能的赖氨酸芽孢杆菌Lysinibacillus fusiformis,进而达到降低血糖含量的研究尚未见报道。
本研究中,利用质量分数为2%的脱脂乳固体培养基,在鲤肠道内含物中筛选出一株产DDP-Ⅳ抑制剂能力较强的益生菌,同时利用响应面分析法对该菌株的发酵培养基配方进行改良,以期为赖氨酸芽孢杆菌大规模工业化生产提供科学参考。
1 材料与方法
1.1 材料
样品来源:试验用德国镜鲤由中国水产科学院黑龙江水产研究所提供,随机选择健康的3尾1龄鲤(200 g±10 g)为试验样本,所有试验操作符合动物福利(欧洲动物实验指令2010/63/EU)相关规定。
2%脱脂乳固体培养基(SKM,质量分数,下同):先配制20 mL 10%脱脂乳培养基,再准确称取1.4 g的琼脂溶于80 mL蒸馏水中,两种溶液于115 ℃条件下灭菌15 min,冷却至60 ℃后在无菌条件下将两种溶液混合均匀。
初始发酵培养基:将100 g刚刚长出嫩芽的新鲜黄豆芽,加蒸馏水100 mL,置于烧杯中加热煮沸30 min,采用多层纱布过滤。用无菌水标定,再加入蔗糖50 g,充分溶解,在高压灭菌锅中115 ℃下灭菌20 min。
1.2 方法
1.2.1 样品采集 将鲤用MS-222麻醉剂(250 mg/L)麻醉,使用无水乙醇擦拭鲤的体表,在超净工作台中用灭菌后的剪刀和镊子进行解剖,取出鲤的整条肠道,轻轻挤出内含物,置于无菌棕色玻璃瓶中。
1.2.2 产DDP-Ⅳ抑制剂菌株的初筛 将鲤肠道内含物,置于含玻璃珠和50 mL无菌水的锥形瓶中,以180 r/min室温振荡30 min,吸取0.5 mL的悬液放入盛有4.5 mL无菌水的试管中,振荡均匀。依次从前一个试管中吸取0.5 mL的悬液加入后一个装有4.5 mL无菌水的试管中,将悬液稀释成10-3、10-4和10-5 3个梯度,从各梯度中分别取100 μL涂布于SKM培养基平板上,每个梯度设置3个重复,置于28 ℃下培养 24~48 h。采用乳蛋白水解圈方法筛选,挑取产生透明圈的分离物进行纯化[17]。
1.2.3 DDP-Ⅳ抑制活性的测定 对出现明显乳蛋白水解圈的菌株进行进一步试验:在96孔板中,准确滴加25 μL 1.6 mmol/L的甘氨酰(Gly)-脯氨酰(Pro)-对硝基苯胺(pNA)和25 μL细胞代谢物(CFS)或细胞内容物(CFE);在37 ℃下反应15 min,再加入50 μL 0.01 U/mL DDP-Ⅳ,在37 ℃下继续反应1 h;最后加入100 μL 1 mol/L醋酸钠缓冲溶液(pH 4.0)终止反应。使用酶标仪在405 nm处检测反应溶液的吸光值[18]。
DDP-Ⅳ抑制率计算公式为
抑制率![]()
其中: A待测样品为25 μL样品+25 μL Gly-Pro-pNA+50 μL DDP-Ⅳ+100 μL醋酸钠;A空白样品为25 μL样品+50 μL Tris-HCl+25 μL Gly-Pro-pNA+100 μL醋酸钠;A阴性对照为25 μL Tris-HCl+25 μL Gly-Pro-pNA+50 μL DDP-Ⅳ+100 μL醋酸钠;A阴性空白为75 μL Tris-HCl+25 μL Gly-Pro-pNA+100 μL醋酸钠。
1.2.4 产DDP-Ⅳ抑制剂菌株的鉴定
16S rRNA鉴定:选用北京索莱宝生物科技公司的细菌基因组DNA提取试剂盒,提取分离纯化后的菌株DNA。采用细菌通用引物27F/1492R进行PCR扩增,PCR扩增体系(共25 μL):10×缓冲液2.5 μL,Taq酶0.5 μL,引物27F 0.5 μL,引物1492R 0.5 μL,DNA模板1 μL,ddH2O 20 μL。反应程序:95 ℃下预变性5 min;94 ℃下变性50 s,56 ℃下退火30 s,72 ℃下延伸1.5 min,共进行30个循环;最后再在72 ℃下延伸10 min,4 ℃下保存。将PCR扩增产物送往RuiBiotech公司测序。通过NCBI数据库比对菌株16S rRNA的测序结果,并构建系统进化树。
生理生化鉴定:取保存的菌株在固体LB培养基平板上三区划线,分离出单菌落并对其形态进行描述,根据《常用细菌系统鉴定手册》[19]对菌株进行革兰氏染色及生理生化鉴定。
1.2.5 培养基优化 将活化好的菌种接种到LB培养基中,37 ℃下以180 r/min摇床培养10 h,制成种子液。
1)单因素试验。最佳碳源的筛选:在初始发酵培养基中分别添加质量分数为2%的蔗糖、阿拉伯糖、乳糖、麦芽糖、可溶性淀粉和玉米粉,按0.5%的接种量接入种子液,在180 r/min、37 ℃条件下摇床培养15 h,测定发酵液中OD600 nm吸光值。
最佳有机氮源的筛选:在添加最佳碳源的初始发酵培养基中分别加入质量分数为1%的蛋白胨、酵母粉、豆粕作为氮源,发酵条件同上。
最佳无机氮源的筛选:在初始发酵培养基中,分别加入质量分数为0.5%的尿素、(NH4)2SO4、NH4NO3和NH4Cl,同时加入相应的最佳碳源和最佳有机氮源,发酵条件同上。
最佳无机盐筛选:在初始发酵培养基中分别加入质量分数为0.3%的MgSO4、KH2PO4、K2HPO4和CaCO3,同时加入相应的最佳碳源及最佳有机与无机氮源,发酵条件同上。
2)响应面分析。基于单因素筛选的最佳碳源、氮源及无机盐的试验结果,利用响应面分析软件,以发酵液的OD600 nm值为优化指标,进行条件优化,从而获得最优培养基配方,并对配方进行验证试验。
1.2.6 验证试验 按0.5%的接种量将菌株接种到响应面优化后的培养基中,在180 r/min、37 ℃条件下摇床培养15 h,测定发酵液中OD600 nm的吸光值,通过比较预测值和试验值验证模型的有效性。
1.3 数据处理
对试验数据采用SPSS 17.0软件进行单因素方差分析和差异显著性检验,对响应面试验数据采用Design Expert 12.0软件进行响应面分析。
2 结果与分析
2.1 产DDP-Ⅳ抑制剂菌株的初筛
从鲤肠道内含物样品中分离得到具有产DDP-Ⅳ抑制剂的细菌共15个。选取蛋白分解能力较强的一株益生菌标记为CR-3。在SKM固体培养基中,CR-3菌株的水解圈直径(D)为0.30 mm,菌落直径(d)为0.98 mm,D/d为3.27(图1)。
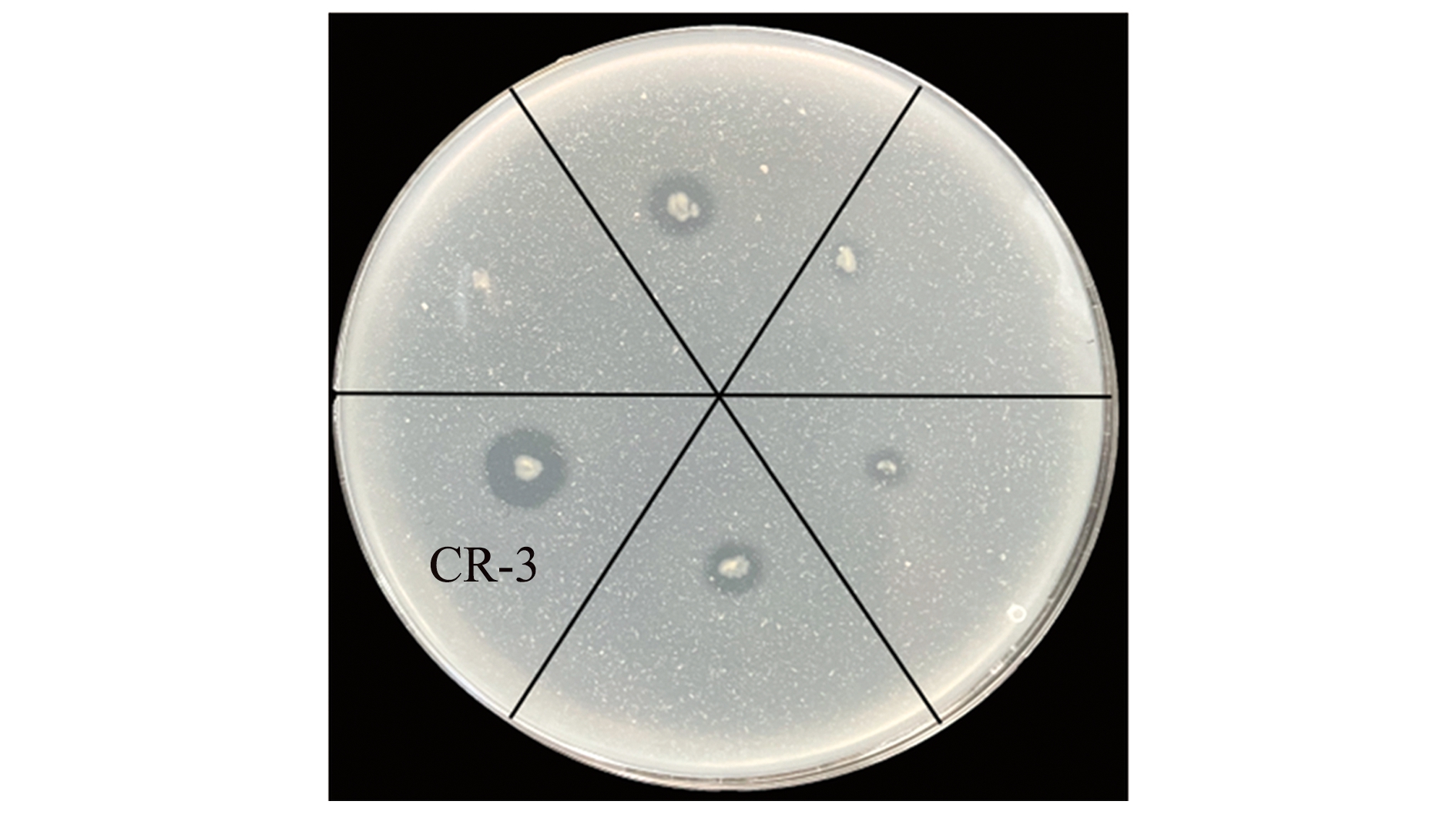
图1 CR-3菌株在SKM培养基中的乳蛋白水解圈
Fig.1 Lactoprotein hydrolysis circles of CR-3 on SKM medium
2.2 DDP-Ⅳ抑制活性的测定
按照“1.2.3节”的方法测得,CR-3菌株在37 ℃时的DDP-Ⅳ抑制剂产率高达62.35%。
2.3 CR-3菌株鉴定
2.3.1 生理生化试验 CR-3菌株在LB固体培养基中的菌落特征:菌落为圆形,无色透明状,边缘整齐,中间突起,有黏性,经革兰氏染色为革兰氏阳性菌。CR-3菌株的部分生理生化指标见表1,CR-3菌株与赖氨酸芽孢杆菌模式种的生理生化具有相同特征,由各项生理生化结果,推断CR-3菌株可能为赖氨酸芽孢杆菌。
表1 CR-3菌株的生理生化特性
Tab.1 Physiological and biochemical properties of strain CR-3
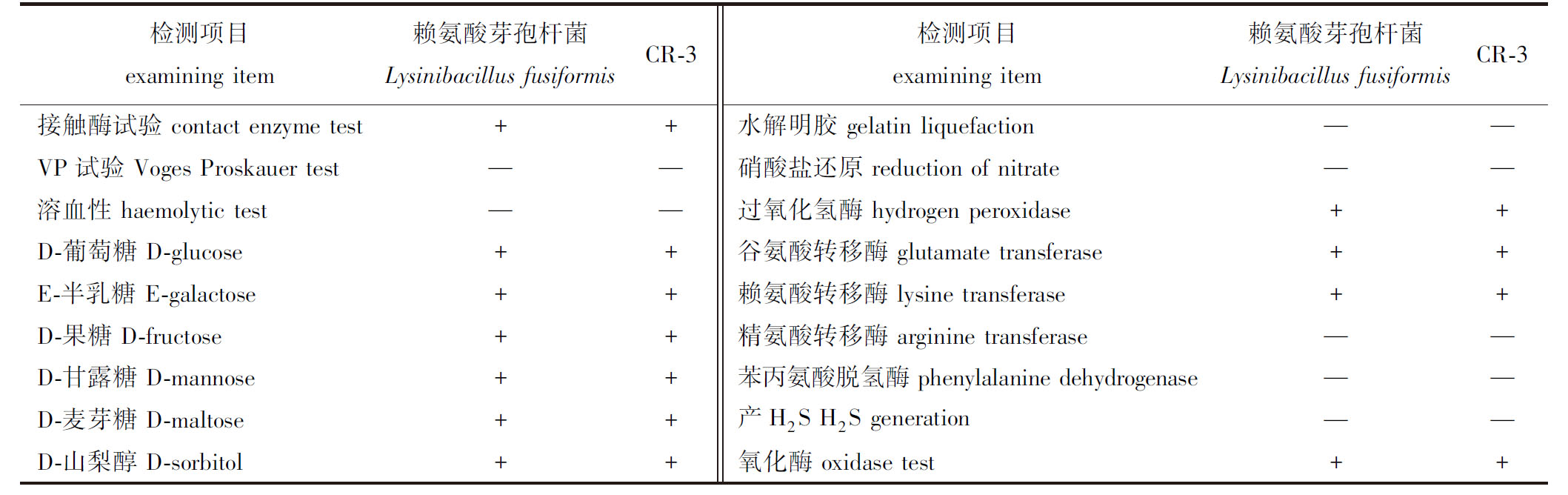
检测项目examining item赖氨酸芽孢杆菌Lysinibacillus fusiformisCR-3检测项目examining item赖氨酸芽孢杆菌Lysinibacillus fusiformisCR-3接触酶试验 contact enzyme test++水解明胶 gelatin liquefaction——VP试验 Voges Proskauer test——硝酸盐还原 reduction of nitrate——溶血性 haemolytic test——过氧化氢酶 hydrogen peroxidase++D-葡萄糖 D-glucose++谷氨酸转移酶 glutamate transferase++E-半乳糖 E-galactose++赖氨酸转移酶 lysine transferase++D-果糖 D-fructose++精氨酸转移酶 arginine transferase——D-甘露糖 D-mannose++苯丙氨酸脱氢酶 phenylalanine dehydrogen-ase——D-麦芽糖 D-maltose++产H2S H2S generation——D-山梨醇 D-sorbitol++氧化酶 oxidase test++
注:+为阳性;—为阴性。
Note:+,positive; —,negative.
2.3.2 16S rRNA鉴定 对CR-3菌株的16S rRNA序列进行测序后,在NCBI中进行BLAST比对发现,CR-3菌株的16S rRNA基因序列与赖氨酸芽孢杆菌Lysinibacillus fusiformis(KP872951.1)一致性为99%。通过构建CR-3菌株的系统发育树,可以看出,CR-3与赖氨酸芽孢杆菌(KP872951.1)同处最小的一个分支,说明进化距离较近。综合生理生化试验、16S rRNA序列比对和系统发育树结果,将CR-3菌株鉴定为赖氨酸芽孢杆菌Lysinibacillus fusiformis(图2)。

图2 CR-3菌株系统发育树
Fig.2 Phylogenetic tree of strain CR-3
2.4 培养基优化
2.4.1 单因素试验 细菌发酵液在OD600 nm处的数值可以作为衡量细菌生长程度的判别指标。表2为赖氨酸芽孢杆菌CR-3在不同碳源培养基下发酵液的OD600 nm值,不同碳源培养基发酵液的OD600 nm值依次为蔗糖>乳糖>阿拉伯糖>麦芽糖>玉米粉>可溶性淀粉,故选择蔗糖作为CR-3菌株的最佳碳源。
表2 CR-3菌株培养基碳源的优化
Tab.2 Optimisation of carbon source for CR-3 strain medium

指标 index阿拉伯糖arabinose乳糖lactose麦芽糖maltose蔗糖sucrose可溶性淀粉soluble starch玉米粉corn flourOD600 nm0.8611.1380.6391.2170.2370.524
在添加最佳碳源的初始培养基中,分别添加不同种类的有机氮源和无机氮源,发酵液发酵15 h后进行OD600 nm测定。从表3可知,不同有机氮源发酵液的OD600 nm值依次为酵母粉>豆粕>蛋白胨,从而确定CR-3菌株培养基的最佳有机氮源为酵母粉,但由于CR-3菌株在豆粕和酵母粉中的OD600 nm值差距较小,同时考虑到生产成本,故最后选择豆粕作为最佳有机氮源;而在发酵培养基无机氮源的筛选中,NH4Cl的OD600 nm值要远高于其他无机氮源,故确定CR-3菌株的最佳无机氮源为NH4Cl。
表3 CR-3菌株培养基氮源的优化
Tab.3 Optimisation of the nitrogen source for CR-3 strain medium
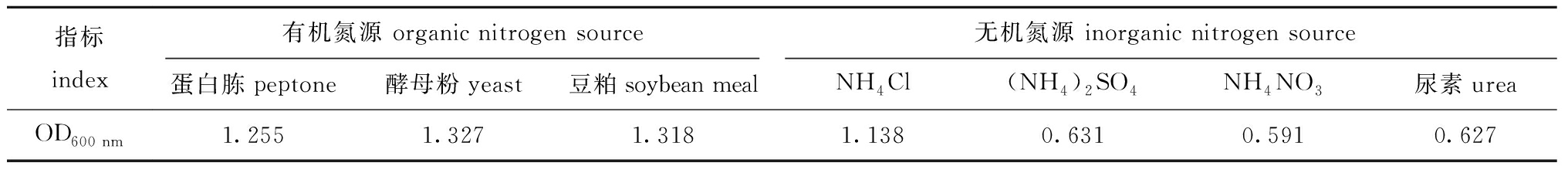
指标index有机氮源 organic nitrogen source无机氮源 inorganic nitrogen source蛋白胨peptone酵母粉yeast豆粕soybean mealNH4Cl(NH4)2SO4NH4NO3尿素ureaOD600 nm1.2551.3271.3181.1380.6310.5910.627
在添加最佳碳源和氮源初始培养基中,分别添加不同种类的无机盐,从而对无机盐的种类进行筛选。从表4可见,添加不同无机盐的发酵液OD600 nm值依次为CaCO3>K2HPO4>KH2PO4>MgSO4,从而确定赖氨酸芽孢杆菌CR-3的最佳无机盐为CaCO3。
表4 CR-3菌株培养基无机盐的优化
Tab.4 Optimisation of inorganic salts in CR-3 strain medium

指标 indexMgSO4K2HPO4KH2PO4CaCO3OD600 nm0.7641.1570.9641.287
2.4.2 响应面优化分析 根据单因素试验确定的赖氨酸芽孢杆菌CR-3最佳碳源、有机氮源、无机氮源和无机盐,选取蔗糖、CaCO3、NH4Cl和豆粕,设计4因素3水平的响应面分析试验方案,共设计29个试验组,采用酶标仪对发酵液OD600 nm进行测定,试验设计如表5所示,响应面分析结果及方差分析结果如表6、表7所示。
表5 响应面分析因素与水平
Tab.5 Factors and levels in response surface analysis w/%
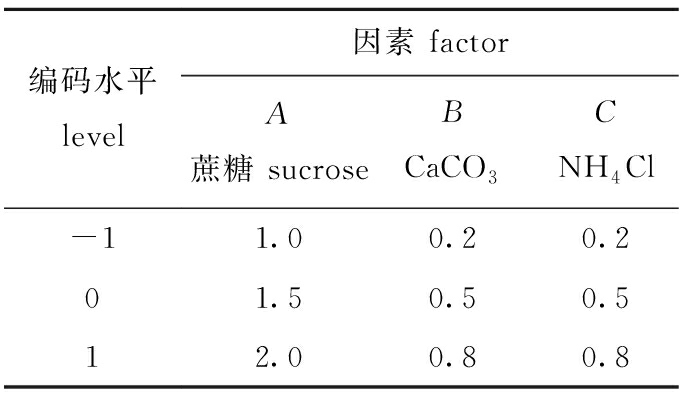
编码水平level因素 factorA蔗糖 sucroseBCaCO3CNH4ClD豆粕 soybean meal-11.00.20.21.001.50.50.52.012.00.80.83.0
表6 响应面分析结果
Tab.6 Results of response surface analysis

试验号No.A蔗糖/% sucroseB碳酸钙/%CaCO3C氯化氨/%NH4ClD豆粕/% soybean mealOD600 nm11.00.20.52.01.082 322.00.20.52.01.195 931.00.80.52.01.177 242.00.80.52.01.138 451.50.50.21.01.128 961.50.50.81.01.087 371.50.50.23.01.145 381.50.50.83.01.103 791.00.50.51.01.189 1102.00.50.51.01.165 0111.00.50.53.01.221 4122.00.50.53.01.181 4131.50.20.22.01.022 1141.50.80.22.01.117 0151.50.20.82.00.980 5试验号No.A蔗糖/% sucroseB碳酸钙/%CaCO3C氯化氨/%NH4ClD豆粕/% soybean mealOD600 nm161.50.80.82.01.075 4171.00.50.22.01.119 0182.00.50.22.01.094 9191.00.50.82.01.077 4202.00.50.82.01.053 3211.50.20.51.01.092 2221.50.80.51.01.187 1231.50.20.53.01.108 9241.50.80.53.01.203 5251.50.50.52.01.285 8261.50.50.52.01.326 8271.50.50.52.01.314 6281.50.50.52.01.334 2291.50.50.52.01.278 9
表7 Box-Behnken 试验结果的方差分析
Tab.7 ANOVA of Box-Behnken test results
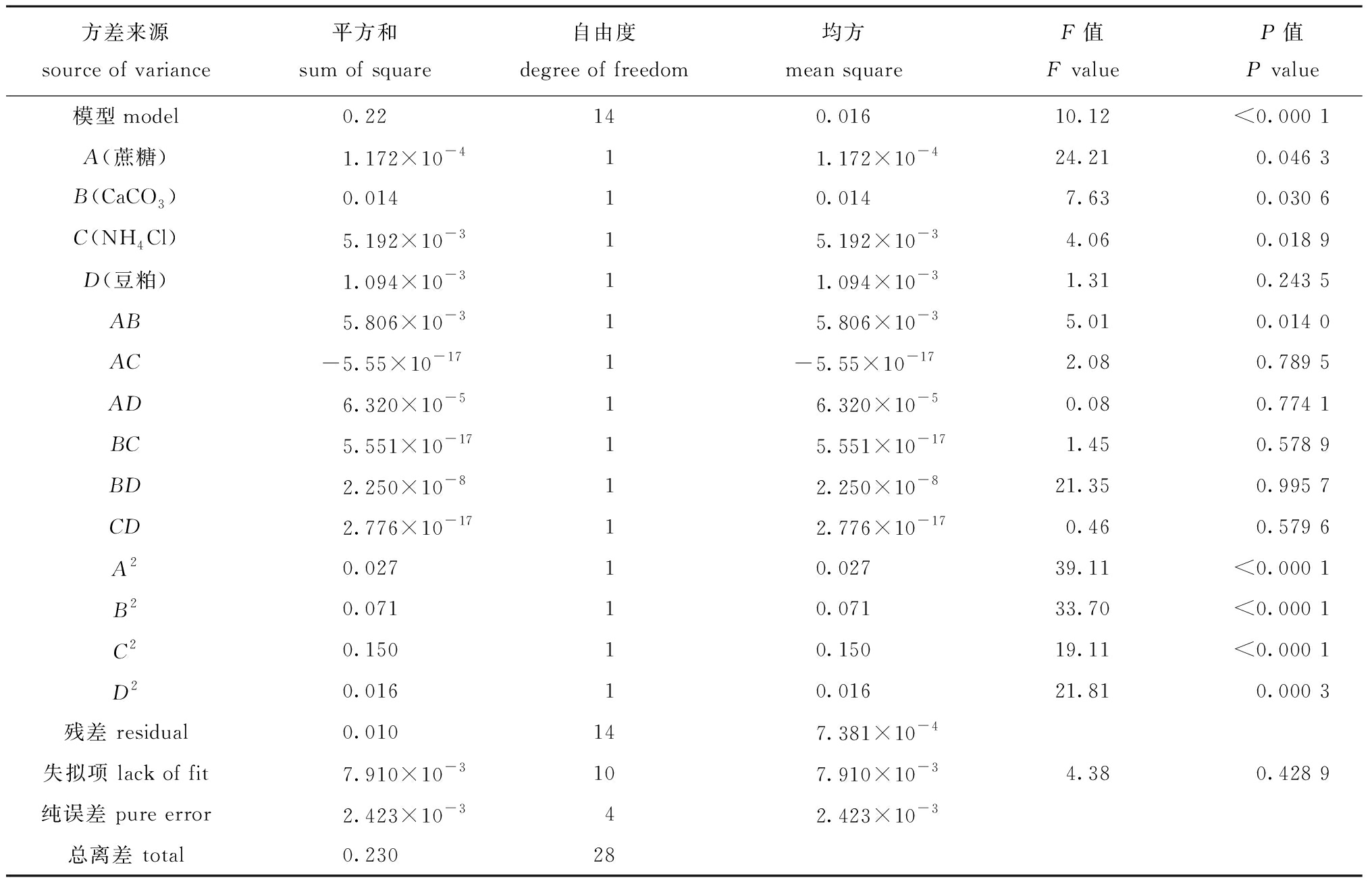
方差来源source of variance平方和sum of square自由度degree of freedom均方mean squareF值F valueP值P value模型model0.22140.01610.12<0.000 1A(蔗糖)1.172×10-411.172×10-424.210.046 3B(CaCO3)0.01410.0147.630.030 6C(NH4Cl)5.192×10-315.192×10-34.060.018 9D(豆粕)1.094×10-311.094×10-31.310.243 5AB5.806×10-315.806×10-35.010.014 0AC-5.55×10-171-5.55×10-172.080.789 5AD6.320×10-516.320×10-50.080.774 1BC5.551×10-1715.551×10-171.450.578 9BD2.250×10-812.250×10-821.350.995 7CD2.776×10-1712.776×10-170.460.579 6A20.02710.02739.11<0.000 1B20.07110.07133.70<0.000 1C20.15010.15019.11<0.000 1D20.01610.01621.810.000 3残差 residual0.010147.381×10-4失拟项 lack of fit7.910×10-3107.910×10-34.380.428 9纯误差 pure error2.423×10-342.423×10-3总离差 total0.23028
响应面是由试验因子的响应值所构成的3D空间曲面图,能够清晰地反映出最佳的优化条件及各个因素间的交互作用。响应面的图形越陡峭,说明因素间的交互作用越显著,相反,则说明因素间的交互作用比较微弱[20]。从图3可见,蔗糖与 CaCO3的响应面曲线最陡(图3A),且等高线呈椭圆,说明它们之间的交互作用显著,而其他因素之间的响应面曲线较为平缓,说明他们之间的交互作用不明显。

图3 各因素间交互作用对赖氨酸芽孢杆菌发酵培养基OD600 nm影响的3D响应面图
Fig.3 3D response surface plot of the effect of interaction between factors on OD600 nm of Lysinibacillus fusiformis fermentation medium
利用Design Expert软件对试验数据进行多元回归分析,得到发酵培养基OD600 nm值(Y)的回归拟合方程如下:
Y=1.31-3.125×10-3A+0.035B-0.021C+ 9.55×10-3D-0.038AB-3.975×10-3AD-7.5×10-5BD-0.065A2-0.10B2-0.15C2-0.050D2。
对上述二次回归方程进行方差分析,由表7可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明所建立的模型可用于赖氨酸芽孢杆菌CR-3的培养基优化。根据F值大小,各因素对发酵培养基OD600 nm值的影响程度依次为蔗糖>CaCO3>NH4Cl>豆粕,其中蔗糖、CaCO3和NH4Cl对试验结果影响显著(P<0.05)。对二次回归方程进行求解,进而得到赖氨酸芽孢杆菌发酵培养基最佳配方为蔗糖1.46%、CaCO3 0.55%、NH4Cl 0.48%和豆粕2.10%(均为质量分数,下同),此时预测OD600 nm值为1.313。
2.4.3 验证试验 初始发酵培养基的OD600 nm值为0.810。根据响应面分析法得到赖氨酸芽孢杆菌发酵培养基最佳配方,在此条件下预测发酵液OD600 nm值为1.313。为了验证模型预测的准确性,在发酵培养基最佳配方条件下进行3次重复验证试验,测得赖氨酸芽孢杆菌CR-3发酵培养基中OD600 nm值为1.328,与预测值误差较小,说明该方法可以较好地预测试验结果,回归模型方程可靠。
3 讨论
3.1 菌株的筛选及鉴定
中国的渔业资源非常丰富,水产养殖业尤为发达,但在饲养过程中会因为饲料中含有的糖类物质导致鱼体中血糖含量上升。有文献表明,鱼类对糖类物质分解能力有限,从而导致饲料的浪费且不利于鱼体健康,究其原因可能与以下因素有关:第一,胰岛素在鱼体血液中含量较低;第二,糖类物质较难被鱼体外周组织所利用;第三,相对于氨基酸等物质,糖类物质刺激鱼类胰岛素分泌的能力较弱;第四,鱼体中肠促胰岛素易被DDP-Ⅳ降解失去活性从而无法起到降糖作用[21]。为了解决DDP-Ⅳ降解肠促胰岛素导致血糖上升的问题,本试验中从鲤肠道内含物中,筛选得到一株具有DDP-Ⅳ抑制剂的益生菌CR-3。通过生理生化试验、16S rRNA序列测定及系统发育树构建,鉴定该菌株为赖氨酸芽孢杆菌,并且测定该菌株在37 ℃时的DDP-Ⅳ抑制剂产率高达62.35%。目前,对赖氨酸芽孢杆菌的研究多集中在纤维素的分解和重金属的吸附,对于该菌株具有产DDP-Ⅳ抑制剂的研究尚未见报道。
3.2 CR-3菌株培养基最佳营养成分的确定
在相关研究中,邴辉[22]在地衣芽孢杆菌Bacillus licheniformis LCDD6的培养基优化试验中,确定最佳碳源为葡萄糖,最佳氮源为豆粕,最佳无机盐为磷酸氢二钾;王晓洁等[23]通过单因素试验考察碳源、氮源、无机盐对发酵短杆菌素Brevibacillin laterosporus的影响,得到最佳碳源为40.0 g/L的蔗糖,最佳氮源为30.0 g/L的牛肉膏,最佳无机盐离子为10.0 g/L的镁离子,并将其作为主要影响因素进行响应面分析。本研究中,通过单因素试验,探究了发酵培养基配方对赖氨酸芽孢杆菌CR-3发酵液OD600 nm的影响,确定出最优碳源为蔗糖,最优无机盐为CaCO3,最优无机氮源为NH4Cl,最优有机氮源为豆粕。其中,豆粕作为有机氮源时,发酵液的OD600 nm值明显优于其他对照,这可能是由于豆粕在生产过程中经益生菌发酵水解,产生大量具有独特生理活性功能的活性肽,同时含有多种营养物质(如乳酸、维生素和氨基酸),能够更大程度地满足微生物的生长需求。除此之外,豆粕还具有价格低廉、原料易得等优点,为下一步的大规模生产提供了成本上的便利[24]。
3.3 CR-3菌株发酵培养基配方的优化
赖氨酸芽孢杆菌CR-3的发酵培养基配方优化试验是一种多因素多水平的优化试验,且涉及多因素不同水平间的交互作用。采用响应面分析法可以快速高效地在影响发酵液OD600 nm的因子中筛选出主要的影响因子,且利用回归方程能更全面地找到整个区域的最优解,避免因非主要成分所造成的资源浪费及工作量的叠加。大量文献表明,该统计学方法已经广泛应用于多种培养基的优化试验,优化后的理论预测值结果与验证试验的实测值接近,且优化后的实测值较未优化前有显著性提升。孙承文等[25]在维氏气单胞菌CA07灭活疫苗菌液发酵工艺的研究中,采用了响应面优化法,优化结果较单因素最高活菌数值提高20.59%,实测结果与预测值结果基本相符。高绘菊等[26]在产漆酶DHJ-4菌株的最佳发酵培养基优化过程中,将爬坡试验与响应面分析法相结合,优化得出酶活力的平均值为410.04 U/mL,与预测值407.57 U/mL间误差小于1%,较单因素试验结果提升9.5倍。李婷等[27]在降解纤维素酶的低温放线菌T23-B的产酶条件优化研究中,得到该菌株纤维素酶最佳生产条件为甘露糖15.6 g/L、酵母浸粉7.8 g/L、初始pH 5.2、培养时间96 h、摇床转速160 r/min、培养温度35 ℃,最适产酶条件下纤维素酶活力高达123.43 U/mL,较优化前提高了4.4倍。张丽等[28]在齐整小核菌发酵产胞外多糖的培养基优化研究中,最终得到的小核菌多糖最优培养基多糖产量为(23.76±1.05)g/L,与预测值误差为2.5%,相比原始培养基提高了54.42%。
本研究中,通过Box-Behnken试验分析确定出关键因素的最佳值,得到的最优发酵培养基配方为蔗糖1.46%、CaCO3 0.55%、NH4Cl 0.48%和豆粕2.10%,得到发酵培养基OD600 nm的平均值为1.328,与预测值(1.313)相差较小。通过分析各变量间的3D曲面模型的陡峭程度,能够迅速高效地呈现出各因素间的交互作用情况和影响发酵液OD600 nm的关键影响因子,说明该统计学方法能够真实反映出碳源、氮源、无机盐对赖氨酸芽孢杆菌CR-3生长的影响程度,同时也佐证了采用响应面分析法优化赖氨酸芽孢杆菌CR-3的发酵培养基配方是科学可行的。
4 结论
1)本试验中采用SKM培养基从鲤肠道内含物中筛选出15株具有产DDP-Ⅳ抑制剂的菌株,其中,CR-3菌株产DDP-Ⅳ抑制剂的能力最强,在 37 ℃时DDP-Ⅳ抑制剂产率高达62.35%,经生理生化试验和16S rRNA测序,将CR-3菌株鉴定为赖氨酸芽孢杆菌。说明该赖氨酸芽孢杆菌能够对DDP-Ⅳ产生抑制效果,从而间接地降低血糖,为进一步提高鲤生存率提供了可能。
2)通过响应面分析法优化获得赖氨酸芽孢杆菌CR-3的液体培养基配方为蔗糖1.46%、CaCO3 0.55%、NH4Cl 0.48%和豆粕2.10%,在此条件下赖氨酸芽孢杆菌发酵培养基的OD600 nm值为1.328,比未优化前的初始发酵培养基的OD600 nm值(0.810)提升了64%,本研究结果可为赖氨酸芽孢杆菌大规模工业化生产提供一定的数据参考。
[1] 蔡春芳,陈立侨.鱼类对糖的利用评述[J].水生生物学报,2006,30(5):608-613.
CAI C F,CHEN L Q.Comment on the utilization of dietary carbohydrates in fish[J].Acta Hydrobiologica Sinica,2006,30(5):608-613.(in Chinese)
[2] WILSON R P,POE W E.Apparent inability of channel catfish to utilize dietary mono- and disaccharides as energy sources[J].The Journal of Nutrition,1987,117(2):280-285.
[3] DIXON D G,HILTON J W.Influence of available dietary carbohydrate content on tolerance of waterborne copper by rainbow trout,Salmo gairdneri Richardson[J].Journal of Fish Biology,1981,19(5):509-518.
[4] HERTZ Y,EPSTEIN N,ABRAHAM M,et al.Effects of metformin on plasma insulin,glucose metabolism and protein synthesis in the common carp(Cyprinus carpio L.)[J].Aquaculture,1989,80(1/2):175-187.
[5] MOON T W.Glucose intolerance in teleost fish:fact or fiction?[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2001,129(2/3):243-249.
[6] MATUCI E,GIAMPIETRO O.Dipeptidyl peptidase-4 (CD26):knowing the function before inhibiting the enzyme[J].Current Medicinal Chemistry,2009,16(23):2943-2951.
[7] 苗雷,许泓瑜,雷楗勇,等.二肽基肽酶Ⅳ抑制剂体外筛选模型的建立及应用[J].中国药理学通报,2009,25(3):411-414.
MIAO L,XU H Y,LEI J Y,et al.Establishment and application of screening method for DPP IV inhibitors in vitro[J].Chinese Pharmacological Bulletin,2009,25(3):411-414.(in Chinese)
[8] PARMAR H S,JAIN P,CHAUHAN D S,et al.DPP-IV F inhibitory potential of naringin:an in silico, in vitro and in vivo study[J].Diabetes Tesearch and Clinical Practice,2012,97(1):105-111.
[9] 闫芬芬,史佳鹭,李娜,等.具有α-葡萄糖苷酶和二肽基肽酶Ⅳ抑制作用降糖益生菌的筛选[J].食品科学,2019,40(20):152-158.
YAN F F,SHI J L,LI N,et al.Screening for potential novel probiotic Lactobacillus strains with high dipeptidyl peptidase IV and α-glucosidase inhibitory activity[J].Food Science,2019,40(20):152-158.(in Chinese)
[10] 李甜.GLP-1/GIP/Gcg三受体激动剂改善3×Tg-AD小鼠学习记忆功能的电生理和分子机制研究[D].太原:山西医科大学,2017.
LI T.The study of electrophysiological and molecular mechanisms of GLP-1/GIP/Gcg triagonist in improving learning and memory of 3×Tg-AD mice[D].Taiyuan:Shanxi Medical University,2017.(in Chinese)
[11] AL-SALAMI H,BUTT G,FAWCETT J P,et al.Probiotic treatment reduces blood glucose levels and increases systemic absorption of gliclazide in diabetic rats[J].European Journal of Drug Metabolism and Pharmacokinetics,2008,33(2):101-106.
[12] 李向菲.产胞外多糖乳酸菌对2型糖尿病的干预及其机制研究[D].无锡:江南大学,2016.
LI X F.Effect of exopolysaccharides-producing lactic acid bacteria on type 2 diabetes and its mechanism[D].Wuxi:Jiangnan University,2016.(in Chinese)
[13] HSIEH F C,LEE C L,CHAI C Y,et al.Oral administration of Lactobacillus reuteri GMNL-263 improves insulin resistance and ameliorates hepatic steatosis in high fructose-fed rats[J].Nutrition & Metabolism,2013,10(1):35.
[14] JAYASHREE B,BIBIN Y S,PRABHU D,et al.Increased circulatory levels of lipopolysaccharide (LPS) and zonulin signify novelbiomarkers of proinflammation in patients with type 2 diabetes[J].Molecular and Cellular Biochemistry,2014,388(1/2):203-210.
[15] EJTAHED H S,MOHTADI-NIA J,HOMAYOUNI-RAD A,et al.Probiotic yogurt improves antioxidant status in type 2 diabetic patients[J].Nutrition,2012,28(5):539-543.
[16] IVEY K L,HODGSON J M,KERR D A,et al.The effects of probiotic bacteria on glycaemic control in overweight men and women:a randomised controlled trial[J].European Journal of Clinical Nutrition,2014,68(4):447-452.
[17] 刘虎,侯贞,易建华,等.一株烟草根际溶磷细菌的筛选鉴定及其培养基优化[J].山东农业大学学报(自然科学版),2016,47(4):514-519.
LIU H,HOU Z,YI J H,et al.Isolation and identification of tobacco rhizosphere phosphate solubilizing bacteria and optimization of medium[J].Journal of Shandong Agricultural University (Natural Science Edition),2016,47(4):514-519.(in Chinese)
[18] 吉薇.南极磷虾蛋白源二肽基肽酶-IV(DDP-IV)抑制肽的研究[D].湛江:广东海洋大学,2017.
JI W.Study of protein-derived dipeptidyl peptidase-IV (DDP-IV) inhibitory peptide from Euphausia superba[D].Zhanjiang:Guangdong Ocean University,2017.(in Chinese)
[19] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
DONG X Z,CAI M Y.Handbook of systematic identification of common bacteria[M].Beijing:Science Press,2001.(in Chinese)
[20] 夏邦华,赵健,宫娉,等.基于响应面分析法优化解淀粉芽孢杆菌DSYZ发酵条件[J].山东农业大学学报(自然科学版),2021,52(2):241-246.
XIA B H,ZHAO J,GONG P,et al.Optimal fermentation conditions for Bacillus amyloliquefaciens DSYZ based on response surface methodology[J].Journal of Shandong Agricultural University (Natural Science Edition),2021,52(2):241-246.(in Chinese)
[21] MOMMSEN T P,PLISETSKAYA E M.Insulin in fishes and agnathans:history,structure and metabolic regulation[J].Reviews In Aquaculture,1991,4(2/3):225-259.
[22] 邴辉.生姜根际促生菌的促生效应[D].泰安:山东农业大学,2020.
BING H.Promoting effect of ginger from rhizosphere probiotics[D].Taian:Shandong Agricultural University,2020.(in Chinese)
[23] 王晓洁,孟凡强,周立邦,等.响应面优化侧孢短芽孢杆菌产短杆菌素发酵培养基[J].食品工业科技,2022,43(4):153-160.
WANG X J,MENG F Q, ZHOU L B,et al. Optimization of brevibacillin fermentation medium with Brevibacillus laterosporus by response surface methodology[J].Science and Technology of Food Industry,2022,43(4):153-160.(in Chinese)
[24] 杨露,谭会泽,刘松柏,等.豆粕在畜禽饲料中的营养价值与抗营养成分解析[J].粮食与饲料工业,2021(3):41-44,51.
YANG L,TAN H Z,LIU S B,et al.Analysis of nutritional value and anti-nutritional components of soybean meal in livestock and poultry feed[J].Cereal & Feed Industry,2021(3):41-44,51.(in Chinese)
[25] 孙承文,赖迎迢,巩华,等.基于响应面法的维氏气单胞菌灭活疫苗菌液发酵工艺优化及免疫效力比较[J].大连海洋大学学报,2021,36(4):546-553.
SUN C W,LAI Y T,GONG H,et al.Optimization of fermentation process by response surface methodology and comparison of immune efficacy of inactivated vaccine of Aeromonas veronii[J].Journal of Dalian Ocean University,2021,36(4):546-553.(in Chinese)
[26] 高绘菊,王凤娟,王维乐,等.Paraconiothyrium variabile GHJ-4产漆酶发酵培养基优化及酶学性质研究[J].山东农业大学学报(自然科学版),2016,47(5):641-646.
GAO H J,WANG F J,WANG W L,et al.Medium optimization and characterization of laccase production by Paraconiothyrium variabile GHJ-4[J].Journal of Shandong Agricultural University (Natural Science Edition),2016,47(5):641-646.(in Chinese)
[27] 李婷,王玥,刘中珊,等.一株降解纤维素的低温放线菌Streptomyces azureus及产酶条件优化[J].中国农学通报,2021,37(32):25-33.
LI T,WANG Y,LIU Z S,et al.A novel low temperature cellulose-degrading strain Streptomyces azureus and its enzymatic production condition optimization[J].Chinese Agricultural Science Bulletin,2021,37(32):25-33.(in Chinese)
[28] 张丽,柳昊睿,赵馨仪,等.齐整小核菌发酵产胞外多糖的培养基优化研究[J].中国酿造,2021,40(9):98-103.
ZHANG L,LIU H R,ZHAO X Y,et al.Medium optimization for exopolysaccharides production by sclerotiumrolfsii[J].China Brewing,2021,40(9):98-103.(in Chinese)