极性是一个复杂的物理参数,溶剂极性大小取决于除分子间氢键作用和能够使溶质发生化学变化的溶剂作用之外,溶剂分子和溶质间所有可能的分子间相互作用[1-2]。在化学、化工领域,溶剂极性是推动化学反应进程的关键参数[3-6]。在生命科学领域,细胞极性变化与生理和病理过程密切相关[7],如溶酶体极性能够影响溶酶体膜流动性和溶酶体内酶促反应等[8]。基于上述特性,有研究人员通过监控秀丽隐杆线虫虫体极性变化或比较处于不同糖尿病阶段小鼠肝脏组织极性的大小,进而分析秀丽隐杆线虫或小鼠生理、病理的发生和发展情况[9-10]。鱼的病变也必然引起病变部位细胞极性的变化,通过监测鱼体极性变化对其病变部位进行定位和诊断,相比于传统解剖方法具有检测手段更加快速、准确且不会对生物体产生伤害的优点。因此,对溶剂或生物微环境进行准确的极性检测具有广泛的应用前景。
荧光检测法是通过分析荧光探针荧光强度、荧光寿命、比例荧光或其他荧光参数的变化,对离子[11-12]、小分子[13-14]、生物大分子浓度[15]及生物微环境参数[16-18]进行检测的方法,该方法具有灵敏度高、特异性好、响应迅速和技术简便等特点[19-28]。其中,极性响应型荧光探针通常由分子内电子给体(如氨基)、共轭连接区和电子受体组成,被光激发后可产生分子内电荷转移(intramolecular charge transfer,ICT),能更好地对微环境极性变化产生响应[2,29]。当周围环境极性发生变化时,探针分子基态、激发态与溶剂间产生偶极-偶极相互作用,荧光发射强度会产生显著变化,即分子基态、激发态间产生π→π*跃迁时,荧光发射峰强度随溶剂极性的增强而降低,而当产生n→π*跃迁时,荧光发射强度则随溶剂极性的增强而升高[30]。可见,构建光激发后同时具有π→π*与n→π*的双分子跃迁荧光探针,即极性比例荧光探针,有利于对微环境极性变化进行准确的荧光检测[31]。目前,极性比例荧光探针的构建尚无明确的理论依据,本文首次提出了极性比例荧光探针的构建方法,为荧光探针准确检测极性提供了有效途径。
本文中,以萘环为荧光团,首先构建具有电子推拉体系的荧光探针IA,再引入乙醇胺缩合形成含氮原子杂环,合成极性比例荧光探针IAN,通过测定荧光探针IA和IAN的吸收、荧光发射光谱,分析探针对溶剂极性的响应性能,并将制备的探针IAN应用于生物活体检测,以期为准确检测生物微环境极性变化的比例荧光探针构建提供参考。
1 材料与方法
1.1 材料
试验动物:试验用雌性BALB/c小鼠(4~6周)购于大连医科大学SPF实验动物中心(体质量为16.0 g±2.0 g,6只);珍珠龙胆石斑鱼Epinephelus fuscoguttatus♀×E.lanceolatus♂购于莱州明波水产有限公司(体质量为120.0 g±5.0 g,10尾),健康珍珠龙胆石斑鱼5尾,患肝胆综合症珍珠龙胆石斑鱼5尾。
动物试验严格遵守美国国立卫生研究院出版的《实验动物护理和使用指南》(2011年)。动物试验方案获得了动物伦理委员会大连理工大学研究伦理审查委员会的批准(伦理批准号为2018-043)。
试剂:化学试剂乙酸铵、丙二腈、苊酮、胍基乙酸、乙醇胺等高纯度试剂均购于上海萨恩化学有限公司;分析纯试剂甲苯、二氯甲烷、乙醇、乙酸乙酯、1,4-二氧六环等均购于天津科密欧化学试剂有限公司。以上试剂未经过进一步处理,直接应用于反应和测试。
仪器设备:核磁共振波谱仪(Bruker Avance II,瑞士布鲁克公司);LC/Q-TOF-MS质谱仪(美国安捷伦公司);荧光分光光度计(Aglient Technologies Eclipse,美国安捷伦公司);紫外-可见分光光度计(Aglient Technologies Cary 60,美国安捷伦公司);稳态/瞬态荧光光谱仪(LP920,英国爱丁堡公司);绝对光致发光量子产率仪(C11347,日本滨松公司);单光子共聚焦激光扫描显微镜(FVl000,日本奥林巴斯公司)。
1.2 方法
1.2.1 荧光探针IA、IAN的制备路线 首先用乙酸铵和乙酸,在回流甲苯中催化丙二腈和原料苊酮I-1发生缩合反应,生成中间体化合物I-2;通过滴加胍基乙酸催化中间体化合物I-2与N, N-二甲基甲酰胺二甲基缩醛继续产生缩合反应,生成探针IA;搅拌状态下,向含有IA的无水二氯甲烷溶液中滴加乙醇胺,反应溶液逐渐变为亮橙色,并析出沉淀,纯化后获得探针IAN。荧光探针IA和IAN的合成路线见图1。
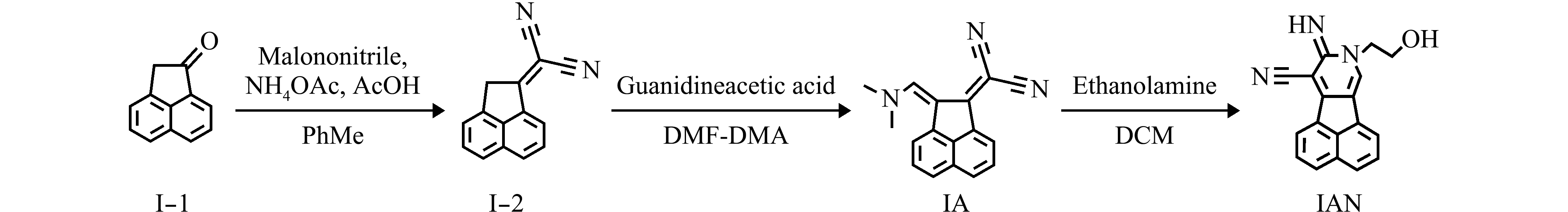
图1 荧光探针IA和IAN的合成路线
Fig.1 Synthesis pathway of fluorescent probes IA and IAN
1.2.2 荧光探针IA、IAN吸收光谱及荧光发射光谱的测定 首先通过空白溶剂对紫外-可见吸收光谱仪进行校正;再将相同体积的探针母液(浓度为20 mmol/L)稀释并置于含不同极性测试溶剂的石英皿中(3 mL),混合均匀后制得测试样本,并将含有测试样本的石英皿置于紫外-可见光谱仪测试仓中进行探针吸收光谱扫描;最后通过荧光光谱仪对上述测试样本进行激发,获得探针的荧光发射光谱,用荧光强度(I)表示。
本研究中,以低极性、非质子溶剂1,4-二氧六环和高极性、质子溶剂水为例,构建两相混合溶剂测试体系。不同于单一溶剂的测试体系,通过自由调节溶剂组分的体积比,能够获得极性覆盖范围广泛的混合溶剂测试体系。其中,两相混合溶剂的极性(Δf)、介电常数(εmix)和折射率![]() 计算公式分别为
计算公式分别为
Δf=(ε-1)/(2ε+1)-(n2-1)/(2n2+1),
(1)
εmix=faεa+fbεb,
(2)
(3)
其中:εa、na和 fa分别为溶剂a的介电常数、折射率和在混合溶剂中的体积比;εb、nb和fb分别为溶剂b的介电常数、折射率和在混合溶剂中的体积比。
1.2.3 荧光探针IAN荧光量子产率及荧光寿命测定 首先在测试石英皿中加入空白溶剂,并用仪器自动校正。再将探针加入测试样品池中(终浓度为0.1 mmol/L),通过量子产率仪测量样品的透射光子数和荧光发射光子数。探针的荧光量子产率(Φf)计算公式为
Φf=Np,em/Np,abs=Np,em/(Np,all-Np,trans)。
(4)
其中:Np,all为用于激发探针分子的全部光子数;Np,em、Np,abs和Np,trans分别为探针分子的发射、吸收和透射光子数。采用稳态/瞬态荧光光谱仪测定探针荧光寿命(τ)。
1.2.4 Stokes’位移的计算及其与溶剂极性的关系
探针溶剂化变色效应和溶剂化荧光变色效应通过Lippert-Mataga公式计算得到[4],即
(5)
其中:h为普朗克常数;c为真空中的光速;a为onsager腔半径;Δf为溶剂极性;μe和μg分别为探针分子的基态偶极和激发态偶极;ε0为真空介电常数。当Δν和Δf可以被线性拟合时,表明探针与溶剂之间的相互作用为一般溶剂化效应;而当Δν和Δf线性拟合的斜率不同时,表明探针基态、激发态偶极矩差值(μe-μg)发生变化。
探针分子在特定溶剂中的Stokes’位移(Δν,cm-1)计算公式为
Δν=νabs-νem=(1/λabs-1/λem)×2π。
(6)
其中:λabs和λem分别为探针分子的吸收峰和发射峰波长。
1.2.5 荧光探针IAN对活体生物的检测 将6只BALB/c雌性小鼠适应性喂养一周。在小鼠乳腺癌细胞4T1传代时,将培养瓶中的4T1细胞消化、收集、离心后弃去细胞培养基,以1×108 cells/mL的密度将细胞重新悬浮于PBS缓冲液(0.01 mol/L,pH 7.4)中。构建肿瘤模型时,在每只BALB/c雌鼠左端侧翼区皮下注射含上述4T1细胞的PBS悬浮液100 μL。肿瘤小鼠模型构建成功后,将雌性BALB/c小鼠的心脏、肾脏、肝脏、脾脏、肺和肿瘤组织取出,在体积分数为10%的中性缓冲福尔马林中固定24 h后,包埋在石蜡中,通过冷冻切片机切成厚度为5 μm的切片。脱蜡后,用IAN(10 μmol/L,孵育1.5 h)对不同组织样本进行染色,使用共聚焦激光扫描显微镜进行荧光观察。
将健康和患肝胆综合症的珍珠龙胆石斑鱼解剖取出肝脏,固定在体积分数为10%的中性缓冲福尔马林溶液中,选出具有代表性的肝脏组织,切下相同位置和大小的组织,用石蜡包埋并切成厚度为5 μm的切片。脱蜡后,用IAN(10 μmol/L,孵育1.5 h)对不同组织样品进行染色,使用共焦激光扫描显微镜进行荧光观察,肝脏组织切片的平均荧光强度比值(I474 nm/I552 nm)可选取多处ROI的荧光比例同时进行定量分析获得。
2 结果与分析
2.1 荧光探针IA和IAN的合成
2.1.1 中间体化合物I-2的合成 在无水甲苯中,通过滴加乙酸铵(0.55 g,浓度为7.1 mmol/L)和乙酸(2.25 mL,39.2 mmol/L),催化丙二腈(2.36 g,35.7 mmol/L)和苊酮I-1(6.00 g,35.7 mmol/L)在加热回流状态下进行缩合反应。反应2 h后,将反应溶液冷却并伴有固体析出,再将析出的固体产物过滤收集后,用乙醇、水和正己烷等溶剂先后进行润洗,真空干燥得到橙黄色固体,即中间体化合物I-2(产量7.96 g,产率77%)。
化合物核磁氢谱数据:1H NMR (400 MHz, CDCl3),δ为8.54 (d,J=7.4 Hz,1H)、8.12 (d,J=8.1 Hz, 1H)、7.83 (d,J=8.3 Hz,1H)、7.76 (t,J=7.8 Hz, 1H)、7.67~7.62(m, 1H)、7.51 (d,J=6.9 Hz,1H)、4.43 (s,2H)。
2.1.2 荧光探针IA的合成 通过滴加胍基乙酸(0.029 g,0.25 mmol/L),催化中间体化合物I-2(0.540 g,2.5 mmol/L)与N, N-二甲基甲酰胺二甲基缩醛(DMF-DMA,0.357 g,3.0 mmol/L)的缩合反应。反应溶液在100 ℃条件下,持续搅拌0.5 h,反应结束后,将反应溶剂蒸干,并将剩余物通过柱层析方法进行分离,提纯目标化合物。硅胶柱层析分离提纯化合物IA所用洗脱液为二氯甲烷。纯化后的目标化合物经真空干燥后为深栗色固体,即产物IA(产量0.676 g,产率接近100%)。
化合物核磁氢谱数据:1H NMR (400 MHz, CDCl3),δ为8.65 (d,J=7.4 Hz,1H)、8.57 (s, 1H)、7.96(d,J=8.1 Hz,1H)、7.67~7.59(m,2H)、7.52~7.47(m, 1H)、7.28(s,1H)、3.46(s,6H)。
2.1.3 荧光探针IAN的合成 向含有化合物IA(0.267 g,0.98 mmol/L)的无水二氯甲烷(5 mL)溶液中,逐滴加入乙醇胺(1.795 g,29.48 mmol/L,滴加时间为10 min)。在30 ℃下持续搅拌反应溶液4 h,反应溶液由浅红色逐渐变为亮橙色,并伴有橙黄色固体沉淀析出。抽滤后,用乙酸乙酯、二氯甲烷和正己烷等溶剂先后对所得滤饼进行润洗,真空干燥后得到橙黄色固体化合物,即终产物IAN(产量0.197 g,产率70%)。
化合物核磁氢谱数据:1H NMR (400 MHz,DMSO-d6),δ为8.36 (s,1H)、8.19 (d,J=7.1 Hz,1H)、8.12 (d,J=8.2 Hz,1H)、7.79 (d,J=15.7,8.1 Hz,2H)、7.72 (d,J=6.9 Hz,1H)、7.67~7.60 (m,1H)、4.10 (t,J=5.1 Hz,2H)、3.78 (t,J=5.1 Hz,2H)。
13C NMR (101 MHz,DMSO-d6),δ为151.08、138.75、135.17、134.18、132.75、131.20、130.55、130.05、128.85、128.30、124.06、123.33、117.50、116.05、113.64、92.09、57.45、54.07。
HRMS(ESI,m/z),化合物IAN的[M+H]+(C18H14N3O+),测定值为288.113 1(理论值为288.113 1)。
2.2 溶液中荧光探针IA光谱的极性响应性能
通过混合不同体积分数的水和1,4-二氧六环,构建极性Δf=0.124~0.301的测试体系,在此体系中,探针IA的吸收峰位于540 nm,并在610 nm处出现了相应的荧光发射峰(图2)。结合探针IA的荧光强度I610 nm与测试溶液极性Δf之间的Boltzmann拟合关系发现,探针IA的吸收峰位置和吸光度不随极性变化而变化,但其在λ=610 nm处,荧光发射峰的强度随着极性的增强而升高(图3)。
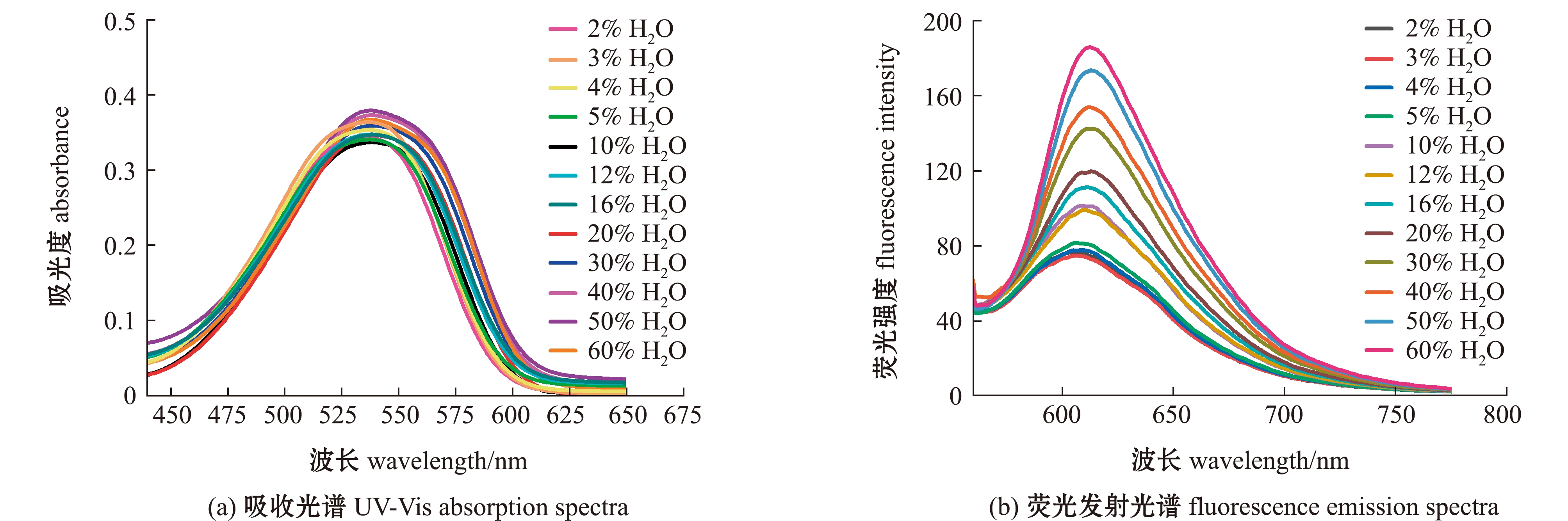
图2 探针IA在不同体积比的水和1,4-二氧六环混合溶剂中的吸收光谱及荧光发射光谱
Fig.2 UV-Vis absorption spectra and fluorescence emission spectra of fluorescent probe IA in the mixtures of H2O and 1,4-dioxane with different volume ratios
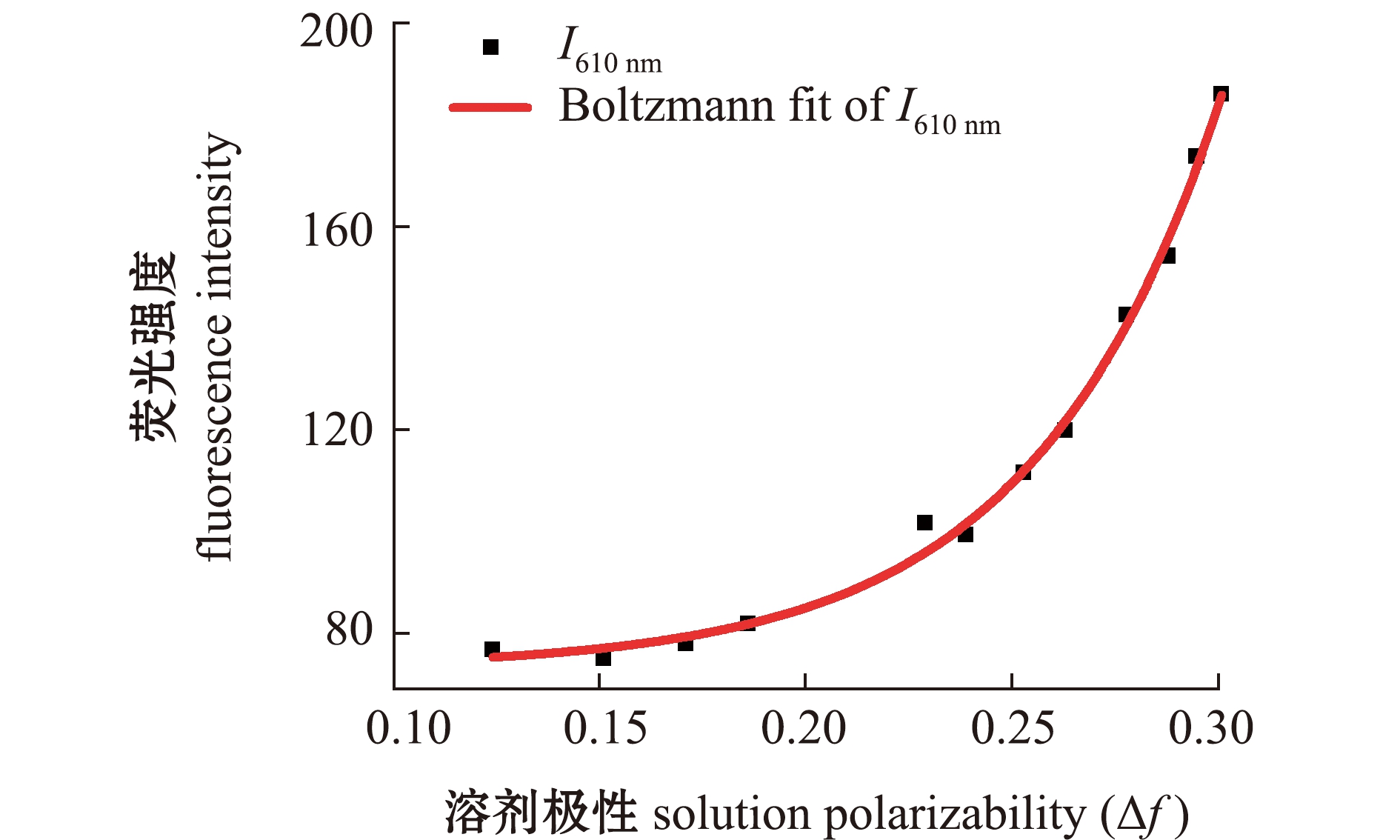
图3 探针IA的I610 nm与溶剂Δf的Boltzmann拟合关系
Fig.3 Boltzmann fit of I610 nm versus Δf for fluorescent probe IA
2.3 溶液中荧光探针IAN光谱的极性响应性能
在不同极性测试体系中,对探针IAN进行光谱测试发现,IAN的吸光度不随极性的变化而变化。但与探针IA不同的是,随着极性的增大,探针IAN吸收峰从480 nm明显蓝移到420 nm(图4)。与此同时,IAN的荧光发射峰也从552 nm明显蓝移到474 nm(图5(a))。通过计算不同极性条件下探针在λ=474 nm和λ=552 nm处荧光强度的比值(I474 nm/I552 nm)可知,在Δf=0.124~0.316时,探针I474 nm/I552 nm值随着测试溶液极性的升高而增加(图5(b))。
图4 探针IAN在不同体积比的水和1, 4-二氧六环混合溶剂中的吸收光谱
Fig.4 UV-Vis absorption spectra of fluorescent probe IAN in the mixtures of H2O and 1,4-dioxane with different volume ratios
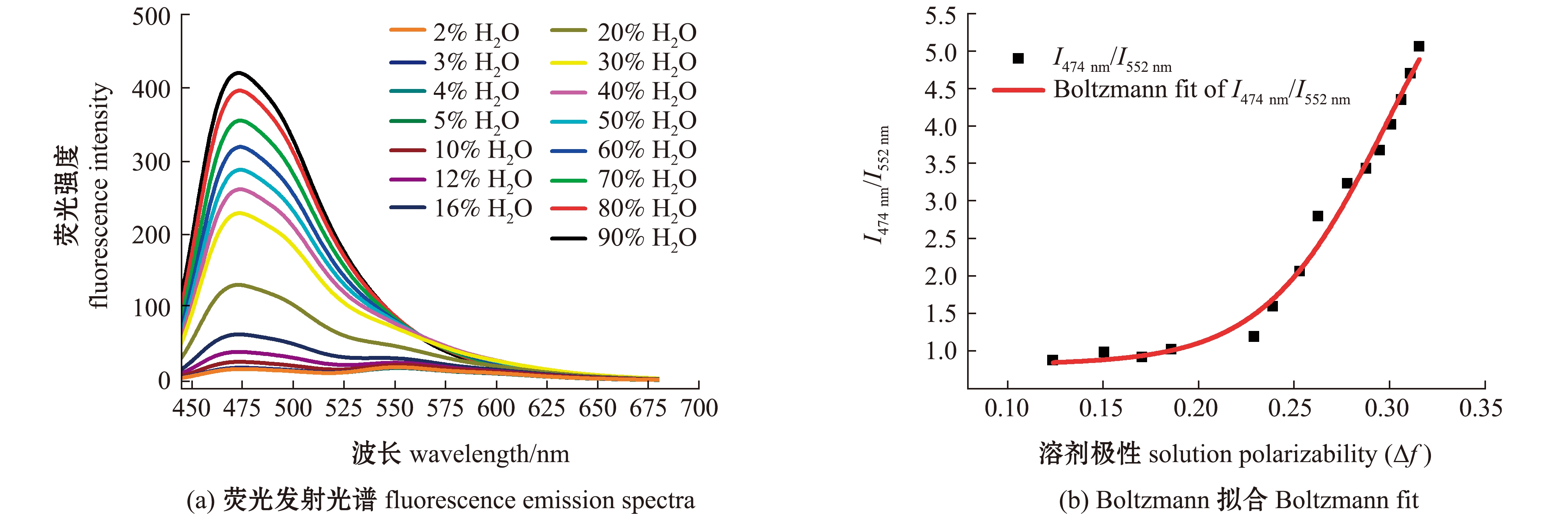
图5 探针IAN在不同体积比的水和1,4-二氧六环混合溶剂中的荧光发射光谱及I474 nm/I552 nm与Δf的Boltzmann拟合
Fig.5 Fluorescence emission spectra and Boltzmann fit of I474 nm/I552 nm versus Δf of fluorescent probe IAN in the mixtures of H2O and 1,4-dioxane with different volume ratios
2.4 不同极性溶剂对探针IAN光物理参数的影响
为分析探针IAN产生双吸收和双荧光发射峰的原因,对荧光探针IAN光物理参数随极性变化的规律进行测定。在单一溶剂中,随着测试溶剂极性的增强,探针IAN的吸收峰位于480 nm左右;当溶剂极性继续增加,即Δf>0.260时,探针IAN的吸收峰波长蓝移到420 nm附近,同时荧光发射峰波长也从550 nm附近蓝移到480 nm附近(表1)。
表1 探针IAN在单一极性溶剂中的吸收和荧光发射波长
Tab.1 Absorption and fluorescence emission wavelengths of fluorescent probe IAN in single solvents
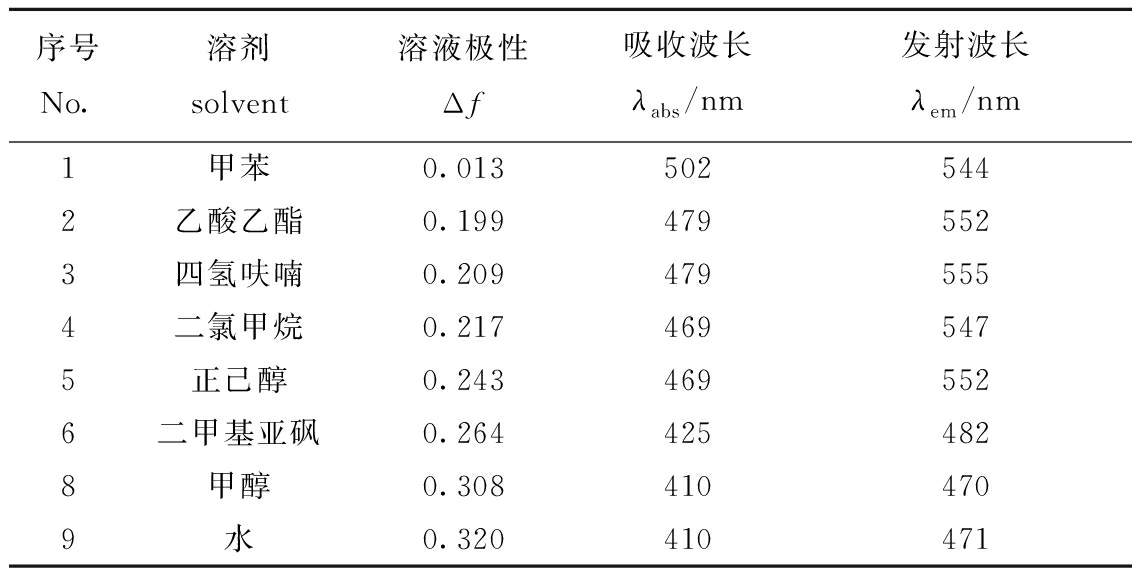
序号No.溶剂solvent溶液极性Δf吸收波长λabs/nm发射波长λem/nm1甲苯0.0135025442乙酸乙酯0.1994795523四氢呋喃0.2094795554二氯甲烷0.2174695475正己醇0.2434695526二甲基亚砜0.2644254828甲醇0.3084104709水0.320410471
将探针IAN溶解在水和1,4-二氧六环两相溶剂的混合体系中,当溶剂极性较低(Δf<0.260)时,探针IAN的吸收峰、荧光发射峰分别位于480、552 nm;随着两相混合溶剂中水含量的增加,溶剂极性不断增强,探针位于552 nm发射峰的荧光量子产率和荧光寿命不断降低;当溶剂极性较高(Δf≥0.260)时,探针IAN的吸收峰、荧光发射峰分别蓝移到420、474 nm;随着溶剂极性的上升,探针的荧光强度不断增强,同时伴有探针荧光量子产率Φf和荧光寿命τ的增加(表2)。
表2 荧光探针IAN在不同极性混合溶剂中的光物理数据
Tab.2 Photophysical data of fluorescent probe IAN in mixed solvents with different polarity
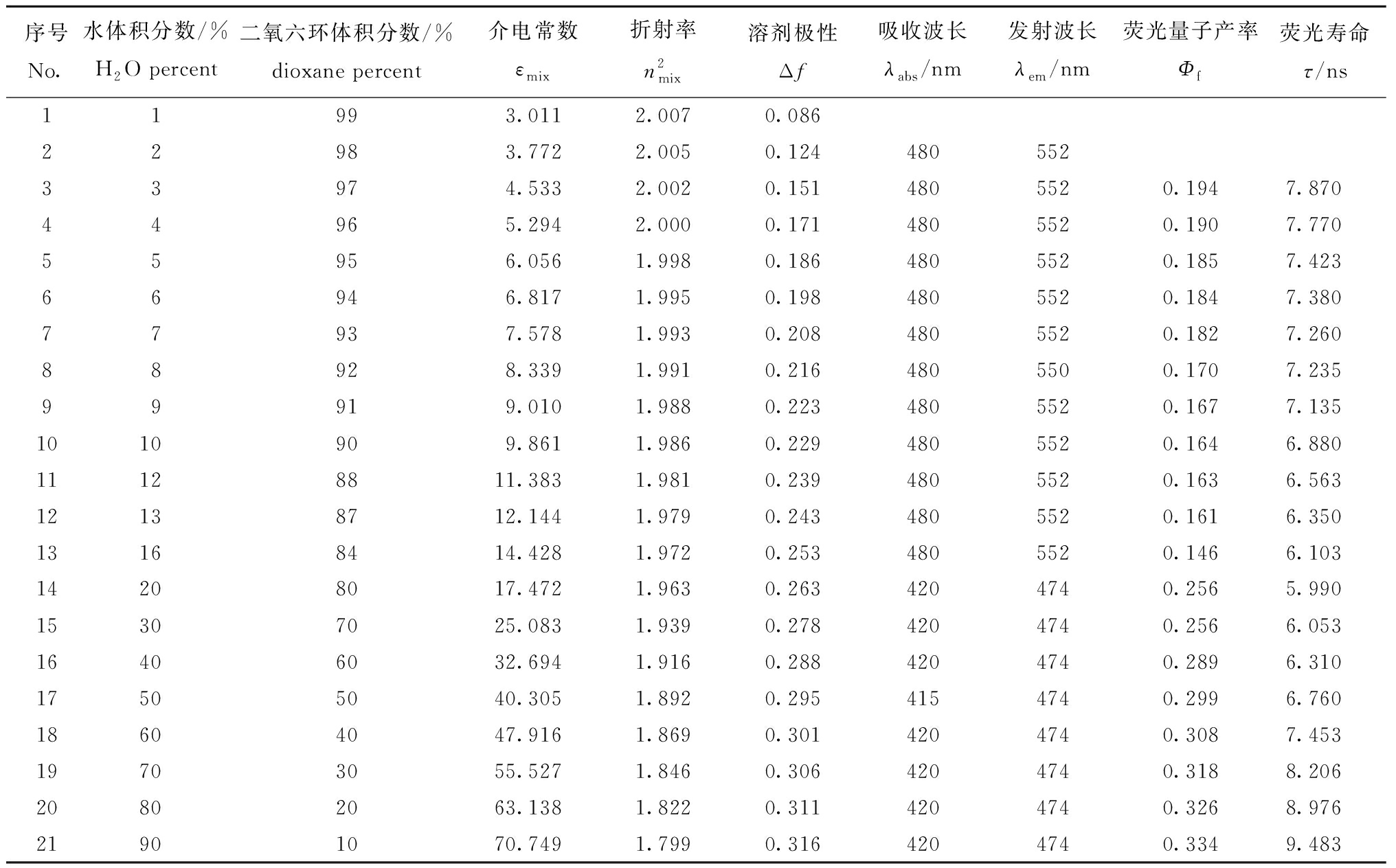
序号No.水体积分数/%H2O percent二氧六环体积分数/%dioxane percent介电常数εmix折射率n2mix溶剂极性Δf吸收波长λabs/nm发射波长λem/nm荧光量子产率Φf荧光寿命τ/ns11993.0112.0070.08622983.7722.0050.12448055233974.5332.0020.1514805520.1947.870 44965.2942.0000.1714805520.1907.77055956.0561.9980.1864805520.1857.42366946.8171.9950.1984805520.1847.38077937.5781.9930.2084805520.1827.26088928.3391.9910.2164805500.1707.23599919.0101.9880.2234805520.1677.1351010909.8611.9860.2294805520.1646.88011128811.3831.9810.2394805520.1636.56312138712.1441.9790.2434805520.1616.35013168414.4281.9720.2534805520.1466.10314208017.4721.9630.2634204740.2565.99015307025.0831.9390.2784204740.2566.05316406032.6941.9160.2884204740.2896.31017505040.3051.8920.2954154740.2996.76018604047.9161.8690.3014204740.3087.45319703055.5271.8460.3064204740.3188.20620802063.1381.8220.3114204740.3268.97621901070.7491.7990.3164204740.3349.483
2.5 探针IAN溶剂极性特异响应特性的判定
从图6可见:当单相溶剂(或两相混合溶剂)极性Δf为0.000~0.250时,探针IAN的Stokes’位移与测试体系极性间的关系可通过线性函数Linear fit 1进行拟合;当单相溶剂(或两相混合溶剂)极性Δf为0.250~0.350时,探针IAN的Stokes’位移与测试体系极性间的关系可通过线性函数Linear fit 2进行拟合。可见,探针IAN的Stokes’位移在测试体系极性Δf处于0.260左右时产生明显的变化,此结果与探针IAN吸收峰、荧光发射峰在Δf处于0.260附近时产生明显移动的结果一致。
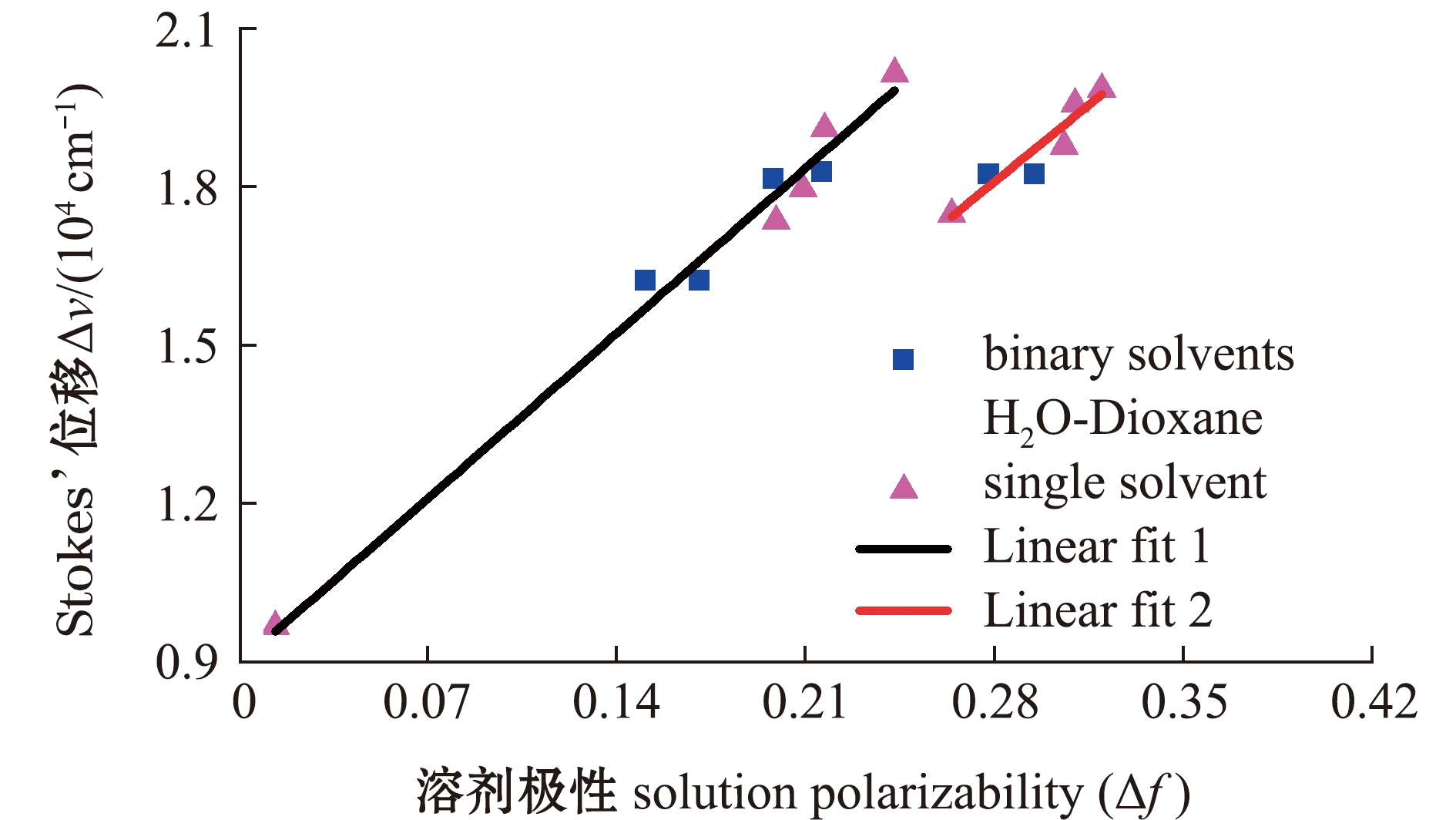
图6 探针IAN在不同极性溶剂中的Stokes’位移与溶剂极性的线性拟合
Fig.6 Linear fit of Stokes’ shift versus the solution polarity for fluorescent probe IAN
探针IAN的Δf和Δν数据点可以被线性拟合,表明溶剂与溶质之间的相互作用为一般溶剂化效应,不存在如分子间氢键作用等特殊溶剂化效应。
而由Linear fit 1与Linear fit 2的斜率不同,可以推测出:当测试体系极性Δf在0.260附近时,探针IAN分子基态、激发态偶极矩差值(μe-μg)发生改变,再次证明了探针分子IAN随着溶剂极性的变化存在两种分子跃迁路径。
2.6 探针IAN对小鼠和珍珠龙胆石斑鱼组织检测的应用
应用共聚焦显微镜对小鼠各组织染色切片进行3D荧光成像(λem=460~500 nm),结果显示,小鼠的心脏和肾脏组织切片荧光最强,肝脏组织切片荧光强度次之,脾脏和肺部组织切片荧光强度稍弱,而肿瘤切片荧光强度最弱(图7)。
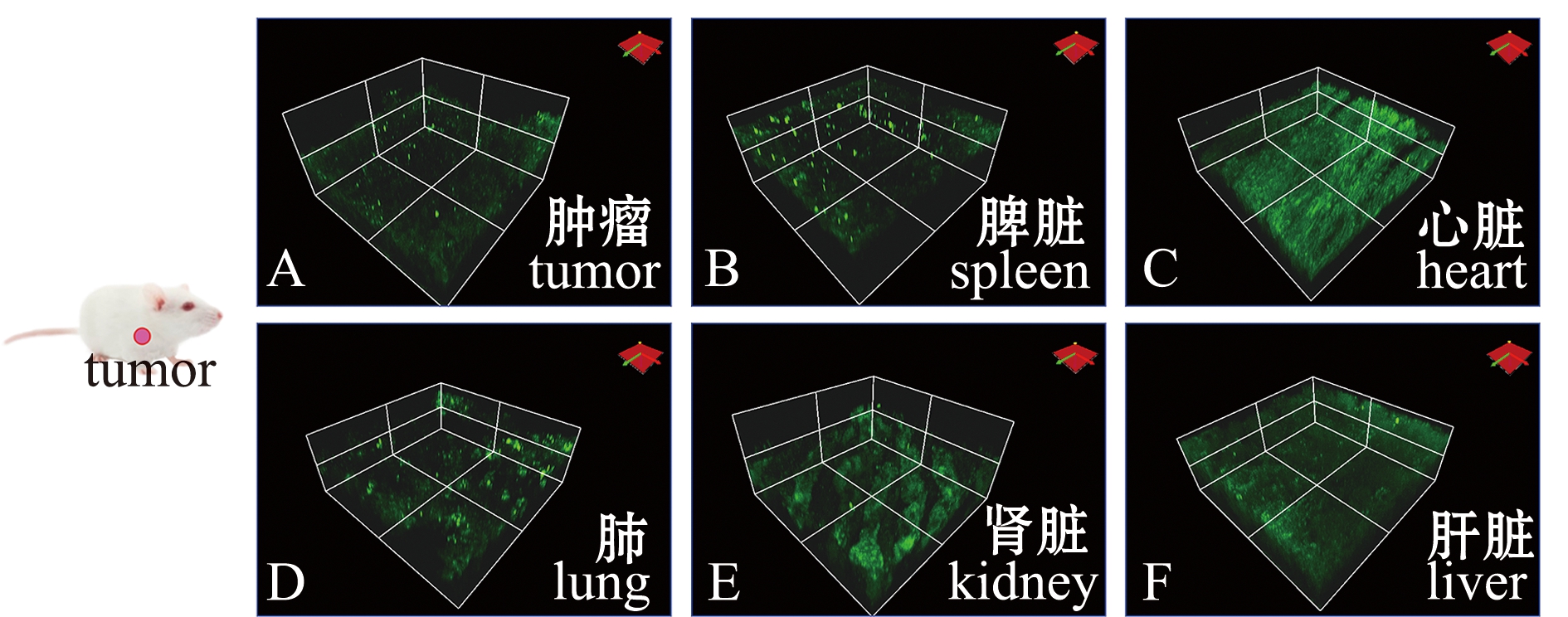
图7 荧光探针IAN在小鼠不同组织中的3D荧光成像图
Fig.7 3D fluorescence images of fluorescent probe IAN in different tissues of mice
利用探针IAN对健康和患有肝胆综合症的珍珠龙胆石斑鱼肝组织进行检测,结果显示,病变肝组织的荧光强度比值极显著低于健康肝组织(P<0.01)(图8),这表明IAN可有效地识别健康和病变组织,在鱼病的诊断方面具有潜在的应用价值。
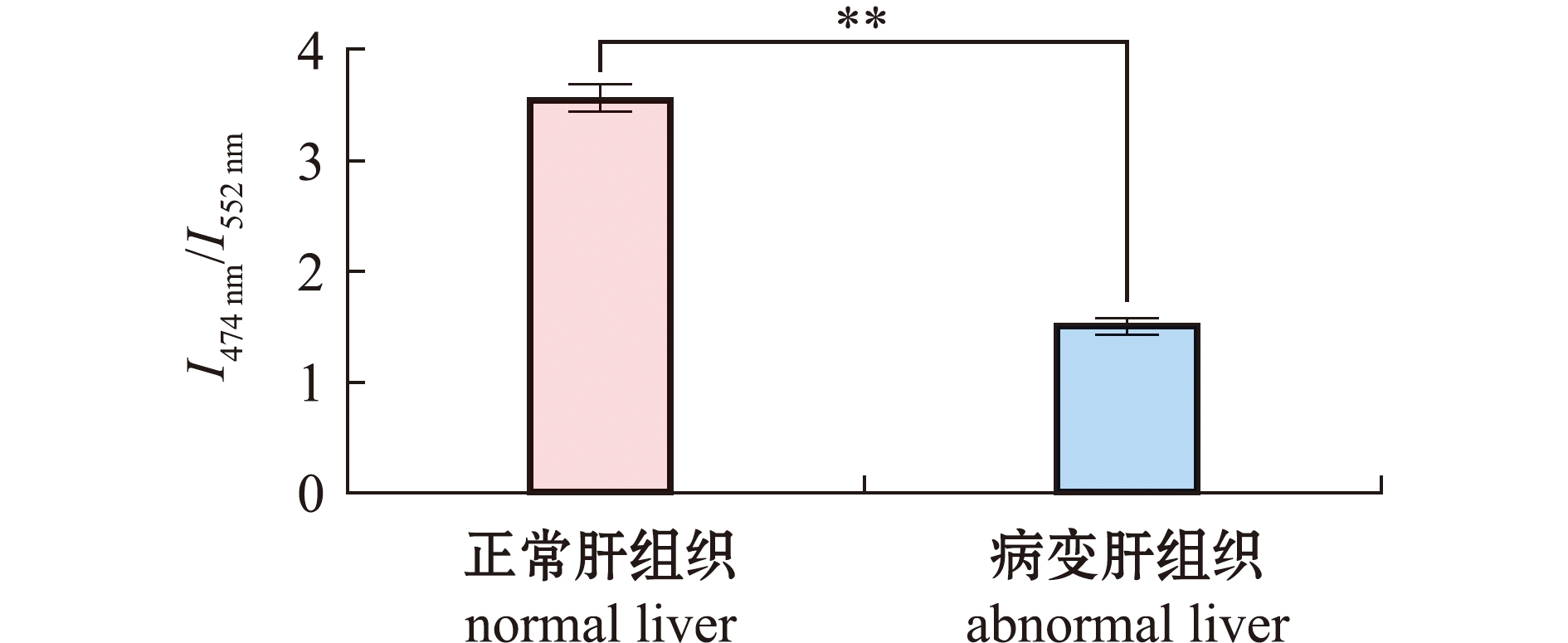
**表示有极显著性差异(P<0.01)。
** means very significant difference(P<0.01).
图8 荧光探针IAN对珍珠龙胆石斑鱼肝组织的检测
Fig.8 Detection of hybrid grouper liver with fluorescent probe IAN
3 讨论
3.1 极性响应型荧光探针的构建方法
细胞极性是很多细胞重要活动的基础,也是复杂生物组织、器官形成和功能的基础[32]。虽然在化学、化工领域,针对极性的研究已经十分透彻,但由于生物微环境精细且复杂,活细胞中极性的直接测定较为困难,而极性响应型荧光探针的出现,恰好解决了这一难题。通常来说,极性响应型荧光探针一般由共轭连接体和位于两端的推电子和拉电子基团共同组成,有利于电子推拉体系形成。Xiao等[9]在2016年报道了第一例位于近红外区(NIR)的超灵敏极性荧光探针MCY-BF2,该探针由具有亲脂性侧链的花菁和双氟硼酸酯组成,其中叔胺和二氟硼酸酯基团分别作为给电子基团和吸电子基团,形成强烈的电子推-拉体系,能够产生响应极性变化的单荧光发射峰。2017年,Jiang等[33]开发了双光子溶酶体极性探针Lyso-OC,通过检测自噬过程中Lyso-OC荧光强度的变化,可对自噬小体形成后溶酶体的极性变化进行监控。然而,由于细胞微环境内荧光探针浓度、流体光学特性和实验仪器等参数波动的影响,单发射荧光探针虽然可监控极性变化,但无法准确计算生物微环境极性的确切数值。因此,亟待开展极性响应型比例荧光探针的设计、合成和构建方法的探索。
本研究中,根据探针IA荧光强度随极性增强而升高的变化规律可知,探针IA被光激发后主要产生n→π*跃迁。不同于探针IA只产生n→π*跃迁,探针IAN分子将氨基缩合成环后,增强了氮原子上的孤对电子与π体系的共轭能力,激活的探针IAN产生双吸收峰(420 nm和480 nm)和双荧光发射峰(474 nm和552 nm)。由于π→π*分子跃迁产生荧光发射峰的强度随极性升高而降低,n→π*分子跃迁荧光发射强度随极性升高而增强,探针IAN能够同时产生n→π*和π→π*分子跃迁,故IAN可作为比例荧光探针,对极性进行灵敏且准确地检测。此外,应用本研究中提出的引入氮原子进行杂环缩合进而构建极性响应型比例荧光探针的方法,可灵活引入吗啉、三苯基膦等细胞器定位基团。根据上述方法,不仅可以构建避免探针浓度、检测环境及底物和光漂白等因素影响的极性响应型比例荧光探针,还可以对特定细胞器部位进行精准定位,简便、高效且准确地对细胞器极性进行检测。
3.2 荧光探针IAN对细胞及生物组织极性的检测
近几年,大量荧光探针被应用于生物微环境内极性的检测,无论探针性能还是其生物应用,都取得了重大进展。目前,许多极性荧光探针检测范围较窄,只实现了亚细胞器层级的极性检测,难以对复杂生理、病理过程中极性的变化进行研究。2015年,Jiang等[34]开发了一例比例型荧光传感器BOB,用于线粒体极性的检测。该探针通过对正常细胞与癌细胞进行比例荧光成像,揭示了癌细胞的线粒体极性比正常细胞低这一病理现象。此外,Li等[35]也报道了一种羟基部花菁荧光探针HXPI-P,用于检测线粒体极性变化,通过进行HXPI-P比例荧光成像,可以监测到饥饿或雷帕霉素诱导线粒体自噬产生时线粒体极性减小的现象。本研究中,IA作为荧光探针,在Δf=0.124~0.301范围内,其荧光强度对极性变化产生响应;而随着极性的增大,探针IAN吸收峰从480 nm(Δf=0.124~0.253)蓝移到420 nm(Δf=0.263~0.316),其荧光发射峰也从552 nm明显蓝移到474 nm。通过对探针IAN荧光强度比值I474 nm/I552 nm与溶液极性Δf进行Boltzmann拟合发现,在Δf=0.124~0.316范围内,I474 nm/I552 nm值随着极性的升高而增加。因此,探针IAN能够作为比例荧光探针,对极性变化进行灵敏且范围广的检测。鉴于上述特性,应用IAN可以对复杂生理、病理过程中极性的变化进行监控。本研究中,根据对小鼠组织的3D荧光成像结果和探针IAN在λem=480 nm处荧光强度随极性变化规律可知,小鼠心脏和肾脏组织极性最强,肝脏、脾脏和肺部组织极性较弱,小鼠肿瘤组织极性最低。考虑到水是极性物质,因此,推测上述结果的产生是由于各器官组织含水量不同所引起的。同时,结合探针IAN荧光强度比值I474 nm/I552 nm与溶液极性大小之间的Boltzmann函数关系,对比健康和肝胆综合症病变的珍珠龙胆石斑鱼肝组织I474 nm/I552 nm的比例荧光成像结果可知,石斑鱼病变肝组织的比例荧光强度极显著低于正常肝组织。这表明,IAN可有效地识别健康和病变组织,在鱼病的诊断方面具有潜在的应用价值。
综上,本研究中合成的探针IAN,不仅可以灵敏响应细胞内极性环境的变化,进行准确便捷地实时监测,还可以探究生理、病理过程中生物组织极性的变化,期望可为日后动物疾病的诊断与治疗提供有效指导。
4 结论
1)本研究中,设计合成了以萘环为主体的极性荧光探针IA和IAN。其中,探针IA产生单一吸收峰,并具有单荧光发射峰,且探针IA荧光强度随着溶液极性升高而增强,而探针IAN不但产生双吸收、双荧光发射峰,且可以对溶液极性变化产生灵敏的比例荧光响应。
2)本研究中,引入氮原子进行杂环缩合进而构建极性响应型比例荧光探针的方法,不但可以构建避免探针浓度、检测环境、底物和光漂白等因素影响的极性响应型比例荧光探针,还可以对特定细胞器部位进行精准定位,简便、高效且准确地对细胞器极性进行检测。
[1] REICHARDT C.Solvatochromic dyes as solvent polarity indicators[J].Chemical Reviews,1994,94(8):2319-2358.
[2] 叶云,姚翠霞,李函,等.溶剂效应对3-氨基苯甲酸吸收与发射光谱性质的影响[J].沈阳师范大学学报(自然科学版),2021,39(4):307-313.
YE Y,YAO C X,LI H,et al.Influence of solvent effect on absorption and emission spectra of 3-aminobenzoic acid[J].Journal of Shenyang Normal University(Natural Science Edition),2021,39(4):307-313.(in Chinese)
[3] YANG Z G,CAO J F,HE Y X,et al.Macro-/ micro-environment-sensitive chemosensing and biological imaging[J].Chemical Society Reviews,2014,43(13):4563-4601.
[4] ERCELEN S,KLYMCHENKO A S,DEMCHENKO A P.Ultrasensitive fluorescent probe for the hydrophobic range of solvent polarities[J].Analytica Chimica Acta,2002,464(2):273-287.
[5] HAN F,CHI L N,WU W T,et al.Environment sensitive phenothiazine dyes strongly fluorescence in protic solvents[J].Journal of Photochemistry and Photobiology A:Chemistry,2008,196(1):10-23.
[6] 高灵芝,崔京南,徐兆超,等.新型苊并吡嗪类高灵敏度极性探针[J].中国科技论文,2012,7(9):697-700,706.
GAO L Z,CUI J N,XU Z C,et al.A highly sensitive polar probe derived from acenaphthopyrazine[J].China Science Paper,2012,7(9):697-700,706.(in Chinese)
[7] VELLODI A.Lysosomal storage disorders[J].British Journal of Haematology,2005,128(4):413-431.
[8] SOREGHAN B,THOMAS S N,YANG A J.Aberrant sphingomyelin/ceramide metabolic-induced neuronal endosomal/lysosomal dysfunction:potential pathological consequences in age-related neurodegeneration[J].Advanced Drug Delivery Reviews,2003,55(11):1515-1524.
[9] XIAO H B,LI P,ZHANG W,et al.An ultrasensitive near-infrared ratiometric fluorescent probe for imaging mitochondrial polarity in live cells and in vivo[J].Chemical Science,2016,7(2):1588-1593.
[10] XIAO H B,WU C C,LI P,et al.Ratiometric photoacoustic imaging of endoplasmic reticulum polarity in injured liver tissues of diabetic mice[J].Chemical Science,2017,8(10):7025-7030.
[11] YANG S H,GUO W J,SUN X H.Electrostatic association complex of a polymer capped CdTe(S) quantum dot and a small molecule dye as a robust ratiometric fluorescence probe of copper ions[J].Dyes and Pigments,2018,158:114-120.
[12] WANG Y,ZHANG L,HAN X Y,et al.Fluorescent probe for mercury ion imaging analysis:strategies and applications[J].Chemical Engineering Journal,2021,406:127166.
[13] CHEN H,SUN T,QIAO X G,et al.Red-emitting fluorescent probe for detecting hypochlorite acid in vitro and in vivo[J].Spectrochimica Acta Part A,Molecular and Biomolecular Spectroscopy,2018,204:196-202.
[14] JOSE D A,SAKLA R,SHARMA N,et al.Sensing and bioimaging of the gaseous signaling molecule hydrogen sulfide by near-infrared fluorescent probes[J].ACS Sensors,2020,5(11):3365-3391.
[15] YUAN G Q,DING H Y,PENG L P,et al.A novel fluorescent probe for ratiometric detection of formaldehyde in real food samples,living tissues and zebrafish[J].Food Chemistry,2020,331:127221.
[16] ZHANG Y M,CHEN Y C,BAI Y,et al.FRET-based fluorescent ratiometric probes for the rapid detection of endogenous hydrogen sulphide in living cells[J].The Analyst,2020,145(12):4233-4238.
[17] 卢克祥,许柳雄,钱卫国.暗适应条件下斑马鱼的光谱敏感性[J].大连海洋大学学报,2022,37(1):88-94.
LU K X,XU L X,QIAN W G.Espectral sensitivity of dark-adapted zebrafish Danio rerio[J].Journal of Dalian Ocean University,2022,37(1):88-94.(in Chinese)
[18] LIU C L,GAO X N,YUAN J L,et al.Advances in the development of fluorescence probes for cell plasma membrane imaging[J].TrAC Trends in Analytical Chemistry,2020,133:116092.
[19] CHEN X Q,LEE D,YU S,et al.In vivo near-infrared imaging and phototherapy of tumors using a cathepsin B-activated fluorescent probe[J].Biomaterials,2017,122:130-140.
[20] DE SILVA A P,GUNARATNE H Q,GUNNLAUGSSON T,et al.Signaling recognition events with fluorescent sensors and switches[J].Chemical Reviews,1997,97(5):1515-1566.
[21] FENG X,ZHANG T,LIU J T,et al.A new ratiometric fluorescent probe for rapid,sensitive and selective detection of endogenous hydrogen sulfide in mitochondria[J].Chemical Communications (Cambridge,England),2016,52(15):3131-3134.
[22] LI M,FAN J L,LI H D,et al.A ratiometric fluorescence probe for lysosomal polarity[J].Biomaterials,2018,164:98-105.
[23] NIU L Y,CHEN Y Z,ZHENG H R,et al.Design strategies of fluorescent probes for selective detection among biothiols[J].Chemical Society Reviews,2015,44(17):6143-6160.
[24] TIAN Y,JU B Z,ZHANG S F,et al.Thermoresponsive cellulose ether and its flocculation behavior for organic dye removal[J].Carbohydrate Polymers,2016,136:1209-1217.
[25] WU J S,LIU W M,GE J C,et al.New sensing mechanisms for design of fluorescent chemosensors emerging in recent years[J].Chemical Society Reviews,2011,40(7):3483-3495.
[26] YUE Y K,HUO F J,NING P,et al.Dual-site fluorescent probe for visualizing the metabolism of cys in living cells[J].Journal of the American Chemical Society,2017,139(8):3181-3185.
[27] ZENG H,ZHANG C,HUANG Y,et al.A novel ratiometric oxygen sensor based on a sextuple hydrogen-bonding self-assembly molecular heterodimer[J].Chinese Journal of Chemistry,2016,34(9):873-877.
[28] 张妍,牛承岗,曾光明,等.一种新型极性荧光探针的合成与应用[J].分析试验室,2009,28(9):28-30.
ZHANG Y,NIU C G,ZENG G M,et al.The synthesis and application of a new polar fluorescent probe[J].Chinese Journal of Analysis Laboratory,2009,28(9):28-30.(in Chinese)
[29] 褚赛,宋晓娟,焦雅文,等.基于ESIPT机理的极性敏感荧光探针的理论研究[J].聊城大学学报(自然科学版),2021,34(6):70-76.
CHU S,SONG X J,JIAO Y W,et al.Theoretical study of an excited-state intramolecular proton transfer (ESIPT) based and polarity-sensitive fluorescent probe[J].Journal of Liaocheng University(Natural Science Edition),2021,34(6):70-76.(in Chinese)
[30] 张华.现代有机波谱分析[M].北京:化学工业出版社,2005.
ZHANG H.Modern organic spectroscopy[M].Beijing:Chemical Industry Press,2005.(in Chinese)
[31] 张励国,王志利,姚凯,等.比率荧光探针的构建及应用[J].广东化工,2016,43(18):90-91.
ZHANG L G,WANG Z L,YAO K,et al.The construction and application of ratiometric fluorescent probes[J].Guangdong Chemical Industry,2016,43(18):90-91.(in Chinese)
[32] LI R,GUO J,DUAN Y,et al.Monitoring inflammation-cancer progression by cell viscosity,polarity and leucine aminopeptidase using multicolor fluorescent probe[J].Chemical Engineering Journal,2022,435:135043.
[33] JIANG J,TIAN X,XU C,et al.A two-photon fluorescent probe for real-time monitoring of autophagy by ultrasensitive detection of the change in lysosomal polarity[J].Chemical Communications,2017,53(26):3645-3648.
[34] JIANG N,FAN J,XU F,et al.Ratiometric fluorescence imaging of cellular polarity:decrease in mitochondrial polarity in cancer cells[J].Angewandte Chemie International Edition,2015,54(8):2510-2514.
[35] LI X,LI X,MA H.A near-infrared fluorescent probe reveals decreased mitochondrial polarity during mitophagy[J].Chemical Science,2020,11(6):1617-1622.