花羔红点鲑Salvelinus malma隶属于鲑形目Salmoniformes鲑科Salmonidae红点鲑属Salvelinus,又名花丽羔子,其肉质鲜美、营养价值较高[1],在中国仅分布于吉林省和黑龙江省,是一种珍稀名贵的冷水性鱼类。细鳞鲑Brachymystax lenok隶属于鲑形目Salmoniformes鲑科Salmonidae细鳞鱼属Brachymystax,又名细鳞鱼,是产于中国北方山地地区的大型名贵冷水性珍稀鱼类,属中国《国家重点保护野生动物名录》Ⅱ级保护动物[2]。目前,国内外对花羔红点鲑和细鳞鲑的研究主要集中在生物学、养殖技术、营养生理学和营养免疫学等方面,有关其肠道菌群结构方面的研究尚未见报道。
肠道微生物在宿主生长发育过程中发挥着至关重要的作用,稳定的肠道菌群结构有助于保护鱼类免受病原微生物通过肠道入侵[3],还可以促进宿主的免疫系统发育,辅助宿主营养吸收[4-5]。因此,了解鱼类肠道菌群的演替和定植过程,对鱼类肠道微生态系统平衡的调控具有重要意义。
花羔红点鲑和细鳞鲑为同科珍稀名贵冷水性鱼类,其生存环境与食性相似。近年来,长白山地区野生花羔红点鲑和细鳞鲑数量逐渐减少,长白山周边养殖场对两种鲑进行了人工繁育、养殖。两种鲑在同一流水环境下养殖,并投喂相同饲料,但其生长速度具有明显差异。本研究中,通过MiSeq 16S rRNA高通量测序方法,分析了相同养殖环境下同科不同属的花羔红点鲑和细鳞鲑肠道菌群结构及其差异,以期为调控两种鲑肠道菌群平衡,配制促进消化吸收和健康生长等功能性饲料提供参考。
1 材料与方法
1.1 材料
试验用花羔红点鲑和细鳞鲑均采自吉林省临江市金莎冷水鱼养殖场。
1.2 方法
1.2.1 样品提取 在相同养殖条件下,挑选活力较好、体表完整无伤的1+龄、2+龄花羔红点鲑各9尾,4+龄细鳞鲑9尾,用体积分数为75%的乙醇棉擦拭体表,无菌条件下取出整条肠道,再用体积分数为75%的乙醇棉擦拭肠道外壁,用灭菌手术剪剪开肠道,用解剖刀刮取肠道内容物,每3尾鱼肠道内容物混合作为1个样品。其中,花羔红点鲑1+龄3个样品分别记为HG11、HG12、HG13,2+龄3个样品分别记为HG21、HG22、HG23,4+龄细鳞鲑3个样品分别记为XL41、XL42、XL43(表1),样品于-80 ℃超低温冰箱中保存备用。
表1 样品信息
Tab.1 Sample information
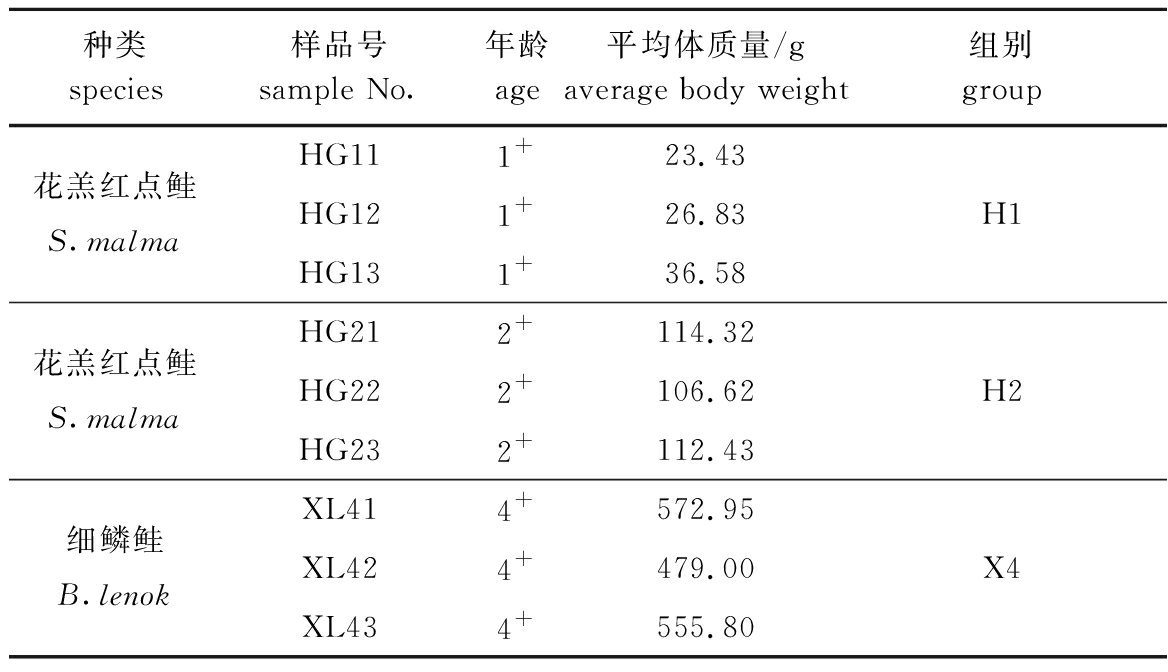
种类species样品号 sample No.年龄 age平均体质量/g average body weight组别 groupHG111+23.43花羔红点鲑S.malmaHG121+26.83H1HG131+36.58HG212+114.32花羔红点鲑S.malmaHG222+106.62H2HG232+112.43XL414+572.95细鳞鲑B.lenokXL424+479.00X4XL434+555.80
1.2.2 DNA提取及MiSeq 16S rRNA 高通量测序 按照Power Soil DNA Isolation Kit说明书提取样品DNA,用10 g/L琼脂糖凝胶电泳和分光光度法检测提取得到的DNA质量和浓度,质检合格的样品于-20 ℃下保存备用。
用引物338F(5′ACTCCTACGGGAGGCAGCAG 3′)和806R(5′GGACTACNNGGGTATCTAAT 3′)扩增细菌16Sr RNA基因的V3~V4区。使用10 g/L琼脂糖凝胶电泳检测PCR产物的目的条带大小,再用Agencourt AMPure XP核酸纯化试剂盒纯化PCR产物。用PCR产物构建微生物多样性测序文库,由北京奥维森基因科技有限公司使用Illumina Miseq PE300高通量测序平台进行Paired-end 测序。
1.3 数据处理
采用Vsearch 2.7.1软件的Uparse算法对优质序列进行OTU聚类(operational taxonomic units),相似性阈值为97%。将OTU聚类结果使用RDP Classifier算法与Silva128数据库进行比对,得到每个OTU对应的物种分类信息。再利用QIIME1 1.8.0软件进行α多样指数分析(包括Shannon、Simpson 和Chao1等指数)。基于物种注释及相对丰度结果,使用R 3.6.0软件进行物种组成柱状图分析。使用Phython 2.7软件进行LefSe分析[6]。
2 结果与分析
2.1 稀释性曲线
从图1可见,测序条数在30 000以下时,随着测序条数的增加,花羔红点鲑和细鳞鲑的肠道内容物中有大量的菌群被发现。测序条数在30 000之后,曲线基本保持平直,更多的测序数据量对发现新的OTUs贡献较小,说明此次测序结果基本覆盖了花羔红点鲑和细鳞鲑肠道内容物的菌群。
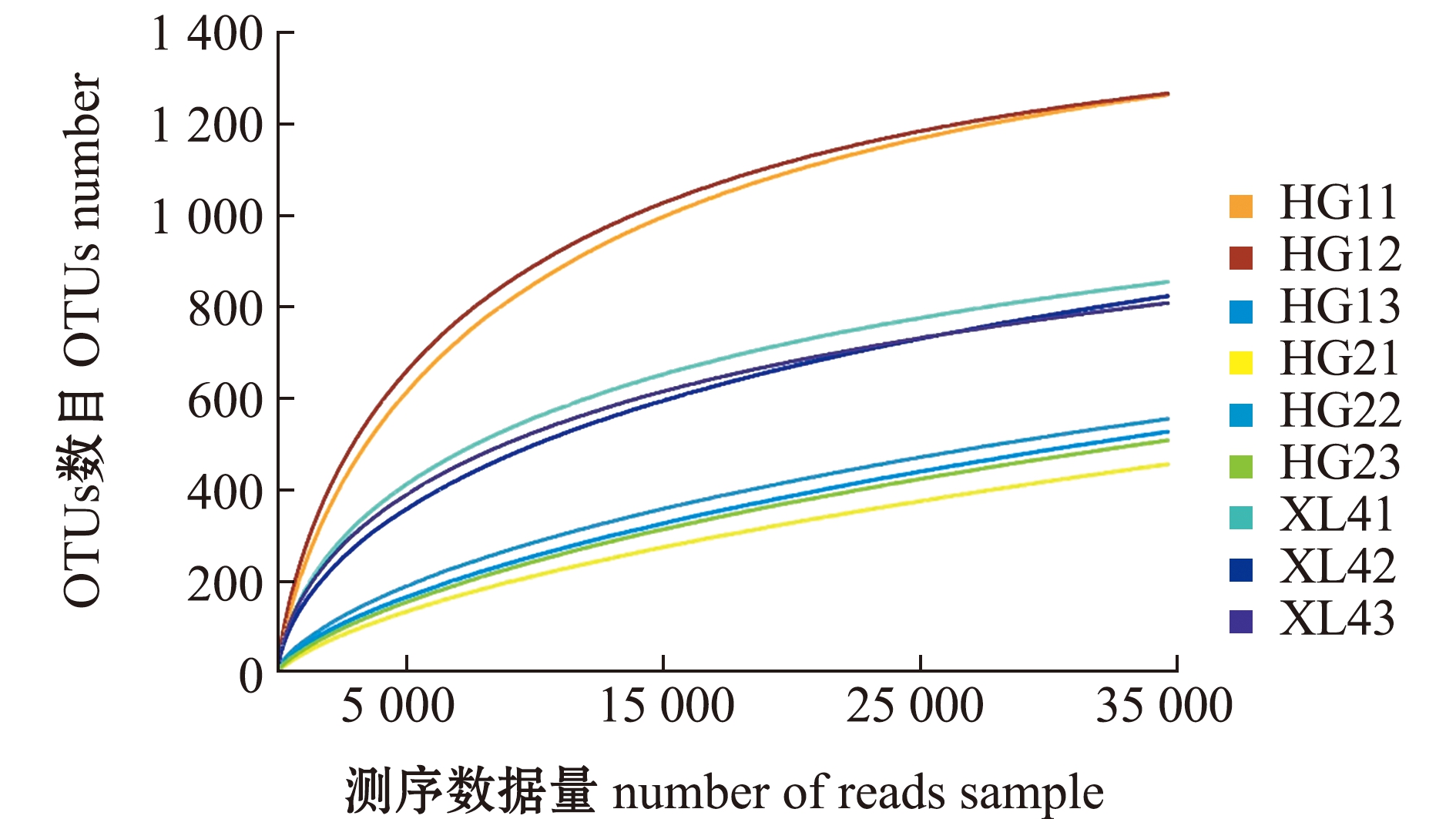
图1 样品稀释性曲线
Fig.1 Sample dilution curve
2.2 两种鲑肠道菌群多样性差异分析
从表2可见:9个样品的观测深度值均大于0.99,说明本次测序结果能够代表样本中菌群的真实情况;采用Chao1指数衡量物种丰富度差异,HG11样品中的Chao1值最大,说明其肠道内容物中菌种种类最多,HG22样品中的Chao1值最小,说明其肠道内容物中菌种种类较少;采用PD-whole-tree和Shannon指数衡量物种多样性时,HG11样品中的PD-whole-tree值最大,HG12样品中的Shannon值最大,说明HG11、HG12肠道菌群多样性较高。
表2 不同样品的Alpha多样性指数
Tab.2 Alpha diversity indices of different samples

样品号sample No.OTUs数OTUsnumber 观测深度Goods-coverage丰富度指数Chao1谱系多样性PD-whole-tree香农指数ShannonHG111 2500.990 81 405.98111.854.57HG121 2420.992 41 360.71108.856.55HG135200.991 3968.9955.541.29HG214490.992 2912.9850.721.82HG225350.991 8885.5358.031.80HG235130.991 3972.1856.271.30XL418350.992 71 021.5775.904.22XL427940.991 81 006.3275.434.96XL437920.992 61 012.2975.685.37
综合3种指数分析发现,4+龄细鳞鲑肠道中菌群多样性介于1+龄和2+龄花羔红点鲑之间。
2.3 两种鲑肠道菌群组成差异分析
从图2(a)可见:在门水平上,H1组优势菌群依次为柔膜菌门Tenericutes(占47.5%)、变形菌门Proteobacteria(占34.4%)、厚壁菌门Firmicutes(占4.1%)、螺旋菌门Spirochaetae(占3.8%)和放线菌门Actinobacteria(占2.4%);H2组优势菌群依次为柔膜菌门(占55.8%)、放线菌门(占25.6%)、变形菌门(占10.3%)、螺旋菌门(占3.8%)和厚壁菌门(占3.0%);X4组优势菌群依次为厚壁菌门(占57.3%)、变形菌门(占32.1%)、蓝藻门Cyanobacteria(占4.2%)、放线菌门(占2.2%)和柔膜菌门(占2.2%)。表明在门水平上,同种鲑优势菌群种类相同,但丰度不同;不同种鲑优势菌群种类不同,丰度亦不相同。
从图2(b)可见:在属水平上,H1组优势菌群为支原体属(占47.5%),H2组优势菌群为支原体属Mycoplasma(占55.8%),X4组优势菌群为芽孢杆菌属Bacillus(占35.9%);一些未确定的菌群在花羔红点鲑和细鳞鲑肠道中的占比仅次于优势菌群。表明在属水平上,同种鲑优势菌群种类相同,但丰度不同;不同种鲑优势菌群种类不同。
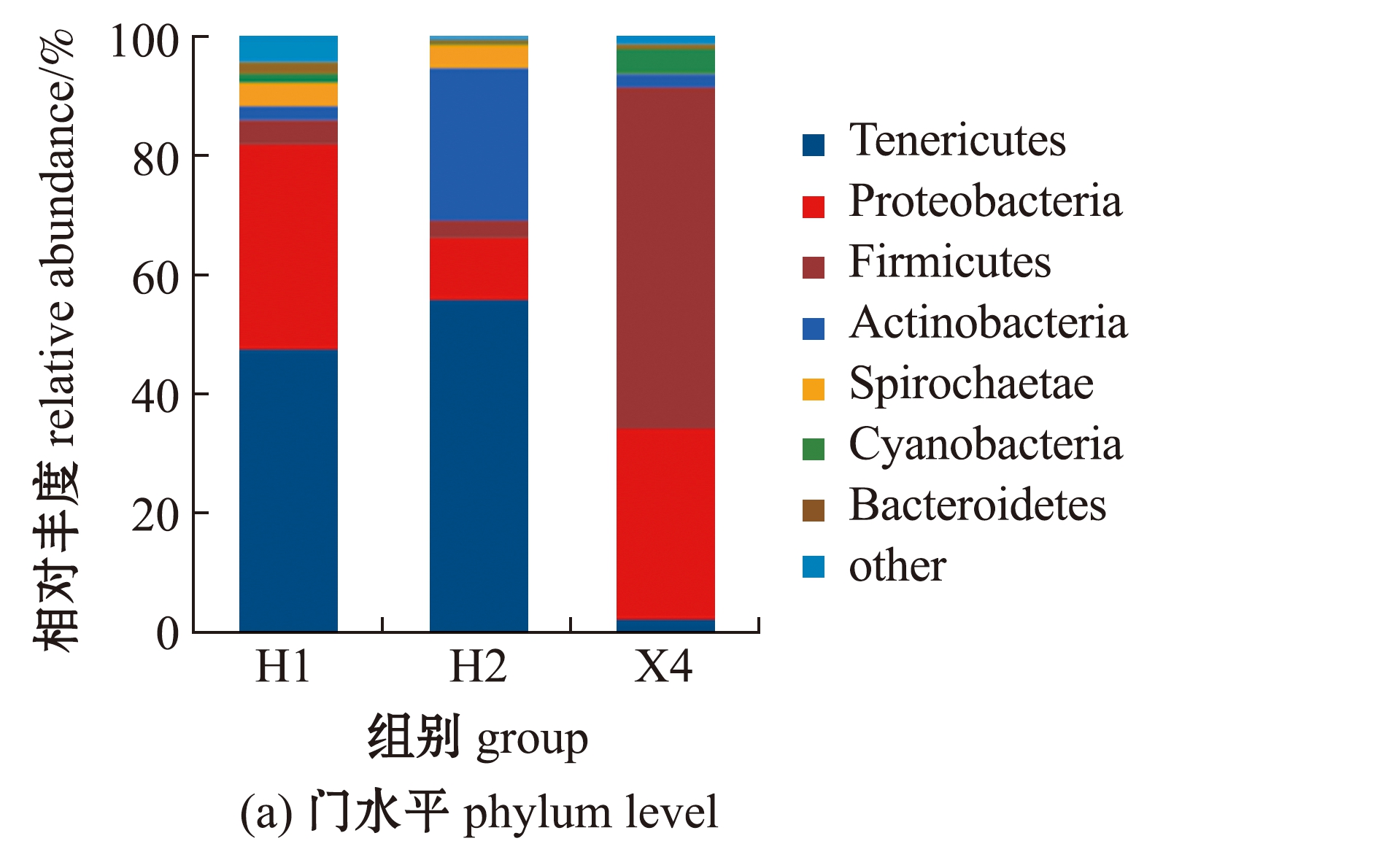

图2 各组样品门、属水平菌群组成分析
Fig.2 Analysis of the bacterial composition of samples in each group on the phylum and genus levels
2.4 PCA分析
从图3可见:第三象限板块中花羔红点鲑H1组一个样品和H2组全部样品的肠道菌群群落形成一个组群,说明这些样品肠道菌群群落结构差异较小;第四象限板块中只包含细鳞鲑X4组样品;第一象限、第二象限分别有花羔红点鲑H1组的一个样品。表明同种鱼类肠道菌群群落结构比较接近,但个体间存在差异;不同种鱼类肠道菌群群落结构存在明显差异。
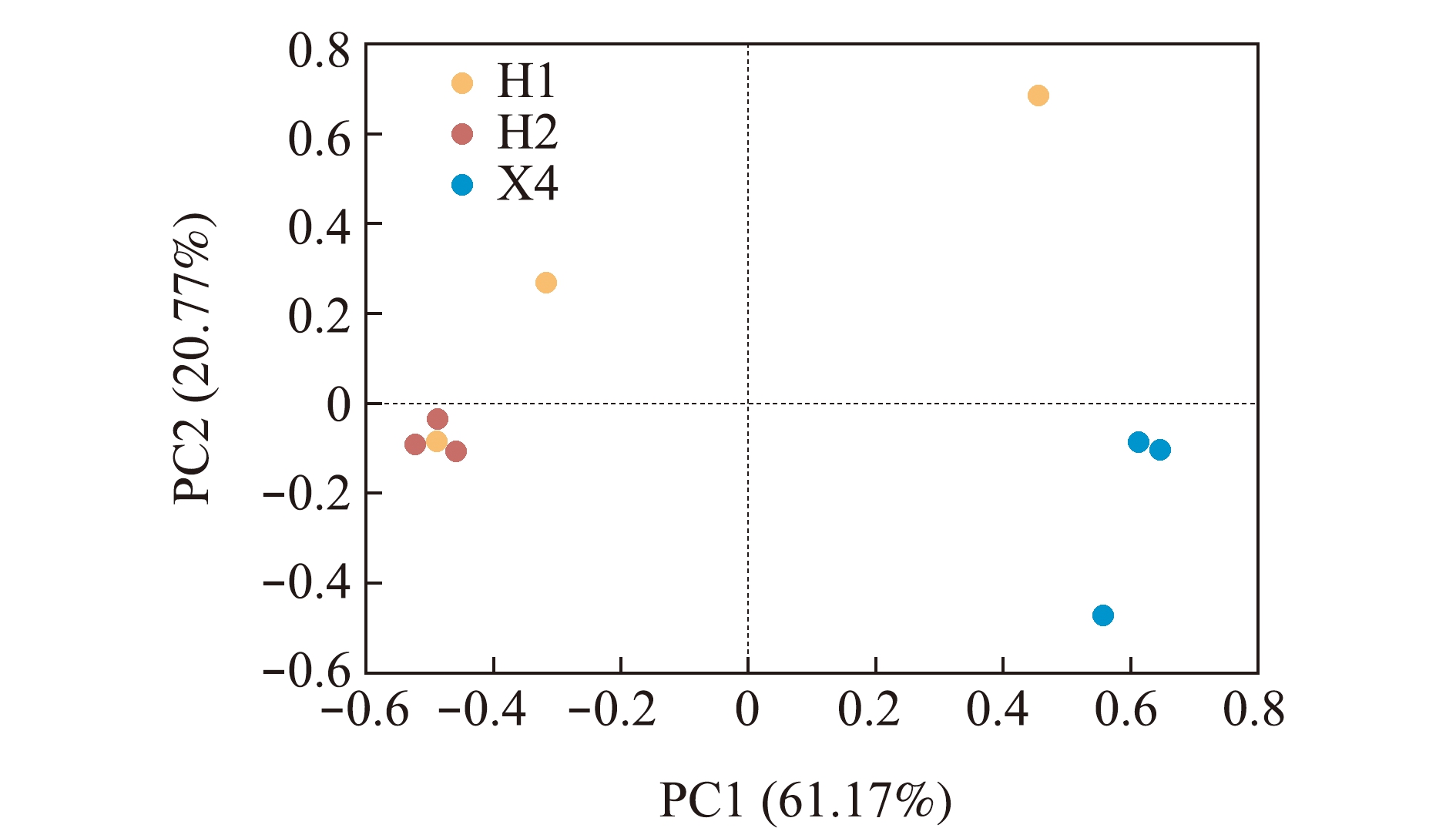
图3 PCA分析图
Fig.3 PCA analysis chart
2.5 LefSe分析
基于LefSe分析发现:Solibacteres纲、Solibacteracae subgroup 3科和JTB255 marine benthic group科菌在H1组中的丰度与H2、X4组有显著性差异(P<0.05);Firmicutes门、Bacilli纲、Sporomusa属和Sporacetigenium属菌在X4组中的丰度与H1、H2组有显著性差异(P<0.05)(图4、图5)。
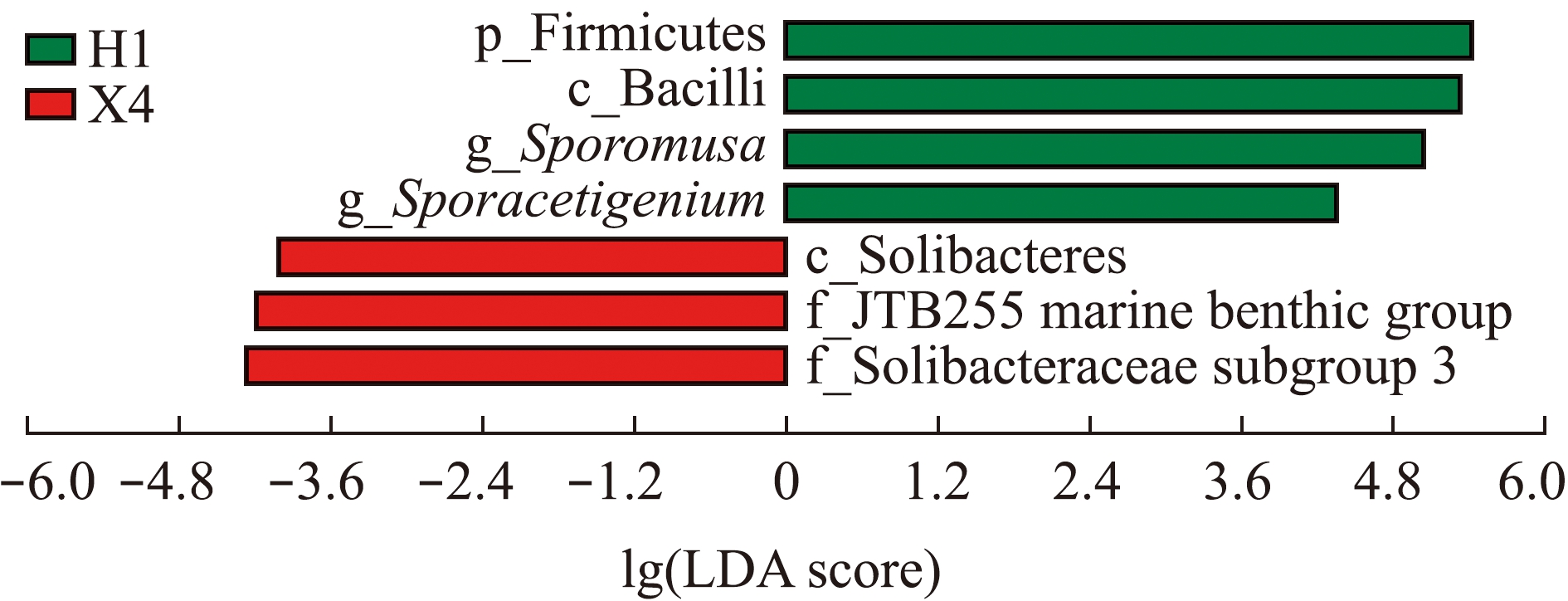
图4 基于分类信息LefSe分析的LDA分布柱状图
Fig.4 Histogram of LDA distribution based on LefSe analysis of classification information
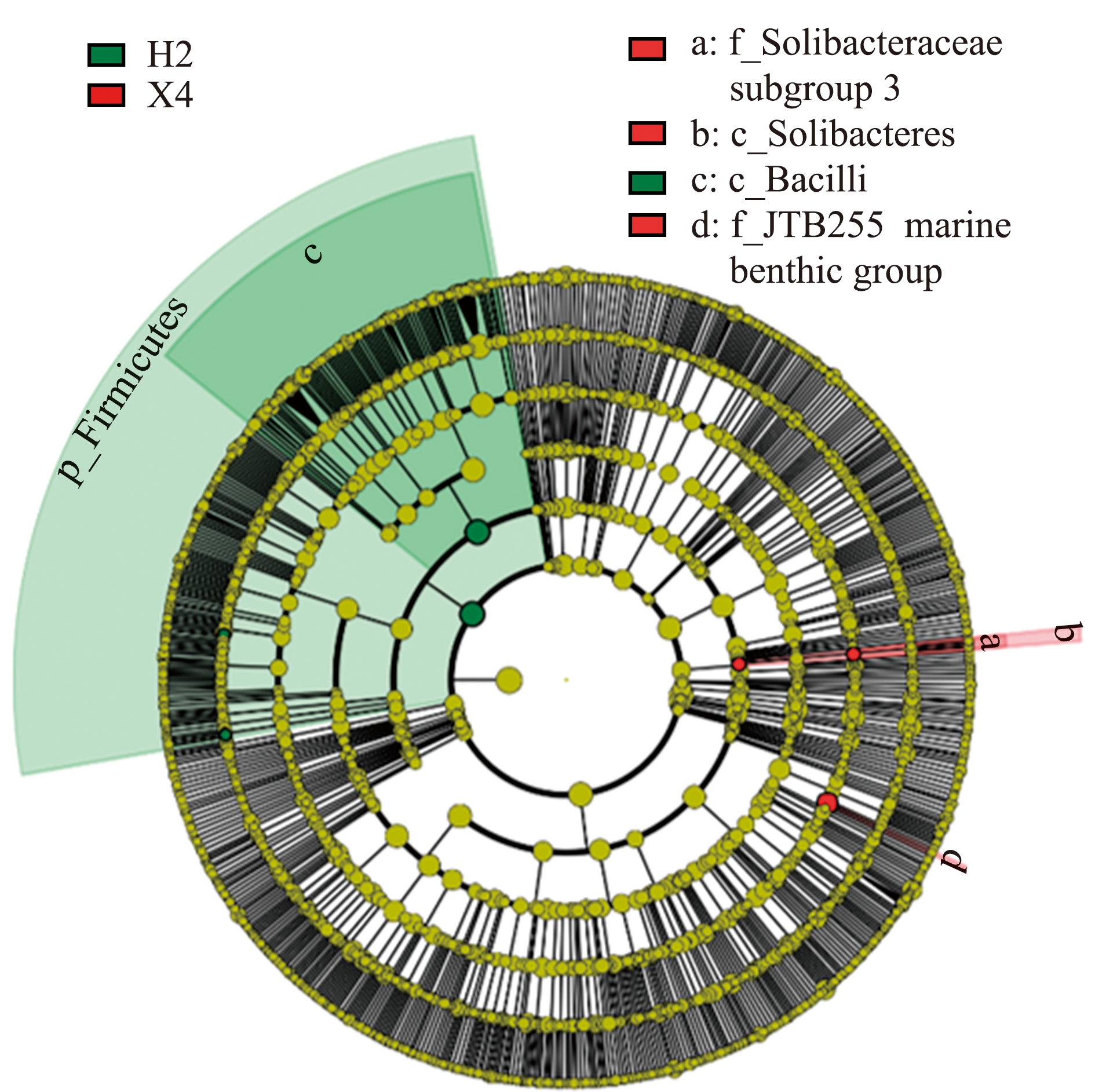
图5 基于分类信息LefSe分析的进化分枝图
Fig.5 Evolutionary branch diagram of LefSe analysis based on classification information
3 讨论
3.1 两种鲑肠道菌群种类丰度及多样性差异分析
OTU数量可反映鱼类肠道内容物菌群的丰富度。李存玉[7]对池塘养殖大菱鲆Paralichthys olivaceus肠道菌群分析发现,其肠道内容物OTU总数为367。黄丽丽等[8]对哲罗鲑Hucho taimen、细鳞鲑和黑斑狗鱼Esox reicherti 3种新疆冷水鱼肠道菌群分析发现,这3种鱼肠道内容物OTU总数为242。徐晟云等[9]对不同环境的鳢Channa maculate肠道菌群群落结构研究显示,鳢肠道内容物样品OTU总数为585。与上述鱼类相比,本研究中,花羔红点鲑和细鳞鲑OTU总数分别为3 896和1 675,表明花羔红点鲑和细鳞鲑肠道菌群物种丰富度很大,这可能是因为生存的水环境不同,导致鱼类肠道菌群的数量和群落结构不同。今后笔者将通过对养殖水环境微生物进行测序分析,了解这两种鱼肠道菌群结构与其生存水环境中微生物结构的关系。
本研究中,Alpha多样性分析发现,1+龄花羔红点鲑肠道菌群多样性高于2+龄,这可能是随着年龄增长,鱼体机能不断完善,菌群在肠道定植完成的结果。细鳞鲑肠道菌群多样性介于1+龄和2+龄花羔红点鲑之间,这可能是因为细鳞鲑与花羔红点鲑同为鲑科冷水鱼,且两种鲑取自同一养殖场,其养殖环境相同所致。也暗示了品种和养殖环境对鱼类肠道菌群多样性影响较大。
3.2 两种鲑肠道优势菌群组成差异分析
鱼类肠道中主要的细菌为变形菌门、厚壁菌门、拟杆菌门和放线菌门[10-14]。本研究中,花羔红点鲑和细鳞鲑优势菌门(厚壁菌门、变形菌门和放线菌门)均为鱼类肠道主要的细菌门类。通常情况下,淡水鱼消化道中常见的细菌属有气单胞菌属Aeromonas、邻单胞菌属Plesiomonas、肠杆菌属Enterobacter和假单胞菌属 Pseudomonas等,而海水鱼消化道中常见的则有弧菌属Vibrio、假单胞菌属和不动杆菌属Acinetobacter等[15]。本研究中,花羔红点鲑优势菌属为支原体属,细鳞鲑优势菌属为芽孢杆菌属,这与淡水鱼肠道中常见的菌群不同,表明鱼类肠道菌群结构因品种和养殖环境不同而有所差异。
在养殖大菱鲆[7]、鲢Hypophthalmichthys molitrix、鲫Carassius auratus、鲤Cyprinus carpio和草鱼Ctenopharyngodon idellus[16]肠道中均发现了芽孢杆菌属。近年来,在水产养殖业上芽孢杆菌属作为益生菌被广泛使用,其产生的消化酶可促进养殖产品的消化功能,还可分泌抑菌物质,提高养殖动物的免疫力[17]。冯雪等[18]对草鱼和异育银鲫Carassius auratus gibelio肠道产消化酶细菌的研究发现,芽孢杆菌可分泌胞外消化酶。Boonthai等[19]对黑虎虾Penaeus monodon的攻毒试验表明,芽孢杆菌能提高黑虎虾的免疫力,从而提高虾的存活率。由此可见,芽孢杆菌属在细鳞鲑体内可能有分泌胞外消化酶、提高鱼体免疫力的作用,可作为益生菌添加在细鳞鲑的人工饲料中,提高细鳞鲑的养殖效益。
支原体属是隶属于柔膜菌纲Tenericutes的革兰氏阴性菌[20-21],是能够在宿主之外进行自我复制的最小生命体,广泛存在于从植物到高等动物的各种生命体中[22]。有研究报道,在养殖及野生大马哈鱼Oncorhynchus keta肠道中首次发现支原体属菌的存在且占主要成分[23],之后在长嘴虾虎鱼Gillichthys mirabilis[24]、东海带鱼Trichiurus spp.[25]和养殖大菱鲆[26]等鱼类肠道中均发现了支原体属菌的存在。虽然过去一直认为支原体菌具有致病性,但是近年来研究发现,支原体属菌在某些鱼类中是其肠道正常菌群的一部分,并在鱼类生理和健康中发挥着未知的作用。本研究中,花羔红点鲑肠道内容物优势菌属为支原体属,但其是否具有致病性及发挥特定的作用,均需进一步研究。
3.3 两种鲑肠道菌群的群落结构差异分析
Li等[27]研究表明,相同饲养环境下,鲢、草鱼、鳙Aristichthys nobilis和团头鲂Megalobrama amblycephala 4种不同鱼类肠道主要菌群的群落结构组成差异显著。对白鲟Psephurus gladius和花鲢幼鱼的研究表明,尽管这两种鱼养殖在相同的鱼塘,且摄食相似的浮游生物,但实际检测到其肠道菌群存在种类特异性,白鲟的肠道菌群多样性明显低于花鲢[28]。本研究中发现,相同养殖环境下,不同年龄花羔红点鲑肠道菌群的群落结构总体上比较接近,但与细鳞鲑肠道菌群的群落结构有差异,这表明鱼类肠道菌群结构会随宿主种类发生变化。
本研究中,对组间丰度有显著差异的物种进行分析发现,H1组JTB255 marine benthic group科丰度显著高于其他组,X4组鼠孢菌属显著高于其他组。有研究表明,JTB255 marine benthic group是深海表层沉积物中微生物群落的普遍核心成员[29],其在花羔红点鲑中的功能尚不可知。鼠孢菌属是产乙酸型细菌属[30],田璐[31]研究盐度对黄姑鱼Nibea albiflora生存、生长、非特异性免疫及肠道菌群的影响时发现,鼠孢菌属在盐度为42试验组中的丰度显著高于对照组。这表明鼠孢菌属可能与鱼体所处水体环境的盐度有关,其在细鳞鲑中的具体作用机制有待进一步研究。
4 结论
1)相同养殖环境下,同种鱼类肠道内容物微生物菌群结构相似,不同种鱼类肠道内容物微生物菌群结构差异较大。
2)芽孢杆菌属可作为益生菌添加到细鳞鲑人工饲料中。
[1] 李虹晔.花羔红点鲑营养评价及消化功能的初步研究[D].长春:吉林农业大学,2020.
LI H Y.Preliminary study on nutrition evaluation and digestive function of Salvelinus malma[D].Changchun:Jilin Agricultural University,2020.(in Chinese)
[2] 曹永芬,李壮,焦永发.细鳞鱼和花羔红点鲑在自然与人工养殖条件下繁殖习性的比较[J].河北渔业,2015(9):41-42.
CAO Y F,LI Z,JIAO Y F.Brachymystax lenok and Salvelinus malma in nature and comparison of reproduction habits under artificial breeding conditions[J].Hebei Fisheries,2015(9):41-42.(in Chinese)
[3] WANG A R,RAN C,RINGØ E,et al.Progress in fish gastrointestinal microbiota research[J].Reviews in Aquaculture,2018,10(3):626-640.
[4] MUELLER K,ASH C,PENNISI E,et al.The gut microbiota[J].Science,2012,336(6086):1245.
[5] LLEWELLYN M S,BOUTIN S,HOSEINIFAR S H,et al.Teleost microbiomes:the state of the art in their characterization,manipulation and importance in aquaculture and fisheries[J].Frontiers in Microbiology,2014,5:207.
[6] SEGATA N,IZARD J,WALDRON L,et al.Metagenomic biomarker discovery and explanation[J].Genome Biology,2011,12(6):R60.
[7] 李存玉.池塘养殖牙鲆肠道菌群结构及其与益生菌调控的关系[D].上海:上海海洋大学,2015.
LI C Y.The structure of intestinal microflora in pond cultured Paralichthys olivaceus and its relationship with the regulation of probiotics[D].Shanghai:Shanghai Ocean University,2015.(in Chinese)
[8] 黄丽丽,张艳,周红,等.基于16S rRNA高通量测序方法比较新疆冷水鱼肠道中微生物多样性[J].食品科学,2018,39(10):138-144.
HUANG L L,ZHANG Y,ZHOU H,et al.Comparison of the microbial diversity in cold-water fishes intestine of Xinjiang by 16S rRNA high-throughput sequencing[J].Food Science,2018,39(10):138-144.(in Chinese)
[9] 徐晟云,陈昆慈,罗青,等.基于16S rRNA高通量测序的鳢肠道微生物群落结构研究[J].大连海洋大学学报,2020,35(5):693-700.
XU S Y,CHEN K C,LUO Q,et al.Microbial community in the gut of snakehead based on 16S rRNA high-throughput sequencing[J].Journal of Dalian Ocean University,2020,35(5):693-700.(in Chinese)
[10] RINGØ E,SPERSTAD S,MYKLEBUST R,et al.Characterisation of the microbiota associated with intestine of Atlantic cod (Gadus morhua L.):the effect of fish meal,standard soybean meal and a bioprocessed soybean meal[J].Aquaculture,2006,261(3):829-841.
[11] DESAI A R,LINKS M G,COLLINS S A,et al.Effects of plant-based diets on the distal gut microbiome of rainbow trout (Oncorhynchus mykiss)[J].Aquaculture,2012,350/353:134-142.
[12] CARDA-DI GUEZ M,MIRA A,FOUZ B.Pyrosequencing survey of intestinal microbiota diversity in cultured sea bass (Dicentrarchus labrax) fed functional diets[J].FEMS Microbiology Ecology,2014,87(2):451-459.
GUEZ M,MIRA A,FOUZ B.Pyrosequencing survey of intestinal microbiota diversity in cultured sea bass (Dicentrarchus labrax) fed functional diets[J].FEMS Microbiology Ecology,2014,87(2):451-459.
[13] LI X M,YAN Q Y,XIE S Q,et al.Gut microbiota contributes to the growth of fast-growing transgenic common carp (Cyprinus carpio L.)[J].PLoS One,2013,8(5):e64577.
[14] INGERSLEV H C,VON GERSDORFF JØRGENSEN L,STRUBE M L,et al.The development of the gut microbiota in rainbow trout (Oncorhynchus mykiss) is affected by first feeding and diet type[J].Aquaculture,2014,424/425:24-34.
[15] GRICE E A,KONG H H,CONLAN S,et al.Topographical and temporal diversity of the human skin microbiome[J].Science,2009,324(5931):1190-1192.
[16] 周玉法,李代军,刘东燕,等.4种常见淡水鱼肠道菌群的分析[J].中国畜牧兽医,2012,39(8):220-223.
ZHOU Y F,LI D J,LIU D Y,et al.The intestinal flora analysis of four types of common freshwater fish[J].Chinese Animal Husbandry and Veterinary Medicine,2012,39(8):220-223.(in Chinese)
[17] KONO M,MATSUI T,SHIMIZU C.Chitin-decomposing bacteria in digestive tracts of cultured red sea bream and Japanese eel[J].Nippon Suisan Gakkaishi,1987,53(2):305-310.
[18] 冯雪,吴志新,祝东梅,等.草鱼和银鲫肠道产消化酶细菌的研究[J].淡水渔业,2008,38(3):51-57.
FENG X,WU Z X,ZHU D M,et al.Study on digestive enzyme-producing bacteria from the digestive tract of Ctenopharyngodon idellus and Carassius auratus gibelio[J].Freshwater Fisheries,2008,38(3):51-57.(in Chinese)
[19] BOONTHAI T,VUTHIPHANDCHAI V,NIMRAT S.Probiotic bacteria effects on growth and bacterial composition of black tiger shrimp (Penaeus monodon)[J].Aquaculture Nutrition,2011,17(6):634-644.
[20] TAYLOR-ROBINSON D.Infections due to species of Mycoplasma and Ureaplasma:an update[J].Clinical Infectious Diseases,1996,23(4):671-684.
[21] WAITES K B.Mycoplasma and ureaplasma[M].HUTTO C.Congenital and perinatal infections.Berlin:Humana Press,2006:271-288.
[22] PAWAR K D,BANSKAR S,RANE S D,et al.Bacterial diversity in different regions of gastrointestinal tract of giant African snail (Achatina fulica)[J].Microbiologyopen,2012,1(4):415-426.
[23] HOLBEN W E,WILLIAMS P,SAARINEN M,et al.Phylogenetic analysis of intestinal microflora indicates a novel Mycoplasma phylotype in farmed and wild salmon[J].Microbial Ecology,2002,44(2):175-185.
[24] BANO N,SMITH D R,BENNETT W,et al.Dominance of mycoplasma in the guts of the long-jawed mudsucker,Gillichthys mirabilis,from five California salt marshes[J].Environmental Microbiology,2007,9(10):2636-2641.
[25] 刘铭,刘辉,李娜,等.应用高通量测序技术对我国东海带鱼肠道菌群的研究[J].生物技术进展,2020,10(2):152-157.
LIU M,LIU H,LI N,et al.Analysis of intestinal contents flora of hairtail fish (Trichiurus spp.) from the East China Sea based on high-throughput sequencing technology[J].Current Biotechnology,2020,10(2):152-157.(in Chinese)
[26] 邢孟欣.养殖大菱鲆肠道微生物多样性及功能分析[D].北京:中国科学院研究生院(海洋研究所),2013.
XING M X.Taxonomic and functional profiling of gastrointestinal tract microbiome of the farmed turbot(Scophthalmus maximus)[D].Beijing:Chinese Academy of Sciences Graduate School of Oceanography,2013.(in Chinese)
[27] LI X M,YU Y H,FENG W S,et al.Host species as a strong determinant of the intestinal microbiota of fish larvae[J].The Journal of Microbiology,2012,50(1):29-37.
[28] LI X M,ZHU Y J,YAN Q Y,et al.Do the intestinal microbiotas differ between paddlefish (Polyodon spathala) and bighead carp (Aristichthys nobilis) reared in the same pond?[J].Journal of Applied Microbiology,2014,117(5):1245-1252.
[29] DYKSMA S,BISCHOF K,FUCHS B M,et al.Ubiquitous Gammaproteobacteria dominate dark carbon fixation in coastal sediments[J].The ISME Journal,2016,10(8):1939-1953.
[30] 刘盛萍,吴晶,吴克,等.一株产电菌Nitratireductor sp.WJ5-4的筛选及产电分析[J].微生物学通报,2015,42(4):665-673.
LIU S P,WU J,WU K,et al.Isolation and characterization of an electricity-producing strain Nitratireductor sp. WJ5-4[J].Microbiology China,2015,42(4):665-673.(in Chinese)
[31] 田璐.盐度对黄姑鱼生存生长、非特异性免疫及肠道菌群的影响[D].舟山:浙江海洋大学,2019.
TIAN L.Effects of salinity on growth, nonspecific immunity and micro-organism of Nibea albiflora[D].Zhoushan:Zhejiang Ocean University,2019.(in Chinese)