西北太平洋海域宽阔,具有独特的地理位置和海流系统[1],受亲潮寒流和黑潮暖流的共同影响,为海洋生物提供了良好的生物和非生物环境,是世界上高产量的海域之一[2]。浮游动物是海洋生态系统中重要的次级生产者,是一些经济鱼类的重要食物来源[3],其数量、种类及分布特征会直接影响区域内的渔业资源丰度。浮游动物分布受纬度、温度、盐度等多重因子的综合影响[4-5]。由于西北太平洋复杂的地理环境,对其浮游动物的研究备受关注。探究西北太平洋浮游动物与环境因子间的相互关系,对掌握海洋生物资源最新分布及变化情况具有重要意义,也可为西北太平洋渔业资源的变化及浮游动物群落结构研究提供基础数据。
关于西北太平洋浮游动物的研究较多,主要集中在浮游动物纬向变化[6]、浮游动物从表面到深海的变化[7]、气候变化对浮游动物群落结构影响[8]及浮游动物生活史[9]等方面。也有部分研究探讨了浮游动物群落结构与环境因子的关系[10]。但这些研究大多集中于高纬度亲潮海区和过渡带海区,与其相比,西北太平洋中纬度海区的浮游动物信息相对较少,尤其是相关因子对浮游动物水平分布的影响研究甚少。本研究中,以2019年3月和2020年12月在该海域开展的海洋调查所获得的浮游动物数据为基础,研究了浮游动物优势种组成及影响其分布的重要因子,以期揭示西北太平洋浮游动物的群落分布特征,丰富西北太平洋浮游动物的相关研究。
1 材料与方法
1.1 调查海域及样本的采集
样本来源于2019年3月和2020年12月“淞航号”在西北太平洋海域(146°~156°E、28°~35°N)的调查结果(图1),共设置58个站位(图2)。采用标准大型浮游生物网(网长为2.8 m,网口内径为80 cm,筛绢孔径近似值为0.505 mm),从下至上垂直拖网(100 m)进行样本采集。获得的样本用中性甲醛溶液固定,甲醛溶液加入量为样品体积的5%,将样本带回实验室进行分类、鉴别、计数等工作。浮游动物样品采集按《海洋调查规范第6部分:海洋生物调查》(GB/T12763.6—2007)进行[11]。
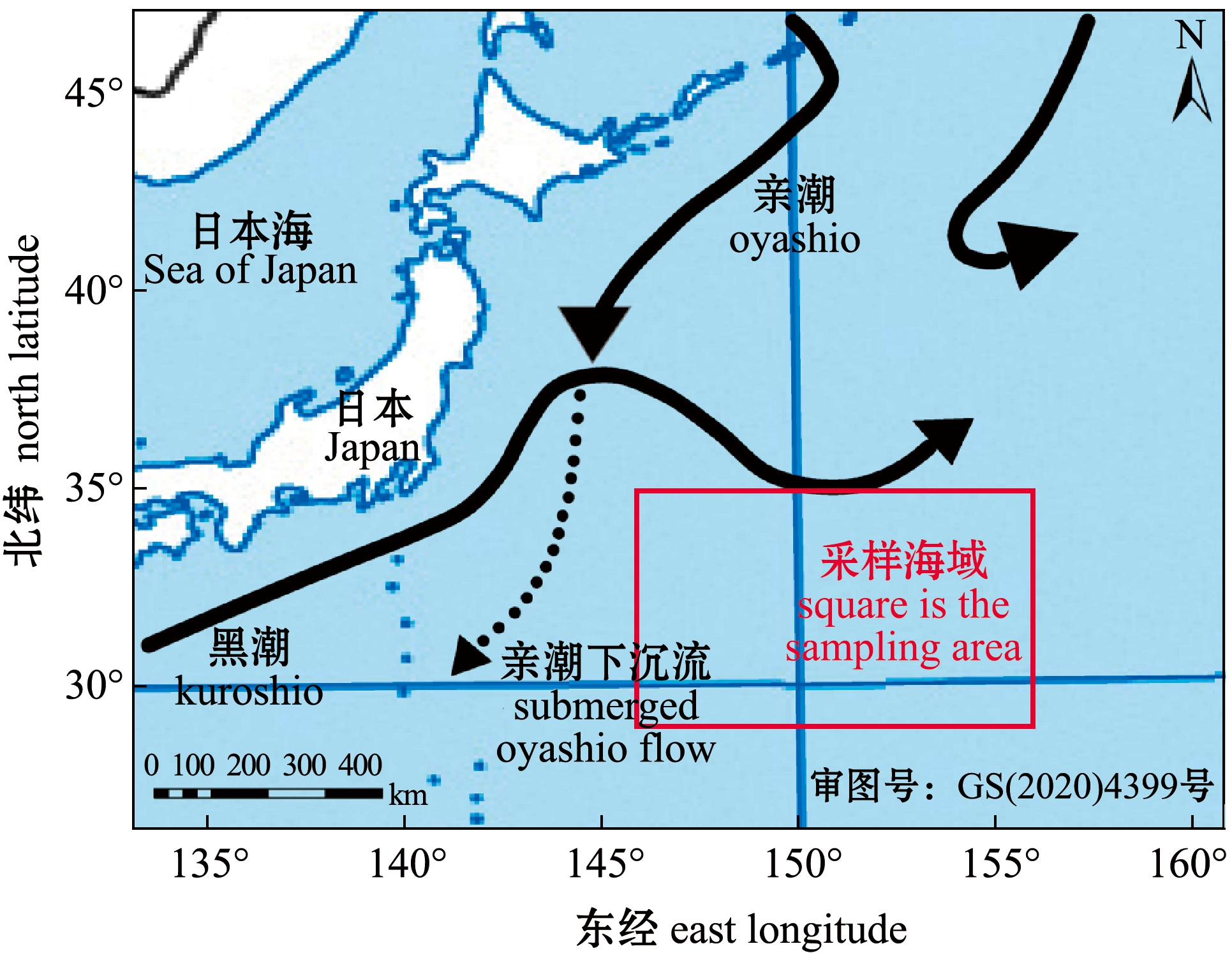
图1 西北太平洋海流图
Fig.1 Distribution of currents in the Northwest Pacific Ocean


图2 春、冬季两个航次调查站位
Fig.2 Zooplankton sampling stations during the two surveys
1.2 方法
1.2.1 丰度 浮游动物丰度为每立方水体中的个体数(ind./m3),其计算公式[12]为
nij=Nij/V。
(1)
其中:nij为第i种浮游动物在第j站点的丰度(ind./m3);Nij为第i种浮游动物在第j站点的个体数(ind.);V为滤水量(m3)。
1.2.2 优势种 根据每个种的优势度值(Y)确定浮游动物的优势种,其计算公式为
Y=(Ni/N)×fi。
(2)
其中:Ni表示第i种浮游动物的个体数(ind.);N表示浮游动物的总个体数(ind.);fi表示第i种浮游动物在总调查站位的出现频率。将Y≥0.02的种类作为优势种[13]。
1.2.3 环境数据获取 所有数据均来自Ocean Watch官方网站(https://oceanwatch.pifsc.noaa.gov/),下载获取调查时间内每天的环境数据,包括海表面温度(sea surface temperature,SST)、海表面盐度(sea surface salinity,SSS)和叶绿素浓度(Chlorophyll a,Chl-a)。
1.2.4 Pearson相关性分析和冗余分析 采用SPSS 19.0软件对浮游动物优势种分布与影响因子进行Pearson相关性分析。本研究中,影响因子包括非生物因子海表面温度、海表面盐度、经度和纬度,以及生物因子叶绿素a。对浮游动物优势种的丰度数据和环境数据进行lg(X+1)转换,使其趋于正态分布,然后对物种数据进行去趋势分析(detrended correspondence analysis,DCA)。结果表明,两个季节4个轴中梯度最大值均小于3,因此,选择线性模型RDA比较合适[14]。蒙特卡洛置换试验后,采用冗余分析(RDA)做进一步分析,研究浮游动物分布与环境因子间的相关性。采用CANOCO 4.5软件进行RDA分析、蒙特卡洛检验(Monte Carlo test)和RDA排序图绘制。
2 结果与分析
2.1 浮游动物优势种
两个航次共鉴定出浮游动物602种,其中,春季航次鉴定出456种,冬季航次鉴定出386种。共筛选出11种浮游动物优势种,属于4大类群。其中,桡足类占比较高,其次是毛颚类,群落结构以桡足类为主(表1)。
表1 西北太平洋海域浮游动物优势种及优势度
Tab.1 Dominant species and dominance of zooplankton in the Northwest Pacific Ocean
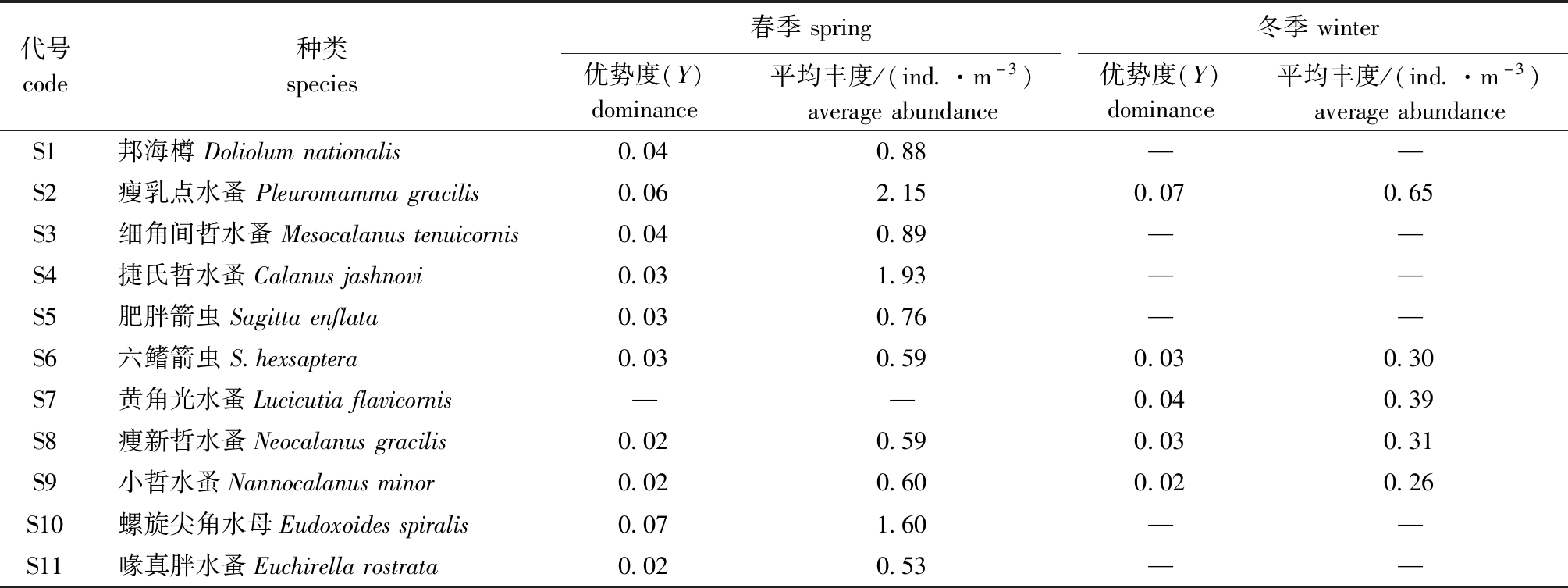
代号code种类species春季spring冬季winter优势度(Y)dominance平均丰度/(ind.·m-3)averageabundance优势度(Y)dominance平均丰度/(ind.·m-3)averageabundanceS1邦海樽Doliolumnationalis0.040.88——S2瘦乳点水蚤Pleuromammagracilis0.062.150.070.65S3细角间哲水蚤Mesocalanustenuicornis0.040.89——S4捷氏哲水蚤Calanusjashnovi0.031.93——S5肥胖箭虫Sagittaenflata0.030.76——S6六鳍箭虫S.hexsaptera0.030.590.030.30S7黄角光水蚤Lucicutiaflavicornis——0.040.39S8痩新哲水蚤Neocalanusgracilis0.020.590.030.31S9小哲水蚤Nannocalanusminor0.020.600.020.26S10螺旋尖角水母Eudoxoidesspiralis0.071.60——S11喙真胖水蚤Euchirellarostrata0.020.53——
注:—,非优势种。
Note:—,non-dominant species.
2.2 环境数据
西北太平洋春季和冬季环境因子的变化范围见表2。调查海域的盐度和叶绿素a质量浓度在不同季节较为稳定,无明显的变化;海表面温度季节变化明显,12月(冬季)海表面温度高于3月(春季),这可能是由于春季调查海域某些站点海表面温度极低,进而影响了其平均值,还有可能是海流、波浪等的影响造成了两个季节海表面温度的差异。
表2 调查期间西北太平洋海域环境因子特征
Tab.2 Characteristics of environmental factors in the Northwest Pacific Ocean during the survey period
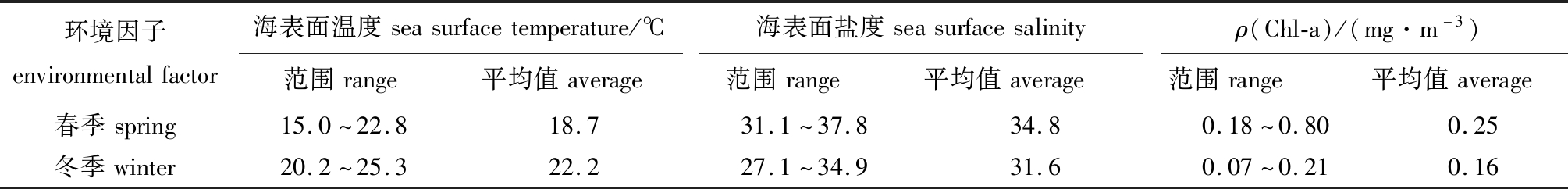
环境因子environmentalfactor海表面温度seasurfacetemperature/℃海表面盐度seasurfacesalinityρ(Chl-a)/(mg·m-3)范围range平均值average范围range平均值average范围range平均值average春季spring15.0~22.818.731.1~37.834.80.18~0.800.25冬季winter20.2~25.322.227.1~34.931.60.07~0.210.16
2.3 优势种丰度与影响因子间的关系
2.3.1 优势种的Pearson相关性分析 两个航次浮游动物优势种与影响因子间相关分析的结果见表3、表4,Pearson分析表明,影响西北太平洋海域浮游动物优势种分布的因子随季节变化而改变。春季调查海域内,邦海樽Doliolum nationalis丰度与纬度呈极显著负相关(P<0.01),与海表面温度呈极显著正相关(P<0.01),细角间哲水蚤Mesocalanus tenuicornis和螺旋尖角水母Eudoxoides spiralis丰度与纬度呈显著负相关(P<0.05),捷氏哲水蚤Calanus jashnovi丰度与纬度呈显著正相关(P<0.05);瘦乳点水蚤Pleuromamma gracilis丰度与盐度、叶绿素a呈极显著或显著正相关(P<0.01或P<0.05);经度对浮游动物优势种分布的影响较小,与各优势种间无显著相关性(P>0.05),是非限制性因子(表3)。
表3 春季浮游动物优势种与影响因子的Pearson相关性分析(相关系数)
Tab.3 Pearson correlation analysis between dominant species of zooplankton and influential factors in spring(correlation coefficients)
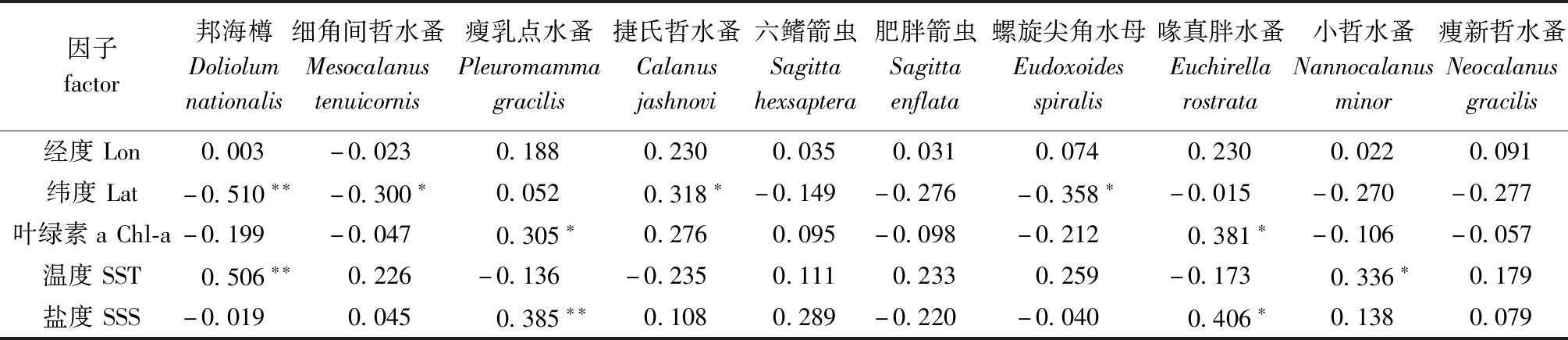
因子factor邦海樽Doliolumnationalis细角间哲水蚤Mesocalanustenuicornis瘦乳点水蚤Pleuromammagracilis捷氏哲水蚤Calanusjashnovi六鳍箭虫Sagittahexsaptera肥胖箭虫Sagittaenflata螺旋尖角水母Eudoxoidesspiralis喙真胖水蚤Euchirellarostrata小哲水蚤Nannocalanusminor痩新哲水蚤Neocalanusgracilis经度Lon0.003-0.0230.1880.2300.0350.0310.0740.2300.0220.091纬度Lat-0.510∗∗-0.300∗0.0520.318∗-0.149-0.276-0.358∗-0.015-0.270-0.277叶绿素aChl-a-0.199-0.0470.305∗0.2760.095-0.098-0.2120.381∗-0.106-0.057温度SST0.506∗∗0.226-0.136-0.2350.1110.2330.259-0.1730.336∗0.179盐度SSS-0.0190.0450.385∗∗0.1080.289-0.220-0.0400.406∗0.1380.079
注:*表示显著相关(P<0.05),**表示极显著相关(P<0.01),下同。
Note:* means significant correlations(P<0.05),**means very significant correlations(P<0.01),et sequentia.
冬季调查海域内,黄角光水蚤Neocalanus gracilis丰度与盐度呈显著的正相关(P<0.05),六鳍箭虫Sagitta hexsaptera丰度与纬度和盐度均呈显著正相关(P<0.05),痩新哲水蚤Neocalanus gracilis、小哲水蚤Nannocalanus minor和瘦乳点水蚤丰度与各环境因子无明显的相关性(P>0.05)(表4)。
表4 冬季浮游动物优势种与影响因子的Pearson相关性分析(相关系数)
Tab.4 Pearson correlation analysis between dominant zooplankton species and influential factors in winter(correlation coefficients)
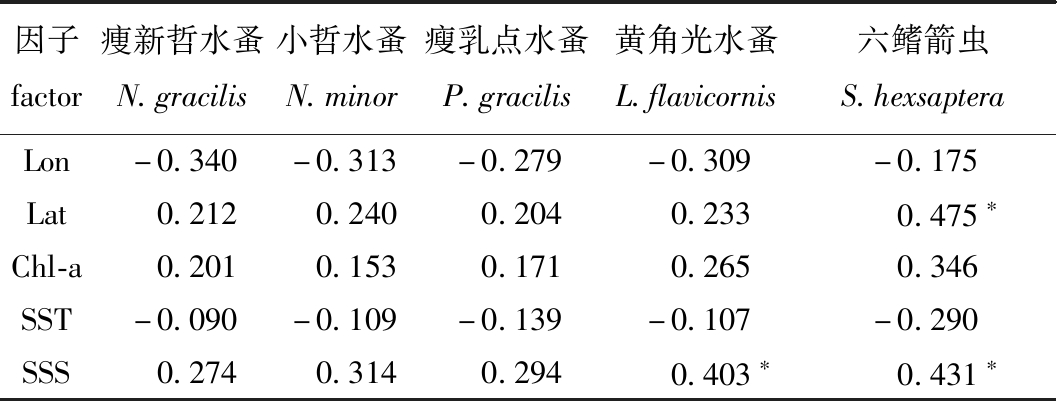
因子factor痩新哲水蚤N.gracilis小哲水蚤N.minor瘦乳点水蚤P.gracilis黄角光水蚤L.flavicornis六鳍箭虫S.hexsapteraLon-0.340-0.313-0.279-0.309-0.175Lat0.2120.2400.2040.2330.475∗Chl-a0.2010.1530.1710.2650.346SST-0.090-0.109-0.139-0.107-0.290SSS0.2740.3140.2940.403∗0.431∗
2.3.2 优势种与影响因子的RDA分析 从表5可见:对5个影响因子进行蒙特卡洛检验,春季影响优势种丰度的主要环境因子为纬度(P<0.01)和叶绿素a(P<0.05);基于RDA对优势种丰度与环境因子进行了相关性分析,第一排序轴的解释比例为11.8%,包含的物种与环境相关系数为0.696,第二排序轴的解释比例为7.1%,包含的物种与环境相关系数为0.463,前两个排序轴累计解释了18.9%的物种与环境因子间的关系;第一排序轴主要与叶绿素a(0.484)、纬度(0.562)呈正相关,其中与纬度的相关性最大。从图3(a)可知,螺旋尖角水母(S10)分布主要受海表面温度的影响,其分布与海表面温度呈正相关,邦海樽(S1)和肥胖箭虫(S5)分布也受海表面温度影响,而瘦乳点水蚤(S2)和捷氏哲水蚤(S4)则与叶绿素a浓度呈正相关。
表5 春、冬季RDA前两轴排序分析及蒙特卡洛检验结果
Tab.5 Results by RDA ordination with the first two axis and Monte Carlo test in spring and winter
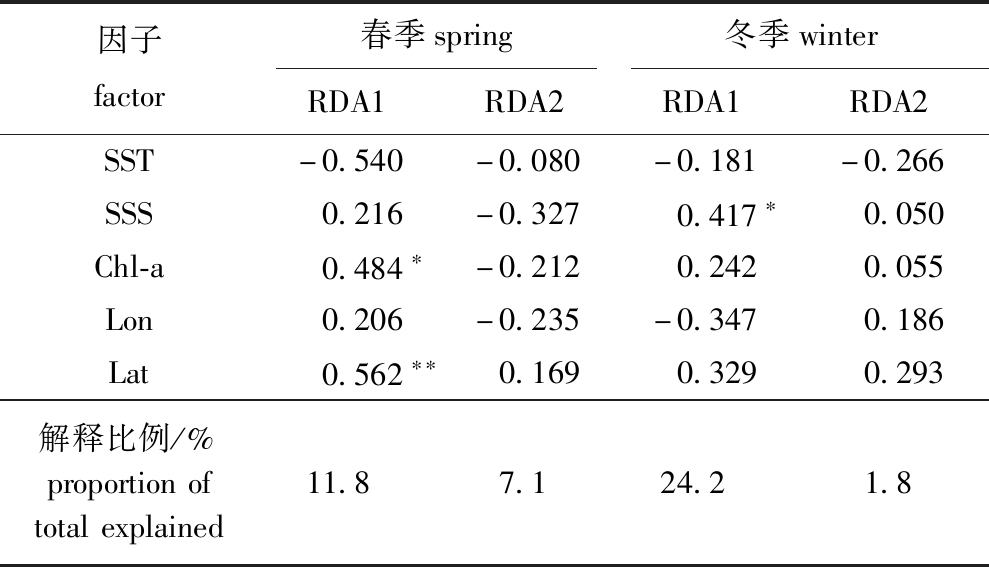
因子factor春季spring冬季winterRDA1RDA2RDA1RDA2SST-0.540-0.080-0.181-0.266SSS0.216-0.3270.417∗0.050Chl-a0.484∗-0.2120.2420.055Lon0.206-0.235-0.3470.186Lat0.562∗∗0.1690.3290.293解释比例/%proportionoftotalexplained11.87.124.21.8
冬季影响浮游动物优势种丰度的主要环境因子为盐度(P<0.05),RDA分析表明,第一排序轴的解释比例为24.2%,包含的物种与环境因子的相关系数为0.621,第二排序轴的解释比例为1.8%,包含的物种与环境因子的相关系数为0.416,前两个排序轴累计解释了26.0%的物种与环境因子间的关系(表5)。从图3(b)可知,黄角光水蚤(S7)和六鳍箭虫(S6)分布与盐度呈正相关。

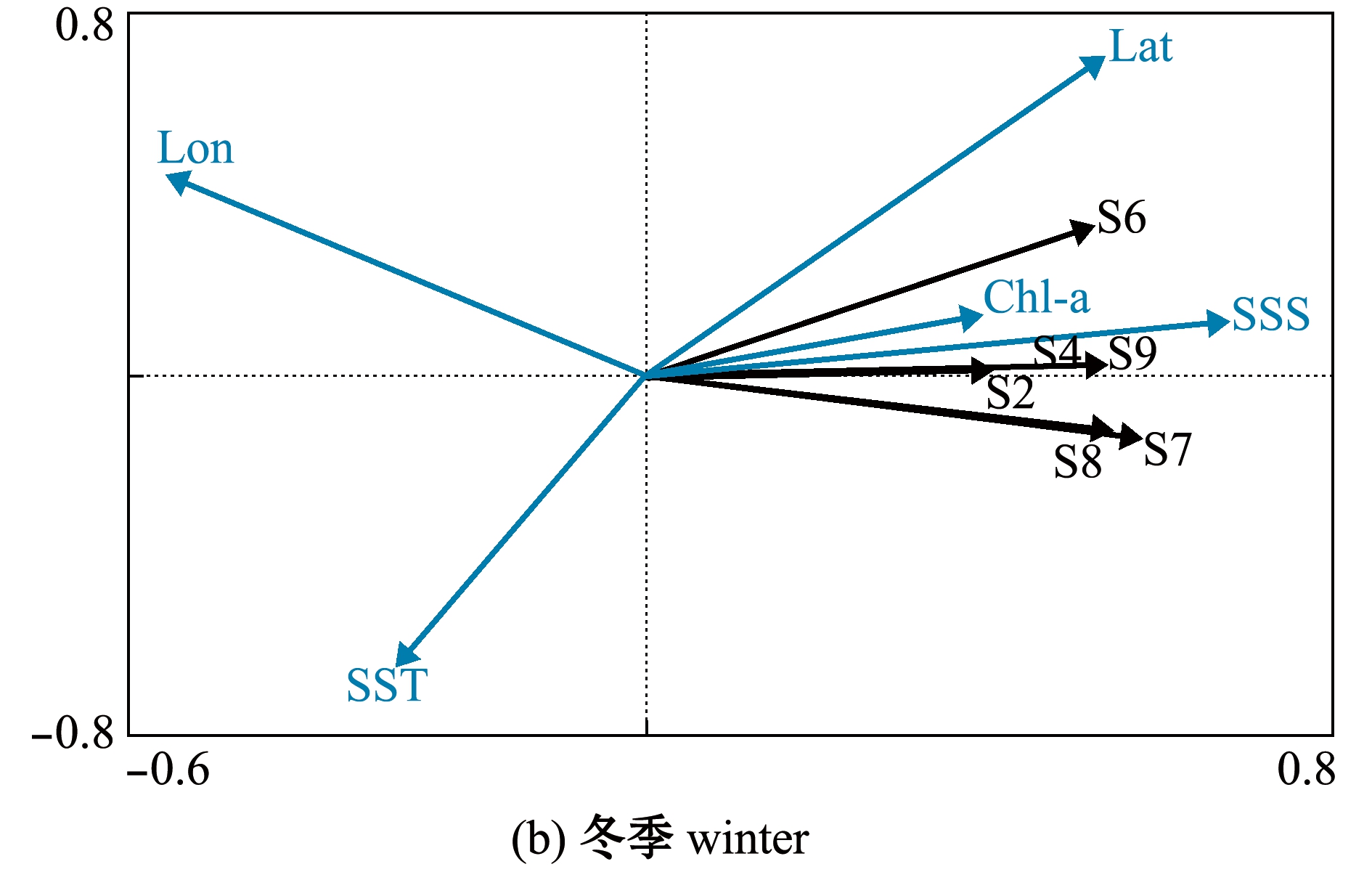
图3 春、冬季浮游动物优势种RDA排序图
Fig.3 RDA ordination graphs of the dominant species of zooplankton in spring and winter
3 讨论
3.1 调查结果与历史数据的比较
目前,对西北太平洋的研究主要集中在亲潮和黑潮-亲潮过渡带周围,而对黑潮延伸体海域的研究较少。与以往的研究结果相比,本次调查中,春、冬两个季节浮游动物丰度远低于Sun等[15]和Long等[16]的研究结果,这可能与调查过程中所使用的网具不同有关,上述两位学者均采用0.200 mm孔径筛绢浮游动物网,其孔径小于本研究中采用的0.505 mm。葛汝平等[17]对两种网型的网采集的浮游动物群落特征进行研究时发现,浅水Ⅱ型网(0.160 mm)采集浮游动物的平均丰度为浅水Ⅰ型网(0.505 mm)的56倍,浅水Ⅰ型网的筛绢孔径较大,不能有效采集小型浮游动物是造成该差异的主要原因。王亮等[18]在对冬季南黄海浮游动物群落结构进行研究时发现,大型浮游生物网的丰度最低值为0~10 ind./m3,中型浮游生物网丰度最低值为0~200 ind./m3。本研究中,春季和冬季桡足类分别占总丰度的55.8%、61.1%(表6)。桡足类是浮游动物中最重要的优势类群,分布于全球各大海域,物种多样性较高,其丰度在浮游动物中居首位,约占海洋后生浮游动物总丰度的55%~95%[19],因此,浮游动物的数量分布特征主要由桡足类决定。本研究中,春季浮游动物的种类数与Sun等[15]的研究结果较为相似,但冬季浮游动物的种类数高于Long等[16]的研究结果,这可能是由于季节不同造成浮游动物种类数有所差异。与对西北太平洋过渡带区域和亚北极区域的研究相比,关于西北太平洋亚热带海域浮游动物的资料相对较少。因此,需要更多的调查资料来充分了解该地区浮游动物的群落结构。
表6 西北太平洋浮游动物调查数据与历史数据的对比
Tab.6 Comparison of zoonplankton data in the Northwest Pacific Ocean between the present survey and the historical data
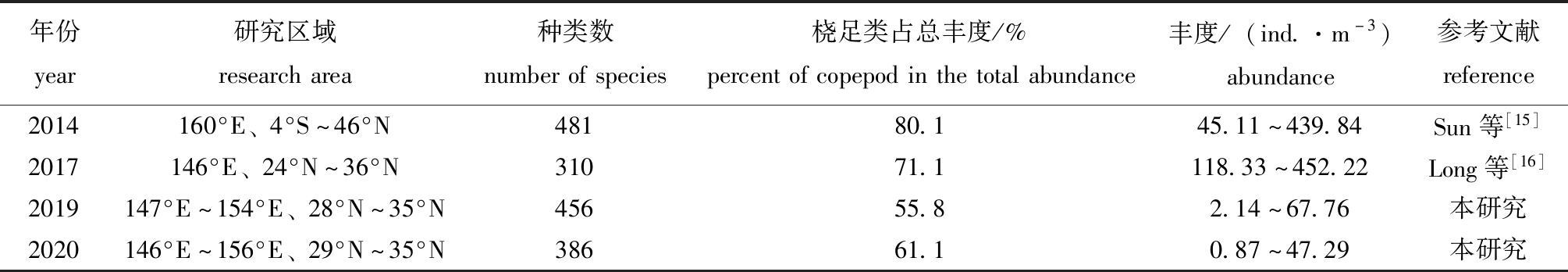
年份year研究区域researcharea种类数numberofspecies桡足类占总丰度/%percentofcopepodinthetotalabundance丰度/(ind.·m-3)abundance参考文献reference2014160°E、4°S~46°N48180.145.11~439.84Sun等[15]2017146°E、24°N~36°N31071.1118.33~452.22Long等[16]2019147°E~154°E、28°N~35°N45655.82.14~67.76本研究2020146°E~156°E、29°N~35°N38661.10.87~47.29本研究
3.2 浮游动物优势种的季节变化
本研究中发现,西北太平洋海域的浮游动物优势种分布具有明显的季节变化,一方面表现为优势种种类数量的变化,另一方面表现为优势种生态类型的更替。浮游动物种群更替受同时期浮游植物的种类组成、丰度、生物量等因素的影响[14]。春季优势种包括9种暖水种及1种温带种(捷氏哲水蚤),而冬季5种优势种则全部由热带暖水种组成。瘦乳点水蚤、六鳍箭虫、小哲水蚤和痩新哲水蚤为两个季节共有的优势种,瘦乳点水蚤作为热带暖水种的代表,在春季占据第二优势种地位,在冬季占据第一优势种地位。张武昌等[20]在对南海北部海域的浮游桡足类群落进行研究时发现,在远海深水站位瘦乳点水蚤的总丰度较大,这也进一步证明了外海瘦乳点水蚤的广泛存在。六鳍箭虫作为黑潮指示种在两个季节均作为优势种出现。由于黑潮具有暖流特征,将热带太平洋的暖水向高纬地区输送,冬季大量浮游动物暖水种在西北太平洋的出现,显示冬季调查海域有高温高盐海水进入,即证实了黑潮的存在[21]。本研究中,春季的优势种数量多于冬季,这可能与调查海域环境改变有一定的关系,不同的浮游动物具有不同的生态适应性,在温度、盐度条件适应的条件下大量繁殖,相反则抑制其生长[22]。黑潮边缘和亲潮交汇一般发生在35°~36°N,由于调查海域北端位于混合水域边缘,西北太平洋优势种的组成基本体现了影响调查海域海流的特点,笔者认为,混合水域边缘影响着浮游动物群落结构的组成。
3.3 优势种分布的影响因子
3.3.1 非生物因子 浮游动物优势种可以影响群落总丰度,重要种类的浮游动物在控制海洋生态系统的整体状况中起着关键的作用。研究优势种水平分布与环境的关系是了解浮游动物群落结构的基础。浮游动物的分布与非生物因子密切相关[23],影响浮游动物优势种水平分布的环境因子有所不同[24]。由于春、冬两季西北太平洋海洋环境发生改变,温盐适应性不同的生态类群间的比例也发生了相应的变化,两个季节优势种丰度与经度的相关性均较低。本研究中,Pearson相关性分析和RDA分析表明:纬度是影响春季浮游动物优势种分布的主要非生物因子,其他因子的影响较小;而在冬季盐度是影响优势种分布的主要因子。丁峰元等[4]研究表明,影响浮游动物分布的主要因子均可在纬度层面得到体现。许多学者的研究也表明,浮游生物群落的纬度梯度通常较为显著[25]。由于水团的交换普遍不受限制,许多海洋物种在这些地区的纬度分布较广[26]。优势种分布因环境因素而异,如捷氏哲水蚤更倾向于高纬度,而邦海樽、螺旋尖角水母、细角间水蚤更适合低纬度,这可能是由于不同的浮游动物具有不同的生长适应性。温度随着纬度的变化而不断改变,纬度越高温度就越低。本研究中,Pearson相关性分析发现,浮游动物优势种分布与温度有一定的相关性(表3),邦海樽与表温呈极显著正相关,这意味着邦海樽更喜欢高温的海洋环境,也证明了暖水表层水域有海樽类出现。在研究浮游动物空间分布与温度间的关系时发现,两者存在较好的对应关系[16],这说明温度是影响浮游动物水平分布的环境因子之一。除了温度,浮游动物的生长也与营养物质密切相关[27]。本研究表明,在春季瘦乳点水蚤与盐度相关性较强,而在冬季黄角光水蚤和瘦乳点水蚤与盐度相关性较强(表3)。Pomerleau等[28]在对太平洋海域浮游动物进行研究时也发现,优势或指示性桡足类的丰度与盐度呈正相关关系。
3.3.2 生物因子 浮游动物作为食物链的中间部分,其分布也受到竞争、捕食的影响[15]。叶绿素a是了解水体中浮游植物生物量的重要量度,在一定程度上能够反映浮游动物饵料生物的水平[29]。浮游植物丰度与浮游动物的生长繁殖密切相关[30]。Long等[16]采用CCA方法分析环境参数与优势种间的关系,将该区域浮游动物群落分为两种类型,一种与铵和溶解氧相关,另一种与营养物、叶绿素a相关。Pershing等[31]研究发现,小型桡足类和中型桡足类的变化与浮游植物丰度指标呈正相关。Sun等[15]研究表明,北太平洋副热带地区的叶绿素a平均质量浓度为0.16 mg/m3,本研究调查海域冬季(0.16 mg/m3)和春季(0.25 mg/m3)的叶绿素a质量浓度与其相似,叶绿素a浓度较低。叶绿素a浓度和浮游动物丰度间的关系与浮游动物的选择性摄食密不可分,大多数以浮游植物为食的浮游动物丰度与叶绿素a浓度呈正对应关系[32]。但也有研究发现,二者间存在良好的负对应关系,如徐兆礼等[33]研究表明,浮游植物和细菌是海樽类的主要食物来源,邦海樽丰度与叶绿素a浓度呈负相关。这可能是因为浮游动物的大量繁殖给浮游植物带来了较大的捕食压力,影响了其他优势种的生长发育。根据Longhurst等[34]研究,热带和亚热带区域被定义为太平洋信风生态区,特点是一个相对恒定的混合层深度,通常导致上层海洋营养缺乏,初级生产力较低。齐衍萍等[24]在对福建罗源湾浮游动物群落结构进行研究时发现,盐度是影响秋季罗源湾浮游动物分布的主要环境因子,而春季受叶绿素a影响较大,这与本研究结果相似。
4 结论
1)在西北太平洋海域共鉴定出浮游动物602种,其中春季456种,冬季386种。优势种从春季的10种演替成冬季的5种,黄角光水蚤是冬季新出现的优势种,瘦乳点水蚤、六鳍箭虫、痩新哲水蚤和小哲水蚤在两个季节均为主要优势种。表明西北太平洋海域浮游动物种类组成丰富,优势种随季节变化明显,其结果可以预测今后浮游动物多样性的变化,促使浮游动物种类研究向更深层次的延伸。
2)Pearson相关性分析和RDA分析研究结果一致,不仅非生物因子纬度、盐度、温度影响浮游动物的分布,生物因子叶绿素a也是影响浮游动物群落分布的因子;春季优势种分布与纬度显著相关,而冬季优势种分布则与盐度显著相关。表明浮游动物与海洋环境因子之间关系复杂,本研究结果提供了有价值的信息,为今后调查研究不同尺度浮游动物奠定了基础。
[1] HU D X,WU L X,CAI W J,et al.Pacific western boundary currents and their roles in climate[J].Nature,2015,522(7556):299-308.
[2] 晏磊.北太平洋公海秋刀鱼渔场分布特征及其环境关系[D].上海:上海海洋大学,2012:1-57.
YAN L.The relationship between the distribution of saury fishing ground and its environmental factors in the North Pacific Ocean[D].Shanghai:Shanghai Ocean University,2012:1-57.(in Chinese)
[3] 陈学超,朱丽岩,黄瑛,等.南黄海浮游动物群落结构研究[J].海洋科学,2017,41(10):41-49.
CHEN X C,ZHU L Y,HUANG Y,et al.Community structure of the zooplankton in the southern Yellow Sea[J].Marine Sciences,2017,41(10):41-49.(in Chinese)
[4] 丁峰元,李圣法,董婧,等.春季东海区近海浮游动物群落结构及其影响因子[J].海洋渔业,2005,27(1):26-32.
DING F Y,LI S F,DONG J,et al.Preliminary study on the zooplankton community structure and its influential factors in the offshore waters of the East China Sea in spring[J].Marine Fisheries,2005,27(1):26-32.(in Chinese)
[5] 张冬融,徐兆礼,徐佳奕,等.杭州湾不同水域秋季浮游动物群落结构及其影响因素[J].应用生态学报,2015,26(9):2859-2866.
ZHANG D R,XU Z L,XU J Y,et al.Zooplankton community structure in relation to influencing factors in different parts of Hangzhou Bay in autumn[J].Chinese Journal of Applied Ecology,2015,26(9):2859-2866.(in Chinese)
[6] YAMAGUCHI A,WATANABE Y,ISHIDA H,et al.Latitudinal differences in the planktonic biomass and community structure down to the greater depths in the Western North Pacific[J].Journal of Oceanography,2004,60(4):773-787.
[7] PUELLES FD,GAZ M,CABANELLAS-REBOREDO M,et al.Zooplankton abundance and diversity in the tropical and subtropical ocean[J].Diversity,2019,11(11):203.
M,CABANELLAS-REBOREDO M,et al.Zooplankton abundance and diversity in the tropical and subtropical ocean[J].Diversity,2019,11(11):203.
[8] HIDAKA K,NAKATA K.Interannual variations of the planktonic ecosystem in the slope water and Kuroshio south of Japan in February in the years 1990-2002[J].Journal of Oceanography,2010,66(6):741-753.
[9] TSUDA A,SAITO H,KASAI H.Life histories of Neocalanus flemingeri and Neocalanus plumchrus (Calanoida:Copepoda) in the western subarctic Pacific[J].Marine Biology,1999,135(3):533-544.
[10] CHIBA S,BATTEN S D,YOSHIKI T,et al.Temperature and zooplankton size structure:climate control and basin-scale comparison in the North Pacific[J].Ecology and Evolution,2015,5(4):968-978.
[11] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 12763.6—2007海洋调查规范第6部分:海洋生物调查[S].北京:中国标准出版社,2008.
General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,China National Standardization Administration Committee.GB/T 12763.6—2007 Specifications for marine survey part 6:Marine biological survey[S].Beijing:Standards Press of China,2008.
[12] 张亮,宋春丽,王岚,等.日照港岚山港区附近海域秋季浮游动物群落结构特征[J].广西科学,2020,27(2):203-210.
ZHANG L,SONG C L,WANG L,et al.Community structure characteristics of zooplankton in the sea area near Lanshan Port of Rizhao Port in autumn[J].Guangxi Sciences,2020,27(2):203-210.(in Chinese)
[13] 徐兆礼,陈亚瞿.东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J].生态学杂志,1989,8(4):13-15,19.
XU Z L,CHEN Y Q.Aggregated intensity of dominant species of zooplankton in autumn in the East China Sea and Yellow Sea[J].Chinese Journal of Ecology,1989,8(4):13-15,19.(in Chinese)
[14] ZHOU S C,JIN B S,GUO L,et al.Spatial distribution of zooplankton in the intertidal marsh creeks of the Yangtze River Estuary,China[J].Estuarine,Coastal and Shelf Science,2009,85(3):399-406.
[15] SUN D,WANG C S.Latitudinal distribution of zooplankton communities in the Western Pacific along 160°E during summer 2014[J].Journal of Marine Systems,2017,169:52-60.
[16] LONG Y,NOMAN M A,CHEN D W,et al.Western Pacific zooplankton community along latitudinal and equatorial transects in autumn 2017 (northern hemisphere)[J].Diversity,2021,13(2):58.
[17] 葛汝平,刘光兴,陈洪举,等.春季黄河口两种网型网采浮游动物的群落特征[J].中国海洋大学学报(自然科学版),2019,49(4):62-70.
GE R P,LIU G X,CHEN H J,et al.Community characteristics of zooplankton sampled with two plankton nets in Yellow River Estuary in spring[J].Periodical of Ocean University of China(Natural Science Edition),2019,49(4):62-70.(in Chinese)
[18] 王亮,李超伦,于非.冬季南黄海浮游动物群落结构及其对黄海暖流的指示[J].海洋与湖沼,2013,44(4):853-859.
WANG L,LI C L,YU F.Zooplankton community structure in the south Yellow Sea in winter and indication of the Yellow Sea warm current[J].Oceanologia et Limnologia Sinica,2013,44(4):853-859.(in Chinese)
[19] LONGHURST A R.The structure and evolution of plankton communities[J].Progress in Oceanography,1985,15(1):1-35.
[20] 张武昌,高尚武,孙军,等.南海北部冬季和夏季浮游哲水蚤类群落[J].海洋与湖沼,2010,41(3):448-458.
ZHANG W C,GAO S W,SUN J,et al.Planktonic calanoid community in the northern South China Sea in winter and summer[J].Oceanologia et Limnologia Sinica,2010,41(3):448-458.(in Chinese)
[21] 杨杰青,史赟荣,全为民,等.基于RDA与GAMs模型的东海近岸海域浮游动物与温盐关系[J].海洋学报(中文版),2019,41(8):72-84.
YANG J Q,SHI Y R,QUAN W M,et al.Analysis of the relationships between zooplankton and temperature-salinity based on RDA and GAMs model in coastal East China Sea[J].Acta Oceanologica Sinica(Chinese Edtion),2019,41(8):72-84.(in Chinese)
[22] 高敬.海洋桡足类生态学研究进展[J].河南科技,2015(21):85-86.
GAO J.Advances in marine copepods ecology[J].Journal of Henan Science and Technology,2015(21):85-86.(in Chinese)
[23] 陈佳琪,赵坤,曹玥,等.鄱阳湖浮游动物群落结构及其与环境因子的关系[J].生态学报,2020,40(18):6644-6658.
CHEN J Q,ZHAO K,CAO Y,et al.Zooplankton community structure and its relationship with environmental factors in Poyang Lake[J].Acta Ecologica Sinica,2020,40(18):6644-6658.(in Chinese)
[24] 齐衍萍,陈洪举,朱延忠,等.福建罗源湾浮游动物群落特征[J].中国海洋大学学报(自然科学版),2010,40(1):39-46.
QI Y P,CHEN H J,ZHU Y Z,et al.Characteristics of zooplankton community in Luoyuan Bay,Fujian[J].Periodical of Ocean University of China(Natural Science Edition),2010,40(1):39-46.(in Chinese)
[25] NAGAI N,TADOKORO K,KURODA K,et al.Latitudinal distribution of chaetognaths in winter along the 137°E meridian in the Philippine Sea[J].Plankton and Benthos Research,2015,10(3):141-153.
[26] 靳少非,唐峰华,戴立峰,等.2010年北太平洋柔鱼渔场浮游动物多样性[J].海洋环境科学,2014,33(4):503-508.
JIN S F,TANG F H,DAI L F,et al.Diversity of zooplankton in the squid fishing ground in the North Pacific Ocean,2010[J].Marine Environmental Science,2014,33(4):503-508.(in Chinese)
[27] THABET R,LEIGNEL V,AYADI H,et al.Interannual and seasonal effects of environmental factors on the zooplankton distribution in the solar saltern of Sfax (South-Western Mediterranean Sea)[J].Continental Shelf Research,2018,165:1-11.
[28] POMERLEAU C,NELSON R J,HUNT B P V,et al.Spatial patterns in zooplankton communities and stable isotope ratios (δ13C and δ15N) in relation to oceanographic conditions in the sub-Arctic Pacific and Western Arctic regions during the summer of 2008[J].Journal of Plankton Research,2014,36(3):757-775.
[29] 杜彩丽,杨丽,赵诣,等.淀山湖浮游动物群落时空分布特征及其与环境因子的关系[J].环境科学,2019,40(10):4513-4522.
DU C L,YANG L,ZHAO Y,et al.Temporal and spatial variation of zooplankton community structure and its relationship with environmental factors in Dianshan Lake,Shanghai[J].Environmental Science,2019,40(10):4513-4522.(in Chinese)
[30] 郑白雯.北部湾北部浮游生物生态学研究[D].厦门:厦门大学,2014.
ZHENG B W.Ecological studies on plankton in northern Beibu Gulf[D].Xiamen:Xiamen University,2014.(in Chinese)
[31] PERSHING A J,HEAD E H J,GREENE C H,et al.Pattern and scale of variability among Northwest Atlantic Shelf plankton communities[J].Journal of Plankton Research,2010,32(12):1661-1674.
[32] 庞碧剑,蓝文陆,黎明民,等.北部湾近岸海域浮游动物群落结构特征及季节变化[J].生态学报,2019,39(19):7014-7024.
PANG B J,LAN W L,LI M M,et al.Community structure and seasonal variation of zooplankton in coastal Beibu Gulf[J].Acta Ecologica Sinica,2019,39(19):7014-7024.(in Chinese)
[33] 徐兆礼,崔雪森,黄洪亮.北太平洋柔鱼渔场浮游动物数量分布及与渔场的关系[J].水产学报,2004,28(5):515-521.
XU Z L,CUI X S,HUANG H L.Distribution of zooplankton in Ommastrephes batrami fishing ground of the North Pacific Ocean and its relationship with the fishing ground[J].Journal of Fisheries of China,2004,28(5):515-521.(in Chinese)
[34] LONGHURST A R.Ecological geography of the sea[M].Oxford:Academic Press,2007.