近年来,新疆维吾尔自治区部分流域资源遭到过度捕捞,鱼类洄游路线被水利设施阻隔,由于特殊的地理位置和经济文化特点,该流域还面临着物种入侵、全球气候变化等更严峻的生态问题[1-2]。新疆沙漠地区生态环境脆弱,高原地区植被覆盖率小、生产力低下,部分河流来源于冰山融水且缺乏营养物质,导致新疆水生生态更容易受到外界的影响[3]。鱼类生活在脆弱的生境中,一旦鱼类资源遭到破坏,恢复过程将会十分缓慢[4-6]。
宽口裂腹鱼Schizothorax eurystomus隶属于鲤形目Cypriniformes鲤科Cyprinidae裂腹鱼亚科Schizothoracinae裂腹鱼属Schizothorax,是新疆克孜勒河土著鱼之一[7]。水利水电设施的修建使得宽口裂腹鱼栖息地受到破坏[8],数量急剧下降,因此,保护宽口裂腹鱼资源迫在眉睫。目前,对宽口裂腹鱼的研究主要集中在简单分类及地理分布[9-11]、线粒体DNA测序[12]、亲缘关系[13-15]等方面,而关于宽口裂腹鱼人工繁殖和早期发育的研究尚未见报道。本研究中,使用鱼脑垂体(pituitary gland,PG)、人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)和促黄体生成素释放激素A2(luteinizing hormone releasing hormone A2,LHRH-A2)对宽口裂腹鱼进行人工催产,采用Box-Benhnken响应面分析法,建回归模型并进行显著性检验,比较不同剂量外源激素组合诱导宽口裂腹鱼亲鱼产卵的效果,筛选出最佳催产剂用量配比,并系统观察了宽口裂腹鱼的胚胎和早期仔鱼的发育生长过程,旨在丰富宽口裂腹鱼的早期生活史和繁殖生物学资料,并为宽口裂腹鱼的资源保护、人工繁育和增殖提供科学依据。
1 材料与方法
1.1 材料
于2019年4—5月在新疆维吾尔自治区克孜勒苏柯尔克自治州乌恰县卡拉贝利水利枢纽工程鱼类增殖放流站进行宽口裂腹鱼人工繁殖试验。试验亲鱼于2017—2018年捕自克孜勒河流域,共捕亲鱼1 478尾,体长为 135.69~302.15 mm,体质量为 93.26~317.22 g。
1.2 方法
1.2.1 人工繁殖试验时间、地点 将试验亲鱼暂养于圆形塑料桶 (直径为2 m,深度为1 m)中,15 d后转移至土池塘 (667 m2)中进行流水培育。亲鱼培育过程中全程投喂斯特佳生物活性饲料T3 (主要原料为高蛋白鱼粉、南极虾粉、酵母细胞壁、鱼溶蛋白、螺旋藻和卵磷脂等),日投饵率为2%~5%。选择3~5龄雄性宽口裂腹鱼亲鱼和4~6龄雌性宽口裂腹鱼亲鱼进人工繁殖试验。
1.2.2 人工催产
1)亲鱼培育。试验用健康雌鱼960尾,进行为期2月的强化培育,使用斯特佳生物活性饲料T3配合冰冻摇蚊幼虫进行投喂,水温维持在14.0~15.0 ℃,增大水流刺激,使试验雌鱼均达到相近的性腺成熟期。其中,雌鱼形体明显大于雄鱼,臀鳍较肥厚,腹部膨大柔软,体表颜色相对雄鱼较浅;雄鱼鳍条及身体颜色较鲜艳,臀鳍呈斜三角且末端为尖形,形体修长,轻压腹部有少量白色精液流淌出。
2)催产药物复合调控试验。采用显著性检验和响应面法,探索PG、HCG和LHRH-A2(均产自宁波第二激素厂)3种药物对宽口裂腹鱼催产效果的复合调控作用。首先进行预试验,确定PG用量范围为5~25 mg/kg,HCG用量范围为100~900 IU/kg,LHRH-A2用量范围为10~30 μg/kg。进行3种催产药物复合调控试验时,采用3因素3水平的Box-Benhnken试验设计,因子水平分别为-1、0、1,试验组共17个,每组设置3个重复,每个重复10尾雌鱼。
根据试验结果拟合宽口裂腹鱼催产率与PG、HCG和LHRH-A2因素间的多元线性回归方程,并计算最佳催产药物组合及理论催产率。根据筛选出的最佳催产药物浓度进行实际注射,设置3个试验组,每组10尾雌鱼,计算实际催产率,与理论催产率进行对比,验证最佳催产药物组合是否合理。
3)催产及人工授精。所有雌鱼进行催产时均采用胸鳍基部二次注射,第1针注射总量的1/5,等待12 h后,将剩下的4/5药量全部进行注射。整个试验用水为经过循环系统过滤的地下水,水温为(16.5±0.5)℃,pH为8.29~8.36,溶解氧为5.9~6.5 mg/L,盐度为16~17,氨氮<0.1 mg/L。
采用干法人工授精,将成熟的鱼卵直接挤入干燥的孵化筐(0.50 m×0.40 m×0.35 m)中,再将雄鱼的精液直接挤到卵子上,用鹅毛轻轻搅动使二者充分混合。2 min后加入适量清水,受精卵吸水膨胀,25 min后再用清水清洗受精卵,将受精卵均匀铺放在孵化筐中,并放入孵化池 (5.00 m×0.45 m×0.50 m)中,采用淋浴平列槽式孵化法进行孵化,溶解氧≥5.0 mg/mL。
4)受精卵最佳孵化水温试验。为确定受精卵孵化最佳水温,在10.0~20.0 ℃水温下设置11个梯度水温试验,每组间隔为1.0 ℃,用温控加热棒控温,每个温度组设置3个重复,每个重复的受精卵为500粒。
1.2.3 胚胎发育和早期仔鱼发育观察 选取同批次50粒受精卵进行胚胎发育观察研究,利用SMZ 1270数码体式显微镜观察受精卵各发育时期,以70%的受精卵进入相同发育时期作为一个发育期的判定;选取同批次受精卵发育出膜的仔鱼用于早期仔鱼发育观察,每次至少选取5尾仔鱼,采用体积分数为10%的福尔马林溶液固定,在显微镜下进行观察并记录。
1.2.4 繁殖效率评价 宽口裂腹鱼催产率(%)、受精率(%)和孵化率(%)计算公式为
催产率=产卵总数/催情总数×100%,
受精率=原肠中期活卵数/产卵总数×100%,
孵化率=鱼苗水花数/受精卵总数×100%。
1.3 数据处理
卵径及各发育阶段的仔鱼全长数据以平均值±标准差 (mean±S.D.)表示。筛选不同催产药物及雌雄比对催产率的影响,以及不同水温对孵化率影响时,采用SPSS 26.0软件进行单因素方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 催产药物复合调控试验
响应面试验设计方案及结果见表1。宽口裂腹鱼催产率 (Y)与PG (A)、HCG (B)和LHRH-A2 (C)因素间的多元线性回归方程为
表1 响应面试验方案及结果
Tab.1 Design and results of response surface experiment
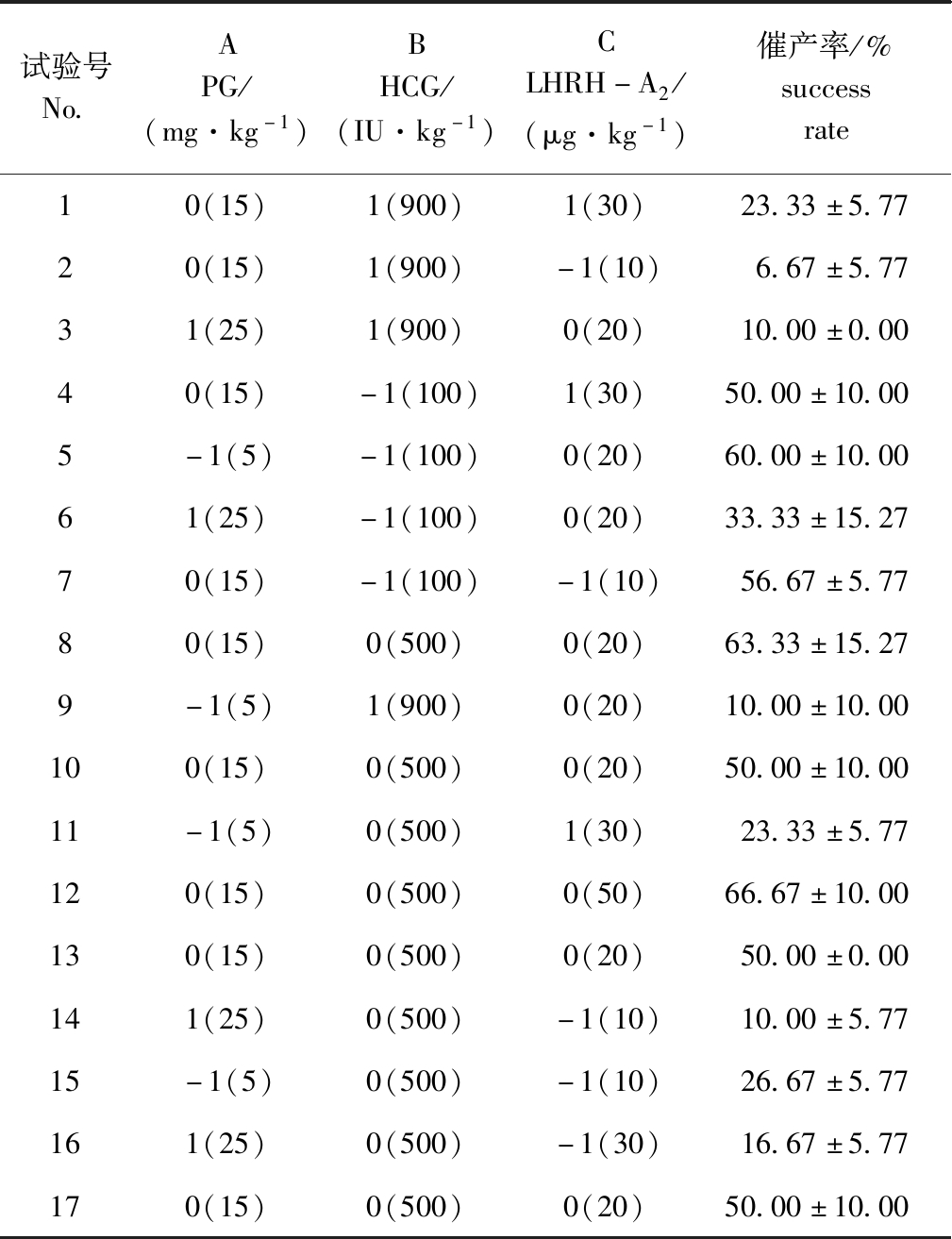
试验号No.APG/(mg·kg-1)BHCG/(IU·kg-1)CLHRH-A2/(μg·kg-1)催产率/%successrate10(15)1(900)1(30)23.33±5.7720(15)1(900)-1(10)6.67±5.7731(25)1(900)0(20)10.00±0.0040(15)-1(100)1(30)50.00±10.005-1(5)-1(100)0(20)60.00±10.0061(25)-1(100)0(20)33.33±15.2770(15)-1(100)-1(10)56.67±5.7780(15)0(500)0(20)63.33±15.279-1(5)1(900)0(20)10.00±10.00100(15)0(500)0(20)50.00±10.0011-1(5)0(500)1(30)23.33±5.77120(15)0(500)0(50)66.67±10.00130(15)0(500)0(20)50.00±0.00141(25)0(500)-1(10)10.00±5.7715-1(5)0(500)-1(10)26.67±5.77161(25)0(500)-1(30)16.67±5.77170(15)0(500)0(20)50.00±10.00
Y=-6.25A2-18.755B2+1.66C2+6.67AB+
2.50AC+5.83BC-21.33A-6.33B-
15.50C+56.00。
回归模型的决定系数R2为0.960 3,校正系数![]() 为0.909 2,预测
为0.909 2,预测![]() 为0.921 1,表明试验误差较小。从表2可见:失拟项(P=0.988)无显著性差异(P>0.05),表明试验值与预测值吻合较好;线性系数 (A、B)和二次项系数 (A2和C2)均有显著或极显著性差异(P<0.05或P<0.01),其他项系数均无显著性差异 (P>0.05)。因此,该模型对试验拟合度较好,可用于预测不同催产药物剂量对宽口裂腹鱼催产率的影响。
为0.921 1,表明试验误差较小。从表2可见:失拟项(P=0.988)无显著性差异(P>0.05),表明试验值与预测值吻合较好;线性系数 (A、B)和二次项系数 (A2和C2)均有显著或极显著性差异(P<0.05或P<0.01),其他项系数均无显著性差异 (P>0.05)。因此,该模型对试验拟合度较好,可用于预测不同催产药物剂量对宽口裂腹鱼催产率的影响。
采用响应面法对催产剂量和催产率之间的关系进行三维响应面分析。如图1(a)所示,随着HCG剂量的增加,催产率明显降低,随着PG剂量的增加,催产率逐渐提高到最大,然后呈现下降趋势。在x-y面的投影等高线显示,沿HCG轴等高线变化密集且等高线呈椭圆形,说明两因素交互作用较强,结果与表2所示一致。
如图1(b)所示,随着PG和LHRH-A2用量的逐渐增加,催产率出现先上升后下降的趋势,等高线呈圆形,说明两因素交互作用一般,影响不显著,结果与表2所示一致。如图1(c)所示,随着HCG用量逐渐增加,催产率整体呈现下降趋势,随着LHRH-A2用量增加,催产率缓慢下降。
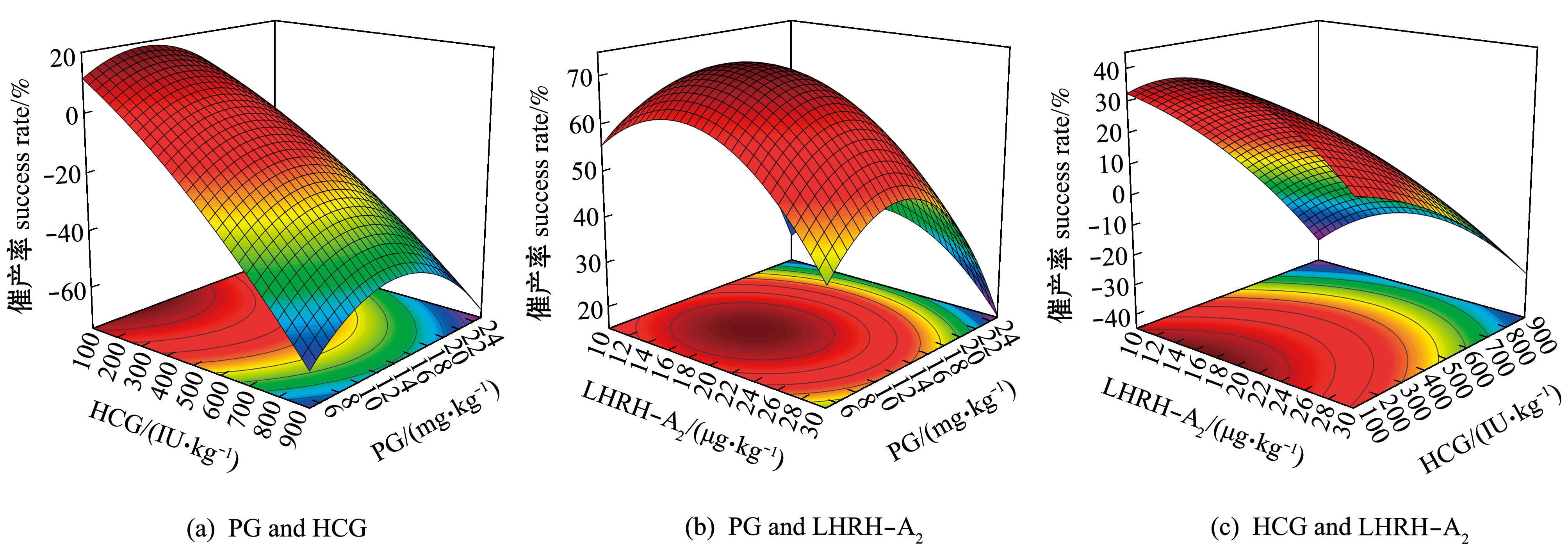
图1 PG、HCG和LHRH-A2对催产率效果的响应面分析
Fig.1 Response surface of effects of PG,HCG and LHRH-A2 on success rate
表2 催产率的方差分析
Tab.2 Variance analysis of extraction yield of success rate
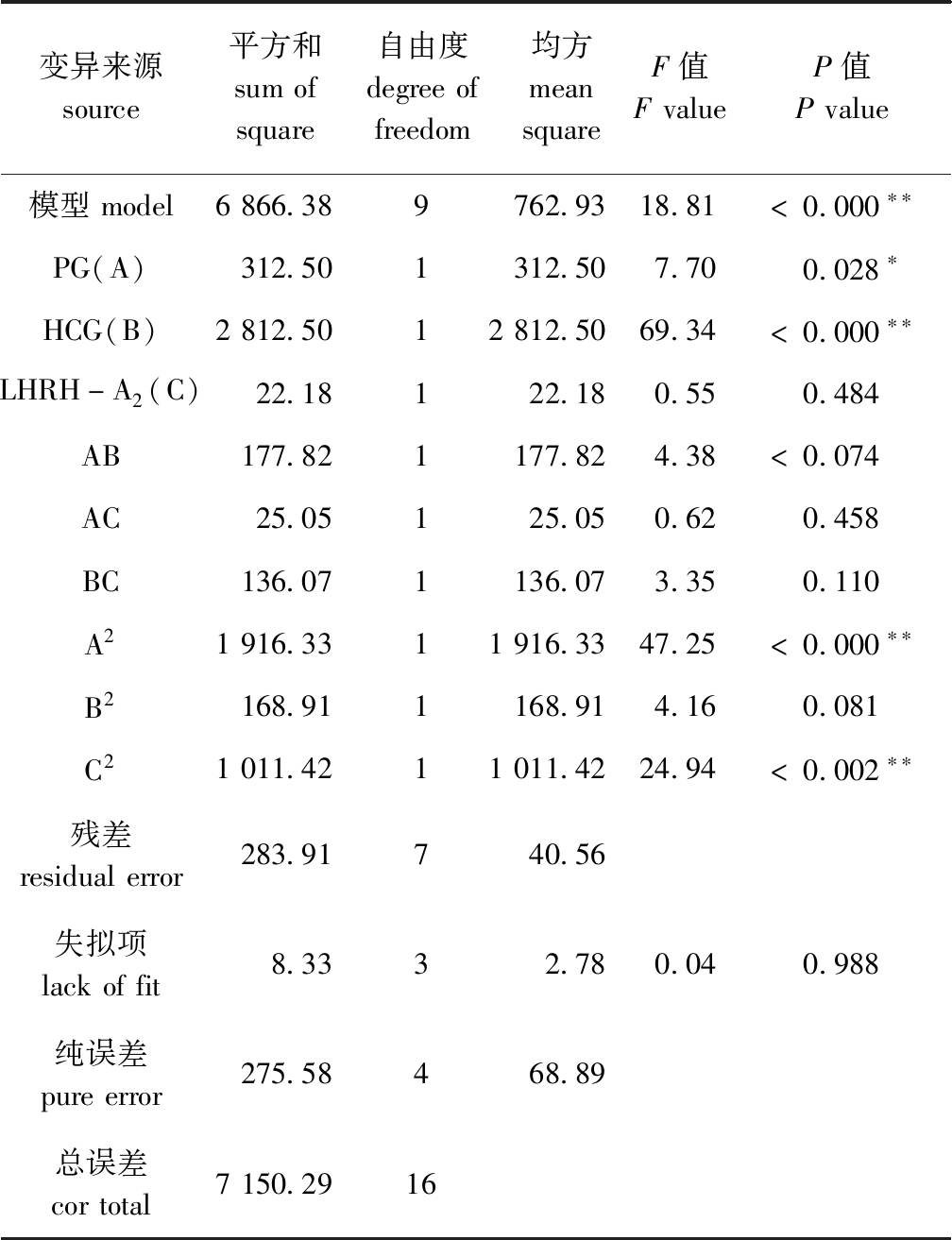
变异来源source平方和sumofsquare自由度degreeoffreedom均方meansquareF值FvalueP值Pvalue模型model6866.389762.9318.81<0.000∗∗PG(A)312.501312.507.700.028∗HCG(B)2812.5012812.5069.34<0.000∗∗LHRH-A2(C)22.18122.180.550.484AB177.821177.824.38<0.074AC25.05125.050.620.458BC136.071136.073.350.110A21916.3311916.3347.25<0.000∗∗B2168.911168.914.160.081C21011.4211011.4224.94<0.002∗∗残差residualerror283.91740.56失拟项lackoffit8.3332.780.040.988纯误差pureerror275.58468.89总误差cortotal7150.2916
注:* 表示有显著性影响(P<0.05);** 表示有极显著性影响(P<0.01)。
Note:* means significant effect(P<0.05);** means very significant effect (P<0.01).
响应模型的优化结果显示,PG为10.27 mg/kg、HCG为300.00 IU/kg和LHRH-A2为19.41 μg/kg时,宽口裂腹鱼催产率理论值最高,为73.67%。经过试验验证,在此最优催产药物浓度下,宽口裂腹鱼的催产率为 76.67%±0.06%,试验结果与理论催产率基本相符,说明响应模型方程建立成功,可有效预测宽口裂腹鱼的催产率。
2.2 适宜孵化水温
从图2可见:温度对宽口裂腹鱼孵化率有显著性影响,当水温为16.0 ℃时,受精卵孵化率高达96.32%;水温为17.0 ℃时,孵化率可达96.18%;温度低于16.0 ℃或高于17.0 ℃时,孵化率显著下降 (P<0.05),因此,其最适孵化水温为16.0~17.0 ℃。

图2 孵化率随水温的变化
Fig.2 Change in hatching rate with water temperature
2.3 宽口裂腹鱼胚胎发育
宽口裂腹鱼胚胎发育过程可划分为胚盘、卵裂、囊胚、原肠胚、神经胚、器官形成和出膜7个阶段。整个发育过程可划分为胚盘期、卵裂期、囊胚期、原肠期、卵黄栓期、神经胚期、胚孔封闭期、肌节出现期、眼囊期、尾芽期、晶体出现期、肌肉效应期、心脏原基期、耳石期、尾鳍原基期、心脏搏动期、胸鳍原基形成期和出膜期18个时期(表3,图3)。宽口裂腹鱼受精卵在水温 (16.19±0.08)℃时,受精卵发育经过145 h 48 min孵化,总积温为2 364.80 ℃·h。
表3 宽口裂腹鱼胚胎发育时序
Tab.3 Temporal sequence of embryonic development in Schizothorax eurystomus
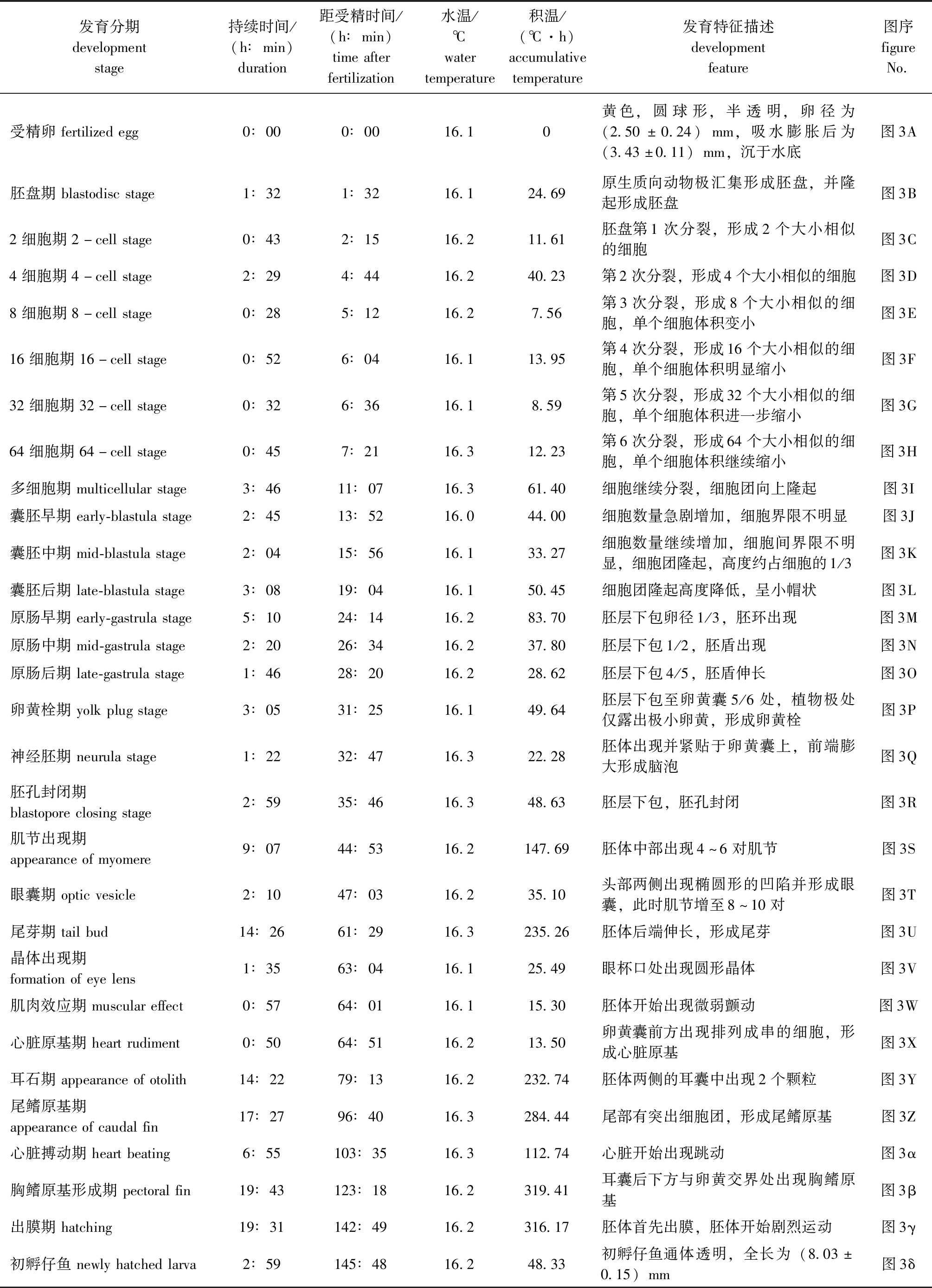
发育分期developmentstage持续时间/(h∶min)duration距受精时间/(h∶min)timeafterfertilization水温/℃watertemperature积温/(℃·h)accumulativetemperature发育特征描述developmentfeature图序figureNo.受精卵fertilizedegg0∶000∶0016.10黄色,圆球形,半透明,卵径为(2.50±0.24)mm,吸水膨胀后为(3.43±0.11)mm,沉于水底图3A胚盘期blastodiscstage1∶321∶3216.124.69原生质向动物极汇集形成胚盘,并隆起形成胚盘图3B2细胞期2-cellstage0∶432∶1516.211.61胚盘第1次分裂,形成2个大小相似的细胞图3C4细胞期4-cellstage2∶294∶4416.240.23第2次分裂,形成4个大小相似的细胞图3D8细胞期8-cellstage0∶285∶1216.27.56第3次分裂,形成8个大小相似的细胞,单个细胞体积变小图3E16细胞期16-cellstage0∶526∶0416.113.95第4次分裂,形成16个大小相似的细胞,单个细胞体积明显缩小图3F32细胞期32-cellstage0∶326∶3616.18.59第5次分裂,形成32个大小相似的细胞,单个细胞体积进一步缩小图3G64细胞期64-cellstage0∶457∶2116.312.23第6次分裂,形成64个大小相似的细胞,单个细胞体积继续缩小图3H多细胞期multicellularstage3∶4611∶0716.361.40细胞继续分裂,细胞团向上隆起图3I囊胚早期early-blastulastage2∶4513∶5216.044.00细胞数量急剧增加,细胞界限不明显图3J囊胚中期mid-blastulastage2∶0415∶5616.133.27细胞数量继续增加,细胞间界限不明显,细胞团隆起,高度约占细胞的1/3图3K囊胚后期late-blastulastage3∶0819∶0416.150.45细胞团隆起高度降低,呈小帽状图3L原肠早期early-gastrulastage5∶1024∶1416.283.70胚层下包卵径1/3,胚环出现图3M原肠中期mid-gastrulastage2∶2026∶3416.237.80胚层下包1/2,胚盾出现图3N原肠后期late-gastrulastage1∶4628∶2016.228.62胚层下包4/5,胚盾伸长图3O卵黄栓期yolkplugstage3∶0531∶2516.149.64胚层下包至卵黄囊5/6处,植物极处仅露出极小卵黄,形成卵黄栓图3P神经胚期neurulastage1∶2232∶4716.322.28胚体出现并紧贴于卵黄囊上,前端膨大形成脑泡图3Q胚孔封闭期blastoporeclosingstage2∶5935∶4616.348.63胚层下包,胚孔封闭图3R肌节出现期appearanceofmyomere9∶0744∶5316.2147.69胚体中部出现4~6对肌节图3S眼囊期opticvesicle2∶1047∶0316.235.10头部两侧出现椭圆形的凹陷并形成眼囊,此时肌节增至8~10对图3T尾芽期tailbud14∶2661∶2916.3235.26胚体后端伸长,形成尾芽图3U晶体出现期formationofeyelens1∶3563∶0416.125.49眼杯口处出现圆形晶体图3V肌肉效应期musculareffect0∶5764∶0116.115.30胚体开始出现微弱颤动图3W心脏原基期heartrudiment0∶5064∶5116.213.50卵黄囊前方出现排列成串的细胞,形成心脏原基图3X耳石期appearanceofotolith14∶2279∶1316.2232.74胚体两侧的耳囊中出现2个颗粒图3Y尾鳍原基期appearanceofcaudalfin17∶2796∶4016.3284.44尾部有突出细胞团,形成尾鳍原基图3Z心脏搏动期heartbeating6∶55103∶3516.3112.74心脏开始出现跳动图3α胸鳍原基形成期pectoralfin19∶43123∶1816.2319.41耳囊后下方与卵黄交界处出现胸鳍原基图3β出膜期hatching19∶31142∶4916.2316.17胚体首先出膜,胚体开始剧烈运动图3γ初孵仔鱼newlyhatchedlarva2∶59145∶4816.248.33初孵仔鱼通体透明,全长为(8.03±0.15)mm图3δ
2.4 宽口裂腹鱼早期仔鱼发育
早期仔鱼发育分为眼球色素出现期、体色素出现期、鳔充气期和卵黄囊完全吸收期4个时期 (表4,图4)。仔鱼生长温度为(17.88±0.44)℃,出膜312 h后,仔鱼开始摄取开口饵料丰年虫。待到出膜480 h后仔鱼卵黄囊消耗完全,全长为 (20.17±0.96)mm,依靠外源性营养存活时,投喂海大集团淡水鱼膨化配合饲料6602系列漂浮料和五龙饲料有限公司的甲鱼配合饲料,于每天9∶30、14∶30和19∶30分别进行投喂,将饲料分批次泼洒,直至幼鱼不摄食为止。
表4 宽口裂腹鱼早期仔鱼发育观察
Tab.4 Observation of early larval development of Schizothorax eurystomus
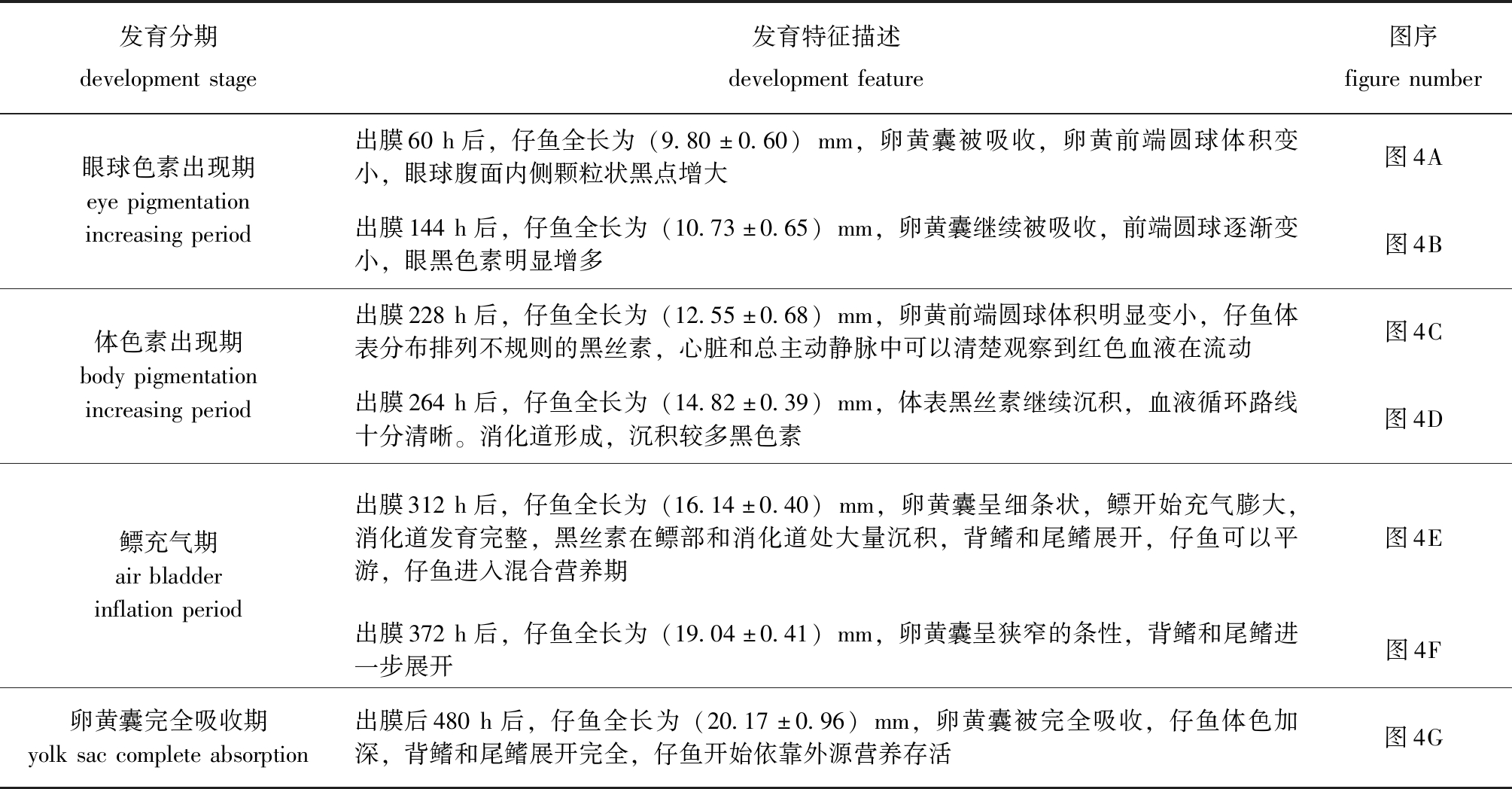
发育分期developmentstage发育特征描述developmentfeature图序figurenumber眼球色素出现期eyepigmentationincreasingperiod出膜60h后,仔鱼全长为(9.80±0.60)mm,卵黄囊被吸收,卵黄前端圆球体积变小,眼球腹面内侧颗粒状黑点增大图4A出膜144h后,仔鱼全长为(10.73±0.65)mm,卵黄囊继续被吸收,前端圆球逐渐变小,眼黑色素明显增多图4B体色素出现期bodypigmentationincreasingperiod出膜228h后,仔鱼全长为(12.55±0.68)mm,卵黄前端圆球体积明显变小,仔鱼体表分布排列不规则的黑丝素,心脏和总主动静脉中可以清楚观察到红色血液在流动图4C出膜264h后,仔鱼全长为(14.82±0.39)mm,体表黑丝素继续沉积,血液循环路线十分清晰。消化道形成,沉积较多黑色素图4D鳔充气期airbladderinflationperiod出膜312h后,仔鱼全长为(16.14±0.40)mm,卵黄囊呈细条状,鳔开始充气膨大,消化道发育完整,黑丝素在鳔部和消化道处大量沉积,背鳍和尾鳍展开,仔鱼可以平游,仔鱼进入混合营养期图4E出膜372h后,仔鱼全长为(19.04±0.41)mm,卵黄囊呈狭窄的条性,背鳍和尾鳍进一步展开图4F卵黄囊完全吸收期yolksaccompleteabsorption出膜后480h后,仔鱼全长为(20.17±0.96)mm,卵黄囊被完全吸收,仔鱼体色加深,背鳍和尾鳍展开完全,仔鱼开始依靠外源营养存活图4G
经过回归分析,宽口裂腹鱼早期仔鱼的全长生长方程为y=8.329e0.002x(R2=0.969 7,0≤x≤480,n=80),其中y为仔鱼全长(mm),x为出膜时间(h),n为样本数 (图5)。
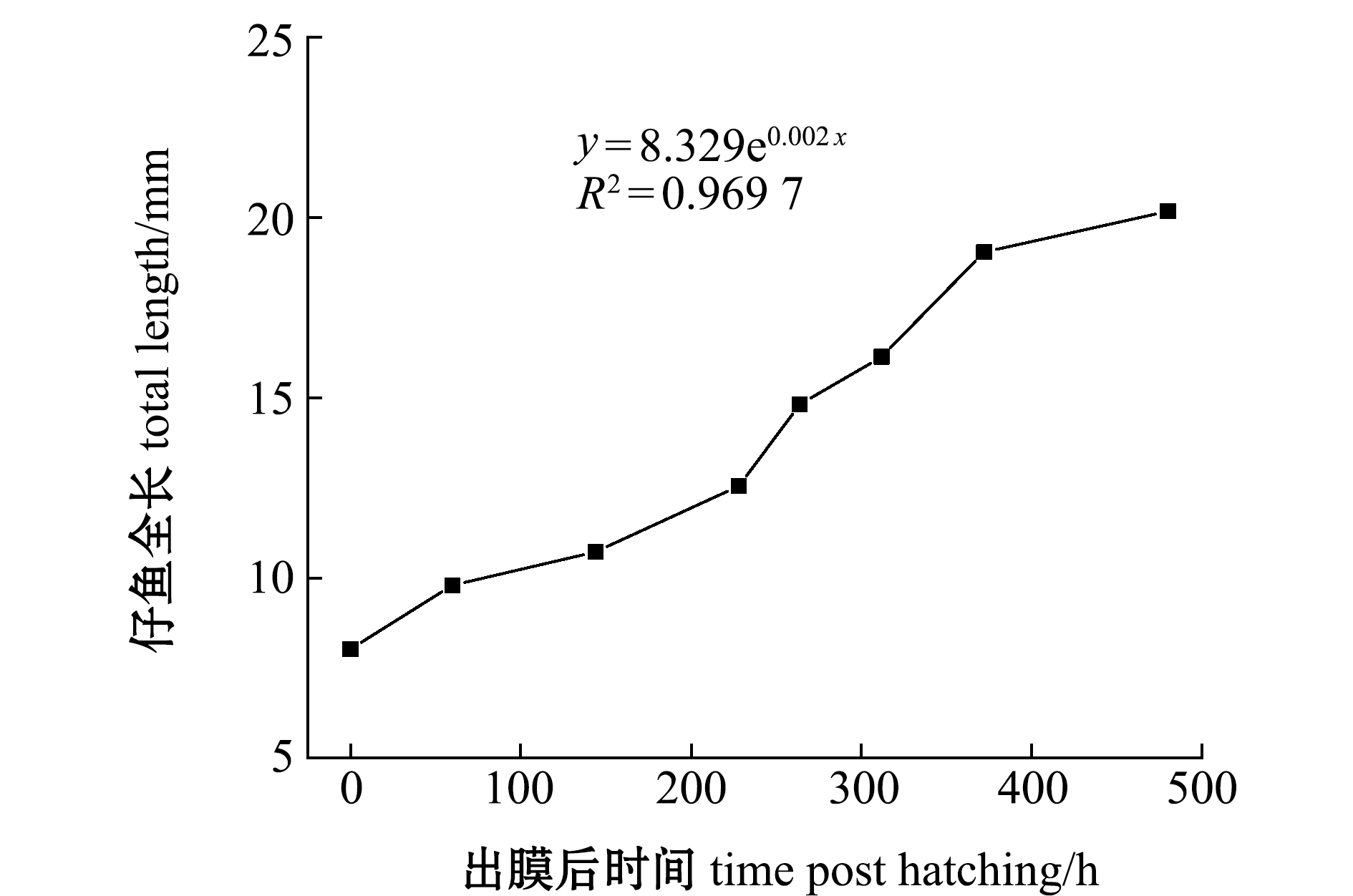
图5 宽口裂腹鱼早期仔鱼的生长(n=80)
Fig.5 Growth of early larval Schizothorax eurystomus(n=80)
3 讨论
3.1 催产药物和剂量对催产效果的影响
性腺发育与生存环境、营养积累有着密切的关系,若投喂饲料营养和数量不足,亲鱼的性腺就无法正常发育[16-17]。宽口裂腹鱼亲鱼催产前,需投喂高蛋白质饵料进行亲鱼的强化培育,为亲鱼发育打下基础。在实际生产中,根据亲鱼的发育情况,催产药物可以选择一次注射或者二次注射。发育较好的亲鱼可进行一次注射,发育较差的亲鱼和初产鱼则必须进行二次或二次以上注射[18]。
响应面法是一种高效便捷的统计方法,具有周期短、拟合方程精度高、预测效果好等优点。响应面法将试验设计与数学建模相结合,通过对具有代表性的局部各点进行试验,回归拟合因素和响应值的函数关系,快速建立数学模型,缩短优化时间并提高应用可信度。通过对函数响应面和等高线的分析,可对各因素水平及其交互作用进行优化并确定多因素系统的最佳条件[19],本研究中采用响应面法来优化宽口裂腹鱼的催产药物方案。
本试验中以催产率为衡量指标,从整体角度评价了宽口裂腹鱼人工催产技术,在预试验基础上,采用响应面法筛选PG、HCG和LHRH-A2的最优用量组合,最终得到宽口裂腹鱼人工催产的最佳药物用量组合为PG 10.27 mg/kg、HCG 300.00 IU/kg和LHRH-A2 19.41 μg/kg,这为宽口裂腹鱼有效催产提供了基础数据。不同催产剂在实际生产过程中存在一个最佳配比。本研究中仅以PG、HCG和LHRH-A2为研究对象筛选其最佳配比,而鱼类的人工催产药物不少于8种[18],因此,还有较多催产剂组合使用有待于进一步探究。
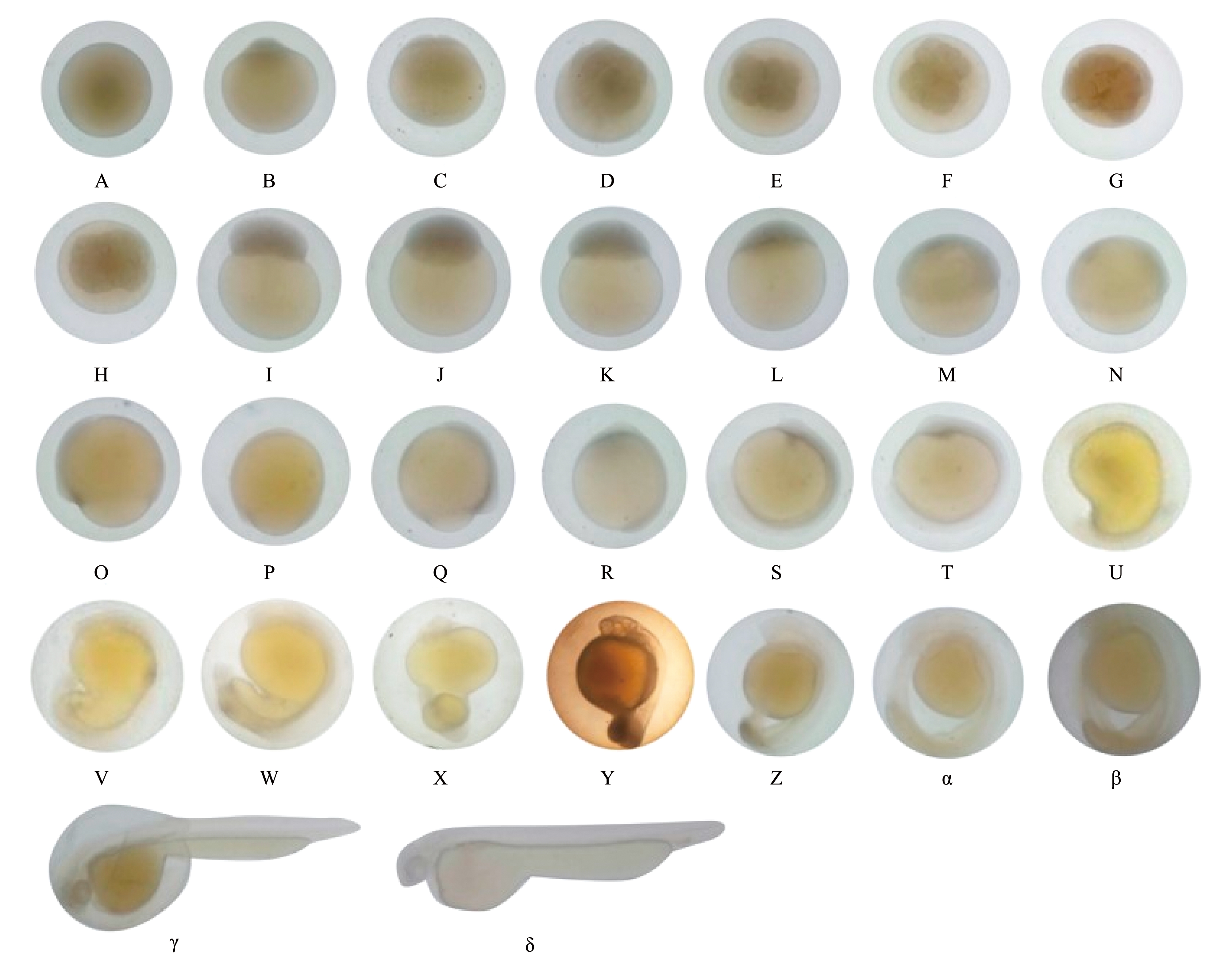
A—受精卵;B—胚盘期;C—2细胞期;D—4细胞期;E—8细胞期;F—16细胞期;G—32细胞期;H—64细胞期;I—多细胞期;J—囊胚早期;K—囊胚中期;L—囊胚后期;M—原肠早期;N—原肠中期;O—原肠后期;P—卵黄栓期;Q—神经胚期;R—胚孔封闭期;S—肌节出现期;T—眼囊期;U—尾芽期;V—晶体出现期;W—肌肉效应期;X—心脏原基期;Y—耳石期;Z—尾鳍原基期;α—心脏搏动期;β—胸鳍原基形成期;γ—出膜期;δ—初孵仔鱼。
A—fertilized egg;B—blastodisc stage;C—2-cell stage;D—4-cell stage;E—8-cell stage;F—16-cell stage;G—32-cell stage;H—64-cell stage;I—multicellular stage;J—early-blastula stage;K—mid-blastula stage;L—late-blastula stage;M—early-gastrula stage;N—mid-gastrula stage;O—late-gastrula stage;P—yolk plug stage;Q—neurula stage;R—blastopore closing stage;S—appearance of myomere;T—optic vesicle;U—tail bud;V—formation of eye lens;W—muscular effect;X—heart rudiment;Y—appearance of otolith;Z—appearance of caudal fin;α—heart beating;β—pectoral fin;γ—hatching;δ—newly hatched larva.
图3 宽口裂腹鱼的胚胎发育
Fig.3 Embryonic development of Schizothorax eurystomus

A、B—眼球色素出现期;C、D—体色素出现期;E、F—鳔充气期;G—卵黄囊完全吸收期。
A,B—eye pigmentation increasing period;C,D—body pigmentation increasing period;E,F—air bladder inflation period;G—yolk sac complete absorption.
图4 宽口裂腹鱼的早期仔鱼发育
Fig.4 Larval development of Schizothorax eurystomus
目前,裂腹鱼类催产所用激素种类和剂量各不相同。曾本和等[20]采用DOM(5 mg/kg)+LHRH-A2(5 μg/kg)催产药物组合,取得拉萨裂腹鱼S.waltoni全人工繁殖成功;许勇[21]采用LHRH-A2(15 μg/kg)+PG(1.2 mg/kg)+HCG(1 000 IU/kg)药物组合催产长丝裂腹鱼S.dolichonema,取得了预期的催产效果;甘维熊等[22]采用PG(3 mg/kg)+LHRH-A2 (12 μg/kg)催产药物组合,对雅砻江短须裂腹鱼S.wangchiachi催产,取得了良好效果。推测催产药物的复合使用是提高裂腹鱼亚科鱼类排卵率的有效方法。
3.2 催产亲鱼死亡率高的原因分析
宽口裂腹鱼在人工繁殖后亲鱼死亡率较高。宽口裂腹鱼人工催产后,效应期前需定期对其进行检查,在这期间亲鱼会产生比较强烈的应激反应并可导致其损伤,这是亲鱼产后死亡的主要原因之一[23]。因此,在生产过程中,可以先用药物对亲鱼进行麻醉,减少亲鱼产生应激,并适当减少检查的次数,可保证亲鱼成活率。催产后的宽口裂腹鱼应尽快放入高溶氧、缓流水的养殖池中,等其体质恢复后,再放入土池塘中进行饲养。本试验中所用宽口裂腹鱼全部捕自天然河流克孜勒河,野性较强,这对亲鱼的成活和再利用均有一定难度。同时,由于宽口裂腹鱼性成熟晚,栖息水域水温较低,生长速度慢,亲鱼绝对怀卵量少,故进行规模化宽口裂腹鱼苗种生产时,需要相对较多的性成熟亲鱼。因此,加强对野生宽口裂腹鱼产后亲鱼的驯化培育,促使亲鱼在人工饲养条件下能够顺利达到性成熟,进而开展人工养殖的基础性研究,是实现宽口裂腹鱼人工规模化育苗生产,保护和开发其种质资源的根本措施。如何有效提高野生鱼类人工催产后的成活率,亟待进一步深入研究。宽口裂腹鱼为国家濒危保护鱼类,野外种质资源十分稀少,人工繁殖又需要捕捞野生亲鱼,这将对野生种群造成极大破坏[17]。因此,有效地提高亲鱼的催产率和产后成活率,对宽口裂腹鱼资源保护具有重大意义。
3.3 宽口裂腹鱼与其他裂腹鱼亚科鱼类的胚胎发育差异
将宽口裂腹鱼与短须裂腹鱼[22]、厚唇裸重唇鱼Gymnodiptychus pachycheilus[24]、长丝裂腹鱼S.dolichonema[25]、光唇裂腹鱼S.lissolabiatus[26]、伊犁裂腹鱼S.pseudaksaiensis [27]、塔里木裂腹鱼S.biddulphi[28]和扁吻鱼Aspiorhynchus laticeps[29]等其他裂腹鱼亚科鱼类胚胎发育进行比较(表5),裂腹鱼亚科鱼类胚胎孵化温度均不超过22 ℃,这是由于裂腹鱼亚科是栖息在高海拔和低温水域环境中的冷水性鱼类,所以其繁殖发育水温也相对较低。宽口裂腹鱼胚胎发育用时长于伊犁裂腹鱼、塔里木裂腹鱼和扁吻鱼,而短于短须裂腹鱼、厚唇裸重唇鱼、长丝裂腹鱼和光唇裂腹鱼,孵化水温和鱼类品种不同可能是造成胚胎发育用时存在差异的原因。宽口裂腹鱼的受精卵卵径为(2.50±0.24)mm,在几种裂腹鱼亚科鱼类中属于较大类型,卵径是反映生物生活史进化过程的一个重要生物学特征,其大小与环境相关,是鱼类长期适应环境的结果[30]。较大卵径在一定程度上弥补了宽口裂腹鱼孵化时间长带来的存活压力[5,31-32]。出膜阶段时,宽口裂腹鱼和厚唇裸重唇鱼处于胸鳍原基形成期,短须裂腹鱼、光唇裂腹鱼和伊犁裂腹鱼处于心脏搏动期,长丝裂腹鱼处于心脏原基期,塔里木裂腹鱼处于肌肉效应期,扁吻鱼处于血液循环期。宽口裂腹鱼在胚胎发育过程中心脏、血液循环、尾鳍原基和胸鳍原基均在孵化出膜前形成,这有利于仔鱼更好地适应高原贫营养及低水温环境[27]。宽口裂腹鱼、短须裂腹鱼和伊犁裂腹鱼出膜方式均为尾部先出膜,厚唇裸重唇鱼、光唇裂腹鱼和扁吻鱼均为头部或尾部先出膜,出膜方式可能与鱼的种类有关。
表5 宽口裂腹鱼与其他裂腹鱼亚科鱼类胚胎发育特点比较
Tab.5 Comparison of the embryonic developmental characteristics between Schizothorax eurystomus and other members in Schizothoracinae fish
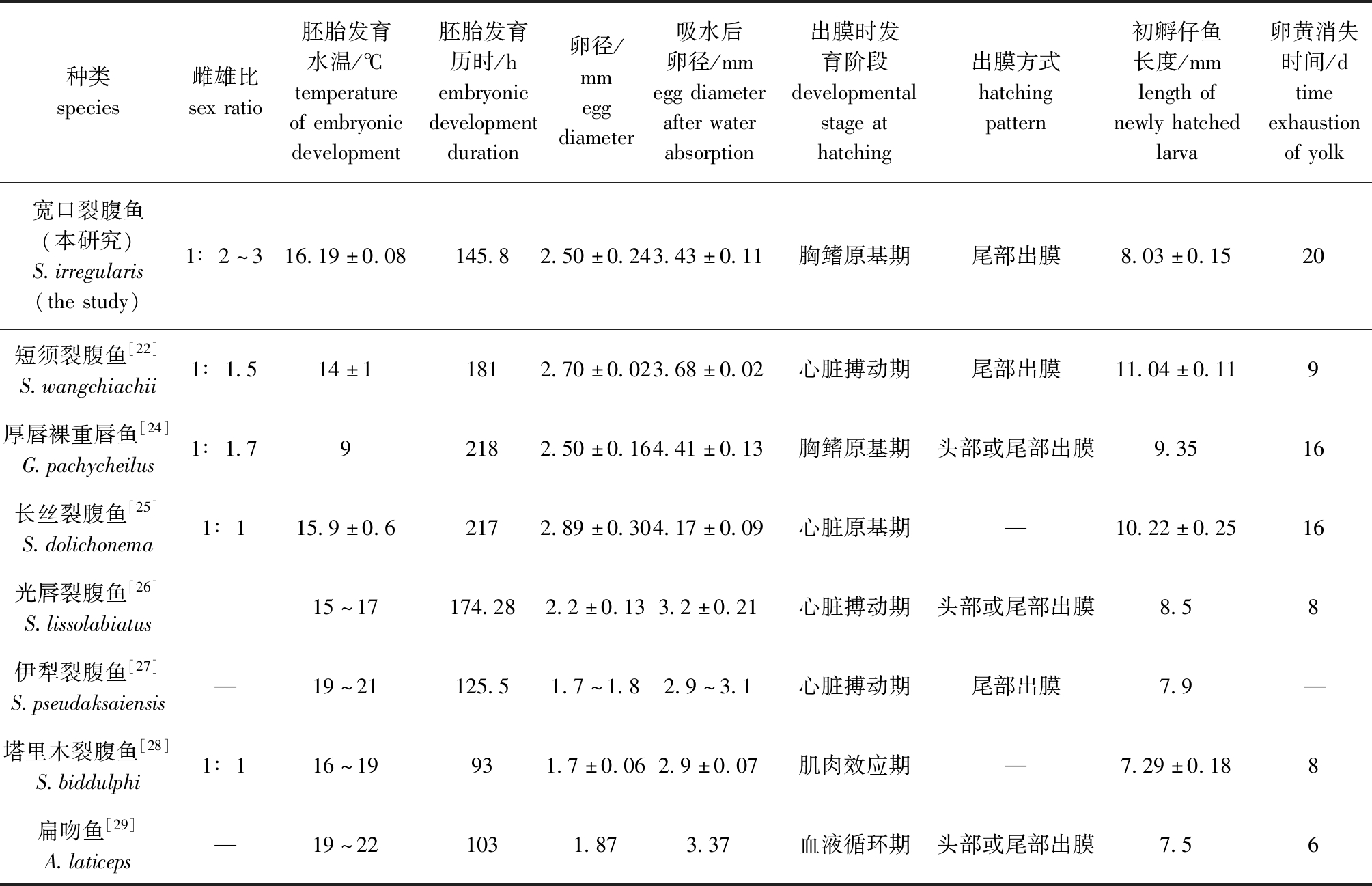
种类species雌雄比sexratio胚胎发育水温/℃temperatureofembryonicdevelopment胚胎发育历时/hembryonicdevelopmentduration卵径/mmeggdiameter吸水后卵径/mmeggdiameterafterwaterabsorption出膜时发育阶段developmentalstageathatching出膜方式hatchingpattern初孵仔鱼长度/mmlengthofnewlyhatchedlarva卵黄消失时间/dtimeexhaustionofyolk宽口裂腹鱼(本研究)S.irregularis(thestudy)1∶2~316.19±0.08145.82.50±0.243.43±0.11胸鳍原基期尾部出膜8.03±0.1520短须裂腹鱼[22]S.wangchiachii1∶1.514±11812.70±0.023.68±0.02心脏搏动期尾部出膜11.04±0.119厚唇裸重唇鱼[24]G.pachycheilus1∶1.792182.50±0.164.41±0.13胸鳍原基期头部或尾部出膜9.3516长丝裂腹鱼[25]S.dolichonema1∶115.9±0.62172.89±0.304.17±0.09心脏原基期—10.22±0.2516光唇裂腹鱼[26]S.lissolabiatus15~17174.282.2±0.133.2±0.21心脏搏动期头部或尾部出膜8.58伊犁裂腹鱼[27]S.pseudaksaiensis—19~21125.51.7~1.82.9~3.1心脏搏动期尾部出膜7.9—塔里木裂腹鱼[28]S.biddulphi1∶116~19931.7±0.062.9±0.07肌肉效应期—7.29±0.188扁吻鱼[29]A.laticeps—19~221031.873.37血液循环期头部或尾部出膜7.56
3.4 宽口裂腹鱼与其他裂腹鱼亚科鱼类的仔鱼发育差异
本研究中,宽口裂腹鱼初孵仔鱼全长大于伊犁裂腹鱼、塔里木裂腹鱼和扁吻鱼,小于短须裂腹鱼、厚唇裸重唇鱼、长丝裂腹鱼和光唇裂腹鱼(表5),估测宽口裂腹鱼初孵仔鱼在裂腹鱼亚科中属于中等类型。推测宽口裂腹鱼由于是中等体型,可以避免因体型太小而被捕食,或者因体型过大而消耗更多能量从而需要不停游动觅食的情况发生[33]。宽口裂腹鱼仔鱼出膜后20 d后卵黄囊才消耗殆尽,时间均长于其他裂腹鱼。鱼类营养方式从内源性向外源性转换时,由于各种原因会造成极高的死亡率,宽口裂腹鱼较长的卵黄囊吸收时间,是对低温环境长期适应的结果[34],但关于宽口裂腹鱼卵黄囊确切的发育机制有待进一步研究。
3.5 宽口裂腹鱼早期发育与环境适应性
本研究中,宽口裂腹鱼采自克孜勒河,平均海拔4 000 m以上,水源是天山南脉中吉边界西侧吉尔吉斯斯坦境内扎尔多布卡山口的冰山融水,水体中营养物质少,流域内生境贫瘠[35]。宽口裂腹鱼卵径和卵黄较大,含有丰富的营养物质,有利于减轻宽口裂腹鱼的摄食压力。生物个体在长期进化中形成了个体发育机制和生存策略,为了适应环境,生物个体会优先发育主要器官[36]。宽口裂腹鱼胚胎孵化温度较低,发育过程中器官发育较快,心脏、血液循环、尾鳍原基和胸鳍原基在出膜前就已形成,从而使出膜后的仔鱼能更好地适应贫营养型水体。出膜仔鱼卵黄囊存在时间较长,降低了仔鱼因摄取不到外源营养而死亡的风险。
综上,宽口裂腹鱼胚胎和早期仔鱼发育特征与其栖息水域生态环境密切相关,这些特征是宽口裂腹鱼对水域生态环境适应的一种表现。
4 结论
1)采用响应面法,最终得到水温为16.0~17.0 ℃时,宽口裂腹鱼人工催产使用的最佳催产药物用量组合为PG 10.27 mg/kg、HCG 300.00 IU/kg和LHRH-A2 19.41 μg/kg。这表明,利用响应面法可以优化宽口裂腹鱼的催产方案并提高孵化率。
2)宽口裂腹鱼受精卵卵径为(2.50±0.24)mm,其卵黄含有丰富的营养物质,出膜480 h后仔鱼卵黄囊才消耗完全,这有利于减轻宽口裂腹鱼的摄食压力,是生物个体在长期进化中形成的个体发育机制和生存策略。
[1] 李国刚,冯晨光,汤永涛,等.新疆内陆河土著鱼类资源调查[J].甘肃农业大学学报,2017,52(3):22-27.
LI G G,FENG C G,TANG Y T,et al.Survey of native fish resources in inland river system in Xinjiang[J].Journal of Gansu Agricultural University,2017,52(3):22-27.(in Chinese)
[2] 唐富江.新疆乌伦古湖外来鱼类对河鲈入侵机制的研究[D].重庆:西南大学,2008.
TANG F J.Study on invasion mechanism of alien fish to perch in Wulungu Lake,Xinjiang[D].Chongqing:Southwest University,2008.(in Chinese)
[3] 李雪健,贾佩尧,牛诚祎,等.新疆阿勒泰地区额尔齐斯河和乌伦古河流域鱼类多样性演变和流域健康评价[J].生物多样性,2020,28(4):422-434.
LI X J,JIA P Y,NIU C Y,et al.Species diversity of freshwater fish and assessment on watershed health in the Irtysh River and Ulungur River basins in Xinjiang,China[J].Biodiversity Science,2020,28(4):422-434.(in Chinese)
[4] 叶尚明,李兴玖,李晓春,等.新疆塔什库尔干河水库建设对鱼类资源的影响[J].水利渔业,2004(4):63-65.
YE S M,LI X J,LI X C,et al.Impact of the construction of Tashkurgan River Reservoir on fish resources in Xinjiang[J].Reservoir Fisheries,2004(4):63-65.(in Chinese)
[5] 殷名称.鱼类早期生活史研究与其进展[J].水产学报,1991,15(4):348-358.
YIN M C.Advances and studies on early life history of fish[J].Journal of Fisheries of China,1991,15(4):348-358.(in Chinese)
[6] 郑怀平.鱼类早期生活史的营养与摄食[J].盐城工学院学报(自然科学版),1999,12(3):63-66.
ZHENG H P.Nutrition and feeding of early life history of fishes[J].Journal of Yancheng Institute of Technology(Natural Science Edition),1999,12(3):63-66.(in Chinese)
[7] 郭焱.新疆鱼类志[M].乌鲁木齐:新疆科学技术出版社,2012:118-119.
GUO Y.Xinjiang fish[M].Urumqi:Xinjiang Science and Technology Press,2012:118-119.(in Chinese)
[8] 崔立新,李政海,张靖,等.克孜勒苏河流域植被覆盖空间格局及动态变化趋势分析[J].大连民族大学学报,2019,21(1):39-43.
CUI L X,LI Z H,ZHANG J,et al.Analysis on spatial pattern and dynamic change trend of vegetation cover in Kizil Su River Basin[J].Journal of Dalian Minzu University,2019,21(1):39-43.(in Chinese)
[9] 韩军军,陈朋,祁峰,等.新疆渭干河流域鱼类资源现状[J].水产科学,2022,41(1):92-100.
HAN J J,CHEN P,QI F,et al.Current situation of fish resources in Weigan River Basin of Xinjiang[J].Fisheries Science,2022,41(1):92-100.(in Chinese)
[10] 马燕武,郭焱,张人铭,等.新疆塔里木河水系土著鱼类区系组成与分布[J].水产学报,2009,33(6):949-956.
MA Y W,GUO Y,ZHANG R M,et al.Fauna composition and distribution of aboriginal fish in the Tarim River of Xinjiang Uygur Autonomous Region[J].Journal of Fisheries of China,2009,33(6):949-956.(in Chinese)
[11] 谢春刚,马燕武,郭焱.塔里木盆地鱼类生物地理学初步解析[J].水产学杂志,2015,28(2):40-46.
XIE C G,MA Y W,GUO Y.Analysis of biogeography of fishes in Tarim Basin[J].Chinese Journal of Fisheries,2015,28(2):40-46.(in Chinese)
[12] 海萨·艾也力汗,张人铭,牛建功,等.基于COI基因探讨塔里木河流域裂腹鱼属鱼类的亲缘关系[J].中国水产科学,2021,28(11):1417-1425.
HAISA· A Y L H,ZHANG R M,NIU J G,et al.Relationship of Schizothorax Heckel in Tarim River basin based on COI gene[J].Journal of Fishery Sciences of China,2021,28(11):1417-1425.(in Chinese)
[13] 杨天燕,孟玮,海萨,等.新疆几种裂腹鱼类系统发育关系探讨[J].干旱区研究,2011,28(3):555-561.
YANG T Y,MENG W,HAI S,et al.Molecular phylogeny of Schizothoracinae fishes in Xinjiang based on mitochondrial cytochrome b gene sequences[J].Arid Zone Research,2011,28(3):555-561.(in Chinese)
[14] 海萨·艾也力汗,郭焱,孟玮,等.新疆裂腹鱼类的系统发生关系及物种分化时间[J].遗传,2014,36(10):1013-1020.
HAISA·A Y L H,GUO Y,MENG W,et al.Phylogeny and divergence time estimation of Schizothoracinae fishes in Xinjiang[J].Hereditas,2014,36(10):1013-1020.(in Chinese)
[15] 王德忠.新疆的裂腹鱼亚科鱼类研究[J].干旱区研究,1998,15(4):26-32.
WANG D Z.The Schizothoracinae fishs in Xinjiang[J].Arid Zone Research,1998,15(4):26-32.(in Chinese)
[16] PINKAS L.Food habits of albacore,bluefin tuna and bonito in California waters[J].Fish Bull,1971,152:100-105.
[17] 章海鑫,李彩刚,李艳芳,等.不同催产剂对黄尾鲴人工繁殖效果的影响[J].江西水产科技,2017(4):7-9,13.
ZHANG H X,LI C G,LI Y F,et al.Effects of different oxytocin on artificial reproduction of Xenocypris davidi Bleeker[J].Jiangxi Fishery Science and Technology,2017(4):7-9,13.(in Chinese)
[18] 骆小年,赵兴文,段友健.中国主要养殖经济鱼类人工催产药物使用进展[J].大连海洋大学学报,2020,35(1):10-18.
LUO X N,ZHAO X W,DUAN Y J.Application of artificial hormones in induction to spawn in economically important main fishes in China:a review[J].Journal of Dalian Ocean University,2020,35(1):10-18.(in Chinese)
[19] ZHAO W Z,YU Z P,LIU J B,et al.Optimized extraction of polysaccharides from corn silk by pulsed electric field and response surface quadratic design[J].Journal of the Science of Food and Agriculture,2011,91(12):2201-2209.
[20] 曾本和,杨瑞斌,刘海平,等.拉萨裂腹鱼人工繁殖初探[J].淡水渔业,2020,50(5):69-73.
ZENG B H,YANG R B,LIU H P,et al.Preliminary study on artificial propagation of Schizothorax waltoni[J].Freshwater Fisheries,2020,50(5):69-73.(in Chinese)
[21] 许勇.人工驯繁下的长丝裂腹鱼卵及胚胎发育特征观察[J].西南农业学报,2019,32(4):942-946.
XU Y.Observation of egg and embryonic development of Schizothorax dolichonema Herzenstein by artificial breeding and propagation technique[J].Southwest China Journal of Agricultural Sciences,2019,32(4):942-946.(in Chinese)
[22] 甘维熊,王红梅,邓龙君,等.雅砻江短须裂腹鱼胚胎和卵黄囊仔鱼的形态发育[J].动物学杂志,2016,51(2):253-260.
GAN W X,WANG H M,DENG L J,et al.The morphological development of embryos and yolk-sac larvae of Yalong River Wangchiachii’s Schizothoracin(Schizothorax)wangchiachii[J].Chinese Journal of Zoology,2016,51(2):253-260.(in Chinese)
[23] 赵贺,洪继彪,赵年桦,等.新疆克孜勒河厚唇裂腹鱼人工繁殖、胚胎发育和早期仔鱼发育研究[J].大连海洋大学学报,2021,36(3):414-422.
ZHAO H,HONG J B,ZHAO N H,et al.Study on the artificial propagation technology,embryonic and early larval development of Schizothorax irregularis in the Kizil River in Xinjiang[J].Journal of Dalian Ocean University,2021,36(3):414-422.(in Chinese)
[24] 张艳萍,王太,焦文龙,等.厚唇裸重唇鱼胚胎发育的形态学观察[J].四川动物,2013,32(3):389-392.
ZHANG Y P,WANG T,JIAO W L,et al.Morphology observation of the embryonic development of Gymnodiptychus pachycheilus[J].Sichuan Journal of Zoology,2013,32(3):389-392.(in Chinese)
[25] 刘小帅,王红梅,甘维熊,等.雅砻江长丝裂腹鱼胚胎形态发育及仔鱼生长研究[J].安徽农业科学,2017,45(31):118-121.
LIU X S,WANG H M,GAN W X,et al.Study on embryonic morphological development and the larvae growth of Schizothorax dolichonema in Yalong River[J].Journal of Anhui Agricultural Sciences,2017,45(31):118-121.(in Chinese)
[26] 申安华,李光华,赵树海,等.光唇裂腹鱼胚胎发育与仔鱼早期发育的研究[J].水生态学杂志,2013,34(6):76-80.
SHEN A H,LI G H,ZHAO S H,et al.Study on embryonic and early larval development of Schizothorax lissolabiatus[J].Journal of Hydroecology,2013,34(6):76-80.(in Chinese)
[27] 蔡林钢,牛建功,张北平,等.伊犁裂腹鱼胚胎及早期仔鱼发育的观察[J].淡水渔业,2011,41(5):74-79.
CAI L G,NIU J G,ZHANG B P,et al.Observation on embryonic and larval development of Schizothorax pseudaksaiensis Herzenstein[J].Freshwater Fisheries,2011,41(5):74-79.(in Chinese)
[28] 龚小玲,崔忠凯,吴敏芝,等.塔里木裂腹鱼胚胎和仔鱼的发育与生长[J].上海海洋大学学报,2013,22(6):827-834.
GONG X L,CUI Z K,WU M Z,et al.Study on embryonic development and larval growth of Schizothorax biddulphi Günther[J].Journal of Shanghai Ocean University,2013,22(6):827-834.(in Chinese)
[29] 任波,任慕莲,郭焱,等.扁吻鱼胚胎及仔鱼发育的形态学观察[J].大连水产学院学报,2007,22(6):397-402.
REN B,REN M L,GUO Y,et al.Morphological observation of the development of Aspiorhynchus laticeps embryo and larva[J].Journal of Dalian Fisheries University,2007,22(6):397-402.(in Chinese)
[30] YAMAMOTO S,NAKANO S,TOKUDA Y.Variation and divergence of the life-history of Japanese charr Salvelinus leucomaenis in an artificial lake-inlet stream system[J].Japanese Journal of Ecology,1992,42(2):149-157.
[31] GOTO A.Alternative life-history styles of Japanese freshwater sculpins revisited[J].Environmental Biology of Fishes,1990,28(1/2/3/4):101-112.
[32] 姜建湖,张德明,竺俊全,等.光唇鱼(Acrossocheilus fasciatus)胚胎及仔、稚鱼的发育[J].海洋与湖沼,2012,43(2):280-287.
JIANG J H,ZHANG D M,ZHU J Q,et al.The development of embryo larva and juvenile of Acrossocheilus fasciatus[J].Oceanologia et Limnologia Sinica,2012,43(2):280-287.(in Chinese)
[33] 刘俊果,宋炜,蒋科技,等.棘头梅童鱼胚胎发育和仔鱼形态观察[J].海洋渔业,2018,40(6):691-702.
LIU J G,SONG W,JIANG K J,et al.Observation of embryonic development and larval morphology of Collichthys lucidus[J].Marine Fisheries,2018,40(6):691-702.(in Chinese)
[34] 马宾,张磊,张志强,等.欧洲舌齿鲈胚胎发育及仔鱼生长观察[J].大连海洋大学学报,2019,34(3):303-309.
MA B,ZHANG L,ZHANG Z Q,et al.Observation of embryonic and larval development of sea bass Dicentrarchus labrax[J].Journal of Dalian Ocean University,2019,34(3):303-309.(in Chinese)
[35] 刘伟东,刘翀,张靖.克孜勒苏河流域生态脆弱性评价[J].天津农业科学,2018,24(4):79-81,90.
LIU W D,LIU C,ZHANG J.Evaluation of ecological vulnerability in Kizil Su River basin[J].Tianjin Agricultural Sciences,2018,24(4):79-81,90.(in Chinese)
[36] NOGUEIRA L B,GODINHO A L,GODINHO H P.Early development and allometric growth in hatchery-reared characin Brycon orbignyanus[J].Aquaculture Research,2014,45(6):1004-1011.