曼氏无针乌贼Sepiella maindroni隶属于软体动物门Mollusca头足纲Cephalopoda乌贼目Sepiida乌贼科Sepiidae无针乌贼属Sepiella,广泛分布于印度东海岸至西太平洋海域,在中国集中分布于浙江省近海与闽东海域[1]。20世纪90年代至21世纪初,作为东海“四大渔产”之一的曼氏无针乌贼资源急剧衰退[2]。近年来,随着全人工育苗与增养殖技术的突破,浙江省在沿岸海域持续开展曼氏无针乌贼规模化增殖放流,其资源呈现恢复迹象[3-5]。捕捞曼氏无针乌贼的主要方式为沿岸定置张网作业,根据近年来舟山定置张网的捕捞数据,六横岛至中街山列岛海域年度总回捕量增幅明显[2]。目前,科研人员已对曼氏无针乌贼进行了繁殖生物学研究,包括其繁殖习性、生殖系统组织学、雌性个体怀卵量与繁殖力等[6-9],但关于雄性个体繁殖力的研究尚未见报道。雄性个体繁殖力大小及其潜在的精卵比例,对合理制定曼氏无针乌贼在养殖过程中的亲本投放比例,具有重要的实践指导意义[10]。
曼氏无针乌贼采取一雄多雌的交配策略,两性亲本均存在多次交配现象[11-12],其个体繁殖力大小能够反映出该物种繁殖后代和生存的能力[13]。目前,有关浙江省沿岸海域曼氏无针乌贼雌性个体繁殖力总体情况已有报道,但各海域特别是舟山海域相关状况尚不清楚[9]。本研究中,以繁殖旺季舟山自然海域曼氏无针乌贼为研究对象,检测了性成熟雌、雄个体繁殖力,以期为揭示曼氏无针乌贼的生殖策略及开展其规模化养殖提供理论依据。
1 材料与方法
1.1 材料
试验样本源于舟山市沿岸海域定置张网作业监测点,共有70顶网,每天生产一次。张网网口为正方形,边长8 m。张网作业位于浙江省舟山市六横岛东南磨盘洋海域,由于4—5月为曼氏无针乌贼繁殖旺盛期,故本试验于2021年4月采集所有张网渔获物中的曼氏无针乌贼。共采集曼氏无针乌贼355只样本,其中雌、雄个体数分别为153只和202只。样本冷藏运输至浙江省海洋渔业资源可持续利用技术研究重点实验后,立刻进行生物学特征分析及繁殖力计算。
1.2 方法
1.2.1 生物学指标的测定 对采集的355只曼氏无针乌贼样本的胴长、体质量、性别、性腺发育程度、卵巢质量、缠卵腺长、缠卵腺质量、精巢质量和精荚复合体质量等指标进行测定,长度测定精确到1 mm,体质量测定除精确到0.1 g,其余质量测定精确到0.01 g。性腺发育程度划分为Ⅰ~Ⅵ期,Ⅴ期及以上为性成熟[14]。
1.2.2 繁殖力指标的测定与计算 采用频度分析法[15]分析样本胴长和体质量分布,组距分别为10 mm和20 g。性腺成熟系数(gonadosomatic index,GSI)、缠卵腺指数(nidamental gland index,NGI)和精荚复合体指数(spermatophoric complex index,SCI)计算公式分别为
GSI=WG/W×100%,
NGI=LNG/LDM×100%,
SCI=WSC/W×100%。
其中:WG为性腺质量(g);W为体质量(g);LNG为缠卵腺长(mm);LDM为胴长(mm);WSC为精荚复合体质量(g)。
繁殖力的计算选择性腺成熟度为Ⅴ期的个体为研究对象。雌、雄个体的繁殖力定义为潜在繁殖力(potential fecundity,Fp)和相对繁殖力(relative fecundity,Fr),雌性个体潜在繁殖力为卵巢卵母细胞与输卵管中成熟卵子数量之和(cell),雄性个体则为精荚囊中精荚数量(条);相对繁殖力为潜在繁殖力与体质量或胴长的比值[13]。
1.3 数据处理
利用Kolmogorov-Smirnov检验分析不同性腺成熟度间性腺成熟系数、缠卵腺指数与精荚复合体指数的差异性[16]。利用χ2拟合优度(Chi-square goodness-of-fittest)检验判断总体及不同性腺成熟度等级的雌、雄比例是否符合1∶1,用Pearson相关性分析显示缠卵腺指数与卵巢成熟系数间、精荚复合体指数与精巢成熟系数间的相关性[17]。利用线性函数、指数函数、幂函数、对数函数分别拟合回归潜在繁殖力与胴长、体质量、缠卵腺长、缠卵腺质量、精荚囊长、精荚复合体质量、卵巢成熟系数、精巢成熟系数的关系,选择拟合R2值最高者为最终的拟合函数[18-19]。
采用SPSS 25软件完成以上统计学分析,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 群体组成
曼氏无针乌贼胴长为29~141 mm,体质量为5.1~341.8 g。其中,雌性个体胴长平均值为(102.30±23.99)mm,优势胴长组为91~130 mm,体质量平均值为(162.56±73.92)g,优势体质量组为120.1~240.0 g;雄性个体胴长平均值为(95.53±20.36)mm,优势胴长组为81~120 mm,体质量平均值为(122.10±51.02)g,优势体质量组为80.1~180.0 g(图1)。统计分析表明,雌、雄个体间胴长和体质量均有极显著性差异(P<0.01)。
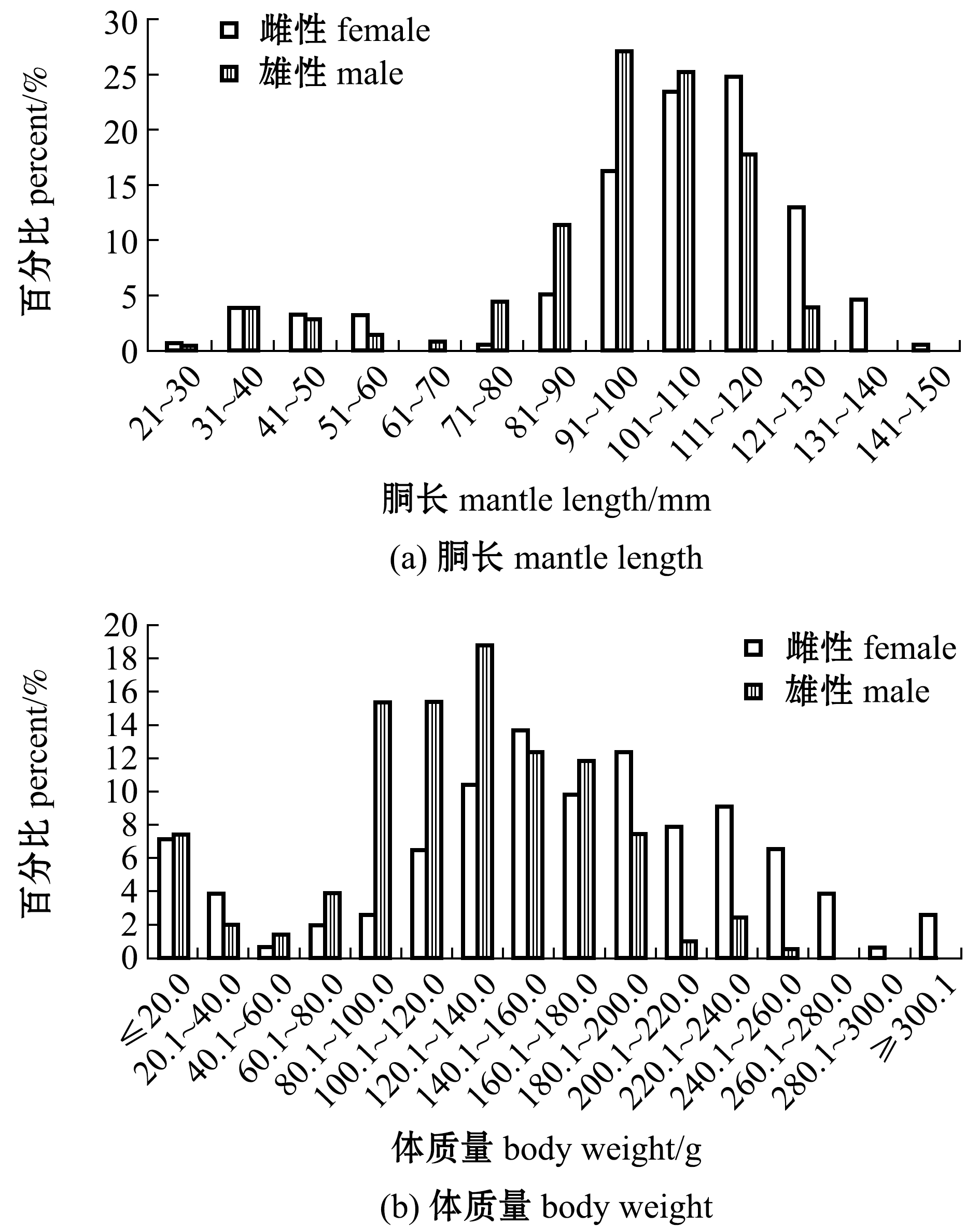
图1 曼氏无针乌贼胴长与体质量分布
Fig.1 Distribution of mantle length and body weight of the cuttlefish Sepiella maindroni
曼氏无针乌贼性腺成熟度组成见表1,雌、雄比例为1∶1.32,符合雌、雄比为1∶1的假设(χ2=3.62,P=0.06)。性腺成熟度为Ⅳ期、Ⅴ期的雌、雄比分别为1∶1.66和1∶1.26,均符合雌、雄比为1∶1的假设(χ2=2.63,P=0.11;χ2=1.63,P=0.20)。
表1 曼氏无针乌贼性腺成熟度分布
Tab.1 Distribution of maturity stages of the cuttlefish Sepiella maindroni
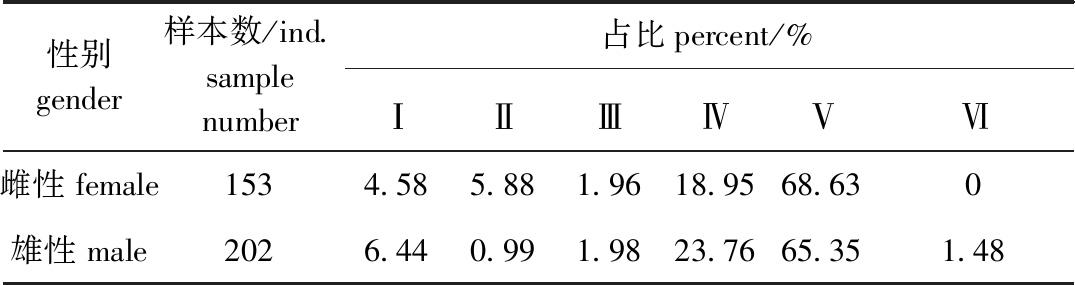
性别gender样本数/ind.samplenumber占比percent/%ⅠⅡⅢⅣⅤⅥ雌性female1534.585.881.9618.9568.630雄性male2026.440.991.9823.7665.351.48
2.2 缠卵腺指数、卵巢成熟系数和卵径
雌性曼氏无针乌贼缠卵腺长与缠卵腺质量呈幂函数关系:![]() (图2)。总体上,缠卵腺指数为23.73%~43.65%,平均值为35.48%±3.93%;卵巢成熟系数为0.53%~16.45%,平均值为9.64%±2.81%(表2)。Pearson相关性分析显示,缠卵腺指数与成熟系数密切相关(r=0.39,P<0.01)。性腺成熟度为Ⅳ期时,成熟系数平均值为7.68%±2.42%,缠卵腺指数平均值为34.09%±3.13%;Ⅴ期时,成熟系数平均值为10.39%±2.27%,缠卵腺指数平均值为36.09%±3.77%(表2)。性成熟个体(Ⅴ期)与未成熟个体(Ⅳ期)的卵巢成熟系数间有极显著性差异(P<0.01),缠卵腺指数间有显著性差异(P<0.05)。
(图2)。总体上,缠卵腺指数为23.73%~43.65%,平均值为35.48%±3.93%;卵巢成熟系数为0.53%~16.45%,平均值为9.64%±2.81%(表2)。Pearson相关性分析显示,缠卵腺指数与成熟系数密切相关(r=0.39,P<0.01)。性腺成熟度为Ⅳ期时,成熟系数平均值为7.68%±2.42%,缠卵腺指数平均值为34.09%±3.13%;Ⅴ期时,成熟系数平均值为10.39%±2.27%,缠卵腺指数平均值为36.09%±3.77%(表2)。性成熟个体(Ⅴ期)与未成熟个体(Ⅳ期)的卵巢成熟系数间有极显著性差异(P<0.01),缠卵腺指数间有显著性差异(P<0.05)。
表2 曼氏无针乌贼的缠卵腺指数和卵巢成熟系数
Tab.2 Nidamental gland index and gonadosomatic index of ovary of the cuttlefish Sepiella maindroni
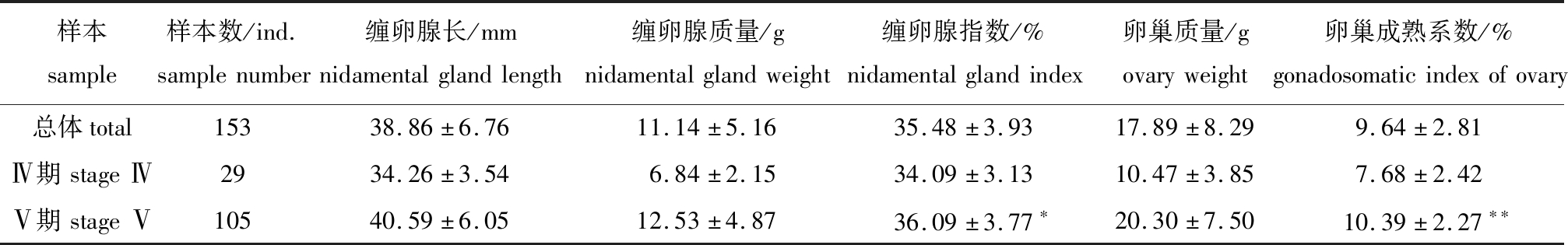
样本sample样本数/ind.samplenumber缠卵腺长/mmnidamentalglandlength缠卵腺质量/gnidamentalglandweight缠卵腺指数/%nidamentalglandindex卵巢质量/govaryweight卵巢成熟系数/%gonadosomaticindexofovary总体total15338.86±6.7611.14±5.1635.48±3.9317.89±8.299.64±2.81Ⅳ期stageⅣ2934.26±3.546.84±2.1534.09±3.1310.47±3.857.68±2.42Ⅴ期stageⅤ10540.59±6.0512.53±4.8736.09±3.77∗20.30±7.5010.39±2.27∗∗
注:*表示Ⅴ期与Ⅳ期样本间有显著性差异(P<0.05);**表示有极显著性差异(P<0.01),下同。
Note:*means significant difference between the stage Ⅴ and the stage Ⅳ(P<0.05);**means very significant difference between the stage Ⅴ and the stage Ⅳ(P<0.01),et sequentia.
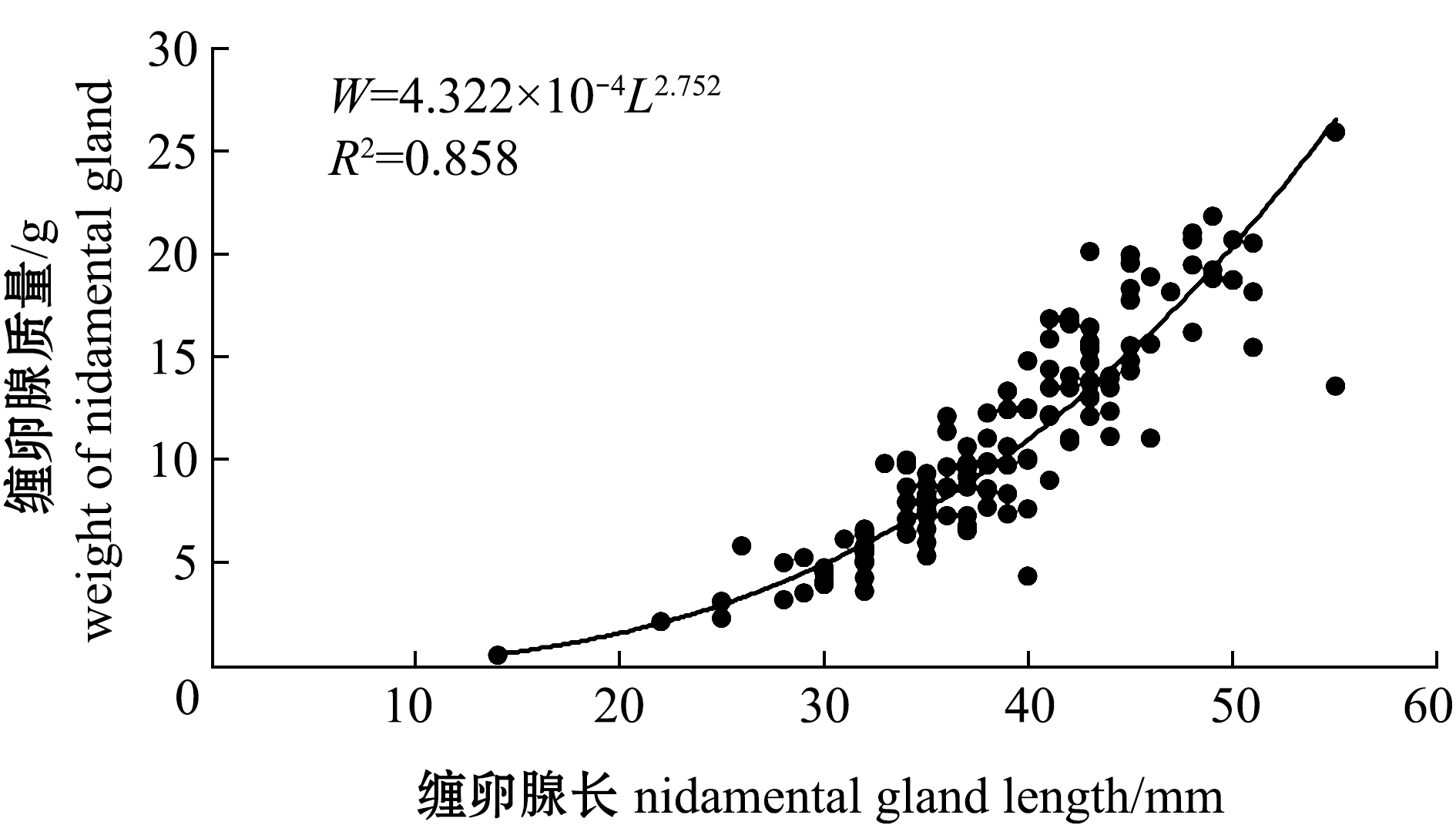
图2 曼氏无针乌贼缠卵腺长与缠卵腺质量的关系
Fig.2 Relationships between length and weight of nidamental gland of the cuttlefish Sepiella maindroni
随机选择39只性成熟(Ⅴ期)曼氏无针乌贼,每只测量3个受精卵的卵径,结果显示,其长径为3.32~5.95 mm,平均值为(4.77±0.39)mm,短径为2.71~5.16 mm,平均值为(3.91±0.40)mm。
2.3 精荚复合体指数和精巢成熟系数
雄性曼氏无针乌贼精荚囊长(Lsc)与精荚复合体质量(WSC)呈幂函数关系:![]() (图3)。总体上,精荚复合体指数为1.30%~4.41%,平均值为2.55%±0.72%;精巢成熟系数为0.91%~6.83%,平均值为2.38%±0.65%(表3)。Pearson相关性分析显示,精荚复合体指数与精巢成熟系数密切相关(r=0.16,P=0.04)。性腺成熟度为Ⅳ期时,精巢成熟系数平均值为2.48%±0.64%,精荚复合体指数平均值为2.20%±0.52%;Ⅴ期时,精巢成熟系数平均值为2.35%±0.65%,精荚复合体指数平均值为2.70%±0.73%。性成熟个体(Ⅴ期)与未成熟个体(Ⅳ期)精荚复合体指数间有极显著性差异(P<0.01),但二者的精巢成熟系数间无显著性差异(P>0.05)。
(图3)。总体上,精荚复合体指数为1.30%~4.41%,平均值为2.55%±0.72%;精巢成熟系数为0.91%~6.83%,平均值为2.38%±0.65%(表3)。Pearson相关性分析显示,精荚复合体指数与精巢成熟系数密切相关(r=0.16,P=0.04)。性腺成熟度为Ⅳ期时,精巢成熟系数平均值为2.48%±0.64%,精荚复合体指数平均值为2.20%±0.52%;Ⅴ期时,精巢成熟系数平均值为2.35%±0.65%,精荚复合体指数平均值为2.70%±0.73%。性成熟个体(Ⅴ期)与未成熟个体(Ⅳ期)精荚复合体指数间有极显著性差异(P<0.01),但二者的精巢成熟系数间无显著性差异(P>0.05)。
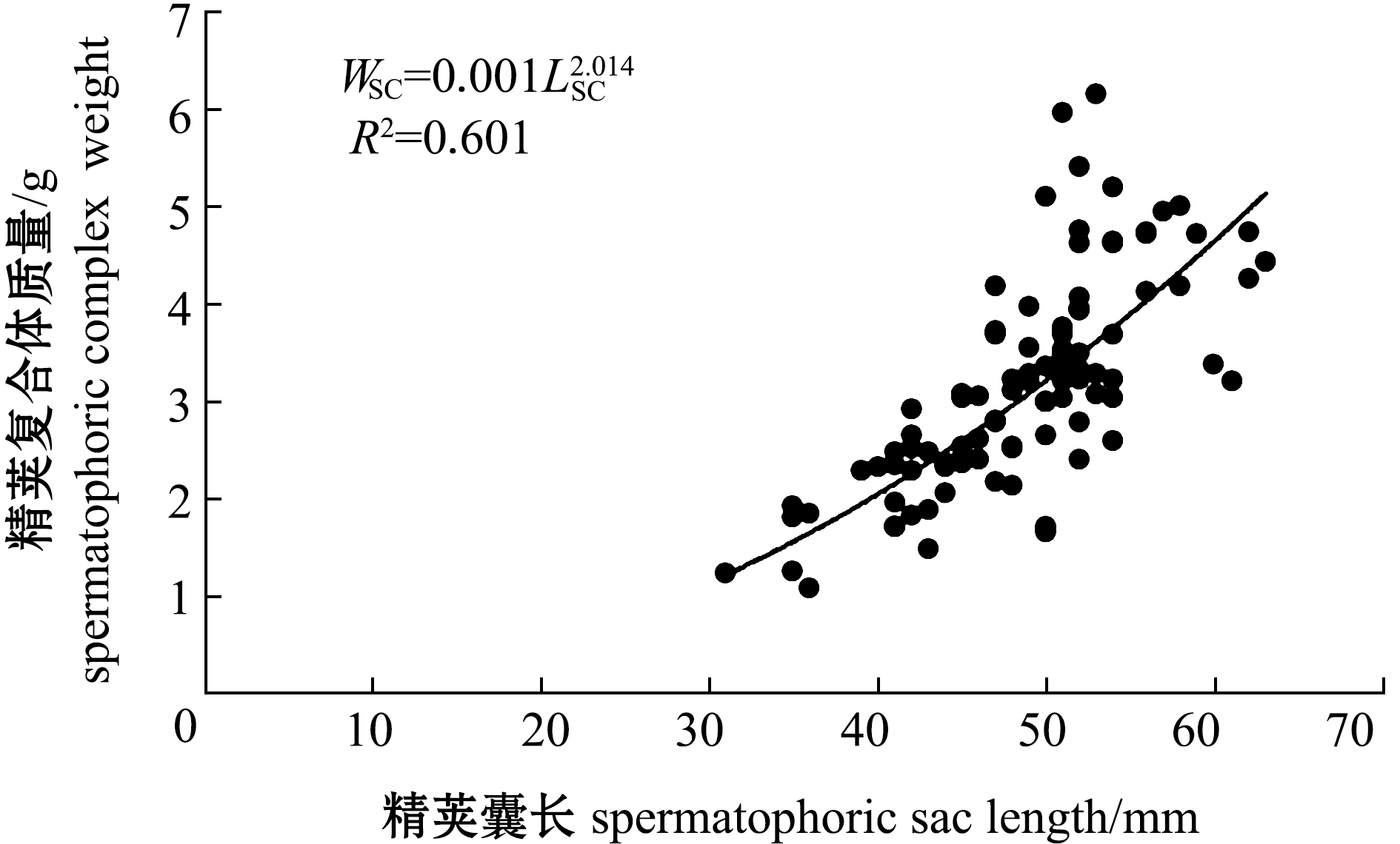
图3 曼氏无针乌贼精荚囊长与精荚复合体质量的关系
Fig.3 Relationships between length of spermatophoric sac and weight of spermatophoric complex of the cuttlefish Sepiella maindroni
表3 曼氏无针乌贼的精荚复合体指数和精巢成熟系数
Tab.3 Spermatophoric complex index and gonadosomatic index of testis of the cuttlefish Sepiella maindroni

样本sample样本数/ind.samplenumber精荚囊长/mmspermatophoricsaclength精荚复合体质量/gspermatophoriccomplexweight精荚复合体指数/%spermatophoriccomplexindex精巢质量/gtestisweight精巢成熟系数/%gonadosomaticindexoftestis总体total20248.64±6.393.18±1.082.55±0.723.05±0.852.38±0.65Ⅳ期stageⅣ4849.66±6.233.55±1.102.20±0.523.09±0.912.48±0.64Ⅴ期stageⅤ13245.96±5.392.64±0.652.70±0.73∗∗2.94±0.712.35±0.65
2.4 个体繁殖力
选择性腺成熟度为Ⅴ期的曼氏无针乌贼雌、雄个体计算繁殖力,结果见表4。雌性性成熟个体潜在繁殖力为554~1 845 cells,平均值为(1 121.01±329.55)cells;胴长相对繁殖力为5.77~16.22 cells/mm,平均值为(9.76±2.43)cells/mm;体质量相对繁殖力为3.63~9.17 cells/g,平均值为(5.77±1.28)cells/g。雌性个体的潜在繁殖力(Fp)与胴长(LDM)、体质量(W)、缠卵腺质量(WNG)均呈幂函数关系,与缠卵腺长(LNG)呈对数关系,与卵巢成熟系数(GSI)呈线性函数关系,即:
表4 曼氏无针乌贼性成熟个体(Ⅴ期)的繁殖力
Tab.4 Fecundity of the cuttlefish Sepiella maindroni(stage Ⅴ)
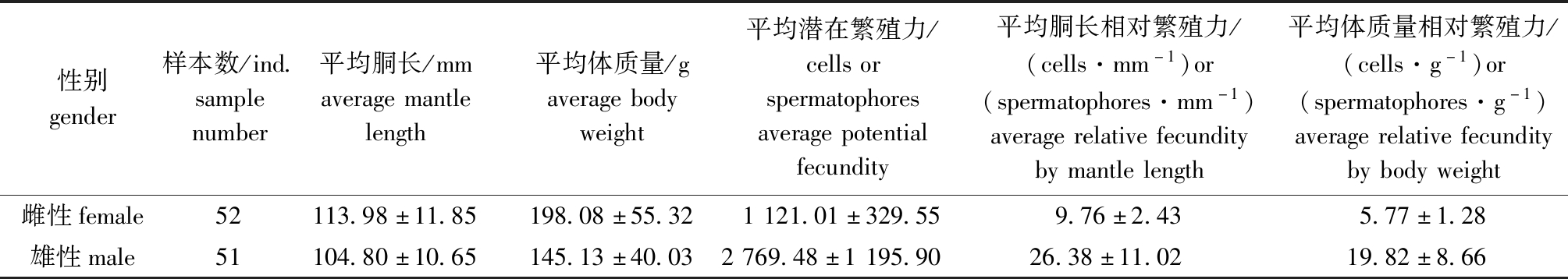
性别gender样本数/ind.samplenumber平均胴长/mmaveragemantlelength平均体质量/gaveragebodyweight平均潜在繁殖力/cellsorspermatophoresaveragepotentialfecundity平均胴长相对繁殖力/(cells·mm-1)or(spermatophores·mm-1)averagerelativefecunditybymantlelength平均体质量相对繁殖力/(cells·g-1)or(spermatophores·g-1)averagerelativefecunditybybodyweight雌性female52113.98±11.85198.08±55.321121.01±329.559.76±2.435.77±1.28雄性male51104.80±10.65145.13±40.032769.48±1195.9026.38±11.0219.82±8.66
Fp=20.349W0.756,R2=0.527,P<0.01,
Fp=1 442.0 lnLNG-4 198.2,R2=0.568,
P<0.01,
Fp=9 565.6GSI+106.94,R2=0.330,P<0.01。
雄性性成熟个体的潜在繁殖力为1 122~6 270条,平均值为(2 769.48±1 195.90)条;胴长相对繁殖力为10.41~57.00条/mm,平均值为(26.38±11.02)条/mm;体质量相对繁殖力为7.27~42.51条/g,平均值为(19.82±8.66)条/g。雄性潜在繁殖力与体质量呈指数函数关系,与精荚囊长(LSC)和精荚复合体质量(WSC)呈幂函数关系,与胴长、精巢成熟系数相关关系均不显著(P>0.05),即:
Fp=1 415.8e0.004W,R2=0.132,P<0.01,
3 讨论
3.1 曼氏无针乌贼的繁殖特性
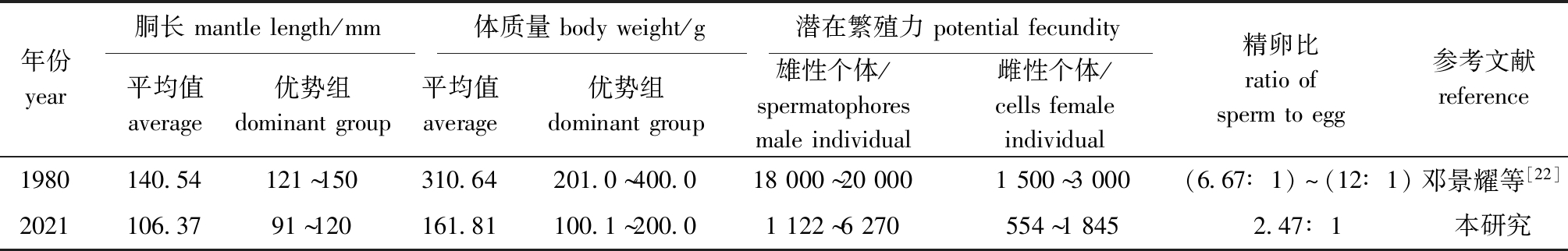
本研究中,根据性腺发育程度,曼氏无针乌贼即将性成熟(Ⅳ期)个体与性成熟(Ⅴ期与Ⅵ期)个体占总体的比例为89.30%,因此,采集样本主要为生殖群体。根据浙江省近海曼氏无针乌贼资源张网监测报告,1982年4月下旬,浙江省北部中街山列岛海域的曼氏无针乌贼生殖群体胴长和体质量平均值分别为140.54 mm、310.64 g[20],该胴长与体质量均明显大于本研究结果(106.37 mm、161.81 g,表5),说明曼氏无针乌贼个体小型化现象严重。曼氏无针乌贼总体雌、雄比及不同性腺发育期雌、雄比与1∶1的假设无显著性差异,符合Fisher法则[21]。吴常文等[9]通过对2009—2011年浙江省近海曼氏无针乌贼进行周年监测,认为其卵巢成熟系数4月达到最大(9.51%±7.23%),这与本研究结果(9.46%±2.81%)基本一致。通过对舟山沿岸水域张网作业捕获的曼氏无针乌贼采样调查,发现3月下旬—4月上旬绝大多数曼氏无针乌贼卵巢已发育成熟。由此看出,2021年曼氏无针乌贼卵巢发育较20世纪80年代初期有所提前。
缠卵腺是曼氏无针乌贼雌性个体生殖系统的重要组成部分,密切参与生殖活动[22]。而雄性个体生殖系统中精巢内的精子经输精管到达贮精囊,最终被逐步纳入精荚。本研究表明,曼氏无针乌贼性成熟个体缠卵腺指数和精荚复合体指数显著大于未成熟个体,这在其他头足类中也得以体现[18,23],但与精巢成熟系数无显著性差异,这可能与精子的储存及精荚的形成过程等有关[24]。因此,缠卵腺指数与精荚复合体指数可作为曼氏无针乌贼性成熟判别的重要指标。
3.2 曼氏无针乌贼的繁殖力
对比不同年份曼氏无针乌贼生殖群体潜在繁殖力发现,20世纪80年代,进入产卵场的性成熟雄性亲体精荚囊中精荚数量为18 000~20 000条,而性成熟雌性亲体卵巢及输卵管内卵子数量为1 500~3 000 cells,精卵比为(6.67∶1)~(12∶1)[22](表5),该性成熟雌、雄个体繁殖力明显大于本研究结果,这可能与个体胴长和体质量大小及所在海域不同有关[25-26]。吴常文等[9]对不同时期浙江省近海曼氏无针乌贼个体繁殖力进行比较分析,认为20世纪80年代雌性个体绝对繁殖力(输卵管中成熟卵子数)最大,平均为447 cells。绝对繁殖力反映自然排出卵巢并完成受精的卵子数,体现个体潜在繁殖力的有效部分。本研究中,曼氏无针乌贼精卵比(平均为2.47∶1)明显小于20世纪80年代,因此,为避免精子限制现象发生,在曼氏无针乌贼规模化养殖过程中,采用合理的亲本投放性比,进而达到合适的潜在精卵比显得尤为重要[10]。
表5 不同年份曼氏无针乌贼生殖群体潜在繁殖力
Tab.5 Potential fecundity of spawning stocks of the cuttlefish Sepiella maindroni in different years
胴长相对繁殖力与体质量相对繁殖力是衡量头足类个体繁殖力大小的重要指标。本研究中,曼氏无针乌贼雌性个体潜在繁殖力和胴长相对繁殖力(平均值分别为1 121.01 cells、9.76 cells/mm)均小于乌贼Sepia officinalis(平均值分别为2 466 cells和14.17 cells/mm),而体质量相对繁殖力(平均值5.77 cells/g)则大于乌贼(平均值为5.18 cells/g),这说明其单个卵子的生殖投入略低于乌贼[26]。乌贼类单个卵子的生殖投入普遍较高,明显高于大洋性柔鱼类,这与其栖息地环境密切相关[19]。与体型较小的乌贼类相比,曼氏无针乌贼雌、雄个体潜在繁殖力均较大,但雌性个体体质量相对繁殖力仅大于太平洋僧头乌贼Rossia pacifica(平均值为3.70 cells/g),这与太平洋僧头乌贼受精卵卵径较大有关,其值约为胴长的10%[27]。而本研究中曼氏无针乌贼受精卵卵径较小,长径与胴长的比值为3.08%~6.17%,平均值为4.31%±0.01%。由此看出,卵径大小与个体相对繁殖力密切相关。
4 结论
1)本次采集的样本主要为生殖群体,卵巢成熟系数较大,说明4月是舟山沿岸水域曼氏无针乌贼繁殖旺盛期,其卵巢发育较20世纪80年代有所提前。
2)缠卵腺指数与精荚复合体指数均与性腺成熟系数密切相关,且性成熟个体的这两个指标显著大于未成熟个体。说明,缠卵腺指数与精荚复合体指数可作为曼氏无针乌贼性成熟判别的重要指标。
3)与20世纪80年代相比,曼氏无针乌贼潜在繁殖力与精卵比均明显降低,在今后的曼氏无针乌贼规模化养殖生产实践中需要考虑合理的亲本投放性比,以提高卵细胞受精率。
[1] 周永东,李圣法.东海区主要经济种类三场一通道及保护区图集[M].北京:海洋出版社,2018:44-47.
ZHOU Y D,LI S F.Atlas of spawning,feeding and wintering gro- unds,migration channels and protected areas of main target species for fisheries in the south Yellow Sea and East China Sea[M].Beijing:Ocean Press,2018:44-47.(in Chinese)
[2] 李继姬,郭宝英,吴常文.浙江海域曼氏无针乌贼资源演变及修复路径探讨[J].浙江海洋学院学报(自然科学版),2011,30(5):381-385,396.
LI J J,GUO B Y,WU C W.A review of the resource evolvement and the way of restoration of Sepiella maindroni in coastal waters of Zhejiang Province[J].Journal of Zhejiang Ocean University (Natural Science Edition),2011,30(5):381-385,396.(in Chinese)
[3] 常抗美,吴常文,吕振明,等.曼氏无针乌贼胚胎发育与人工育苗技术的研究[J].浙江海洋学院学报(自然科学版),2009,28(3):257-263.
CHANG K M,WU C W,LÜ Z M,et al.Study on embryo development and artificial breeding of Sepiella maindroni[J].Journal of Zhejiang Ocean University (Natural Science Edition),2009,28(3):257-263.(in Chinese)
[4] 董智勇.中街山列岛曼氏无针乌贼增殖放流、产卵场修复及效果分析[D].舟山:浙江海洋学院,2010.
DONG Z Y.Enhancement and effects analysis,and spawning gro- unds rehabilitation of Sepiella maindroni in Zhongjieshan waters[D].Zhoushan:Zhejiang Ocean University,2010.(in Chinese)
[5] 徐开达,周永东,王洋,等.浙北近海曼氏无针乌贼增殖放流效果评估[J].中国水产科学,2018,25(3):654-662.
XU K D,ZHOU Y D,WANG Y,et al.Effect and assessment of enhancement release of Sepiella maindroni in the northern coastal water of Zhejiang[J].Journal of Fishery Sciences of China,2018,25(3):654-662.(in Chinese)
[6] 张建设,夏灵敏,迟长凤,等.人工养殖曼氏无针乌贼(Sepiella maindroni)繁殖生物学特性研究[J].海洋与湖沼,2011,42(1):55-59.
ZHANG J S,XIA L M,CHI C F,et al.Study on reproductive biology characteristics of cultured rochebrune(Sepiella maindroni)[J].Oceanologia et Limnologia Sinica,2011,42(1):55-59.(in Chinese)
[7] 吴常文,董智勇,迟长凤,等.曼氏无针乌贼(Sepiella maindroni)繁殖习性及其产卵场修复的研究[J].海洋与湖沼,2010,41(1):39-46.
WU C W,DONG Z Y,CHI C F,et al.Reproductive and spawning habits of Sepiella maindroni of Zhejiang,China[J].Oceanologia et Limnologia Sinica,2010,41(1):39-46.(in Chinese)
[8] 叶素兰.人工养殖曼氏无针乌贼繁殖生物学及生殖生物学研究[D].杭州:浙江工业大学,2009.
YE S L.Studies on reproductive biology and spermigenesis in cultured Sepiella maindroni[D].Hangzhou:Zhejiang University of Technology,2009.(in Chinese)
[9] 吴常文,周超,郭宝英,等.浙江近海曼氏无针乌贼(Sepiella maindroni)繁殖生物学特性变化研究[J].海洋与湖沼,2012,43(4):689-694.
WU C W,ZHOU C,GUO B Y,et al.Study on changes in reproductive biology characteristics of rochebrune(Sepiella maindroni) offshore Zhejiang[J].Oceanologia et Limnologia Sinica,2012,43(4):689-694.(in Chinese)
[10] 宣富君,何杰,刘乃更,等.室内养殖条件下中华绒螯蟹雄性个体的生殖潜力[J].水产学报,2016,40(2):236-242.
XUAN F J,HE J,LIU N G,et al.Reproductive potentiality of individual male Chinese mitten crab(Eriocheir sinensis) under the laboratory-reared conditions[J].Journal of Fisheries of China,2016,40(2):236-242.(in Chinese)
[11] 王亮,张秀梅,丁鹏伟,等.金乌贼繁殖行为与交配策略[J].生态学报,2017,37(6):1871-1880.
WANG L,ZHANG X M,DING P W,et al.Reproductive behavior and mating strategy of Sepia esculenta[J].Acta Ecologica Sinica,2017,37(6):1871-1880.(in Chinese)
[12] 汪金海,韩松,郑小东.金乌贼(Sepia esculenta)繁殖模式的分子学鉴定[J].海洋与湖沼,2017,48(1):184-189.
WANG J H,HAN S,ZHENG X D.Molecular identification of reproduction model for Sepia esculenta[J].Oceanologia et Limnologia Sinica,2017,48(1):184-189.(in Chinese)
[13] 宣思鹏,陈新军,林东明,等.西南大西洋阿根廷滑柔鱼雄性个体的有效繁殖力特性研究[J].水生生物学报,2018,42(4):800-810.
XUAN S P,CHEN X J,LIN D M,et al.The effective fecundity in male Illex argentinus in southwest Atlantic Ocean[J].Acta Hydrobiologica Sinica,2018,42(4):800-810.(in Chinese)
[14] 陈新军,刘必林,方舟.头足纲[M].北京:海洋出版社,2019:68-69.
CHEN X J,LIU B L,FANG Z.Cephalopoda [M].Beijing:Ocean Press,2019:68-69.(in Chinese)
[15] 李楠,方舟,陈新军.东海北部外海剑尖枪乌贼渔业生物学特征[J].上海海洋大学学报,2020,29(4):622-631.
LI N,FANG Z,CHEN X J.Fisheries biology characteristics of Uroteuthis edulis off the northern East China Sea[J].Journal of Shanghai Ocean University,2020,29(4):622-631.(in Chinese)
[16] 章寒,郑基,虞聪达,等.东太平洋赤道海域茎柔鱼主要生物学特性比较研究[J].中国水产科学,2019,26(4):745-755.
ZHANG H,ZHENG J,YU C D,et al.A comparative study of the main biological characteristics of jumbo flying squid(Dosidicus gigas) in the waters near the equator of the eastern Pacific Ocean[J].Journal of Fishery Sciences of China,2019,26(4):745-755.(in Chinese)
[17] 林东明,朱国平,陈新军,等.西南大西洋巴塔哥尼亚枪乌贼的繁殖生物学特性[J].水产学报,2017,41(5):795-805.
LIN D M,ZHU G P,CHEN X J,et al.Reproductive characteristics of Patagonian longfin squid(Doryteuthis gahi) in the southwest Atlantic Ocean[J].Journal of Fisheries of China,2017,41(5):795-805.(in Chinese)
[18] 朱凯.南海鸢乌贼繁殖策略研究[D].上海:上海海洋大学,2020.
ZHU K.Reproductive strategy of Sthenoteuthis oualaniensis in the South China Sea[D].Shanghai:Shanghai Ocean University,2020.(in Chinese)
[19] 朱凯,张立川,肖楚源,等.南海鸢乌贼微型群雌性个体繁殖力研究[J].渔业科学进展,2020,41(6):140-148.
ZHU K,ZHANG L C,XIAO C Y,et al.Characterizing fecundity of dwarf form of female purple flying squid (Sthenoteuthis oualaniensis) in the South China Sea[J].Progress in Fishery Sciences,2020,41(6):140-148.(in Chinese)
[20] 倪正雅,徐汉祥.浙江近海曼氏无针乌贼资源调查报告[C]//朱德林.浙江省大陆架渔业自然资源调查和区划论文集.舟山:浙江省海洋水产研究所,1985:97-112.
NI Z Y,XU H X.Investigation report on the resources of Sepiella maindroni off the coast of Zhejiang Province[C]//ZHU D L.Collection of essays about fishery resource survey and regionalization on the continental shelf of Zhejiang Province.Zhoushan:Zhejiang Marine Fisheries Research Insititute,1985:97-112.(in Chinese)
[21] HAMILTON W D.Extraordinary sex ratios a sex-ratio theory for sex linkage and inbreeding has new implications in cytogenetics and entomology[J].Science,1967,156(3774):477-488.
[22] 邓景耀,赵传絪,唐启升,等.海洋渔业生物学[M].北京:农业出版社,1991:641-680.
DENG J Y,ZHAO C Y,TANG Q S,et al.Marine fisheries biology[M].Beijing:Agricultural Press,1991:641-680.(in Chinese)
[23] 林东明,陈新军,方舟.西南大西洋阿根廷滑柔鱼夏季产卵种群繁殖生物学的初步研究[J].水产学报,2014,38(6):843-852.
LIN D M,CHEN X J,FANG Z.Preliminary study on reproductive biology of summer spawning stock of Illex argentinus in the southwestern Atlantic Ocean[J].Journal of Fisheries of China,2014,38(6):843-852.(in Chinese)
[24] 叶德锋.曼氏无针乌贼精子包装、传递及储存研究[D].舟山:浙江海洋学院,2011.
YE D F.Sperm packaging,transmitting and storing in Sepiella maindroni[D].Zhoushan:Zhejiang Ocean University,2011.(in Chinese)
[25] 林东明,宣思鹏,陈新军.头足类鞘亚纲繁殖力研究进展[J].海洋渔业,2021,43(1):112-128.
LIN D M,XUAN S P,CHEN X J.Research progress in fecundity study of Coleoidea (Cephalopoda)[J].Marine Fisheries,2021,43(1):112-128.(in Chinese)
[26] 陈子末,陈新军,林东明,等.毛里塔尼亚外海乌贼的繁殖力特性研究[J].上海海洋大学学报,2017,26(4):597-606.
CHEN Z M,CHEN X J,LIN D M,et al.The fecundity of common cuttlefish(Sepia officinalis) in the offshore area of Mauritania[J].Journal of Shanghai Ocean University,2017,26(4):597-606.(in Chinese)
[27] LAPTIKHOVSKY V V,NIGMATULLIN C M,HOVING H J T,et al.Reproductive strategies in female polar and deep-sea bobtail squid genera Rossia and Neorossia (Cephalopoda:Sepiolidae)[J].Polar Biology,2008,31(12):1499-1507.