鱼类的免疫系统能在抵御病原入侵和感染疾病后的恢复上发挥重要作用,IgM是鱼类特异性免疫应答中最主要的介质。目前,血清中抗体效价的高低已成为反映水生动物免疫水平较为理想的可靠指标[1],因此,建立检测鱼类血清中IgM抗体水平的方法,不仅有助于深入了解鱼类体液免疫应答规律,也可有效地监测鱼类疫苗的免疫效果,从而推动鱼类疫苗的研制,促进水产养殖业的健康发展。
单克隆抗体(monodonal antibody,Mab)具有均一性、高效性、特异性、生物活性的单一性及可无限供应等特点,将单克隆抗体技术应用于鱼类IgM结构与功能分析、病原与抗体检测、疫苗研制及免疫应答规律研究等方面具有科学理论意义和生产应用价值[2]。近年来,世界范围内纷纷开始研制重要经济鱼类IgM的单克隆抗体,并以此为工具,借助多种生物学技术对鱼类体液免疫应答机理及疫苗免疫效果评价等方面开展了广泛研究[3-9]。
异育银鲫Carassius auratus gibelio具有生长快、抗逆性强和肉质好等优点,是主要的养殖鲫品种之一。关于异育银鲫IgM的单克隆抗体已有学者开展了一些相关研究,但并未进行商业化开发,仅限于在研究者所在的实验室内使用[3,10]。近年来,随着异育银鲫养殖规模的逐渐扩大、集约化程度的不断提高,鲫鱼养殖病害问题日益突出。鲫造血器官坏死病(俗称鲫鳃出血病),其病原为鲤疱疹病毒Ⅱ型(cyprinid herpesvirus 2,CyHV-2),是2008年以来在中国江苏、湖北、江西、浙江省等异育银鲫养殖区新发的一种烈性传染病,给养殖户造成了重大经济损失,对该病进行早期诊断及免疫防控是控制该病蔓延的有效手段之一[11]。本研究中,通过分离纯化得到异育银鲫血清IgM,并以此为抗原免疫小鼠,制备其特异性单克隆抗体,利用制备的抗体构建了一种鲫血清中CyHV-2特异性抗体酶联免疫检测技术,以期为今后开展异育银鲫免疫应答研究提供有力工具,为开展CyHV-2疫苗对异育银鲫免疫效果的评价提供科学参考。
1 材料与方法
1.1 材料
试验用异育银鲫购于江苏省大丰市某养殖场;试验用SPF级BALB/c雌性小鼠购于大连医科大学实验动物中心;骨髓瘤细胞系(P3)购于武汉普诺赛生命科技有限公司;鲤疱疹病毒Ⅱ型(CyHV-2)及其灭活疫苗由盐城工学院水产动物免疫与疾病实验室分离制备。
RPMI-1640培养基、HAT培养基、HT培养基、弗氏完全佐剂、弗氏不完全佐剂及碱性磷酸酶(AP)标记羊抗鼠Ig等均购自Sigma公司;异硫氰酸荧光素(FITC)标记羊抗鼠Ig购自索莱宝公司;胎牛血清购自Gibco公司;Protein A亲和层析柱购自上海碧云天有限公司。
1.2 方法
1.2.1 异育银鲫血清IgM的纯化 从健康异育银鲫尾静脉采血,室温下放置1 h后置于4 ℃下过夜,次日以3 000 g离心20 min,吸取上层血清。将血清与等体积PBS混合后,逐滴加入饱和硫酸铵,边加边搅拌,使硫酸铵终质量分数为50%,充分搅拌后于4 ℃下静置过夜;次日以12 000 g离心30 min,收集沉淀;将沉淀溶解于适量0.02 mol/L磷酸钠缓冲液中,放入透析袋中,用相同缓冲液透析除去硫酸铵。透析后的样品经0.22 μm滤膜过滤后,装入已预先平衡好的Protein A亲和层析柱中进一步纯化,具体方法参照产品说明书。收集样品进一步超滤浓缩,通过SDS-PAGE电泳测定IgM蛋白纯度,使用Bradford法测定IgM蛋白浓度。
1.2.2 抗异育银鲫IgM单克隆抗体的制备 以异育银鲫IgM为抗原免疫4周龄BALB/c小鼠,末次免疫后第3天取免疫小鼠脾细胞与骨髓瘤细胞进行融合,具体免疫程序和细胞融合参照Li等[12]的方法。融合后待杂交瘤细胞群长到占96孔细胞培养板孔底1/3时,取细胞培养上清液,利用酶联免疫吸附法(ELISA)进行初筛。
ELISA检测流程如下:用异育银鲫IgM包被酶标板,0.01 mg/孔,于4 ℃下过夜,用PBST洗涤3次,每次5 min;用体积分数为3%的牛血清白蛋白(BSA)封闭,200 μL/孔,于37 ℃下孵育1 h,用PBST洗涤;加待检测杂交瘤细胞培养上清液(以骨髓瘤细胞培养上清液作为阴性对照),100 μL/孔,于37 ℃下孵育1 h,用PBST洗涤;加AP标记羊抗鼠Ig(1∶3 000稀释),100 μL/孔,于37 ℃下孵育1 h,用PBST洗涤;加100 μL pNPP底物液进行显色,避光反应30 min,用酶标仪测定吸光度值(OD405 nm),当阳性OD/阴性OD(P/N)>2.1时判定为阳性。
将阳性杂交瘤细胞转到24孔扩大培养后再次经ELISA进行检测,利用有限稀释法对结果呈阳性的杂交瘤细胞进行克隆,将克隆后的杂交瘤细胞进行扩大培养、冻存。利用小鼠单抗Ig类/亚类进行抗体亚型分析,用ELISA试剂盒(北京博奥龙)进行鉴定,具体过程参照试剂盒说明书进行。
1.2.3 单抗的Western blot分析 将纯化的异育银鲫IgM经SDS-PAGE后,转移至硝酸纤维素(NC)膜(恒定电压为100 V,90 min),在4 ℃条件下用体积分数5%的BSA封闭过夜;NC膜经PBST洗涤后置于阳性杂交瘤细胞培养上清液中(以骨髓瘤细胞培养上清液作为阴性对照),于37 ℃下孵育1 h;膜经PBST洗涤后置于AP标记羊抗鼠Ig(1∶3 000稀释)中,于37 ℃下孵育1 h;膜再经PBST洗涤后置于NBT-BCIP发色液中,显色后用超纯水清洗终止反应,记录反应结果。
1.2.4 单抗免疫荧光检测 利用质量分数为51%的Percoll(原浓度1.130 g/mL)分离健康异育银鲫脾脏中白细胞,制作细胞滴片,用丙酮固定;细胞滴片上滴加阳性杂交瘤细胞培养上清液(以骨髓瘤细胞培养上清液作为阴性对照),于37 ℃下孵育1 h;滴片经PBST洗涤后滴加FITC标记羊抗鼠Ig(1∶256稀释),于37 ℃下孵育1 h;滴片再经PBST洗涤后滴加Hoechst 33342复染,用荧光显微镜观察并拍照。
1.2.5 鲫血清中CyHV-2特异性抗体检测技术的构建
1)ELISA检测流程。用CyHV-2包被酶标板(2 μg/孔),4 ℃下过夜,用PBST洗涤3次,每次5 min;用体积分数为3%的牛血清白蛋白(BSA)封闭,200 μL/孔,于37 ℃下孵育1 h,用PBST洗涤;加待检测异育银鲫血清,100 μL/孔,于25 ℃下孵育2 h,用PBST洗涤;加抗异育银鲫IgM单抗,100 μL/孔,于37 ℃下孵育1 h,用PBST洗涤;加AP标记羊抗鼠Ig,100 μL/孔,于37 ℃ 孵育1 h,用PBST洗涤;加100 μL pNPP底物液进行显色,避光反应30 min,用酶标仪测定吸光度值(OD405 nm),当P/N>2.1时判定为阳性。
2)最佳单抗的确定。以CyHV-2灭活疫苗注射免疫异育银鲫21 d后的血清作为阳性血清(1∶50稀释),注射PBS的异育银鲫血清作为阴性血清(1∶50稀释),分别以抗异育银鲫IgM单抗8C5、8G1、7C6、5C2、8C2作为检测单抗,AP标记羊抗鼠Ig为二抗(1∶4 000稀释),按照上述构建的ELISA技术进行CyHV-2特异性抗体检测。以P/N>2.1时判断为阳性,以数值最高者为最佳单抗。
3)最佳二抗稀释度的确定。以CyHV-2灭活疫苗注射免疫异育银鲫21 d后的血清作为阳性血清(1∶50稀释),注射PBS的异育银鲫血清作为阴性血清(1∶50稀释),以抗异育银鲫IgM单抗8C5作为检测单抗,分别以1∶2 000、1∶3 000和1∶4 000稀释的AP标记羊抗鼠Ig作为二抗,按照上述构建的ELISA技术进行CyHV-2特异性抗体检测。以P/N>2.1时判断为阳性,以数值最高者为最佳二抗稀释度。
4)最佳鲫血清稀释度的确定。以CyHV-2灭活疫苗注射免疫异育银鲫21 d后的血清作为阳性血清(1∶10、1∶20、1∶50稀释),注射PBS的异育银鲫血清作为阴性血清(1∶10、1∶20、1∶50稀释),以抗异育银鲫IgM单抗8C5作为检测单抗,以1∶2 000稀释的AP标记羊抗鼠Ig作为二抗,按照上述构建的ELISA技术进行CyHV-2特异性抗体检测。以P/N>2.1时判断为阳性,以数值最高者为最佳鲫血清稀释度。
2 结果与分析
2.1 异育银鲫血清IgM的纯化
异育银鲫血清经硫酸铵盐析、Protein A亲和层析后,得到的样品经SDS-PAGE分析显示,呈现出2条主要蛋白条带,相对分子质量分别为82 000和25 000(图1),分别为异育银鲫IgM的重链和轻链。样品经超滤浓缩后,通过Bradford法测得IgM蛋白质量浓度约为1 mg/mL。
2.2 单抗的制备
细胞融合后,经含HAT的选择性培养基培养后,有100余株杂交瘤生成,利用间接ELISA法筛选发现,其中有20余株杂交瘤检测结果均呈阳性。利用有限稀释法对阳性杂交瘤克隆后,进一步筛选获得了5株稳定分泌抗异育银鲫IgM单克隆抗体的杂交瘤细胞,分别命名为8G1、7C6、8C2、8C5、5C2(表1)。利用小鼠单抗Ig类/亚类,用ELISA试剂盒对5株单抗进行亚型鉴定,结果显示,8G1、8C2、8C5和5C2均为IgG1亚型,7C6为IgG2b亚型。
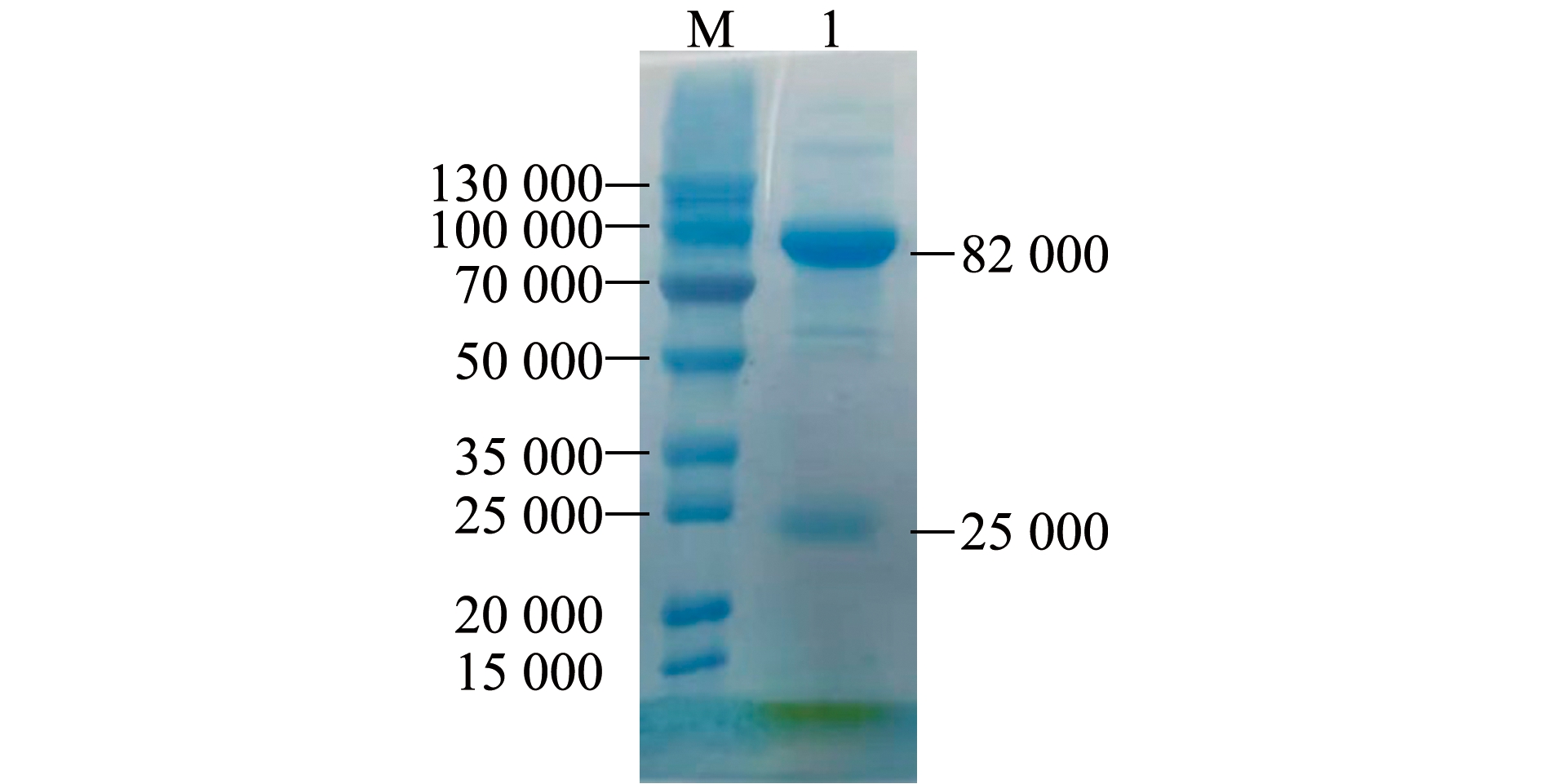
M—标准分子量蛋白;1—纯化的IgM。
M—marker;1—purified IgM.
图1 异育银鲫血清 IgM蛋白的电泳结果
Fig.1 SDS-PAGE result of IgM protein from the serum of silver prussian carp
表1 异育银鲫血清IgM单克隆抗体间接ELISA筛选结果
Tab.1 Results of the anti-silver prussian carp IgM monoclonal antibody screening by indirect ELISA
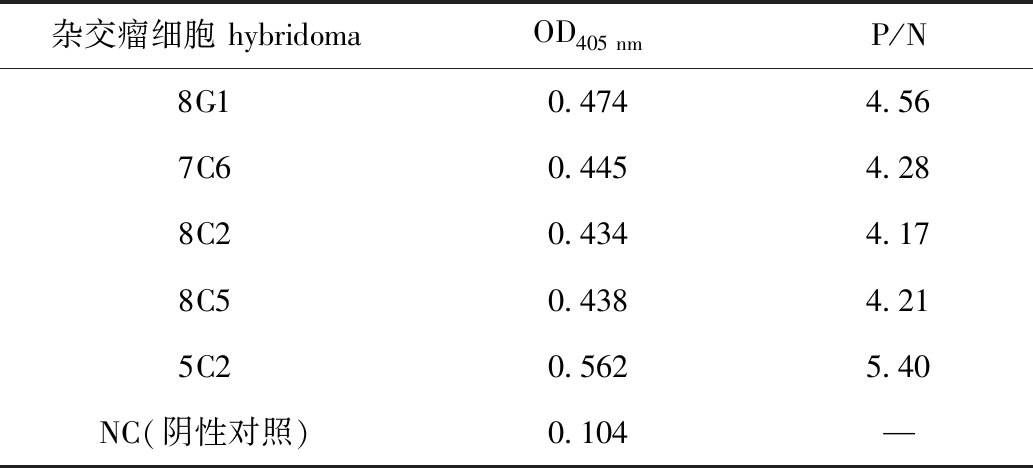
杂交瘤细胞hybridomaOD405nmP/N8G10.4744.567C60.4454.288C20.4344.178C50.4384.215C20.5625.40NC(阴性对照)0.104—
2.3 单抗的Western blot分析
经Western blot分析显示,单抗8C5、5C2、8G1、8C2和7C6均可特异性识别相对分子质量为25 000的IgM轻链分子(图2)。
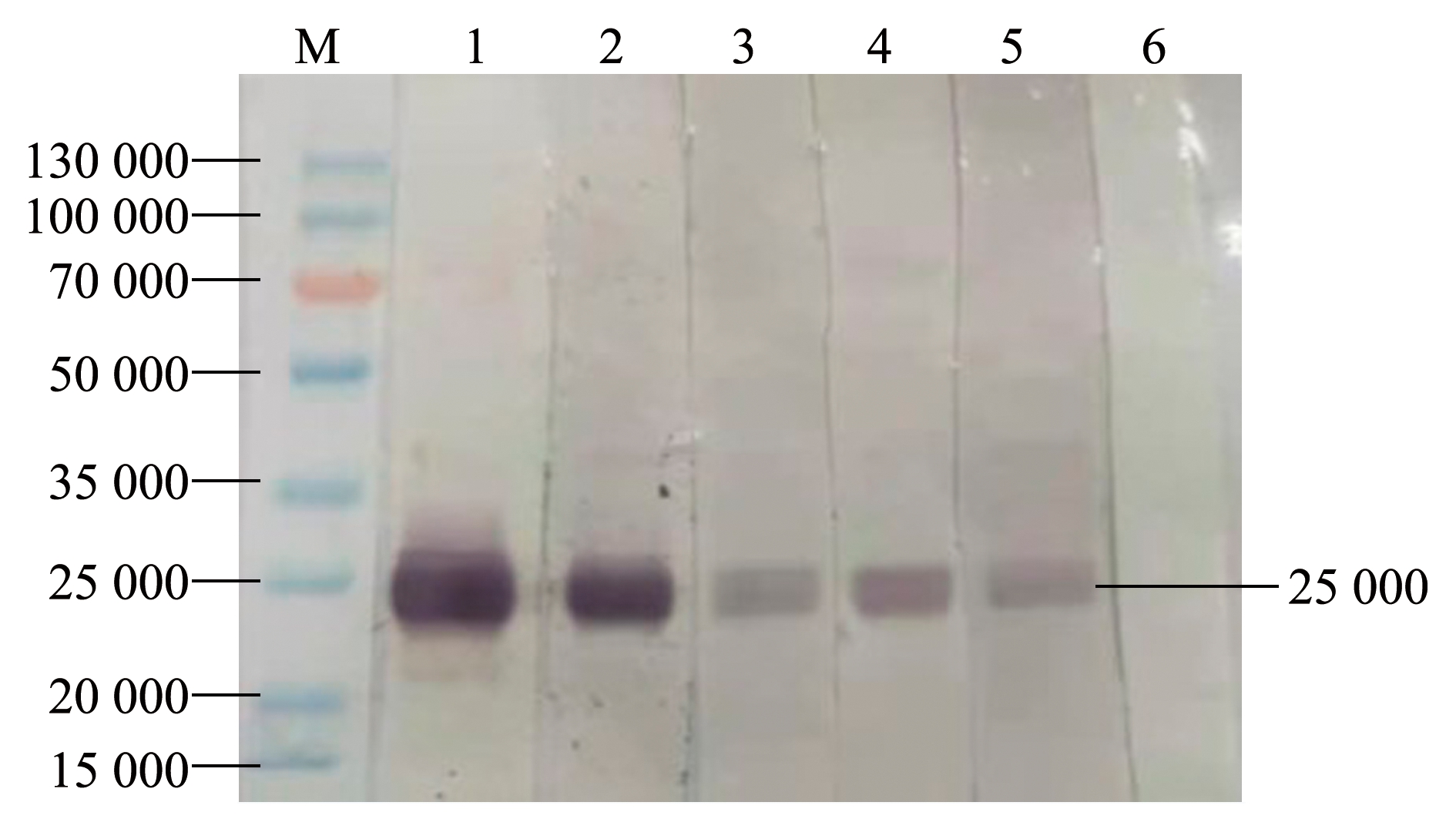
M—标准分子量蛋白;1—8C5;2—5C2;3—8G1;4—8C2;5—7C6;6—阴性对照。
M—marker;1—8C5;2—5C2;3—8G1;4—8C2;5—7C6;6—negative control.
图2 抗异育银鲫血清IgM蛋白的单抗免疫印迹结果
Fig.2 Western blot of MAbs with purified IgM protein of silver prussian carp
2.4 单抗的免疫荧光检测
利用Percoll试剂分离获取健康异育银鲫脾脏中白细胞,通过细胞滴片间接免疫荧光检测发现,单抗8C5、5C2、8G1、8C2和7C6均可与异育银鲫脾脏中部分白细胞发生特异性结合,阳性细胞表面呈现绿色点状荧光信号。图3为单抗8C5的间接免疫荧光检测结果。

A1、B1—白细胞Hoechst 33342染色;A2、B2—白细胞与单抗8C5或骨髓瘤上清反应结果;A3、B3—A1与A2及B1与B2的组合;红色箭头指示阳性细胞。
A1,B1—leukocytes staining with Hoechst 33342;A2,B2—leukocytes staining with MAb 8C5 or myeloma culture supernatant;A3,B3—merged of A1 and A2,B1 and B2;red arrows indicate the positive cells.
图3 单抗8C5的间接免疫荧光检测结果
Fig.3 Detection of MAb 8C5 by IFA
2.5 鲫血清CyHV-2特异性抗体检测技术的构建
1)最佳单抗的确定。试验结果显示,8G1、5C2、8C2、7C6和8C5均可识别鲫血清中CyHV-2特异性抗体,其中,8C5的检测数值最高,因此,确定8C5为ELISA检测方法中的最佳单抗(表2)。
表2 最佳单抗的确定
Tab.2 Determination of the optimal monoclonal antibody
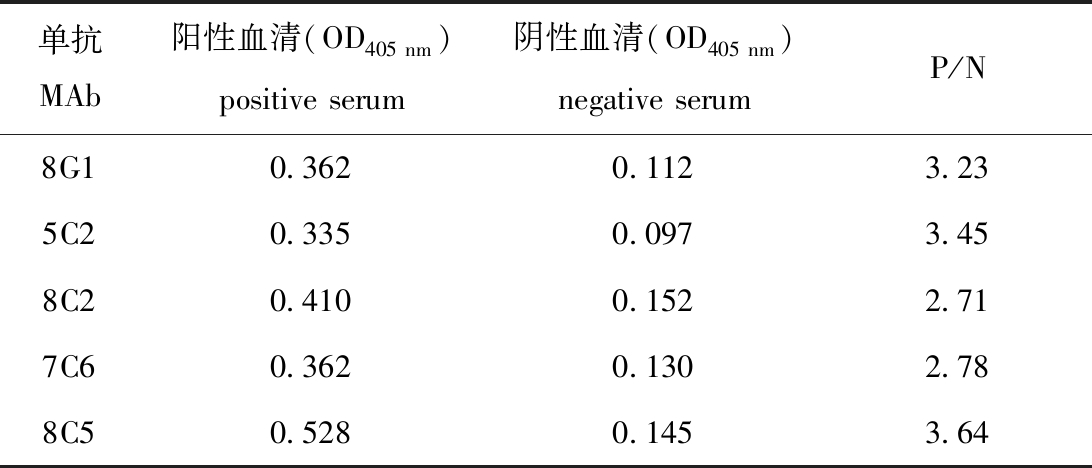
单抗MAb阳性血清(OD405nm)positiveserum阴性血清(OD405nm)negativeserumP/N8G10.3620.1123.235C20.3350.0973.458C20.4100.1522.717C60.3620.1302.788C50.5280.1453.64
2)最佳二抗稀释度的确定。以8C5作为检测单抗,2 000、3 000、4 000倍稀释的AP标记羊抗鼠Ig作为二抗,通过ELISA技术检测鲫血清中CyHV-2特异性抗体。结果显示,3种稀释度的二抗均可用于鲫血清中CyHV-2特异性抗体的检测,其中以2 000倍稀释的P/N值最高,故确定1∶2 000为ELISA检测方法中的最佳二抗稀释度(表3)。
表3 最佳二抗稀释度的确定
Tab.3 Determination of optimal dilution of secondary antibody

二抗稀释度dilutionofsecondaryantibody阳性血清(OD405nm)positiveserum阴性血清(OD405nm)negativeserumP/N1∶20000.4660.0915.121∶30000.3490.0874.011∶40000.2980.0843.54
3)鲫血清最佳稀释度的确定。以8C5作为检测单抗,2 000倍稀释的AP标记羊抗鼠Ig作为二抗,通过ELISA检测鲫血清中CyHV-2特异性抗体。结果显示:将血清10倍稀释时,阳性血清OD405 nm值最高,但阴性血清背景值偏高;将血清50倍稀释时,阴性血清背景值较低,P/N值也最低;将血清20倍稀释时,阴性血清背景值适中,P/N值与10倍稀释时差异不大。因此,确定1∶20为ELISA检测方法中鲫血清最佳稀释度(表4)。
表4 鲫血清最佳稀释度的确定
Tab.4 Determination of the optimal dilution ratio of serum in silver prussian carp Carassius auratus gibelio
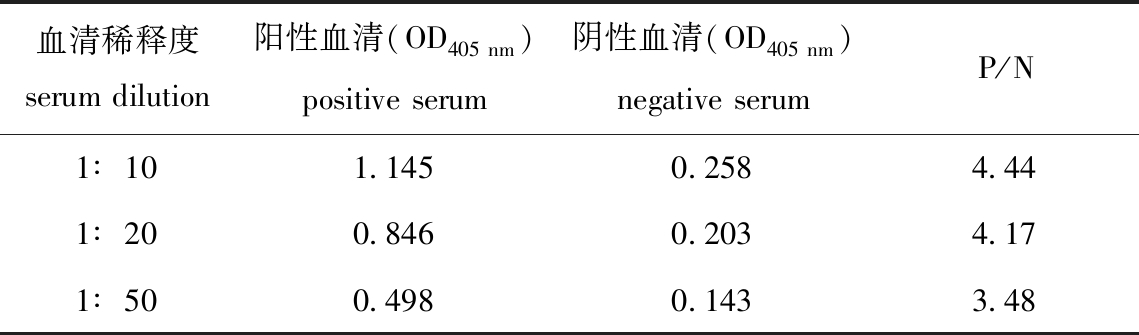
血清稀释度serumdilution阳性血清(OD405nm)positiveserum阴性血清(OD405nm)negativeserumP/N1∶101.1450.2584.441∶200.8460.2034.171∶500.4980.1433.48
3 讨论
3.1 鲫血清IgM蛋白的纯化
硬骨鱼类作为水生脊椎动物,应对病原侵袭主要依靠自身的免疫系统,而IgM作为硬骨鱼类血清中主要免疫球蛋白,是鱼类特异性免疫应答中最主要的介质[13]。IgM的纯化有助于开展其结构及理论特性的研究,目前,针对鲫血清中IgM已成功建立了多种纯化方式。沈锦玉等[3]利用山羊 IgG-琼脂糖层析柱亲和层析纯化异育银鲫IgM,获得重链为75 000的IgM蛋白,但杂蛋白较多。陈垚等[14]利用饱和硫酸铵盐析结合葡聚糖凝胶柱,分离纯化异育银鲫血清中IgM蛋白,获得的IgM蛋白纯度达80%以上,重链和轻链相对分子质量分别为79 000和25 000。Wu等[10]利用饱和硫酸铵盐析、DEAE琼脂糖层析柱提取纯化异育银鲫血清中IgM,获得的IgM蛋白纯度高,无明显杂蛋白,重链和轻链相对分子质量分别为74 000和24 000。吴光辉等[15]通过ProteinA亲和层析法纯化异育银鲫血清中IgM蛋白,获得的IgM蛋白重链和轻链清晰可辨,相对分子质量分别为85 000和25 000,无明显杂蛋白。本试验中,通过饱和硫酸铵盐析、Protein A亲和层析提取纯化异育银鲫血清中IgM蛋白,获得的IgM蛋白纯度高,无明显杂蛋白,重链和轻链相对分子质量分别为82 000和25 000,重链和轻链分子量与以往报道基本一致。
3.2 鱼血清IgM单克隆抗体的制备
单克隆抗体具有纯度高、灵敏度高、特异性强、交叉反应少和制备成本低等优点,已成为研究鱼类免疫球蛋白结构及功能的重要工具。目前,已成功研制出欧洲鳗Anguilla anguilla、南方鲇Silurus meridionalis、罗非鱼Silurus meridionalis、大菱鲆Scophthalmus maximus、鲇Clarias macrocephalus、罗湖鲤Labeo rohita和鲫等[3-9]多种鱼类血清IgM单克隆抗体,其主要识别IgM重链分子。本试验中,以纯化的异育银鲫IgM蛋白为抗原,免疫BALB/c小鼠,采用杂交瘤技术,经细胞融合、筛选和有限稀释克隆共获得了5株稳定分泌抗异育银鲫IgM单抗的杂交瘤细胞株。经Western blot鉴定显示,5株单抗均可与变性条件下的异育银鲫IgM轻链分子发生特异性结合,说明这5株单抗识别的抗原决定簇位于异育银鲫IgM轻链分子上,这与沈锦玉等[3]和Wu等[10]的研究结果有所不同,后者制备的鲫血清IgM单抗识别的抗原决定簇位于IgM重链。与哺乳类等高等动物相似,鱼类B淋巴细胞表面也存在膜结合型免疫球蛋白(sIgM),利用识别sIgM的单抗可以对淋巴细胞亚群及其生物学活性进行分析[16]。本研究中,间接免疫荧光分析显示,5株单抗均可与异育银鲫脾脏中部分白细胞发生特异性结合,阳性细胞表面呈现绿色点状荧光信号,说明5株单抗均可识别异育银鲫组织内淋巴细胞表面的sIgM分子,这为进一步研究淋巴细胞针对抗原刺激的免疫应答提供了有效的细胞示踪工具。
3.3 鱼血清IgM单克隆抗体的应用
以鱼类IgM单抗作为检测工具,通过ELISA技术检测鱼类血清中病原特异性抗体,可进行疾病的辅助诊断和疫苗的免疫效果评价。Li等[17]以抗鲤IgM单抗为一抗,建立了鲤Cyprinus carpio血清中KHV特异性抗体的间接ELISA检测技术,利用此技术对200份疑似感染KHV样品检测,阳性检出率为26.5%,而PCR阳性检出率为16.5%。Zeng等[18]在以抗草鱼IgM单抗为一抗,开发了一种草鱼Ctenopharyngodon idella血清中GCRV-Ⅱ特异性抗体的间接ELISA检测技术,利用此技术对242份血清标本进行检测,阳性率为69.8%,此方法可用于检测鱼体是否感染GCRV-Ⅱ,起到监测草鱼体内抗体水平变化的作用。Faisal等[19]以抗北美狗鱼IgM单抗为一抗,建立了北美狗鱼Esox masquinongy血清中VHSV-IVB特异性抗体的间接ELISA检测技术,并使用该技术对VHSV-IVB DNA疫苗注射后北美狗鱼体内的抗体水平进行了评估,结果表明,此方法可以很好地检测到接种VHSV-IVB DNA疫苗后北美狗鱼体内特异性抗体水平动态变化。鲫造血器官坏死病传染速度快、致死率高,是2008年以来制约中国鲫养殖产业最主要的病毒病。为有效防治该病,国内外众多研究单位已开始进行疫苗攻关,包括日本东京水产研究所研制的灭活疫苗[20]、浙江省淡水水产研究所研制的灭活疫苗[21]、中国水产科学院长江水产研究所制备的弱毒疫苗[22]、中国科学院水生生物研究所研制的重组亚单位疫苗[23]和苏州大学制备的DNA疫苗[24]等。目前,针对这些疫苗的免疫效果评价主要采用攻毒感染的方式进行,缺少从特异性抗体水平层面的效果评价。本研究中建立的间接ELISA检测技术,可有效检测鲫血清中CyHV-2特异性抗体,为今后CyHV-2疫苗的效果评价奠定了基础。
4 结论
1)本研究中纯化得到了重链、轻链相对分子质量分别为82 000和25 000的异育银鲫IgM蛋白,制备了5株抗异育银鲫IgM单克隆抗体,经鉴定,所制单抗均可以特异性识别IgM蛋白轻链。
2)以所制单抗为检测工具构建了检测鲫血清中CyHV-2特异性抗体的间接ELISA技术,为CyHV-2疫苗的开发及其在异育银鲫养殖中的应用提供了免疫效果评价工具。
[1] 王荻,刘红柏.5种鲟鱼免疫球蛋白重链恒定区序列研究[J].遗传,2006,28(10):1247-1253.
WANG D,LIU H B.A research on Ig heavy chain constant region of five Acipenseridae[J].Hereditas,2006,28(10):1247-1253.(in Chinese)
[2] 王蔚芳,李青梅,柴书军,等.大菱鲆免疫球蛋白M(IgM)单克隆抗体的制备与特性鉴定[J].中国工程科学,2014,16(9):16-20.
WANG W F,LI Q M,CHAI S J,et al.Development and characterization of monoclonal antibody to the immunoglobulin M of Scophthalmus maximus[J].Strategic Study of CAE,2014,16(9):16-20.(in Chinese)
[3] 沈锦玉,THOMPSON K D,ADAMS A,等.银鲫IgM的纯化及其单克隆抗体的制备[J].水产学报,2006,30(3):421-424.
SHEN J Y,THOMPSON K D,ADAMS A,et al.Production and characterization of monoclonal antibodies against Carassius auratus gibelio IgM[J].Journal of Fisheries of China,2006,30(3):421-424.(in Chinese)
[4] 林天龙,陈强,龚晖,等.欧洲鳗免疫球蛋白单克隆抗体的制备与特性[J].水产学报,2001,25(6):532-537.
LIN T L,CHEN Q,GONG H,et al.Production and characterization of monoclonal antibodies against Anguilla anguilla IgM[J].Journal of Fisheries of China,2001,25(6):532-537.(in Chinese)
[5] 张小萍,魏静,邱艳.南方鲇免疫球蛋白单克隆抗体的制备及特性[J].水生生物学报,2012,36(3):379-384.
ZHANG X P,WEI J,QIU Y.Production and characterization of monoclonal antibodies against Silurus meridionalis Chen serum immunoglobulin[J].Acta Hydrobiological Sinica,2012,36(3):379-384.(in Chinese)
[6] 郝贵杰,潘晓艺,徐洋,等.奥尼罗非鱼免疫球蛋白单克隆抗体的制备及其初步应用[J].大连海洋大学学报,2013,28(1):7-11.
HAO G J,PAN X Y,XU Y,et al.Preparation and application of immunoglobulin monoclonal antibodies in tilapia Oreochromis niloticus × O.aureus[J].Journal of Dalian Ocean University,2013,28(1):7-11.(in Chinese)
[7] 张伟,唐小千,绳秀珍,等.大菱鲆血清免疫球蛋白IgM单克隆抗体的制备及其特性分析[J].中国海洋大学学报,2016,46(1):27-32.
ZHANG W,TANG X Q,SHENG X Z,et al.Development and characterization of monoclonal antibodies to serum IgM of turbot (Scophthalmus maximus)[J].Periodical of Ocean University of China,2016,46(1):27-32.(in Chinese)
[8] BUNNOY A,NA-NAKORN U,SRISAPOOME P.Development of a monoclonal antibody specific to the IgM heavy chain of bighead catfish (Clarias macrocephalus):a biomolecular tool for the detection and quantification of IgM molecules and IgM+ cells in Clarias catfish[J].Biomolecules,2020,10(4):567.
[9] BAG M R,MAKESH M,RAJENDRAN K V,et al.Characterization of IgM of Indian major carps and their cross-reactivity with anti-fish IgM antibodies[J].Fish &Shellfish Immunology,2009,26(2):275-278.
[10] WU R H,SHEN J Y,LAI X L,et al.Development of monoclonal antibodies against serum immunoglobulins from gibel carp (Carassius auratus gibelio) and their applications in serodiagnosis of inapparent infection and evaluation of vaccination strategies[J].Fish &Shellfish Immunology,2020,96:69-77.
[11] 许洪杰,刘进军.鲫鱼造血器官坏死病(鳃出血)防控对策[J].科学养鱼,2017(9):87.
XU H J,LIU J J.Prevention and control strategy of haematopoietic organ necrosis disease (gill hemorrhage) of crucian carp[J].Scientific Fish Farming,2017(9):87.(in Chinese)
[12] LI Q,ZHAN W B,XING J,et al.Production,characterisation and applicability of monoclonal antibodies to immunoglobulin of Japanese flounder (Paralichthys olivaceus)[J].Fish &Shellfish Immunology,2007,23(5):982-990.
[13] 叶剑敏,王玉红,丁明媚,等.硬骨鱼IgM结构和功能及其体液免疫应答[J].华南师范大学学报(自然科学版),2015,47(5):1-8.
YE J M,WANG Y H,DING M M,et al.Teleost IgM structure,function and humoral immune response[J].Journal of South China Normal University(Natural Science Edition),2015,47(5):1-8.(in Chinese)
[14] 陈垚,王石泉,韩晓冬,等.鲫鱼血清和皮肤黏液IgM的分离纯化及部分性质的鉴定[J].动物学研究,2003,24(2):111-115.
CHEN Y,WANG S Q,HAN X D,et al.Purification and partial characterization of immunoglobulin M from Carassius auratus serum and skin mucus[J].Zoological Research,2003,24(2):111-115.(in Chinese)
[15] 吴光辉,王庆,巩华,等.用Protein A亲和层析法快速分离纯化鲫血清IgM方法的建立和应用[J].大连海洋大学学报,2010,25(3):233-237.
WU G H,WANG Q,GONG H,et al.Rapid purification of serum IgM from crucian carp,Carassius auratus by protein A agarose affinity chromatography[J].Journal of Dalian Ocean University,2010,25(3):233-237.(in Chinese)
[16] FILLATREAU S,SIX A,MAGADAN S,et al.The astonishing diversity of Ig classes and B cell repertoires in teleost fish[J].Frontiers in Immunology,2013,4:28.
[17] LI Y Y,ZHENG S C,WANG Q,et al.Detection of koi herpesvirus (KHV) using a monoclonal antibody against Cyprinus carpio IgM[J].Archives of Virology,2017,162(8):2381-2385.
[18] ZENG W W,WANG Y Y,GUO Y M,et al.Development of a VP 38 recombinant protein-based indirect ELISA for detection of antibodies against grass carp reovirus genotype Ⅱ (iELISA for detection of antibodies against GCRV Ⅱ)[J].Journal of Fish Diseases,2018,41(12):1811-1819.
[19] FAISAL M,STANDISH I F,VOGELBEIN M A,et al.Production of a monoclonal antibody against of muskellunge (Esox masquinongy) IgM heavy chain and its use in development of an indirect ELISA for titrating circulating antibodies against VHSV-IVB[J].Fish &Shellfish Immunology,2019,88:464-471.
[20] ITO T,OTOTAKE M.Vaccination against cyprinid herpesvirus 2 (CyHV-2) infection in goldfish Carassius auratus[J].Bulletin of the European Association of Fish Pathologists,2013,33(5):158-164.
[21] 沈锦玉,曹铮,潘晓艺,等.一种鲫造血器官坏死病灭活疫苗及其制备方法:CN110893235A[P].2020-03-20.
SHEN J Y,CAO Z,PAN X Y,et al.Preparation of inactivated vaccine against hematopoietic organ necrosis of crucian carp (Carassius auratus gibelio):CN110893235A[P].2020-03-20.(in Chinese)
[22] 周勇,薛明洋,范玉顶,等.一种鲤疱疹病毒Ⅱ型弱毒株及其应用:CN111411087A[P].2020-07-14.
ZHOU Y,XUE M Y,FAN Y D,et al.A attenuated strain of cyprinid herpesvirus 2 and its application:CN111411087A [P].2020-07-14.(in Chinese)
[23] 宁德刚,韦瑶,张磊,等.一种异育银鲫抗CyHV-2口服重组芽孢疫苗及其制备方法:CN107126559A[P].2017-09-05.
NING D G,WEI Y,ZHANG L,et al.Preparation of the oral recombinant spore vaccine against the cyprinid herpesvirus 2 of crucian carp(Carassius auratus gibelio):CN107126559A[P].2017-09-05.(in Chinese)
[24] 贡成良,曹广力,李坤,等.一种基于杆状病毒载体的鲤疱疹病毒Ⅱ型DNA疫苗及其构建方法与应用:CN108728490A[P].2018-11-02.
GONG C L,CAO G L,LI K,et al.Construction and application of the DNA vaccine based on a baculovirus vectors against cyprinid herpesvirus 2:CN108728490A[P].2018-11-02.(in Chinese)