溶藻弧菌Vibrio alginolyticus是一种致病性强、致死率高的常见水生病原体[1],为杆状、嗜盐的革兰氏阴性菌,在沿海地区、海洋沉积物和咸水等环境中普遍存在[2-3]。溶藻弧菌可导致海水养殖品种甚至海产品消费者患病,鱼类感染时会出现炎症反应、溃疡、肾脏出血和败血症等,严重时可致死,人类感染时表现为皮肤、耳部感染[4-6]。该病原体的暴发性感染对水产养殖业造成巨大损失[7]。
乙酰化是蛋白质翻译后化学官能团附在蛋白质上的一种类型,是将氨基酸侧链基团上引入乙酰基的过程。乙酰化修饰有两种类型:一种是N末端乙酰基转移酶催化的修饰[8];另一种是在赖氨酸的ε-氨基上进行翻译后修饰[9]。乙酰化过程中乙酰基团转移途径有两种:一种是转移酶介导的,如GNAT(Gcn5-related N-acetyltransferase)超家族[10];另一种是非酶学途径,如大肠杆菌中乙酰磷酸(acetylphosphate,AcP)可诱导乙酰化[11]。乙酰化修饰参与基因表达调控,如对人类胸腺素β4(thymosin beta 4,TB4)的活性和稳定性,以及对肿瘤发生、抗纤维化和抑制炎症等多种功能均具有调控作用[12];人原代成骨细胞p21基因组蛋白乙酰化水平降低会抑制相关蛋白表达,从而引起氟骨症的发生[13];乙酰化也会破坏糖皮质激素受体与热休克蛋白90(Hsp90)间的相互作用[14]。这表明,乙酰化发挥着关键的调控作用,因此,研究溶藻弧菌硫胺素合成相关蛋白的乙酰化修饰具有重要意义。
硫胺素即维生素B1,由嘧啶环和噻唑环通过亚甲基结合而成,真菌、植物和微生物可以自身合成硫胺素。磷酸甲基嘧啶合酶(phosphomethylpyrimidine synthase,ThiC)是一种S-腺苷甲硫氨酸自由基酶[15],参与硫胺素的生物合成,为催化初级代谢中复杂的重排反应之一[16]。研究表明,在拟南芥幼苗中添加硫胺素超过1 mg/L时,ThiC的表达受到抑制,抑制程度与硫胺素添加浓度成正比[17],而当嘧啶部分4-氨基-2-甲基-5-羟甲基嘧啶焦磷酸供应不足时,也会限制硫胺素的积累[18]。硫胺素生物合成及ThiC的功能研究在植物、大肠杆菌中较多,但在溶藻弧菌中的相关研究尚未见报道。
本项目组在前期工作中,通过抗乙酰赖氨酸抗体和高效液相色谱-质谱联用技术,构建了溶藻弧菌乙酰化蛋白组,从中鉴定了206种乙酰化蛋白和252个赖氨酸乙酰化位点(数据未发表)。其中,蛋白(VAGM004753)被注释为ThiC,参与硫胺素代谢。本研究中,通过克隆溶藻弧菌ThiC基因,优化诱导其蛋白表达条件,并对ThiC蛋白是否存在乙酰化修饰进行了分析和验证,以期为进一步研究乙酰化修饰对该蛋白功能的影响提供科学参考。
1 材料与方法
1.1 材料
溶藻弧菌HY9901、表达载体pET-28a保存在广东省水产经济动物病原生物学及流行病学重点实验室。
细菌基因组提取试剂盒、质粒提取试剂盒和切胶回收试剂盒购自Thermo Fisher公司,大肠杆菌BL21(DE3)购自北京全式金生物公司;兔抗乙酰化赖氨酸抗体购自Cell Signaling Technology公司;辣根过氧化物酶标记的羊抗兔IgG(Goat Anti-Rabbit IgG/ HRP)购自科敏生物公司;多组氨酸标签(His-Tag)蛋白纯化介质(耐变性剂型)及封闭液购自碧云天公司;去乙酰化酶CobB(0.1 μg/μL)蛋白为实验室前期制备。
1.2 方法
1.2.1 ThiC基因的克隆与表达载体的构建 将HY9901菌株接种至胰蛋白胨大豆肉汤(tryptic soy broth,TSB)培养基培养,按照细菌基因提取试剂盒说明书提取溶藻弧菌HY9901的DNA。根据NCBI上溶藻弧菌的ThiC基因(ID:CP035700.1)序列,设计含酶切位点的正反链引物,正链引物F:CGGAATTCATGTCGAGTCGCAAACAAGCGAGA(下划线为EcoRI酶切位点);反链引物R:CCGCTCGAGTTAGTCACTTACCTCGGCATGTGCTGC(下划线为XhoⅠ酶切位点)。以提取的溶藻弧菌DNA为模板链,扩增ThiC基因。聚合酶链式反应(PCR)条件:95 ℃下预变性5 min;96 ℃下循环变性25 s,53 ℃下退火复性35 s,72 ℃下延伸1 min,共进行34个循环;最后再在72 ℃下延伸10 min。PCR产物经电泳检测后,纯化回收目的条带,酶切后与提取的pET-28a连接、转化。挑取单菌落进行PCR鉴定,鉴定所用引物序列为F:TGCTAGTTATTGCTCAGCGG;R:TAATACGACTCACTATAGGG。为保证pET-28a-ThiC载体序列的正确性,将鉴定结果为阳性的菌落扩大培养后送至生工生物广东公司进行测序。
1.2.2 ThiC蛋白的诱导表达 按体积比1∶100将含pET-28a-ThiC表达载体的大肠杆菌BL21接种于含卡那霉素(kanamycin,Kana)抗性的LB培养基中,37 ℃下扩培至 OD600 nm为0.4~0.6,再加入0.5 mmol/L 异丙基-β-D-硫代半乳糖苷(IPTG)进行诱导,设置未经IPTG诱导的重组质粒、空载质粒、IPTG诱导的空载质粒为对照组。37 ℃下继续培养4 h,离心后弃上清液,沉淀部分用磷酸缓冲盐溶液(PBS)反复冲洗3次。提取细菌蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.2.3 ThiC蛋白表达条件优化 为获得ThiC蛋白表达的最优条件,当OD600 nm为0.4~0.6时开始诱导,分别改变诱导时间、温度、IPTG 浓度条件之一,对结果进行比较。
诱导时间优化试验:在37 ℃、0.5 mmol/L IPTG下,分别诱导1、2、3、4、5、6、7 h后,提取细菌蛋白进行SDS-PAGE电泳分析。
诱导温度优化试验:设置IPTG浓度为0.5 mmol/L,分别在28 ℃和37 ℃下诱导4 h,收集菌体4 ℃下离心,再用PBS冲洗2次。将收集的细菌置于冰水混合物中,用超声波破碎至菌液清亮,分别收集离心后的上清液和沉淀,沉淀中加入8 mol/L尿素溶解,提取细菌蛋白进行SDS-PAGE电泳分析。
IPTG浓度优化试验:设置IPTG浓度分别为0.1、0.2、0.4、0.6、0.8、1.0、2.0 mmol/L,在37 ℃下诱导4 h后,提取细菌蛋白进行SDS-PAGE电泳分析。
1.2.4 His-ThiC蛋白的纯化 按照优化的条件诱导蛋白,用超声波破碎后离心,取上清液通过镍离子金属螯合亲和层析介质纯化。将蛋白与填料在4 ℃中孵育过夜,孵育后的蛋白加入纯化柱中,按His标签蛋白纯化介质使用说明书操作。
1.2.5 蛋白质免疫印迹(Western blot)验证ThiC蛋白的乙酰化及去乙酰化 配制10×去乙酰化酶磷酸缓冲液(各试剂的终浓度):100 mmol/L氯化钠,50 mmol/L磷酸氢二钠(pH 8.0),2.7 mmol/L氯化钾,1 mmol/L氯化镁,500 μmol/L烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)。在50 μL缓冲液中加入0.2 μg/μL CobB蛋白和0.2 μg/μL ThiC蛋白各20 μL,用PBS补足至500 μL,充分混合。纯化后的融合蛋白以不加入NAD+或不加入CobB蛋白的反应作为阴性对照组。将反应体系置于25 ℃下孵育6 h后,按体积比1∶1将电泳蛋白质上样缓冲液加至适量的反应体系中终止反应,采用Western blot检测目的蛋白的乙酰化水平。
Western blot操作步骤:收集蛋白样品,进行SDS-PAGE电泳后转膜1 h;将蛋白膜漂洗2 min,移至含Western封闭液的平皿中4 ℃下封闭过夜;选用兔抗乙酰化赖氨酸抗体为一抗,参照说明书稀释一抗,去除平皿中的封闭液,加入稀释好的一抗,室温孵育1~2 h后回收一抗,加入洗涤液洗涤3次,每次洗涤5 min;选用辣根过氧化物酶标记的羊抗兔IgG为二抗,孵育步骤与一抗相同;用配制好的定影液和显影液洗片,得到明显条带即可。
2 结果与分析
2.1 ThiC基因的克隆
用PCR扩增获得溶藻弧菌的ThiC基因(GenBank登录号:MZ960934),扩增产物采用琼脂糖凝胶电泳进行鉴定,获得大小为1 941 bp的条带(图1),电泳条带大小与ThiC开放阅读框大小一致,这表明ThiC基因克隆成功。
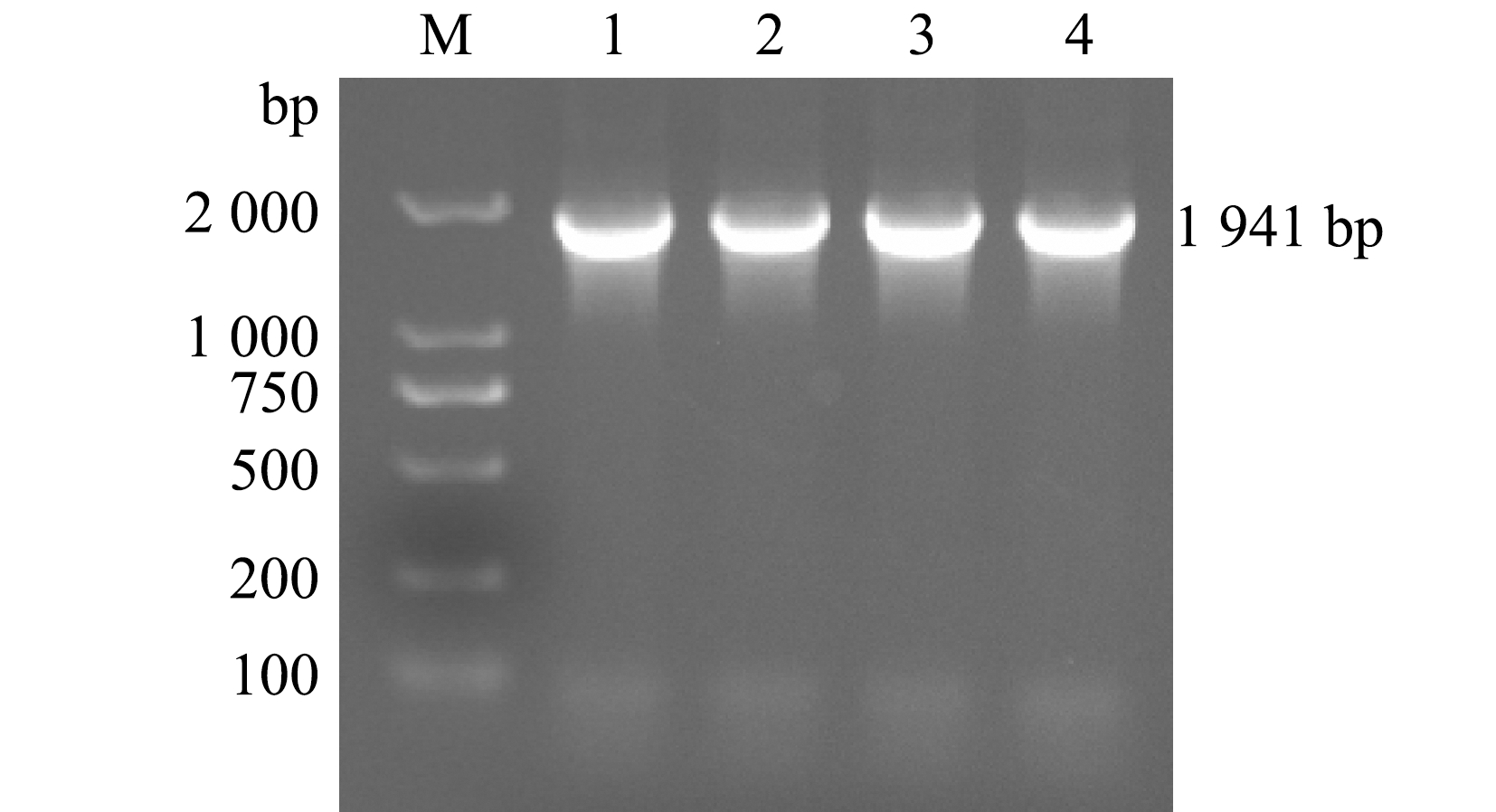
M—DNA marker;1~4—目的基因。
M—DNA marker;1-4—target gene.
图1 ThiC基因PCR扩增结果
Fig.1 PCR amplification result of ThiC gene
2.2 重组质粒pET-28a-ThiC的构建
将ThiC基因插入pET-28a质粒,再转入大肠杆菌BL21中进行PCR鉴定,所得条带与预测大小一致(图2),经测序鉴定后确认结果正确,证明pET-28a-ThiC载体构建成功。
2.3 ThiC蛋白的诱导表达
收集构建成功的重组菌株所诱导表达的蛋白,电泳结果显示,诱导的重组菌株在相对分子质量72 500附近出现条带(图3),而其他情况下均未表达,这表明ThiC蛋白已成功表达。
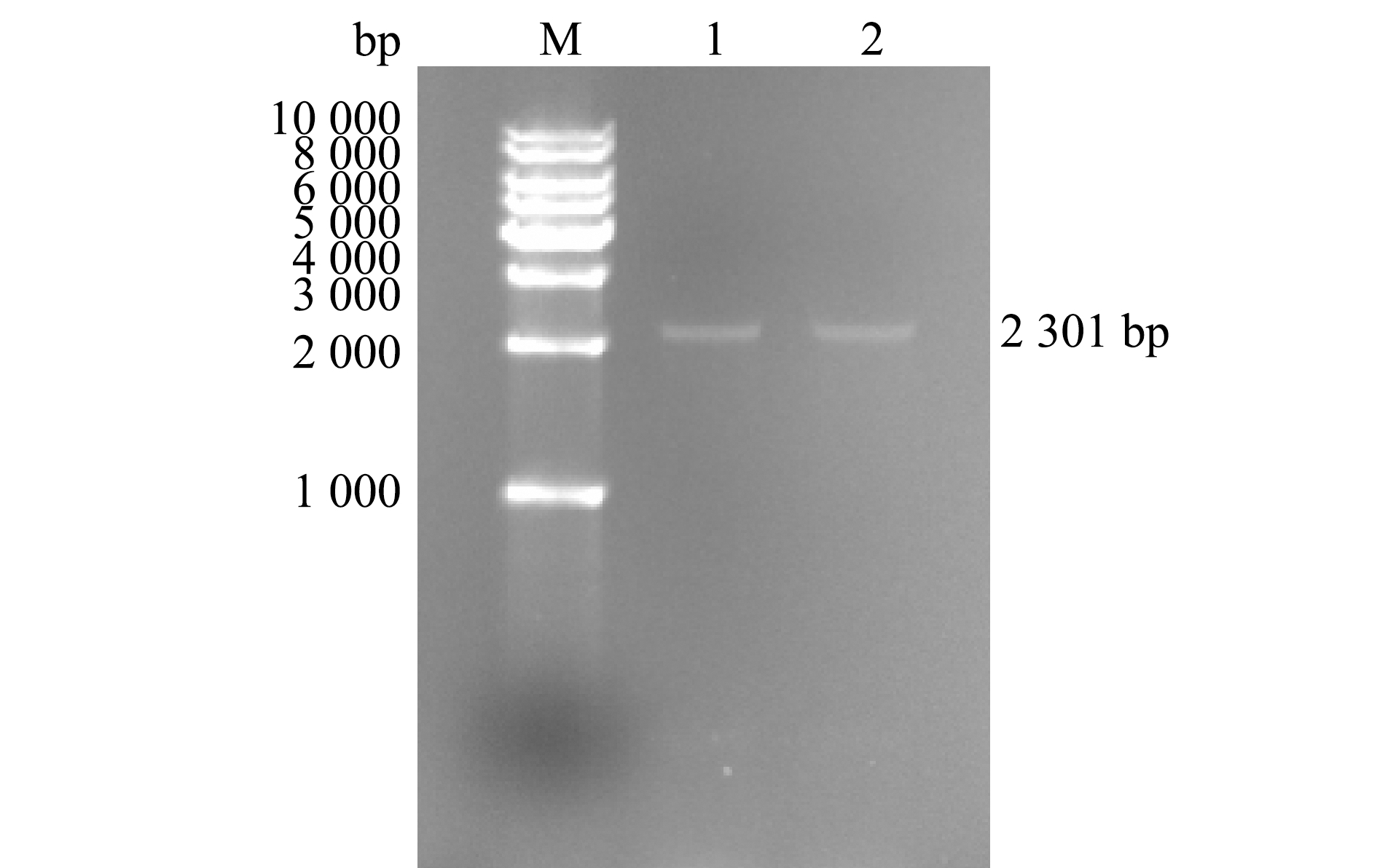
M—DNA marker;1、2—pET-28a-ThiC的PCR产物。
M—DNA marker;1 and 2—PCR products of pET-28a-ThiC.
图2 pET-28a-ThiC表达载体的构建
Fig.2 Construction of pET-28a-ThiC expression vector
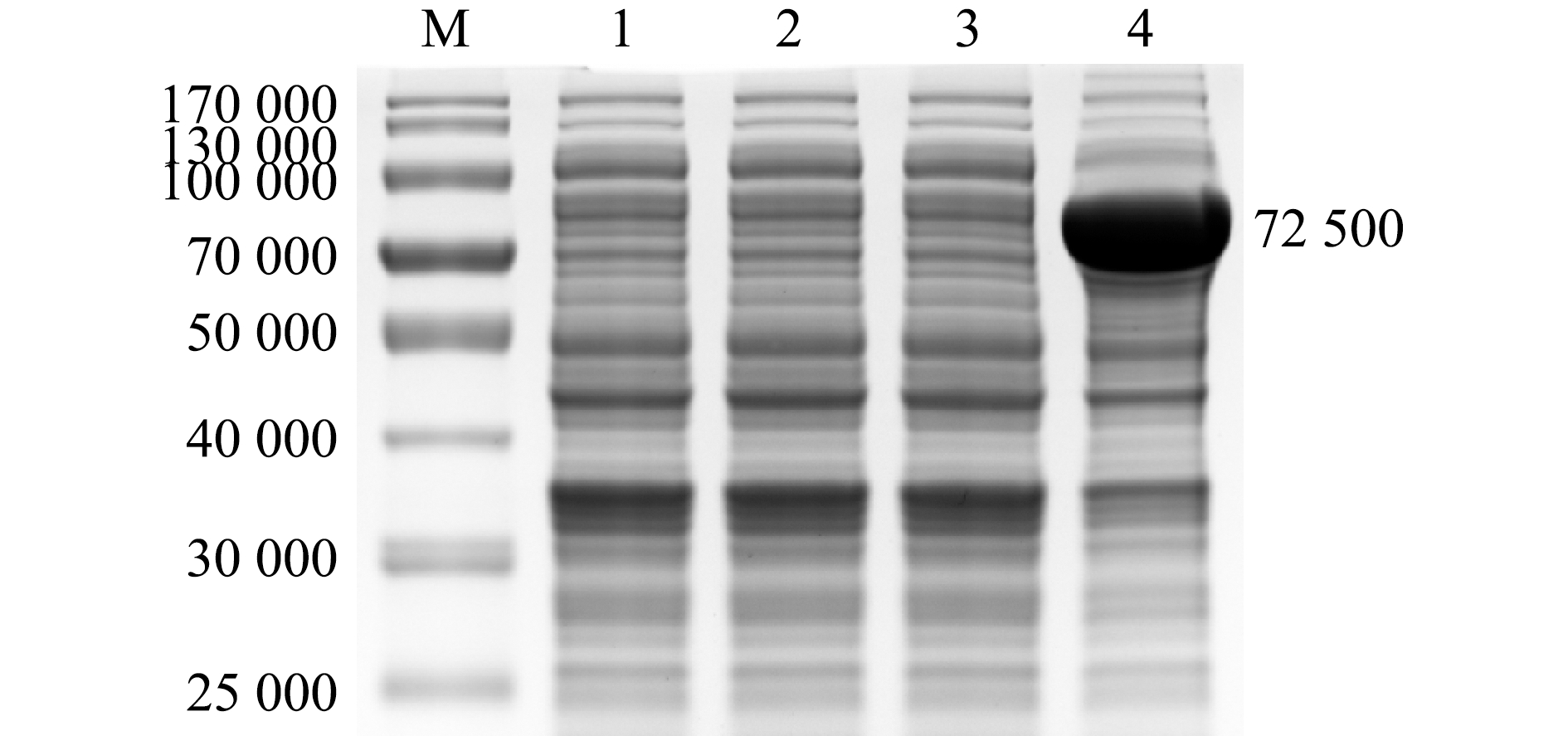
M—蛋白marker;1、2—未诱导和诱导的pET-28a;3、4—未诱导和诱导的pET-28a-ThiC。
M—protein marker;1,2—pET-28a without IPTG and induced with IPTG;3,4—pET-28a-ThiC without IPTG and induced with IPTG.
图3 ThiC蛋白的SDS-PAGE检测
Fig.3 SDS-PAGE detection of ThiC protein
2.4 ThiC蛋白表达条件的优化
2.4.1 不同诱导时间下ThiC蛋白的表达 ThiC蛋白的表达量随诱导时间的延长呈先增加后趋于稳定的趋势,表达量在3 h时达到峰值,之后该蛋白表达量随诱导时间延长无显著增加的现象(图4)。
2.4.2 不同诱导温度下ThiC蛋白的表达 在28、37 ℃诱导条件下,上清液和沉淀中均可见ThiC融合蛋白表达,在37 ℃条件下诱导的上清液和沉淀中的表达量均高于28 ℃,且包涵体中蛋白表达量明显高于上清液(图5)。
2.4.3 不同IPTG浓度下ThiC蛋白的表达 采用浓度为0.1~2.0 mmol/L的IPTG诱导时,ThiC蛋白表达量无明显差异(图6)。
综上所述,ThiC蛋白最佳表达条件为温度37 ℃、IPTG 0.1 mmol/L和诱导时间3 h。

M—蛋白marker;1~7—诱导时间分别为1、2、3、4、5、6、7 h。
M—protein marker;1-7—induction for 1,2,3,4,5,6,and 7 h,respectively.
图4 不同诱导时间下ThiC蛋白的表达
Fig.4 Expression of ThiC protein at different induction time
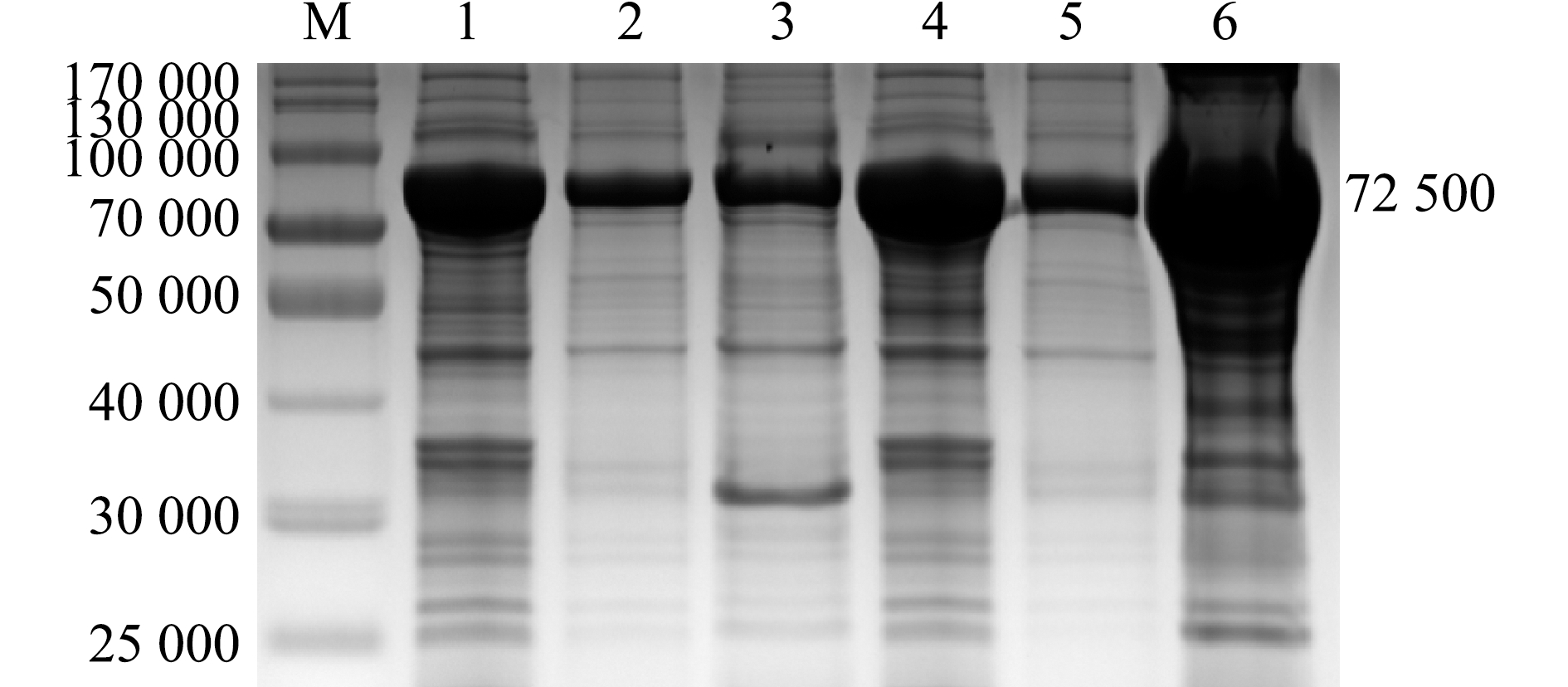
M—蛋白marker;1~3—28 ℃条件下诱导的全菌蛋白、上清液和沉淀;4~6—37 ℃条件下诱导的全菌蛋白、上清液和沉淀。
M—protein marker;1-3—whole bacterial protein,supernatant and precipitation induced at 28 ℃;4-6—whole bacterial protein,supernatant and precipitation induced at 37 ℃.
图5 不同诱导温度下ThiC蛋白的表达
Fig.5 Expression of ThiC protein at different induction temperature
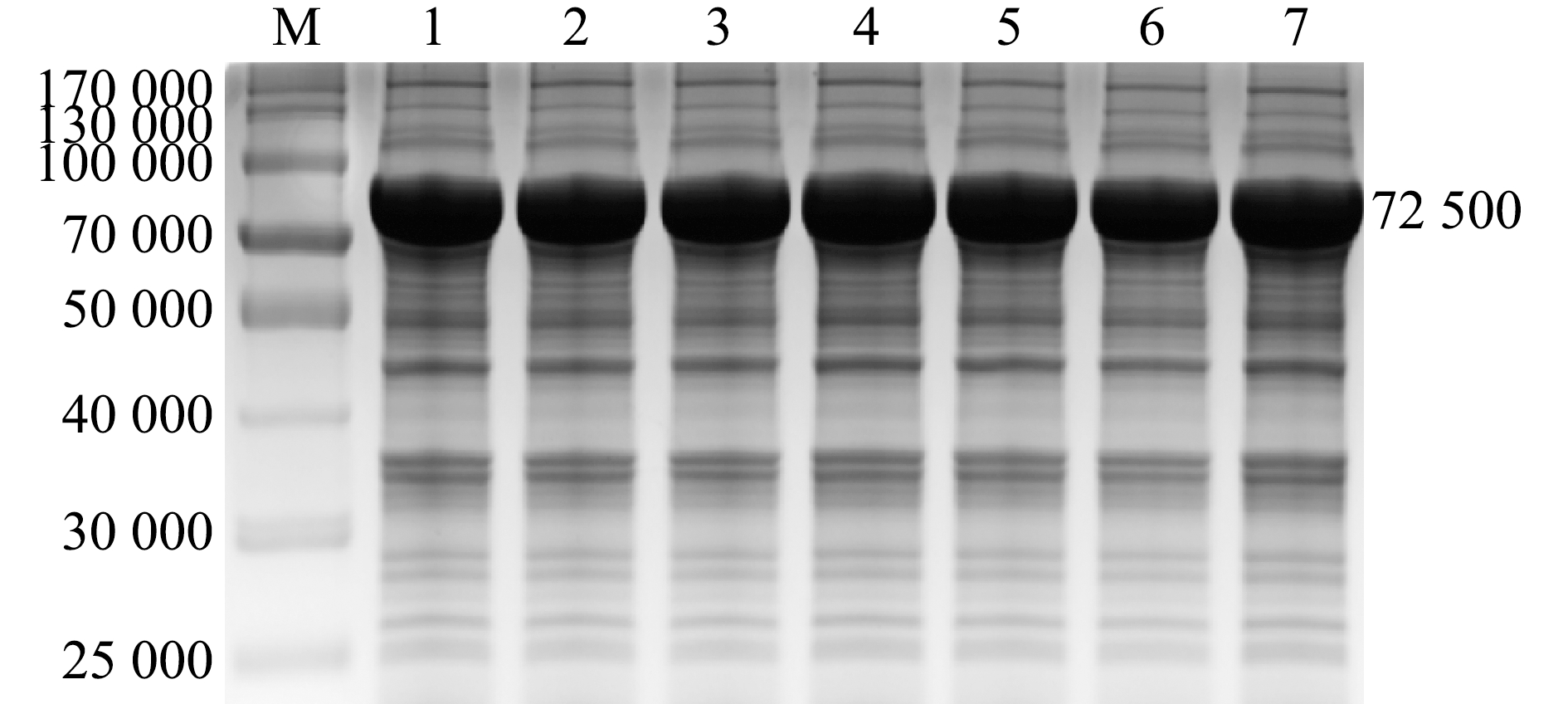
M—蛋白marker;1~7—IPTG浓度分别为 0.1、0.2、0.4、0.6、0.8、1.0、2.0 mmol/L。
M—protein marker;1-7—0.1,0.2,0.4,0.6,0.8,1.0,and 2.0 mmol/L IPTG.
图6 不同IPTG浓度下ThiC蛋白的表达
Fig.6 Expression of ThiC protein at different concentrations of IPTG
2.5 His-ThiC蛋白的纯化
融合蛋白ThiC经His标签蛋白纯化柱纯化后,SDS-PAGE分析表明,纯化后的融合蛋白在相对分子质量72 500附近具有单一条带(图7)。
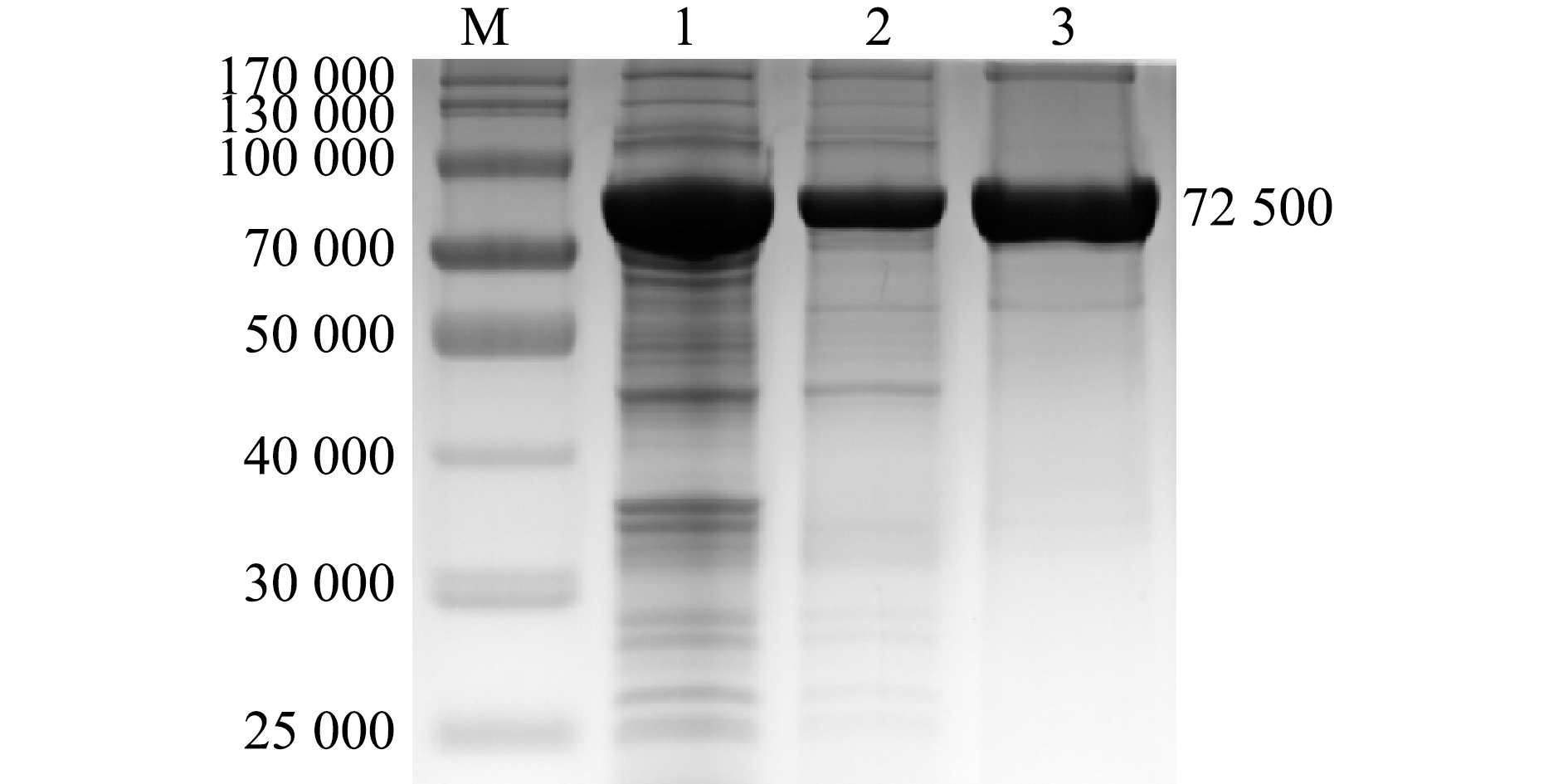
M—蛋白marker;1—全菌;2—上清液ThiC蛋白;3—纯化的ThiC蛋白。
M—protein marker;1—whole bacterium;2—supernatant of ThiC protein;3—purification of ThiC protein.
图7 ThiC纯化蛋白的SDS-PAGE检测
Fig.7 SDS-PAGE detection of purification of ThiC protein
2.6 ThiC蛋白的乙酰化验证
利用CobB蛋白的体外去乙酰化功能,采用抗乙酰赖氨酸抗体进行蛋白质印迹分析,以测试CobB蛋白处理前后ThiC的乙酰化水平。结果表明:Western blot结果均呈阳性,可见ThiC蛋白是一个乙酰化蛋白;不加入NAD+或不加入CobB蛋白的反应,与加入NAD+和CobB蛋白的反应中条带亮度变化不明显,表示CobB蛋白对ThiC蛋白乙酰化影响程度较小,未发生去乙酰化(图8)。

anti-KAC—Western blot(抗乙酰赖氨酸抗体);Cooma—考马斯亮蓝染色;1—无CobB蛋白、无NAD+组;2—有CobB蛋白、无NAD+组;3—无CobB蛋白、有NAD+组;4—有CobB蛋白、有NAD+组。
anti-KAC—Western blot (anti-acetyl-lysine antibody);Cooma—Coomassie blue staining;1—without CobB protein,and without NAD+;2—with CobB protein,and without NAD+;3—without CobB protein,and with NAD+;4—with CobB protein,and with NAD+.
图8 ThiC蛋白乙酰化的Western blot鉴定
Fig.8 Western blot identification of ThiC protein acetylization
3 讨论
3.1 ThiC重组蛋白的制备及最佳表达条件
本研究中,根据NCBI上已公布的ThiC基因序列设计引物,扩增得到序列长度为1 941 bp。因大肠杆菌具有增长快速、易于遗传、高产量和低成本等优点,故其为重组蛋白最理想的宿主之一[19]。由于His标签分子量小,不改变蛋白溶解性,便于分离纯化,因此,本研究中选用His标签以有效纯化ThiC蛋白,为后续ThiC蛋白的乙酰化修饰鉴定提供了有益参考。
为了使蛋白表达量最大化,本研究中对原核表达诱导的时间、温度和IPTG 浓度进行优化,结果表明,在0.1 mmol/L IPTG、37 ℃条件下诱导3 h时蛋白表达量最大,随着诱导时间的延长,蛋白表达量在3 h时达到最高,3~7 h时表达量变化不明显,说明长时间诱导并不会使表达量一直增加;大肠杆菌的最佳生长温度是37 ℃,但适合诱导蛋白表达的温度并不相同,融合蛋白快速表达会影响蛋白结构的正确折叠,导致包涵体的形成增加[19],由于包涵体纯化活性蛋白比较困难,故选取37 ℃上清液进行后续试验;IPTG浓度对重组蛋白表达量的影响不明显,这与徐洲等[20]的IPTG浓度在一定范围内对PepA蛋白表达量无影响的研究结果相似。
3.2 乙酰化及去乙酰化对ThiC蛋白的调控作用
乙酰化修饰在蛋白质水平和代谢水平上具有多方面影响,因此,深入研究乙酰化修饰对蛋白功能的调控与细胞代谢具有重要意义。乙酰化发生在许多涉及代谢过程的蛋白质中,包括乙酰辅酶A的合成、糖酵解、糖异生、糖原生物合成、氨基酸生物合成和脂肪酸代谢等[21]。赖氨酸乙酰化可被脱乙酰基酶去乙酰化,在原核生物中去乙酰化机制主要是依赖NAD+的沉默信息调节因子Sirtuins家族,如大肠杆菌中CobB可在体外使趋化蛋白CheY脱乙酰,体内CobB导致的CheY脱乙酰化可以调节其与鞭毛运动开关蛋白FliM的结合能力,从而影响大肠杆菌的运动功能[22]。CobB在细胞正常生长过程中抑制乙酰化,其缺失对细胞生长和乙酰化水平具有重要影响[23]。本研究表明,ThiC蛋白在体外不能去乙酰化。
ThiC是硫胺素生物合成过程中的一种关键酶,ThiC缺乏会导致嘧啶营养缺陷型的产生。在体外重组2-甲基-4-氨基-5-羟甲基嘧啶(HMP)合成试验中,从反应混合物中去除AIR或ThiC时,无法检测到HMP合成[24]。目前,溶藻弧菌ThiC蛋白的功能及其翻译后修饰研究较为缺乏,本研究中首次发现ThiC蛋白存在乙酰化修饰,表明该蛋白在胞内极有可能受到乙酰化修饰调控,并在溶藻弧菌生命活动中发挥重要作用。但乙酰化修饰对溶藻弧菌ThiC蛋白及其相关代谢过程的影响、ThiC蛋白乙酰化水平的分子调控机制等,尚需进一步研究。
4 结论
1)本研究中扩增获得了溶藻弧菌ThiC基因,并成功构建了其重组表达菌株,确定了最优诱导条件为温度37 ℃、IPTG 0.1 mmol/L及诱导时间3 h。
2)本研究中验证了ThiC蛋白存在乙酰化修饰,但体外不能去乙酰化。
[1] AHMED R,RAFIQUZAMAN S M,HOSSAIN M T,et al.Species-specific detection of Vibrio alginolyticus in shellfish and shrimp by real-time PCR using the groEL gene[J].Aquaculture International,2016,24(1):157-170.
[2] LAJNEF R,SNOUSSI M,ROMALDE J L,et al.Comparative study on the antibiotic susceptibility and plasmid profiles of Vibrio alginolyticus strains isolated from four Tunisian marine biotopes[J].World Journal of Microbiology and Biotechnology,2012,28(12):3345-3363.
[3] NARRACCI M,ACQUAVIVA M I,CAVALLO R A.Mar Piccolo of Taranto:Vibrio biodiversity in ecotoxicology approach[J].Environmental Science and Pollution Research,2014,21(3):2378-2385.
[4] 杨少丽,王印庚,董树刚.海水养殖鱼类弧菌病的研究进展[J].海洋水产研究,2005,26(4):75-83.
YANG S L,WANG Y G,DONG S G.Progress of research on vibriosis in marine cultured fish[J].Marine Fisheries Research,2005,26(4):75-83.(in Chinese)
[5] SLIFKA K M J,NEWTON A E,MAHON B E.Vibrio alginolyticus infections in the USA,1988-2012[J].Epidemiology &Infection,2017,145(7):1491-1499.
[6] XIE J S,BU L F,JIN S,et al.Outbreak of vibriosis caused by Vibrio harveyi and Vibrio alginolyticus in farmed seahorse Hippocampus kuda in China[J].Aquaculture,2020,523:735168.
[7] WANG Y D,HUANG S J,CHOU H N,et al.Transcriptome analysis of the effect of Vibrio alginolyticus infection on the innate immunity-related complement pathway in Epinephelus coioides[J].BMC Genomics,2014,15(1):1102.
[8] AKSNES H,VAN DAMME P,GORIS M,et al.An organellar nα-acetyltransferase,naa60,acetylates cytosolic N termini of transmembrane proteins and maintains Golgi integrity[J].Cell Reports,2015,10(8):1362-1374.
[9] DRAZIC A,MYKLEBUST L M,REE R,et al.The world of protein acetylation[J].Biochimica et Biophysica Acta (BBA) -Proteins and Proteomics,2016,1864(10):1372-1401.
[10] 刘婧,李淑娴,邵雷.细菌体内乙酰化修饰研究进展[J].微生物学通报,2021,48(2):637-647.
LIU J,LI S X,SHAO L.Protein acetylation in bacteria[J].Microbiology China,2021,48(2):637-647.(in Chinese)
[11] WEINERT B T,IESMANTAVICIUS V,WAGNERS A,et al.Acetyl-phosphate is a critical determinant of lysine acetylation in E. coli[J].Molecular Cell,2013,51(2):265-272.
[12] 潘德渊,许丽艳,李恩民.TB4的翻译后修饰及其功能调控[J].生命的化学,2021,41(4):734-740.
PAN D Y,XU L Y,LI E M.Post-translational modification of TB4 and its functional regulation[J].Chemistry of Life,2021,41(4):734-740.(in Chinese)
[13] 游同钊,廖玉丹,严威敏,等.氟化钠对人原代成骨细胞p21基因组蛋白乙酰化及表达的影响[J].环境与职业医学,2016,33(6):536-541.
YOU T Z,LIAO Y D,YAN W M,et al.Effects of sodium fluoride on histone acetylation and expression of p21 gene in human primary osteoblasts[J].Journal of Environmental and Occupational Medicine,2016,33(6):536-541.(in Chinese)
[14] KOVACS J J,MURPHY P J M,GAILLARDS,et al.HDAC6 regulates Hsp90 acetylation and chaperone-dependent activation of glucocorticoid receptor[J].Molecular Cell,2005,18(5):601-607.
[15] PALMERL D,DOWNS D M.The thiamine biosynthetic enzyme ThiC catalyzes multiple turnovers and is inhibited by S-adenosylmethionine (AdoMet) metabolites[J].Journal of Biological Chemistry,2013,288(42):30693-30699.
[16] CHATTERJEE A,HAZRA A B,ABDELWAHEDS,et al.A “Radical Dance” in thiamin biosynthesis:mechanistic analysis of the bacterial hydroxymethylpyrimidine phosphate synthase[J].Angewandte Chemie,2010,122(46):8835-8838.
[17] KONG D Y,ZHU Y X,WUH L,et al.AtTHIC,a gene involved in thiamine biosynthesis in Arabidopsis thaliana[J].Cell Research,2008,18(5):566-576.
[18] DONG W,STOCKWELL V O,GOYER A.Enhancement of thiamin content in Arabidopsis thaliana by metabolic engineering[J].Plant and Cell Physiology,2015,56(12):2285-2296.
[19] BAESHEN M N,AL-HEJIN A M,BORAR S,et al.Production of biopharmaceuticals in E.coli:current scenario and future perspectives[J].Journal of Microbiology and Biotechnology,2015,25(7):953-962.
[20] 徐洲,范晨龙,丁燏.溶藻弧菌PepA蛋白原核表达载体的构建及其乙酰化鉴定[J].生物技术通报,2020,36(12):75-81.
XU Z,FAN C L,DING Y.Construction of prokaryotic expression vector of PepA protein of Vibrio alginolyticus and identification of its acetylation[J].Biotechnology Bulletin,2020,36(12):75-81.(in Chinese)
[21] HU L I,LIMA B P,WOLFEA J.Bacterial protein acetylation:the dawning of a new age[J].Molecular Microbiology,2010,77(1):15-21.
[22] LI R,GU J,CHENY Y,et al.CobB regulates Escherichia coli chemotaxis by deacetylating the response regulator CheY[J].Molecular Microbiology,2010,76(5):1162-1174.
[23] WEINERT B T,SATPATHY S,HANSENB K,et al.Accurate quantification of site-specific acetylation stoichiometry reveals the impact of sirtuin deacetylase CobB on the E.coli acetylome[J].Molecular &Cellular Proteomics,2017,16(5):759-769.
[24] LAWHORN B G,MEHL R A,BEGLEYT P.Biosynthesis of the thiamin pyrimidine:the reconstitution of a remarkable rearrangement reaction[J].Organic &Biomolecular Chemistry,2004,2(17):2538-2546.