杂色鲍Haliotis diversicolor是中国南方一种特色养殖鲍类,其肉质紧密、营养丰富,深受消费者青睐。近年来,高密度集约化鲍苗种的生产和养殖,面临着疾病频繁发生的严峻挑战,特别是在夏季,水温升高和水体缺氧时鲍会产生强烈应激,且水体中易滋生大量细菌,疾病频发[1],其中,副溶血弧菌Vibrio parahaemolyticus是鲍细菌性疾病的主要病原之一[2]。因此,杂色鲍的遗传改良是其养殖产业可持续健康发展的迫切需求,而研究杂色鲍在高温应激、缺氧应激中的表达情况可为培养优良性状的鲍品种提供新的思路和相应的数据支撑。
细胞凋亡(apoptosis)是一个基本而又复杂的生物学过程,在发育、内稳态和免疫中发挥杀死和清除不必要细胞的作用[3]。Caspase(cysteinyl aspartate specific proteinase)是在细胞凋亡的激活和执行过程中发挥作用的主要酶类[4-5]。根据Caspase家族在凋亡通路的位置,Caspase成员可分为启动型Caspase(Caspase-2、Caspase-8、Caspase-9、Caspase-10)和执行型Caspase(Caspase-3、Caspase-6、Caspase-7)[6-7]。启动型Caspase成员位于Caspase细胞凋亡传导通路的上游,与辅助因子发生相互作用而自我活化,从而激活下游的Caspase[8];执行型Caspase能够特异性地裂解底物,导致机体结构和生化发生改变,引发细胞凋亡[9]。另外,Caspase家族还有一类炎症介导因子(Caspase-1、Caspase-4、Caspase-5、Caspase-11、Caspase-12)[10-11],在细胞凋亡中起辅助作用[10]。Caspase-3是典型的Caspase家族成员,位于凋亡级联反应的下游,汇集整合凋亡刺激信号[4,12],是细胞凋亡的关键执行者,在细胞凋亡过程中发挥着重要的作用[4]。
目前,鲍的Caspase-3分子克隆尚未见报道,细胞凋亡在应激条件方面的作用分析也鲜有报道。为此,本研究中克隆了杂色鲍caspase-3基因的全长cDNA序列,并分析了该基因在杂色鲍组织、早期发育和各种应激下的表达,以期了解细胞凋亡在鲍应激和发育过程的作用,为杂色鲍的发育和应激条件提供数据参考。
1 材料与方法
1.1 材料
试验用杂色鲍购于福建省厦门市大嶝岛养殖场,体质量为(7.50±2.00)g,体长为(4.10±0.50)cm,暂养期间溶解氧为6.0~6.5 mg/L,水温为23~25 ℃,每天投喂新鲜海带或石莼一次,每两天换1/2新鲜海水。
1.2 方法
1.2.1 样品的采集与处理 随机选取8只健康杂色鲍进行解剖,分别收集每只鲍的肝胰腺、血淋巴、肾、鳃和外套膜等组织,并分别放入冻存管中,经液氮速冻后置于-80 ℃冰箱中保存,用于样品总RNA提取。
选取性腺发育状况良好的杂色鲍进行催产和人工授精。催产和人工授精参考王国栋等[13]的方法。授精成功后使用解剖镜实时观察胚胎发育情况,并收集受精卵到稚鲍各个时期的样品,经液氮速冻后置于-80 ℃冰箱中保存备用。
1.2.2 应激试验
1)细菌病原感染应激试验。试验组和对照组各取8只杂色鲍,试验组使用微量注射器在杂色鲍腹足肌肉处注射浓度为1.1×108 CFU/mL的副溶血弧菌菌液50 μL,对照组注射等体积的无菌生理盐水。注射后分别取试验组和对照组0、3、6、12、24、48 h时的杂色鲍,解剖后取其血淋巴,经液氮速冻后,置于-80 ℃冰箱中保存,用于总RNA提取。
2)高温应激试验。根据本课题组前期杂色鲍高温应激的研究结果,确定高温应激温度为31 ℃。应激处理自25 ℃开始,以1 ℃/h升温至28 ℃时作为第1时相(0 h)取样点,至31 ℃时作为第2时相(3 h)取样点;此后维持水温不变,以6、24、96、192 h时分别作为第3、4、5、6时相点。以25 ℃作为对照组,取样时间点与高温应激试验组相同。高温应激试验组及对照组分别取8只健康杂色鲍的鳃、血淋巴和肝胰腺于液氮中速冻后,置于-80 ℃冰箱中保存,用于总RNA提取。
3)缺氧应激试验。缺氧应激试验参考张鑫等[14]的方法,设定2 mg/L的溶氧量为本次试验的缺氧条件。空气曝气(5.5 mg/L)为对照组的溶氧量。在4、24、96、192 h各取试验组和对照组8只鲍鱼的血淋巴和鳃,经液氮速冻后,置于-80 ℃冰箱中保存,用于总RNA提取。
1.2.3 总RNA的提取及检测 取20 mg冻存的样品组织加入0.5 mL Trizol,置于全自动样品快速研磨仪(JXFSTPRP-48)冰浴匀浆后,按照Trizol抽提试剂盒说明书进行总RNA的提取。提取完成后取3 μL 总RNA进行琼脂糖电泳检测,取1 μL用微量紫外分光光度计测定RNA浓度。
1.2.4 caspase-3基因片段的克隆和序列分析 根据杂色鲍转录组中的caspase-3部分核酸序列,用Primer 5软件设计RACE引物来扩增此基因的全长cDNA序列,并采用NCBI中的ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)验证开放阅读框(ORF)的正确性。PCR产物经纯化、连接、转化后测序,CBI vector screen在线(http://www.ncbi.nlm.nih.gov/VecScreen/VecScreen.html)去除载体序列,采用bl2seq进行比对拼接。利用BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列同源性比对分析。采用ExPASY分析工具(http://www.expasy.org/tools/pi_tool.html)预测蛋白的等电点和分子量,利用NCBI(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线预测蛋白的功能结构域。采用ClustalX2.1软件进行序列多重比较,利用MAGE 7.0软件(Neighbor-joining法)构建系统进化树。
1.2.5 定量PCR反应体系及条件 总RNA经随机引物逆转录后作为定量PCR模板。采用罗氏LightCycler480 Real Time PCR System进行定量PCR。
定量PCR反应体系(共20 μL):SYBR Green Realtime PCR Master Mix 9 μL(购自 Promega公司GoTaq qPCR Master Mix,A6001),10 μmol/L正、反向引物各0.5 μL,cDNA 模板10 μL。定量PCR体系反应程序:95 ℃下预变性2 min;95 ℃下变性15 s,60 ℃下退火 1 min,72 ℃下延伸30 s,进行40 个循环。选择β-actin为内参基因(将内参基因归一化),具体引物信息见表1。
表1 试验用引物和序列
Tab.1 Primers and sequence information in the experiment
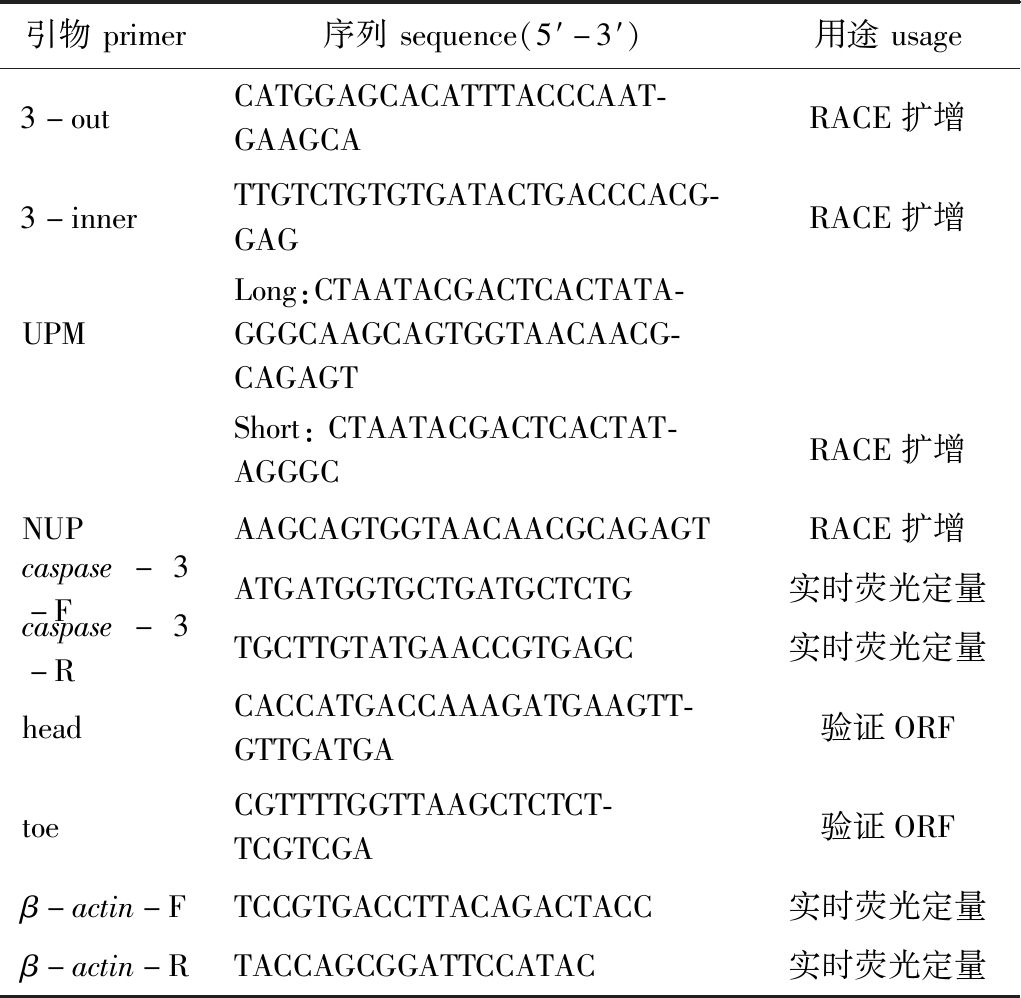
引物primer序列sequence(5′-3′)用途usage3-outCATGGAGCACATTTACCCAAT-GAAGCARACE扩增3-innerTTGTCTGTGTGATACTGACCCACG-GAGRACE扩增UPMLong:CTAATACGACTCACTATA-GGGCAAGCAGTGGTAACAACG-CAGAGTShort:CTAATACGACTCACTAT-AGGGCRACE扩增NUPAAGCAGTGGTAACAACGCAGAGTRACE扩增caspase-3-FATGATGGTGCTGATGCTCTG实时荧光定量caspase-3-RTGCTTGTATGAACCGTGAGC实时荧光定量headCACCATGACCAAAGATGAAGTT-GTTGATGA验证ORFtoeCGTTTTGGTTAAGCTCTCT-TCGTCGA验证ORFβ-actin-FTCCGTGACCTTACAGACTACC实时荧光定量β-actin-RTACCAGCGGATTCCATAC实时荧光定量
1.3 数据处理
由LightCycler480 Real Time PCR System仪器测出Ct值,采用2-△△Ct法计算各样品的基因表达量,以缺氧应激4 h的第一个生物学重复组的表达量为基值,计算各样品的相对表达量。待测基因的表达量用8个生物学重复的平均值±标准误(mean±S.E.)表示。采用SPSS 22.0软件对杂色鲍不同组织和发育阶段的基因表达量进行单因素方差分析(one-way ANOVA),采用Duncan法进行组间多重比较;对杂色鲍高温应激、缺氧应激的表达量进行单样本T检验(Student’s T test)分析。显著性水平设为0.05。
2 结果与分析
2.1 杂色鲍caspase-3基因的克隆和序列分析
杂色鲍caspase-3基因cDNA全长为1 192 bp,3′UTR为298 bp,5′UTR为135 bp,ORF为759 bp,编码252个氨基酸。预测其编码的蛋白相对分子质量为28 480,等电点为6.08,含有一个完整的CASc结构域;9~130 aa为半胱氨酸蛋白家族大亚基(P20)活性位点,160~252 aa为小亚基(P10)活性位点,116~127 aa为半胱氨酸CYS活性位点,72~86 aa为组氨酸HIS信号(图1)。

*为终止子;短虚划线为P20活性位点(9~130 aa);实下划线为P10活性位点(160~252 aa);虚线方框为HIS信号(72~86 aa),实线方框为CYS活性位点(116~127 aa)。
* is terminator;the short dashed lines indicate the P20 active site (9-130 aa);The active site of P10 (160-252 aa) is shown in solid underline;HIS signal (72-86 aa) is shown in the dashed box,and CYS active site(116-127 aa) is shown in the box.
图1 杂色鲍caspase-3基因的核苷酸序列和推导的氨基酸序列
Fig.1 Nucleotide sequence and the deduced amino acid sequences of caspase-3 gene in variously colored abalone Haliotis diversicolor
2.2 Caspase-3氨基酸序列的同源性分析
采用ClustalX 2.1软件和MEGA7 软件对氨基酸序列进行多重比对分析,比对结果显示,杂色鲍Caspase-3有一个高度保守的大亚基(P20)和一个小亚基(P10),保守基序HIS信号(HKDTDCFVCVILTHG)和CYS活性位点(QACRG)位于P20上。所有序列均在相同位置含有保守的半胱氨酸残基。经BLAST比对显示,杂色鲍Caspase-3与厚壳贻贝Mytilus coruscus Caspase-7的氨基酸序列一致性最高(48.62%),与高等脊椎动物人Homo sapiens Caspase-3、马Equus caballus Caspase-3、山羊Capra hircus Caspase-7的氨基酸序列一致性为44.44%~45.42%,与软体动物美洲牡蛎Crassostrea virginic Caspase-3、长牡蛎Crassostrea gigas Caspase-7的氨基酸序列一致性分别为44.09%、45.67%(图2)。Caspase-3氨基酸序列的系统进化树分析显示,杂色鲍Caspase-3氨基酸序列与长牡蛎、厚壳贻贝、加州海兔Aplysia californica等软体动物聚成一大支,与斑马鱼Danio rerio、褐家鼠Rattus norvegicus和人等脊椎动物聚成另一大支(图3)。

虚线方框表示保守基序 HIS 信号(HKDTDCFVCVILTHG),实线方框表示 CYS 活性位点(QACRG)。 表示CASc蛋白水解位点,★表示CASc的二聚体作用位点;▲表示caspase-3高度保守的半胱氨酸。
表示CASc蛋白水解位点,★表示CASc的二聚体作用位点;▲表示caspase-3高度保守的半胱氨酸。
The conservative motif HIS signal(HKDTDCFVCVILTHG)is shown in the dotted box,and the active sites of CYS(QACRG)are shown in the solid boxes. indicates the site of CASc protein hydrolysis,★ indicates the dimer action site of CASc;▲ indicates caspase-3 highly conserved cysteine.
indicates the site of CASc protein hydrolysis,★ indicates the dimer action site of CASc;▲ indicates caspase-3 highly conserved cysteine.
图2 杂色鲍与其他物种Caspase-3氨基酸的多重序列比对
Fig.2 Multiple alignment of amino acids sequence of Caspase-3 between variously colored abalone Haliotis diversicolor and other species
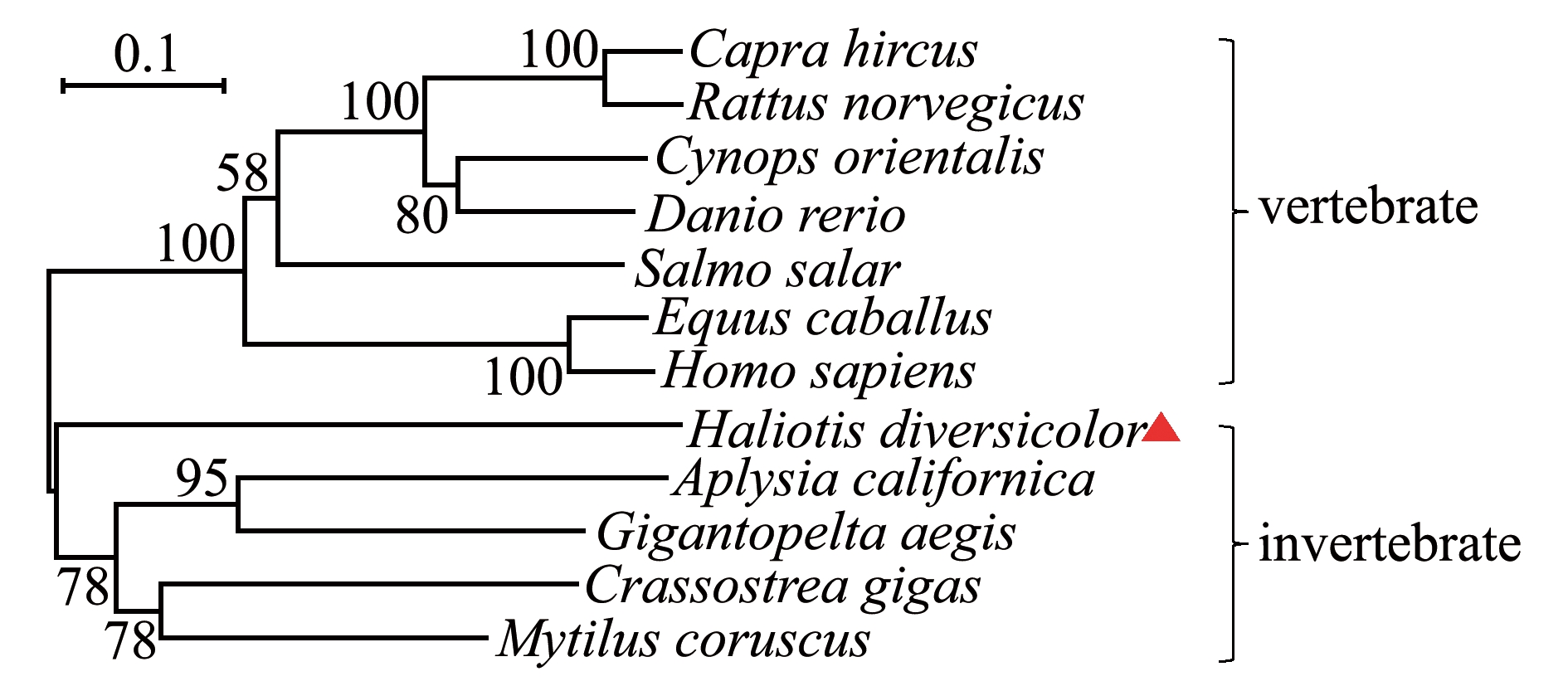
图3 杂色鲍Caspase-3氨基酸序列的系统进化树
Fig.3 Phylogenetic tree of Caspase-3 amino acid sequences in variously colored abalone Haliotis diversicolor
2.3 杂色鲍caspase-3在早期发育阶段的表达
从图4可见:在杂色鲍早期发育过程中,从受精卵时期开始到稚鲍时期均有检测到caspase-3基因的表达,其中,在杂色鲍受精卵时期和2细胞期的表达量最高;4细胞期、桑椹胚期、囊胚期、原肠胚期和担轮幼虫期的表达量显著低于受精卵时期和2细胞期(P<0.05),但显著高于面盘幼虫早期与晚期、匍匐幼虫早期和稚鲍期;面盘幼虫早期caspase-3基因表达量为早期发育时期的最低表达量,到匍匐期时caspase-3基因表达量开始回升,到稚鲍时期表达量趋于稳定。

1—受精卵期;2—2细胞期;3—4细胞期;4—桑椹胚期;5—囊胚期;6—原肠胚期;7—担轮幼虫早期;8—担轮幼虫晚期;9—面盘幼虫早期;10—面盘幼虫晚期;11—匍匐幼虫早期;12—稚鲍。标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
1—fertilized egg stage;2—2-cell stage;3—4-cell stage;4—morula stage;5—blastula stage;6—gastrula stage;7—early trochophore stage;8—late trochophore stage;9—early veliger stage;10—late veliger stage;11—creeping larva stage;12—juvenile abalone stage.The means with different letters are significant differences in different groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图4 不同发育阶段caspase-3基因的绝对表达量
Fig.4 Absolute expression levels of caspase-3 at different development stages
2.4 caspase-3基因在杂色鲍组织中的表达
从图5可见:caspase-3基因在杂色鲍各组织中均有表达,其中,肝胰腺组织中caspase-3的表达量最低,但与鳃、消化道、外套膜、肾和黏液腺组织中的表达量无显著性差异(P>0.05);血淋巴中caspase-3基因的表达量最高且显著高于其他组织(P<0.05)。
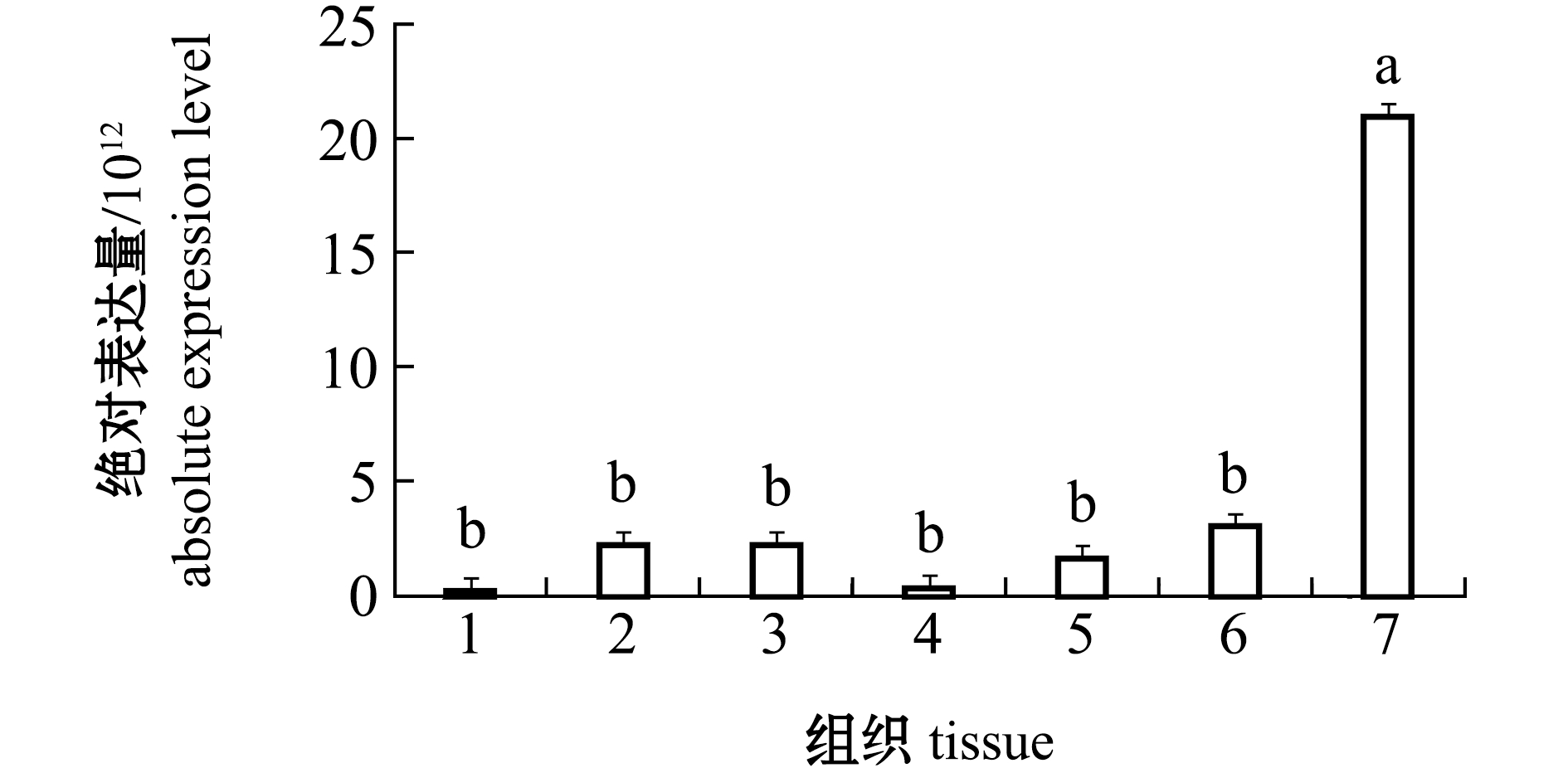
1—肝胰腺;2—鳃;3—外套膜;4—肾;5—消化道;6—黏液腺;7—血淋巴。
1—hepatopancreas;2—gill;3—mantle;4—kidney;5—digestive tract;6—mucous gland;7—hemolymph.
图5 不同组织中caspase-3基因的绝对表达量
Fig.5 Absolute expression levels of caspase-3 gene in different tissues
2.5 副溶血弧菌感染后caspase-3基因的表达变化
从图6可见:在感染0~6 h时,试验组与对照组caspase-3 mRNA相对表达量无显著性差异(P>0.05);12 h时相对表达量达到最大值,且显著高于对照组(P<0.05);24~48 h时表达量又逐渐恢复到对照水平(P>0.05)。
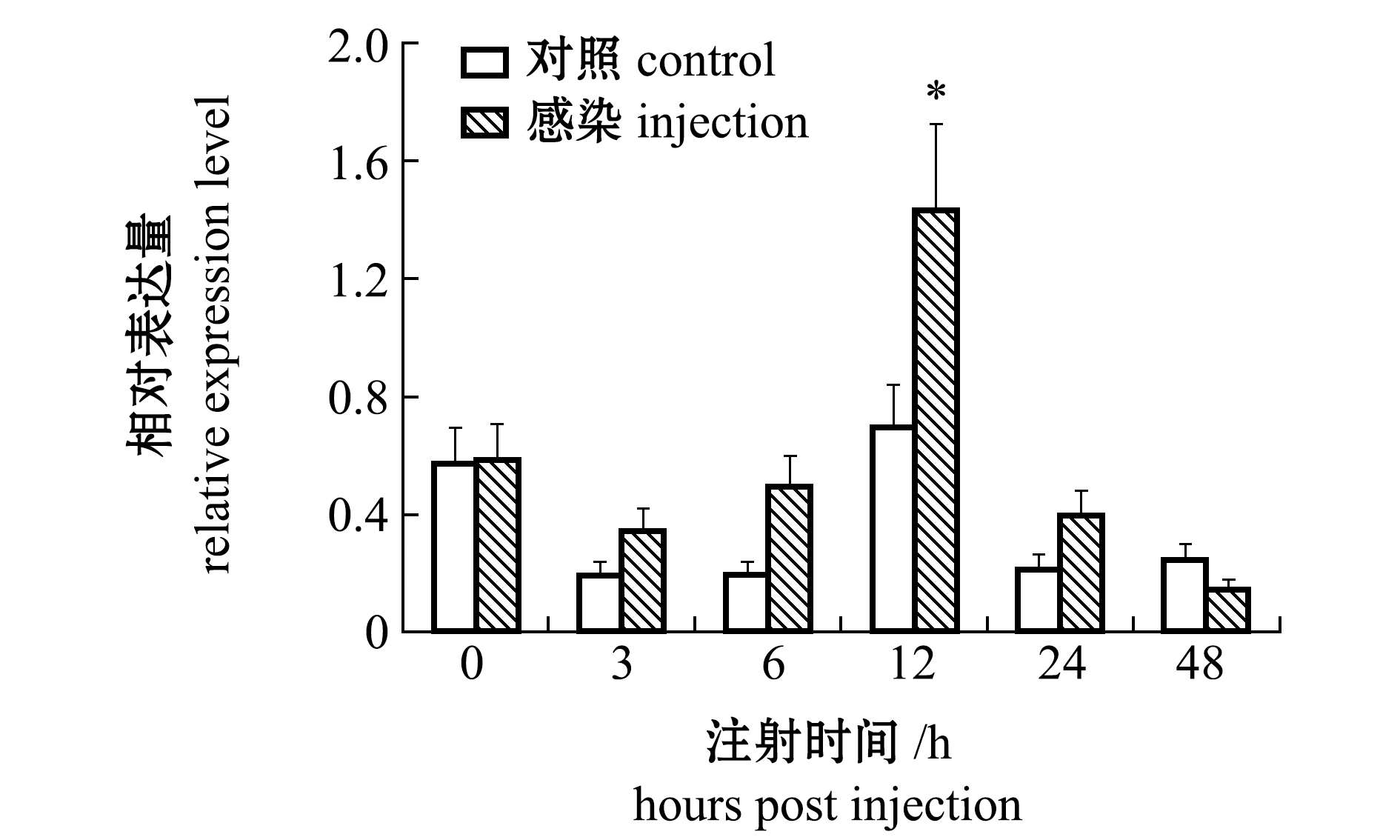
*表示与对照组有显著性差异(P<0.05),下同。
* means significant difference compared with the control(P<0.05),et sequentia.
图6 副溶血弧菌感染后caspase-3基因在血淋巴中的表达变化
Fig.6 Change in caspase-3 gene expression in hemolymph injected with Vibrio parahaemolyticus
2.6 高温应激处理后caspase-3基因的表达变化
从图7可见:经高温应激处理后,鳃中的caspase-3 mRNA相对表达量在0、3 h时显著高于对照组(P<0.05),在6 h时表达量降到最低,在24 h时表达量又开始升高,其中,24、96 h时表达量与对照组无显著性差异(P>0.05),在192 h时表达量达到最高,且显著高于对照组(P<0.05);血淋巴中的caspase-3基因相对表达量在0~6 h时无显著性差异(P>0.05),24 h时表达量上调并达到最高水平,且显著高于对照组 (P<0.05),96、192 h时其表达量与对照组无显著性差异(P>0.05);肝胰腺中的caspase-3基因相对表达量在高温应激0~6 h时无显著性差异(P>0.05),24 h时试验组表达量上升到最大值,且显著高于对照组(P<0.05),96、192 h时表达量恢复至与对照组无显著性差异的水平(P>0.05)。
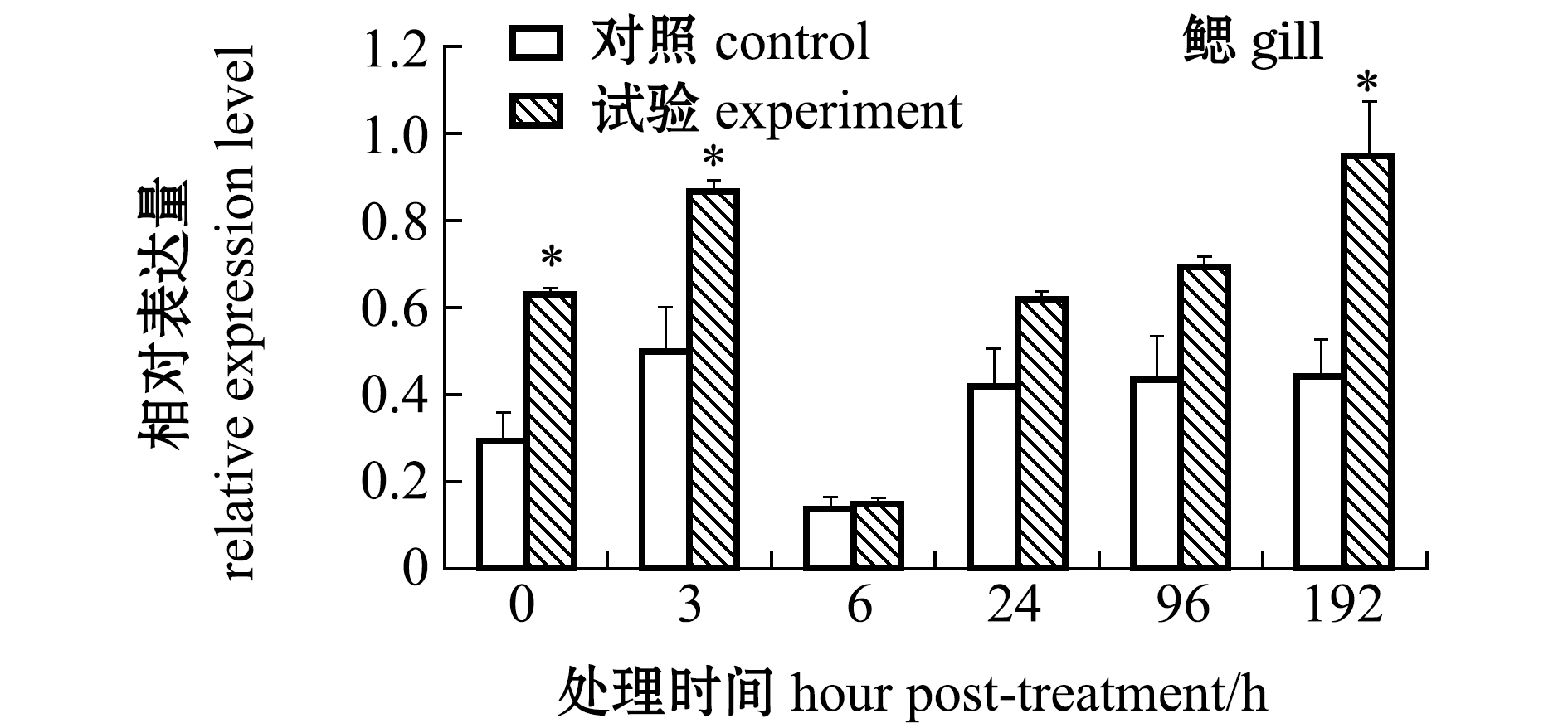

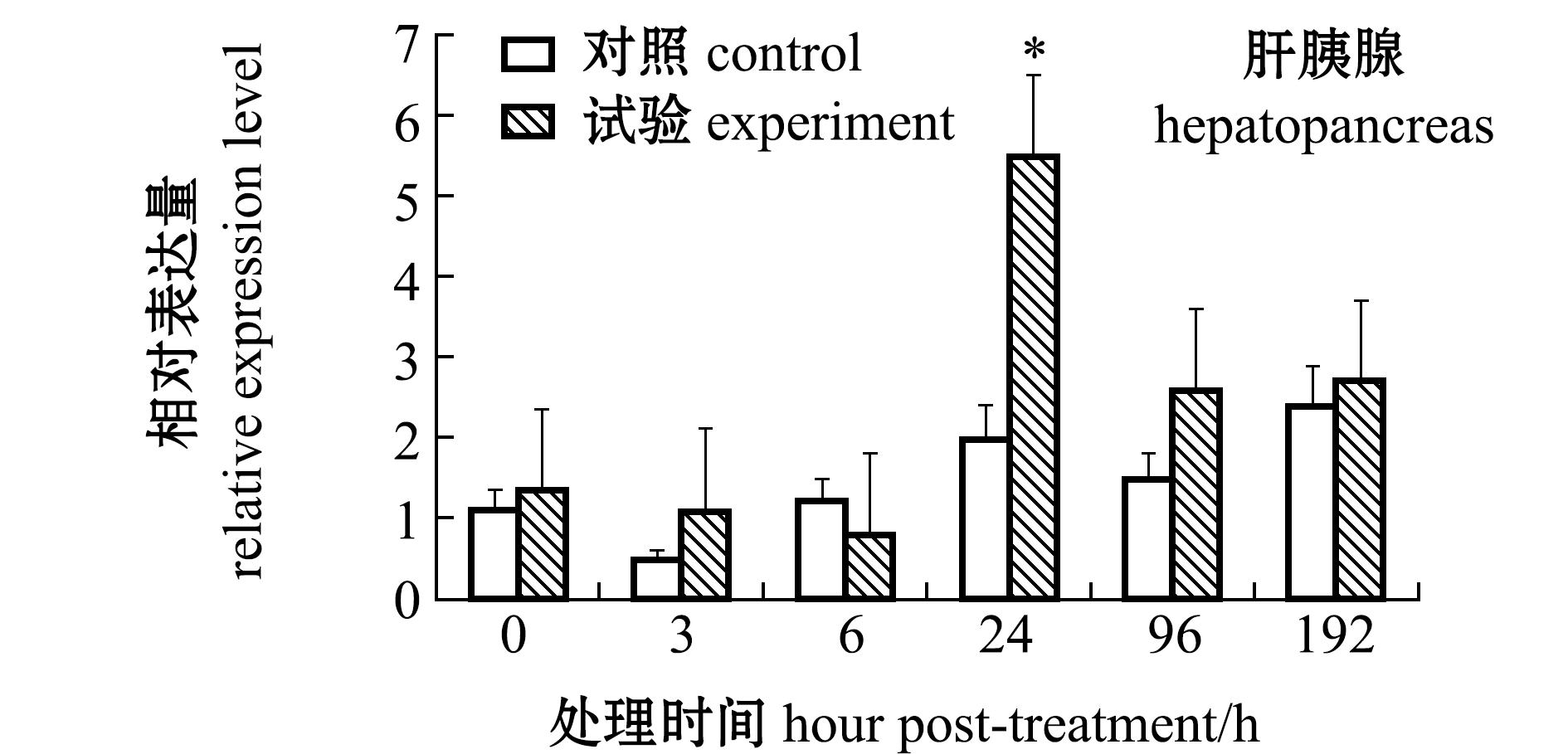
图7 高温应激后caspase-3基因在鳃、血淋巴和肝胰腺中的表达变化
Fig.7 Change in caspase-3 gene expression in gills,hemolymph and hepatopancreas exposed to high temperature
2.7 缺氧应激处理后caspase-3基因的表达变化
从图8可见:经缺氧处理后,在鳃组织中的caspase-3 mRNA在96 h时表达水平较对照组显著上调(P<0.05),在其他时间点缺氧试验组和对照组间无显著性差异(P>0.05);血淋巴中的caspase-3基因在4 h时就出现显著性上调(P<0.05),在24~96 h时试验组与对照组表达量均无显著性差异(P>0.05)。
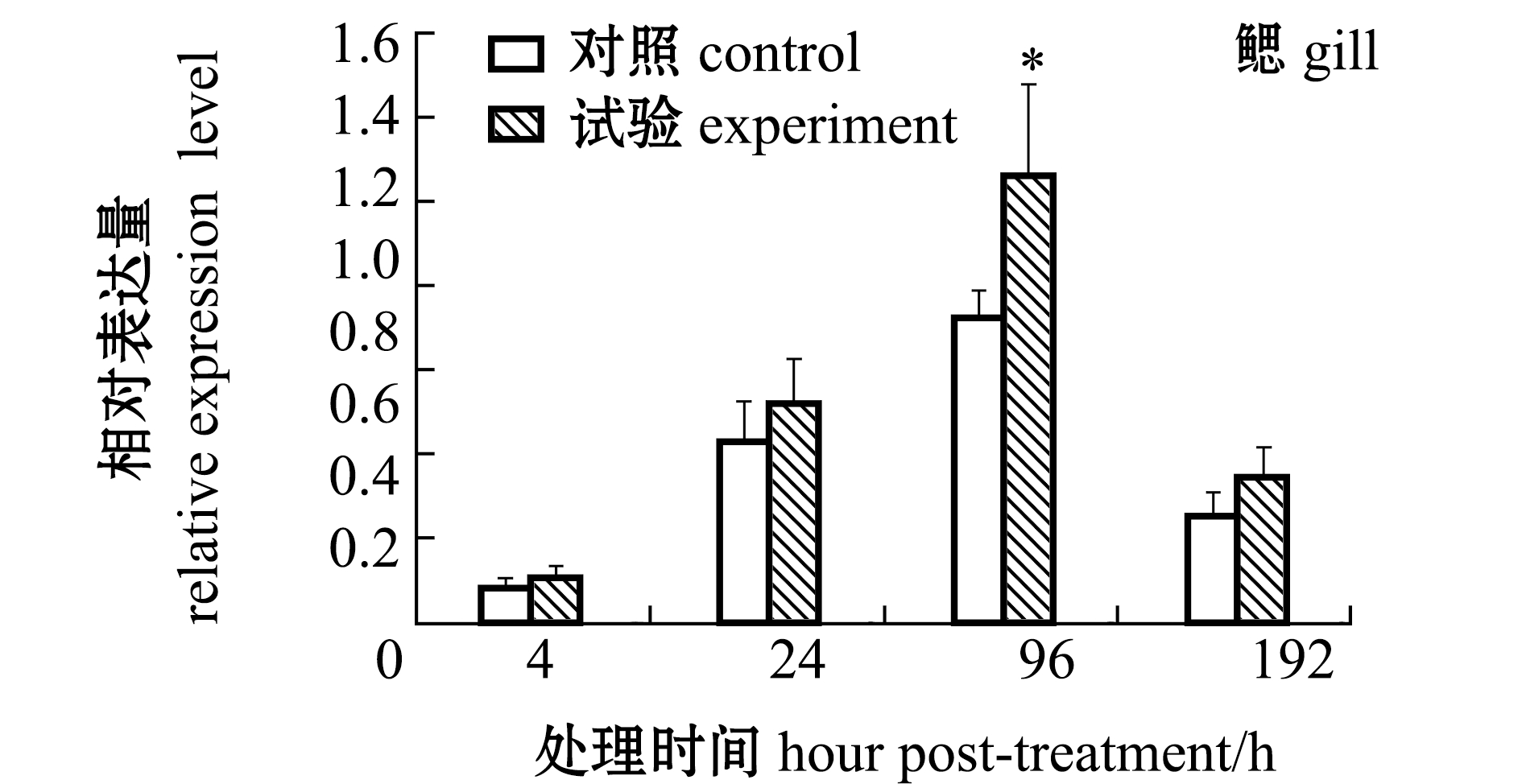
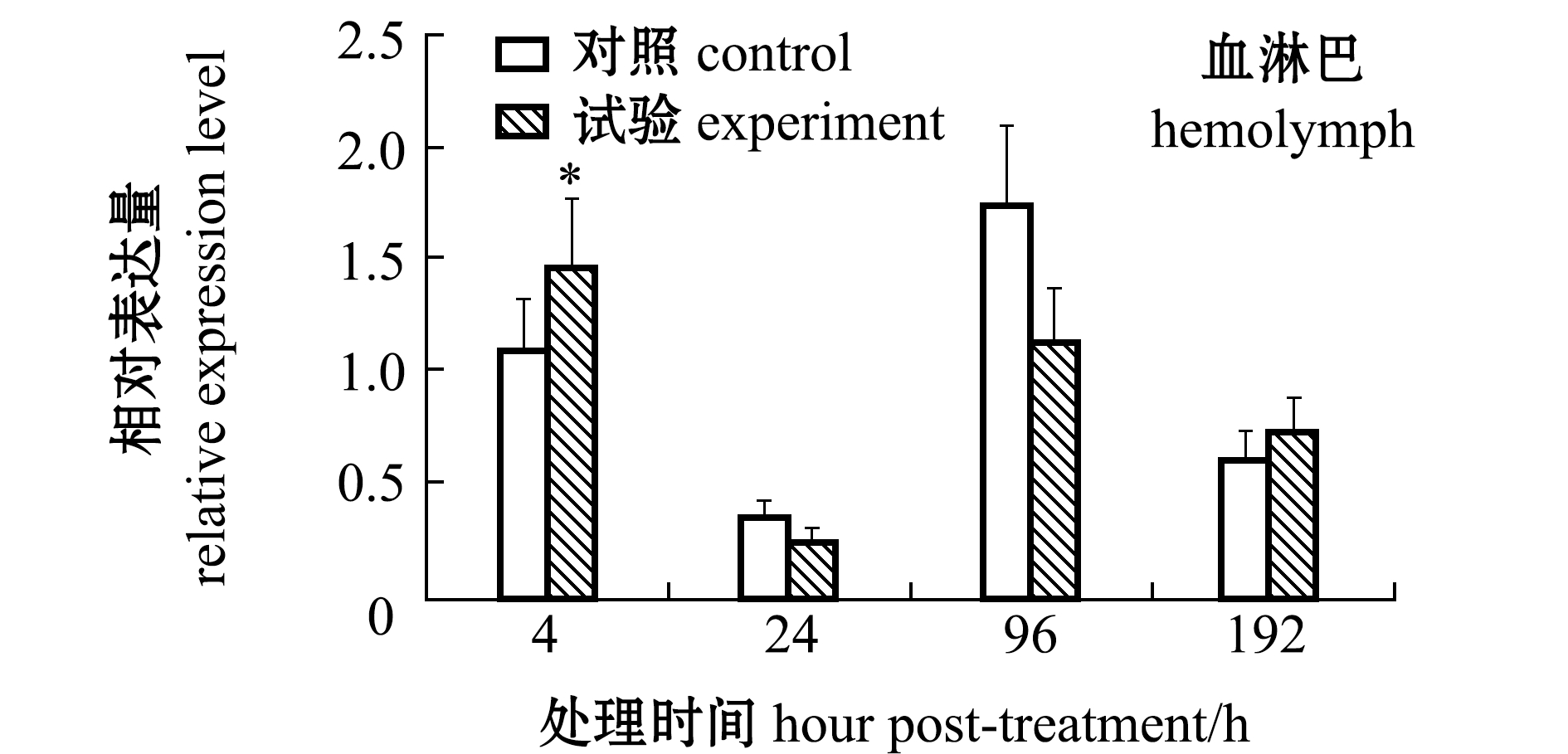
图8 缺氧应激后caspase-3基因在鳃和血淋巴中的表达变化
Fig.8 Change in caspase-3 gene expression in gills and hemolymph exposed to hypoxia
3 讨论
3.1 杂色鲍caspase-3基因序列分析
本研究中,杂色鲍caspase-3基因cDNA全长为1 192 bp,编码252个氨基酸残基Pro-Caspase蛋白,含有一个完整的CASc结构域,该结构为Caspase家族特有。Pro-Caspase可自体水解为P20和P10两个亚基,结合形成异二聚体,异二聚体随后形成具有酶活性的四聚体[15]。P20和P10在不同物种的Caspase-3中非常保守,已报道的几种水产动物caspase-3基因的克隆和鉴定也表明了这一点[16-18]。杂色鲍的Caspase-3也具有保守的P20和P10序列,通过序列比对发现,杂色鲍的Caspase-3与几种模式生物的Caspase-3同源,含有Caspase-3的所有保守氨基酸残基,具有参与细胞凋亡的结构基础[19]。
3.2 杂色鲍早期发育阶段caspase-3 mRNA的表达差异
本研究表明,在胚胎发育早期,caspase-3基因表达量在受精卵期和2细胞期无显著差异,但显著高于其他时期,4细胞期时表达量显著下降,这表明caspase-3基因具有显著的母系效应,胚胎早期阶段的mRNA主要来自母体在卵子中的积累。面盘幼虫由担轮幼虫发育而来,需要新形成面盘、贝壳和面盘收缩肌等新结构[20],以细胞分化和增殖为主,细胞凋亡较少出现,因此,该时期的caspase-3基因表达量显著下降。晚期面盘幼虫发育至早期匍匐幼虫时,面盘等组织开始退化崩解,细胞凋亡重新活跃。虽然caspase-3基因表达量有上升趋势,但尚未达到显著水平。早期匍匐幼虫会形成足、鳃等新组织,需要细胞分化和增殖,故细胞凋亡的强度和水平可能会被适当控制。杂色鲍caspase-3基因表达量在早期发育的关键阶段均有显著性变化,表明该基因参与了杂色鲍的早期发育。与此类似,杂色鲍的另一种caspase基因——CARD的表达与发育阶段也有较强的关联[21],这表明caspase基因在调节早期发育过程具有重要作用。
3.3 杂色鲍caspase-3 mRNA的组织表达差异
本研究表明,caspase-3基因在杂色鲍肝胰腺、血淋巴、肾、鳃、外套膜等组织中均有表达,但各组织中的表达量各异。这与厚壳贻贝中的caspase-8[22]、皱纹盘鲍Haliotis discus hannai中的caspase-8[23]和凡纳滨对虾Litopenaeus vannamei中的caspase-3[24]的表达模式类似。水生无脊椎动物血淋巴是机体主要的免疫组织,在免疫防御屏障中发挥了重要作用[25],能够有效抵御外来病原的入侵[26]。细胞凋亡是贝类细胞免疫的主要方式之一,能够防止病原体的扩散,降低炎症反应,修复组织损伤[27]。本研究中,杂色鲍caspase-3基因在血淋巴中的表达水平显著高于其他组织,表明其参与了杂色鲍免疫应答过程。
3.4 副溶血弧菌感染、高温应激和缺氧应激处理后杂色鲍caspase-3 mRNA的表达差异
杂色鲍的病原识别和免疫信号传递的基因,通常在弧菌感染3 h后上调表达[28-29],而免疫效应基因在感染后12 h上调表达[30-31]。本研究中,经副溶血弧菌感染后12 h,caspase-3基因表达量显著上调。这表明,caspase-3受免疫上游基因的调控,其响应时间晚于病原识别和信号传递过程,可能主要参与了病原清除过程。对虾感染病原后其caspase-3基因表达量同样在12 h时显著上调[32],与杂色鲍的表达模式类似。
本研究中,经高温处理后caspase-3基因在杂色鲍血淋巴、肝胰腺和鳃中的表达规律类似,在某些时间点试验组表达量显著高于对照组,与团头鲂Megalobrama amblycephala中的casapase-3[33]、caspase-9[34]和日本鳗鲡Anguilla japonica中的caspase-6[35]表达模式相似。大部分贝类的运动能力微弱,难以快速运动躲避不良环境,且经常受到高温或者缺氧的胁迫,导致caspase基因的表达上调[22,36]。本研究中,鳃直接接触外界水体,水温上升后直接刺激鳃组织,导致鳃细胞损伤,诱导caspase-3基因的上调,启动细胞凋亡清除受损细胞。所以在水温快速上升阶段(0~3 h),鳃中的caspase-3基因显著上调表达。而当水温稳定在高温初期,可能是损伤细胞暂时被清除,所以caspase-3基因的表达量与对照组无显著性差异;但长时间高温处理(高温应激192 h时)会导致更严重的损伤,因此,caspase-3基因再次显著上调。本研究中,机体内部组织血淋巴和肝胰腺中的caspase-3基因表达模式类似,均在24 h时显著上调,晚于鳃的上调表达时间,且在0、3、6、96、192 h时也未再次上调表达。这表明,血淋巴和肝胰腺对温度变化刺激的敏感程度低于鳃。本试验中还发现,当高温处理24 h时,杂色鲍活力表现变弱,这或许可以从侧面反映出机体需要caspase-3基因的参与和上调以稳定其生理所需。
本研究表明,杂色鲍缺氧时,caspase-3基因在血淋巴和鳃的表达有所差异,血淋巴在处理4 h时caspase-3基因表达量显著上升,而鳃组织在96 h时才开始显著上升。机体不同部位的氧分压不同,通常呼吸器官、血液和机体内部各组织等的氧分压依次降低[37]。杂色鲍鳃与外界水体直接接触,其氧分压接近环境的溶氧量。本试验中的低氧应激浓度为2 mg/L,高于正常组织的氧分压[38]。因此,即使处于低溶氧环境下的鳃也能获得较充足的氧气,短时间内不会因缺氧导致鳃组织损伤,不需要启动细胞凋亡程序。血淋巴作为氧气运输的组织,其氧分压低于水体环境;当机体处于缺氧环境时,血淋巴氧分压下降产生缺氧应激,所以在较早的时间里就需要caspase-3基因上调以维持机体稳定。
4 结论
1) 本研究成功克隆出杂色鲍caspase-3基因,预测Ccaspase-3蛋白有一个完整的CASc结构域。
2) 杂色鲍早期发育过程中,从受精卵时期开始到稚鲍时期均检测到caspase-3基因的表达,且caspase-3基因的表达量在早期发育的关键阶段均有显著性变化,这表明其参与了杂色鲍的早期发育。
3) 在健康杂色鲍各个组织中均能检测到caspase-3基因的表达量,其中,在血淋巴中的表达量显著高于其他组织,这表明其参与了杂色鲍免疫应答过程。
4) 副溶血弧菌感染、高温应激处理和缺氧应激处理后caspase-3 mRNA表达量在杂色鲍血淋巴、肝胰腺和鳃组织中均有显著性上调,暗示该基因在杂色鲍应激中发挥了重要作用。
[1] 陈政强,陈昌生,战文斌.低氧胁迫对九孔鲍免疫防御因子的影响[J].水产学报,2012,36(11):1739-1747.
CHEN Z Q,CHEN C S,ZHAN W B.Effect of hypoxia on the immune response of the abalone Haliotis diversicolor supertexta and its susceptibility to pathogen Vibrio parahaemolyticus[J].Journal of Fisheries of China,2012,36(11):1739-1747.(in Chinese)
[2] 邓先余,王智学,孙成波,等.工厂化养殖杂色鲍致病菌副溶血弧菌的分离鉴定及其生理特性[J].海洋科学,2007,31(11):33-38.
DENG X Y,WANG Z X,SUN C B,et al.Isolation and biological characteristics of the pathogen (Vibrio parahaemolyticus) in plant-cultured abalone (Haliotis diversicolor)[J].Marine Sciences,2007,31(11):33-38.(in Chinese)
[3] THOMPSON C B.Apoptosis in the pathogenesis and treatment of disease[J].Science,1995,267(5203):1456-1462.
[4] NICHOLSON D W,THORNBERRY N A.Caspases:killer proteases[J].Trends in Biochemical Sciences,1997,22(8):299-306.
[5] CRYNS V,YUAN J Y.Proteases to die for[J].Genes &Development,1998,12(11):1551-1570.
[6] FAN T J,HAN L H,CONG R S,et al.Caspase family proteases and apoptosis[J].Acta Biochimica et Biophysica Sinica,2005,37(11):719-727.
[7] THORNBERRY N A,LAZEBNIK Y.Caspases:enemies within[J].Science,1998,281(5381):1312-1316.
[8] KUMAWAT K L,KAUSHIK D K,GOSWAMI P,et al.Acute exposure to lead acetate activates microglia and induces subsequent bystander neuronal death via caspase-3 activation[J].Neurotoxicology,2014,41:143-153.
[9] 刘大锐,李报春,李怀东.细胞凋亡核心基因Caspase家族的研究进展[J].中国医药导刊,2020,22(11):800-805.
LIU D R,LI B C,LI H D.Research progress in Caspase family of apoptosis core gene[J].Chinese Journal of Medical Guide,2020,22(11):800-805.(in Chinese)
[10] GURUNG P,KANNEGANTI T D.Novel roles for caspase-8 in IL-1β and inflammasome regulation[J].The American Journal of Pathology,2015,185(1):17-25.
[11] 于丰铭,徐扬.Caspase-3的研究进展[J].中国细胞生物学学报,2020,42(11):2072-2078.
YU F M,XU Y.Research progress of Caspase-3[J].Chinese Journal of Cell Biology,2020,42(11):2072-2078.(in Chinese)
[12] 赵瑞杰,李引乾,王会,等.Caspase家族与细胞凋亡的关系[J].中国畜牧杂志,2010,46(17):73-78.
ZHAO R J,LI Y Q,WANG H,et al.Relationship of Caspase family and apoptosis[J].Chinese Journal of Animal Science,2010,46(17):73-78.(in Chinese)
[13] 王国栋,和四梅,张丽莉,等.杂色鲍DAD1的克隆及在发育、弧菌感染、高温和缺氧下的表达分析[J].水产学报,2016,40(7):1018-1027.
WANG G D,HE S M,ZHANG L L,et al.Molecular cloning and expression of defender against cell DAD1 from Haliotis diversicolor in development,vibrio infection,thermal stress and hypoxia stress[J].Journal of Fisheries of China,2016,40(7):1018-1027.(in Chinese)
[14] 张鑫,蔡秀红,黄贻涛,等.杂色鲍(Haliotis diversicolor)硒结合蛋白1基因的克隆及其应激表达[J].海洋与湖沼,2015,46(2):454-462.
ZHANG X,CAI X H,HUANG Y T,et al.Molecular cloning and expression of selenium-binding protein1 in Haliotis diversicolor under stresses[J].Oceanologia et Limnologia Sinica,2015,46(2):454-462.(in Chinese)
[15] 邬皓晨,陈勇军,徐易尘,等.Caspase-1在炎症及程序性细胞死亡过程中的作用[J].中国细胞生物学学报,2011,33(2):182-189.
WU H C,CHEN Y J,XU Y C,et al.The role of Caspase-1 played in the process of inflammation and programmed cell death[J].Chinese Journal of Cell Biology,2011,33(2):182-189.(in Chinese)
[16] LI M Y,DING Y,MU Y N,et al.Molecular cloning and characterization of caspase-3 in large yellow croaker (Pseudosciaena crocea)[J].Fish &Shellfish Immunology,2011,30(3):910-916.
[17] 何军军,梁海鹰,陈崧,等.马氏珠母贝TRADD基因克隆与组织表达分析[J].广东海洋大学学报,2019,39(4):13-19.
HE J J,LIANG H Y,CHEN S,et al.Gene cloning and tissue expression analysis of TRADD from Pinctada martensii[J].Journal of Guangdong Ocean University,2019,39(4):13-19.(in Chinese)
[18] WU M H,JIN X K,YU A Q,et al.Caspase-mediated apoptosis in crustaceans:cloning and functional characterization of EsCaspase-3-like protein from Eriocheir sinensis[J].Fish &Shellfish Immunology,2014,41(2):625-632.
[19] MARCHLER-BAUER A,BO Y,HAN L Y,et al.CDD/SPARCLE:functional classification of proteins via subfamily domain architectures[J].Nucleic Acids Research,2017,45(D1):D200-D203.
[20] 林师,张丽莉,王国栋.杂色鲍两种perlucin基因的克隆与表达分析[J].生物技术通报,2016,32(12):113-123.
LIN S,ZHANG L L,WANG G D.Molecular cloning and expression analysis of two types of perlucin gene from small abalone Haliotis diversicolor[J].Biotechnology Bulletin,2016,32(12):113-123.(in Chinese)
[21] 张丽莉,和四梅,王国栋,等.杂色鲍一种编码CRAD功能域基因的克隆及其在发育和应激中的表达[J].水产学报,2018,42(10):1520-1530.
ZHANG L L,HE S M,WANG G D,et al.Molecular cloning and expression of a coding CARD gene from Haliotis diversicolor in development and under stresses[J].Journal of Fisheries of China,2018,42(10):1520-1530.(in Chinese)
[22] ZHANG D,WANG H W,YAO C L.Molecular and acute temperature stress response characterizations of caspase-8 gene in two mussels,Mytilus coruscus and Mytilus galloprovincialis[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2014,177/178:10-20.
[23] LEE Y,DE ZOYSA M,WHANG I,et al.Molluscan death effector domain (DED)-containing caspase-8 gene from disk abalone (Haliotis discus hannai):molecular characterization and expression analysis[J].Fish &Shellfish Immunology,2011,30(2):480-487.
[24] WANG P H,WAN D H,CHEN Y G,et al.Characterization of four novel caspases from Litopenaeus vannamei(Lvcaspase2-5) and their role in WSSV infection through dsRNA-mediated gene silencing[J].PLoS One,2013,8(12):e80418.
[25] 吴芳丽,王月,尚跃勇,等.水生无脊椎动物血淋巴细胞分类及免疫研究进展[J].大连海洋大学学报,2016,31(6):696-704.
WU F L,WANG Y,SHANG Y Y,et al.Current progress of research on classification and immunity of hemocytes in aquatic invertebrates:a review[J].Journal of Dalian Ocean University,2016,31(6):696-704.(in Chinese)
[26] ALLAM B,RAFTOS D.Immune responses to infectious diseases in bivalves[J].Journal of Invertebrate Pathology,2015,131:121-136.
[27] SOKOLOVA I M.Apoptosis in molluscan immune defense[J].Invertebrate Survival Journal,2009,6(1):49-58.
[28] GE H,WANG G D,ZHANG L L,et al.Characterization of interleukin-1 receptor-associated kinase 1 binding protein 1 gene in small abalone Haliotis diversicolor[J].Gene,2012,506(2):417-422.
[29] GE H,WANG G D,ZHANG L L,et al.Molecular cloning and expression of interleukin-1 receptor-associated kinase 4,an important mediator of Toll-like receptor signal pathway,from small abalone Haliotis diversicolor[J].Fish &Shellfish Immunology,2011,30(4/5):1138-1146.
[30] WANG B Z,ZHANG Z P,WANG Y L,et al.Molecular cloning and characterization of macrophage migration inhibitory factor from small abalone Haliotis diversicolor supertexta[J].Fish &Shellfish Immunology,2009,27(1):57-64.
[31] LI N,ZHANG Z P,ZHANG L L,et al.Insulin-like growth factor binding protein 7,a member of insulin-like growth factor signal pathway,involved in immune response of small abalone Haliotis diversicolor[J].Fish &Shellfish Immunology,2012,33(2):229-242.
[32] CHANG C C,YEH M S,LIN H K,et al.The effect of Vibrio alginolyticus infection on caspase-3 expression and activity in white shrimp Litopenaeus vannamei[J].Fish &Shellfish Immunology,2008,25(5):672-678.
[33] 孙盛明,朱健,戈贤平,等.团头鲂(Megalobrama amblycephala)caspase 3基因克隆及其在高温胁迫中的表达分析[J].基因组学与应用生物学,2017,36(10):4090-4099.
SUN S M,ZHU J,GE X P,et al.Cloning of caspase 3 gene in Megalobrama amblycephala and analysis of its expression in high temperature stress[J].Genomics and Applied Biology,2017,36(10):4090-4099.(in Chinese)
[34] 章琼,孙盛明,李冰,等.团头鲂(Megahbrama amblycephala)Caspase 9基因全长cDNA的克隆及在氨氮胁迫下的表达分析[J].渔业科学进展,2016,37(1):36-45.
ZHANG Q,SUN S M,LI B,et al.Molecular cloning and expression analysis of Caspase 9 gene from blout snout bream (Megahbrama amblycephala) under ammonia-N stress[J].Progress In Fishery Sciences,2016,37(1):36-45.(in Chinese)
[35] 张在鹏.日本鳗鲡Caspase 6基因的克隆和表达分析[D].厦门:集美大学,2016.
ZHANG Z P.Molecular cloning and expression analysis of Caspase 6 in Japanese Eel (Anguilla japonica)[D].Xiamen:Jimei University,2016.(in Chinese)
[36] ROMERO A,EST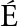 VEZ-CALVAR N,DIOS S,et al.New insights into the apoptotic process in mollusks:characterization of caspase genes in Mytilus galloprovincialis[J].PLoS One,2011,6(2):e17003.
VEZ-CALVAR N,DIOS S,et al.New insights into the apoptotic process in mollusks:characterization of caspase genes in Mytilus galloprovincialis[J].PLoS One,2011,6(2):e17003.
[37] WILSON D F.Quantifying the role of oxygen pressure in tissue function[J].American Journal of Physiology:Heart and Circulatory Physiology,2008,294(1):H11-H13.
[38] LÜBBERS D,BAUMG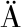 RTL H.Heterogeneities and profiles of oxygen pressure in brain and kidney as examples of the pO2 distribution in the living tissue[J].Kidney International,1997,51(2):372-380.
RTL H.Heterogeneities and profiles of oxygen pressure in brain and kidney as examples of the pO2 distribution in the living tissue[J].Kidney International,1997,51(2):372-380.