斜带石斑鱼Epinephelus coioides属于鲈形目,是中国南方重要的经济养殖鱼类之一[1]。近年来,随着其养殖规模的扩大和增养殖密度的提高,斜带石斑鱼在养殖过程中频繁发生寄生虫疾病、细菌性疾病和病毒性疾病。其中,寄生虫疾病主要为瓣体虫病和小瓜虫病,细菌性疾病主要为烂尾病和溃烂病,病毒性疾病主要为虹彩病毒病和病毒性神经坏死病[2],这些疾病严重影响了石斑鱼产业的发展。因此,开展石斑鱼抗感染免疫反应研究,有助于挖掘该过程中的关键因子或信号通路,并为开发新型疾病防控技术提供理论参考。
T细胞免疫球蛋白黏蛋白-4(T-cell immunoglobulin and mucin-domain-containing molecule 4,TIM-4)家族是一类Ⅰ型跨膜糖蛋白,最早在小鼠体内发现,有TIM-1、TIM-2、TIM-3、TIM-4 4个成员,位于11号染色体上相邻位置,而人类中只鉴定到3个TIM家族基因,分别是TIM-1、TIM-3、TIM-4,位于第5号染色体上[3]。TIM家族成员具有特征性的Ig(immunoglobulin)结构域,是胞外的主要功能结构域,其含有的4~6个保守半胱氨酸在折叠过程中可形成二硫键用以维持Ig结构的稳定,还能介导TIM蛋白与配体的识别和结合[4]。TIM蛋白最初被定义为A型肝炎病毒受体和一种肾脏损伤分子,是调节肾脏缺血的上皮细胞分子[5],随后的研究发现,TIM蛋白在细胞增殖、凋亡、自噬、迁移、组织再生和免疫调节中发挥着重要作用[6-8],在病毒感染、过敏反应、自身免疫和肿瘤免疫等病理过程中维持细胞稳态[9]。其中,TIM-4基因通过结合磷脂酰丝氨酸受体的免疫球蛋白结构控制细胞凋亡[10],并作为配体与TIM-1基因结合,通过TIM-1~TIM-4途径共刺激T细胞增殖,参与体内免疫调节[11]。然而,关于斜带石斑鱼TIM-4的免疫作用目前尚未见报道。本研究中,通过扩增获得斜带石斑鱼TIM-4基因的蛋白编码区,分析其序列特征,检测该基因在健康鱼体中的组织分布,以及经LPS和Poly I:C刺激后的表达变化,并构建TIM-4原核表达载体,转化至大肠杆菌(BL21)中进行诱导重组蛋白表达,以期为进一步研究该基因在斜带石斑鱼免疫调节中的功能提供科学参考。
1 材料与方法
1.1 材料
试验用斜带石斑鱼(40~50 g)采集于广东省湛江市某水产批发市场。
载体与菌株:克隆载体pMDTM 19T 质粒购于TaKaRa公司;pGEX-4T-1载体及大肠杆菌DH5α、BL21由广东省水产经济动物病原生物学及流行病学重点实验室保存。
主要试剂:Ex Taq DNA聚合酶、限制性核酸内切酶EcoR Ⅰ、Xho Ⅰ及T4DNA连接酶等购自TaKaRa公司(日本);质粒提取试剂盒及胶回收试剂盒购自生工生物工程(上海)股份有限公司;TransZol Up Plus RNA Kit和相关反转录试剂盒、实时荧光定量试剂盒(TransStart Green qPCR Super Mix)等购自北京全式金公司;SDS-PAGE凝胶制备试剂盒购自西安晶彩生物科技有限公司;10×PBS、1×PBS购自碧云天公司;胰蛋白胨、无水乙醇等均为分析纯;PCR引物及序列测定均由广州生工生物技术有限公司完成。
实时荧光定量PCR(qPCR)所用的斜带石斑鱼脾脏细胞(GS 细胞)由华南农业大学秦启伟教授惠赠。LPS购于碧云天公司,Poly I:C购于Apexbio公司。
1.2 方法
1.2.1 引物设计合成 在本实验室斜带石斑鱼转录组数据中[12]筛选出斜带石斑鱼TIM-4基因的蛋白编码区序列,利用Primer Premier 5.0软件设计正反向引物及荧光定量引物(表1)。
表1 本研究所用引物
Tab.1 The primers used in this study
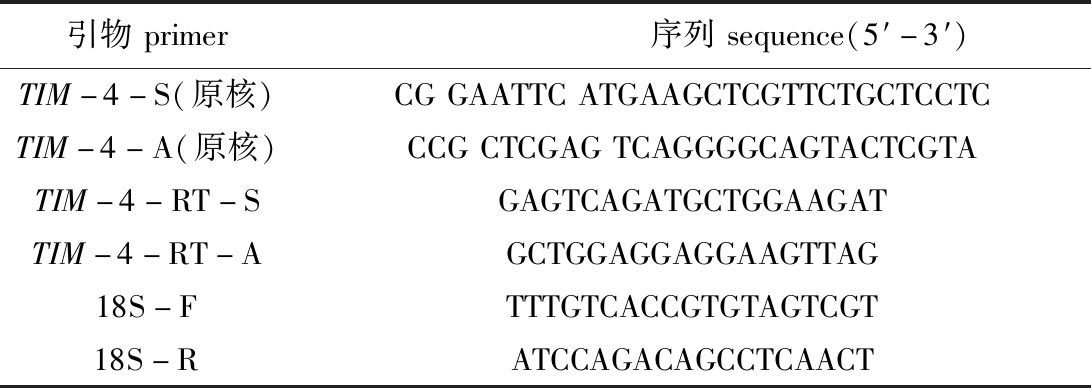
引物primer序列sequence(5′-3′)TIM-4-S(原核)CGGAATTCATGAAGCTCGTTCTGCTCCTCTIM-4-A(原核)CCGCTCGAGTCAGGGGCAGTACTCGTATIM-4-RT-SGAGTCAGATGCTGGAAGATTIM-4-RT-AGCTGGAGGAGGAAGTTAG18S-FTTTGTCACCGTGTAGTCGT18S-RATCCAGACAGCCTCAACT
1.2.2 总RNA提取及反转录 根据TransZol Up Plus RNA Kit说明书方法进行斜带石斑鱼总RNA的提取。将斜带石斑鱼的脾脏、皮肤、心脏、头肾、小肠、鳃、肾脏、大脑、肌肉、胃组织置于2 mL无RNA酶的离心管中,加入1 mL的Trizol Up及1个钢珠,使用研磨器研磨3 min;将200 μL氯仿加入组织匀浆中,充分振荡后将混合液于4 ℃下以12 000 r/min离心15 min,将分层后的上层水相转移至1.5 mL无RNA酶的离心管中,加入等体积提前预冷的异丙醇,室温下静置10 min;离心后弃上清液,加入500 μL体积分数为75%的乙醇,温和振荡后以8 000 r/min离心5 min,弃上清液,室温晾干10 min,而后加入无RNA酶的水溶解RNA样品。取1 μL的RNA使用超微量生物检测仪检测其浓度,按照全式金公司的反转录试剂盒说明书,分别向其中加入Anchored Oligo (dT)18 1 μL、Easy Script RT/RI Enzynle Mix 1 μL、gDNA Remove 1 μL、2×Es Reaction Mix 10 μL、RNase-free water 2 μL和RNA 5 μL,样品经过混合,于42 ℃ 下反应15 min,85 ℃ 下作用5 s,进行cDNA合成,产物于-20 ℃下保存待用。
1.2.3 TIM-4基因的蛋白编码区扩增 按照Ex Taq 酶说明书推荐体系,扩增TIM-4基因的蛋白编码区。PCR 反应体系(20 μL):上、下游引物(TIM-4-S和TIM-4-A,10 μmol/L)各1 μL,cDNA模板1 μL,Ex Taq 10 μL,ddH2O 7 μL。PCR 反应程序:94 ℃下预变性5 min;94 ℃下循环变性30 s,55 ℃下退火复性30 s,72 ℃下延伸90 s,共进行35个循环;最后在72 ℃下再延伸10 min,于4 ℃下保存备用。
1.2.4 TIM-4基因的生物信息学分析 在生物信息分析网站(NCBI)进行基因序列比对及同源性分析,使用DNAMAN 5.0软件进行多序列比对,比对后的序列利用MEGA 7.0软件构建系统进化树。
1.2.5 TIM-4基因的组织表达 以β-actin作为内参基因,每个样本设置3个平行复孔,采用qPCR法检测TIM-4基因在斜带石斑鱼脾脏、心脏、头肾、鳃、脑、肾脏、胃、肠、肌肉和皮肤10个组织中的表达情况,采用2-△△Ct法计算基因表达量[13],以脾脏表达量为参照,计算各组织的相对表达量。
1.2.6 LPS和Poly I:C刺激后GS细胞中TIM-4基因的表达变化 将GS细胞接种至24孔细胞培养板中,细胞量约为1×105 cells/孔,分别加入终质量浓度为1 mg/mL的LPS和5 mg/mL的Poly I:C进行刺激[14],在感染0、4、8、12、24、48 h时收集GS细胞,反转录为cDNA后用于qPCR。qPCR反应体系(10 μL):模板0.5 μL,上、下游引物(TIM-4-RT-S与TIM-4-RT-A)各1 μL,2×SYBR Green Mix(Roche) 5 μL,ddH2O 2.5 μL。每个样品设置4个复孔,反应条件:95 ℃下预变性10 s;95 ℃下循环变性5 s,58 ℃下退火复性15 s,72 ℃下延伸20 s,共进行34个循环。
1.2.7 TIM-4基因原核表达载体构建 根据已经得到的TIM-4基因的蛋白编码区设计含酶切位点的引物TIM-4-S(EcoR Ⅰ)和TIM-4-A(Xho Ⅰ),用Ex Taq酶扩增含酶切位点的基因片段连接到pMDTM 19T载体,对测序正确的阳性克隆TIM-4-19T和pGEX-4T-1载体采用EcoR Ⅰ和Xho Ⅰ进行双酶切。酶切反应体系(50 μL):DNA 5 μL,10×QuickCut Buffer 5 μL,QuickCutTM EcoR Ⅰ 2 μL,QuickCutTM Xho Ⅰ 2 μL,ddH2O 36 μL。反应程序为37 ℃下反应15 min,于4 ℃下保存。
经15 g/L琼脂糖凝胶电泳后,回收相应的目的条带,将切胶回收的DNA片段分别与双酶切的表达质粒用T4 DNA酶进行连接。连接体系为TIM-4-19T质粒DNA 6 μL、pGEX-4T-1质粒DNA 2 μL、T4 DNA连接酶1 μL、T4 Ligaze Buffer 1 μL,连接过夜,然后转化至大肠杆菌DH5α中,利用氨苄西林筛选TIM-4-4T重组质粒阳性克隆,阳性克隆经PCR鉴定后送至广州生工生物技术有限公司进行测序,将测序结果正确的重组质粒命名为TIM-4-4T。
1.2.8 TIM-4重组蛋白诱导表达条件的优化 将构建好的TIM-4-4T重组质粒导入到大肠杆菌BL21感受态细胞中,参考梁振宇等[15]的方法,对TIM-4重组蛋白的表达条件进行优化,当OD600 nm为0.4~0.6时开始诱导,温度分别设置为37、28、16 ℃,IPTG浓度分别设置为1.0、0.8、0.6、0.4、0.2 mmol/L,摇床6 h后收集样品,然后在4 ℃下以6 000 r/min离心30 min,再用5 mL的PBS吹匀冲洗,如此重复两次。再向其中加入50 μL PBS吹匀,再加入10 μL Protein Loading Buffer吹匀,热水煮沸5 min后以14 000 r/min 离心4 min,将样品置于-20 ℃下保存。经过SDS-PAGE凝胶电泳后用考马斯亮蓝染色,用Gel-Pro Analyzer分析结果。
取重组质粒菌液200 μL,加入30 mL含氨苄西林(Ampillin)抗性的LB培养液,在37 ℃、0.4 mmol/L IPTG条件下诱导6 h后,分别移入2个15 mL的离心管中,以15 000 r/min离心2 min,去掉上清液,分别用7 mL PBS吹匀润洗两遍,之后再将其吹匀,置于冰水混合物中超声破碎重组细菌。超声程序设置为功率300 W、开5 s、关8 s,超声破碎15 min至菌液清澈透亮即可。取破碎后的液体移至低温离心机,离心30 min,取离心后的上清液50 μL加10 μL Protein Loading Buffer吹匀,于-20 ℃下保存,将沉淀用10 mL尿素吹匀浸泡过夜。经过SDS-PAGE后用考马斯亮蓝染色,采用Gel-Pro Analyzer分析结果。
1.3 数据处理
基因表达量试验数据以平均值±标准差表示,采用SPSS 21软件进行单因素方差分析,用Duncan法进行不同组织间基因表达量显著性差异比较,用T检验进行不同时间点基因表达量显著性差异比较,显著性水平设为0.05。
2 结果与分析
2.1 斜带石斑鱼TIM-4基因的蛋白编码区扩增及序列特征分析
利用PCR扩增斜带石斑鱼TIM-4基因的蛋白编码区,扩增产物经凝胶电泳检测,得到702 bp的目的条带(图1),即基因的蛋白编码区片段长度为702 bp,可编码234个氨基酸,预测蛋白的相对分子质量为25 100,理论等电点为5.41。利用SMART软件预测该蛋白序列包含3个功能结构域,即V-Type(IGV)、BTK和PRY结构域(图2)。
2.2 TIM-4氨基酸序列比对及系统进化分析
采用DNAMAN软件,将斜带石斑鱼TIM-4氨基酸与龙胆石斑鱼E.lanceolatus、大黄鱼Larimichthys crocea、河鲈Perca fluviatilis、泰国斗鱼Betta splendens、贝氏南极鱼Trematomus bernacchii、人Homo sapiens和小鼠Mus musculus TIM-4氨基酸序列进行比对,结果显示,不同物种TIM-4氨基酸序列均含有Ig保守结构域(图2)。通过对比发现,斜带石斑鱼TIM-4氨基酸序列与鱼类TIM-4氨基酸序列相似度较高,其中与龙胆石斑鱼TIM-4氨基酸序列的一致性最高(85.66%),而与人TIM-4氨基酸序列的一致性最低(17.10%)。

加粗部分为起始密码子(ATG)和终止密码子(TGA),灰色阴影部分为Ig结构域。
The bold part is the start codon (ATG) and the stop codon (TGA),and the underlined part is the Ig domain.
图1 斜带石斑鱼TIM-4基因的蛋白编码区序列
Fig.1 Sequence of protein coding region of TIM-4 gene in oblique grouper Epinephelus coioides

Ig保守结构域用方框标记;IGV、BTK、PRY功能结构域用实线标记。
Conserved domain of Ig-type lectin is shown in the box;IGV,BTK and PRY functional domains are marked with solid lines.
图2 斜带石斑鱼与其他物种TIM-4氨基酸的多序列比对
Fig.2 Multiple alignment of amino acid sequence of TIM-4 between oblique grouper Epinephelus coioides with other species
采用MEGA 7.0软件构建斜带石斑鱼与其他物种的TIM-4氨基酸序列的系统进化树,结果显示,斜带石斑鱼TIM-4与龙胆石斑鱼、大黄鱼和泰国斗鱼TIM-4聚为一支,且与龙胆石斑鱼TIM-4的亲缘关系最近(图3),这与氨基酸序列比对结果一致。
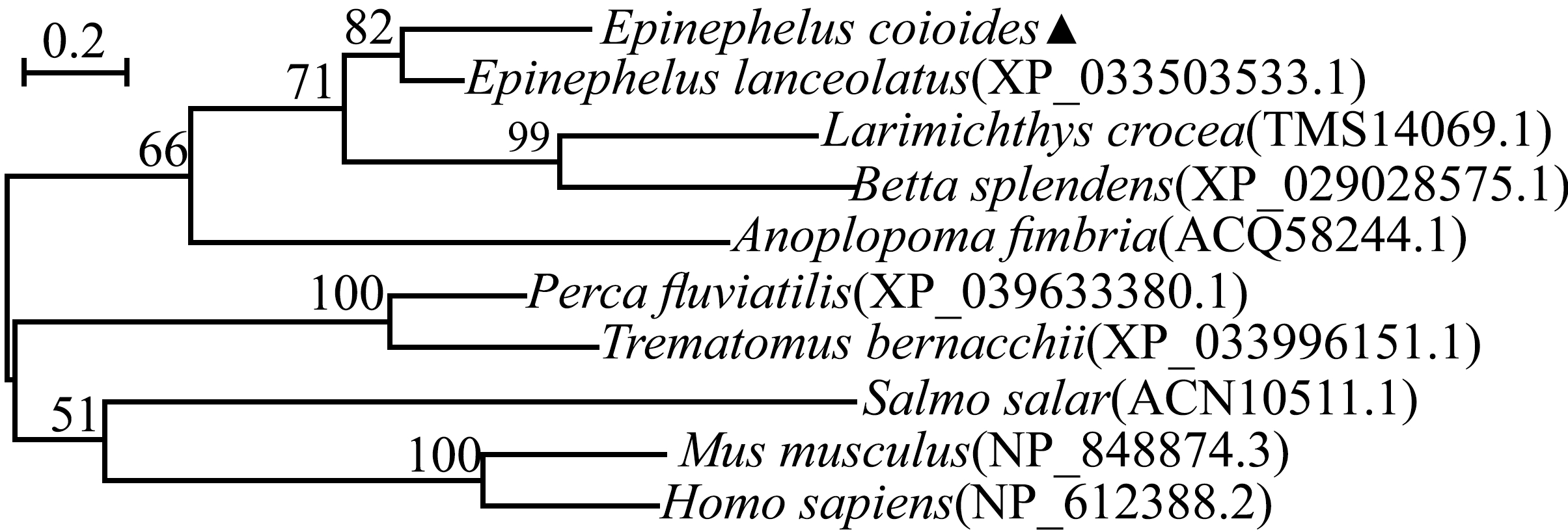
图3 TIM-4氨基酸序列的进化分析
Fig.3 Phylogenetic analysis of TIM-4 amino acid sequence
2.3 斜带石斑鱼TIM-4基因的组织表达
从图4可见,TIM-4基因在斜带石斑鱼的脾脏、皮肤、心脏、头肾、肠、鳃、肾脏、脑、肌肉、胃组织中均有表达,在胃中表达量最高(P<0.05),其次是肌肉、脑和肾脏,在脾脏中表达量最低。
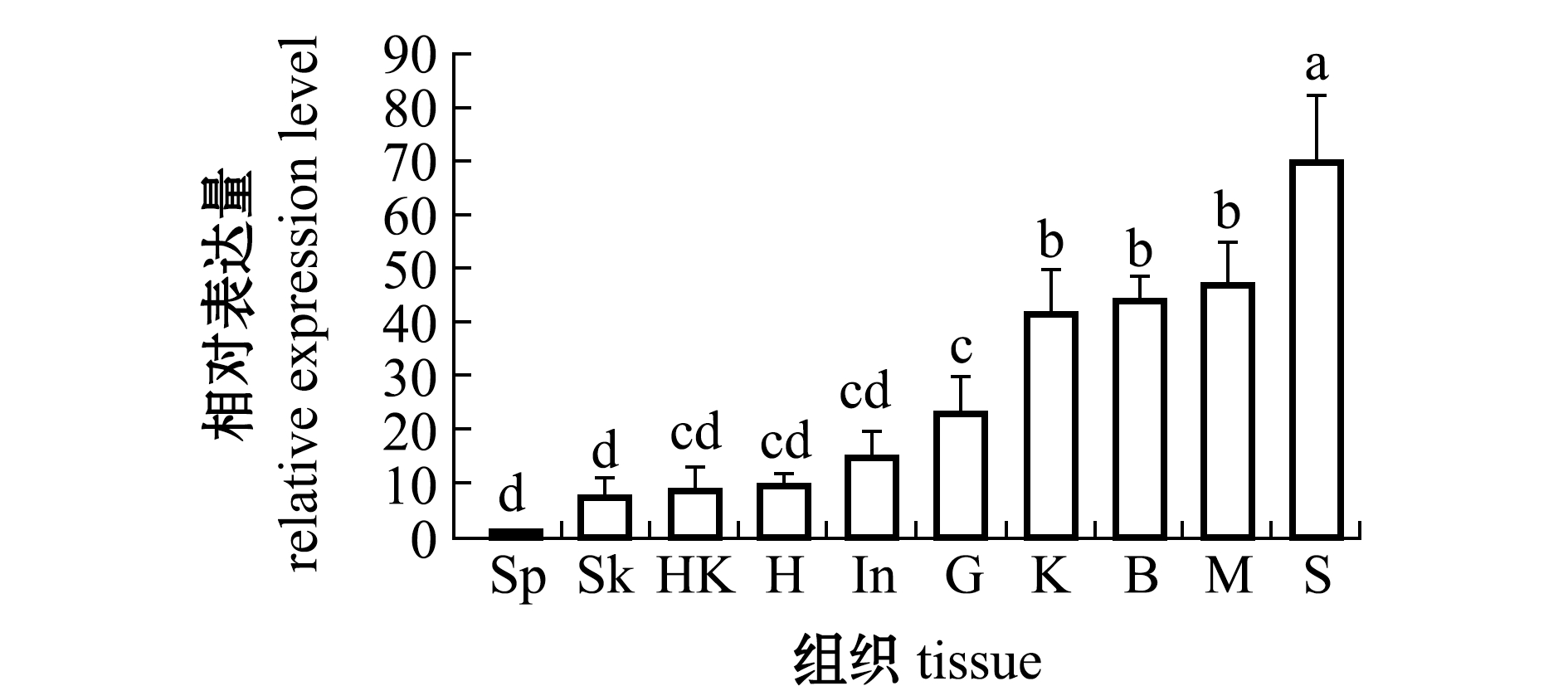
Sp—脾脏;Sk—皮肤;H—心脏;HK—头肾;In—肠;G—鳃;K—肾脏;B—脑;M—肌肉;S—胃。标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Sp—spleen;Sk—skin;H—heart;HK—head kidney;In—intestinal;G—gill;K—kidney;B—brain;M—muscle;S—stomach.The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences.
图4 TIM-4基因在不同组织中的表达量
Fig.4 Expression level of TIM-4 gene in different tissues
2.4 LPS、Poly I:C刺激后脾脏细胞中TIM-4基因的表达变化
从图5可见:经LPS刺激后,TIM-4基因在GS细胞中的表达量显著下降(P<0.05),在4 h时下降到最低值;而经Poly I:C刺激后,TIM-4基因在GS细胞中的表达量显著上升(P<0.05),在4 h时达到最高。
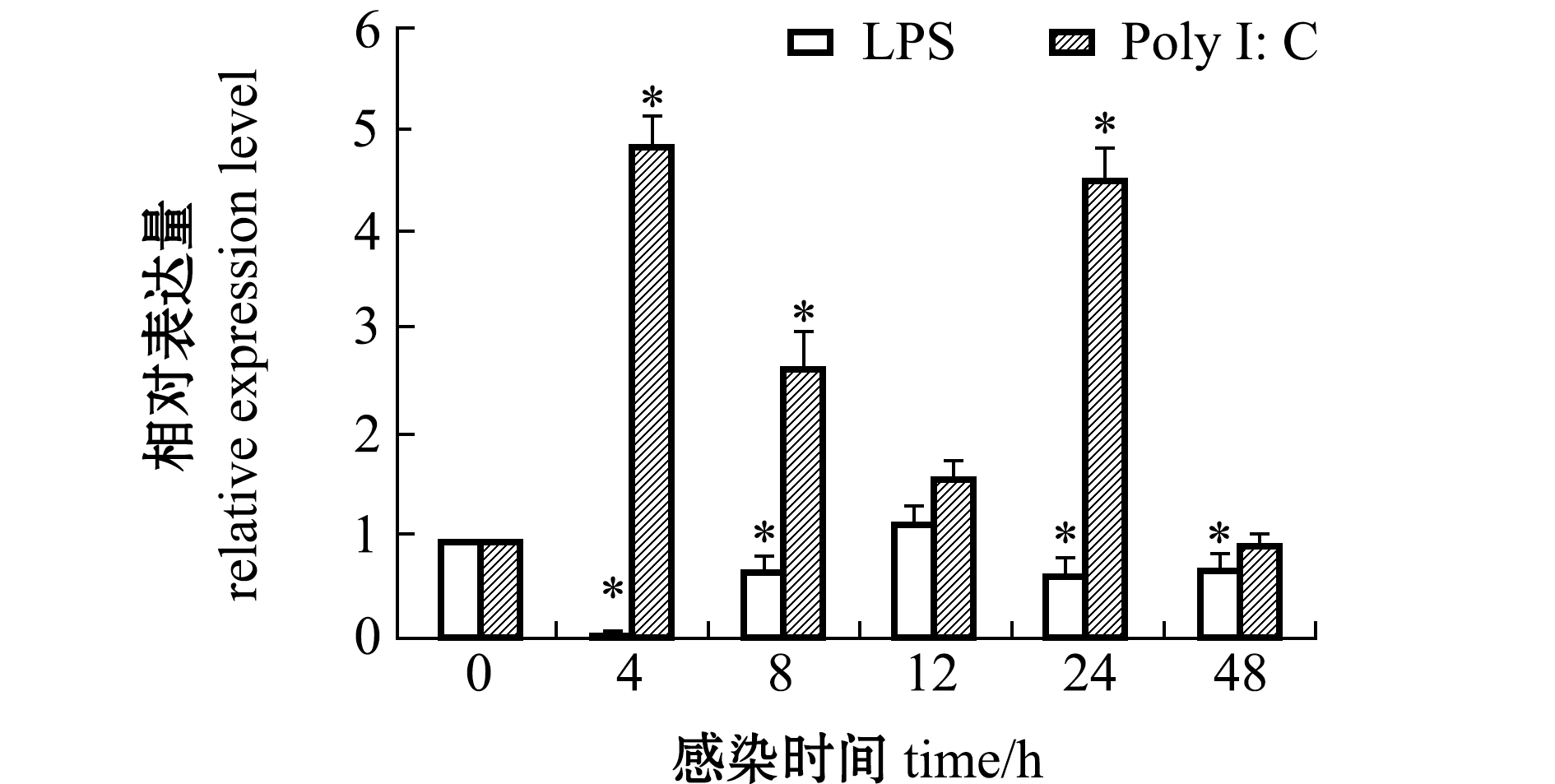
*表示与0 h的表达量相比有显著性差异(P<0.05)。
*,significant differences compared to 0 h (P<0.05).
图5 LPS和Poly I:C刺激后脾脏细胞中TIM-4基因的表达变化
Fig.5 Differential expression of TIM-4 gene in GS by LPS and Poly I:C stimulations
2.5 重组蛋白表达分析
取TIM-4-4T阳性克隆分别于37、28、16 ℃下,以1.0、0.8、0.6、0.4、0.2 mmol/L IPTG的浓度分别进行诱导,SDS-PAGE凝胶电泳结果显示,在37 ℃、0.4 mmol/L IPTG条件下诱导6 h时的重组蛋白表达量最高(图6)。
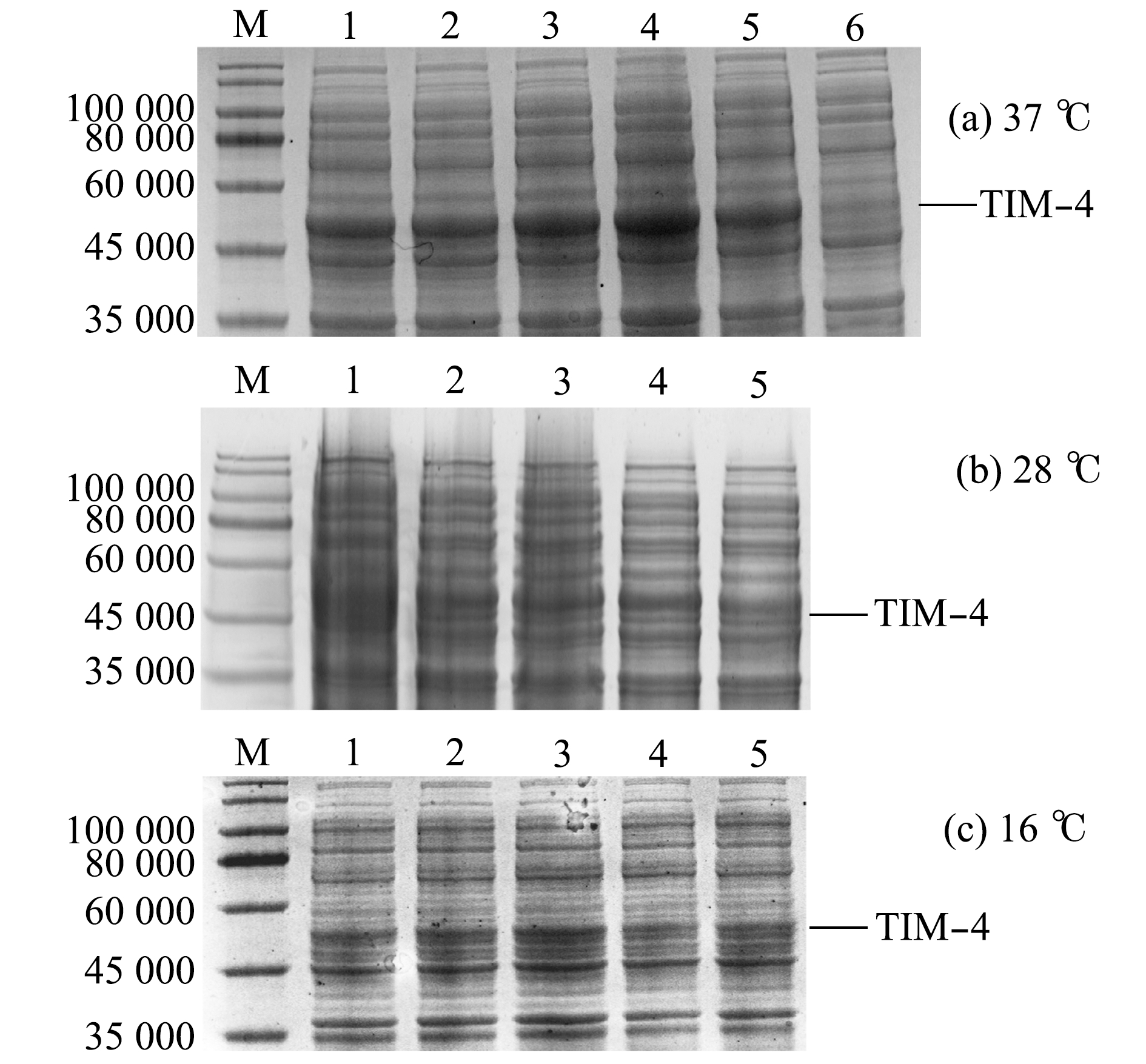
M—蛋白marker;1~5—1.0、0.8、0.6、0.4、0.2 mmol/L IPTG诱导;6—未诱导。
M—protein marker;1-5—recombinant bacteria induced by IPTG at a dose of 1.0,0.8,0.6,0.4 and 0.2 mmol/L;6—non-reduced by IPTG.
图6 TIM-4重组蛋白表达与条件优化
Fig.6 Optimal conditions for the expression of TIM-4 recombinant protein
对不同温度和IPTG浓度诱导下重组蛋白的可溶性分析表明,在温度37 ℃、IPTG 0.4 mmol/L的条件下诱导的重组蛋白表达量最大,经超声破碎后,在沉淀中出现明显的蛋白条带(图7),这表明TIM-4蛋白主要以包涵体形式表达。
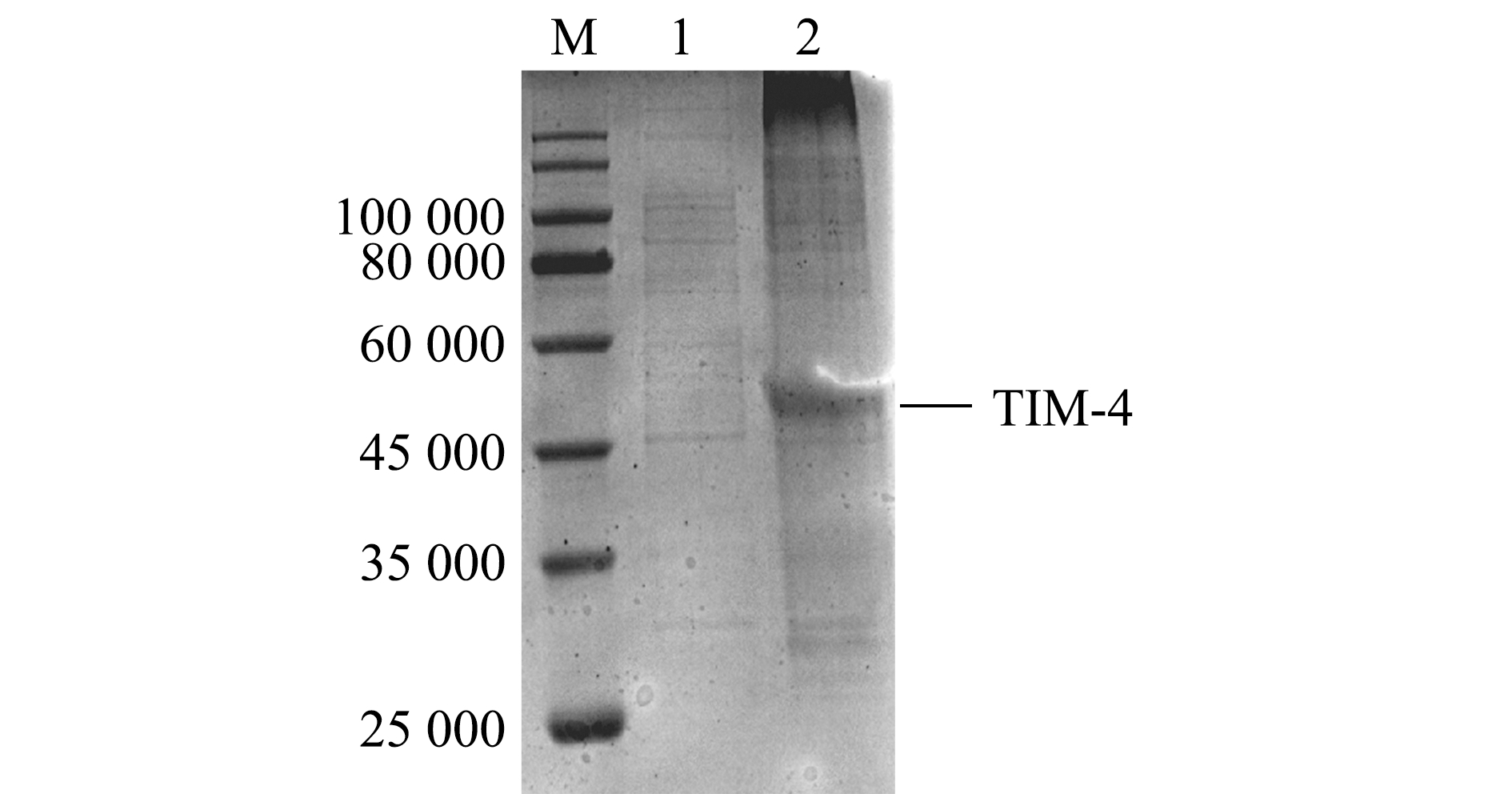
M—蛋白marker;1—TIM-4-4T超声裂解上清液;2—TIM-4-4T超声裂解沉淀。
M—protein marker;1—sonicated supernatant of TIM-4-4T;2—sonicated sediment of TIM-4-4T.
图7 TIM-4-4T重组菌裂解上清液和沉淀中的重组蛋白
Fig.7 TIM-4 recombinant protein of supernatant and precipitation of the lysis from TIM-4-4T recombinant strain
3 讨论
3.1 TIM-4蛋白序列特征分析
TIM-4是TIM家族中的重要成员之一[4]。研究表明,TIM与哺乳动物的过敏性疾病和自身免疫性疾病相关[16-18],但目前尚未见鱼类TIM-4的报道。本研究中,扩增了斜带石斑鱼TIM-4基因的蛋白编码区,长度为702 bp,可编码234个氨基酸,与其他已报道的TIM-4蛋白相同,TIM-4氨基酸序列含有IGV、BTK和PRY 3个功能结构域。已有研究表明,TIM-4的IGV结构域参与调节NLRP3炎症小体的激活及影响病毒的侵染[19-20];BTK结构域能通过与G蛋白亚基的相互作用介导细胞信号转导[21];PRY结构域在与胞内模式识别受体(RIG-I和NOD2)的互相作用中发挥着关键作用,从而调节宿主的先天免疫[22]。由此推测,斜带石斑鱼TIM-4在病原感染及免疫应答过程中可能具有类似作用。
3.2 TIM-4基因的组织表达模式
本研究中,采用qPCR法分析了TIM-4基因在斜带石斑鱼各组织中的表达情况,结果显示,TIM-4基因在所有检测的组织中均有分布,在胃组织中表达量最高,其次是肌肉、脑、肾脏、鳃、肠等组织。已有研究表明,TIM-4基因是特定组织定位的巨噬细胞的标记[23],肠胃中巨噬细胞可与微生物群落共同调节平滑肌的运动,影响消化,因此,本研究中斜带石斑鱼TIM-4基因在胃中高表达,暗示其可能具有调节消化的功能。而肌肉中的巨噬细胞则与再生相关[24],脑部的巨噬细胞则与抵御病原侵染相关[25],因此,本研究中斜带石斑鱼TIM-4基因可能在生长调控、抗病原感染及免疫应答过程中也发挥作用。
3.3 LPS与Poly I:C刺激后TIM-4表达变化
TIM-4基因表达水平可由不同的刺激因子调节,如LPS、霍乱毒素和细胞因子等[8,26-29]。LPS是革兰氏阴性细菌细胞壁的主要成分,能刺激细胞释放炎症因子,诱导细胞凋亡[30-31],细胞凋亡时细胞膜内侧的磷脂酰丝氨酸(ptdSer)外翻,TIM-4对ptdSer具有较高的亲和力,能特异性识别凋亡细胞并介导吞噬凋亡细胞[7],从而抑制炎症与维持组织稳态。本研究中,在LPS刺激后斜带石斑鱼TIM-4基因在脾脏细胞中的表达量显著下降,表明TIM-4可能参与了炎症因子通路的调控。而Poly I:C作为一种干扰素诱导剂,属病毒核酸的类似物,能被MDA5和TLR3识别,从而激活Ⅰ型干扰素的表达[32-33],因此,本研究中斜带石斑鱼TIM-4基因在Poly I:C刺激下表达量显著上升,暗示TIM-4可能在干扰素表达的正向调控中发挥作用。
3.4 斜带石斑鱼TIM-4重组蛋白的制备
本试验中成功地表达出相对分子质量约为25 100的斜带石斑鱼TIM-4重组蛋白。选择pGEX-4T作为原核表达载体,是因为pGEX-4T载体能在IPTG诱导下高效表达外源蛋白,且构建的重组蛋白还能通过谷胱甘肽巯基转移酶(GST)亲和层析柱简便、快速地纯化,得到高纯度的蛋白[34]。本研究表明,斜带石斑鱼TIM-4重组蛋白以包涵体的形式表达,在IPTG终浓度0.4 mmol/L、温度37 ℃的条件下,诱导6 h时的重组蛋白表达量最大。
4 结论
1)本研究中,扩增了斜带石斑鱼TIM-4基因的蛋白编码区序列,预测的氨基酸序列含有IGV、BTK和PRY 3个保守结构域,表明TIM-4基因在抗病原感染及免疫应答过程中发挥作用。
2)TIM-4在斜带石斑鱼胃中的表达量最高,且经LPS刺激后,TIM-4在脾脏细胞中的表达量显著下降,经Poly I:C刺激后TIM-4在脾脏细胞中的表达量显著上升,表明TIM-4基因在斜带石斑鱼生长调控、抗病原感染及免疫应答过程中发挥了作用。
3)斜带石斑鱼TIM-4重组蛋白相对分子质量约为25 100,主要以包涵体形式表达。
[1] 丁少雄,刘巧红,吴昊昊,等.石斑鱼生物学及人工繁育研究进展[J].中国水产科学,2018,25(4):737-752.
DING S X,LIU Q H,WU H H,et al.Advances in biology and artificial breeding of grouper[J].Journal of Fishery Sciences of China,2018,25(4):737-752.(in Chinese)
[2] PIERRE S,GAILLARD S,PR VOT-D’ALVISE N,et al.Grouper aquaculture:Asian success and Mediterranean trials[J].Aquatic Conservation:Marine and Freshwater Ecosystems,2008,18(3):297-308.
VOT-D’ALVISE N,et al.Grouper aquaculture:Asian success and Mediterranean trials[J].Aquatic Conservation:Marine and Freshwater Ecosystems,2008,18(3):297-308.
[3] RODRIGUEZ-MANZANET R,DEKRUYFF R,KUCHROO V K,et al.The costimulatory role of TIM molecules[J].Immunological Reviews,2009,229(1):259-270.
[4] KUCHROO V K,UMETSU D T,DEKRUYFF R H,et al.The TIM gene family:emerging roles in immunity and disease[J].Nature Reviews Immunology,2003,3(6):454-462.
[5] ICHIMURA T,BONVENTRE J V,BAILLY V,et al.Kidney injury molecule-1 (KIM-1),a putative epithelial cell adhesion molecule containing a novel immunoglobulin domain,is up-regulated in renal cells after injury[J].Journal of Biological Chemistry,1998,273(7):4135-4142.
[6] MEYERS J H,CHAKRAVARTI S,SCHLESINGER D,et al.TIM-4 is the ligand for TIM-1,and the TIM-1-TIM-4 interaction regulates T cell proliferation[J].Nature Immunology,2005,6(5):455-464.
[7] KOBAYASHI N,KARISOLA P,PE A-CRUZ V,et al.TIM-1 and TIM-4 glycoproteins bind phosphatidylserine and mediate uptake of apoptotic cells[J].Immunity,2007,27(6):927-940.
A-CRUZ V,et al.TIM-1 and TIM-4 glycoproteins bind phosphatidylserine and mediate uptake of apoptotic cells[J].Immunity,2007,27(6):927-940.
[8] BAGHDADI M,YONEDA A,YAMASHINA T,et al.TIM-4 glycoprotein-mediated degradation of dying tumor cells by autophagy leads to reduced antigen presentation and increased immune tolerance[J].Immunity,2013,39(6):1070-1081.
[9] LIU W,XU L Y,LIANG X H,et al.Tim-4 in health and disease:friend or foe?[J].Frontiers in Immunology,2020,11:537.
[10] MIYANISHI M,TADA K,KOIKE M,et al.Identification of Tim4 as a phosphatidylserine receptor[J].Nature,2007,450(7168):435-439.
[11] NURTANIO N,YANG P C.Role of TIM-4 in innate or adaptive immune response[J].North American Journal of Medical Sciences,2011,3(5):217-221.
[12] 张海艳,鲁义善,汪志文,等.β-葡聚糖刺激下的斜带石斑鱼(Epinephelus coioides)转录组分析[J].基因组学与应用生物学,2018,37(1):219-228.
ZHANG H Y,LU Y S,WANG Z W,et al.Transcriptome analysis of Epinephelus coioides stimulated by β-glucan[J].Genomics and Applied Biology,2018,37 (1):219-228.(in Chinese)
[13] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,2001,25(4):402-408.
[14] 牛金中,黄瑜,汤菊芬,等.尼罗罗非鱼补体3基因片段的原核表达及条件优化[J].广东海洋大学学报,2018,38(2):80-84.
NIU J Z,HUANG Y,TANG J F,et al.Prokaryotic expression and optimization of conditions of Nile tilapia complement 3 gene fragment [J].Journal of Guangdong Ocean University,2018,38 (2):80-84.(in Chinese)
[15] 梁振宇,邹子鸿,汤菊芬,等.斜带石斑鱼热休克蛋白(HSP70)基因在LPS和Poly I:C刺激下的表达分析及重组蛋白制备[J].大连海洋大学学报,2021,36(6):937-942.
LIANG Z Y,ZOU Z H,TANG J F,et al.Expression analysis of heat shock protein (HSP70) gene in Epinephelus coioides under LPS and Poly I:C stimulation and preparation of recombinant protein [J].Journal of Dalian Ocean University,2021,36(6):937-942.(in Chinese)
[16] MARSH D G,NEELY J D,BREAZEALE D R,et al.Linkage analysis of IL4 and other chromosome 5q31.1 markers and total serum immunoglobulin E concentrations[J].Science,1994,264(5162):1152-1156.
[17] SU E W,LIN J Y,KANE L P.TIM-1 and TIM-3 proteins in immune regulation[J].Cytokine,2008,44(1):9-13.
[18] MEYERS J H,SABATOS C A,CHAKRAVARTI S,et al.The TIM gene family regulates autoimmune and allergic diseases[J].Trends in Molecular Medicine,2005,11(8):362-369.
[19] LIU W,BAI F X,WANG H X,et al.Tim-4 inhibits NLRP3 inflammasome via the LKB1/AMPKα pathway in macrophages[J].The Journal of Immunology,2019,203(4):990-1000.
[20] RHEIN B A,BROUILLETTE R B,SCHAACK G A,et al.Characterization of human and murine T-cell immunoglobulin mucin domain 4 (TIM-4) IgV domain residues critical for Ebola virus entry[J].Journal of Virology,2016,90(13):6097-6111.
[21] JIANG Y,MA W,WAN Y,et al.The G protein Gα12 stimulates Bruton’s tyrosine kinase and a rasGAP through a conserved PH/BM domain[J].Nature,1998,395(6704):808-813.
[22] D’CRUZ A A,BABON J J,NORTON R S,et al.Structure and function of the SPRY/B30.2 domain proteins involved in innate immunity[J].Protein Science,2013,22(1):1-10.
[23] SHAW T N,HOUSTON S A,WEMYSS K,et al.Tissue-resident macrophages in the intestine are long lived and defined by Tim-4 and CD4 expression[J].The Journal of Experimental Medicine,2018,215(6):1507-1518.
[24] 曾志刚.IGF-1和MGF干预对巨噬细胞剔除所致骨骼肌再生受损的影响及其作用机制研究[D].上海:上海体育学院,2019.
ZENG Z G.Effect of IGF-1 and MGF intervention on skeletal muscle regeneration damage caused by macrophage depletion and its mechanism [D].Shanghai:Shanghai Institute of Physical Education,2019.(in Chinese)
[25] 初凤娜.巨噬细胞亚型在实验性自身免疫性脑脊髓炎发病中的作用及其机制研究[D].长春:吉林大学,2018.
CHU F N.Role and mechanism of macrophage subtypes in experimental autoimmune encephalomyelitis [D].Changchun:Jilin University,2018.(in Chinese)
[26] ABE Y,KAMACHI F,KAWAMOTO T,et al.TIM-4 has dual function in the induction and effector phases of murine arthritis[J].The Journal of Immunology,2013,191(9):4562-4572.
[27] FENG B S,CHEN X,HE S H,et al.Disruption of T-cell immunoglobulin and mucin domain molecule (TIM)-1/TIM4 interaction as a therapeutic strategy in a dendritic cell-induced peanut allergy model[J].Journal of Allergy and Clinical Immunology,2008,122(1):55-61.
[28] KIM H S,KIM H S,LEE C W,et al.T cell Ig domain and mucin domain 1 engagement on invariant NKT cells in the presence of TCR stimulation enhances IL-4 production but inhibits IFN-γ production[J].The Journal of Immunology,2010,184(8):4095-4106.
[29] XU L Y,QI J N,ZHAO P Q,et al.T cell immunoglobulin- and mucin-domain-containing molecule-4 attenuates concanavalin a-induced hepatitis by regulating macrophage[J].Journal of Leukocyte Biology,2010,88(2):329-336.
[30] WANG Y Y,SUN S P,ZHU H S,et al.GABA regulates the proliferation and apoptosis of MAC-T cells through the LPS-induced TLR4 signaling pathway[J].Research in Veterinary Science,2018,118:395-402.
[31] LU Z Y,LI Y C,RU J H,et al.Interaction of palmitate and LPS regulates cytokine expression and apoptosis through sphingolipids in human retinal microvascular endothelial cells[J].Experimental Eye Research,2019,178:61-71.
[32] KATO H,TAKEUCHI O,SATO S,et al.Differential roles of MDA5 and RIG-I helicases in the recognition of RNA viruses[J].Nature,2006,441(7089):101-105.
[33] WESCH D,BEETZ S,OBERG H H,et al.Direct costimulatory effect of TLR3 ligand poly(I:C) on human γδ T lymphocytes[J].The Journal of Immunology,2006,176(3):1348-1354.
[34] KIMS Y,HAKOSHIMA T.GST pull-down assay to measure complex formations[M]//HERGOVICH A.The hippo pathway.New York:Humana Press,2019:273-280.doi:10.1007/978-1-4939-8910-2_20.