贝类是软体动物门Mollusca动物的统称,其种类和数量仅次于节肢动物,是动物界的第二大类群,已定名的现生种类超过10万种,还有数万化石种类。经过漫长的进化,贝类具备了高效复杂的适应机制,演化出各式各样的生活习性,适应高度差异化的生境,形成了广泛的生物空间分布特征[1]。
生物体在“适者生存”的自然法则下长期进化形成了对外界环境变化的适应能力,而神经内分泌系统(neuroendocrine system,NES)在生物体响应环境胁迫、维持内稳态和保障生存中发挥了关键作用。脊椎动物的神经内分泌系统主要由下丘脑-垂体-靶器官轴组成,参与调节生长、生殖、应激、免疫和基础代谢等生命活动过程。神经内分泌系统和免疫系统构成的互惠性调节关系已成为近年来神经学、内分泌学、生理学、免疫学乃至医学等研究领域的热点,它们间的相互作用构成的统一整体称为神经内分泌免疫系统(neuroendocrine-immune regulatory system,NEI)。神经内分泌系统通过其广泛的外周神经突触及其分泌的神经递质和神经激素,以及神经和内分泌细胞分泌的细胞因子,共同调控免疫系统。免疫系统通过释放细胞因子和激素样物质反馈作用于神经内分泌系统,两者之间相互作用、相互依赖,共同维持机体的内稳态[2]。
近年来,低等无脊椎动物中神经内分泌系统的结构和功能及其免疫调节机制引起了广泛关注。贝类是真体腔原口动物,它们适应性强、分布广且进化地位特殊。研究发现,贝类尚未分化出完整的神经和内分泌器官,但具备类似于高等动物神经内分泌免疫系统的分子组成,是研究无脊椎动物神经内分泌系统起源与进化的关键类群。贝类神经内分泌系统参与调节免疫应答、应激反应和能量代谢等过程,在维持机体内稳态中发挥重要作用[3]。本文总结了近年来在贝类神经内分泌领域的研究进展,重点阐述了贝类神经内分泌系统的分子组成、激活机制及其对免疫应答的调节机制,对进一步了解海洋无脊椎动物的适应机制、推动水产养殖产业绿色高质量发展具有重要的指导意义。
1 贝类神经内分泌系统的分子组成
软体动物进化形成了索式神经系统。原始的贝类未出现分化显著的神经节,其神经系统主要由环状神经中枢和神经中枢派生的两对神经索构成。较为高等的贝类神经系统主要由头、足、脏和侧神经节及神经索组成。有些种类的主要神经节集中在一起形成脑,外有软骨包围[4]。例如,双壳贝类长牡蛎Crassostrea gigas的神经系统主要由1对头神经节、1个脏神经节和与神经节相连的神经索及神经纤维组成。头神经节位于唇瓣基部,左右各1个,脏神经节位于闭壳肌前端平滑肌与横纹肌之间的凹陷内,在神经节内部,神经元聚集成团,神经纤维汇集成束[5]。目前普遍认为,从软体动物开始出现真正的内分泌细胞类群和内分泌腺体。性腺、肝胰腺和视腺等是贝类重要的内分泌腺体。
贝类的神经内分泌系统能合成和释放单胺类、胆碱类、肽类、氨基酸类等多种神经递质及激素。在长牡蛎、香港牡蛎Crassostrea hongkongensis、栉孔扇贝Chlamys farreri、缢蛏Sinonovacula constricta等贝类中已鉴定出儿茶酚胺(catecholamines,CAs)、乙酰胆碱(acetylcholine,ACh)、谷氨酸(glutamate,Glu)、γ-氨基丁酸(γ-aminobutyric acid,GABA)、脑啡肽(enkephalin,ENK)、酰胺肽FMRFamide等神经递质及其代谢关键酶和相关受体[6-9],以及甲状腺激素(thyroid hormone,TH)[10]、胰岛素(insulin)[11]、皮质醇(cortisol)和促性腺激素释放激素(reproductive regulation-related hormone,GnRH)[12]等激素。这些神经递质和激素被证实在贝类响应外界刺激、调节免疫防御能力及适应环境变化等方面发挥关键作用。
贝类中存在结构和功能相对完善的儿茶酚胺、乙酰胆碱、脑啡肽、一氧化氮、谷氨酸和皮质醇等系统,并进化形成原始而简单的神经内分泌免疫调节轴(图1)。
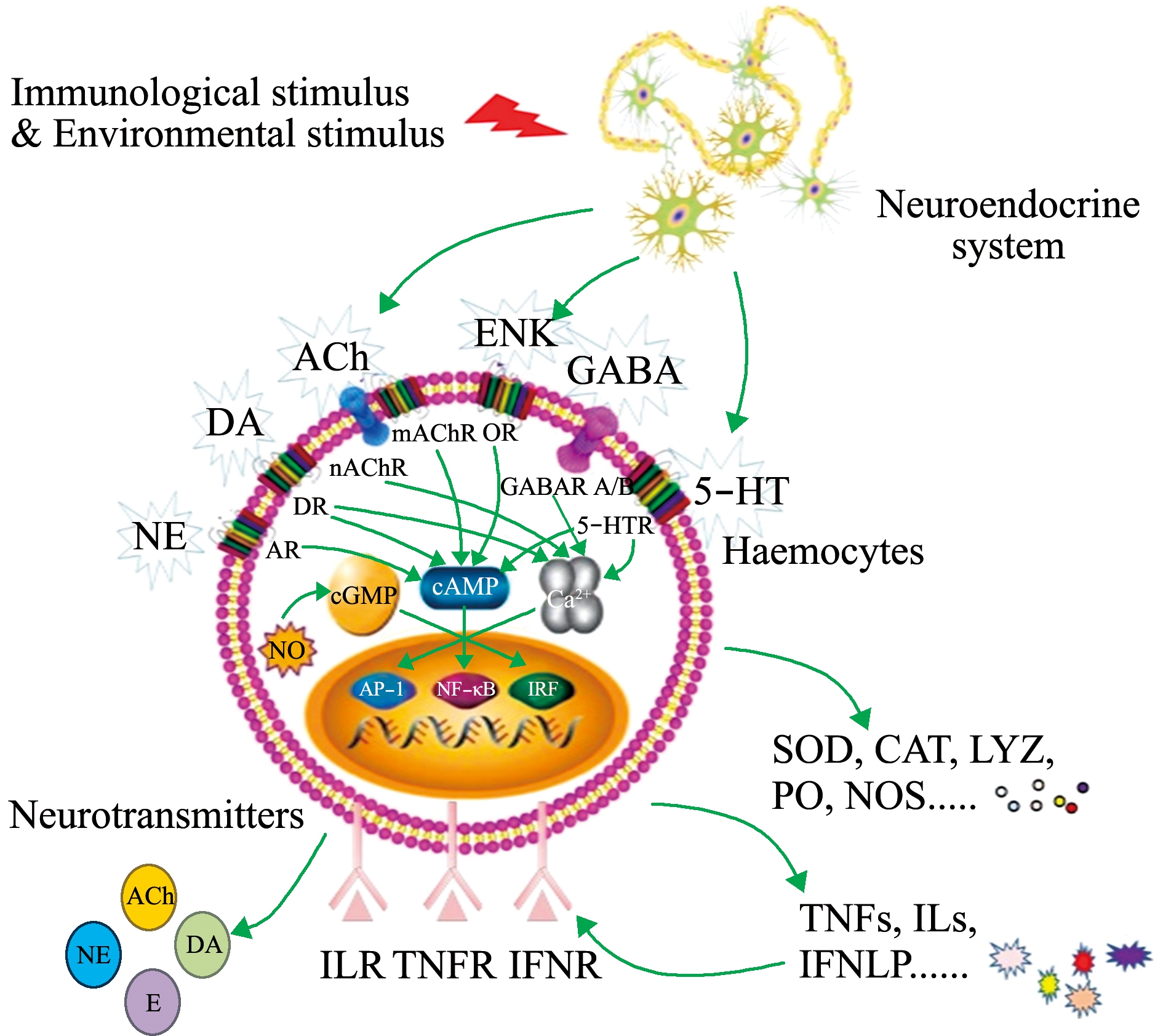
图1 贝类原始简单的神经内分泌免疫调节轴
Fig.1 A primitive and simple neuroendocrine-immune regulatory axis in the molluscs
1.1 儿茶酚胺
儿茶酚胺(catecholamines,CAs)是指含有邻苯二酚基本结构的胺类。机体内具有生物学活性的儿茶酚胺主要包括多巴胺(dopamine,DA)、去甲肾上腺素(norepinephrine,NE)和肾上腺素(epinephrine or adrenalin,E)。DA是大脑中含量最丰富的儿茶酚胺类神经递质,NE和E既是肾上腺髓质所分泌的激素,又是交感和中枢神经系统合成和分泌的神经递质。在线虫、软体动物和节肢动物等无脊椎动物中都发现了含有儿茶酚胺的神经元。与仅拥有多巴胺神经元的线虫相比,软体动物开始出现去甲肾上腺素和肾上腺素神经元。在贝类中已鉴定出DA、NE和E,它们广泛分布于神经节、肝胰腺、血淋巴细胞和血清中,通常在神经节和血淋巴细胞中含量较高。儿茶酚胺神经元最早出现于担轮幼虫,分布于幼虫腹缘[13]。
儿茶酚胺是由苯丙氨酸经一系列催化反应后生成的。在此过程中,苯丙氨酸羟化酶(phenylalanine hydroxylase,PAH)、酪氨酸羟化酶(tyrosine hydroxylase,TH)、多巴脱羧酶(dopa decarboxylase,DDC)、多巴胺羟化酶(dopamine beta hydroxylase,DBH)、苯乙醇胺-N-甲基转移酶(phenylethanolamine-N-methyl transferase,PNMT)、单胺氧化酶(monoamine oxidase,MAO)和儿茶酚邻位甲基转移酶(catechol-O-methyltransferase,COMT)等发挥重要作用[14]。在贝类中已鉴定出PAH[15]、DDC[16]、DBH[17-18]和MAO[19]等多种儿茶酚胺代谢酶,这些代谢酶在结构上与脊椎动物同源酶类似。从长牡蛎基因组中筛选得到7个DBH家族成员,它们在成体不同组织中的表达特征呈现出显著差异,其中DBH-1在长牡蛎血淋巴细胞、脏神经节和肝胰腺中表达量较高,在性腺、唇瓣、肌肉、外套膜和鳃中表达量较低。体外重组的长牡蛎DBH-1具有转化多巴胺为去甲肾上腺素的活性。栉孔扇贝中的PAH具有催化苯丙氨酸转化为酪氨酸的活性,MAO能催化5-羟色胺、去甲肾上腺素、肾上腺素和多巴胺脱氨基,DDC能转化L-多巴为多巴胺。以上研究表明,这些代谢酶具有与脊椎动物同源酶类似的活性和功能,在血淋巴细胞和多种组织中催化合成儿茶酚胺。
儿茶酚胺通过与分布在不同细胞上的相应受体结合,介导相应的级联反应,实现其生理调节功能。高等动物中儿茶酚胺受体主要包括α-肾上腺素受体(α-adrenergic receptor,αAR)、β-肾上腺素受体(β-adrenergic receptor,βAR)和多巴胺受体(dopamine receptor)[18]。在不同贝类中已鉴定出高等动物儿茶酚胺受体的同源蛋白,包括长牡蛎2个肾上腺素受体α1AR和α2AR[20],缢蛏1个多巴胺受体DopR2-1,栉孔扇贝1个肾上腺素受体ADR等。已鉴定出的贝类儿茶酚胺受体均含有7个疏水性跨膜结构域,属于7次跨膜的G蛋白偶联受体(G protein-coupled receptor,GPCR) 家族成员[21]。贝类肾上腺素受体和多巴胺受体分别含有与高等动物同源蛋白类似的保守结构域,这些结构对于其与去甲肾上腺素、肾上腺素和多巴胺的结合,以及信号的跨膜传递非常重要。目前,对贝类儿茶酚胺受体的研究主要聚焦于结构和表达特征的分析,对其介导的信号通路及生理活动等的研究报道则较少。去甲肾上腺素受体广泛分布于脊椎动物中枢神经系统和所有外周组织。在长牡蛎的性腺、唇瓣、肌肉、外套膜、鳃和血淋巴细胞中均检测到α1AR和α2AR mRNA表达,其中,α1AR mRNA 在肝胰腺中的表达量最高[20],α2AR mRNA在血淋巴细胞中的表达量最高。高等动物的免疫细胞主要表达β型 AR,但在软体动物中目前尚未鉴定出β型AR[22]。将长牡蛎α2AR转染到HEK293T细胞后发现,它能结合去甲肾上腺素,并参与调控胞内cAMP的含量。以上研究表明,贝类已进化形成了相对完善的儿茶酚胺神经系统,能从头合成多巴胺、肾上腺素和去甲肾上腺素,具备了与哺乳动物儿茶酚胺系统类似的分子基础(图2)。
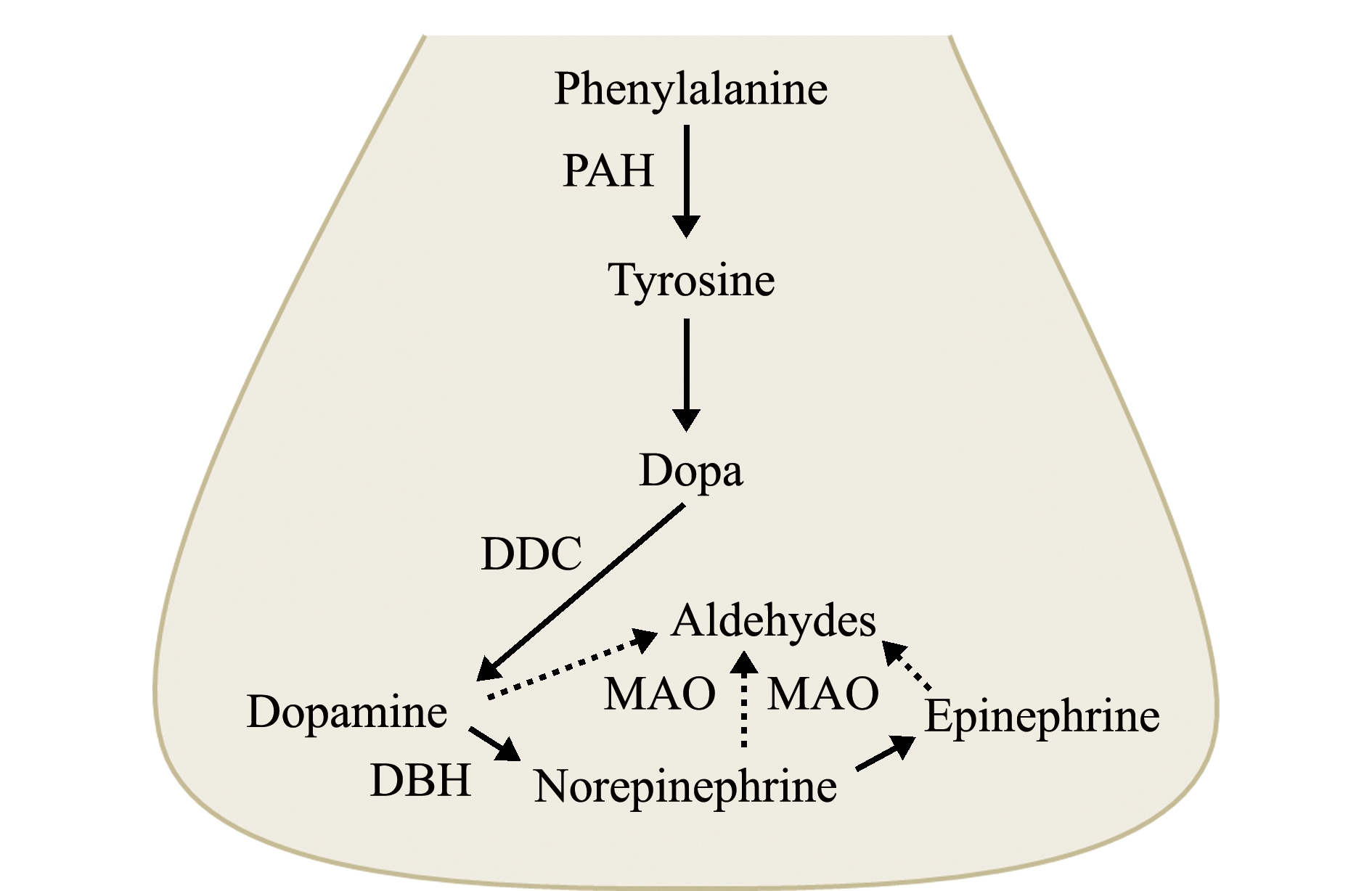
图2 贝类中儿茶酚胺的代谢途径
Fig.2 Metabolism of catecholamines in the molluscs
1.2 乙酰胆碱
乙酰胆碱是经典的胆碱类神经递质,在高等动物中枢和外周神经系统中均有分布,但主要由副交感神经(传出/运动迷走神经)释放,在调节兴奋性、注意力、学习、记忆和应激反应等生理活动中发挥着重要作用。乙酰胆碱信号通路主要由乙酰胆碱、乙酰胆碱转运体、乙酰胆碱受体(acetylcholine receptor,AChR)、胆碱乙酰转移酶(choline acetyltransferase,ChAT)和乙酰胆碱酯酶(acetylcholinesterase,AChE)等组成[23]。乙酰胆碱主要通过两种乙酰胆碱受体发挥作用,其中毒蕈碱型乙酰胆碱受体(muscarinic acetylcholine receptor,mAChR)为7次跨膜的G蛋白偶联受体,共分为M1、M2、M3、M4和M5 5种亚型,而烟碱型乙酰胆碱受体(nicotinic acetylcholine receptor,nAChR)为门控型离子通道受体。nAChRs 由5个同源或异源亚基构成,在高等动物中已鉴定出17种nAChRs 亚基。
乙酰胆碱作为古老的信号分子也存在于原始的原生生物中,主要发挥生理调节功能。随着神经系统的出现与进化,乙酰胆碱作为神经递质发挥神经调节功能。近年来,相继在节肢动物、软体动物及线虫中鉴定出胆碱神经系统中的关键元件。在贝类中已鉴定出胆碱乙酰转移酶、乙酰胆碱酯酶、乙酰胆碱转运体和乙酰胆碱受体等胆碱系统的成员,并在幼虫不同发育时期和成体不同组织中检测到乙酰胆碱。在栉孔扇贝个体发育过程中,乙酰胆碱神经元最早出现在担轮幼虫,分布于幼虫腹缘。长牡蛎胆碱乙酰转移酶ChAT主要分布于脏神经节,在血淋巴细胞中也检测到该基因的表达,该基因具有催化合成乙酰胆碱的能力。在栉孔扇贝中鉴定出1个乙酰胆碱酯酶AChE和2个烟碱型乙酰胆碱受体亚基nAChRα1与nAChRα2,在栉孔扇贝受精卵到眼点幼虫的各个发育时期,以及成体的闭壳肌、肝胰腺、外套膜、鳃等组织和血淋巴细胞中均能检测到其mRNA表达[24]。在静水椎实螺Lymnaea stagnalis中已鉴定出12个AChRs亚基,它们在椎实螺中枢神经系统及周围神经元中的表达水平较高[25]。在长牡蛎中鉴定出1个毒蕈碱型乙酰胆碱受体mAChR-1和1个烟碱型乙酰胆碱受体nAChR,其中mAChR-1能识别并结合乙酰胆碱,诱导HEK293细胞内二级信使钙离子和cAMP含量的显著升高[26],而nAChR 在长牡蛎血淋巴细胞中表达量最高,主要分布于形态较小、核质比较大的透明细胞的细胞膜上。
1.3 谷氨酸和γ-氨基丁酸
谷氨酸和γ-氨基丁酸属于氨基酸类神经递质,谷氨酸为兴奋型神经递质,而γ-氨基丁酸属于抑制型神经递质,二者间的动态平衡对于维持机体内稳态非常重要[27]。谷氨酸主要是由谷氨酚胺通过谷氨酞胺酶(glutaminase,GLS)降解产生,释放的谷氨酸作用于靶细胞上的不同谷氨酸受体,发挥对细胞功能的调节作用。谷氨酸受体分为离子型(ionotropic glutamate receptor,iGluR)和代谢型(metabotropic glutamate receptor,mGluR)两大类。γ-氨基丁酸由谷氨酸经谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)催化脱羧基后生成,GAD是合成γ-氨基丁酸的关键限速酶[28]。在高等动物中发现了包括γ-氨基丁酸转运蛋白2(GABA transporter 2,GAT2)、GAT-3、GAT-4、CT1和TAUT在内的5种γ-氨基丁酸转运蛋白,以及离子型受体GABAa、GABAc和代谢型受体GABAb,它们在γ-氨基丁酸的生理调节中发挥重要作用[29]。
1971年,研究人员首次在蜗牛Achatina fulica脑神经节提取物中鉴定出γ-氨基丁酸,引发了人们对无脊椎动物γ-氨基丁酸和谷氨酸神经系统的关注[30]。近年来,研究人员在鲍、牡蛎、扇贝等贝类的神经节和血淋巴中检测到γ-氨基丁酸。最近,在长牡蛎中鉴定出了1个谷氨酸脱羧酶(GAD),GAD含有保守的“NPHK”吡哆醛结合位点[31],主要在血淋巴细胞和神经节中大量表达,将其转染到HEK293细胞后,能促进HEK293 细胞中γ-氨基丁酸的合成。脊椎动物及果蝇、海胆等无脊椎动物中的GAD分化为GAD65和GAD67两种亚型,分别存在于不同类型的细胞中。然而,在较为低等的线虫及长牡蛎中,仅发现一种GAD,表明在系统进化过程中,GAD亚型的分化要晚于软体动物的出现。在河蚬Corbicula fluminea和杂色鲍Haliotis diversicolor中鉴定出γ-氨基丁酸受体相关蛋白(GABA receptor-associated protein,GABARAP),其中GABARAP在鲍肝胰腺中的表达水平相对较高[32]。在哺乳动物中已经发现了5种GABA转运蛋白,与之相比,贝类中的γ-氨基丁酸转运蛋白种类较少。在河蚬中发现了1个γ-氨基丁酸转运蛋白GAT-1[33],而在深海贻贝Bathymodiolus septemdierum基因组中发现了2个γ-氨基丁酸转运蛋白GAT-1和TAUT,其中GAT-1对次古龙碱显示出亲和力,次古龙碱参与热液口动物的硫化物解毒,GAT-1的这一特性被认为可能与深海贻贝适应其特殊生境相关[34]。
谷氨酸是脊椎动物中重要的兴奋型神经递质,但其在无脊椎动物中却可以同时执行兴奋和抑制两种类型神经递质的功能。谷氨酸也是刺胞动物和栉板动物最重要的神经递质,栉水母仅以谷氨酸作为神经信号传递物质,而侧腕水母中则存在数量较多的谷氨酸合成酶和转运体。iGluRs和 mGluRs在原始的后生动物栉水母中出现扩张,表明谷氨酸作为生物进化过程中较早出现的神经递质,可能在低等无脊椎动物中发挥重要的信号转导功能[35]。在长牡蛎等贝类中已鉴定出包括谷氨酰胺合成酶、GLS、谷氨酸受体和谷氨酸转运体等在内的谷氨酸神经系统的重要元件。长牡蛎谷氨酰胺酶GLS-1和谷氨酸脱氢酶GDH分别含有典型的谷氨酰胺酶结构域和脱氢酶结构域,表明贝类具有合成和分解谷氨酸的能力。长牡蛎谷氨酸受体mGluR5和mGluR6均含有保守的7次跨膜结构域,属于代谢型受体[36]。
1.4 一氧化氮
一氧化氮(nitric oxide,NO)是一种含氧自由基,由L-精氨酸在一氧化氮合酶(nitricoxide synthase,NOS)作用下催化生成。NO作为气体信号转导分子在许多细胞和组织中参与神经传递、血管调节和免疫防御等多种生理过程。NO能激活可溶性鸟苷酸环化酶(soluble guanylate cyclase,sGC),从而导致cGMP的产生和cGMP信号通路的激活。根据NOS不同的组织分布特征和催化活性,高等动物NOS分为神经型NOS(neuronal NOS,nNOS)、内皮型NOS (endothelial NOS,eNOS)和诱导型NOS(inducible NOS,iNOS)3种类型[37]。
NO广泛分布于无脊椎动物各种神经元中,能够调节和支配机体的行为和发育[38]。在贝类中,NO广泛分布在各个组织中,且在个体发育的不同阶段均能检测到NO。贝类的NOS尚未分化,仅有1个合酶家族成员,不存在nNOS、eNOS和iNOS的分型。长牡蛎NOS仅存在1个mRNA 转录本,但由于翻译后的加工而具备多种蛋白表达形式[39]。栉孔扇贝NOS具有类似哺乳动物nNOS和iNOS的催化中心活性结构,以及类似哺乳动物iNOS的免疫诱导活性,能催化L-精氨酸合成NO。NOS mRNA在栉孔扇贝担轮幼虫期及面盘幼虫中期与后期的表达水平较其他发育时期显著升高,表明这两个时期是双壳贝类NO系统发生的重要阶段。在脊椎动物中,NO系统因其合酶的分型而具有组织差异性和功能特异性。而在无脊椎动物中,NOS尚未出现结构和功能的分化,提示无脊椎动物 NO系统可能有着独特的分化或调控机制。
1.5 5-羟色胺
5-羟色胺(5-hydroxytryptamine,5-HT)是由1个吲哚环和2个官能团组成,即位于5位的酸性OH基团和位于3位的柔性乙胺侧链。5-羟色胺由色氨酸衍生而来,由限速酶色氨酸羟化酶(tryptophan hydroxylase,TPH)催化合成。5-羟色胺是一种重要的神经递质,通过与不同的受体结合,激活胞内cAMP和离子通道,参与调节睡眠、体温、疼痛及免疫等生理过程。在脊椎动物中已鉴定出15种5-羟色胺受体,归为7个家族,不同类型的 5-羟色胺受体在人脑中的分布及功能不尽相同,故参与的生理活动也不相同。
5-羟色胺主要存在于贝类的神经节及生殖系统中,在个体发育的不同时期,5-羟色胺主要在特定胚胎神经中枢的神经元及顶端感觉器官中表达[40]。在头足类南方微鳍乌贼Idiosepius notoides中发现,位于每个视叶背侧的神经元是第一个表达5-羟色胺的神经元[41]。在淡水蜗牛Helisoma trivolvis中分离到单个5-羟色胺神经元并确认了其对神经突生长的调节功能[42]。在章鱼中鉴定出5-羟色胺样神经元,并发现这些神经元参与了章鱼触手的感觉传递[43]。在静水椎实螺胚胎中,5-羟色胺主要存在于胚胎发育的E12和E32~E38时期。在贻贝的卵裂期也检测到5-羟色胺,用 5-羟色氨酸孵育后,所有胚胎细胞中5-羟色胺的浓度显著升高[44]。在成体长牡蛎中,5-羟色胺主要分布于外套膜边缘、肝小管间隙及脏神经节,在鳃、唇瓣和性腺中也有少量分布。目前,已鉴定的贝类5-羟色胺受体主要包括5-HT1、5-HT2、5-HT4和5-HT7共4种类型。在海兔中己经鉴定出3种,分别为5-HT1、5-HT2和5-HT4[45];在静水椎实螺、三旋卷丽螺Planorbella trivolvis和虾夷扇贝Mizuhopecten yessoensis中仅鉴定出5-HT1[46-48]。在长牡蛎中已鉴定出4个5-羟色胺受体基因(5-HTR1、5-HTR2、5-HTR3和5-HTR4),均为含有7次跨膜结构域的G蛋白偶联受体,其在长牡蛎肝胰腺、血淋巴细胞和性腺中均有表达,且在肝胰腺、血淋巴细胞中表达量较高,5-羟色胺受体的基因表达模式与5-羟色胺的分布模式相一致[40]。
1.6 神经肽
神经肽(neuropeptide)泛指存在于神经系统并参与神经系统功能作用的内源活性多肽类神经递质,在生物体内的含量低、活性高、作用广泛且复杂。神经肽由神经细胞分泌,经囊泡运输到靶细胞,与靶细胞上的G蛋白偶联受体特异性结合并使其激活,引起下游效应分子活性的改变[49]。高等动物神经肽类型众多,已报道的具有免疫调节功能的神经肽主要包括神经肽Y(neuropeptide Y)、促肾上腺皮质素释放激素、P 物质(substance P)、降钙素基因相关肽(calcitonin gene-related peptide)和脑啡肽(enkephalin,ENK)等。
目前,在贝类中已发现了多种神经肽及其前体。在长牡蛎中鉴定出44种神经肽前体,而在虾夷扇贝中鉴定出63种神经肽前体,其中有13种神经肽被认为是新发现的[50]。在紫贻贝Mytilus edulis体内发现并分离出甲硫氨酸脑啡肽(Met-enkephalin,MEK)、亮氨酸脑啡肽(Leu-enkephalin,LEK)和脑啡肽七肽(Met-enkephalin-Arg-Phe)[51]。在长牡蛎和栉孔扇贝的血淋巴中也检测到了甲硫氨酸脑啡肽和亮氨酸脑啡肽,脑啡肽神经元最早见于长牡蛎D型幼虫,分布于幼虫背缘。在栉孔扇贝中已鉴定出1个脑啡肽受体OGFR,其对甲硫氨酸脑啡肽具有高度的亲和力和特异性结合活性。在长牡蛎中也发现了1个脑啡肽受体DOR,其能与ENK结合后引起HEK293细胞内二级信使Ca2+和cAMP含量的显著下降[52]。
酰胺肽FMRFamide(Phe-Met-Arg-Phe-NH2)是无脊椎动物特有的神经肽,仅在环节动物、节肢动物及软体动物中被发现。在长牡蛎、虎斑乌贼Sepia pharaonis、曼氏无针乌贼Sepiella japonica和耳鲍Haliotis asinine中都鉴定出酰胺肽前体FMRFamide[53-56]。FMRFamide在长牡蛎脏神经节中的表达量最高,同时在肝胰腺消化道内壁和外套膜边缘也有大量分布[53]。在长牡蛎中已鉴定出28个FMRFamide受体基因,其中3个FMRFamide受体基因在长牡蛎血淋巴细胞中特异性高水平表达(未发表数据),提示FMRFamide可能在介导血淋巴细胞免疫应答过程中发挥重要作用。在长牡蛎中也发现了脂肪运动激素(adipokinetic hormones,AKH)样神经肽,AKH在多种组织中均有表达,但其是否具有与昆虫中脂肪运动激素类似的能量动员作用有待进一步研究[57]。
1.7 糖皮质激素
糖皮质激素是一种类固醇激素,主要包括皮质醇、皮质酮和可的松等。糖皮质激素是生命活动过程中重要的应激激素,参与调节许多生理过程以维持内稳态。高等动物糖皮质激素的合成与分解反应分别由11β-羟基类固醇脱氢酶(11β-hydroxysteroid dehydrogenases,11β-HSD)、5α-还原酶(5α-reductase,5α-R)和5β-还原酶(5β-reductase,5β-R)催化完成。糖皮质激素可以通过糖皮质激素受体(glucocorticoid receptor,GR)信号通路的介导,发挥生理和药理作用。糖皮质激素也可不依赖GR的参与,而与细胞膜上的G蛋白偶联受体如GPR97等发生非特异性结合而产生效应,还能影响质膜的阳离子转运和增加线粒体的质子渗漏,从而改变细胞的功能[58]。糖皮质激素的多途径选择性调节机制,为在突发生理刺激下快速调节各种生理活动、维持稳态奠定了重要基础。
研究者在头足纲、腹足纲和双壳纲中分别检测到类固醇激素,从而引发了无脊椎动物中是否存在类固醇激素的争议[59]。1998年,研究者首次在软体动物中鉴定出皮质醇,随后在一种淡水贻贝Anodonta anatina的肝胰腺、外套膜、鳃和生殖腺中均检测到了皮质醇的存在[60]。研究发现,贝类皮质醇含量在外源药物刺激和不同养殖环境胁迫下呈现显著性变化。泥蚶Tegillarca granosa中的皮质醇含量在氟西汀(fluoxetine)刺激下呈现剂量依赖性升高[61],而紫贻贝中的皮质醇含量在不同密度的养殖条件下也出现了显著变化[62]。近期,在长牡蛎中已鉴定出皮质醇合成代谢酶11β-HSD1和皮质醇分解代谢酶5α-R1,它们在闭壳肌、外套膜、鳃、肝胰腺、性腺、唇瓣等组织和血淋巴细胞中均有表达,且分别在血淋巴细胞和唇瓣中表达量最高。在高温胁迫条件下,长牡蛎肝胰腺中皮质醇含量显著升高,血淋巴细胞中11β-HSD1和5α-R1的表达水平也显著提高。这表明,贝类生物中已经具备皮质醇合成和分解代谢系统,皮质醇在调节高温胁迫应答中发挥重要作用,但具体的调节机制仍有待进一步探索。
1.8 胰岛素样肽
胰岛素是脊椎动物中参与调节血糖的一种重要的蛋白质激素。1984年,Nagasawa等首先在家蚕Bombyx mori中发现了家蚕素(bombyxin),这是在无脊椎动物中首次发现的胰岛素样肽(insulin-like peptide,ILP),随后的研究发现,编码胰岛素样肽的基因广泛存在于线虫动物、软体动物和节肢动物等无脊椎动物中,胰岛素样肽及其受体可以通过介导保守的胰岛素信号通路调控动物的生长、代谢、发育、生殖和衰老等生命过程[63]。
在长牡蛎中已鉴定出6种胰岛素相关肽(insulin related peptides,IRPs),它们不仅调控长牡蛎幼虫的发育,还参与调节繁殖和代谢。秀丽隐杆线虫中的胰岛素样肽按照其结构特征分为α、β和γ 3种类型。而软体动物中的胰岛素样肽主要为β型,具有保守的半胱氨酸特征性基序[64]。在哺乳动物中,胰岛素受体分为能与胰岛素、胰岛素类生长因子等结合的受体酪氨酸激酶(receptor tyrosine kinase,RTK),以及能与松驰素等结合的G蛋白偶联受体(G-protein coupled receptors,GPCRs),而在节肢动物和软体动物中仅发现 RTK 类型的受体[65-66]。长牡蛎胰岛素样肽受体在性腺的生殖干细胞有丝分裂期间或成熟卵母细胞中高水平表达,且在不同幼虫发育阶段表达量差异显著,提示其可能参与长牡蛎胚胎和幼虫的早期发育[67]。长牡蛎胰岛素促进因子1(pancreatic duodenal homeobox,Pdx)与胰岛素样肽受体共定位于肝胰腺的内胚层,推测长牡蛎Pdx可能依赖与脊椎动物Pdx1类似的机制激活胰岛素样肽受体的转录[68]。这表明,胰岛素样肽受体介导的信号通路在进化过程中高度保守,但关于胰岛素信号通路在软体动物免疫调控中的具体作用机制还有待进一步研究。
2 贝类神经内分泌系统的激活机制
高等动物神经内分泌系统对免疫系统的调节过程主要包括:1)病原入侵激活机体细胞免疫和体液免疫应答,并促进炎性相关因子等的释放,后者通过转运分子和血脑屏障进入大脑,或通过激活传入神经系统将外周免疫信号传入中枢神经系统;2)中枢神经系统一方面激活交感神经释放NE等神经递质,NE通过与免疫细胞上的受体结合,激活信号通路,从而增强/放大免疫应答,另一方面激活副交感神经释放ACh等神经递质,ACh通过与免疫细胞上的受体结合,抑制信号通路,从而降低免疫应答水平;3)下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal,HPA)调节糖皮质等激素的释放,糖皮质激素通过与免疫细胞中的相应受体结合,抑制信号通路,从而降低免疫应答水平。神经内分泌系统的激活是其调节免疫应答的重要环节[69]。
2.1 神经递质和激素代谢相关基因的激活
免疫刺激能诱导神经递质和激素代谢相关基因的表达,促进各种神经递质和激素的合成,激活贝类神经内分泌系统。大部分贝类神经内分泌相关基因在其血淋巴细胞、神经节、鳃、肌肉、性腺、肝胰腺及肾脏等细胞和组织中均有表达,提示这些神经递质和激素可能在不同组织和细胞中发挥不同的生理调节作用。与多巴胺、5-羟色胺、去甲肾上腺素、乙酰胆碱、酰胺肽、谷氨酸和γ-氨基丁酸等神经递质合成相关的基因均在血淋巴细胞中表达,这表明,从无脊椎动物到脊椎动物的进化过程中,免疫细胞合成和释放氨基酸类、单胺类、肽类和胆碱类神经递质的功能较为保守。病原微生物和病原相关分子模式(pathogen-associated molecular patterns,PAMPs)刺激能诱导贝类儿茶酚胺、乙酰胆碱、γ-氨基丁酸和谷氨酸等代谢通路相关基因的表达。经灿烂弧菌刺激后,长牡蛎幼虫中多巴胺羟化酶和单胺氧化酶的表达量显著升高,成体血淋巴细胞中胆碱乙酰转移酶、酰胺肽前体等的表达量也显著升高[70]。转录组分析发现,长牡蛎血淋巴细胞中Glu、GABA、5-羟色胺、DA、NE和ACh合成代谢相关基因的表达量在LPS处理后6~24 h时显著升高,其中,Glu合成相关基因的表达量在6 h(前期)和12 h(中期)时显著升高,GABA和ACh合成相关基因表达量在24 h(后期)时显著升高,DA和5-羟色胺合成相关基因表达量主要在中后期显著升高。
贝类中的神经递质和激素含量在免疫刺激后也发生显著变化。长牡蛎血清中NE含量在LPS刺激后12~48 h时显著上升,长牡蛎血淋巴细胞中ACh和NE含量在体外与LPS孵育1 h后显著升高;GABA含量在LPS刺激后6 h时显著下降,48 h时显著上升,而Glu的变化趋势与GABA相反。长牡蛎血清中甲硫氨酸脑啡肽浓度在LPS刺激后2~6 h时显著上升,扇贝血清中NO含量在LPS刺激后24 h时显著增加[71]。以上研究表明,长牡蛎血淋巴细胞中存在多种神经递质和激素的合成途径,这些神经递质合成相关基因能够动态响应病原刺激,合成和分泌不同的神经递质和激素,它们可能通过自分泌和旁分泌的方式在免疫应答的不同阶段起重要的调节作用。
2.2 神经递质和激素受体的激活
贝类血淋巴细胞可以表达分泌乙酰胆碱、儿茶酚胺、5-羟色胺、脑啡肽和皮质醇等多种神经递质和激素的受体。在长牡蛎血淋巴细胞中表达的基因约占基因组基因总数的59%,809个基因在血淋巴细胞中的表达量为其他组织中的 2 倍以上,这些基因主要富集到与神经-内分泌-免疫相关的通路中,其中147个基因在血淋巴细胞中特异性表达,主要包括肾上腺素受体(alpha-2c adrenergic receptor)、胆囊收缩素受体(cholecystokinin receptor)、前列腺素 E2 受体(prostaglandin E2 receptor)、酰胺肽受体(FMRfamide receptor)、褪黑素受体(melatonin receptor)、食欲肽受体(orexin receptor)等神经内分泌相关受体,以及Toll样受体(Toll-like receptor)、整合素(integrin)、补体 C1q(complement C1q)、凝集素(C-type lectin、galectin)等免疫识别受体,表明它们在血淋巴细胞的信号感知及免疫应答中发挥重要作用。病原刺激能诱导贝类神经递质和激素受体的表达。如长牡蛎血淋巴细胞中儿茶酚胺受体A1AR-1,脑啡肽受体DOR,以及Glu受体的mGluR5、mGluR6表达量在细菌刺激后均显著升高[14,18,20];鲍GABA受体相关蛋白表达量在细菌侵染后显著上升[32]。这表明,贝类神经内分泌系统合成和分泌的神经递质、激素能与其受体结合,调节细胞内环磷酸腺苷(cyclic AMP,cAMP)和钙离子含量的变化,激活相关信号通路,进一步调节免疫应答过程。
3 贝类神经内分泌系统对免疫应答的调节
神经内分泌系统对免疫系统的调节作用对于机体抵抗病原入侵、维持内稳态至关重要。神经内分泌系统对免疫应答的调节作用主要包括:免疫应答早期增强免疫应答反应,加速入侵病原的清除过程;免疫应答晚期抑制免疫应答水平,防止过度应答对机体造成损害;优化机体免疫应答过程中的能量消耗,恢复机体内稳态。在高等动物中,神经内分泌调节免疫应答的过程主要包括经典途径和非经典途径。经典途径的调节过程主要包括机体识别病原入侵后将外周免疫信号传入中枢神经系统,中枢系统激活交感神经、副交感神经及内分泌腺体合成释放NE、ACh和糖皮质激素等神经递质/激素类物质,这些神经递质/激素类物质与受体结合进而发挥免疫调节功能;非经典调节途径于20世纪末才被人们所认可,其区别于经典途径的主要特征是免疫细胞可直接合成神经递质/激素类物质,后者通过自分泌或旁分泌的方式与相应受体结合行使免疫调节功能[72]。相对于经典调节途径,非经典调节途径能更直接、更快速响应病原入侵并对免疫应答产生精细调节作用。儿茶酚胺、乙酰胆碱、谷氨酸等受体在多种类型的免疫细胞(NK细胞、巨噬细胞、中性粒细胞、肥大细胞、树突状细胞、T细胞和B细胞等)中均有表达。但因免疫细胞类型的不同、免疫细胞表达受体类型的不同及细胞内外环境的差异,神经递质和激素可对免疫细胞的功能产生差异性调节。近年来,多种神经递质合成酶、转运体和受体等先后在不同无脊椎动物的神经系统中被成功鉴定,提示经典神经内分泌调节途径在无脊椎动物的胚胎发育、变态附着、生殖、免疫应答和环境适应等生命过程中发挥重要作用。同时,在无脊椎动物的免疫细胞中也发现了神经内分泌系统的关键元件[73]。这表明,贝类等低等无脊椎动物神经内分泌系统结构组成相对简单,以免疫细胞合成和释放神经递质及激素为特征的非经典调节途径可能在其内稳态维持中发挥着至关重要的作用。
3.1 神经递质和激素对免疫应答的调节
贝类神经内分泌系统参与调控免疫细胞吞噬和凋亡等免疫应答过程。长牡蛎儿茶酚胺能调控血淋巴细胞的吞噬及凋亡,介导细胞免疫应答。在免疫刺激并注射多巴胺后,欧洲鲍Haliotis tuberculata的血淋巴细胞数目增多,吞噬效应显著增强[74]。NO能够参与抑制扇贝血淋巴细胞的凋亡,增强血淋巴细胞的吞噬能力[53]。在泥蚶中,ACh通过与mAChRs和nAChRs结合抑制吞噬作用,破坏细胞内Ca2+稳态,并干扰下游Ca2+和NF-κB信号通路[75]。GABA能抑制LPS刺激后免疫细胞的吞噬率和凋亡率的升高,以避免过度免疫反应,维持免疫稳态[31]。
贝类的一氧化氮、5-羟色胺、乙酰胆碱、脑啡肽和儿茶酚胺等神经递质能调节免疫相关酶的活性及细胞因子等的表达[76]。扇贝NOS具有nNOS和iNOS的活性特征,免疫刺激后血淋巴细胞中的NOS能快速催化合成NO,而NO能参与调节活性氧的水平,从而缓解血淋巴细胞的氧化应激状态。在长牡蛎中,甲硫氨酸脑啡肽与其受体结合后,能激活血淋巴细胞内二级信使Ca2+和cAMP的信号转导,调节免疫识别分子和免疫效应分子的表达和酚氧化酶的活性,ACh和5-羟色胺参与调节血淋巴中超氧化物歧化酶(superoxide dismutase,SOD)的活性[41,76] (图3),神经肽FMRFamide能调节血淋巴细胞中p38 MAPK磷酸化水平,以及白细胞介素17-5(interleukin 17-5,IL17-5)、凋亡相关基因 Caspase-1与Caspase-3的表达。缢蛏的多巴胺受体DopR2-1能够调节过氧化氢酶(catalase,CAT)和SOD的活性[21]。去甲肾上腺素和肾上腺素能抑制病原侵染后扇贝血淋巴中抗氧化酶活性的升高,这种负向调节是扇贝恢复氧化还原稳态所必需的[77]。胆碱能受体nAChRα1能调节扇贝体内由LPS引起的肿瘤坏死因子(tumor necrosis factor-α,TNF-α)浓度变化。这表明,贝类的DDC、BDH、AChE、NOS等神经内分泌相关基因参与了贝类免疫识别、信号传导及病原清除等过程,在调节免疫应答中发挥重要作用。
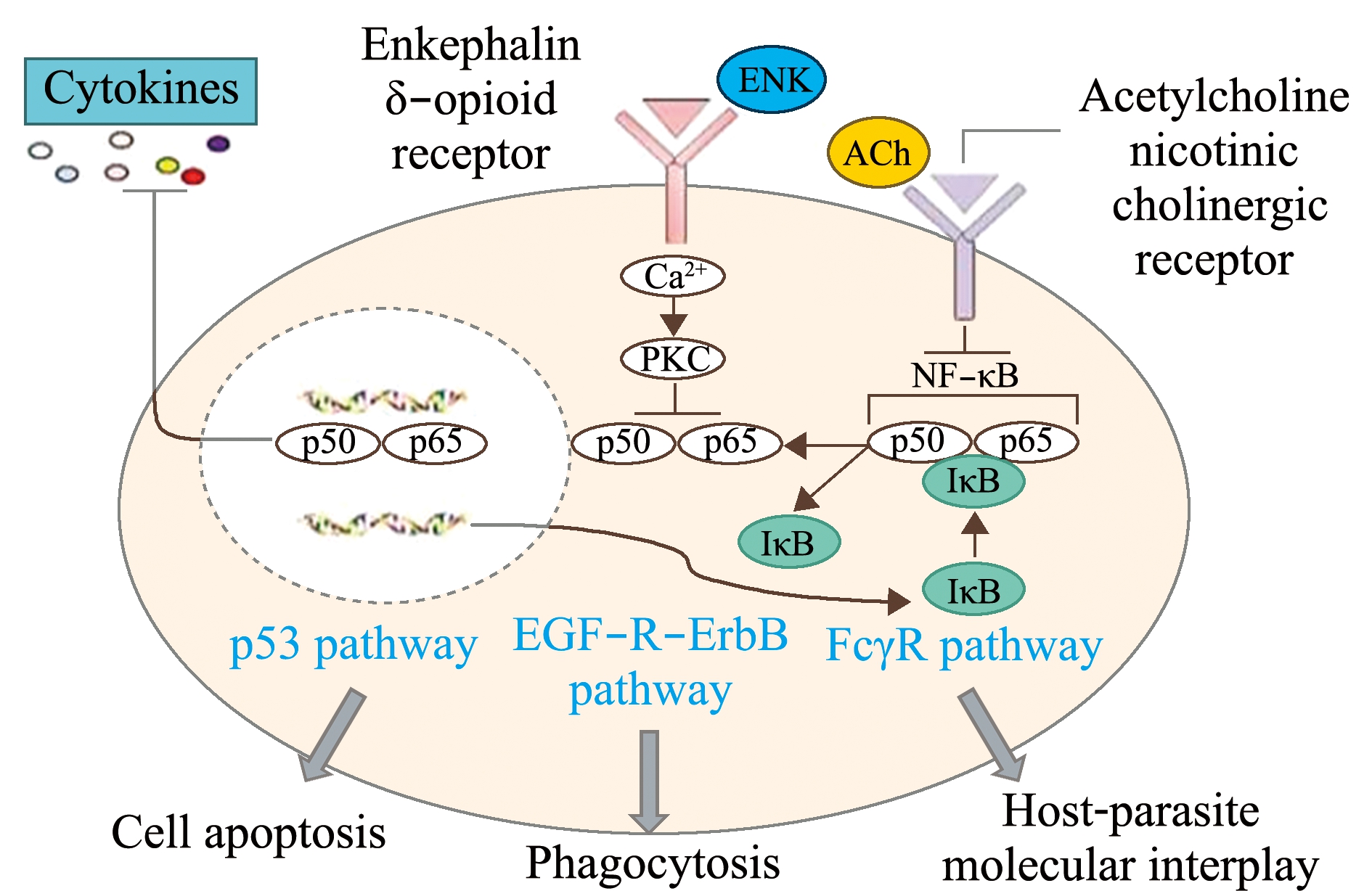
图3 贝类乙酰胆碱和脑啡肽及其受体介导的免疫调节作用
Fig.3 Immunomodulatory role of ENK and ACh as well as their receptors in the immune response of molluscs
3.2 不同神经递质和激素的协同调节
神经递质和激素主要通过与免疫细胞表面的相应受体结合实现其免疫调节功能,且结合的受体类型不同,介导的下游通路、发挥的调节作用也不尽相同。不同神经递质和激素在贝类免疫应答的不同时期发挥不同的调节作用。在免疫应答前中期,ENK、NE、FMRFamide和Glu等兴奋型神经递质在介导贝类血淋巴细胞增强免疫应答反应及快速清除病原中起作用。而在免疫应答后期,血淋巴细胞表面的受体可能倾向于结合ACh 和GABA等抑制型神经递质,抑制免疫应答反应,降低免疫应答水平,防止过度免疫应答造成机体损害,维持机体内稳态。在对免疫应答的调控过程中,贝类神经内分泌系统对效应分子合成及细胞吞噬与凋亡等免疫应答过程的调节往往是同时发生的。对长牡蛎的研究发现,体外注射5-羟色胺后,血淋巴细胞凋亡率显著降低,血淋巴中SOD活性显著升高,而抑制5-羟色胺受体后血淋巴细胞凋亡率显著升高,TNF表达量显著降低,提示5-羟色胺能同时参与调节免疫细胞的多种复杂的应答过程。贝类不同类型神经递质具有不同的免疫应答响应模式,不同神经递质这种差异化的免疫响应模式也赋予了贝类灵活多变的免疫应答调控机制。
贝类的乙酰胆碱、脑啡肽、儿茶酚胺和5-羟色胺等神经递质和激素存在原始的协同调节作用,共同调节免疫应答。研究发现,NE通过激活α-和β-肾上腺素受体改变cAMP和Ca2+的浓度(即NE-α/β-AR-cAMP/Ca2+途径),调控NO的活性(图4),PI3K-Akt通路及NF-κB1/STAT6等转录因子参与调控NOS的转录和表达,部分NOS结合PSD-95并锚定于内膜周边,在免疫应答发生时从细胞膜转位到细胞质,通过表达形式和磷酸化修饰的变化,改变其催化活性及合成NO的速率[39]。对转录组和蛋白质组数据联合分析发现,乙酰胆碱、去甲肾上腺素和脑啡肽协同刺激长牡蛎后,血淋巴细胞中差异表达基因结成以TNF为核心的共表达网络,AP和NF-κB等转录因子参与了该网络中相关基因的协同调节。当乙酰胆碱和去甲肾上腺素分别与脑啡肽协同作用时,乙酰胆碱和去甲肾上腺素的免疫调节效应占主导。这表明,不同神经递质具备原始而有序的协同调控机制,通过与受体耦联的下游通路及效应器,系统地调节血淋巴细胞介导的免疫应答过程。
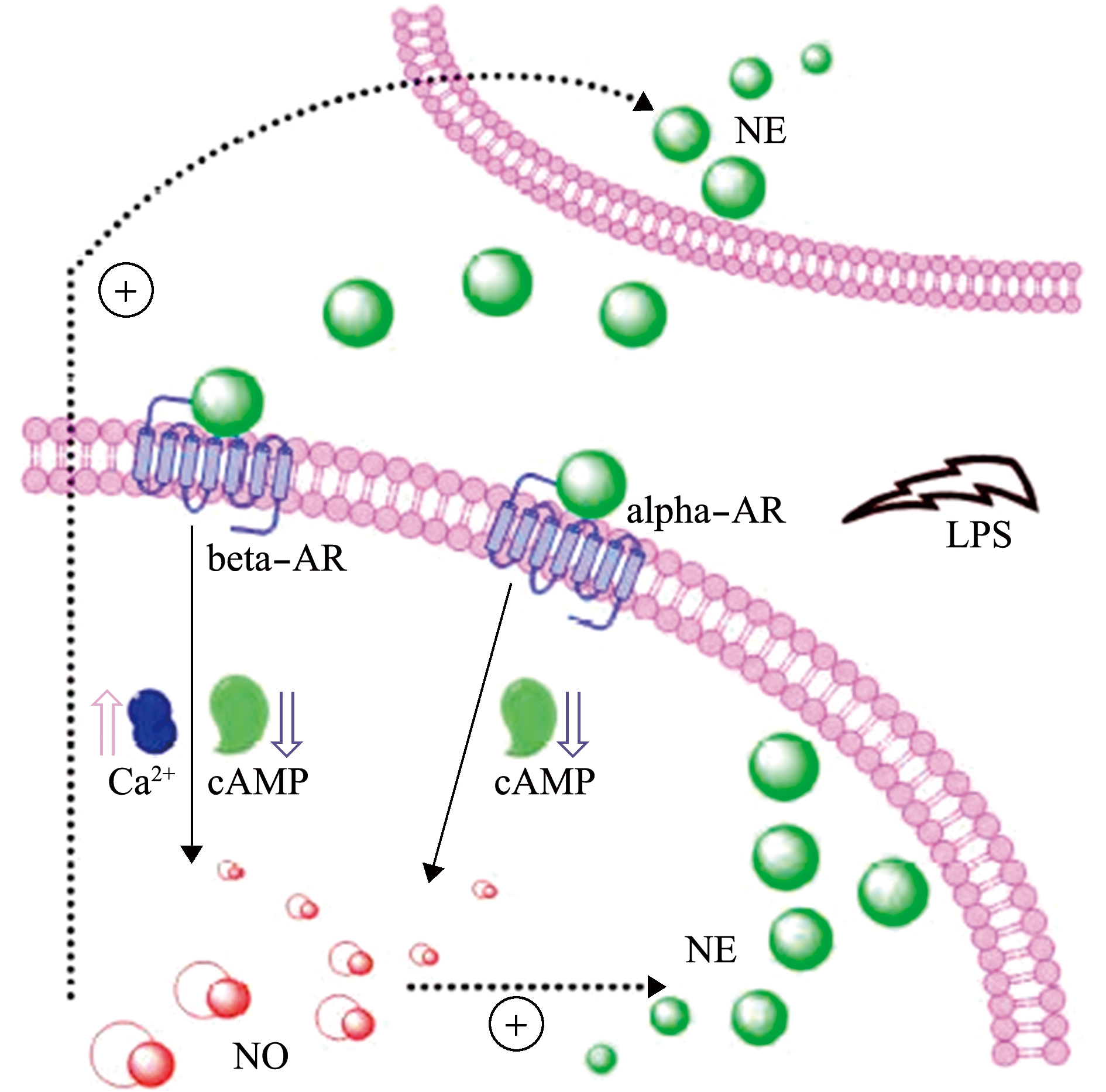
图4 贝类NE-AR-cAMP/Ca2+调控NO合成的机制
Fig.4 Regulation mechanism of NE-AR-cAMP/Ca2+ to NO synthesis in the molluscs
3.3 细胞因子的调节作用
神经内分泌系统除了可以通过神经递质和激素对免疫系统进行调节外,还可以通过细胞因子调节免疫应答。对哺乳动物的研究表明,神经内分泌系统能够分泌细胞因子。如星形胶质细胞和小胶质细胞能够产生TNF、干扰素(interferon,IFN)-α、γ及IL1和IL6[78],下丘脑和垂体组织能够产生转化生长因子(transforming growth factor,TGF)、IL10、IL18和IL1等[79-80]。此外,由于细胞因子可以通过血脑屏障[81],即使是中枢系统产生的细胞因子依然能够通过血液循环到达免疫组织,实现对免疫应答的调控。神经内分泌系统还可以通过神经递质和激素对细胞因子的合成和表达进行调控。如糖皮质激素能抑制IL6的分泌,而儿茶酚胺则能够促进IL6的表达,从而实现对免疫应答的调控[82]。更有趣的是,除免疫细胞外,神经元或者内分泌细胞表面也具有能与细胞因子结合的相应受体。如IL1β和IL6可以结合神经元和星形胶质细胞表面的相应受体,从而改变其功能和活性[83]。因此,NEI系统能利用许多相似的配体和受体来实现系统内和系统间的通信。GABA、5-羟色胺、去甲肾上腺素等能够影响贝类血淋巴细胞中TNF、IL1等细胞因子的表达,表明贝类的神经递质可以调节细胞因子的产生。而贝类的血淋巴细胞也能够分泌去甲肾上腺素、多巴胺、NO等神经递质,血淋巴细胞的这种自分泌和旁分泌的调节方式,对于拥有开放式循环系统的贝类来说意义更为显著。对血蛤研究发现,TNF能够刺激血淋巴细胞分泌NO,提示细胞因子同样能够刺激贝类神经内分泌系统分泌神经递质[61]。近期的研究显示,经氟西汀刺激后,贝类血淋巴中的ACh和GABA与Ca2+浓度、肿瘤坏死因子受体相关因子2(tumor necrosis factor receptor-associated factor 2,TRAF2)的表达呈负相关[75],而Ca2+及TRAF2也受到一系列细胞因子级联反应的调控。这些结果表明,细胞因子在贝类神经内分泌系统对免疫应答的调节过程中起非常重要的信号转导作用。
4 未来重点研究方向
神经内分泌系统在生物体响应环境胁迫、维持内稳态和保障生存中发挥了关键作用。贝类种类繁多,生活环境迥异,适应性强,进化地位特殊,是研究无脊椎动物神经内分泌系统起源与进化的关键类群。贝类中存在结构和功能相对完善的儿茶酚胺、乙酰胆碱、脑啡肽、一氧化氮、谷氨酸和皮质醇等系统,进化形成原始而简单的神经内分泌免疫调节轴,深入了解其神经内分泌系统及其对免疫应答的调节作用,对于全面认识无脊椎动物乃至整个生物界神经内分泌免疫系统的发生和发展都具有重要意义。鉴于目前对贝类神经内分泌系统的研究刚刚起步,对其结构特征、功能作用、调节机制和进化意义等的认识尚不够深入,未来的研究应聚焦在以下几个方面。
4.1 深入研究贝类神经内分泌系统的结构特征
贝类拥有索式神经系统,出现了原始的内分泌腺,其神经内分泌系统的分子和细胞组成与具备完善的神经内分泌组织和器官的高等动物相比类似,但不尽相同。解析贝类等低等无脊椎动物神经内分泌系统的分子和细胞组成,可为进一步了解高等动物神经内分泌系统的结构特征提供参考。
4.2 深入分析贝类神经递质和激素的功能作用
虽然已经确认贝类中存在多种类型的神经递质和激素,但目前对不同类型神经递质和激素的合成与分泌、受体的分布,及其介导的信号通路、功能特征与特异性作用及可能存在的其他更多类型神经递质和激素等信息仍然知之甚少。贝类不同类型神经递质和激素的功能作用有待深入探索。
4.3 阐明贝类神经内分泌系统对免疫应答的调节机制
贝类缺乏基于淋巴细胞和抗体的获得性免疫系统,仅依赖固有免疫系统抵御病原侵染。贝类的免疫应答过程受到精细复杂的调控,其中神经递质和激素在免疫调控中扮演重要角色。血淋巴细胞是贝类的主要免疫细胞,几乎所有的神经内分泌免疫调节作用都通过血淋巴细胞来完成。以血淋巴细胞合成和释放神经递质和激素为特征的非经典调节途径可能在其免疫防御及内稳态维持中发挥至关重要的作用。阐明不同神经递质、激素和细胞因子对免疫应答的调节机制及其协同作用,将为深入了解贝类免疫防御机制奠定基础。
4.4 探索贝类神经内分泌免疫系统的进化意义
贝类拥有开放式循环系统,循环血淋巴细胞与神经系统组成原始简单的“神经-血淋巴细胞”调节轴,探索贝类神经内分泌免疫调节轴的激活机制及功能特征,将为探索高等动物“血脑屏障”的作用机制及人类相关疾病的治疗策略提供借鉴。同时,贝类种类繁多、适应性广,探索贝类神经内分泌免疫系统与其他系统之间的关系及其在环境适应中的作用也将成为未来重要的研究方向。
[1] WANNINGER A,WOLLESEN T.The evolution of molluscs[J].Biological Reviews,2019,94(1):102-115.
[2] PANG T Y,YAEGER J D W,SUMMERS C H,et al.Cardinal role of the environment in stress induced changes across life stages and generations[J].Neuroscience and Biobehavioral Reviews,2021,124:137-150.
[3] STRAUB R H,CUTOLO M,BUTTGEREIT F,et al.Energy regulation and neuroendocrine-immune control in chronic inflammatory diseases[J].Journal of Internal Medicine,2010,267(6):543-560.
[4] ALBERTIN C B,SIMAKOV O,MITROS T,et al.The Octopus genome and the evolution of cephalopod neural and morphological novelties[J].Nature,2015,524(7564):220-224.
[5] HOCHNER B,GLANZMAN D L.Evolution of highly diverse forms of behavior in molluscs[J].Current Biology:CB,2016,26(20):R965-R971.
[6] WANG L L,SONG X R,SONG L S.The oyster immunity[J].Developmental and Comparative Immunology,2018,80:99-118.
[7] SONG L S,WANG L L,ZHANG H,et al.The immune system and its modulation mechanism in scallop[J].Fish &Shellfish Immunology,2015,46(1):65-78.
[8] LIU Z Q,LI M J,YI Q L,et al.The neuroendocrine-immune regulation in response to environmental stress in marine bivalves[J].Frontiers in Physiology,2018,9:1456.
[9] HUANG Q S,LI Q H,CHEN H M,et al.Neuroendocrine immune-regulatory of a neuropeptide ChGnRH from the Hongkong oyster,Crassostrea hongkongensis[J].Fish &Shellfish Immunology,2019,93:911-916.
[10] HUANG W,XU F,QU T,et al.Identification of thyroid hormones and functional characterization of thyroid hormone receptor in the Pacific oyster Crassostrea gigas provide insight into evolution of the thyroid hormone system[J].PLoS One,2015,10(12):e0144991.
[11] SMIT A B,VREUGDENHIL E,EBBERINK R H,et al.Growth-controlling molluscan neurons produce the precursor of an insulin-related peptide[J].Nature,1988,331(6156):535-538.
[12] 李婉茹,张玲玲,张美溦,等.海湾扇贝促性腺激素释放激素基因克隆及表达分析[J].中国海洋大学学报(自然科学版),2020,50(2):68-74.
LI W R,ZHANG L L,ZHANG M W,et al.Cloning and expression analysis of gonadotropin-releasing hormone gene in the bay scallop[J].Periodical of Ocean University of China(Natural Science Edition),2020,50(2):68-74.(in Chinese)
[13] LIU Z Q,WANG L L,LV Z,et al.The cholinergic and adrenergic autocrine signaling pathway mediates immunomodulation in oyster Crassostrea gigas[J].Frontiers in Immunology,2018,9:284.
[14] YOUDIM M B H,EDMONDSON D,TIPTON K F.The therapeutic potential of monoamine oxidase inhibitors[J].Nature Reviews Neuroscience,2006,7(4):295-309.
[15] ZHOU Z,NI D J,WANG M Q,et al.The phenoloxidase activity and antibacterial function of a tyrosinase from scallop Chlamys farreri[J].Fish &Shellfish Immunology,2012,33(2):375-381.
[16] ZHOU Z,YANG J L,WANG L L,et al.A dopa decarboxylase modulating the immune response of scallop Chlamys farreri[J].PLoS One,2011,6(4):e18596.
[17] ZHOU Z,WANG L L,YANG J L,et al.A dopamine beta hydroxylase from Chlamys farreri and its induced mRNA expression in the haemocytes after LPS stimulation[J].Fish &Shellfish Immunology,2011,30(1):154-162.
[18] LI M J,DONG M R,WANG W L,et al.A membrane-bound dopamine β-hydroxylase highly expressed in granulocyte of Pacific oyster Crassostrea gigas[J].Developmental and Comparative Immunology,2020,104:103563.
[19] ZHOU Z,WANG L L,GAO Y,et al.A monoamine oxidase from scallop Chlamys farreri serving as an immunomodulator in response against bacterial challenge[J].Developmental and Comparative Immunology,2011,35(7):799-807.
[20] LIU Z Q,ZHOU Z,WANG L L,et al.CgA1AR-1 acts as an alpha-1 adrenergic receptor in oyster Crassostrea gigas mediating both cellular and humoral immune response[J].Fish &Shellfish Immunology,2016,58:50-58.
[21] NIU D H,LI Z,DU Y C,et al.Identification of a dopamine receptor in Sinonovacula constricta and its antioxidant responses[J].Developmental and Comparative Immunology,2020,103:103512.
[22] BAUKNECHT P,J KELY G.Ancient coexistence of norepinephrine,tyramine,and octopamine signaling in bilaterians[J].BMC Biology,2017,15(1):6.
KELY G.Ancient coexistence of norepinephrine,tyramine,and octopamine signaling in bilaterians[J].BMC Biology,2017,15(1):6.
[23] DEIANA S,PLATT B,RIEDEL G.The cholinergic system and spatial learning[J].Behavioural Brain Research,2011,221(2):389-411.
[24] SHI X W,ZHOU Z,WANG L L,et al.The immunomodulation of nicotinic acetylcholine receptor subunits in Zhikong scallop Chlamys farreri[J].Fish &Shellfish Immunology,2015,47(1):611-622.
[25] VAN NIEROP P,BERTRAND S,MUNNO D W,et al.Identification and functional expression of a family of nicotinic acetylcholine receptor subunits in the central nervous system of the mollusc Lymnaea stagnalis[J].The Journal of Biological Chemistry,2006,281(3):1680-1691.
[26] LIU Z Q,ZHOU Z,WANG L L,et al.The cholinergic immune regulation mediated by a novel muscarinic acetylcholine receptor through TNF pathway in oyster Crassostrea gigas[J].Developmental and Comparative Immunology,2016,65:139-148.
[27] NAKAHARA T,TSUGAWA S,NODA Y,et al.Glutamatergic and GABAergic metabolite levels in schizophrenia-spectrum disorders:a meta-analysis of H-magnetic resonance spectroscopy studies[J].Molecular Psychiatry,2022,27(1):744-757.
[28] FENALTI G,BUCKLE A M.Structural biology of the GAD autoantigen[J].Autoimmunity Reviews,2010,9(3):148-152.
[29] ENGIN E,BENHAM R S,RUDOLPH U.An emerging circuit pharmacology of GABA receptors[J].Trends in Pharmacological Sciences,2018,39(8):710-732.
[30] TAKEUCHI H,YOKOI I,HIRAMATSU M.Structure-activity relationships of GABA and its relatives on the excitability of an identified molluscan giant neurone (Achatina fulica Férussac)[J].Comparative Biochemistry and Physiology C:Comparative Pharmacology,1977,56(1):63-73.
[31] LI M J,WANG L L,QIU L M,et al.A glutamic acid decarboxylase (CgGAD) highly expressed in hemocytes of Pacific oyster Crassostrea gigas[J].Developmental and Comparative Immunology,2016,63:56-65.
[32] BAI R Y,YOU W W,CHEN J,et al.Molecular cloning and expression analysis of GABA(A) receptor-associated protein (GABARAP) from small abalone,Haliotis diversicolor[J].Fish &Shellfish Immunology,2012,33(4):675-682.
[33] CHEN H H,GU X H,ZENG Q F,et al.Characterization of the GABAergic system in Asian clam Corbicula fluminea:phylogenetic analysis,tissue distribution,and response to the aquatic contaminant carbamazepine[J].Comparative Biochemistry and Physiology Toxicology &Pharmacology:CBP,2021,239:108896.
[34] KINJO A,SASSA M,KOITO T,et al.Functional characterization of the GABA transporter GAT-1 from the deep-sea mussel Bathymodiolus septemdierum[J].Comparative Biochemistry and Physiology Part A:Molecular &Integrative Physiology,2019,227:1-7.
[35] MOROZ L L,KOCOT K M,CITARELLA M R,et al.The ctenophore genome and the evolutionary origins of neural systems[J].Nature,2014,510(7503):109-114.
[36] LIANG Y G,LI M J,LIU Z Q,et al.The glutaminase (CgGLS-1) mediates anti-bacterial immunity by prompting cytokine synthesis and hemocyte apoptosis in Pacific oyster Crassostrea gigas[J].Scientific Reports,2021,11(1):1281.
[37] MONCADA S,PALMER R M,HIGGS E A.Nitric oxide:physiology,pathophysiology,and pharmacology[J].Pharmacological Reviews,1991,43(2):109-142.
[38] CIONI C,DI PATTI M C,VENTURINI G,et al.Cellular,biochemical,and molecular characterization of nitric oxide synthase expressed in the nervous system of the prosobranch Stramonita haemastoma (Gastropoda,Neogastropoda)[J].The Journal of Comparative Neurology,2012,520(2):364-383.
[39] JIANG Q F,LIU Z Q,ZHOU Z,et al.Transcriptional activation and translocation of ancient NOS during immune response[J].The FASEB Journal,2016,30(10):3527-3540.
[40] DONG W J,LIU Z Q,QIU L M,et al.The modulation role of serotonin in Pacific oyster Crassostrea gigas in response to air exposure[J].Fish &Shellfish Immunology,2017,62:341-348.
[41] WOLLESEN T,DEGNAN B M,WANNINGER A.Expression of serotonin (5-HT) during CNS development of the cephalopod mollusk,Idiosepius notoides[J].Cell and Tissue Research,2010,342(2):161-178.
[42] AHN K C,BAKER G B,JANG W C,et al.Roles of 5-HT on phase transition of neurite outgrowth in the identified serotoninergic neuron C1,Helisoma trivolvis[J].Invertebrate Neuroscience:IN,2018,18(3):10.
[43] BELLIER J P,XIE Y,FAROUK S M,et al.Immunohistochemical and biochemical evidence for the presence of serotonin-containing neurons and nerve fibers in the Octopus arm[J].Brain Structure &Function,2017,222(7):3043-3061.
[44] CANESI L,MIGLIOLI A,BALBI T,et al.Physiological roles of serotonin in bivalves:possible interference by environmental chemicals resulting in neuroendocrine disruption[J].Frontiers in Endocrinology,2022,13:792589.
[45] BARBAS D,ZAPPULLA J P,ANGERS S,et al.Functional characterization of a novel serotonin receptor (5-HTap2) expressed in the CNS of Aplysia californica[J].Journal of Neurochemistry,2002,80:335-345.
[46] FILLA A,HIRIPI L,ELEKES K.Role of aminergic (serotonin and dopamine) systems in the embryogenesis and different embryonic behaviors of the pond snail,Lymnaea stagnalis[J].Comparative Biochemistry and Physiology Toxicology &Pharmacology:CBP,2009,149(1):73-82.
[47] MAPARA S,PARRIES S,QUARRINGTON C,et al.Identification,molecular structure and expression of two cloned serotonin receptors from the pond snail,Helisoma trivolvis[J].The Journal of Experimental Biology,2008,211(Pt 6):900-910.
[48] TANABE T,YUAN Y,NAKAMURA S,et al.The role in spawning of a putative serotonin receptor isolated from the germ and ciliary cells of the gonoduct in the gonad of the Japanese scallop,Patinopecten yessoensis[J].General and Comparative Endocrinology,2010,166(3):620-627.
[49] J KELY G.Global view of the evolution and diversity of metazoan neuropeptide signaling[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(21):8702-8707.
KELY G.Global view of the evolution and diversity of metazoan neuropeptide signaling[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(21):8702-8707.
[50] ZHANG M W,WANG Y F,LI Y P,et al.Identification and characterization of neuropeptides by transcriptome and proteome analyses in a bivalve mollusc Patinopecten yessoensis[J].Frontiers in Genetics,2018,9:197.
[51] LEUNG M,STEFANO G B.Isolation of molluscan opioid peptides[J].Life Sciences,1983,33(sup 1):77-80.
[52] GUO Y,WANG L L,ZHOU Z,et al.An opioid growth factor receptor (OGFR) for[Met5]-enkephalin in Chlamys farreri[J].Fish &Shellfish Immunology,2013,34(5):1228-1235.
[53] LI M J,WANG M,WANG W L,et al.The immunomodulatory function of invertebrate specific neuropeptide FMRFamide in oyster Crassostrea gigas[J].Fish &Shellfish Immunology,2019,88:480-488.
[54] ZHU Y,SUN L L,WU J H,et al.An FMRFamide neuropeptide in cuttlefish Sepia pharaonis:identification,characterization,and potential function[J].Molecules (Basel,Switzerland),2020,25(7):1636.
[55] LI Y,CAO Z H,LI H F,et al.Identification,characterization,and expression analysis of a FMRFamide-like peptide gene in the common Chinese cuttlefish (Sepiella japonica)[J].Molecules (Basel,Switzerland),2018,23(4):742.
[56] CUMMINS S F,TOLLENAERE A,DEGNAN B M,et al.Molecular analysis of two FMRFamide-encoding transcripts expressed during the development of the tropical abalone Haliotis asinina[J].The Journal of Comparative Neurology,2011,519(10):2043-2059.
[57] DUBOS M P,BERNAY B,FAVREL P.Molecular characterization of an adipokinetic hormone-related neuropeptide (AKH) from a mollusk[J].General and Comparative Endocrinology,2017,243:15-21.
[58] STREHL C,BUTTGEREIT F.Unraveling the functions of the membrane-bound glucocorticoid receptors:first clues on origin and functional activity[J].Annals of the New York Academy of Sciences,2014,1318:1-6.
[59] FERNANDES D,LOI B,PORTE C.Biosynthesis and metabolism of steroids in molluscs[J].The Journal of Steroid Biochemistry and Molecular Biology,2011,127(3/4/5):189-195.
[60] BINDER A R D,PFAFFL M W,HILTWEIN F,et al.Does environmental stress affect cortisol biodistribution in freshwater mussels?[J].Conservation Physiology,2019,7(1):coz101.
[61] SHI W,HAN Y,GUAN X F,et al.Fluoxetine suppresses the immune responses of blood clams by reducing haemocyte viability,disturbing signal transduction and imposing physiological stress[J].The Science of the Total Environment,2019,683:681-689.
[62] LAGOS L,HERRERA M,S NCHEZ-LAZO C,et al.Effect of larval stocking density on growth,survival and whole body cortisol of the Mediterranean mussel Mytilus galloprovincialis (Lamarck,1819) larvae reared under laboratory conditions[J].Aquaculture Research,2013,46(7):1-9.
NCHEZ-LAZO C,et al.Effect of larval stocking density on growth,survival and whole body cortisol of the Mediterranean mussel Mytilus galloprovincialis (Lamarck,1819) larvae reared under laboratory conditions[J].Aquaculture Research,2013,46(7):1-9.
[63] 张龙辉,王国栋.无脊椎动物胰岛素样蛋白(Insulin-like/related peptides)研究进展:以昆虫为例[J].生物技术通报,2014(10):33-42.
ZHANG L H,WANG G D.Insulin-like peptides in invertebrates and their signaling pathways—take insects,for example[J].Biotechnology Bulletin,2014(10):33-42.(in Chinese)
[64] CHERIF-FEILDEL M,HEUDE-BERTHELIN C,ADELINE B,et al.Molecular evolution and functional characterisation of insulin related peptides in molluscs:contributions of Crassostrea gigas genomic and transcriptomic-wide screening[J].General and Comparative Endocrinology,2019,271:15-29.
[65] N SSEL D R,LIU Y T,LUO J N.Insulin/IGF signaling and its regulation in Drosophila[J].General and Comparative Endocrinology,2015,221:255-266.
SSEL D R,LIU Y T,LUO J N.Insulin/IGF signaling and its regulation in Drosophila[J].General and Comparative Endocrinology,2015,221:255-266.
[66] ROOVERS E,VINCENT M E,VAN KESTEREN E,et al.Characterization of a putative molluscan insulin-related peptide receptor[J].Gene,1995,162(2):181-188.
[67] GRICOURT L,MATHIEU M,KELLNER K.An insulin-like system involved in the control of Pacific oyster Crassostrea gigas reproduction:hrIGF-1 effect on germinal cell proliferation and maturation associated with expression of an homologous insulin receptor-related receptor[J].Aquaculture,2006,251(1):85-98.
[68] XU F,MARL TAZ F,GAVRIOUCHKINA D,et al.Evidence from oyster suggests an ancient role for Pdx in regulating insulin gene expression in animals[J].Nature Communications,2021,12(1):3117.
TAZ F,GAVRIOUCHKINA D,et al.Evidence from oyster suggests an ancient role for Pdx in regulating insulin gene expression in animals[J].Nature Communications,2021,12(1):3117.
[69] BILBO S D,KLEIN S L.Special issue:the neuroendocrine-immune axis in health and disease[J].Hormones and Behavior,2012,62(3):187-190.
[70] LIU Z Q,WANG L L,ZHOU Z,et al.Transcriptomic analysis of oyster Crassostrea gigas larvae illustrates the response patterns regulated by catecholaminergic system upon acute heat and bacterial stress[J].Developmental and Comparative Immunology,2017,73:52-60.
[71] JIANG Q F,ZHOU Z,WANG L L,et al.Mutual modulation between norepinephrine and nitric oxide in haemocytes during the mollusc immune response[J].Scientific Reports,2014,4:6963.
[72] REARDON C,MURRAY K,LOMAX A E.Neuroimmune communication in health and disease[J].Physiological Reviews,2018,98(4):2287-2316.
[73] WANG F X,LI S H,XIANG J H,et al.Transcriptome analysis reveals the activation of neuroendocrine-immune system in shrimp hemocytes at the early stage of WSSV infection[J].BMC Genomics,2019,20(1):247.
[74] MALHAM S K,LACOSTE A,G L
L BART F,et al.Evidence for a direct link between stress and immunity in the mollusc Haliotis tuberculata[J].Journal of Experimental Zoology Part A:Comparative Experimental Biology,2003,295(2):136-144.
BART F,et al.Evidence for a direct link between stress and immunity in the mollusc Haliotis tuberculata[J].Journal of Experimental Zoology Part A:Comparative Experimental Biology,2003,295(2):136-144.
[75] DU X Y,TANG Y,HAN Y,et al.Acetylcholine suppresses phagocytosis via binding to muscarinic- and nicotinic-acetylcholine receptors and subsequently interfering Ca2+- and NFκB-signaling pathways in blood clam[J].Fish &Shellfish Immunology,2020,102:152-160.
[76] LIU Z Q,ZHOU Z,JIANG Q F,et al.The neuroendocrine immunomodulatory axis-like pathway mediated by circulating haemocytes in Pacific oyster Crassostrea gigas[J].Open Biology,2017,7(1):160289.
[77] ZHOU Z,WANG L L,SHI X W,et al.The modulation of catecholamines to the immune response against bacteria Vibrio anguillarum challenge in scallop Chlamys farreri[J].Fish &Shellfish Immunology,2011,31(6):1065-1071.
[78] WEST P K,VIENGKHOU B,CAMPBELL I L,et al.Microglia responses to interleukin-6 and type I interferons in neuroinflammatory disease[J].Glia,2019,67(10):1821-1841.
[79] HUANG X Q,REN L Y,HOU L B,et al.Paeoniflorin ameliorates antipsychotic-induced hyperprolactinemia in rats by attenuating impairment of the dopamine D2 receptor and TGF-β1 signaling pathways in the hypothalamus and pituitary[J].Journal of Ethnopharmacology,2020,257:112862.
[80] WONG M L,BONGIORNO P B,RETTORI V,et al.Interleukin (IL) 1beta,IL-1 receptor antagonist,IL-10,and IL-13 gene expression in the central nervous system and anterior pituitary during systemic inflammation:pathophysiological implications[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(1):227-232.
[81] ROCHFORT K D,CUMMINS P M.The blood-brain barrier endothelium:a target for pro-inflammatory cytokines[J].Biochemical Society Transactions,2015,43(4):702-706.
[82] KUNZ-EBRECHT S R,MOHAMED-ALI V,FELDMAN P J,et al.Cortisol responses to mild psychological stress are inversely associated with proinflammatory cytokines[J].Brain,Behavior,and Immunity,2003,17(5):373-383.
[83] M NARD C,PFAU M L,HODES G E,et al.Immune and neuroendocrine mechanisms of stress vulnerability and resilience[J].Neuropsychopharmacology,2017,42:62-80.
NARD C,PFAU M L,HODES G E,et al.Immune and neuroendocrine mechanisms of stress vulnerability and resilience[J].Neuropsychopharmacology,2017,42:62-80.