铜藻Sargassum horneri为马尾藻属海洋植物,别名柱囊马尾藻、海柳麦、草茜、竹茜菜等[1]。铜藻是来自北太平洋西部地区的一种暖温性海藻,在中国主要分布于浙江、福建、辽宁和广东等沿海地区。铜藻富含藻胶、褐藻聚糖硫酸酯、纤维素、半纤维素和矿物质等,具有较高的营养和生态价值[2],是构成潮下带海藻场的重要种类之一,也是海洋生物(贝类、鱼类)的重要繁育藻场[3]。铜藻提取物不仅具有促进骨质形成及抑制骨吸收的功能,还具有抗辐射、抗过敏、抗菌等生物学活性。铜藻因其营养丰富,许多研究者和相关企业将其开发成方便食品,如朱亚珠[4]研究制作了铜藻罐头,在日本将铜藻通过加热煮沸的方式食用和销售[5]。还有研究者开始关注铜藻中的褐藻聚糖硫酸酯(fucoidan)。研究发现,褐藻中的褐藻聚糖硫酸酯具有降血糖、抗凝血、抗病毒、调节免疫和保肝护肝等多种生物活性[6],铜藻多糖能显著抑制氧自由基的氧化作用,也可用于烟草保润或化妆品等领域[7]。
目前,对铜藻研究主要集中在资源调查及其形态学、人工繁殖等方面,而对其开发利用的研究尚处于初级阶段[8-9]。许多学者开展了从马尾藻属分离的褐藻聚糖硫酸酯的抗氧化和抗肿瘤活性研究[10-11],但对其生物活性研究较少。因此,开展铜藻褐藻多糖生物活性的研究对其开发利用具有重要意义。本研究中,以铜藻为原料提取分离褐藻聚糖硫酸酯粗多糖,通过阴离子交换柱进行分离纯化,对粗品及各纯化组分的单糖组成及结构特征进行分析,并通过建立动物模型,进行了各组分的保肝护肝作用的小鼠灌胃试验,以期为铜藻的高效综合利用提供科学依据。
1 材料与方法
1.1 材料
原料:铜藻褐藻聚糖硫酸酯粗品采用酶解结合的热水浸提法提取,由大连海洋大学国家海藻加工技术研发分中心提供。
试验动物:180只SPF级BALA/C小鼠(体质量20.0 g±2.0 g),由大连医科大学SPF实验动物中心提供(动物生产许可证号:SYXK-2013-0006)。
试剂:DEAE-Sepharose Fast Flow 为 Pharmacia 进口分装;标准糖购于Sigma公司;谷丙转氨酶(ALT)、谷草转氨酶(AST)、丙二醛(MDA)和超氧化物歧化酶(SOD)测定试剂盒均购自北京索莱宝生物科技有限公司;谷胱甘肽过氧化物酶(GSH-Px)、肿瘤坏死因子(TNF-α)试剂盒均购自生工生物工程(上海)股份有限公司;联苯双脂购自北京协和药厂;其他试剂均为分析纯。
仪器设备:主要有安捷伦1260型高效液相色谱仪(美国Agilent公司)和 Nicolet-470型红外光谱仪(美国Nicolet公司)。
1.2 方法
1.2.1 铜藻褐藻聚糖硫酸酯的分离纯化 准确称量铜藻褐藻聚糖硫酸酯粗品(TF)0.4 g,将其溶解于20 mL浓度为0.02 mol/L的磷酸盐缓冲溶液(pH 7.4)中,采用DEAE-Sepharose Fast Flow阴离子交换柱对粗品TF进行分离纯化,分别用浓度为0~2.5 mol/L的NaCl溶液进行梯度洗脱,利用自动收集器对其纯化后的组分进行收集,设定洗脱条件为0.75 mol/L,每管溶液3 mL。纯化得到的4个组分分别记为TF1、TF2、TF3和TF4,用苯酚-硫酸法测定其总糖含量,以洗脱体积为横坐标绘制洗脱曲线,然后对其进行反复收集、透析、冷冻干燥,密封保存,并计算各组分的回收率。通过明胶-BaCl2法测定各组分的硫酸根含量。
1.2.2 高效液相色谱法测定单糖组成 样品水解:分别称取20 mg TF、TF1、TF2、TF3、TF4置于溶胀瓶中,加入1.5 mL超纯水溶胀过夜,再加入1.5 mL TFA溶液,放入105 ℃烘箱中水解6 h后,4 ℃下放置12 h,用4 mol/L NaOH调节水解液pH至中性,取上清液避光保存备用。采用PMP甲醇溶液进行衍生,然后用0.45 μm的水系膜进行过滤,再用高效液相色谱法(HPLC)进行分析。
色谱条件:Agilent ZORBAX Eclipse XDB C-18色谱柱(5 μm,4.6 mm×250 mm),柱温为30 ℃,流速为1 mL/min,检测波长为250 nm,进样体积为20 μL;流动相A为15%乙腈(体积分数)+50 mmol/L KH2PO4(pH 6.0),流动相B为40%乙腈(体积分数)+50 mmol/L KH2PO4(pH 6.0);流动相梯度洗脱流程为 0 min 100%A→10 min 85%A→55 min 50%A→65 min 100%A。
1.2.3 傅里叶红外光谱分析 准确称量2 mg TF、TF1、TF2、TF3、TF4,加入溴化钾后压制成透明均匀的薄片。使用Nicolet型红外光谱仪扫描4 000~400 cm-1波长范围内的吸收值。
1.2.4 铜藻褐藻聚糖硫酸酯对小鼠肝损伤的保护作用试验 将180只SPF级BALA/C小鼠随机分成18组,每组10只。连续10 d给小鼠饲喂基础饲料,空白对照组、模型组、阳性组,以及铜藻褐藻聚糖硫酸酯各组分低、中、高剂量组的小鼠每天按表1设定的剂量进行灌胃,连续灌胃7 d。末次灌胃结束后 2 h,空白对照组腹腔注射植物油,其余每组均按 10 mL/kg(体质量)腹腔注射含体积分数为0.2% CCl4的植物油溶液。禁食24 h后,摘除眼球取血,静置0.5 h,以3 000 r/min离心15 min,取上清液即为血清样本。之后快速处死小鼠,解剖取出肝脏,固定在体积分数为10%中性福尔马林溶液中。在肝左叶组织取约0.3 g,放入冰冷的生理盐水中漂洗,滤纸拭干,用组织匀浆器制成质量分数10%的肝组织匀浆即为肝组织样本。
表1 动物分组及饲喂剂量
Tab.1 Mice grouping and feeding dose
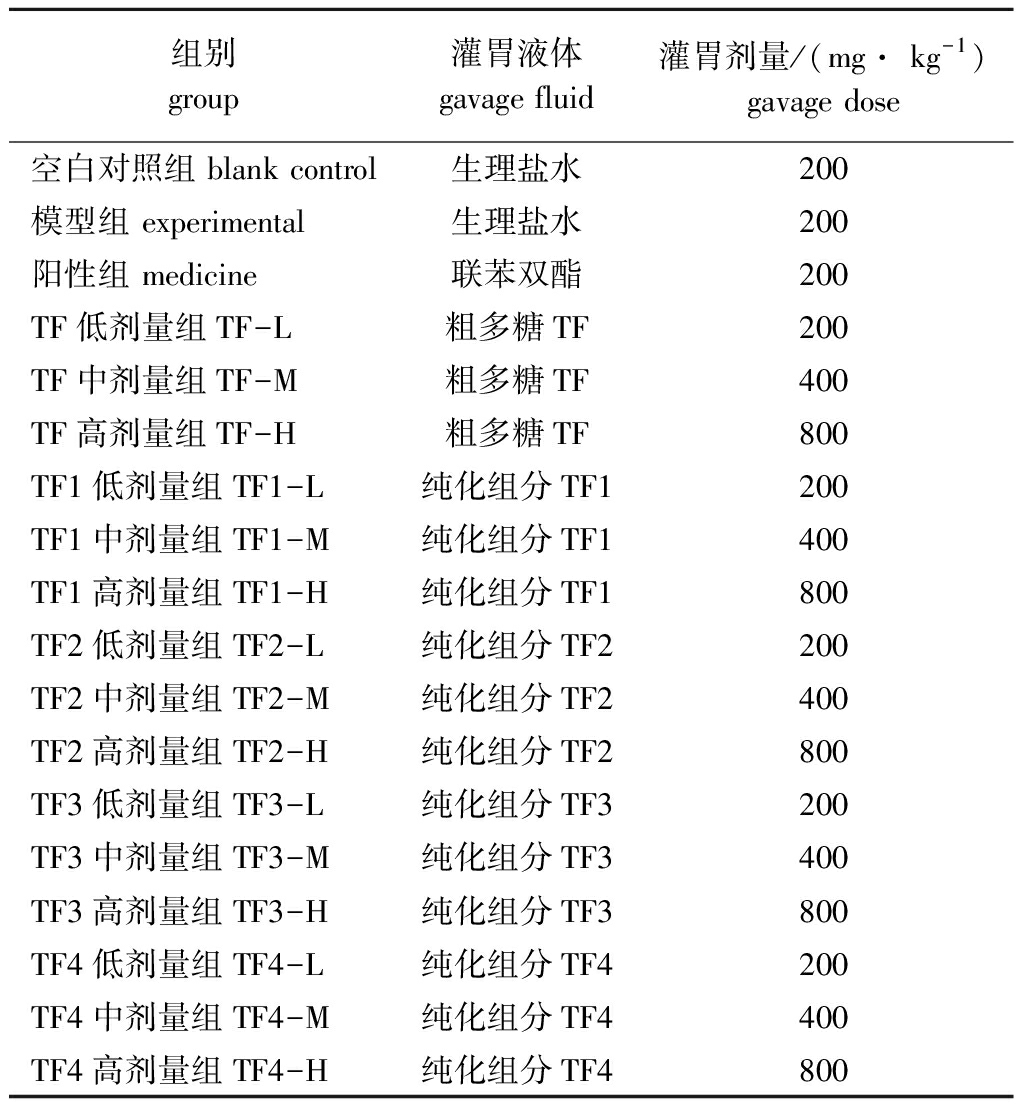
组别 group灌胃液体 gavage fluid 灌胃剂量/(mg· kg-1) gavage dose空白对照组 blank control生理盐水200模型组 experimental生理盐水200阳性组 medicine联苯双酯200TF低剂量组TF-L粗多糖TF200TF中剂量组TF-M粗多糖TF400 TF高剂量组TF-H粗多糖TF800 TF1低剂量组TF1-L纯化组分TF1200 TF1中剂量组TF1-M纯化组分TF1400TF1高剂量组TF1-H纯化组分TF1800TF2低剂量组TF2-L纯化组分TF2200 TF2中剂量组TF2-M纯化组分TF2400 TF2高剂量组TF2-H纯化组分TF2800 TF3低剂量组TF3-L纯化组分TF3200 TF3中剂量组TF3-M纯化组分TF3400TF3高剂量组TF3-H纯化组分TF3800 TF4低剂量组TF4-L纯化组分TF4200 TF4中剂量组TF4-M纯化组分TF4400 TF4高剂量组TF4-H纯化组分TF4800
用试剂盒测定小鼠血清中的TNF-α、ALT、AST活力,以及肝组织中的MDA含量、GSH-Px、SOD活力。
1.2.5 肝组织切片观察 取出固定在福尔马林溶液中的肝组织,选出具有代表性的肝脏组织,切下相同位置和大小的组织,用石蜡包埋切片,用苏木精-伊红(H.E)染色,于光学显微镜下进行病理学观察。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示。采用SPSS 17.0软件进行单因素方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 铜藻褐藻聚糖硫酸酯的分离纯化
铜藻褐藻聚糖硫酸酯粗品经阴离子交换柱分离纯化,得到4个纯化组分TF1、TF2、TF3、TF4,其中TF1、TF2为流出峰,TF3、TF4为洗脱峰,且4个纯化组分均无拖尾现象(图1)。收集4个纯化组分透析,然后冷冻干燥备用。4个纯化组分的化学组成如表2所示,其中,TF2的总糖含量最高(37.97%),TF3中硫酸根含量最高(14.51%)。
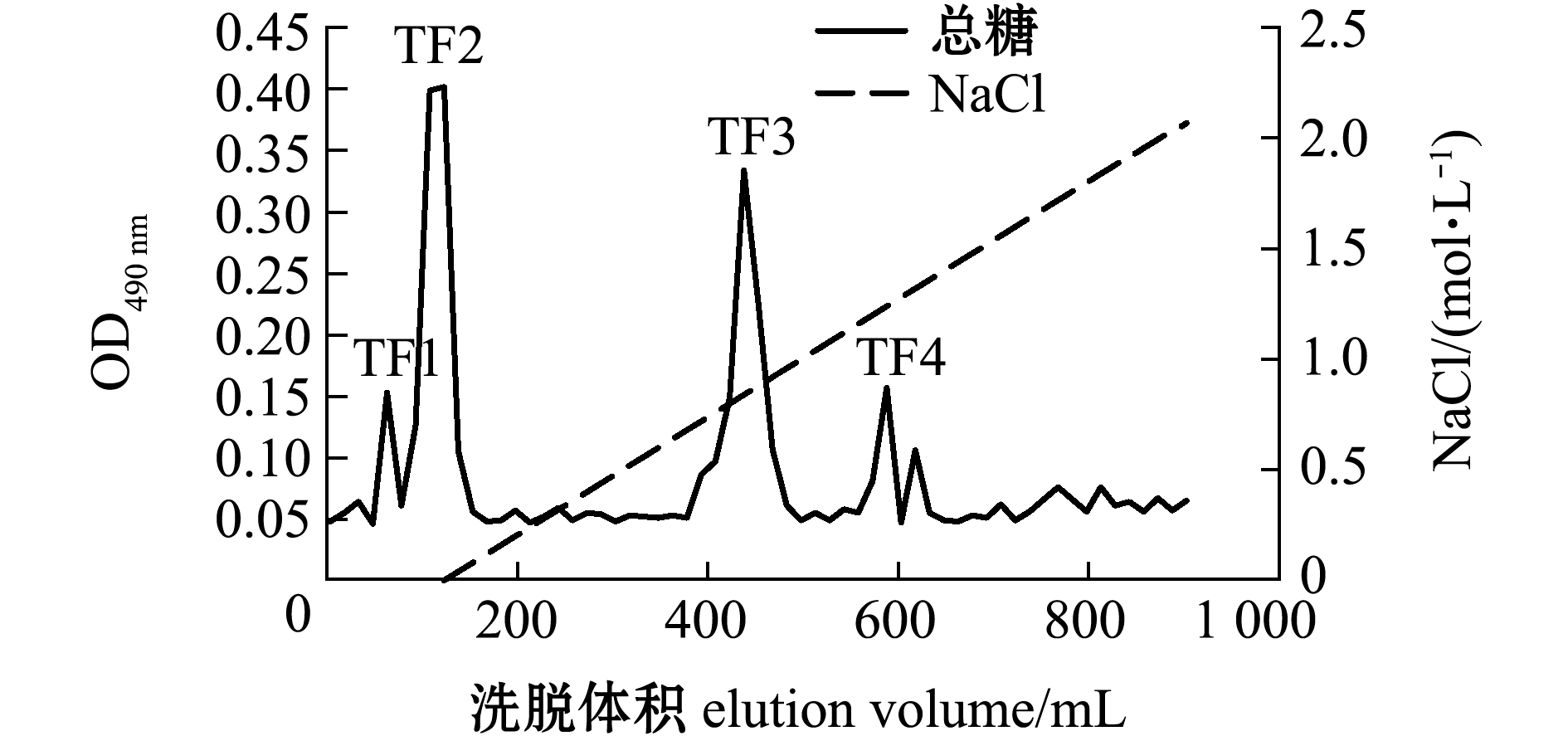
图1 铜藻褐藻聚糖硫酸酯分离纯化梯度洗脱曲线
Fig.1 Gradient elution curve of fucoidan from seaweed Sargassum horneri
2.2 铜藻褐藻聚糖硫酸酯各组分的单糖组成分析
单糖的相对量是通过HPLC对标准单糖和测定单糖的PMP衍生物相对应的摩尔吸光度值(mAU)来确定。TF及其4个纯化组分的HPLC分析及单糖组成如图2、表2所示。从图2和表2可见:铜藻TF主要由岩藻糖(Fuc)、葡萄糖(Glu)、甘露糖(Man)和半乳糖(Gal)组成,其中,岩藻糖含量最高(30.81%),其次为Glu、Man、Gal(分别为29.91%、15.05%、13.68%);4个纯化组分的单糖组成含量差异较大,TF1中Man含量最高(73.23%),其次为Fuc含量(18.94%),TF2中Fuc含量最高(33.17%),其次为Gal含量(28.30%),TF3中Fuc含量最高(32.74%),其次为Glu含量(7.48%),TF4中Fuc含量最高(41.95%),其次为Gal、Man(分别为27.96%、12.94%)。TF单糖组成的HPLC色谱图(图2(a))显示,甘露糖左右两侧分别出现两个未知峰,这两个未知峰可能是甘露糖的同分异构体。
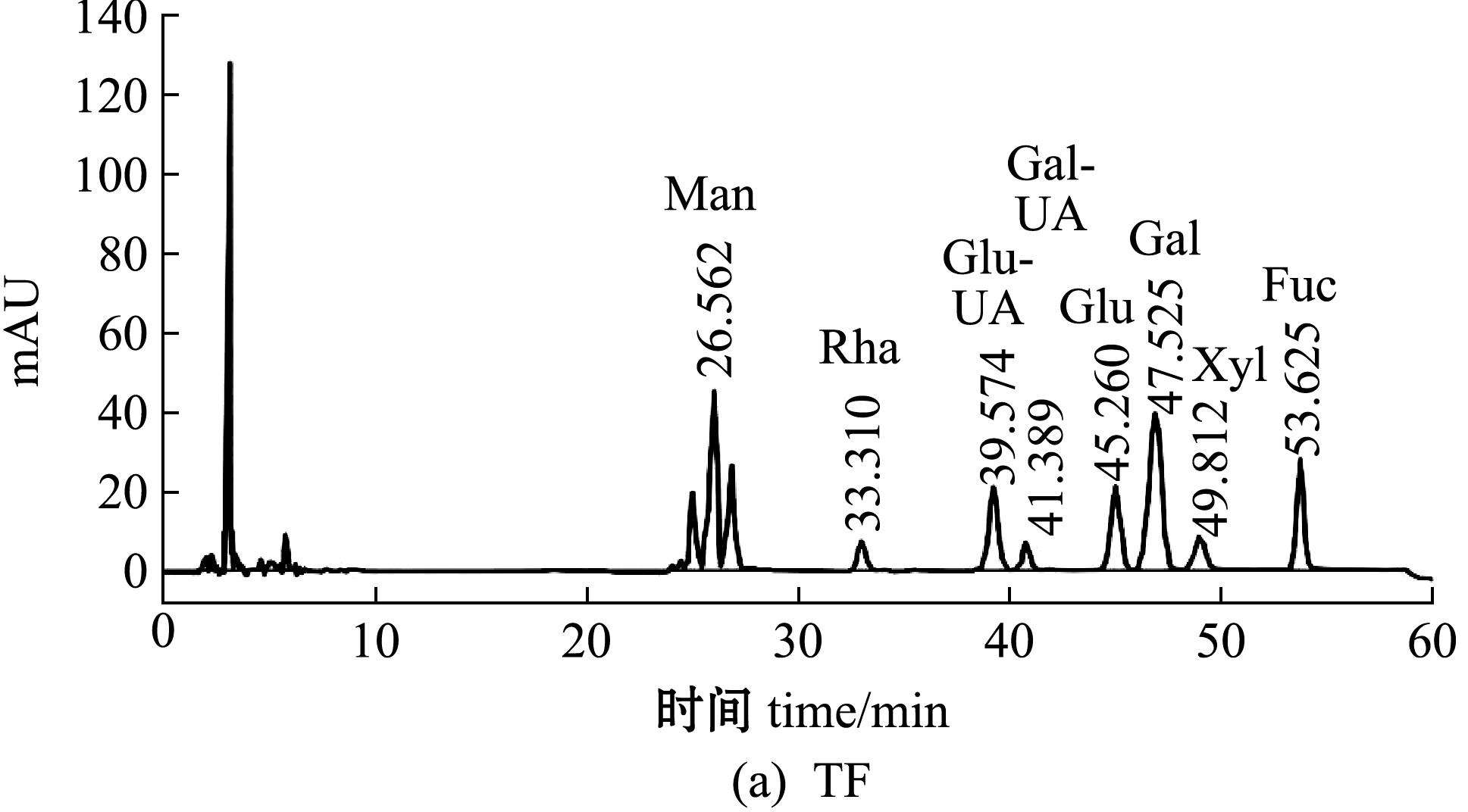
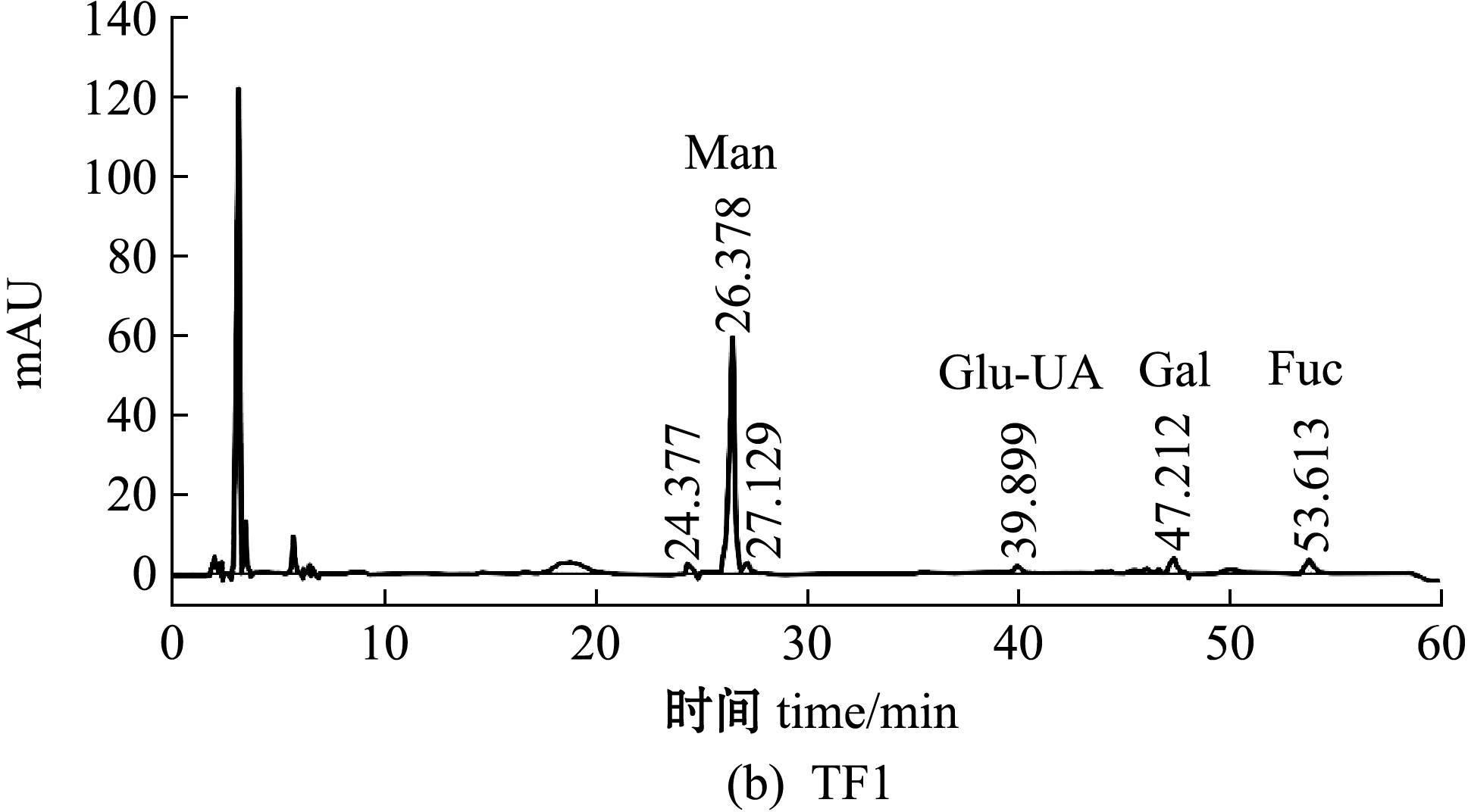
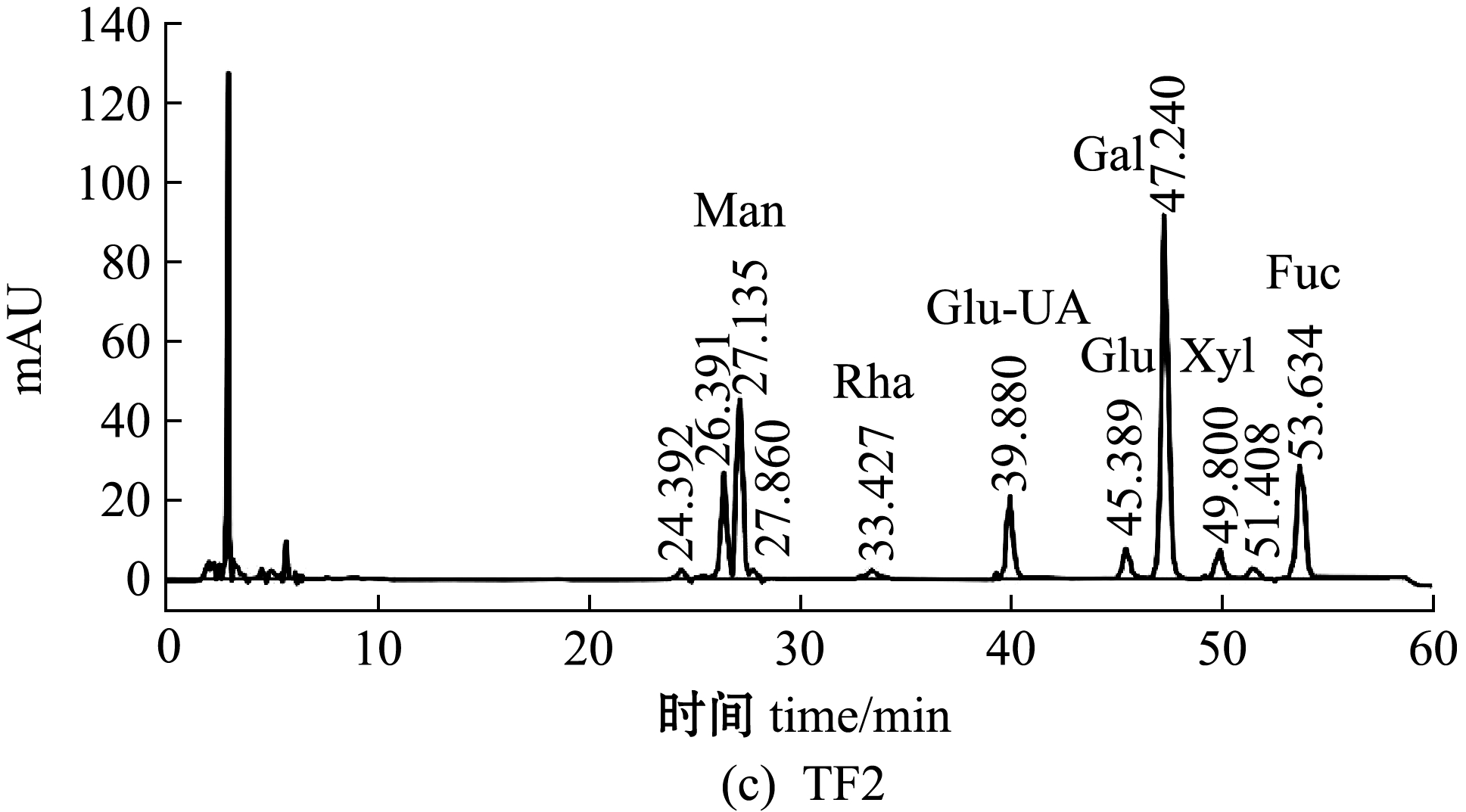
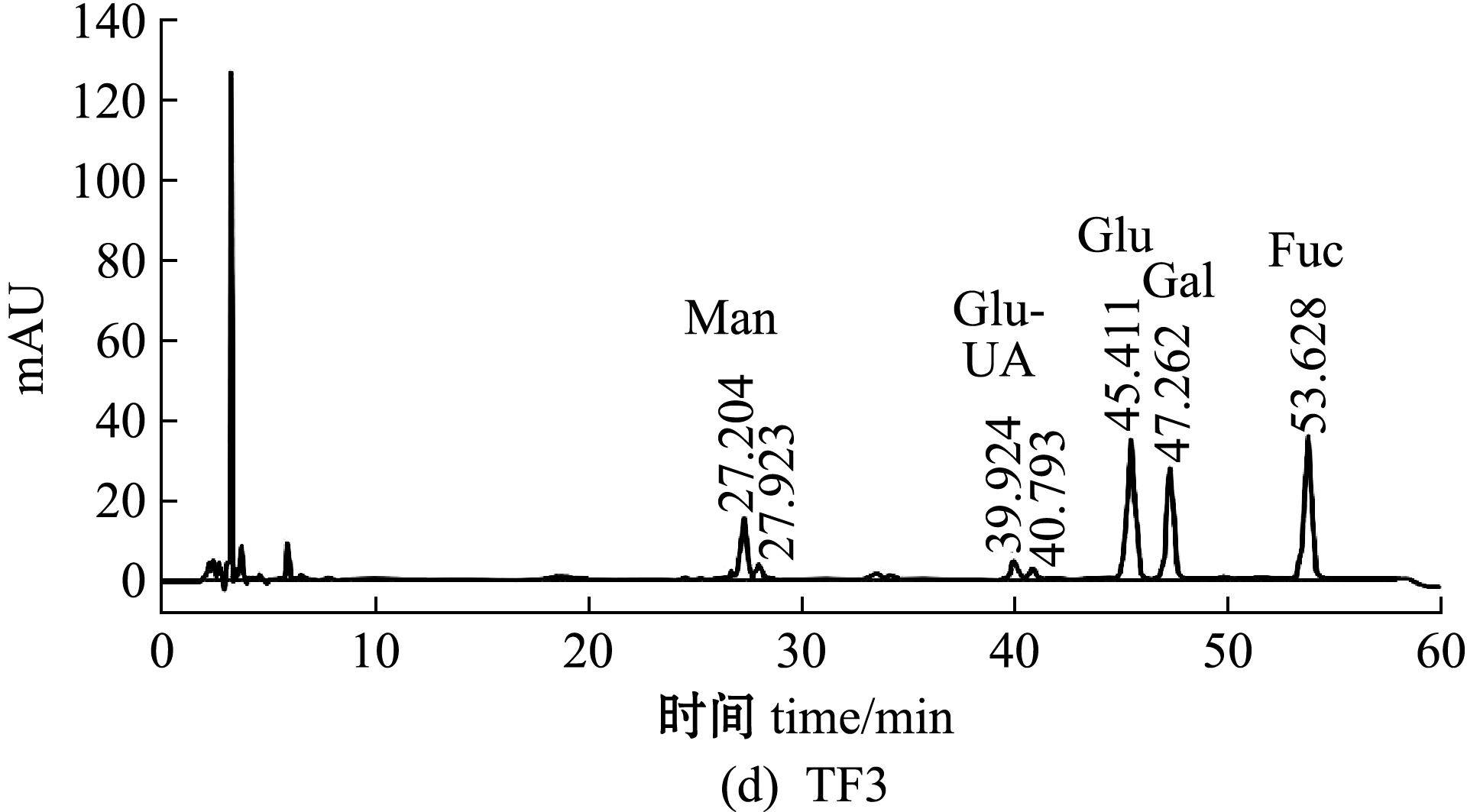
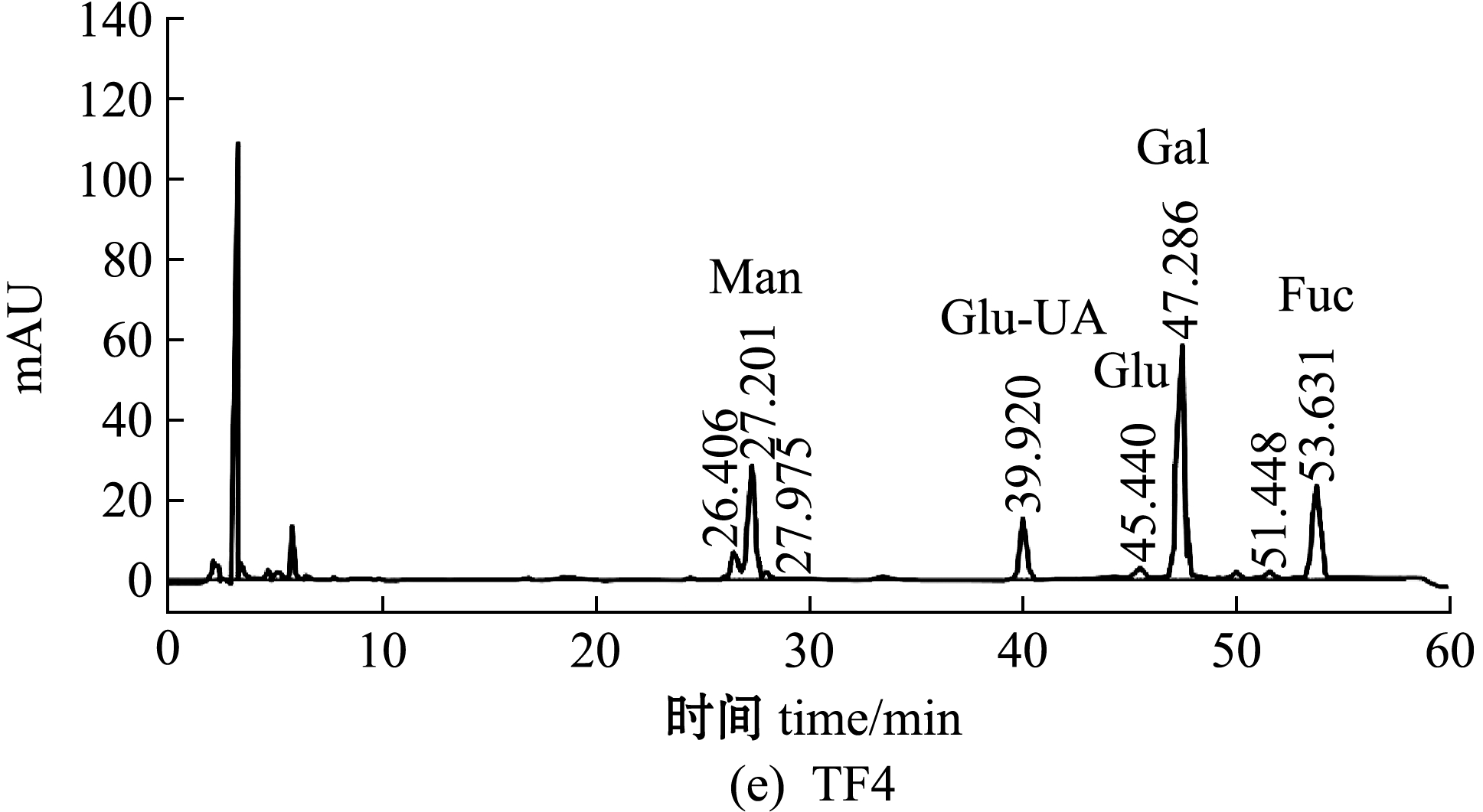
图2 铜藻褐藻聚糖硫酸酯及其分离纯化组分单糖组成的HPLC分析
Fig.2 Monosaccharide composition analysis of TF,TF1,TF2,TF3 and TF4 by HPLC
表2 褐藻聚糖硫酸酯各组分的理化性质及其单糖组成
Tab.2 Physicochemical properties and monosaccharide composition of different fucoidan fractions %
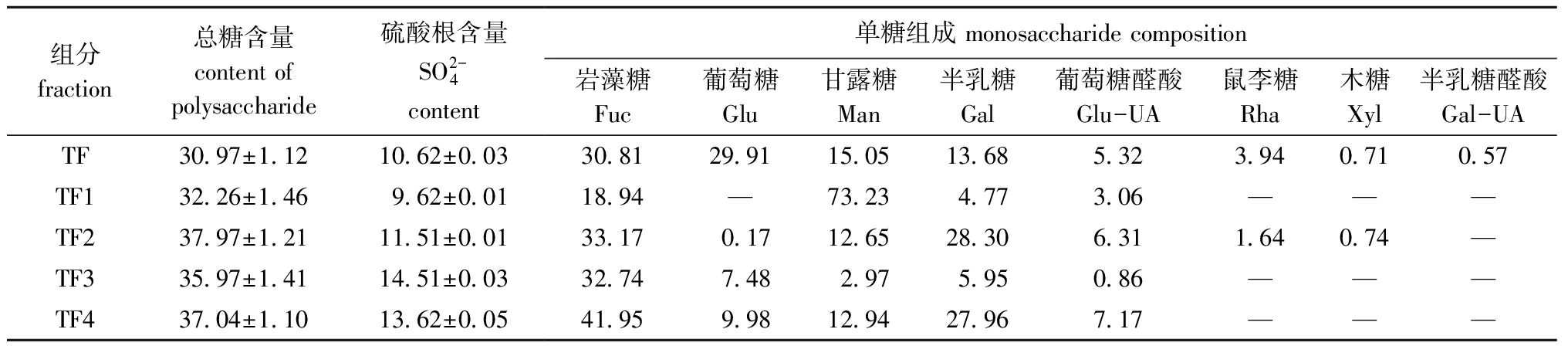
组分fraction总糖含量content ofpolysaccharide硫酸根含量SO2-4content单糖组成 monosaccharide composition岩藻糖Fuc葡萄糖Glu甘露糖Man半乳糖Gal葡萄糖醛酸Glu-UA鼠李糖Rha木糖Xyl半乳糖醛酸Gal-UATF30.97±1.1210.62±0.0330.8129.9115.0513.685.323.940.710.57TF132.26±1.469.62±0.0118.94—73.234.773.06———TF237.97±1.2111.51±0.0133.170.1712.6528.306.311.640.74—TF335.97±1.4114.51±0.0332.747.482.975.950.86———TF437.04±1.1013.62±0.0541.959.9812.9427.967.17———
注:—表示未检出。
Note:—means undetected.
2.3 铜藻褐藻聚糖硫酸酯各组分的红外光谱分析
铜藻褐藻聚糖硫酸酯及其分离纯化组分的红外光谱图分析(图3)显示:在3 404~3 449 cm-1附近出现吸收峰,应为糖类共有O-H伸缩振动;在2 921~2 936 cm-1附近出现的振动应为C-H伸缩振动;在1 619~1 633 cm-1附近为酰胺基 N-H 变角震动;在1 250 cm-1附近出现强吸收峰,为S=O(硫酸基)的吸收峰,证明粗品及纯化的4个组分均含有硫酸基;在1 039 cm-1附近均有吸收峰,是由C-O-C中的C-O伸缩振动和C-O-H变角振动引起的吸收。TF、TF3、TF4图谱中分别在827、819、830 cm-1处有吸收峰,说明是C-O-S伸缩振动,这表明TF、TF3、TF4的硫酸基主要连接于Fuc的C-2或C-3位置,TF1、TF2图谱中分别在838、836 cm-1处也有C-O-S的伸缩振动,说明二者的硫酸基主要连接于Fuc的C-4位置。
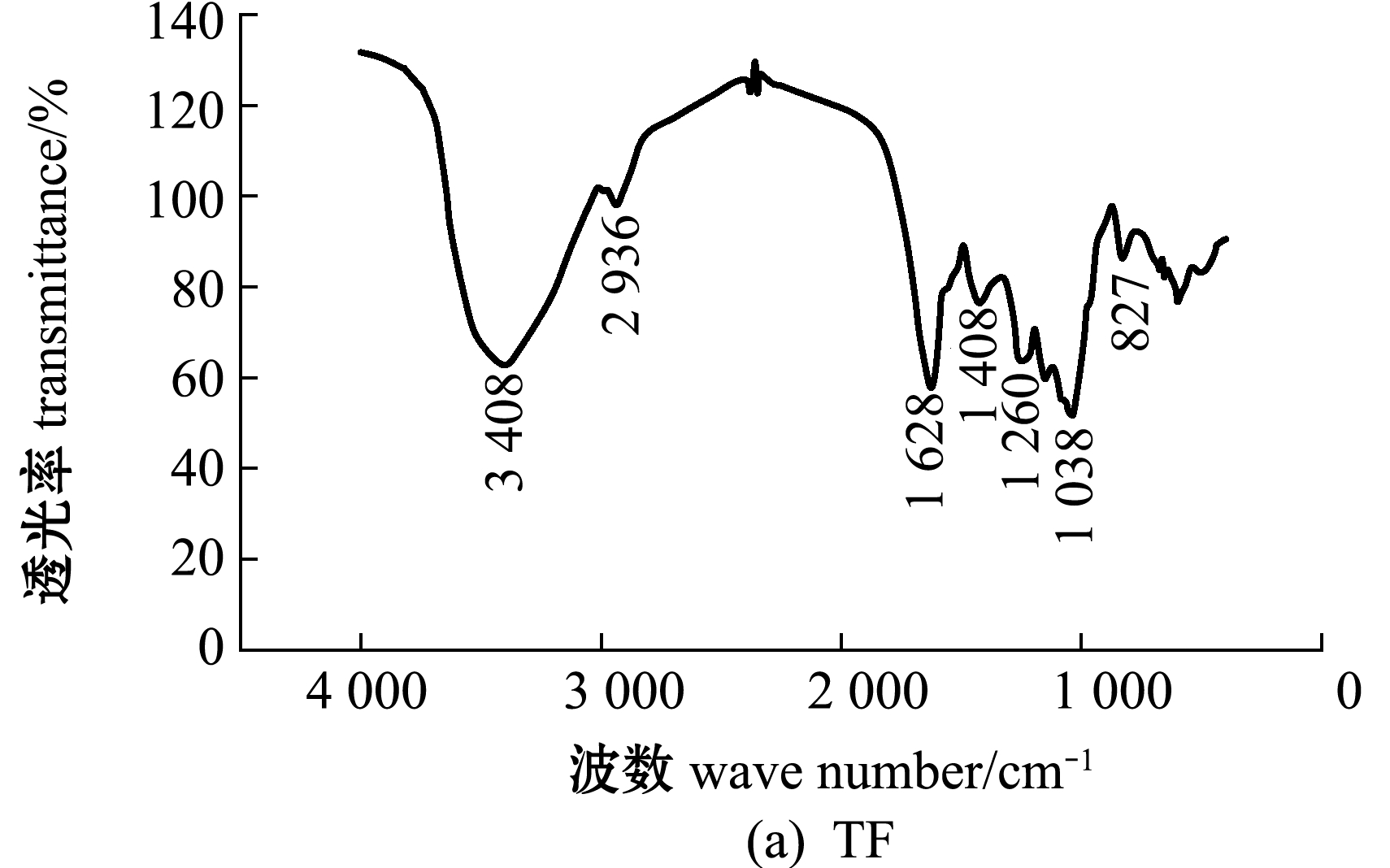
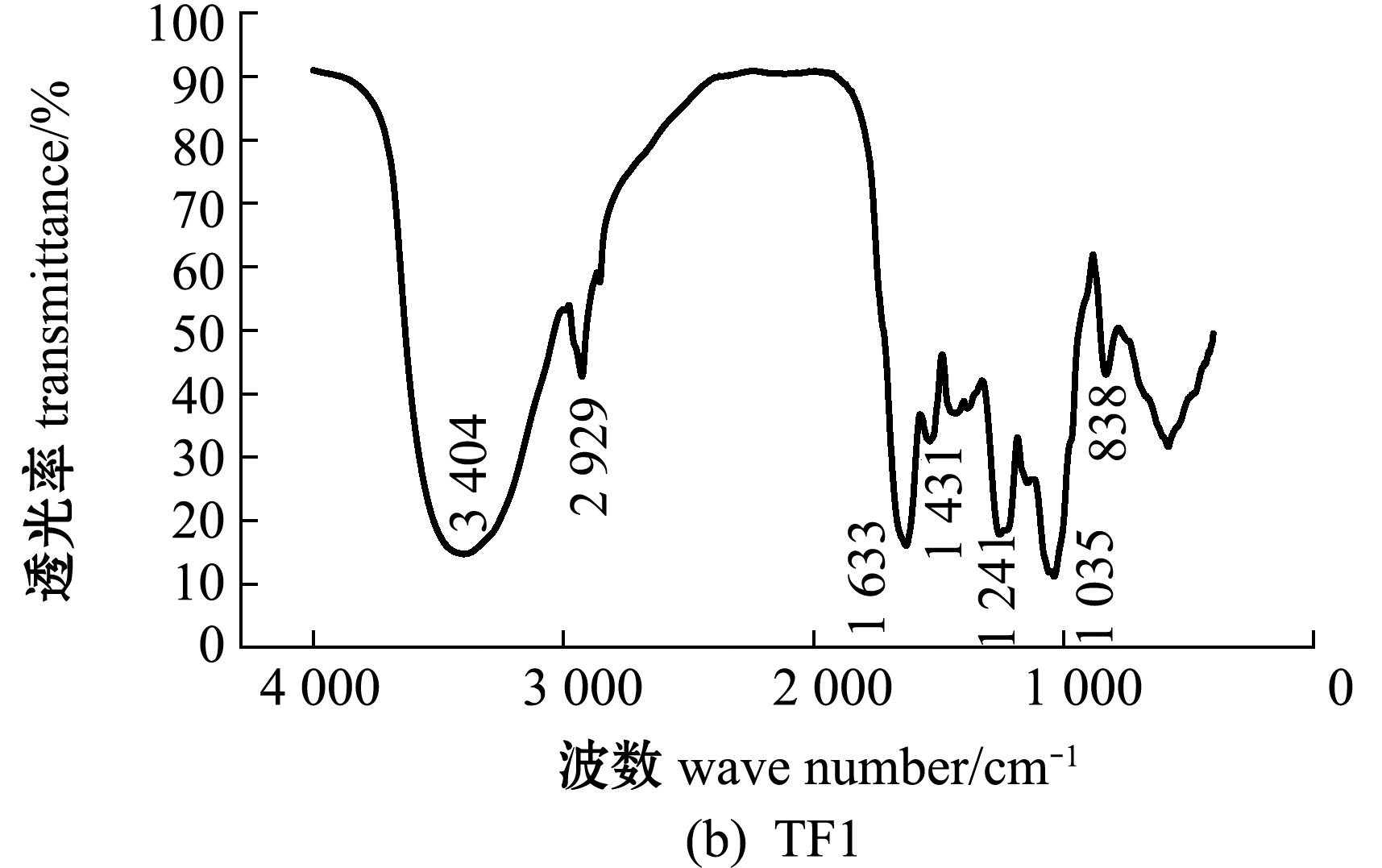
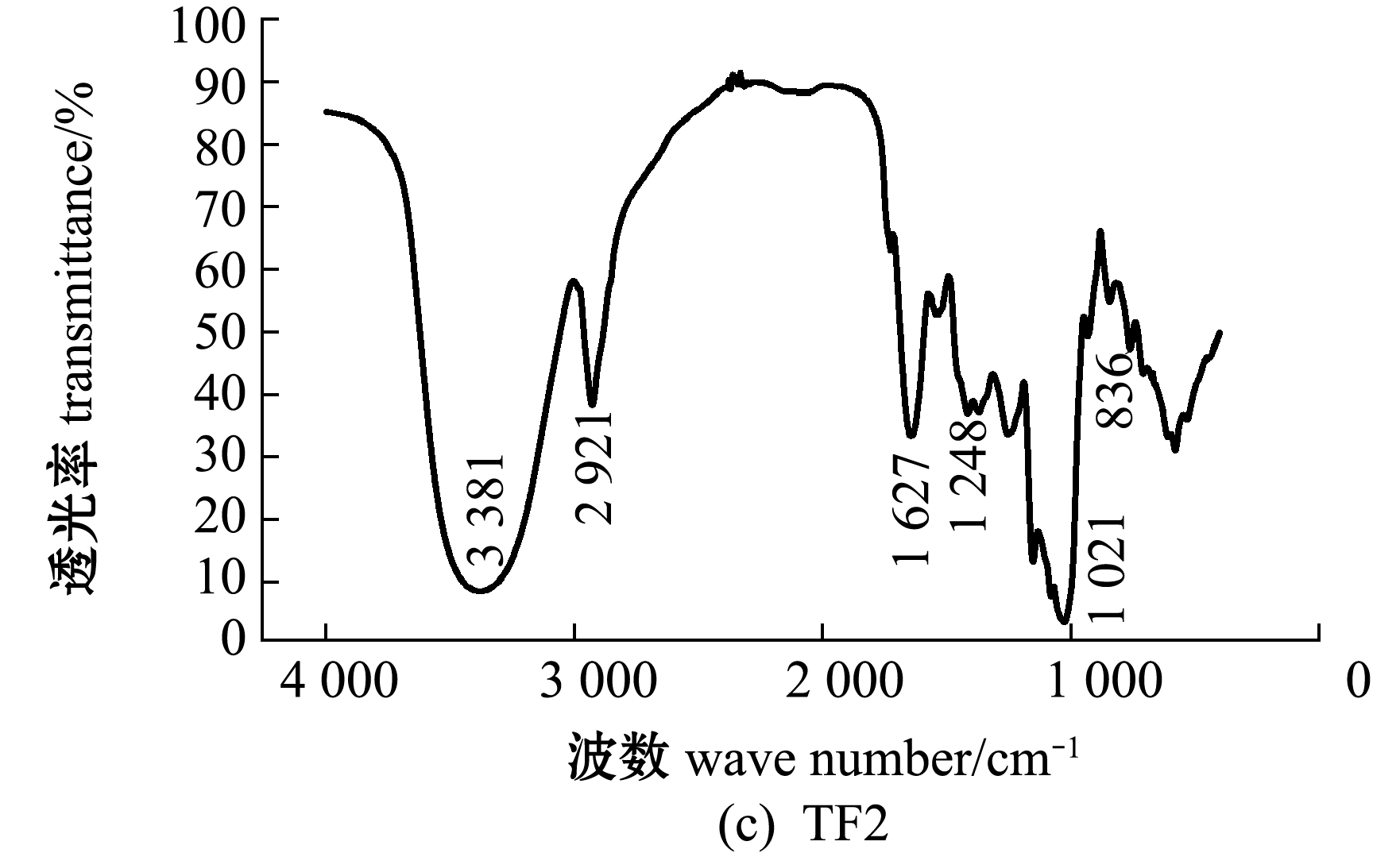
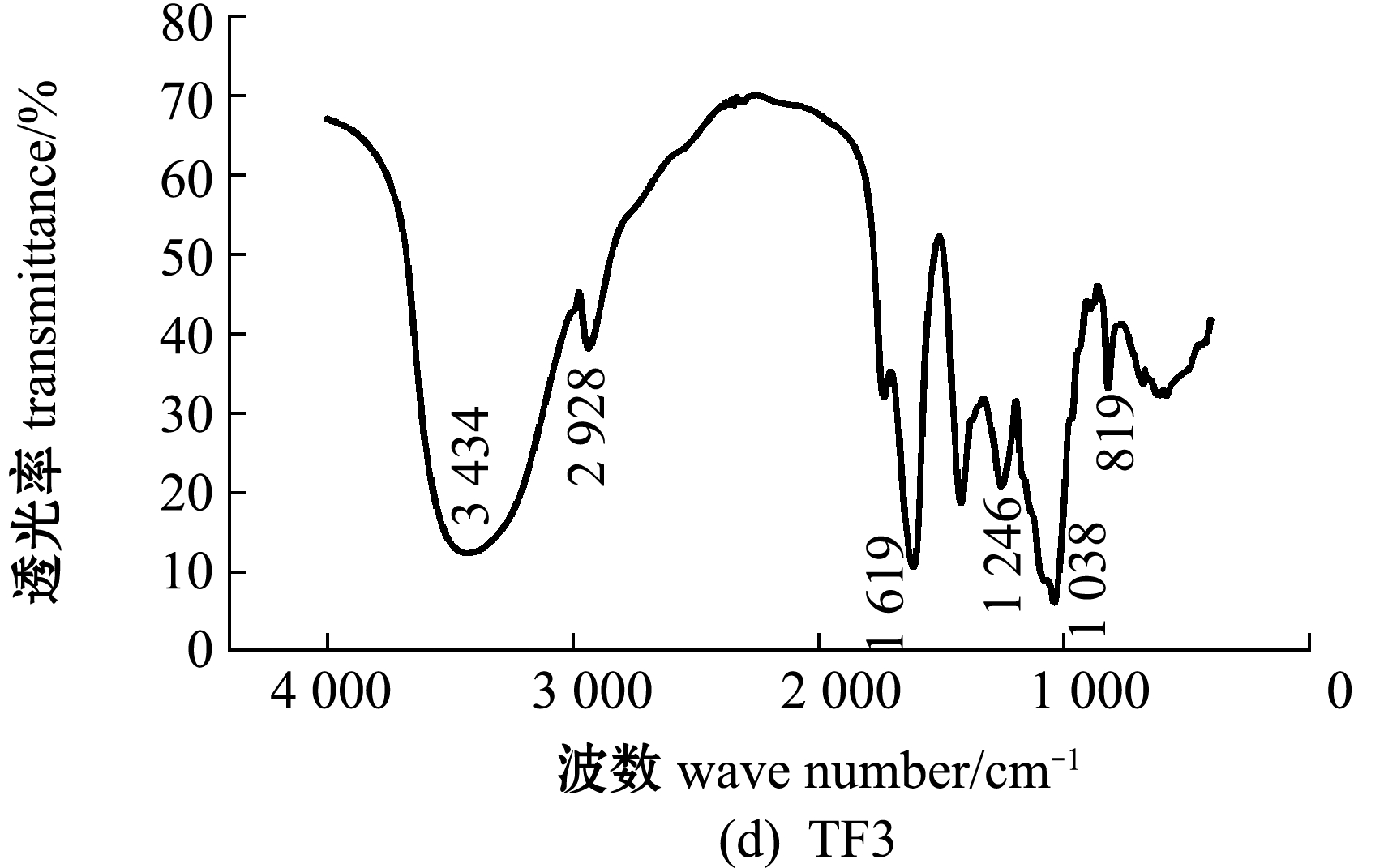
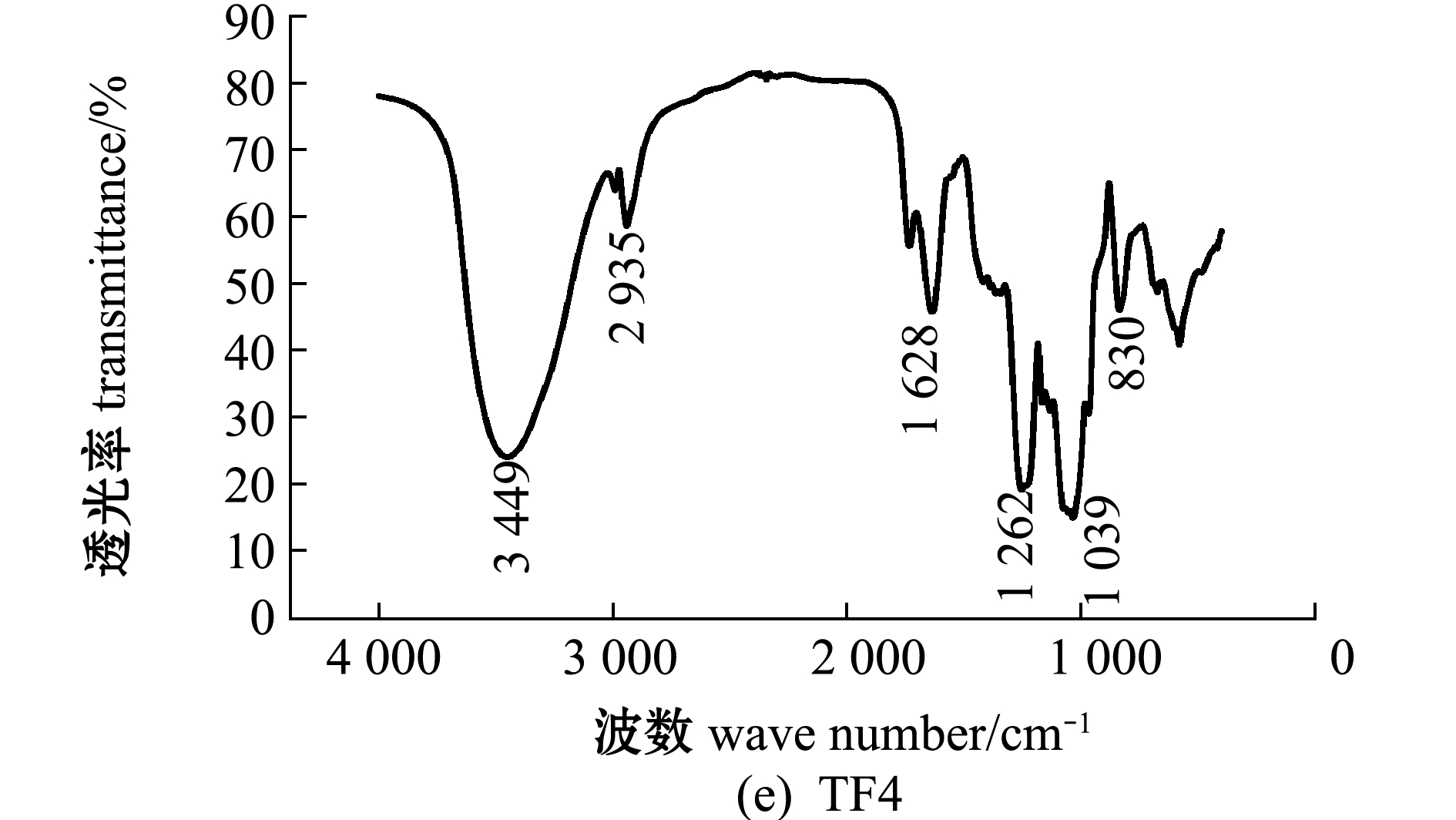
图3 铜藻褐藻聚糖硫酸酯及其分离纯化组分结构的红外光谱分析
Fig.3 Structural analysis of TF,TF1,TF2,TF3 and TF4 by IR
2.4 铜藻褐藻聚糖硫酸酯对小鼠脏器指标的影响
从表3可见:与空白组相比,模型组的脾脏指数、肝脏指数极显著升高(P<0.01);灌胃不同剂量的铜藻褐藻聚糖硫酸酯一周后,各组小鼠的脾脏指数、肝脏指数均较模型组有不同程度的降低,相较于模型组,灌胃褐藻聚糖硫酸酯各剂量的TF和TF3组分均能极显著抑制小鼠脾脏指数的升高(P<0.01),不同剂量的各组分均能极显著抑制肝脏指数的升高(除TF4中剂量组外)(P<0.01)。
表3 铜藻褐藻聚糖硫酸酯对小鼠脏器指数的影响
Tab.3 Effects of fucoidan on the organ index of mice
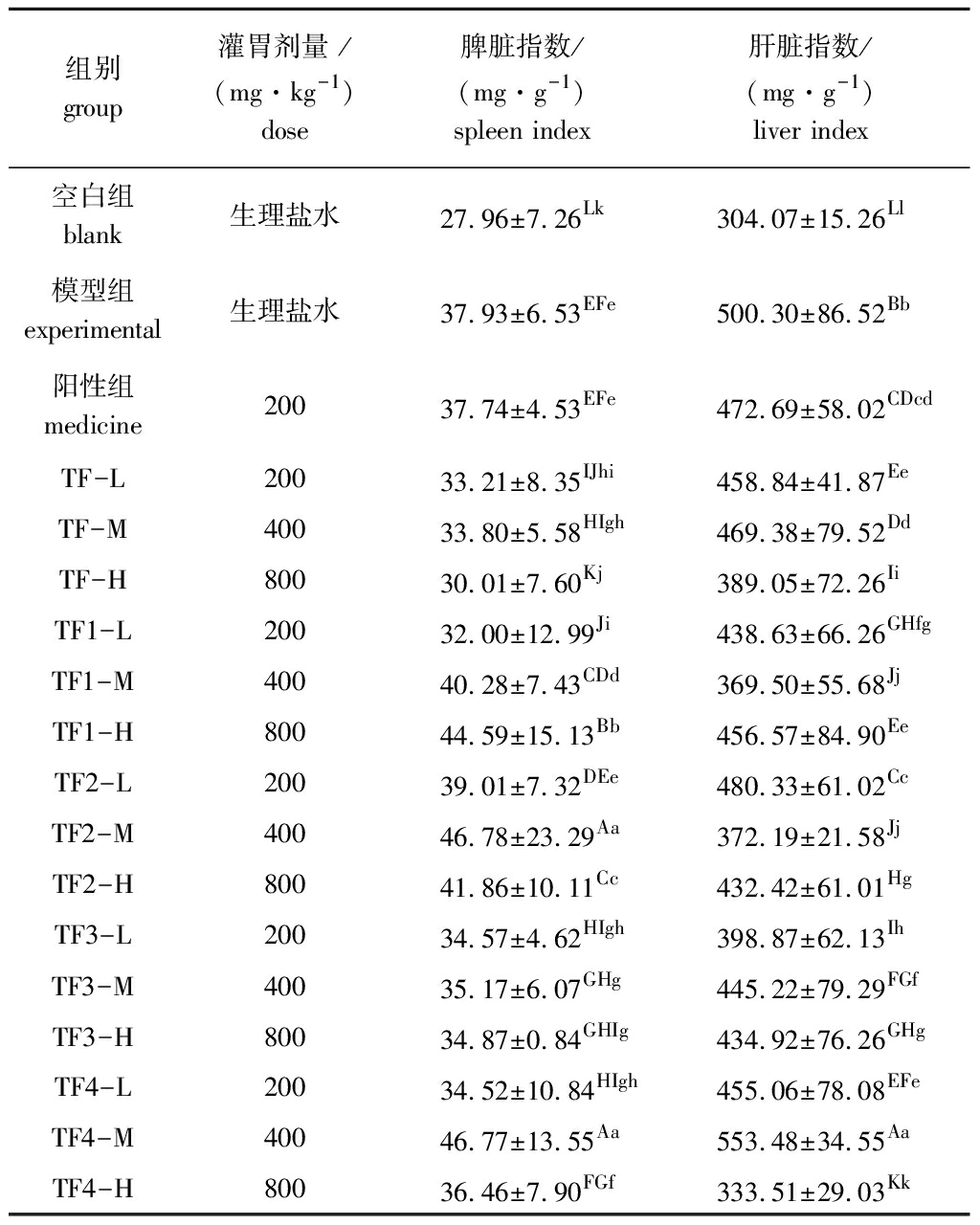
组别 group灌胃剂量 /(mg·kg-1)dose脾脏指数/(mg·g-1) spleen index肝脏指数/(mg·g-1) liver index空白组blank 生理盐水27.96±7.26Lk304.07±15.26Ll模型组experimental生理盐水37.93±6.53EFe500.30±86.52Bb阳性组medicine20037.74±4.53EFe472.69±58.02CDcdTF-L200 33.21±8.35IJhi458.84±41.87EeTF-M400 33.80±5.58HIgh469.38±79.52DdTF-H800 30.01±7.60Kj389.05±72.26IiTF1-L20032.00±12.99Ji438.63±66.26GHfgTF1-M400 40.28±7.43CDd369.50±55.68JjTF1-H800 44.59±15.13Bb456.57±84.90EeTF2-L200 39.01±7.32DEe480.33±61.02CcTF2-M400 46.78±23.29Aa372.19±21.58JjTF2-H800 41.86±10.11Cc432.42±61.01HgTF3-L200 34.57±4.62HIgh398.87±62.13IhTF3-M400 35.17±6.07GHg445.22±79.29FGfTF3-H800 34.87±0.84GHIg434.92±76.26GHgTF4-L200 34.52±10.84HIgh455.06±78.08EFeTF4-M400 46.77±13.55Aa553.48±34.55AaTF4-H800 36.46±7.90FGf333.51±29.03Kk
注:同列中标有不同大写字母者表示组间有极显著性差异(P < 0.01);标有不同小写字母者表示组间有显著性差异(P<0.05);标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different capital letters within the same column are very significantly different at the 0.01 probability level, means with different letters being significantly different at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
2.5 铜藻褐藻聚糖硫酸酯对小鼠肝组织生化指标的影响
从表4可见:与空白组相比,模型组小鼠肝组织MDA含量极显著升高(P<0.01),SOD、GSH-Px活力极显著降低(P<0.01);相较于模型组,联苯双酯阳性组MDA含量极显著降低(P<0.01),SOD和GSH-Px活力极显著升高(P<0.01),说明肝损伤造模成功;相较于模型组,灌胃褐藻聚糖硫酸酯各组分均极显著降低了MDA含量(P<0.01),显著或极显著提高了SOD和GSH-Px活力(除TF3低剂量组GSH-Px外)(P<0.05或P<0.01)。
表4 铜藻褐藻聚糖硫酸酯对小鼠肝脏组织MDA、SOD、GSH-Px活力的影响
Tab.4 Effects of fucoidan on MDA content and SOD and GSH-Px activities of mice liver
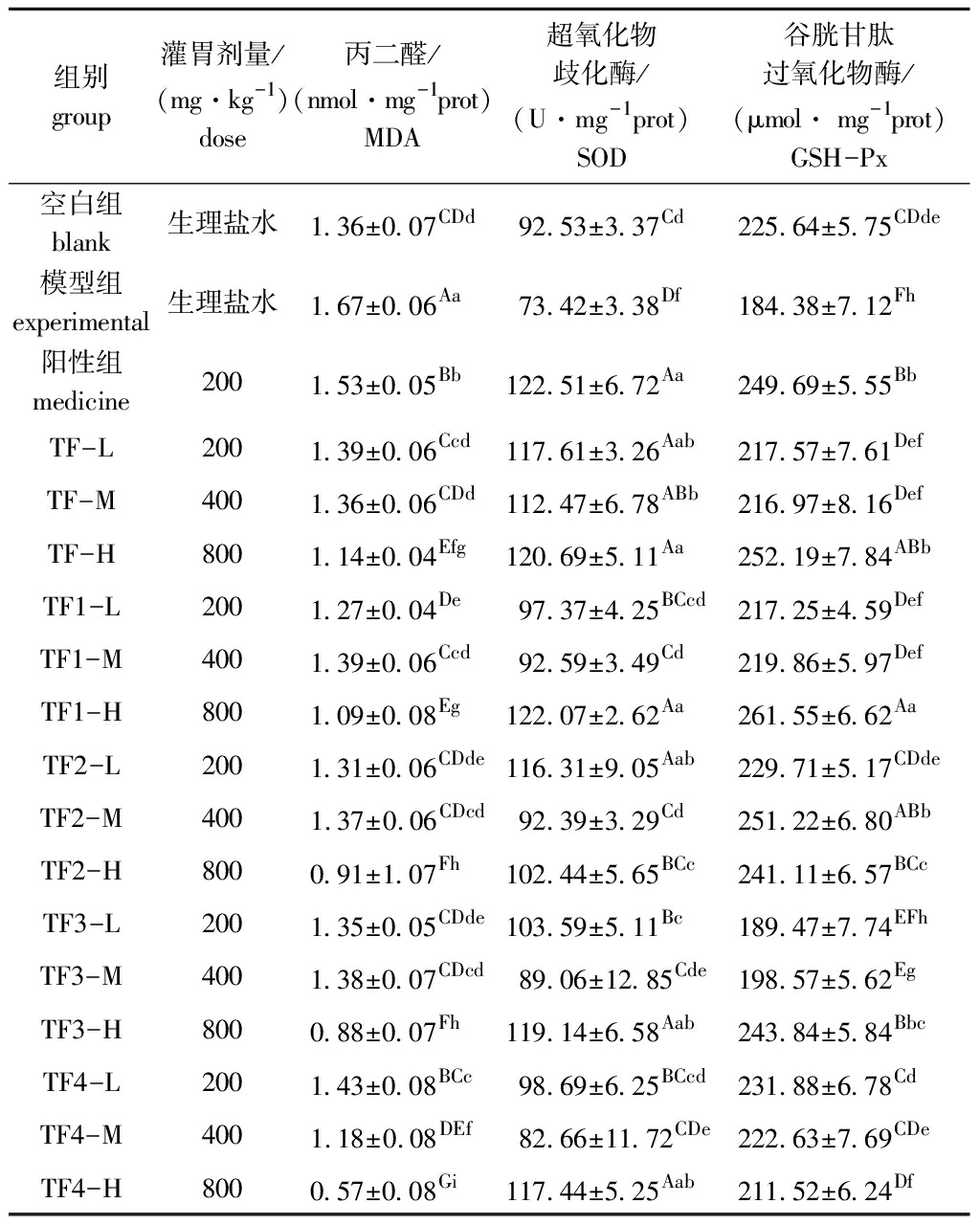
组别group灌胃剂量/(mg·kg-1)dose丙二醛/(nmol·mg-1prot)MDA超氧化物歧化酶/(U·mg-1prot)SOD谷胱甘肽过氧化物酶/(μmol· mg-1prot)GSH-Px空白组 blank生理盐水1.36±0.07CDd92.53±3.37 Cd225.64±5.75CDde模型组 experimental生理盐水1.67±0.06Aa73.42±3.38Df184.38±7.12 Fh阳性组 medicine2001.53±0.05Bb122.51±6.72 Aa249.69±5.55BbTF-L2001.39±0.06Ccd117.61±3.26Aab217.57±7.61 DefTF-M4001.36±0.06CDd112.47±6.78ABb216.97±8.16 DefTF-H8001.14±0.04Efg120.69±5.11Aa252.19±7.84ABbTF1-L2001.27±0.04De97.37±4.25 BCcd217.25±4.59DefTF1-M4001.39±0.06Ccd92.59±3.49Cd219.86±5.97DefTF1-H8001.09±0.08Eg122.07±2.62 Aa261.55±6.62AaTF2-L2001.31±0.06CDde116.31±9.05Aab229.71±5.17 CDdeTF2-M4001.37±0.06CDcd92.39±3.29Cd251.22±6.80ABbTF2-H8000.91±1.07Fh102.44±5.65 BCc241.11±6.57BCcTF3-L2001.35±0.05CDde103.59±5.11 Bc189.47±7.74EFhTF3-M4001.38±0.07CDcd89.06±12.85 Cde198.57±5.62 EgTF3-H8000.88±0.07Fh119.14±6.58 Aab243.84±5.84 BbcTF4-L2001.43±0.08BCc98.69±6.25BCcd231.88±6.78 CdTF4-M4001.18±0.08DEf82.66±11.72CDe222.63±7.69CDeTF4-H8000.57±0.08Gi117.44±5.25 Aab211.52±6.24 Df
2.6 铜藻褐藻聚糖硫酸酯对小鼠血清免疫指标的影响
从表5可见:与空白组相比,模型组小鼠血清TNF-α活力极显著降低(P<0.01),而AST、ALT活力极显著升高(P<0.01);相较于模型组,联苯双酯阳性药物组AST、ALT活力极显著降低(P<0.01),TNF-α活力极显著升高(P<0.01),这进一步说明肝损伤造模成功;相比于模型组,灌胃褐藻聚糖硫酸酯各组分均极显著提高了TNF-α活力(除TF4低剂量组外,P<0.01),极显著降低了AST、ALT活力(P<0.01)。
表5 铜藻褐藻聚糖硫酸酯对小鼠血清免疫指标的影响
Tab.5 Effects of fucoidan from the seaweed on serum immune indices in mice
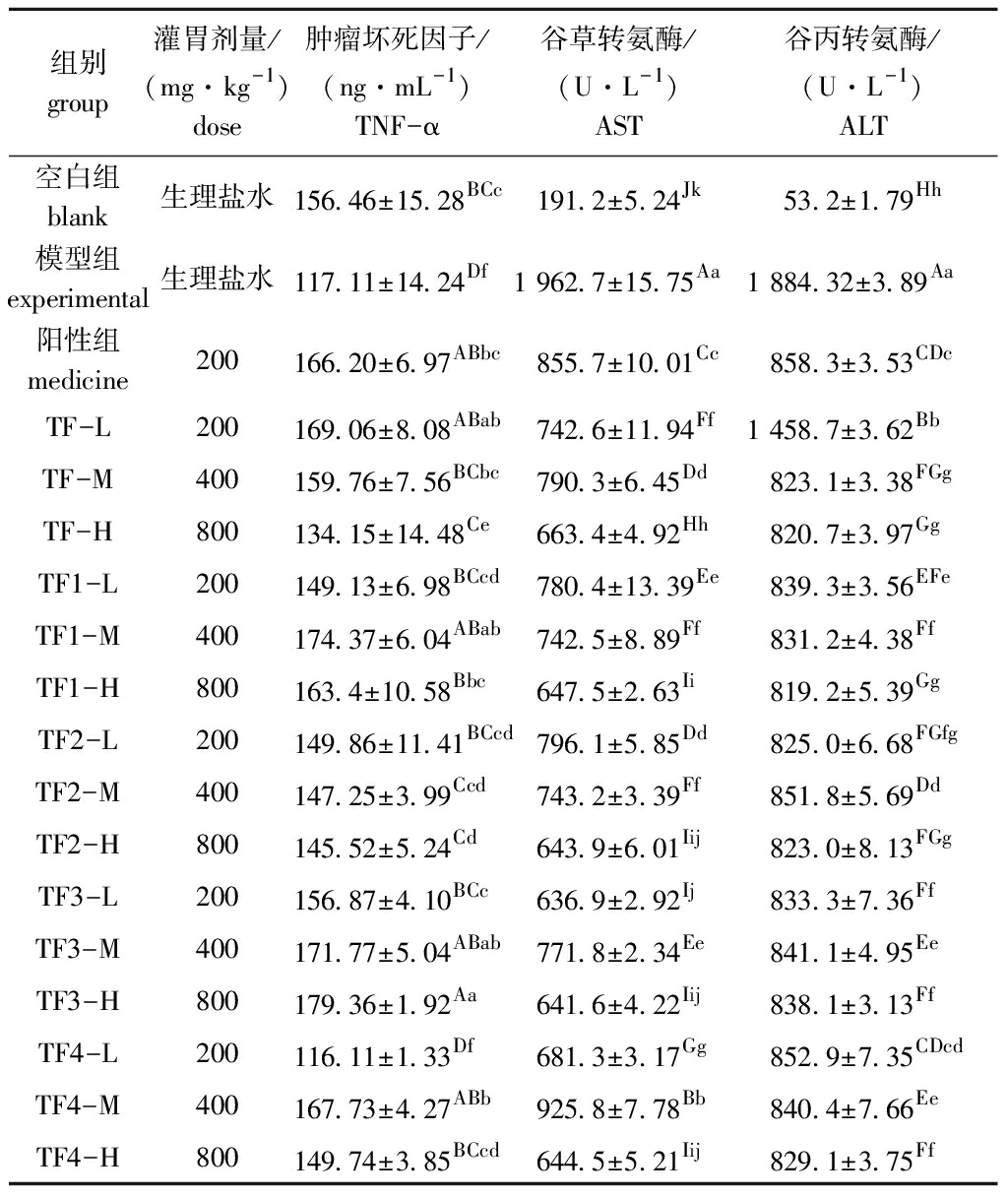
组别group灌胃剂量/(mg·kg-1)dose肿瘤坏死因子/(ng·mL-1)TNF-α谷草转氨酶/(U·L-1)AST谷丙转氨酶/(U·L-1)ALT空白组blank生理盐水156.46±15.28BCc191.2±5.24Jk53.2±1.79Hh模型组experimental生理盐水117.11±14.24Df1 962.7±15.75Aa1 884.32±3.89Aa阳性组medicine200166.20±6.97ABbc855.7±10.01 Cc858.3±3.53CDcTF-L200169.06±8.08ABab742.6±11.94Ff1 458.7±3.62 BbTF-M400159.76±7.56BCbc790.3±6.45Dd823.1±3.38FGgTF-H800134.15±14.48Ce663.4±4.92Hh820.7±3.97GgTF1-L200149.13±6.98BCcd780.4±13.39Ee839.3±3.56 EFeTF1-M400174.37±6.04ABab742.5±8.89Ff831.2±4.38FfTF1-H800163.4±10.58Bbc647.5±2.63Ii819.2±5.39GgTF2-L200149.86±11.41BCcd796.1±5.85Dd825.0±6.68FGfgTF2-M400147.25±3.99 Ccd743.2±3.39Ff851.8±5.69 DdTF2-H800145.52±5.24 Cd643.9±6.01Iij823.0±8.13FGgTF3-L200156.87±4.10 BCc636.9±2.92 Ij833.3±7.36FfTF3-M400171.77±5.04 ABab771.8±2.34Ee841.1±4.95EeTF3-H800179.36±1.92 Aa641.6±4.22 Iij838.1±3.13 FfTF4-L200116.11±1.33Df681.3±3.17 Gg852.9±7.35 CDcdTF4-M400167.73±4.27ABb925.8±7.78 Bb840.4±7.66EeTF4-H800149.74±3.85 BCcd644.5±5.21Iij829.1±3.75 Ff
2.7 肝组织切片观察
在光镜(×400)下,小鼠正常组织肝小叶结构清晰(图4A),肝细胞索状排列规则,肝细胞结构及形态正常。而CCl4模型组小鼠肝细胞发生肿胀现象(图4 B),肝细胞索紊乱,细胞界限不清,有气球样变细胞,并伴有炎症细胞浸润现象,这说明小鼠肝脏受到损坏,表明造模成功。与模型组相比,TF、TF1、TF2、TF3、TF4低中高剂量组均不同程度降低了对肝组织的损伤(图4D~R),肝细胞病变程度明显减轻,TF1高剂量组少数区域明显可见碎片状坏死,坏死灶周边可见少量双核再生肝细胞。从组织切片观察形态来看,铜藻褐藻聚糖硫酸酯对小鼠肝损伤具有显著地保护作用。

A为空白组;B为模型组;C为阳性组;D、E、F为TF低、中、高剂量组;G、H、I 为TF1低、中、高剂量组;J、K、L 为TF2低、中、高剂量组;M、N、O 为TF3低、中、高剂量组;P、Q、R 为TF4低、中、高剂量组。
A, blank control group; B,experimental group; C, medicine group; D, E and F,low,medium and high dose groups of TF,respectively; G, H and I, low,medium and high dose groups of TF1,respectively; J, K and L, low,medium and high dose groups of TF2,respectively; M, N and O, low,medium and high dose groups of TF3,respectively; P, Q and R, low,medium and high dose groups of TF4,respectively.
图4 各组小鼠肝组织切片的对比
Fig.4 Comparison of H.E sections of liver tissues of mice in different experimental groups
3 讨论
3.1 铜藻褐藻聚糖硫酸酯的分离纯化
本研究中,采用DEAE-Sepharose Fast Flow阴离子交换柱,从铜藻褐藻聚糖硫酸酯粗品中分离纯化得到4个组分TF1、TF2、TF3、TF4。张玉等[12]采用质量分数为2% 的CaCl2溶液提取铜藻粗多糖,经由DEAE-Sephrose Fast Flow分离纯化得到铜藻多糖4个组分SF1~SF4;陈晓晓[13]利用酶解法将铜藻多糖进行修饰,并将酶解产物同样用阴离子交换柱分离纯化也得到4个组分。上述研究分离纯化组分数量均与本研究中结果一致。刘丽佳等[14]使用水提法、超声法、酶解法优化提取铜藻粗多糖,对铜藻粗多糖进行分离纯化得到3个组分;李伟[15]采用醇沉法得到铜藻粗多糖,通过阴离子交换柱层析与分子筛凝胶柱层析结合纯化铜藻粗多糖,获得2个主要组分。上述研究分离纯化组分数量与本研究结果有一定差异,可能是粗多糖提取方法不同,导致分离结果不同。
3.2 铜藻褐藻聚糖硫酸酯的结构组成特征
本研究表明,铜藻粗多糖及3个纯化组分TF2、TF3、TF4中单糖组成主要是岩藻糖,而TF1中单糖组成主要为甘露糖。Su等[16]研究表明,裙带菜孢子叶多糖的单糖组成主要是岩藻糖、半乳糖和少量的其他单糖;孙启立[17]通过水提醇沉法得到亨氏马尾藻粗多糖,利用离子交换柱层析得到均一多糖后,其单糖以岩藻糖和半乳糖为主,上述研究结果与本研究结果相符。本研究中红外光谱分析表明,铜藻粗多糖及纯化的4个组分在1 250 cm-1附近出现强吸收峰,证明均含有硫酸基,这与分离各组分的理化性质相对应,且纯化组分TF1、TF2的硫酸基主要连接于岩藻糖的C4位置,TF3、TF4的硫酸基主要连接于岩藻糖的C2或C3位置,这与刘舒[18]、张海霞等[19]对马尾藻褐藻聚糖硫酸酯单糖组成及红外光谱分析结果较为一致。
3.3 铜藻褐藻聚糖硫酸酯的保肝护肝作用
肝脏是肌体中至关重要的器官之一,在体内具有储存肝糖、分泌蛋白等功能。脾脏指数、肝脏指数与淋巴细胞的增殖程度有关,脾脏指数与肝脏指数增强,说明淋巴细胞增殖程度增强,免疫调节功能全面提升。本试验结果表明,模型组脾脏指数和肝脏指数显著增大,这表明肝损伤模型造模成功,解剖时可明显观察到肝脏组织肿大且颜色加深,表明肝脏组织受到损伤,这与蒙田秀等[20]研究的试验现象一致。
MDA是脂质过氧化的终产物,这是反映机体脂质过氧化水平的重要指标。SOD是清除氧自由基的主要酶系之一,GSH-Px 是机体内广泛存在的一种重要的催化过氧化氢分解酶,其具有保护细胞膜结构和功能完整的作用,SOD和GSH-Px活力水平反映了机体抗氧化能力的强弱[21]。本研究中,小鼠试验结果表明,与模型组相比,褐藻聚糖硫酸酯各组MDA含量、AST、ALT的活力均显著降低,且SOD、GSH-Px、TNF-α活力显著提高。由此可见,主要存在于细胞浆中的ALT和细胞浆线粒体中的AST,当细胞受到损伤时,ALT首先进入血液中,当细胞严重损伤危及线粒体时,AST也会进入血液中[22],从而阻止血清中ALT、AST的释放,对肝损伤起到了良好的保护作用。Madkourf等[23]研究发现,马尾藻乙醇提取物能显著抑制肝炎大鼠血清ALT、AST、ALP和胆红素水平的升高,证明马尾藻的乙醇提取物对CCl4诱导的小鼠肝损伤具有潜在的保肝作用。Chale-dzul等[24]研究发现,马尾藻提取物褐藻聚糖硫酸酯对CCl4诱导的大鼠毒性肝脏具有保护作用,马尾藻提取物可显著抑制大鼠血清中MDA、ALT、AST活力的升高,对总蛋白(TP)影响较小。二者研究的马尾藻与本研究中铜藻均为同一个属且研究结果一致,本研究中铜藻褐藻聚糖硫酸酯各剂量均能提高小鼠SOD、GSH-Px、TNF-α活力,能抑制小鼠MDA、ALT、AST活力,对CCl4造成的小鼠急性肝损伤具有一定保护作用。任丹丹等[25]研究表明,海带褐藻聚糖硫酸酯各剂量均能抑制肝损伤小鼠血清ALT、AST活性,且显著提高肝组织中SOD活力,降低MDA的含量,海带中褐藻聚糖硫酸酯对CCl4造成的小鼠急性肝损伤具有一定的保护作用。Kang等[26]研究发现,裙带菜孢子叶和海带提取的褐藻聚糖硫酸酯均可抑制MDA水平的升高,恢复CCl4损伤大鼠的SOD、过氧化氢酶(CAT),这表明,从裙带菜孢子叶和海带提取的褐藻聚糖硫酸酯具有抗CCl4诱导的氧化应激的抗氧化性能。研究结果证明,铜藻提取的Fucoidan同样具有保肝作用。
4 结论
1)从铜藻褐藻聚糖硫酸酯粗品分离获得4个组分,分别为TF1、TF2、TF3、TF4,其总糖含量分别为30.97%、32.26%、37.97%、35.97%和37.04%,硫酸基团含量分别为10.62%、9.62%、11.51%、14.51%和13.62%,其单糖主要由岩藻糖、葡萄糖、甘露糖和半乳糖组成,但各纯化组分的单糖组成含量差异较大。
2)铜藻褐藻聚糖硫酸酯粗品及各纯化组分均能提高小鼠肝脏或血清SOD、GSH-Px、TNF-α活性,抑制小鼠MDA、ALT、AST活性,具有显著的抗氧化和抑制肝损伤作用,这表明铜藻中褐藻聚糖硫酸酯具有显著的保肝护肝作用。
[1] 孙建璋,庄定根,陈万东,等.铜藻Sargassum horneri繁殖生物学及种苗培育研究[J].南方水产,2008(2):6-14.
SUN J Z,ZHUANG D G,CHEN W D,et al.Studies on sexual reproduction and seedling production of the brown alga Sargassum horneri[J].South China Fisheries Science,2008(2):6-14.(in Chinese)
[2] 郑海羽,饶道专,陈高峰,等.保护性开发南麂列岛铜藻Sargassaum horneri(Turn.)Ag资源的思考[J].现代渔业信息,2008(10):25-26.
ZHENG H Y,RAO D Z,CHEN G F,et al.Consideration on protective exploitation of Sargassaum horneri(Turn.)Ag resource around Nanji Islands[J].Modern Fisheries Information,2008(10):25-26.(in Chinese)
[3] 孙建璋,陈万东,庄定根,等.中国南麂列岛铜藻Sargassum horneri实地生态学的初步研究[J].南方水产,2008(3):58-63.
SUN J Z,CHEN W D,ZHUANG D G,et al.In situ ecological studies of the subtidal brown alga Sargasssum horneri at Nanji Island of China[J].South China Fisheries Science,2008(3):58-63.(in Chinese)
[4] 朱亚珠.铜藻粉末的关键工艺研究[J].河北渔业,2014(7):62-66.
ZHU Y Z.Key processing technology of powder of the macro-algae Sargassum horneri[J].Hebei Fisheries,2014(7):62-66.(in Chinese)
[5] JANG S,KITAMURA Y,YOSHIDA S,et al.Hot water extraction of brown seaweed,nagamo(Sargassum horneri)processing residue[J].Food Science and Technology Research,2011,17(6):487-492.
[6] 曲桂燕.五种褐藻岩藻聚糖硫酸酯提取纯化及其功能活性的比较研究[D].青岛:中国海洋大学,2013.
QU G Y.Comparative study of fucoidan on extraction,purification and functional activities from five brown seaweeds[D].Qingdao:Ocean University of China,2013.(in Chinese)
[7] 张尔贤,俞丽君.鼠尾藻多糖清除氧自由基作用的研究Ⅱ.UVc鼠尾藻对多糖抗氧化作用的影响[J].中国海洋药物,1997(3):1-4.
ZHANG E X,YU L J.Studies on polysaccharide from Sargassum thunbergii for its ability to scavenge active oxygen species Ⅱ.on effect of far ultraviolet radiation on antioxidation of polysaccharides[J].Chinese Journal of Marine Drugs,1997(3):1-4.(in Chinese)
[8] REN J R,YANG R,HE Y Y,et al.Genetic variation of Sargassum horneri populations detected by inter-simple sequence repeats[J].Genetics and Molecular Research:GMR,2015,14(1):619-625.
[9] SHAN T F,PANG S J,LI J,et al.Isolation and characterization of eight novel microsatellite loci from the brown alga Sargassum horneri[J].Journal of Applied Phycology,2015,27(6):2419-2421.
[10] VIJAYABASKAR P,VASEELA N,THIRUMARAN G.Potential antibacterial and antioxidant properties of a sulfated polysaccharide from the brown marine algae Sargassum swartzii[J].Chinese Journal of Natural Medicines,2012,10(6):421-428.
[11] SURESH V,SENTHILKUMAR N,THANGAM R,et al.Separation,purification and preliminary characterization of sulfated polysaccharides from Sargassum plagiophyllum and its in vitro anticancer and antioxidant activity[J].Process Biochemistry,2013,48(2):364-373.
[12] 张玉,张绵松,史亚萍,等.铜藻活性组分多糖的体外抗氧化性研究[J].食品研究与开发,2018,39(6):12-18.
ZHANG Y,ZHANG M S,SHI Y P,et al.Comparison on antioxidant activity of polysaccharide fraction from Sargassum horneri in vitro[J].Food Research and Development,2018,39(6):12-18.(in Chinese)
[13] 陈晓晓.铜藻多糖的酶法修饰、活性及应用研究[D].杭州:浙江工业大学,2014.
CHEN X X.Enzymatic degradation,activity and applacation study of polysaccharides from Sargassum horneri[D].Hangzhou:Zhejiang University of Technology,2014.(in Chinese)
[14] 刘丽佳.铜藻多糖分离纯化及其抗氧化、免疫调节活性研究[D].舟山:浙江海洋学院,2014.
LIU L J.Preparation,purification and activity of polysaccharides produced by Sargassum herneri(Tarn)Ag[D].Zhoushan:Zhejiang Ocean University,2014.(in Chinese)
[15] 李伟.铜藻多糖的纯化、结构及免疫活性的研究[D].温州:温州大学,2015.
LI W.The purification,structure and immunological activity of polysaccharides from Sargassum horneri[D].Wenzhou:Wenzhou University,2015.(in Chinese)
[16] SU X R,LI T W,DING M J.Analysis of the nutrients in sporophyll of Undaria pinnatifida(Harv.)Suringar[J].Acta Nutrimenta Sinica, 1994, 16(2): 236.
[17] 孙启立.亨氏马尾藻多糖结构分析及其抗病毒活性研究[D].佳木斯:佳木斯大学,2019.
SUN Q L.Structural analysis and antiviral activity of polysaccharides from Sargassum henslowianum C.Ag[D].Jiamusi:Jiamusi University,2019.(in Chinese)
[18] 刘舒.三种褐藻中岩藻聚糖硫酸酯的纯化及结构分析[D].大连:大连海洋大学,2013.
LIU S.Studies on the purification and structural characteristics of fucoidan from Costaria costata,Saccarina japonica,Kjellmaniella crassifolia[D].Dalian:Dalian Ocean University,2013.(in Chinese)
[19] 张海霞,汪秋宽,何云海,等.马尾藻褐藻多糖硫酸酯的分离纯化及结构研究[J].大连海洋大学学报,2016,31(5):559-562.
ZHANG H X,WANG Q K,HE Y H,et al.Purification and structure of fucoidan from sargasso weed Sargassum[J].Journal of Dalian Ocean University,2016,31(5):559-562.(in Chinese)
[20] 蒙田秀,谢丽莎,黄茂春.岩黄连提取物对CCl4致小鼠肝损伤的保护作用[J].上海中医药杂志,2013,47(11):89-91.
MENG T X,XIE L S,HUANG M C.Protective effect of Corydalis saxicola buning extract on liver injury induced by CCl4 in mice[J].Shanghai Journal of Traditional Chinese Medicine,2013,47(11):89-91.(in Chinese)
[21] 王尊文,华玉琴,李国平,等.羊栖菜多糖对高血脂模型大鼠血脂和抗氧化功能的影响[J].中国海洋药物,2008,27(6):13-15.
WANG Z W,HUA Y Q,LI G P,et al.Effects of polysaccharide from Sargassum fusiforme on blood-lipids and antioxidation ability in hyperlipemia rats[J].Chinese Journal of Marine Drugs,2008,27(6):13-15.(in Chinese)
[22] 王庆钧,谷越,杨颖,等.萱藻中岩藻聚糖硫酸酯的提取工艺优化及其保肝护肝作用[J].大连海洋大学学报,2015,30(4):417-421.
WANG Q J,GU Y,YANG Y,et al.Optimization of extraction and hepatoprotective activity of fucoidan from seaweed Scytosiphon lomentaria[J].Journal of Dalian Ocean University,2015,30(4):417-421.(in Chinese)
[23] MADKOURF F,KHALILW F,DESSOUKIA A.Protective effect of ethanol extract of Sargassum dentifolium(Phaeophyceae)in carbon tetrachloride-induced hepatitis in rats[J].International Journal of Pharmacy and Pharmaceutical Sciences,2012,4:637-641.
[24] CHALE-DZUL J,P REZ-CABEZA DE VACA R,QUINTAL-NOVELO C,et al.Hepatoprotective effect of a fucoidan extract from Sargassum fluitans Borgesen against CCl4-induced toxicity in rats[J].International Journal of Biological Macromolecules,2020,145:500-509.
REZ-CABEZA DE VACA R,QUINTAL-NOVELO C,et al.Hepatoprotective effect of a fucoidan extract from Sargassum fluitans Borgesen against CCl4-induced toxicity in rats[J].International Journal of Biological Macromolecules,2020,145:500-509.
[25] 任丹丹,汪秋宽,张甜翠,等.海带岩藻聚糖硫酸酯对四氯化碳致肝损伤小鼠的保护作用[J].华中农业大学学报,2009,28(6):764-766.
REN D D,WANG Q K,ZHANG T C,et al.Hepatoprotective activity of fucoidan from Laminaria japonica against CCl4 induced hepatic injury in mice[J].Journal of Huazhong Agricultural University,2009,28(6):764-766.(in Chinese)
[26] KANG K S,KIM I D,KWON R H,et al.The effects of fucoidan extracts on CCl4-induced liver injury[J].Archives of Pharmacal Research,2008,31(5):622-627.