褶皱臂尾轮虫Brachionus plicatilis隶属于轮虫动物门Rotifera单巢纲Monogononta游泳轮虫目Ploima臂尾轮虫科Brachionidae臂尾轮虫属Brachionus,其具有抗逆性强、营养价值高、生长速度快、易培养等优点,已成为海水养殖鱼虾蟹类最常用的生物饵料[1]。轮虫不仅可以将摄食的藻类、细菌和有机碎屑等食物转换为蛋白质、脂肪等营养物质[2],而且还能够富集一些矿物质、维生素和色素等微量营养元素,是水域生态系统食物网中的重要组成部分[3],因此,也被称为“胶囊”生物[4-7]。
虾青素(astaxanthin)是一种天然存在的红色类胡萝卜素色素,可溶于有机溶剂,不溶于水[8]。作为类胡萝卜素家族的重要一员,虾青素也是目前被发现具有较强抗氧化活性的物质,兼具抗衰老、抗肿瘤、增强免疫系统功能和减轻炎症反应等多种功效[9-10]。虾青素等一些类胡萝卜素也是体内合成维生素A的前体物质[11-12],对生物发育具有重要作用。自然界中,绝大多数动物缺乏自我合成虾青素的能力[13],必须来源于所摄入的食物。水生生物也不例外,它们通常要摄食大量富含虾青素或其前体原料的生物饵料,以满足生长、发育需要。而对于水产养殖动物,饲料中添加虾青素可有效增强和改善虾[14-15]、蟹[16]和鱼类[17-19]等水产动物的免疫力及体色,一些国家已批准将虾青素作为着色剂在动物及水产饲料中使用[20]。此外,虾青素还能够促进水生动物生长与繁殖[13],如对淡水玛雅臂尾轮虫Brachionus manjavacas种群增长也有着明显效果[21]。然而,与多数水生动物相似,轮虫不具有合成虾青素的能力,且其体内类胡萝卜素类物质均较缺乏[22],同样需依靠摄食满足自身需要。虾青素易被氧化,饲料加工过程中的高温和强光照都会显著减弱其生物活性,这一特性影响了虾青素在普通饲料中的添加与应用。而利用轮虫等活体生物饵料富集虾青素,再间接投喂水产动物苗种将是解决上述问题的有效途径。
本试验中,以添加不同浓度虾青素的微拟球藻Nannochlorsis sp.投喂褶皱臂尾轮虫,测定其种群增长、生物富集及相关水质指标,探讨外源虾青素对轮虫生长及营养强化的效果,以期为轮虫高密度、高质量培养工艺的建立提供科学参考。
1 材料与方法
1.1 材料
试验用褶皱臂尾轮虫、冷冻微拟球藻膏由盘锦光合蟹业有限公司研发中心提供。轮虫经过75 μm筛网过滤,选取规格大小相对整齐的个体进行纯化扩大培养。藻膏在使用前称重,置于纯净水中解冻、稀释为藻细胞密度为(400±50)×108 cells/L的藻液。虾青素由广州立达尔生物科技股份有限公司提供(含量≥100.0 g/kg)。试验所需海水经过过滤、沉淀、消毒处理,曝气24 h后使用。
1.2 方法
1.2.1 轮虫种群增长试验 将试验轮虫分为4组,分别为仅投喂微拟球藻藻液的对照组,以及添加0.05、0.10、0.15 mg/L虾青素的处理组,每组设置3个平行。养殖容器为120 L的塑料水箱,其中注入90 L经过沉淀、过滤、消毒且盐度为18的海水,连续充气,水温为23~25 ℃。轮虫的初始接种密度为10 ind./mL,全程于室内自然光照中培养,每天7:00、13:00、18:00、23:00投喂1 L配制好的饵料。每天6:00取样,之后换水20%,连续培养7 d。
1.2.2 虾青素富集试验 结合轮虫在实际生产中的应用,为确定轮虫在投喂前进行营养强化的最佳时间,进行轮虫富集虾青素的试验。除初始接种密度为80 ind./mL外,其他试验条件、饵料配制及投喂与“1.2.1节”相同,分别在试验的第0、2、4、6、8、10、12 h收集轮虫,测定其体内虾青素含量。
1.2.3 轮虫密度的测定 将培养水槽中的轮虫尽量混匀,用吸管随机吸取1 mL,置于培养皿中,加入甲醛溶液固定,置于光学显微镜下观察,轮虫的密度和怀卵量等数据重复计数3次,取其平均值。各指标计算公式为
轮虫抱卵率=卵的总数/轮虫总数×100%,
(1)
增长倍数=NC/N0,
(2)
日均增长量=(Nt-N0)/t,
(3)
日均增长率=(lnNC-lnN0)/t×100%。
(4)
其中: N0和NC分别为增殖计算开始和结束时轮虫的密度(ind./mL);Nt为t时间点的轮虫密度(ind./mL);t为试验时间(d)。
1.2.4 虾青素富集的测定
1)虾青素标准曲线的制作。使用电子天平(梅特勒拖利多,ME103E)准确称取1 mg虾青素标准品(北京中科质检生物技术有限公司,HPLC≥98%),溶于10 mL 100%(体积分数,下同)分析纯丙酮中,配制成虾青素标准溶液(100 μg/mL)。用丙酮稀释标准液,分别获得质量浓度为1、2.5、5、10、20 μg/mL的溶液。通过高效液相色谱仪(PerkinElmer,Flexar)检测。所用色谱柱为大连依利特分析仪器有限公司AQ-C18色谱柱(250 mm×4.6 mm,5 μm),柱温为20 ℃,紫外检测器波长为476 nm,进样量为20 μL,流速为1 mL/min,流动相为甲醇-乙腈(体积比90∶10),对照标准品出峰时间和面积,计算样品中虾青素浓度。上述操作均在黑暗通风的条件下避光进行。
通过峰面积(Y)与相对应的虾青素溶液浓度(X)得到虾青素含量的标准曲线:
Y=162 646X+11 233,R2 = 0.999。
(5)
2)轮虫体内虾青素含量的测定。分别在培养0、2、4、6、8、10、12 h时收集轮虫,用纯净水冲洗干净,参考已有文献中的方法[23-24],测定其虾青素含量。简要流程如下:
(1)取10 mL离心管置于电子天平上称重,然后向离心管中加入一定量样品,再次称重,记录样品质量。
(2)将离心管置于冰水浴中,加入100%分析纯丙酮,使用匀浆机以8 000 r/min 对样品进行持续研磨,每 30 s 暂停1次,研磨3次。
(3)在4 ℃条件下以4 000 r/min离心,取上层橙红色液体转移至容量瓶中,再加入100%分析纯丙酮,并重复上述步骤,直到样品变为纯白色。
(4)最后使用100%分析纯丙酮定容至10 mL,过0.45 μm有机滤膜后,使用高效液相色谱法测定样品中虾青素含量。轮虫体内虾青素含量(A,μg/g)及其对虾青素的富集效率(E,μg/(g·h))计算公式为
A=Ax/G,
(6)
E=(At-A0)/t。
(7)
其中:Ax为测定样品中虾青素的含量(μg);G为测定样品的质量(g);At为t时间点轮虫富集虾青素的含量(μg/g);A0为初始轮虫虾青素的含量(μg/g);t为培养时间(h)。
1.2.5 水质指标的测定 每天换水前,使用溶氧仪(陆恒生物科技有限公司LH-D701)测定培养水体中的溶解氧(DO)含量,使用pH计(力辰科技有限公司pH-100)测定水体中pH值。采用纳氏试剂法、重氮-偶氮光度法测定水体中氨氮![]() 和亚硝酸盐
和亚硝酸盐![]() 浓度。
浓度。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,采用SPSS 20.0软件对试验数据进行单因素方差分析和Tukey多重比较,显著性水平设为0.05。
2 结果与分析
2.1 虾青素对轮虫种群增长的影响
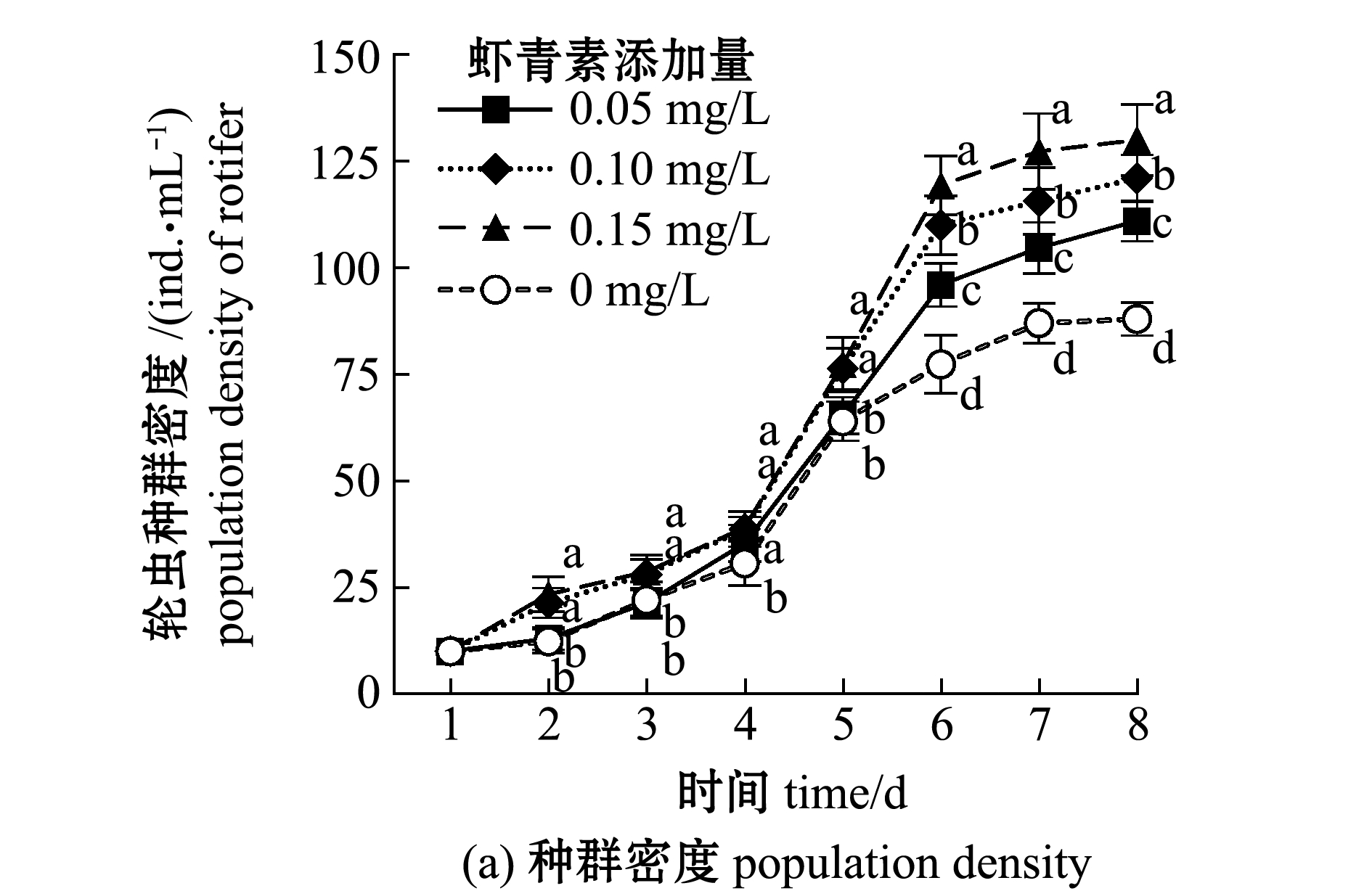
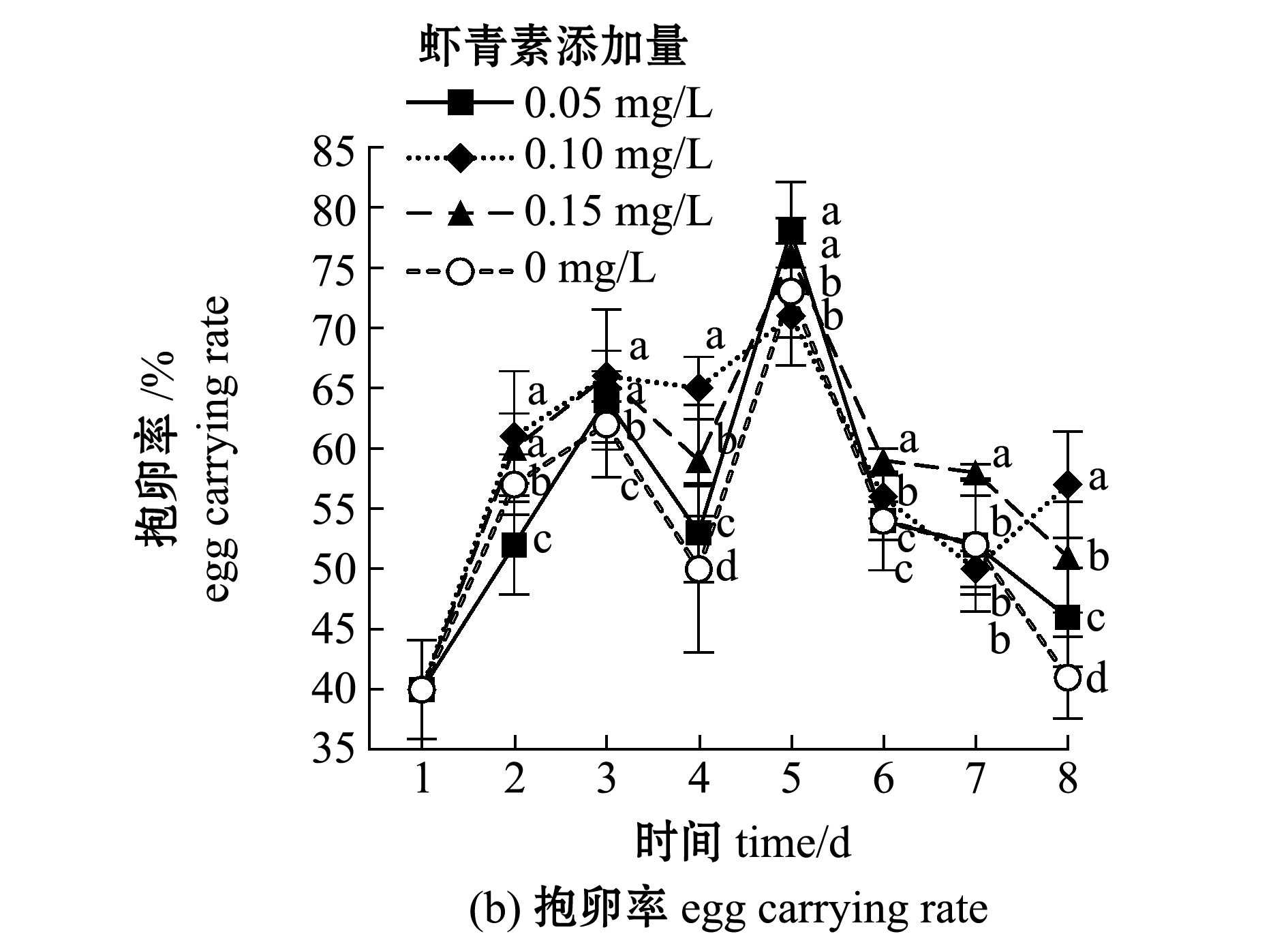
从图1可见:随着培养时间的延长,各组轮虫种群密度总体呈上升趋势,至6 d时轮虫密度上升趋势趋于平缓,试验结束时,0.15 mg/L虾青素组轮虫密度最高(134 ind./mL),显著高于对照组(90 ind./mL)、0.05 mg/L虾青素组(111 ind./mL)和0.10 mg/L虾青素组(122 ind./mL)(P<0.05);各组轮虫的抱卵率在试验前4 d呈现波动上升趋势,5 d时均达到峰值,之后呈下降趋势,0.05 mg/L虾青素组轮虫的最高抱卵率为78%,与0.15 mg/L虾青素组(76%)无显著性差异(P>0.05),但显著高于对照组(73%)和0.10 mg/L虾青素组(71%)(P<0.05)。

标有不同字母者表示同一时间下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters in the same time are significant differences in different groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.
图1 各组轮虫种群增长情况
Fig.1 Population growth of rotifers in each group
在轮虫培养过程中,其最高日增长量往往出现在最高抱卵率后1 d,试验结束时,0.15 mg/L虾青素组轮虫的日均增长量、日均增长率及增长倍数均为最高,分别为17.1 ind./(mL·d)、36.6%/d和13.0倍,显著高于对照组和0.05 mg/L虾青素组(P<0.05),对照组各项指标均最低(表1)。
表1 各组轮虫种群增长情况
Tab.1 Population growth of rotifers in each group
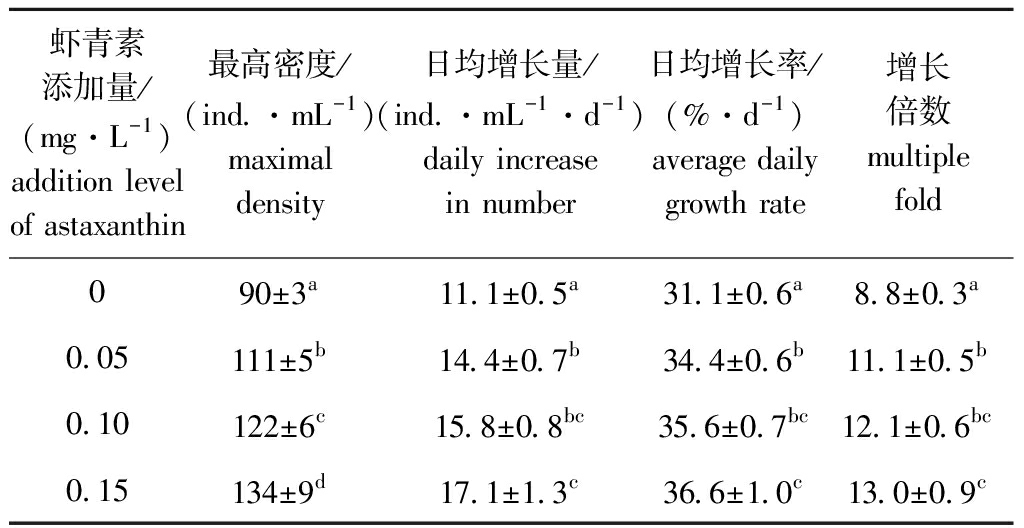
虾青素添加量/(mg·L-1)addition level of astaxanthin最高密度/(ind.·mL-1)maximal density日均增长量/(ind.·mL-1·d-1)daily increase in number日均增长率/(%·d-1)average daily growth rate增长倍数multiple fold090±3a11.1±0.5a31.1±0.6a8.8±0.3a0.05111±5b14.4±0.7b34.4±0.6b11.1±0.5b0.10122±6c15.8±0.8bc35.6±0.7bc12.1±0.6bc0.15134±9d17.1±1.3c36.6±1.0c13.0±0.9c
注: 同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note: The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
2.2 轮虫富集虾青素的效果
从图2可见:试验开始前4 h,各组轮虫虾青素含量总体呈上升趋势,3个虾青素添加组轮虫体内虾青素含量在各时间点始终显著高于对照组(P<0.05);各组轮虫体内虾青素含量最大值的达到时间和数值具有明显差异,其中,0.10、0.15 mg/L虾青素组在4 h时达到最大值(分别为17.02、19.46 μg/g),而0.05 mg/L虾青素组和对照组在6 h时才达到最大值(分别为12.54、2.37 μg/g),且对照组显著低于虾青素组(P<0.05);随着培养时间的延长,3个虾青素处理组轮虫的虾青素含量在达到最大值后,均呈先降后升再趋于平稳的趋势。
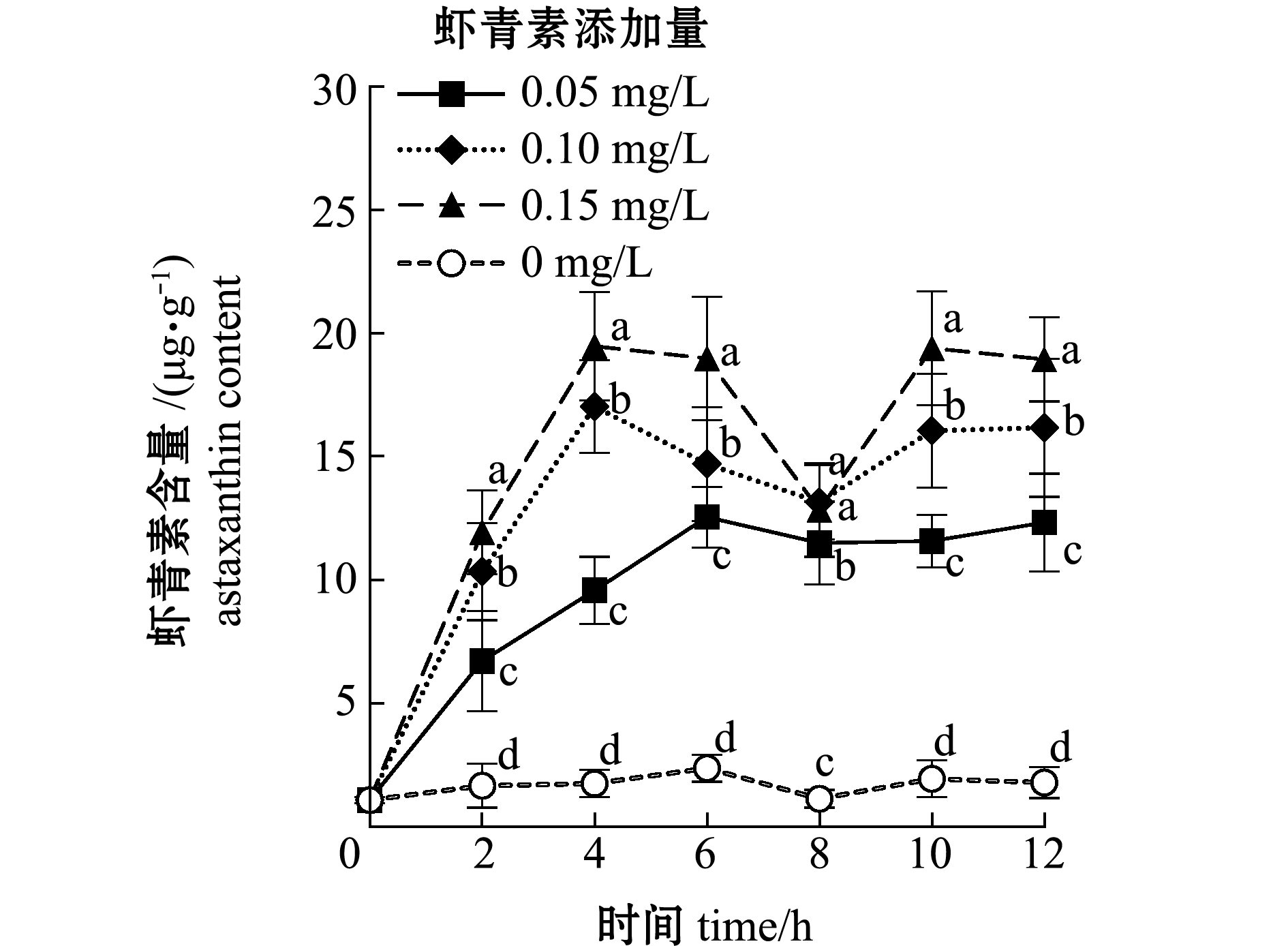
图2 各组轮虫体内虾青素的含量
Fig.2 Content of astaxanthin in rotifers in each group
从表2可见:虾青素强化培养2 h时,各组轮虫富集虾青素的效率均最高,其中0.05、0.10、0.15 mg/L虾青素添加组轮虫富集虾青素的效率分别为2.82、4.63、5.43 μg/(g·h),且各组间有显著性差异(P<0.05),均显著高于对照组(0.29 μg/(g·h))(P<0.05);随着培养时间的延长,各组轮虫富集虾青素的效率逐渐降低,并趋于平稳。
表2 各组轮虫在不同时间点虾青素的富集效率
Tab.2 Enrichment efficiency of astaxanthin in rotifers in each group at different time
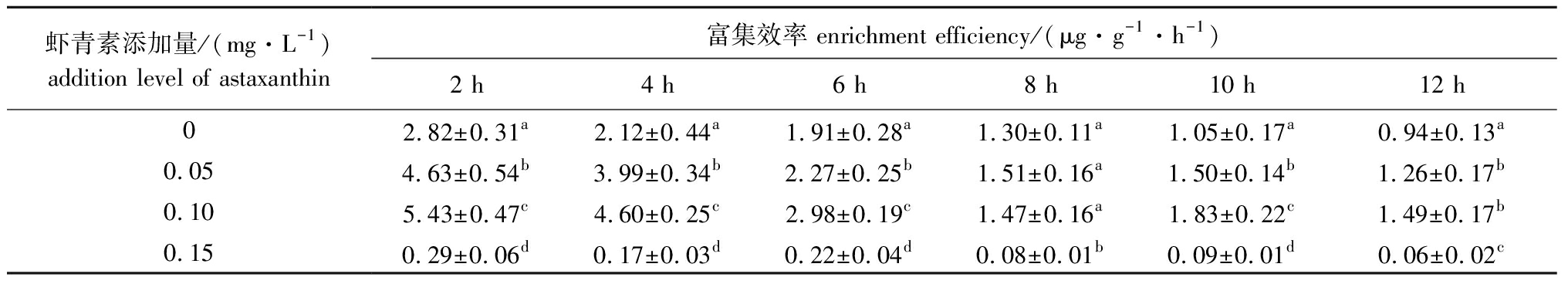
虾青素添加量/(mg·L-1)addition level of astaxanthin富集效率 enrichment efficiency/(μg·g-1·h-1)2 h4 h6 h8 h10 h12 h02.82±0.31a2.12±0.44a1.91±0.28a1.30±0.11a1.05±0.17a0.94±0.13a0.054.63±0.54b3.99±0.34b2.27±0.25b1.51±0.16a1.50±0.14b1.26±0.17b0.105.43±0.47c4.60±0.25c2.98±0.19c1.47±0.16a1.83±0.22c1.49±0.17b0.150.29±0.06d0.17±0.03d0.22±0.04d0.08±0.01b0.09±0.01d0.06±0.02c
综上,0.10、0.15 μg/L虾青素组轮虫在培养4 h时体内虾青素含量最高,虾青素富集效率较高。
2.3 各轮虫培养组水质的变化
从图3可见:各组轮虫培养水体氨氮质量浓度总体呈上升的趋势,且与轮虫密度呈正相关,至试验结束时,各组轮虫培养水体的氨氮质量浓度也达到最大值,其中0.15 mg/L虾青素组氨氮质量浓度最高(2.4 mg/L),其次是0.10 mg/L虾青素组(2.3 mg/L),这两个组间无显著性差异(P>0.05),但均显著高于0.05 mg/L虾青素组(2.07 mg/L)和对照组(1.48 mg/L);试验期间,各组轮虫培养水体亚硝酸盐质量浓度总体呈上升趋势,组间无显著性差异(P>0.05);各组轮虫培养水体DO质量浓度总体呈下降趋势,且与轮虫密度呈负相关,其中,密度最高的0.15 mg/L虾青素组DO质量浓度最低(5.32 mg/mL),密度最低的对照组DO质量浓度最高(6.09 mg/mL),至试验结束时,各组间有显著性差异(P<0.05);试验期间,各组水体pH为8.21~8.25,且各组间无显著性差异(P>0.05)。
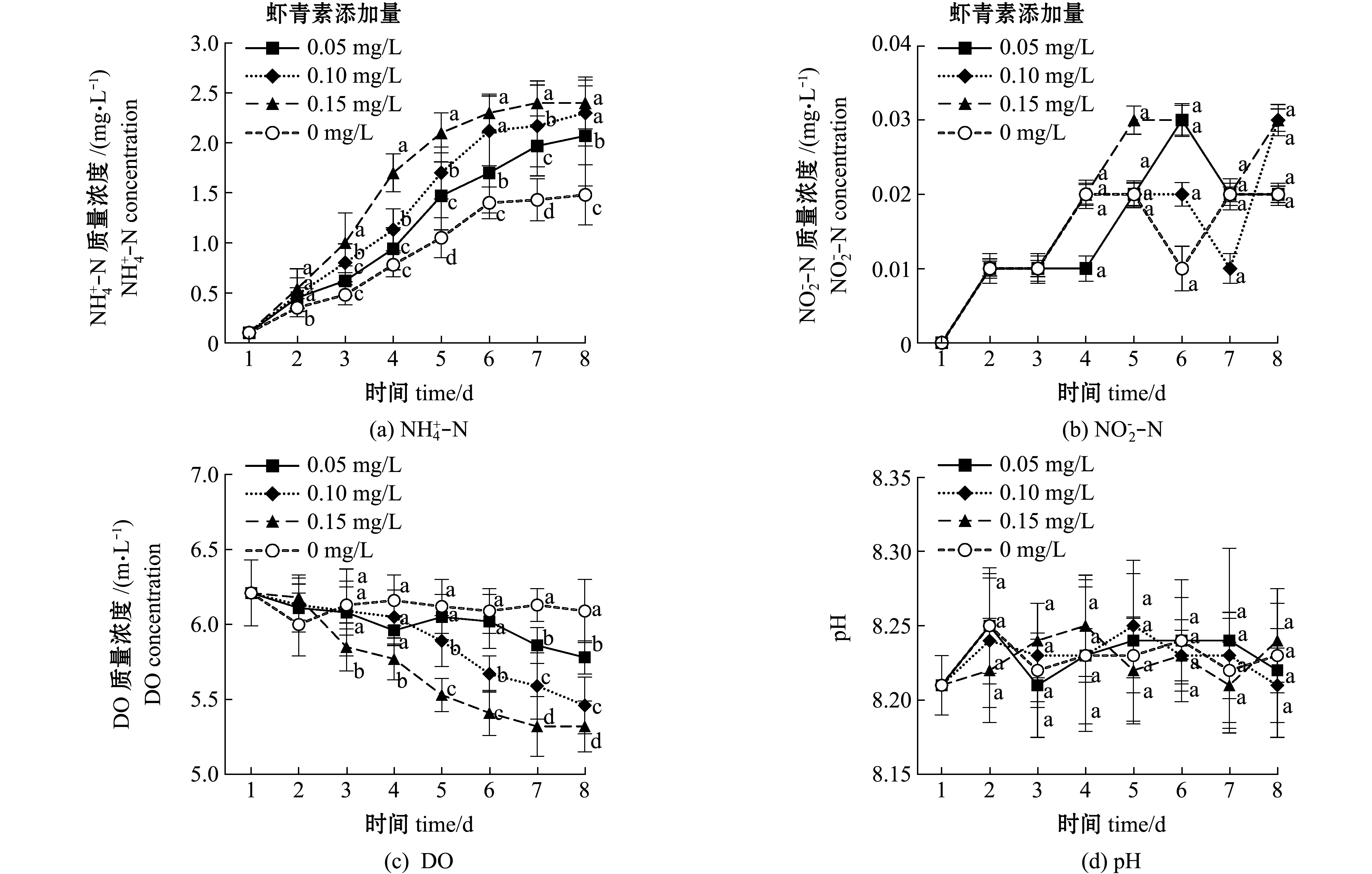
图3 试验期间各轮虫培养组水质的变化
Fig.3 Changes in water quality of rotifer culture in each group during the experiment
3 讨论
3.1 投喂虾青素对轮虫种群密度的影响
轮虫作为鱼虾蟹类苗种繁育中重要的生物饵料,高效、稳定、连续培养一直是水产业中的关键技术[25]。除通过养殖模式与设施条件的优化来保证培养水质条件外,轮虫所摄食食物的种类和营养组成也是影响其繁殖及种群数量的重要因素[26]。Sahandi等[27]研究表明,以酵母与微拟球藻混合投喂的轮虫,其种群密度增长要明显优于单一投喂酵母或微拟球藻,且单一投喂酵母的轮虫其种群密度增长会过早进入平台期,之后再难以增长,表现出营养缺乏的现象,然而,投喂脱脂雨生红球藻Haematococcus pluvialis藻粉则能够促进轮虫繁殖[21]。众所周知,雨生红球藻富含虾青素,其优秀的抗氧化能力是促进轮虫生长和繁殖的重要物质。本试验中,将人工合成的虾青素添加到微拟球藻藻液中,投喂海水培养的褶皱臂尾轮虫,探讨其作为营养强化剂对轮虫种群增长及富集规律,结果发现,在微拟球藻藻液中分别添加0.05、0.10、0.15 mg/L的虾青素,轮虫的密度、抱卵率、日均增长量及日均增长率均比仅投喂微拟球藻藻液的对照组显著升高,证明虾青素对轮虫具有生物效应。Rodrigues等[28]研究表明,与只投喂酵母的褶皱臂尾轮虫相比,摄食微拟球藻的轮虫具有较高的抗氧化能力。本试验中所投喂的虾青素应该进一步强化轮虫的抗氧化机能,进而表现出较好的繁殖与生长效果,后续对其抗氧化能力指标的测定将有助于对相关机理的深入分析。
本试验中,在试验开始后的前4 d,投喂虾青素的各组轮虫种群密度与对照组相比差异不大,但随着轮虫培养时间的延长,各组轮虫密度逐渐出现显著性差异,且与投喂虾青素的量呈现出明显的正相关关系。本试验中对轮虫的培养水质也进行了连续监测,结合轮虫生长指标与水质指标综合分析,轮虫培养前期密度较小,代谢物积累较少,所处水环境中各项指标尚未达到影响其繁殖与生长的水平;后期各组轮虫种群密度增长减慢与水环境变差有较大关系,水体中的氨氮由离子氨![]() 与非离子氨(NH3)组成,可穿透动物细胞膜对其组织产生毒性[29],氨氮浓度的升高会使轮虫受到一定应激反应,其中,0.15 mg/L虾青素组轮虫的生长速率最高、密度最大,产生的代谢废物积累也随之增加,导致0.15 mg/L虾青素组水体氨氮浓度升高,而此时摄食虾青素的轮虫开始表现出明显的抗逆性,且呈现剂量效应,即使水体氨氮浓度较高、水质环境较差,也可以保证种群密度不会因此崩溃,与所报道的虾青素具有抗氧化、增加免疫力的特点相符合。试验各组轮虫的抱卵率在第5天时均达到最大值,其中,投喂虾青素最少的0.05 mg/L组抱卵率最高(78%),对照组最低(73%),这表明在水质环境相对较好时,虾青素对轮虫的抱卵能力影响并不明显。然而,试验后期各组轮虫密度的差异,可能是由于摄食虾青素后,轮虫所产卵的孵化率及幼虫成活率较高引起的,这暗示虾青素具有提高卵质量进而增强幼体抗逆性的作用。
与非离子氨(NH3)组成,可穿透动物细胞膜对其组织产生毒性[29],氨氮浓度的升高会使轮虫受到一定应激反应,其中,0.15 mg/L虾青素组轮虫的生长速率最高、密度最大,产生的代谢废物积累也随之增加,导致0.15 mg/L虾青素组水体氨氮浓度升高,而此时摄食虾青素的轮虫开始表现出明显的抗逆性,且呈现剂量效应,即使水体氨氮浓度较高、水质环境较差,也可以保证种群密度不会因此崩溃,与所报道的虾青素具有抗氧化、增加免疫力的特点相符合。试验各组轮虫的抱卵率在第5天时均达到最大值,其中,投喂虾青素最少的0.05 mg/L组抱卵率最高(78%),对照组最低(73%),这表明在水质环境相对较好时,虾青素对轮虫的抱卵能力影响并不明显。然而,试验后期各组轮虫密度的差异,可能是由于摄食虾青素后,轮虫所产卵的孵化率及幼虫成活率较高引起的,这暗示虾青素具有提高卵质量进而增强幼体抗逆性的作用。
3.2 轮虫富集虾青素的效果
自然界中,多数动物体内所需虾青素来源于所摄入的食物。与生活在天然水域中的个体相比,养殖环境食物单一,动物更易缺乏虾青素、类胡萝卜素等生物活性物质,进而导致免疫力低下、体色暗淡、易受病害侵袭等问题。上述情况对于各种类工厂化苗种生产的影响更大,往往是苗种质量低下的主要原因。目前,商业化配合饲料中虽然也已开始添加虾青素或其他类胡萝卜素等成分,但这些色素性质不稳定,易于氧化,生产加工及储运条件均会影响其效果。在生物机体内,维生素A具有重要的生物学功能,但直接投喂易过量且对机体产生毒性[11]。若生物摄食富含虾青素的食物,增加体内虾青素等一些类胡萝卜素的含量后,再将其作为合成维生素A的前体原料,效果将优于直接投喂维生素A,但前提是要最大程度地保证虾青素的生物活性。
在实际生产中为了节约成本,通常在投喂前对轮虫仅进行短时间的营养强化。因此,本试验中选择水产苗种繁育中最常用的生物饵料——褶皱臂尾轮虫作为活体“胶囊”,研究其短时间内富集虾青素的规律,为轮虫营养强化操作及实际应用提供参考。本试验结果显示,对照组轮虫在取样各时间点均能测定出一定的虾青素含量,其应源于自身或所投喂的藻液。试验开始后,轮虫滤食大量虾青素颗粒富集在体内,3个虾青素添加组在试验前4 h轮虫体内的虾青素含量呈上升趋势,且与投喂量呈正相关,表明在本试验条件下轮虫中虾青素的富集与时间及投喂量有关。随着培养时间的延长,虾青素添加量较高的0.10、0.15 mg/L组轮虫体内虾青素含量在4 h时达到最大值。据相关文献记载,使用油脂型虾青素对轮虫进行营养强化,轮虫体内虾青素含量可短时间内(1.5 h)达到最大值[21]。结合本试验结果,推测0.10、0.15 mg/L虾青素组轮虫在试验的4 h时其体内虾青素含量达到饱和。而虾青素投喂量最低的0.05 mg/L组则在6 h时才达到饱和状态,不仅晚于0.10、0.15 mg/L虾青素组,且轮虫体内虾青素饱和时的含量也显著低于0.10、0.15 mg/L虾青素组。之后,各组轮虫体内的虾青素含量均在6~8 h呈下降趋势,随后又上升并趋于平稳。
有学者使用叶黄素投喂轮虫时发现,轮虫体内叶黄素含量达到最大值后,会随培养时间延长而逐渐降低[30]。同时根据轮虫的摄食特点,食物充足时,其通常会在短时间内通过滤食将胃肠道填满食物,营养物质会被消化、吸收,而消化率、排泄时长会因食物种类各异[31]。推测出现这种情况与轮虫自身代谢相关,但有关轮虫对虾青素的消化、吸收及代谢途径等方面的内容尚有待进一步研究。本试验中取样时采用孔径为48 μm的筛绢网过滤轮虫,可能会混有少量较大的悬浮虾青素颗粒,造成测定数值与实际数值相比偏大,从轮虫体内虾青素含量和虾青素成本两方面考虑,按照0.10 mg/L虾青素的比例添加虾青素对褶皱臂尾轮虫进行强化,并在强化4 h时收集,投喂水产苗种较为合适。
3.3 虾青素强化轮虫的操作条件优化
影响轮虫种群繁殖与增长的因素较多,除轮虫培养所用饵料种类外,其培养水体的氨氮、亚硝酸盐、pH等环境因子也会对其产生影响[32]。本试验结果表明,投喂一定量的虾青素有利于轮虫的繁殖与生长,但随着培养时间延长,轮虫种群密度虽然增加明显,但水质迅速变差,表现为溶解氧降低,氨氮和亚硝酸盐浓度升高。另外,所投入的微藻为经过离心、冷冻储存的藻膏,加之虾青素为非水溶性的悬浮颗粒,在静水充气培养条件下易沉积、腐败,进一步加速了水质恶化。因此,轮虫集约化培养及营养强化时,提供合适的培养条件,建立水质、投喂量和轮虫密度间的平衡关系是生产高质量轮虫的关键。综合分析,建议生产中可以采用微藻与轮虫连续培养、采收,短时间集中营养强化的工艺流程,以提高生产效率。
4 结论
1)以微拟球藻藻液作为基础饵料,添加虾青素投喂轮虫,有利于褶皱臂尾轮虫繁殖和种群增长。
2)饵料中虾青素能够在褶皱臂尾轮虫体内富集,且在一定范围内表现出剂量效应。
3)从富集效率和虾青素成本两方面考虑,本试验条件下,以0.10 mg/L的比例添加虾青素投喂轮虫,并进行4 h强化培养较为合适。
[1] 成永旭.生物饵料培养学[M].2版.北京:中国农业出版社,2005:116-136.
CHENG Y X.Live food culture[M].2nd ed.Beijing:China Agriculture Press,2005:116-136.(in Chinese)
[2] 曹建亭,张乐涛.轮虫在虾蟹育苗中的投喂技术[J].渔业致富指南,2006(4):28.
CAO J T,ZHANG L T.Feeding technology of rotifers in shrimp and crab nursery[J].Fishery Guide to Be Rich,2006(4):28.(in Chinese)
[3] 孙薇.长江口轮虫群落生态特征分析[D].上海:上海海洋大学,2012.
SUN W.The ecological characteristics of rotifer community in the Yangtze River Estuary[D].Shanghai:Shanghai Ocean University,2012.(in Chinese)
[4] WAQALEVU V,HONDA A,DOSSOU S,et al.Effect of oil enrichment on Brachionus plicatilis rotifer and first feeding red sea bream(Pagrus major)and Japanese flounder(Paralichthys olivaceus)[J].Aquaculture,2019,510:73-83.
[5] DOM NGUEZ A,FERREIRA M,COUTINHO P,et al.Delivery of astaxanthin from Haematocuccus pluvialis to the aquaculture food chain[J].Aquaculture,2005,250(1/2):424-430.
NGUEZ A,FERREIRA M,COUTINHO P,et al.Delivery of astaxanthin from Haematocuccus pluvialis to the aquaculture food chain[J].Aquaculture,2005,250(1/2):424-430.
[6] SRIVASTAVA A,STOSS J,HAMRE K.A study on enrichment of the rotifer Brachionus “Cayman” with iodine and selected vitamins[J].Aquaculture,2011,319(3/4):430-438.
[7] KHOA T N D,WAQALEVU V,HONDA A,et al.Enrichment effects of fermented by-product of Shochu distillery on Brachionus plicatilis sp.rotifer and larviculture performance in Japanese flounder(Paralichthys olivaceus)[J].Aquaculture,2021,535:736352.
[8] 董玉华,赵元凤.虾青素生物学来源和功能的研究进展[J].水产科学,2005,24(10):50-52.
DONG Y H,ZHAO Y F.Advancement of research on biological sources and physiological functions of astaxanthin[J].Fisheries Science,2005,24(10):50-52.(in Chinese)
[9] 胡红伟,闫凌鹏,麻啸涛,等.虾青素在水产养殖中的应用研究进展[J].饲料博览,2021(7):10-18.
HU H W,YAN L P,MA X T,et al.Application research progress on astaxanthin in aquaculture[J].Feed Review,2021(7):10-18.(in Chinese)
[10] 韩吉平,江宁,诸永志,等.天然虾青素的制备和功能研究进展[J].江苏农业科学,2021,49(8):56-60.
HANG J P,JIANG N,ZHU Y Z,et al.Research progress on the preparation and function of natural astaxanthin[J].Jiangsu Agricultural Sciences,2021,49(8):56-60.(in Chinese)
[11] RØNNESTAD I,HEMRE G I,FINN R N,et al.Alternate sources and dynamics of vitamin A and its incorporation into the eyes during the early endotrophic and exotrophic larval stages of Atlantic halibut(Hippoglossus hippoglossus L.)[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,1998,119(3):787-793.
[12] RØNNESTAD I,HELLAND S,LIE Ø.Feeding Artemia to larvae of Atlantic halibut(Hippoglossus hippoglossus L.)results in lower larval vitamin A content compared with feeding copepods[J].Aquaculture,1998,165(1/2):159-164.
[13] 于孝东,姚维志,栾会妮,等.虾青素的开发及其在水产养殖上的应用[J].饲料博览,2005(4):42-45.
YU X D,YAO W Z,LUAN H N,et al.Development of astaxanthin and its application in aquaculture[J].Feed Review,2005(4):42-45.(in Chinese)
[14] WANG W L,ISHIKAWA M,KOSHIO S,et al.Effects of dietary astaxanthin and vitamin E and their interactions on the growth performance,pigmentation,digestive enzyme activity of kuruma shrimp(Marsupenaeus japonicus)[J].Aquaculture Research,2019,50(4):1186-1197.
[15] 温为庚,林黑着,吴开畅,等.饲料中添加虾青素对斑节对虾生长和免疫指标的影响[J].中山大学学报(自然科学版),2011,50(3):144-146.
WEN W G,LIN H Z,WU K C,et al.Effects of dietary with astaxanthin on growth and immunological parameters of black tiger shrimp,Penaeus monodon[J].Acta Scientiarum Naturalium Universitatis Sunyatseni,2011,50(3):144-146.(in Chinese)
[16] HAN T,LI X Y,WANG J T,et al.Effects of dietary astaxanthin(AX)supplementation on pigmentation,antioxidant capacity and nutritional value of swimming crab,Portunus trituberculatus[J].Aquaculture,2018,490:169-177.
[17] 张晓红,吴锐全,王海英,等.虾青素与螺旋藻对血鹦鹉体色的影响[J].大连水产学院学报,2009,24(1):79-82.
ZHANG X H,WU R Q,WANG H Y,et al.Effect of dietary astaxanthin and Spirulina on pigmentation of blood parrot(Cichlasoma citrinellum × C.synspilum)[J].Journal of Dalian Fisheries University,2009,24(1):79-82.(in Chinese)
[18] BOONYAPAKDEE A,POOTANGON Y,LAUDADIO V,et al.Astaxanthin extraction from golden apple snail(Pomacea canaliculata)eggs to enhance colours in fancy carp(Cyprinus carpio)[J].Journal of Applied Animal Research,2015,43(3):291-294.
[19] 王军辉,熊建利,张东洋,等.饲料中添加虾青素对锦鲤生长、体色、抗氧化能力和免疫力的影响[J].动物营养学报,2019,31(9):4144-4151.
WANG J H,XIONG J L,ZHANG D Y,et al.Effects of astaxanthin supplementation on growth,body color,antioxidant capability and immunity of kio carp(Cyprinus carpio L.)[J].Chinese Journal of Animal Nutrition,2019,31(9):4144-4151.(in Chinese)
[20] AMBATI R R,PHANG S M,RAVI S,et al.Astaxanthin:sources,extraction,stability,biological activities and its commercial applications:a review[J].Marine Drugs,2014,12(1):128-152.
[21] JOHNSTON R K,SIEGFRIED E J,SNELL T W,et al.Effects of astaxanthin on Brachionus manjavacas(Rotifera)population growth[J].Aquaculture Research,2018,49(6):2278-2287.
[22] HAMRE K,SRIVASTAVA A,RØNNESTAD I,et al.Several micronutrients in the rotifer Brachionus sp.may not fulfil the nutritional requirements of marine fish larvae[J].Aquaculture Nutrition,2008,14(1):51-60.
[23] 刘晓慧.不同来源的虾青素对凡纳滨对虾幼虾的影响及作用机制[D].青岛:中国科学院大学(中国科学院海洋研究所),2018.
LIU X H.Effects and mechanism of astaxanthin from different sources on Litopenaeus vannamei[D].Qingdao: University of Chinese Academy of Sciences(Institute of Oceanology,Chinese Academy of Sciences),2018.(in Chinese)
[24] 游奎,杨红生,刘鹰,等.不同光源及光照时间对凡纳滨对虾(Litopenaeus vannamei)游离虾青素含量及生长的影响[J].海洋与湖沼,2005,36(4):296-301.
YOU K,YANG H S,LIU Y,et al.Effect of different light source and light application time on free astaxanthin concentrations and growth of shrimp Litopenaeus vannamei[J].Oceanologia et Limnologia Sinica,2005,36(4):296-301.(in Chinese)
[25] 江巍.褶皱臂尾轮虫高密度培育技术的研究[D].厦门:集美大学,2008.
JIANG W.The high density cultivation of Brachionus plicatilis[D].Xiamen:Jimei University,2008.(in Chinese)
[26] 刘鑫,王伟,姜玉声,等.VC发酵废液投喂褶皱臂尾轮虫的可行性研究[J].大连海洋大学学报,2020,35(3):333-338.
LIU X,WANG W,JIANG Y S,et al.Potentiality of cultivation of rotifer Brachionus plicatilis with vitamin C fermentation wastes[J].Journal of Dalian Ocean University,2020,35(3):333-338.(in Chinese)
[27] SAHANDI J,JAFARYAN H.Rotifer(Brachionus plicatilis)culture in batch system with suspension of algae(Nannochloropsis oculata)and bakery yeast(Saccharomyces cerevisiae)[J].Aquaculture Aquarium Conservation & Legislation,2011,4(4):526-529.
[28] RODRIGUES R V,MALTEZ L C,FERREIRA C C,et al.ROS in vivo determination and antioxidant responses in rotifers Brachionus plicatilis fed with commercial yeast Saccharomyces cerevisiae or microalgae Nannochloropsis oculata[J].Aquaculture International,2021,29(4):1657-1667.
[29] 温小波,库夭梅,罗静波.克氏原螯虾耗氧率及窒息点的研究[J].大连水产学院学报,2003,18(3):170-174.
WEN X B,KU Y M,LUO J B.Studies on the oxygen consumption rate and asphyxiant point of the red swamp crawfish Procambrus clarkii[J].Journal of Dalian Fisheries University,2003,18(3):170-174.(in Chinese)
[30] BERGEIJK S A,PAULLADA SALMER N J A,L
N J A,L PEZ P
PEZ P REZ A I,et al.Lutein enrichment of the rotifer Brachionus sp.using freeze-dried Muriellopsis sp.cells[J].Aquaculture Research,2013,44(11):1724-1730..
REZ A I,et al.Lutein enrichment of the rotifer Brachionus sp.using freeze-dried Muriellopsis sp.cells[J].Aquaculture Research,2013,44(11):1724-1730..
[31] BAER A,LANGDON C,MILLS S,et al.Particle size preference,gut filling and evacuation rates of the rotifer Brachionus “Cayman” using polystyrene latex beads[J].Aquaculture,2008,282(1/2/3/4):75-82.
[32] SNELL T W,HOFF F H.Fertilization and male fertility in the rotifer Brachionus plicatilis[J].Hydrobiologia,1987,147(1):329-334.