中国是世界第一大水产品生产与消费国,水产种业作为现代渔业发展第一产业要素,在水产生物产业链中占有引领性的战略地位,是确保水产品有效供给和国民优质动物蛋白供应的重要物质基础[1-3]。因此,加快水产种质创新,是中国渔业发展和科技竞争力提高的必然要求。
在育种学上,家系是指由共同祖先繁殖的子代[4],其为育种学和经典遗传学提供了不可或缺的基础材料。家系建立是贝类育种工作的基础,近年来,国内水产动物遗传育种工作得到了长足发展,并相继构建了不同规模的家系。董在杰等[5]建立了60个吉富罗非鱼Oreochromis niloticus家系,并从中挑选出体质量生长速度最快的59号家系;关健[6]建立了31个大菱鲆Scophthalmus maximus家系,选育出7个生长性状优良家系;张吕平等[7]建立了62个凡纳滨对虾Litopenaeus vannamei 全同胞家系,选育出7个具有明显生长优势的家系。在贝类育种中,家系选择育种的方法应用广泛。王雪磊等[8]采用巢式设计,构建了壳金长牡蛎Crassostrea gigas 25个全同胞家系,成功选育出G19和G28家系作为育种材料;张兴志等[9]通过家系建立结合高盐环境养殖的方法选育出B1、B2、I1、J1和J2香港牡蛎C.hongkongensis耐高盐品系;孙欣等[10]采用巢式设计,建立了獐子岛红虾夷扇贝Patinopecten yessoensis 12个父系半同胞和36个母系全同胞家系,选育出生长、抗逆性状优良的D2、I1家系作为育种材料。这些优良家系的建立为水产动物选育工作提供了丰富的遗传材料。在家系建立的基础上,为了制定科学有效的育种计划需要进行遗传参数估计。目前,国内外关于贝类的遗传参数评估研究已有较多报道,主要集中在九孔鲍Haliotis diversicolor supertexta[11]、菲律宾蛤仔Ruditapes philippinarum[12]和硬壳蛤Mercenaria mercenaria[13]等贝类。
菲律宾蛤仔(以下简称“蛤仔”)属广温、广盐性种类,原产于亚洲太平洋和印度洋沿岸,在中国北起辽宁,南至广西、海南均有分布。蛤仔是中国传统“四大养殖贝类”之一,年产量300多万t,占世界养殖产量的90%以上,占中国海水贝类养殖产量的22%[14]。目前,中国蛤仔产业正处于创新驱动、结构转型升级的关键期,制约蛤仔养殖产业健康可持续发展的突出问题是北方蛤仔养殖长期严重依赖南方苗种,且大部分为野生型苗种,经过多年的人工繁殖已出现种质退化等问题,导致品质下降、养殖效益降低[12]。中国莱州群体属“壳宽型”蛤仔,本课题组对辽宁营口及大连獐子岛、山东莱州及荣成、河北嘴东、福建连江、广西北海7个地理群体蛤仔壳型遗传变异研究表明,莱州群体壳型最“饱满”,类似于球状(壳宽/壳长=0.549 6,腹面观椭圆指数EIV=0.954 3),且出肉率、壳腔体积、壳质量、壳密度等生长指标均属最高。Tan等[15]开展了东亚沿岸7个野生蛤仔群体的遗传多样性研究,指出莱州群体遗传多样性最高,对环境适应能力较强,是重要的种质资源,可用于种质资源保护和开发利用。2007年以来,中国学者已开展了大量的蛤仔遗传育种工作,闫喜武等[16]、霍忠明等[17] 构建了不同群体、不同壳色蛤仔家系,并估算了生长性状遗传参数。但关于莱州群体蛤仔的选育工作尚未开展。本研究中,在蛤仔莱州群体中挑选壳色为红色的个体作为“莱州红”蛤仔基础群体,采用巢式设计建立家系,系统开展了蛤仔“莱州红”品系生长性状家系聚类分析和遗传参数估计,以期为 “莱州红”蛤仔品系选择育种提供理论依据。
1 材料与方法
1.1 材料
于2019年4月从山东莱州采集亲贝,选择无损伤、壳色为红色、活力较强的2龄野生蛤仔1 000枚作为基础繁殖群体。
1.2 方法
1.2.1 试验设计 2019年6月,将性腺发育成熟的 “莱州红”蛤仔亲贝移入室内,阴干后开始产卵排精。根据巢式设计[18],即1个父本与3个母本交配(表1),共建立11个父系半同胞和33个母系全同胞家系。将受精卵分别转入60 L塑料白桶内连续充气孵化,密度为5~6 ind./mL。
表1 巢式设计
Tab.1 Method of nest mating design

父本 sire母本 dam家系子一代 family F1…父本 sire母本 dam家系子一代 family F1♂A♀1A1♀2A2♀3A3♂B, …,♂J♂K♀1K1♀2K2♀3K3
1.2.2 幼虫培育 幼虫期试验在60 L桶内进行,每隔一天进行全量换水。试验前期投喂等鞭金藻,随着幼虫的生长,投喂等鞭金藻与小球藻的混合藻(体积比为1∶1),投饵量根据幼虫的实际摄食情况而定。试验过程中,水温为22.8~29.4 ℃, pH为8.05~8.21,盐度为24~29,定期调整各家系培育密度,使其保持每桶幼虫密度为3~4 ind./mL。
1.2.3 稚贝培育 将75日龄稚贝转入3 m3玻璃钢槽内进行中间育成,用对角线长245 μm的网袋在玻璃钢槽内进行挂袋培育,每袋装入约200枚稚贝,试验期间投喂小球藻膏,藻膏细胞密度为4×1010cells/g。试验水温为21.4~27.2 ℃,pH为8.05~8.24,盐度为22.8~27.6。当稚贝100日龄时,将各家系稚贝转入辽宁庄河石城岛海域进行越冬,用对角线长830 μm的网袋进行养殖,根据稚贝大小定期更换网袋,并保持培育密度一致,每袋装入约100枚稚贝。
1.2.4 指标测定与计算 测量各家系4、16、50、75、100、200日龄时的壳长和壳高,并计算各家系绝对增长量。计算公式为
G=(X1-X0)/(t1-t0)。
其中:G为绝对增长量(μm/d);X0为第一次测量时的壳长(壳高)(μm);X1为最后一次测量时的壳长(壳高)(μm);t0为第一次测量时的日龄(d);t1为最后一次测量时的日龄(d)。
1.2.5 聚类分析 采用R软件对蛤仔群体进行聚类分析,参照石蕾[19]的方法。具体过程为:将数据标准化,计算欧氏距离(Euclidean),采用离差平方和法计算类间距离,最后绘制出聚类树状图。按照蛤仔发育阶段,分为4个阶段进行聚类分析,分别为浮游期(0~16 d)、稚贝期(50~75 d)、室内混养期(75~100 d)和室外混养期(100~200 d)。同时,将33个家系分为4类进行分析。
1.2.6 遗传参数估计 采用约束性极大似然法(REML)进行遗传参数估计。参照张景晓等[20]方法计算遗传力、遗传相关和表型相关,采用LRT法[21]对2种遗传相关进行显著性检验。
1.3 数据处理
采用SPSS 17.0软件对试验数据进行单因素方差分析(one-way ANOVA),采用Tukey 法进行组间多重比较,差异显著性水平设为0.05。
2 结果与分析
2.1 浮游幼虫的生长性能及家系聚类分析
4~16日龄幼虫33个家系的壳长、壳高绝对增长量排名结果(表2)显示:浮游幼虫平均壳长绝对增长量为(6.32±0.67)μm/d,有14个家系高于平均值,壳长绝对增长量排名前五名的家系依次为E1、I2、C2、F2和A2,前五名与后五名间有显著性差异(P<0.05);平均壳高绝对增长量为(6.69±0.80)μm/d,有14个家系高于平均值,壳高绝对增长量排名前五的家系依次为E1、F2、E3、I2和H2,前五名与后五名间有显著性差异(P<0.05)。
表2 浮游期幼虫壳长、壳高生长性能排名表
Tab.2 Rank of growth performance on shell length and shell height of planktonic larvae

排名ranking家系family壳长绝对增长量/(μm·d-1)absolute increasein shell length家系family壳高绝对增长量/(μm·d-1)absolute increase in shell height1E17.53±0.68aE18.22±0.76a2I27.28±0.61abF28.16±0.32a3C27.25±0.54abcE37.98±1.15ab4F27.12±0.67abcdI27.75±0.64ab5A26.98±1.11abcdeH27.51±0.97abc6E36.98±1.00abcdeC27.36±0.43bcd7I36.91±0.56abcdefA27.33±0.87bcde8D36.78±0.36bcdefgJ27.33±1.10bcde9J26.75±0.86bcdefgC37.28±0.86bcdef10C36.54±0.89cdefghD37.28±0.82bcdef11F16.53±0.94cdefghH36.87±0.95cdefg12G16.44±1.03defghiH16.82±0.57cdefg13H26.43±0.81efghijB36.79±0.65cdefg14H36.33±1.05fghijkG16.76±0.89cdefg15B16.30±0.60fghijkF16.62±1.09defgh16F36.25±0.82fghijkI36.54±1.04defgh17B36.18±0.67ghijklD16.53±2.80efghi18H16.16±0.65ghijklI16.53±0.83efghi19J36.11±0.40ghijklF36.49±0.60fghi20G36.10±0.37ghijklB16.43±0.66ghi21B26.08±0.61ghijklD26.30±0.46ghi22J16.04±0.69ghijklA36.28±0.75ghi23K36.03±0.45ghijklK36.24±0.60ghi24I16.03±0.49ghijklG36.22±0.48ghi25K25.96±0.80hijklJ36.19±0.52ghi26D25.92±0.34hijklK26.15±0.96ghij27D15.86±0.53hijklB26.07±0.64ghij28A35.78±0.87hijklC15.90±0.52hij29K15.74±0.50ijklE25.90±1.11hij30C15.65±0.46jklJ15.90±0.55hij31A15.57±0.32klK15.90±0.68hij32G25.57±0.90klA15.70±0.65ij33E25.41±0.49lG25.37±0.49j平均值average6.32±0.676.69±0.80
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
对4~16日龄幼虫各家系壳长、壳高及绝对增长量数据进行聚类分析。从图1、表3可见:第Ⅰ类包括12个家系,这一类4日龄表型值相对较高,16日龄表型值为4类中最小,生长趋势为先快后慢,整个浮游期表现为生长劣势;第Ⅱ类包括10个家系,这一类生长趋势与第Ⅰ类相似,除4日龄外,无论是表型值还是绝对增长量均比第Ⅰ类大;第Ⅲ类包括9个家系,这一类4日龄表型值最小,16日龄表型值仅次于第Ⅳ类,生长趋势为先慢后快,这导致其浮游期绝对增长量大于第Ⅰ类和第Ⅱ类;第Ⅳ类包括2个家系,这一类表型值最大,生长速度最快,在浮游期表现出了较大的生长优势。
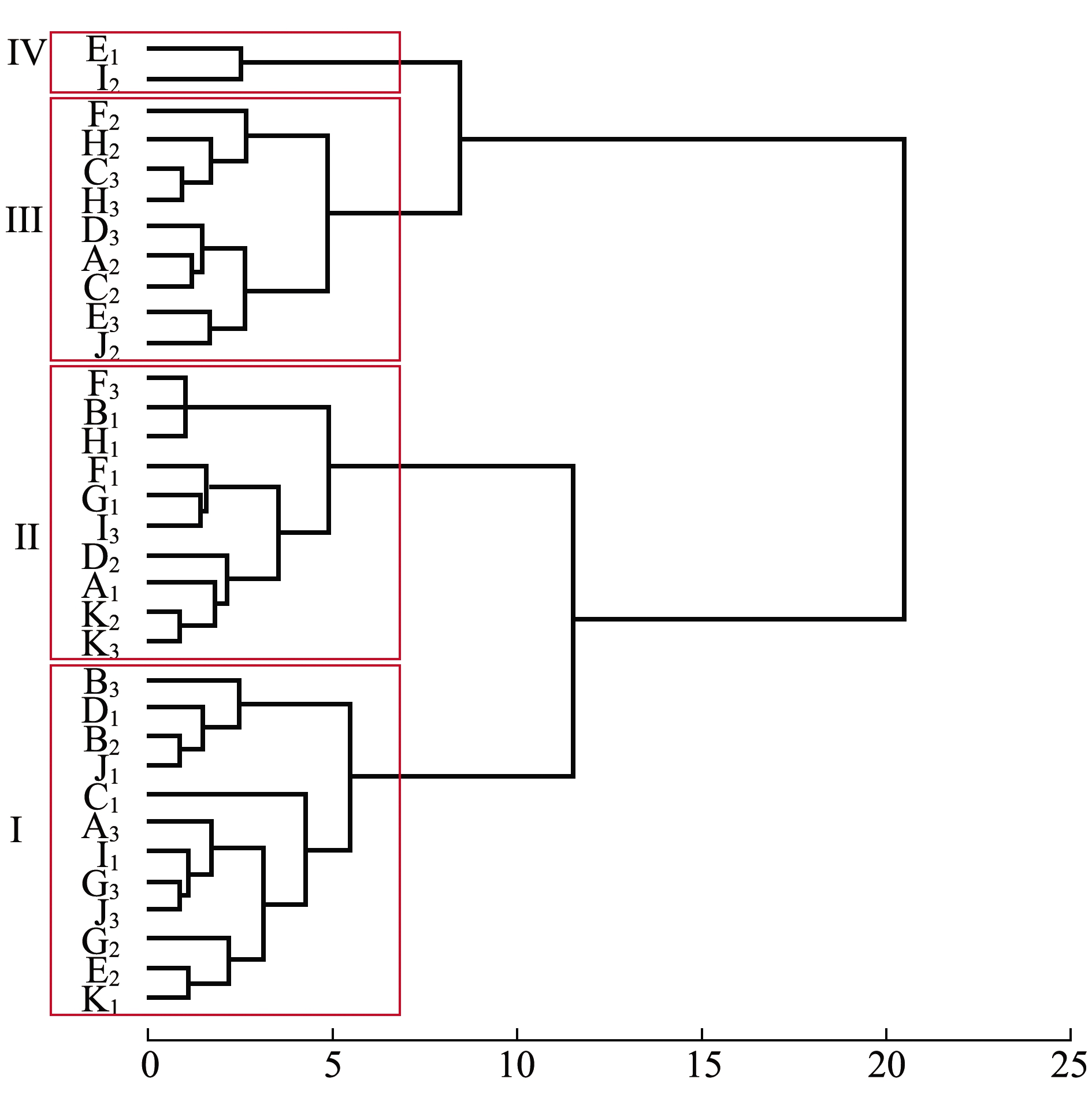
图1 浮游期33个全同胞家系聚类分析
Fig.1 Cluster analysis of 33 full-sib families in the planktonic larval stage
表3 浮游期各类群生长性状的平均值
Tab.3 Average values of growth traits in various groups at the planktonic larval stage
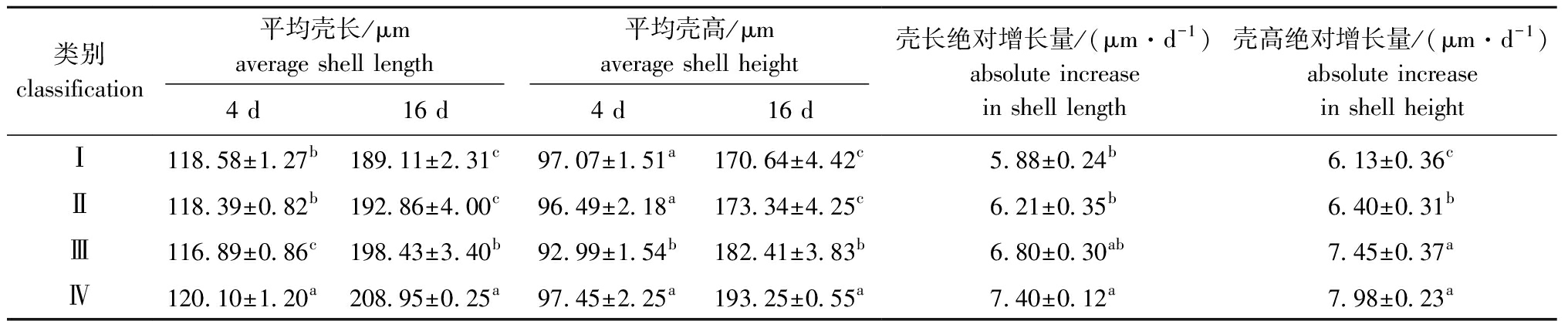
类别classification平均壳长/μmaverage shell length平均壳高/μmaverage shell height4 d16 d4 d16 d壳长绝对增长量/(μm·d-1)absolute increasein shell length壳高绝对增长量/(μm·d-1)absolute increasein shell heightⅠ118.58±1.27b189.11±2.31c97.07±1.51a170.64±4.42c5.88±0.24b6.13±0.36cⅡ118.39±0.82b192.86±4.00c96.49±2.18a173.34±4.25c6.21±0.35b6.40±0.31bⅢ116.89±0.86c198.43±3.40b92.99±1.54b182.41±3.83b6.80±0.30ab7.45±0.37aⅣ120.10±1.20a208.95±0.25a97.45±2.25a193.25±0.55a7.40±0.12a7.98±0.23a
2.2 稚贝的生长性能及家系聚类分析
50~75日龄稚贝33个家系的壳长、壳高绝对增长量排名结果(表4)显示:稚贝壳长平均绝对增长量为(61.77±38.42)μm/d,有13个家系高于平均值,壳长绝对增长量排名前五的家系依次为G3、F1、F2、B2和B1,前五名与后五名间有显著性差异(P<0.05);壳高平均绝对增长量为(61.03±31.07)μm/d,有13个家系高于平均值,壳高绝对增长量排名前五的家系依次为G3、F1、B2、F3和B1,前五名与后五名间有显著性差异(P<0.05)。
表4 稚贝期稚贝壳长、壳高生长性能排名表
Tab.4 Rank of growth performance in shell length and shell height in juvenile Manila clam

排名ranking家系family壳长绝对增长量/(μm·d-1)absolute increase in shell length家系family壳高绝对增长量/(μm·d-1)absolute increasein shell height1G3167.26±63.14aG3133.35±42.90a2F1104.24±84.21bF191.05±65.63b3F2103.67±76.01bB288.51±74.59bc4B2101.84±101.29bF383.90±42.21bcd5B190.44±77.55bcB181.66±59.93bcde6F387.07±50.67bcdF279.28±50.07bcdef7G280.61±47.25bcdeG278.85±42.74bcdef8C280.57±45.19bcdeC275.95±39.00bcdefg9K177.16±46.81bcdefA169.81±37.03bcdefgh10D173.65±54.86bcdefgI367.55±34.30bcdefgh11J169.90±24.64bcdefgD166.69±41.25bcdefgh12J369.84±43.98bcdefgK166.29±31.65bcdefgh13A162.91±41.87bcdefgJ165.33±21.91bcdefgh14K355.93±24.71cdefgJ360.87±35.35bcdefgh15E155.92±56.39cdefgE159.51±46.05bcdefgh16D255.30±31.53cdefgH358.09±19.61cdefgh17H354.67±24.80cdefgH255.82±17.61defgh18I353.77±34.55cdefgD255.65±25.54defgh19D352.24±20.25cdefgD355.57±14.41defgh20I150.39±28.82cdefgK355.31±17.70defgh21H249.03±21.86cdefgI153.96±22.49defgh22C343.07±18.47defgE351.00±43.46efgh23G141.97±13.00efgC350.17±15.99efgh24K240.57±18.92efgH147.58±23.72fgh25B339.37±20.50efgG147.56±12.55fgh26E237.84±41.40efgK246.71±16.17fgh27H137.22±35.93efgB344.27±18.65gh28E336.67±16.81efgI243.85±19.91gh29A235.73±29.31efgA242.67±24.71h30A334.12±16.43fgJ241.04±14.47h31J233.34±19.48fgA340.54±13.97h32C131.44±11.09gE237.88±30.25h33I230.69±26.06gC137.60±9.63h平均值average61.77±38.4261.03±31.07
对50~75日龄稚贝各家系壳长、壳高及绝对增长量数据进行聚类分析。从图2、表5可见:第Ⅰ类包括7个家系,这一类50日龄表型值仅次于第Ⅱ类,75日龄表型值显著大于其他3类(P<0.05),
表5 稚贝期各类群生长性状的平均值
Tab.5 Average values of growth performance in various groups during juvenile stage

类别classification平均壳长/μmaverage shell length平均壳高/μmaverage shell height50 d75 d50 d75 d壳长绝对增长量/(μm·d-1)absolute increasein shell length壳高绝对增长量/(μm·d-1)absolute increasein shell heightⅠ0.50±0.06b3.01±0.79a0.47±0.06b2.37±0.51a101.5±31.34a88.82±18.15aⅡ0.67±0.06a1.68±0.22c0.56±0.04a1.44±0.14c40.42±9.38c47.21±7.90dⅢ0.35±0.06c1.47±0.20c0.32±0.05c1.32±0.20c44.58±8.75c50.36±7.79cⅣ0.36±0.03c2.27±0.17b0.33±0.03c1.80±0.17b76.93±7.14b69.46±7.07b
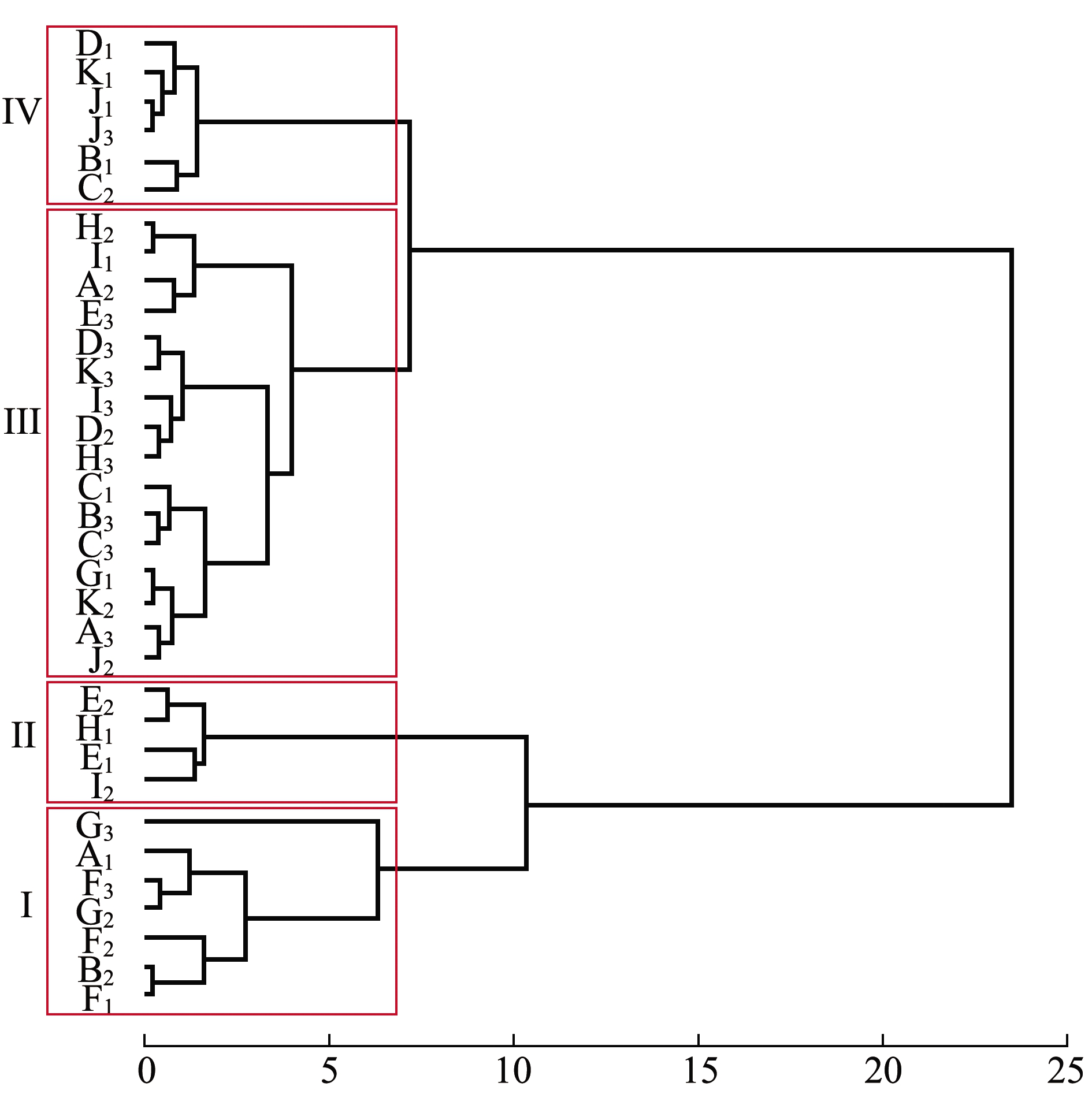
图2 稚贝期33个全同胞家系聚类分析
Fig.2 Cluster analysis of 33 full-sib families in Manila clam juvenile stage
绝对增长量显著大于其他3类(P<0.05),整个稚贝期表现为生长优势;第Ⅱ类包括4个家系,这一类50日龄表型值最大,但是生长缓慢,75日龄表型值显著小于第Ⅰ、第Ⅳ类(P<0.05);第Ⅲ类包括16个家系,这一类表型值均为最小,绝对增长量仅比第Ⅱ类略大(P>0.05),整个稚贝期表现为生长劣势;第Ⅳ类包括6个家系,这一类家系50日龄表型值仅比第Ⅲ类略大(P>0.05),但75日龄时表型值仅次于第Ⅰ类,绝对增长量也仅次于第Ⅰ类且显著大于第Ⅱ、Ⅲ类(P<0.05)。
2.3 室内混养期幼贝的生长性能及家系聚类分析
75~100日龄幼贝33个家系壳长、壳高绝对增长量排名结果(表6)显示:室内混养期幼贝壳长平均绝对增长量为(123.93±48.05)μm/d,有15个家系高于平均值,壳长绝对增长量排名前五的家系依次为H3、K3、C3、K1和I3,前五名与后五名间有显著性差异(P<0.05);壳高平均绝对增长量为(86.17±36.71)μm/d,有17个家系高于平均值,壳高绝对增长量排名前五的家系依次为J3、H3、K3、C3和K1,前五名与后五名间有显著性差异(P<0.05)。
表6 室内混养期幼贝壳长、壳高生长性能排名表
Tab.6 Rank of growth performance on shell length and shell height during indoor spat stage

排名ranking家系family壳长绝对增长量/(μm·d-1)absolute increase in shell length家系family壳高绝对增长量/(μm·d-1)absolute increasein shell height1H3183.87±64.45aJ3125.37±49.91a2K3176.76±46.53abH3121.73±48.58ab3C3169.97±39.52abcK3117.23±34.91abc4K1157.80±61.99abcdC3115.30±29.44abc5I3155.00±55.64bcdeK1109.95±44.13abcd6H2154.87±36.29bcdeJ1109.67±37.18abcd7J3145.07±62.87cdefK2105.13±24.38abcde8J1144.03±44.93cdefH2104.63±28.44bcde9G2140.17±53.81defgD2103.27±38.23bcdef10G1140.00±41.48defgG1102.50±32.76bcdefg11D3139.70±45.02defgI399.70±43.66cdefgh12D2138.80±48.05defgG296.73±38.86cdefghi13K2136.83±30.15defgA292.90±28.71defghij14A2134.23±36.38defghD391.60±27.33defghijk15J2127.27±23.13efghiD191.30±48.42defghijk16A3121.90±33.95fghijJ289.97±19.26defghijk17D1121.50±64.45fghijE288.10±32.66efghijk18E3121.00±38.44fghijI184.30±38.39efghijkl19E2119.66±47.84fghijA382.27±23.85fghijklm20I1118.63±55.41fghijF281.50±47.65ghijklm21C1118.33±24.19fghijB380.43±21.20hijklmn22C2112.37±44.23ghijkC179.17±17.48hijklmn23B3110.00±26.66ghijkE377.87±42.40ijklmn24E1106.50±60.67hijklC277.70±35.84ijklmn25F2106.23±75.17hijklF172.60±48.69jklmno26A1105.33±44.40hijklH171.30±25.65klmno27H1102.40±34.63ijklE167.00±44.21lmnop28F197.47±65.00ijklmA166.37±34.17lmnop29F395.50±61.68jklmF363.07±47.72mnop30I288.29±17.50klmI260.33±15.06nop31B280.17±76.18lmB254.43±14.52opq32B171.77±72.59mnB150.57±14.13pq33G348.41±12.31nG340.53±15.76q平均值average123.93±48.0586.17±36.71
对75~100日龄幼贝各家系的壳长、壳高及绝对增长量数据进行聚类分析。从图3、表7可见:第Ⅰ类包括6个家系,这一类家系75日龄表型值仅次于第Ⅱ类,100日龄表型值仅比第Ⅳ类大,绝对增长量仅比第Ⅱ类大;第Ⅱ类包括1个家系,这一类家系表型值均为四类中最大,但是绝对增长量却是最小;第Ⅲ类包括10个家系,这一类家系75日龄表型值仅比第Ⅳ类大,100日龄表型值仅次于第Ⅱ类,这一类家系绝对增长量显著大于其他三类(P<0.05);第Ⅳ类包括16个家系,表型值均最小,绝对增长量仅次于第Ⅲ类。
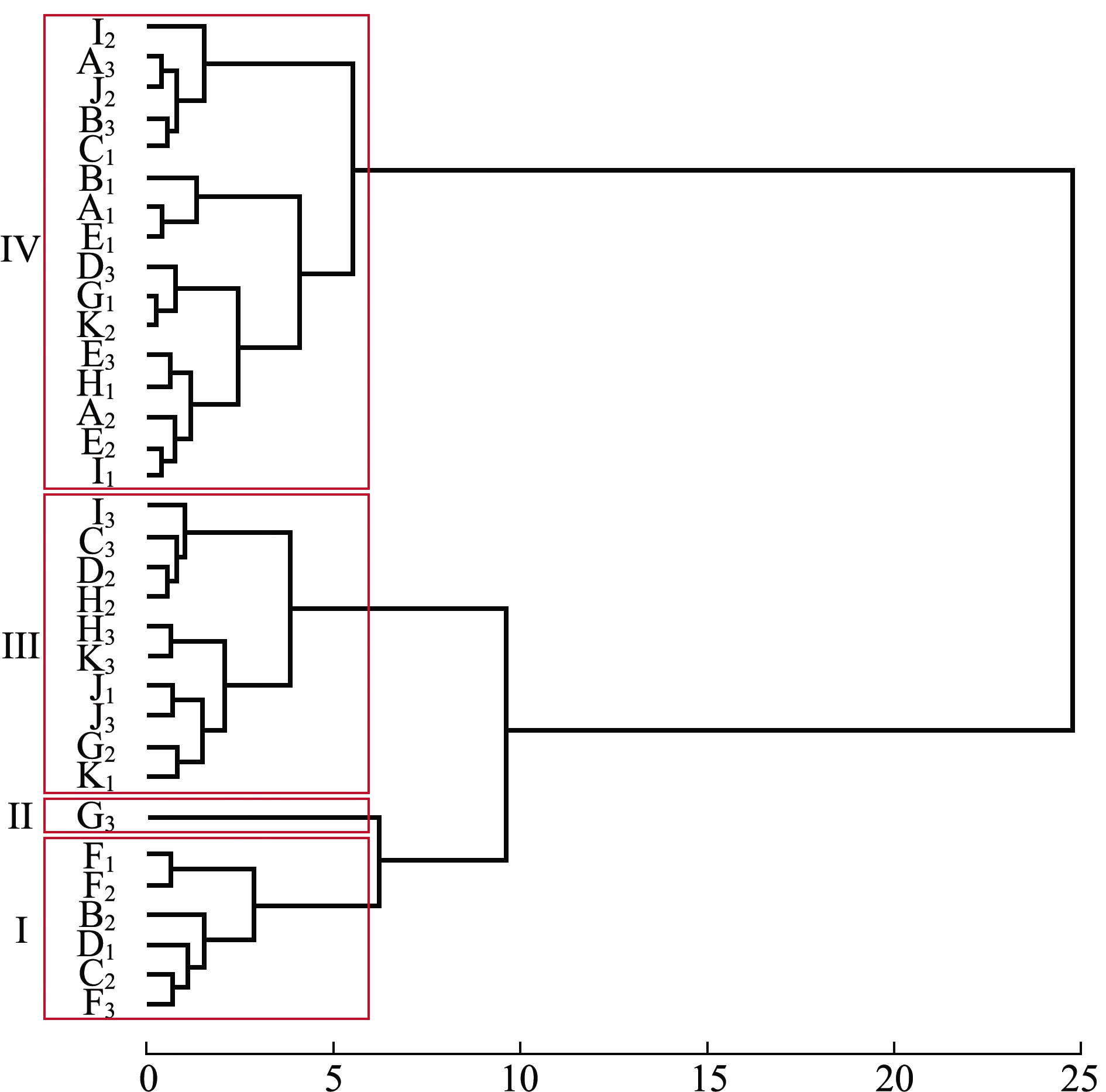
图3 室内混养期33个全同胞家系聚类分析
Fig.3 Cluster analysis of 33 full-sib families during indoor mixing rearing period
表7 室内混养期幼贝各类群生长性状的平均值
Tab.7 Average values of growth traits in various groups during indoor spat stage
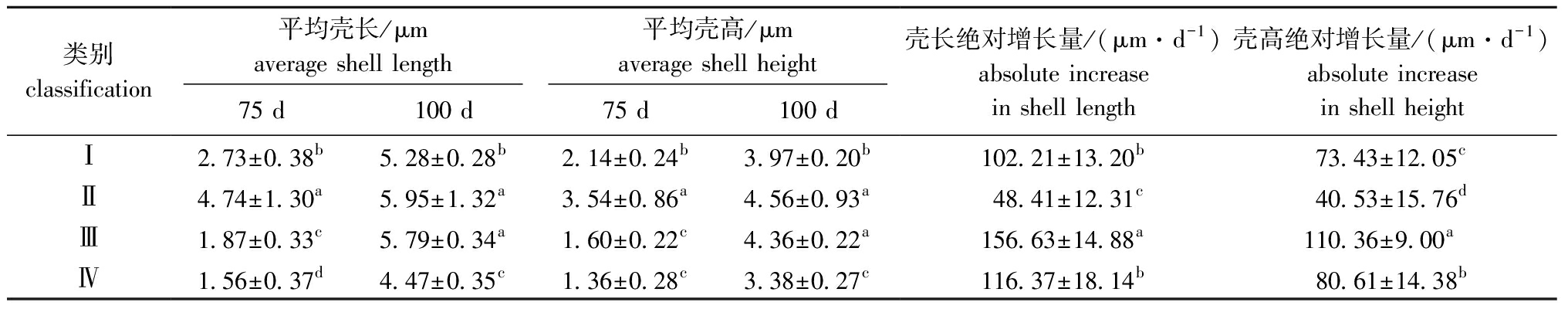
类别classification平均壳长/μmaverage shell length平均壳高/μmaverage shell height75 d100 d75 d100 d壳长绝对增长量/(μm·d-1)absolute increasein shell length壳高绝对增长量/(μm·d-1)absolute increasein shell heightⅠ2.73±0.38b5.28±0.28b2.14±0.24b3.97±0.20b102.21±13.20b73.43±12.05cⅡ4.74±1.30a5.95±1.32a3.54±0.86a4.56±0.93a48.41±12.31c40.53±15.76dⅢ1.87±0.33c5.79±0.34a1.60±0.22c4.36±0.22a156.63±14.88a110.36±9.00aⅣ1.56±0.37d4.47±0.35c1.36±0.28c3.38±0.27c116.37±18.14b80.61±14.38b
2.4 室外培育期幼贝的生长性能及家系聚类分析
100~200日龄幼贝30个家系(室外培育过程中家系D1、E3、F3死亡)壳长、壳高绝对增长量排名结果(表8)显示:室内混养期,壳长平均绝对增长量为(54.27±38.61)μm/d,有20个家系高于平均值,壳长绝对增长量排名前五的家系依次为I3、G3、K3、J1和H2,前五名与后五名间有显著性差异(P<0.05);壳高平均绝对增长量为(38.69±18.49)μm/d,有19个家系高于平均值,壳高绝对增长量排名前五的家系依次为H3、I3、K3、J1和H2,前五名与后五名间有显著性差异(P<0.05)。
表8 室外培育期壳长、壳高生长性能排名表
Tab.8 Rank of spat growth performance on shell length and shell height during outdoor culture stage

排名ranking家系family壳长绝对增长量/(μm·d-1)absolute increase in shell length家系family壳高绝对增长量/(μm·d-1)absolute increase in shell height1I380.93±42.54aH358.03±26.94a2G372.73±31.11abI352.60±19.76ab3K371.10±40.40abcK351.47±20.58bc4J170.43±38.20abcdJ150.97±20.67bcd5H268.67±41.26abcdeH250.97±19.86bcd6K268.43±33.41abcdeG347.23±13.94bcde7D265.10±47.14bcdefK245.80±15.51cdef8A162.67±36.76bcdefB145.37±21.42cdef9H162.37±37.69bcdefgK144.27±20.44defg10G162.10±43.97bcdefgA144.23±16.78defg11J361.67±44.70bcdefgH144.13±17.95defg12B360.60±26.64bcdefgD243.50±23.18efg13B160.57±49.27bcdefgG143.50±21.67efg14J260.40±26.41bcdefgD341.70±18.57efgh15K160.17±41.86bcdefgJ241.17±12.34efgh16F158.30±32.15cdefghB340.43±12.73efgh17F257.33±40.38defghiI240.20±15.51efgh18D356.80±40.84efghiF239.90±19.25fgh19I256.60±29.37efghiB239.33±21.02fgh20B254.53±44.61fghiJ338.10±21.59ghi21C349.03±36.34ghijF137.50±14.24ghi22C246.00±40.24hijC235.47±20.23hij23C145.63±31.70hijC334.80±16.27hij24G244.57±29.39ijC132.23±14.54ij25I139.37±53.22jkG230.63±12.91j26E138.27±39.62jkI129.07±25.67j27E232.30±39.18klE128.77±18.97j28A329.70±36.34klE221.08±17.81k29A225.13±33.71lA320.27±17.71k30H36.63±49.84mA216.83±16.64k平均值average54.27±38.6138.69±18.49
对100~200日龄幼贝各家系壳长、壳高及绝对增长量数据进行聚类分析。从图4、表9可见:第Ⅰ类包括8个家系,这一类家系无论是表型值还是绝对增长量均是最大的,整个阶段表现为生长优势;第Ⅱ类包括10个家系,这一类家系100、200日龄表型值仅次于第Ⅰ类,绝对增长量仅比第Ⅳ类大,但与第Ⅲ类无显著性差异(P>0.05);第Ⅲ类包括7个家系,这一类家系100日龄表型值小于其余3组,200日龄表型值仅比第Ⅳ类大,绝对增长量仅次于第Ⅰ类,但与第Ⅱ类差异不大;第Ⅳ类包括5个家系,除100日龄表型值比第Ⅲ类大外,200日龄表型值、绝对增长量均为最小,整个阶段表现为生长劣势。
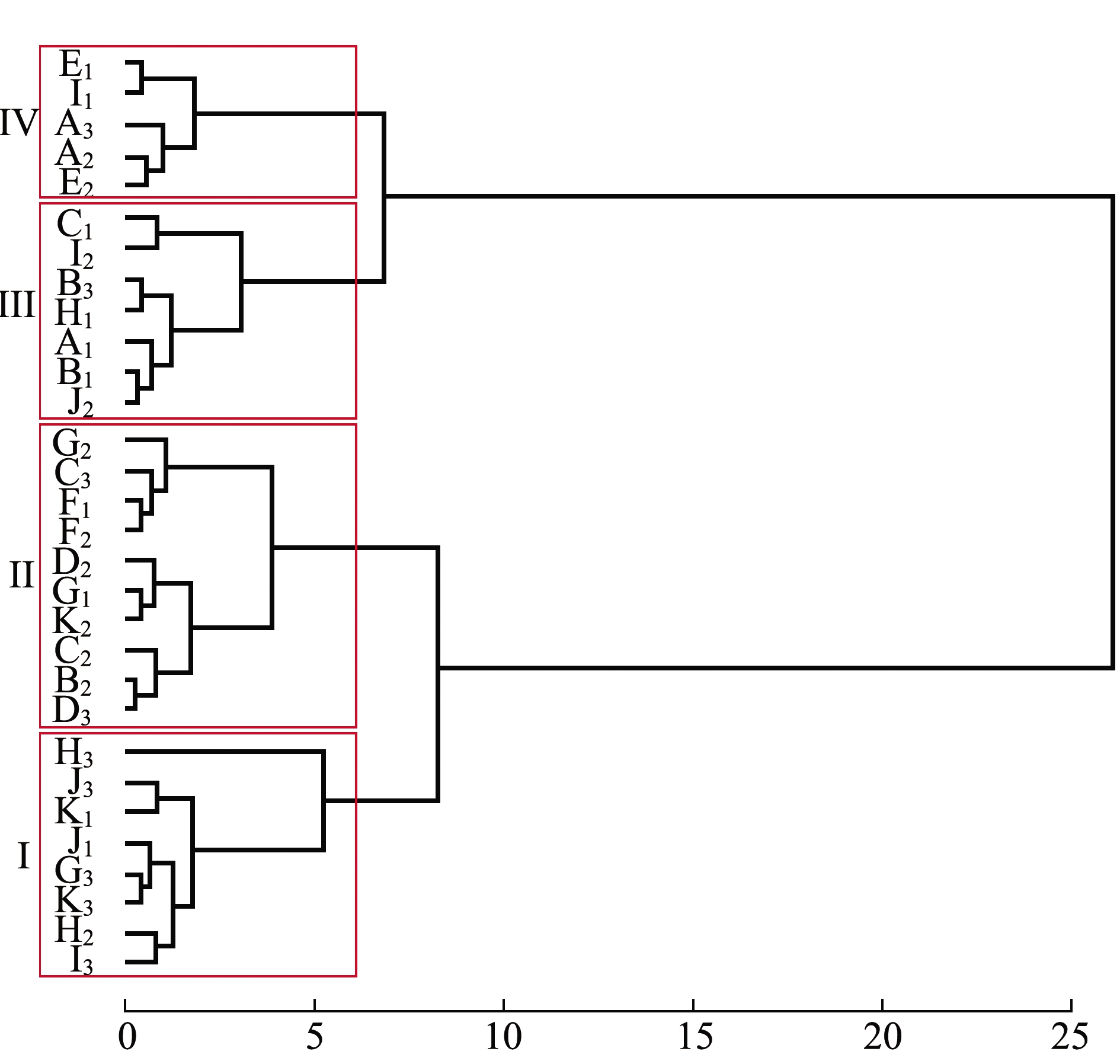
图4 室外培育期30个全同胞家系聚类分析
Fig.4 Cluster analysis of 30 full-sib families during outdoor culture stage
表9 室外培育期各类群生长性状的平均值
Tab.9 Average values of growth traits in various groups during outdoor rearing stage
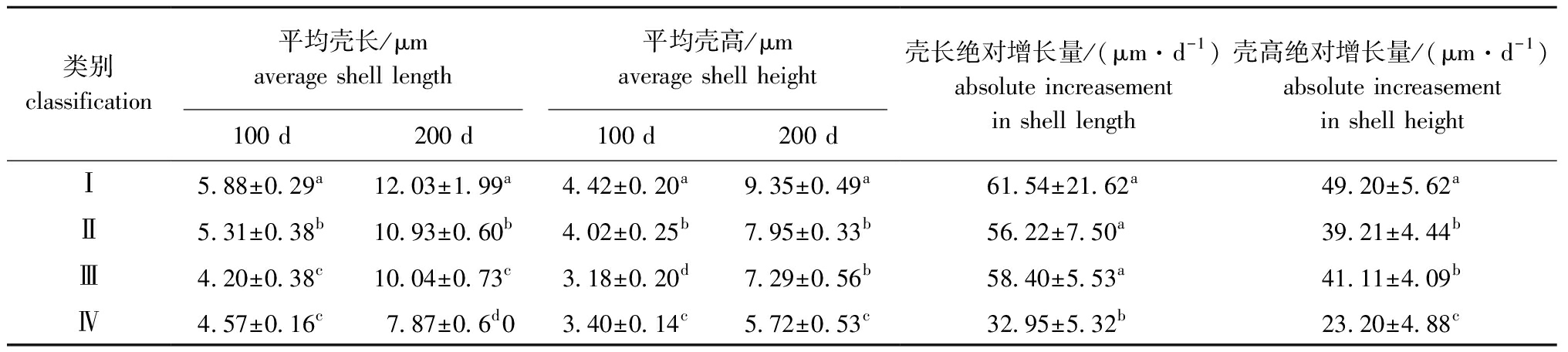
类别classification平均壳长/μmaverage shell length平均壳高/μmaverage shell height100 d200 d100 d200 d壳长绝对增长量/(μm·d-1)absolute increasement in shell length壳高绝对增长量/(μm·d-1)absolute increasement in shell heightⅠ5.88±0.29a12.03±1.99a4.42±0.20a9.35±0.49a61.54±21.62a49.20±5.62aⅡ5.31±0.38b10.93±0.60b4.02±0.25b7.95±0.33b56.22±7.50a39.21±4.44bⅢ4.20±0.38c10.04±0.73c3.18±0.20d7.29±0.56b58.40±5.53a41.11±4.09bⅣ4.57±0.16c7.87±0.6d03.40±0.14c5.72±0.53c32.95±5.32b23.20±4.88c
2.5 “莱州红”蛤仔壳长和壳高的遗传参数估计
采用R软件对壳长和壳高进行相关性分析,结果如表10所示,在100、200日龄时,“莱州红”蛤仔壳长和壳高的遗传相关和表型相关达到极显著水平(P<0.01),相关系数均在92%以上。
采用多性状动物模型计算“莱州红”蛤仔壳长和壳高的遗传力,结果见表10,100日龄的壳长、壳高遗传力分别为(0.35±0.09)、(0.34±0.10),200日龄的壳长、壳高遗传力分别为(0.19± 0.10)、(0.18± 0.11)。
表10 蛤仔“莱州红”100、200日龄壳长与壳高遗传参数分析
Tab.10 Analysis of genetic parameters of shell length and shell height of “Laizhou red”strain of Manila clam Ruditapes philippenarum at the age of 100 and 200 days

日龄/dage遗传相关genetic correlation表型相关phenotypic correlation壳长遗传力heritability of shell length 壳高遗传力heritability of shell height 1000.983 3±0.009 5∗∗0.930 2±0.005 4∗∗0.35± 0.090.34 ±0.102000.999 4±0.012 2∗∗0.924 9±0.008 1∗∗0.19± 0.100.18± 0.11
注: *表示显著相关(P<0.05); **表示极显著相关(P<0.01)。
Note: * means significant correlations(P<0.05);**means very significant correlations(P<0.01).
3 讨论
3.1 生长性状比较分析
生长指标的差异可以反映生物体生长的优劣,目前,对蛤仔生长性状的研究主要集中在不同地理群体、壳形态及壳色的蛤仔生长比较等方面[22-23]。本研究中,“莱州红”在浮游期幼虫壳长、壳高的平均日增长分别为6.32、6.69 μm/d,低于莆田群体(壳长9.63 μm/d、壳高9.79 μm/d)和大连群体(壳长12.20 μm/d、壳高12.47 μm/d)[24]。通过对比发现,“莱州红”蛤仔浮游期生长缓慢,造成差异的原因可能与温度、饵料、性腺发育程度等有关[25]。本研究中发现,“莱州红”蛤仔亲贝从4月初挑选后,转移至大连市庄河池塘内进行促熟,庄河海域水温比莱州海域水温低,可能使蛤仔亲贝性腺发育不齐,蛤仔幼虫生长达不到最适水温,最终导致“莱州红”蛤仔生长发育慢于其他群体。此外,本实验室在开展蛤仔育种工作中发现,同样在庄河海域培育,“莱州红”蛤仔浮游期比其他群体长,推测“莱州红”蛤仔变态有效积温高于其他群体。
3.2 优势家系选择
本研究中采用聚类分析方法,从建立的33个家系中选择优势家系。通过聚类分析既可以看出不同类群间的关系,又可以了解同类内各家系的亲疏远近。因此,聚类分析可作为种质改良中优质亲本的选择依据,该方法在动植物育种工作中已得到了广泛应用[26]。在选择优势家系的过程中,不能只通过一个时期或一个指标的好坏就做出判断,还需要综合各方面因素对各个家系之间进行比较,从而较为科学的选出优势家系。彭慧婧[27]以经2代家系选育的施氏獭蛤Lutraria sieboldii速生品系为亲本,构建了30个全同胞家系,在选择优势家系时,A15家系虽然在生长性状方面并未表现出全阶段的明显优势,但其存活性状明显高于其他家系,因此,最终被选为良种培育材料;丁严冬[28]使用4个不同地理群体的河川沙塘鳢Odontobutis potamophila进行群体内和群体间杂交,建立了48个家系,选出的优势家系F1虽然在体质量增长方面优势不明显,但在体长增长方面优势明显。本研究中,G3家系在稚贝期、室内混养期和室外混养期排名前五,除浮游期外的聚类分析中均处于最好一类,因此,G3家系可以作为建立蛤仔“莱州红”品系的基础群体。
3.3 生长性状遗传参数估计
对遗传力合理有效的评估,可以了解选育动物特定性状遗传给下一代的能力,制定合理的育种计划,可使子代的遗传改进量实现最大化。在前期蛤仔相关研究中,霍忠明[29]采用全同胞组内相关法,估计北方群体蛤仔5月龄壳长和壳高的遗传力,分别为 0.18~0.99 和0.23~0.88;李冬春等[30]利用REML法估计大连石河野生群体90、300、330 日龄的壳长遗传力,分别为 0.264、0.020、0.363。本研究中,采用REML法对 “莱州红”蛤仔100、200日龄生长性状进行评估,100日龄壳长遗传力为0.35± 0.09,壳高为0.34 ±0.10,壳长和壳高均属于中度遗传力;200日龄壳长遗传力为0.19± 0.10,壳高为0.18± 0.11,壳长和壳高均为中低遗传力,本研究结果与前期研究报道结果相近。
基因连锁和基因多效性使得动物个体的数量性状间存在相关性,即对一种性状选择时,会对另一种性状产生间接影响。因此,在育种工作中,有些性状难以从表型上进行度量,就可以通过相关性较大、易测量的性状进行间接选择获得较满意的成效,提高选种效率。此外,在进行间接选择时,也应注意避免产生负向效应[31]。王照旗等[32]对三角帆蚌的遗传参数估计中发现,壳色同生长性状的相关度较低,为 0.02~0.18,无法通过选择较易测量的生长性状对壳色进行间接选育;徐如卫等[33]通过研究凡纳滨对虾生长性状的遗传参数发现,各性状间遗传相关及表型相关均达到极显著水平,这表明以任意一个生长性状为参数进行选育,均可达到改良凡纳滨对虾生长情况的效果。本研究中发现,蛤仔“莱州红”100、200日龄壳长与壳高的遗传相关和表型相关均达到极显著水平,说明在对壳长进行选育时,会对壳高带来显著的间接选育效应。本研究结果可为 “莱州红”蛤仔品系生长性状遗传改良提供科学依据。
4 结论
1)采用“1 雄对 3 雌”的巢式设计方法,建立了 “莱州红”蛤仔11 个父系半同胞家系和 33 个母系全同胞家系,对不同家系4个阶段进行综合评价,结果表明,G3家系具有明显的生长优势,可以作为蛤仔“莱州红”品系选育的核心家系。
2)采用 REML 法估计“莱州红”蛤仔 100、200 日龄壳长和壳高的遗传力属于中低度遗传力,壳长和壳高的遗传相关和表型相关均达到极显著水平。结合各家系表型值的聚类分析和遗传力综合分析发现,可以采用家系选择或群体选育方法对“莱州红”蛤仔生长性状进行逐代选育。
[1] 桂建芳,包振民,张晓娟.水产遗传育种与水产种业发展战略研究[J].中国工程科学,2016,18(3):8-14.
GUI J F,BAO Z M,ZHANG X J.Research on aquatic genetic breeding and development strategy of aquatic seed industry[J].Strategic Study of CAE,2016,18(3):8-14.(in Chinese)
[2] 2021年中央一号文件解读[J].现代农村科技,2021(4):126.
Interpretation of the No.1 Central Document in 2021[J].ModernRural Science and Technology,2021(4):126.(in Chinese)
[3] 唐启升.中国水产种业创新驱动发展战略研究报告[M].北京:科学出版社,2014.
TANG Q S.Research report on innovation-driven development strategy of China’s aquatic seed industry[M].Beijing: Science Press,2014.(in Chinese)
[4] 王学敏,任守文,方晓敏,等.种猪系谱图绘制软件设计与使用[J].猪业科学,2016,33(1):115.
WANG X M,REN S W,FANG X M,et al.Pig pedigree mapping software design and use[J].Swine Industry Science,2016,33(1): 115.(in Chinese)
[5] 董在杰,何杰,朱健,等.60个家系吉富品系罗非鱼初期阶段的生长比较[J].淡水渔业,2008,38(3):32-34.
DONG Z J,HE J,ZHU J,et al.Comparison of growth among 60 families GIFT strain tilapia at initial stage[J].Freshwater Fisheries,2008,38(3):32-34.(in Chinese)
[6] 关健.大菱鲆耐高温品系选育及生长相关数量性状的基础研究[D].青岛:中国海洋大学,2012.
GUAN J.Selective breeding of thermotolerant strain and analysis of growth related traits of turbot Scophthalmus maximus[D].Qingdao:Ocean University of China,2012.(in Chinese)
[7] 张吕平,吴立峰,沈琪,等.凡纳滨对虾全同胞家系的建立及生长比较[J].水产学报,2009,33(6):932-939.
ZHANG L P,WU L F,SHEN Q,et al.Establishment and growth comparison of all-sib families of Litopenaeus vannamei[J].Journal of Fisheries of China,2009,33(6):932-939.(in Chinese)
[8] 王雪磊,李琪,孔令锋,等.壳金长牡蛎家系的建立及生长和存活性状的比较[J].水产学报,2016,40(11):1683-1693.
WANG X L,LI Q,KONG L F,et al.Construction and comparison of growth and survival among different golden shell families of Pacific oyster(Crassostrea gigas)[J].Journal of Fisheries of China,2016,40(11):1683-1693.(in Chinese)
[9] 张兴志,官俊良,何苹萍,等.香港牡蛎野生群体家系建立及耐高盐性筛选[J].南方农业学报,2019,50(2):385-390.
ZHANG X Z,GUAN J L,HE P P,et al.Establishment of families and subsequent high salinity resistance testing for wild population of Crassostrea hongkongensis[J].Journal of Southern Agriculture,2019,50(2):385-390.(in Chinese)
[10] 孙欣,梁峻,赵学伟.虾夷扇贝獐子岛红品系家系建立及生长发育的比较[J].水产科学,2016,35(5):510-515.
SUN X,LIANG J,ZHAO X W.Establishment,family growth and development in Zhangzidao Hong strain of yesso scallop Patinopecten yessoensis[J].Fisheries Science,2016,35(5):510-515.(in Chinese)
[11] 蒋湘,刘建勇,赖志服.九孔鲍幼鲍生长性状的遗传参数估计[J].中国水产科学,2013,20(3):544-550.
JIANG X,LIU J Y,NAI Z F,et al.Genetic parameter estimation of growth traits in small abalone,Haliotis diversicolor supertexta[J].Journal of Fishery Sciences of China,2013,20(3): 544-550.(in Chinese)
[12] 张国范,闫喜武.蛤仔养殖学[M].北京:科学出版社,2010.
ZHANG G F,YAN X W.Clam aquaculture study[M].Beijing:Science Press,2010.(in Chinese)
[13] HEEKENDA E J,AUSTIN J D,ZHANG Z,et al.Phenotypic and genetic identification of Mercenaria mercenaria,Mercenaria campechiensis,and their hybrids[J].Journal of Shellfish Research,2020,39(3):535-546.
[14] 闫喜武,霍忠明.菲律宾蛤仔“斑马蛤2号”[J].中国水产,2022(1):102-106.
YAN X W,HUO Z M.Ruditapes philippinarum“Zebra 2”[J].China Fisheries,2022(1):102-106.
[15] TAN Y,FANG LQIU M,et al.Population genetics of the Manila clam(Ruditapes philippinarum)in East Aisa[J].Scitific Reports,2020,10:21890.
[16] 闫喜武,霍忠明,张跃环,等.菲律宾蛤仔家系的建立及早期生长发育[J].水产学报,2010,34(1):32-40.
YAN X W,HUO Z M,ZHANG Y H,et al.Preliminary study of establishment of families and their early growth and development for Manila clam(Ruditapes philippinarum)[J].Journal of Fisheries of China,2010,34(1):32-40.(in Chinese)
[17] 霍忠明,闫喜武,张跃环,等.菲律宾蛤仔(Ruditapes philippinarum)大连群体家系建立及生长比较[J].海洋与湖沼,2010,41(3):334-340.
HUO Z M,YAN X W,ZHANG Y H,et al.Family system and growth of Dalian population of Manila clam Ruditapes philippinarum[J].Oceanologia et Limnologia Sinica,2010,41(3): 334-340.(in Chinese)
[18] COMSTOCK R E,ROBINSON H F.Estimation of average dominance of genes[M]//GOWEN J W.Heterosis.Ames,Iowa:Iowa State College Press,1952.
[19] 石蕾.R语言在藓类形态与遗传变异研究中的应用——以大灰藓为例[D].上海:上海师范大学,2015.
SHI L.Application of R in studies of morphological and genetic variation of plant populations-a case of Hypnum plumaeforme wilson[D].Shanghai:Shanghai Normal University,2015.(in Chinese)
[20] 张景晓,李琪,徐成勋.长牡蛎‘海大1号’生长性状的遗传参数评估[J].中国水产科学,2018,25(5):998-1003.
ZHANG J X,LI Q,XU C X.Estimates of genetic parameters of growth-related traits in Crassostrea gigas ‘Haida No.1’[J].Journal of Fishery Sciences of China,2018,25(5):998-1003.(in Chinese)
[21] PLACKETT R L.The advanced theory of statistics.Vol.2-inference and relationship by M.G.Kendall,A.Stuart[J].Journal of the Royal Statistical Society:Series A(General),1962,125(2):284-286.
[22] 刘振,闫喜武,霍忠明,等.蛤仔白斑马品系的家系选择及近交效应研究[J].大连海洋大学学报,2013,28(4):355-360.
LIU Z,YAN X W,HUO Z M,et al.The family selection and inbreeding effects of white zebra strains in Manila clam Ruditapes philippinarum[J].Journal of Dalian Ocean University,2013,28(4):355-360.(in Chinese)
[23] 张兴志,张继彪,刘辉,等.菲律宾蛤仔獐子岛群体两种壳型表型性状比较[J].水产科学,2015,34(10):616-620.
ZHANG X Z,ZHANG J B,LIU H,et al.Comparisons of phenotypic traits in two shell type strains of Manila clam in Zhangzi Island[J].Fisheries Science,2015,34(10):616-620.(in Chinese)
[24] 闫喜武.菲律宾蛤仔养殖生物学、养殖技术与品种选育[D].青岛:中国科学院海洋研究所,2005.
YAN X W.The culture biology and technology and selective breeding in Manila clam,Ruditapes philippinarum[D].Qingdao:The Institute of Oceanology,Chinese Academy of Sciences,2005.(in Chinese)
[25] 杨林.中国蛤蜊和文蛤的繁殖生物学研究[D].青岛:中国海洋大学,2010.
YANG L.Studies on reproductive biology of Mactra chinensis and Meretrix meretrix[D].Qingdao:Ocean University of China,2010.(in Chinese)
[26] 刘庆华,董晨晨,雷逢进,等.西葫芦种质资源主要农艺性状主成分及聚类分析[J].种子,2021,40(2):63-66,75.
LIU Q H,DONG C C,LEI F J,et al.Principal component and cluster analysis of main agronomic character of Cucurbita pepo germplasm resources[J].Seed,2021,40(2): 63-66,75.(in Chinese)
[27] 彭慧婧,张守都,郑德斌,等.施氏獭蛤全同胞家系建立及生长与存活性状分析[J].海洋科学,2019,43(7):132-138.
PENG H J,ZHANG S D,ZHENG D B,et al.Construction and comparison of growth and survival among full-sib families of Lutraria sieboldii[J].Marine Sciences,2019,43(7):132-138.(in Chinese)
[28] 丁严冬.河川沙塘鳢家系的建立及5个主要家系的遗传分析[D].南京:南京师范大学,2015.
DING Y D.Establishment of Odontobutis potamophilus family and genetic analysis of 5 main families[D].Nanjing:Nanjing Normal University,2015.(in Chinese)
[29] 霍忠明.菲律宾蛤仔数量遗传和家系育种研究[D].大连:大连海洋大学,2009.
HUO Z M.Studies on the quantitative genetics and family breeding of Ruditapes philippinarum[D].Dalian: Dalian Ocean University,2009.(in Chinese)
[30] 李冬春,闫喜武,霍忠明,等.蛤仔(Ruditapes philippinarum)养成期壳长遗传力与育种值估计[J].海洋与湖沼,2013,44(6):1550-1556.
LI D C,YAN X W,HUO Z M,et al.Estimation of heritability and breeding value on shell length of Manila clam Ruditapes philippinarum at spat stage[J].Oceanologia et Limnologia Sinica,2013,44(6):1550-1556.(in Chinese)
[31] NEWKIRK G F,HALEY L E.Phenotypic analysis of the European oyster Ostrea edulis L.:relationship between length of larval period and postsetting growth rate[J].Journal of Experimental Marine Biology and Ecology,1982,59(2/3):177-184.
[32] 王照旗,韩学凯,白志毅,等.三角帆蚌紫色选育系1龄阶段内壳色及生长性状的遗传参数估计[J].水产学报,2014,38(5):644-650.
WANG Z Q,HAN X K,BAI Z Y,et al.Estimates of genetic parameters for inner shell color and growth straits during one year old stage in the purple strain of Hyriopsis cumingii using microsatellite based parentage assignment[J].Journal of Fisheries of China,2014,38(5):644-650.(in Chinese)
[33] 徐如卫,钱昭英,刘小林,等.凡纳滨对虾生长性状遗传参数的估计[J].水产学报,2013,37(5):672-678.
XU R W,QIAN Z Y,LIU X L,et al.Genetic parameter estimation for growth traits of Pacific white shrimp(Litopenaeus vannamei)[J].Journal of Fisheries of China,2013,37(5):672-678.(in Chinese)