随着工业进程的加快和人们生活水平的提高,化石燃料的大量使用导致大气中CO2含量持续增加。海洋作为CO2重要的汇,以每小时100万t以上的速率从大气中吸收CO2[1],经过一系列反应使海水H+浓度增加、pH降低,从而引起海水酸化。工业革命前,全球海洋的平均pH为8.2,目前已降至8.1,至21世纪末预计将再降低0.25个pH单位,pH每降低1个单位,海水中H+浓度会升高10倍[2],海水pH若降低0.25个单位,H+浓度将比工业革命前增加125%,依赖于海洋环境的浮游生物将受到一定的影响[3],甚至通过食物链放大影响。
浮游植物作为海洋生态系统的初级生产者,是物质循环和能量流动的重要基础。近年来,很多学者开展了海水酸化对浮游植物影响的研究,早期主要集中在钙化藻类上,如海水酸化不仅会抑制颗石藻Coccolithus pelagicus生长,而且会降低其钙化量[4-5];随后研究对象逐渐扩展到甲藻和硅藻等一些非钙化藻类上,它们对海水酸化的响应因种类的不同而存在差异,如海水酸化可以抑制强壮前沟藻Amphidinium carterae和异甲藻属Heterocapsaoceanica的生长[6],然而却促进三角褐指藻Phaeodacty lumtricornutum和旋链角毛藻Chaetoceros curvisetus的生长[7]。CO2酸化可以通过影响浮游植物的CO2浓缩机制(CO2 concentrating mechanisms, CCMs)、![]() 利用机制、色素含量和光合固碳相关酶的活性等来对其生长产生影响[8]。
利用机制、色素含量和光合固碳相关酶的活性等来对其生长产生影响[8]。
海水酸化对不同浮游植物的影响还受其他环境因子的影响,如海水温度升高[9-11]、紫外线增强[8,12-13]和金属离子浓度改变等。其中,Fe作为重要的金属离子,一直作为研究重点,伴随酸化发生,海水pH降低,其中游离Fe离子浓度会相应增加[14],Fe(Ⅱ)的稳定性提高,Fe(Ⅲ)溶解度发生改变[15],其生物可利用度会增加[16]。大量“铁假说”试验表明,在太平洋东北部高营养盐、低叶绿素a海域中投放Fe,会促进浮游植物的生长,提高其生物量[17],海水酸化通过影响浮游植物对Fe离子的吸收利用而间接影响其生长[18]。近岸海域Fe离子浓度较大洋高,一般为十几到几十纳摩尔每升水平[19],对浮游植物的影响更为复杂。本研究中,为进一步探讨酸化和Fe离子对浮游植物的影响,选择近海常见浮游植物中肋骨条藻Skeletonema costatum作为受试种类,通过测定其叶绿素荧光参数,阐明CO2酸化和Fe离子对中肋骨条藻细胞光化学活性的影响,以期为评估海水酸化背景下中肋骨条藻的生理生态响应特征提供基础数据。
1 材料与方法
1.1 材料
中肋骨条藻购于上海光语生物科技有限公司。
1.2 方法
1.2.1 藻种的培养 选用f/2培养基[20],培养温度(22±2)℃,光照强度为(80±10)μmol/(m2·s),光暗比为12L∶12D。
1.2.2 酸化海水的制备
人工海水的制备:为避免自然海水中Fe离子对试验结果的影响,本研究中所用海水为人工海水[21],除FeCl3·6H2O有变外其他成分保持不变。
酸化海水的制备:试验设1个对照组和1个处理组,均为人工海水配制的不含Fe离子的f/2培养基,分别向对照组和处理组中通入CO2含量为0.038%(2013年全球大气CO2含量平均水平,NOAA/ESRL)和0.08%(2100年大气平均CO2含量预测水平[22])的混合气体(购自天津安利达气体有限公司)。气体流量用流量计控制在300 mL/min,利用pH计监测培养基中pH变化情况,待到pH稳定后酸化海水制备完成。不同CO2含量的混合气体中氧气含量均为21.00%,氮气含量分别为78.96%和78.92%。
1.2.3 Fe(Ⅲ)浓度(均为质量浓度,下同)的设定 配制FeCl3·6H2O母液,在酸化处理后,取一定量的FeCl3·6H2O母液,使不同酸化组内均包含1.5、2.0、3.0、4.0 μg/L 4个Fe(Ⅲ)浓度。
1.2.4 试验设计 试验开始前3 d,将中肋骨条藻转移至不含Fe(Ⅲ)的培养基中暂养,使吸附在藻细胞上的Fe(Ⅲ)消耗代谢完毕。每个CO2水平设4个Fe(Ⅲ)浓度组,每组设3个平行。试验用培养液制备完成后接种中肋骨条藻,各组初始密度均为5×105 cells/mL。接种后,对藻液持续通入相应混合气体直至试验结束,气体流量为300 mL/min。试验共进行6 d,每隔24 h取样一次,用于测定各组细胞密度及相关叶绿素荧光诱导动力学参数。
1.2.5 叶绿素荧光参数的测定 用叶绿素荧光分析仪(Phyto-PAM, Walz, 德国)测定中肋骨条藻叶绿素荧光参数:初始荧光(F0)、最大荧光(Fm)、稳态荧光(Fs)、光适应下最大荧光(Fm′)和最大电子传递速率(rETR),具体操作参考张媛媛等[23]的方法,然后根据下式计算最大光能转化效率(Fv/Fm)、实际光能转化效率(ΦPSⅡ)和有效光能转化效率(Yield):
Fv/Fm=(Fm-F0)/Fm,
(1)
ΦPSⅡ=(Fm′-Fs)/Fm′,
(2)
Fv′=Fm′-F0′,
(3)
Yield=Fv′/Fm′,
(4)
F0′=1/(1/F0-1/Fm+1/Fm′)。
(5)
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示。采用 SPSS 19.0软件进行双因素方差分析(two-way ANOVA),分析海水酸化和不同Fe(Ⅲ)浓度对中肋骨条藻各叶绿素荧光参数的影响,若存在CO2含量和Fe(Ⅲ)的交互作用,则对相同CO2含量水平下不同Fe(Ⅲ)浓度组进行单因素方差分析(one-way ANOVA)和多重比较(Tukey)。利用独立样本T检验分析相同Fe(Ⅲ)浓度条件下不同酸化处理之间的差异性。显著性水平设为0.05,极显著水平设为0.01。
2 结果与分析
2.1 海水酸化和Fe(Ⅲ)对中肋骨条藻生长的影响
从图1可见:CO2含量、Fe(Ⅲ)浓度及二者的交互作用均对中肋骨条藻细胞密度有显著性影响(P<0.05);CO2含量为0.038%时,各Fe(Ⅲ)浓度组藻细胞密度自第4天开始显著升高(P<0.05),至培养结束时,1.5、2.0 μg/L Fe(Ⅲ)处理组藻细胞密度分别为12.09×105、15.06×105 cells/mL,显著高于3.0、4.0 μg/L Fe(Ⅲ)处理组(P<0.05);CO2含量为0.08%时,不同浓度的Fe(Ⅲ)对中肋骨条藻生长自培养第1天开始就具有显著性影响(P<0.05),Fe(Ⅲ)浓度分别为3.0、4.0 μg/L时,其生长速度较快,至培养结束时,中肋骨条藻细胞密度分别为14.48×105、12.89×105 cells/mL,显著高于1.5、2.0 μg/L Fe(Ⅲ)处理组(P<0.01),但与CO2含量为0.038%时1.5、2.0 μg/L Fe(Ⅲ)处理组的细胞密度基本持平。
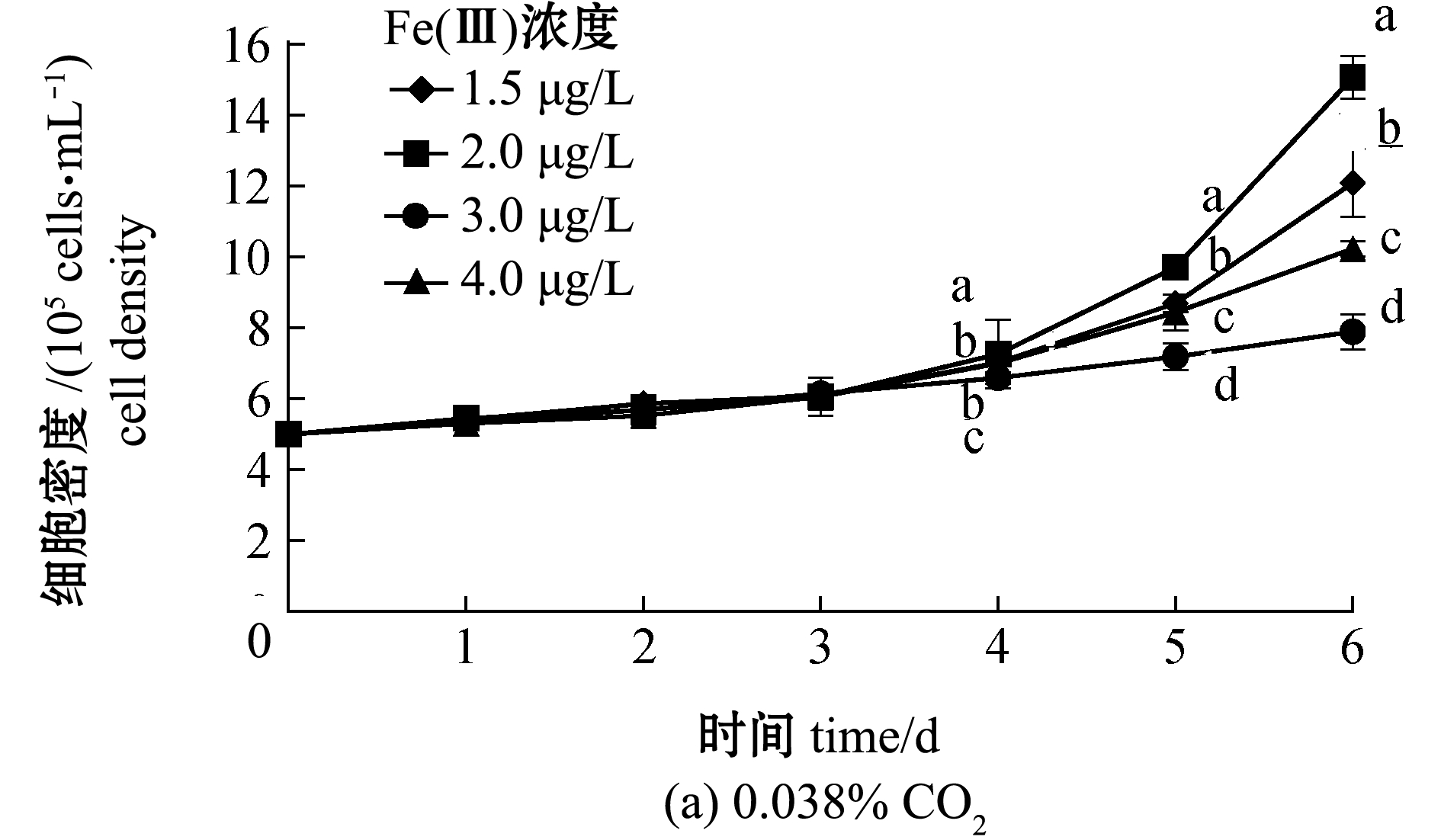
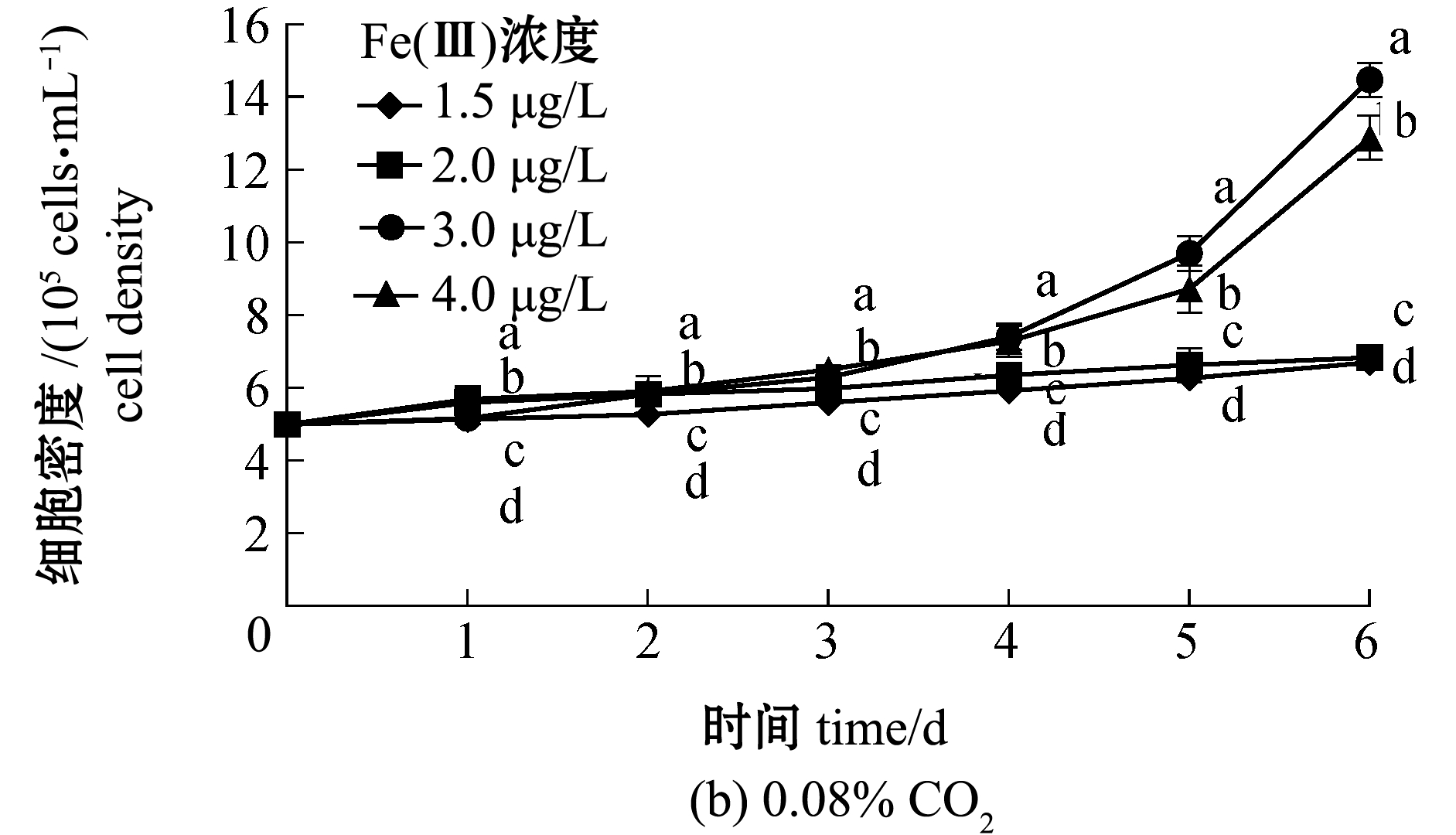
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences.
图1 海水酸化和Fe(Ⅲ)对中肋骨条藻生长的影响
Fig.1 Effects of ocean acidification and different Fe(Ⅲ)concentrations on the growth of alga Skeletonema costatum
独立样本T检验表明,当Fe(Ⅲ)浓度分别为1.5、2.0 μg/L时,0.038% CO2组中藻细胞密度显著高于0.08% CO2组(P<0.05),但当Fe(Ⅲ)浓度分别为3.0、4.0 μg/L时,0.038% CO2组中藻细胞密度则显著低于0.08% CO2组(P<0.05)。
2.2 海水酸化和Fe(Ⅲ)对叶绿素荧光参数的影响
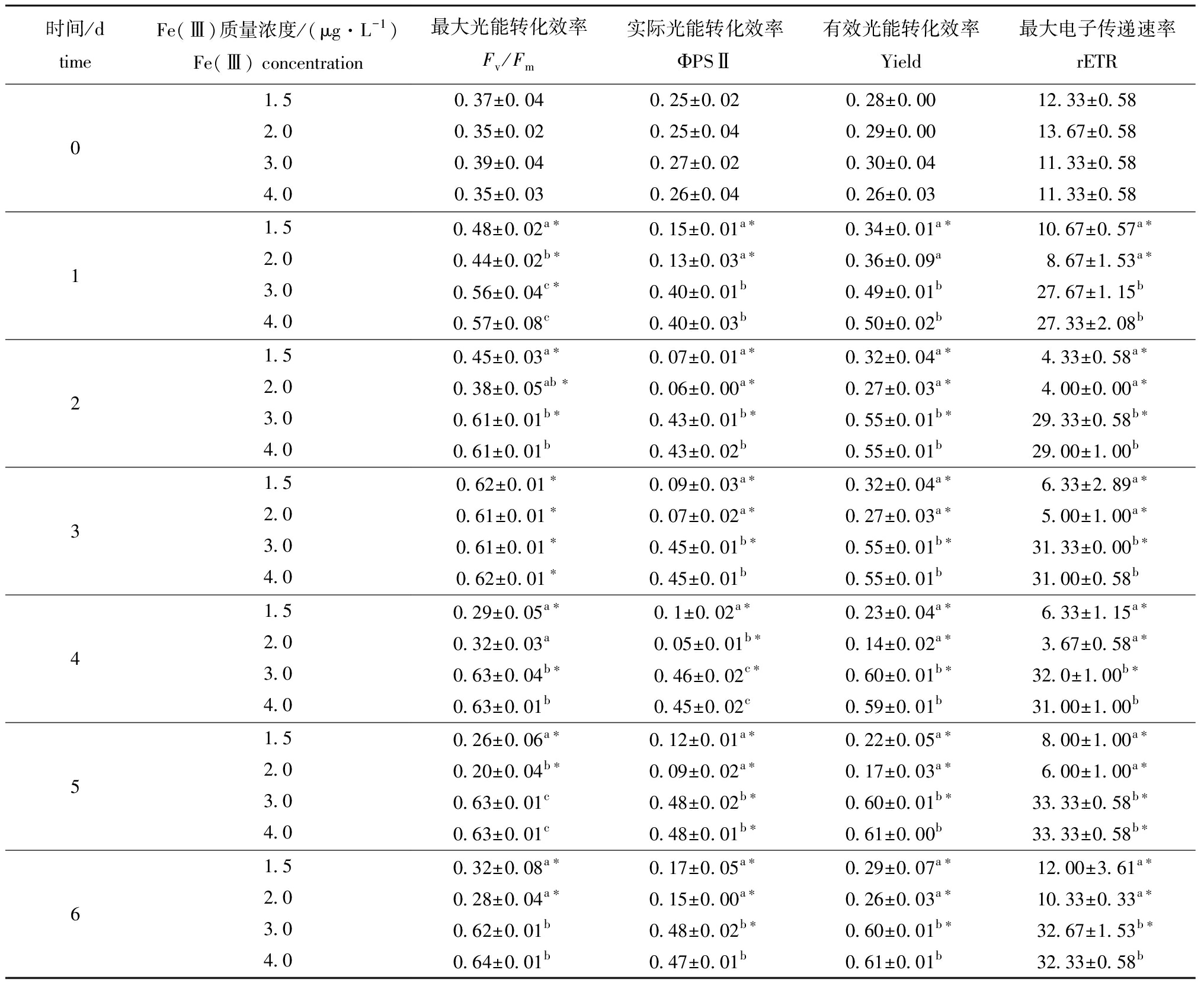
海水CO2含量、Fe(Ⅲ)浓度及二者的交互作用均在培养的第1天开始对中肋骨条藻叶绿素荧光参数产生极显著影响(P<0.01),并持续至试验结束(表1)。CO2含量为0.038%时,不同Fe(Ⅲ)浓度处理组中肋骨条藻Fv/Fm、ΦPSⅡ、Yield和rETR变化趋势基本相同,从第4天开始,不同浓度的Fe(Ⅲ)对叶绿素荧光参数均产生显著的促进作用(P<0.05)(表2);CO2含量为0.08%时,浓度为1.5、2.0 μg/L的Fe(Ⅲ)对中肋骨条藻叶绿素荧光参数均产生显著的抑制作用(P<0.05),且抑制作用在培养第1天时就开始出现,而浓度为3.0、4.0 μg/L的Fe(Ⅲ)则具有显著的促进作用(P<0.05)(表3)。
表1 海水酸化和不同Fe(Ⅲ)浓度对中肋骨条藻光合系统Ⅱ各指标影响的双因素分析
Tab.1 Two-way ANOVA results of ocean acidification and different Fe(Ⅲ)concentrations for various parameters of alga Skeletonema costatum PSⅡ
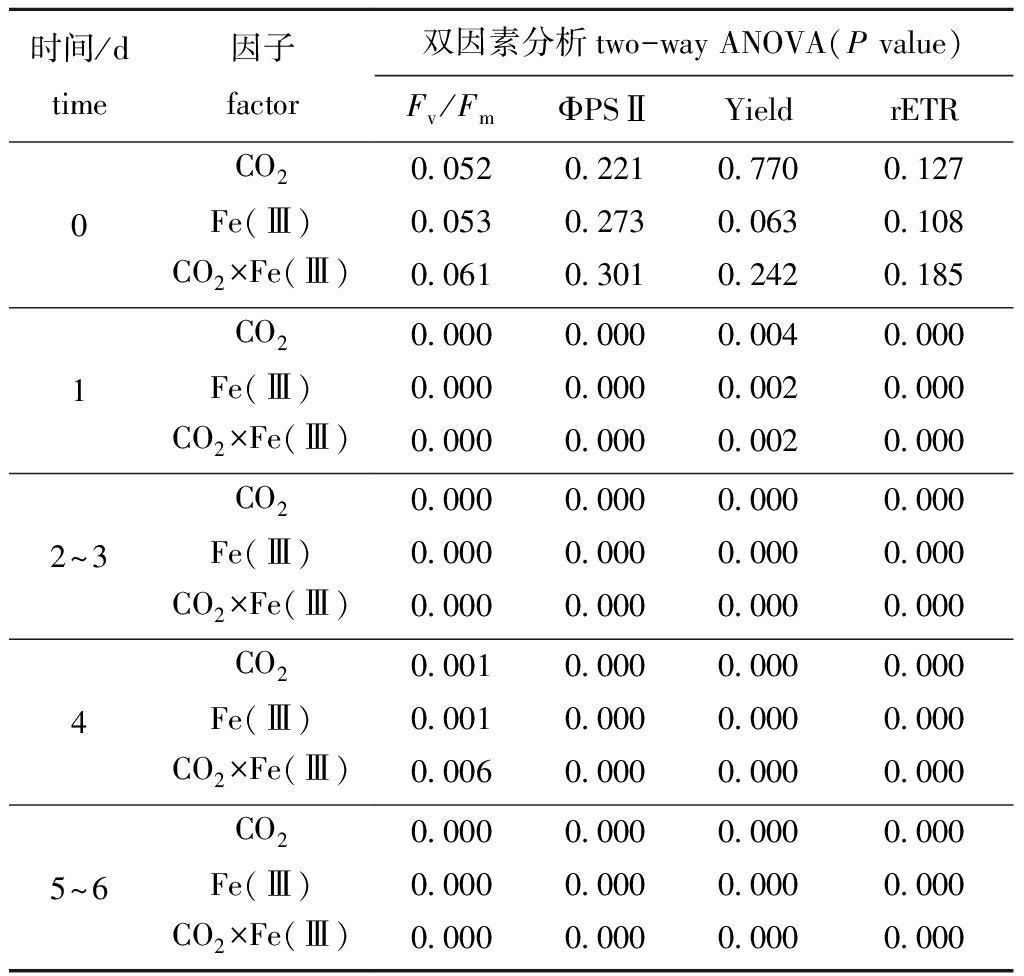
时间/dtime因子factor双因素分析two-way ANOVA(P value)Fv/FmΦPSⅡYieldrETR0 CO20.0520.2210.7700.127Fe(Ⅲ)0.0530.2730.0630.108CO2×Fe(Ⅲ)0.0610.3010.2420.1851 CO20.0000.0000.0040.000Fe(Ⅲ)0.0000.0000.0020.000CO2×Fe(Ⅲ)0.0000.0000.0020.0002~3 CO20.0000.0000.0000.000Fe(Ⅲ)0.0000.0000.0000.000CO2×Fe(Ⅲ)0.0000.0000.0000.0004 CO20.0010.0000.0000.000Fe(Ⅲ)0.0010.0000.0000.000CO2×Fe(Ⅲ)0.0060.0000.0000.0005~6 CO20.0000.0000.0000.000Fe(Ⅲ)0.0000.0000.0000.000CO2×Fe(Ⅲ)0.0000.0000.0000.000
相同Fe(Ⅲ)浓度下,海水酸化(0.08% CO2)对中肋骨条藻叶绿素荧光参数的影响存在一定差异。当Fe(Ⅲ)浓度分别为1.5、2.0 μg/L时,海水酸化总体上对中肋骨条藻叶绿素荧光参数均存在显著的抑制作用(P<0.05),用1.5 μg/L Fe(Ⅲ)处理至培养结束时,酸化组的Fv/Fm、ΦPSⅡ、Yield和rETR比0.038% CO2组分别降低46.6.%、61.4%、49.2%和60.0%;当Fe(Ⅲ)浓度分别为3.0、4.0 μg/L时,海水酸化对中肋骨条藻叶绿素荧光参数略有促进作用,用4.0 μg/L Fe(Ⅲ)处理至培养结束时,酸化组中Yield和rETR分别比0.038% CO2组高1.3%和2.1%,但无显著性差异(P>0.05)(表2、表3)。
表2 0.038% CO2处理组Fe(Ⅲ)浓度对中肋骨条藻叶绿素荧光参数的影响
Tab.2 Effects of Fe(Ⅲ)concentrations on chlorophyⅡ fluorescence parameters of alga Skeletonema costatum PSⅡ at CO2 concentration of 0.038%
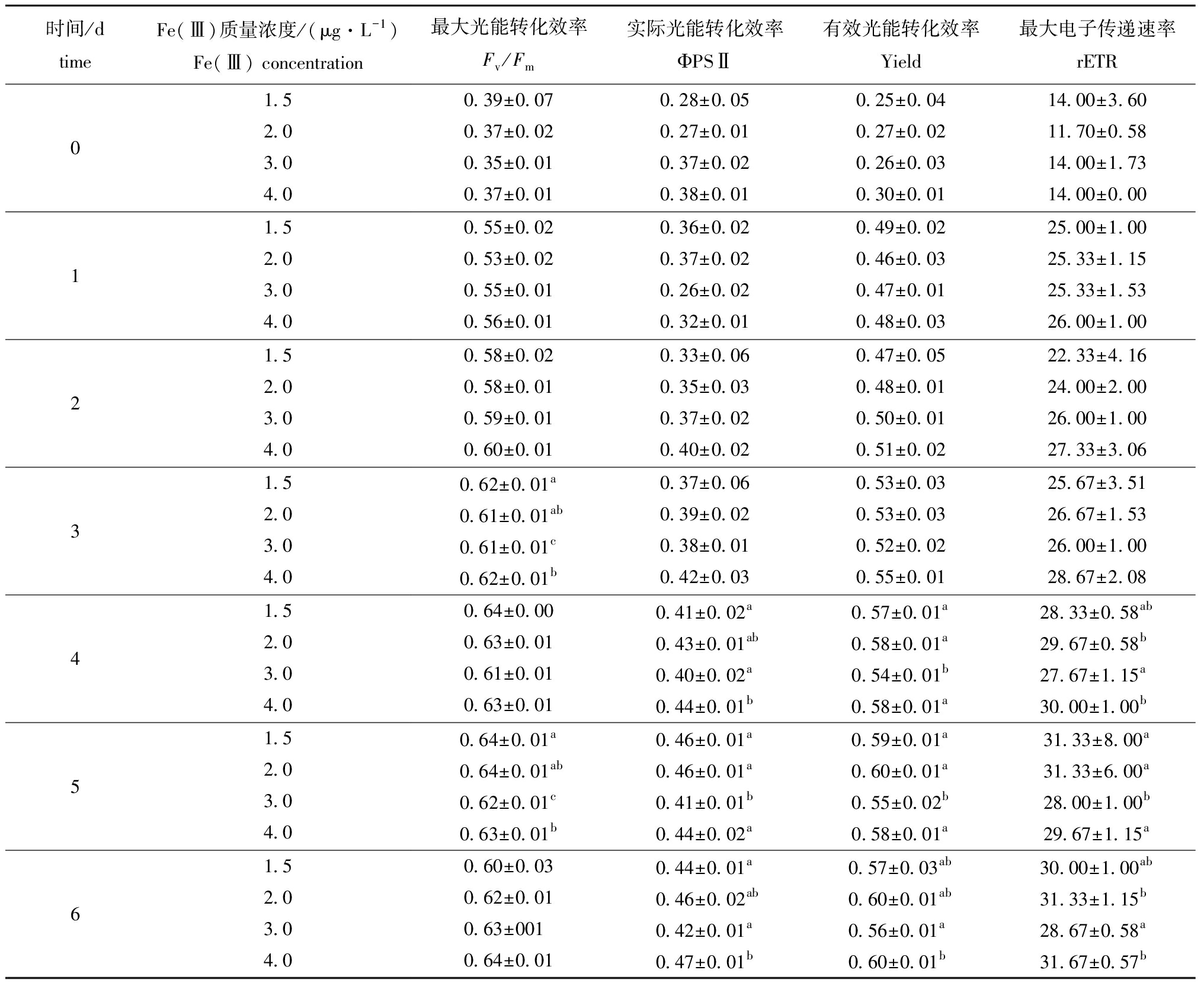
时间/dtimeFe(Ⅲ)质量浓度/(μg·L-1)Fe(Ⅲ) concentration最大光能转化效率Fv/Fm实际光能转化效率ΦPSⅡ有效光能转化效率Yield最大电子传递速率rETR0 1.50.39±0.070.28±0.050.25±0.0414.00±3.602.00.37±0.020.27±0.010.27±0.0211.70±0.583.00.35±0.010.37±0.020.26±0.0314.00±1.734.00.37±0.010.38±0.010.30±0.0114.00±0.001 1.50.55±0.020.36±0.020.49±0.0225.00±1.002.00.53±0.020.37±0.020.46±0.0325.33±1.153.00.55±0.010.26±0.020.47±0.0125.33±1.534.00.56±0.010.32±0.010.48±0.0326.00±1.002 1.50.58±0.020.33±0.060.47±0.0522.33±4.162.00.58±0.010.35±0.030.48±0.0124.00±2.003.00.59±0.010.37±0.020.50±0.0126.00±1.004.00.60±0.010.40±0.020.51±0.0227.33±3.063 1.50.62±0.01a0.37±0.060.53±0.0325.67±3.512.00.61±0.01ab0.39±0.020.53±0.0326.67±1.533.00.61±0.01c0.38±0.010.52±0.0226.00±1.004.00.62±0.01b0.42±0.030.55±0.0128.67±2.084 1.50.64±0.000.41±0.02a0.57±0.01a28.33±0.58ab2.00.63±0.010.43±0.01ab0.58±0.01a29.67±0.58b3.00.61±0.010.40±0.02a0.54±0.01b27.67±1.15a4.00.63±0.010.44±0.01b0.58±0.01a30.00±1.00b5 1.50.64±0.01a0.46±0.01a0.59±0.01a31.33±8.00a2.00.64±0.01ab0.46±0.01a0.60±0.01a31.33±6.00a3.00.62±0.01c0.41±0.01b0.55±0.02b28.00±1.00b4.00.63±0.01b0.44±0.02a0.58±0.01a29.67±1.15a6 1.50.60±0.030.44±0.01a0.57±0.03ab30.00±1.00ab2.00.62±0.010.46±0.02ab0.60±0.01ab31.33±1.15b3.00.63±0010.42±0.01a0.56±0.01a28.67±0.58a4.00.64±0.010.47±0.01b0.60±0.01b31.67±0.57b
注:标有不同字母者表示同一时间下不同Fe(Ⅲ)浓度组间有显著性差异(P<0.05),标有相同字母者或无字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters at the same time are significantly different at the 0.05 probability level in different Fe(Ⅲ)concentration groups,and the means with the same letter or no letter are not significant differences, et sequentia.
表3 0.08% CO2处理组Fe(Ⅲ)浓度对中肋骨条藻叶绿素荧光参数的影响
Tab.3 Effects of Fe(Ⅲ)concentrations on chlorophyⅡ fluorescence parameters of alga Skeletonema costatum PSⅡ at CO2 concentration of 0.08%
时间/dtimeFe(Ⅲ)质量浓度/(μg·L-1)Fe(Ⅲ) concentration最大光能转化效率Fv/Fm实际光能转化效率ΦPSⅡ有效光能转化效率Yield最大电子传递速率rETR0 1.50.37±0.04 0.25±0.02 0.28±0.00 12.33±0.58 2.00.35±0.02 0.25±0.04 0.29±0.00 13.67±0.58 3.00.39±0.04 0.27±0.02 0.30±0.04 11.33±0.58 4.00.35±0.03 0.26±0.04 0.26±0.03 11.33±0.58 1 1.50.48±0.02a∗0.15±0.01a∗0.34±0.01a∗10.67±0.57a∗2.00.44±0.02b∗0.13±0.03a∗0.36±0.09a8.67±1.53a∗3.00.56±0.04c∗0.40±0.01b0.49±0.01b27.67±1.15b4.00.57±0.08c0.40±0.03b0.50±0.02b27.33±2.08b2 1.50.45±0.03a∗0.07±0.01a∗0.32±0.04a∗4.33±0.58a∗2.00.38±0.05ab∗0.06±0.00a∗0.27±0.03a∗4.00±0.00a∗3.00.61±0.01b∗0.43±0.01b∗0.55±0.01b∗29.33±0.58b∗4.00.61±0.01b0.43±0.02b0.55±0.01b29.00±1.00b3 1.50.62±0.01∗0.09±0.03a∗0.32±0.04a∗6.33±2.89a∗2.00.61±0.01∗0.07±0.02a∗0.27±0.03a∗5.00±1.00a∗3.00.61±0.01∗0.45±0.01b∗0.55±0.01b∗31.33±0.00b∗4.00.62±0.01∗0.45±0.01b0.55±0.01b31.00±0.58b4 1.50.29±0.05a∗0.1±0.02a∗0.23±0.04a∗6.33±1.15a∗2.00.32±0.03a0.05±0.01b∗0.14±0.02a∗3.67±0.58a∗3.00.63±0.04b∗0.46±0.02c∗0.60±0.01b∗32.0±1.00b∗4.00.63±0.01b0.45±0.02c0.59±0.01b31.00±1.00b5 1.50.26±0.06a∗0.12±0.01a∗0.22±0.05a∗8.00±1.00a∗2.00.20±0.04b∗0.09±0.02a∗0.17±0.03a∗6.00±1.00a∗3.00.63±0.01c0.48±0.02b∗0.60±0.01b∗33.33±0.58b∗4.00.63±0.01c0.48±0.01b∗0.61±0.00b33.33±0.58b∗6 1.50.32±0.08a∗0.17±0.05a∗0.29±0.07a∗12.00±3.61a∗2.00.28±0.04a∗0.15±0.00a∗0.26±0.03a∗10.33±0.33a∗3.00.62±0.01b0.48±0.02b∗0.60±0.01b∗32.67±1.53b∗4.00.64±0.01b0.47±0.01b0.61±0.01b32.33±0.58b
注:*表示相同时间和Fe(Ⅲ)浓度下0.08%、0.038% CO2组间具有显著差异(P<0.05)。
Note:*indicates significant difference between the 0.08% and 0.038% CO2 groups at the same time and same Fe(Ⅲ)concentration(P<0.05).
3 讨论
3.1 海水酸化对中肋骨条藻生长的影响
海水酸化可引起一系列环境问题,尤其对近海生态系统的影响更为剧烈。研究表明,一些近海海域数月内因酸化引起的环境效应相当于大洋表层未来50~150年的酸化进程,环境条件的改变必然对海洋生物产生严重的环境胁迫[24]。本研究表明,中肋骨条藻光合系统Ⅱ的Fv/Fm、ΦPSⅡ、Yield和rETR均受到CO2含量、Fe(Ⅲ)浓度及二者交互作用的显著影响。浮游植物利用核酮糖二磷酸羧化酶-氧化酶(Rubisco)固定CO2,海水中CO2的浓度不能使Rubisco酶反应全速进行,大多数藻类的光合作用受CO2的限制[8],浮游植物通过利用![]() 及二氧化碳浓缩机制来适应低浓度CO2[25]。当环境中CO2含量升高时,藻类的无机碳吸收机制启动,CCMs下调,导致藻细胞对
及二氧化碳浓缩机制来适应低浓度CO2[25]。当环境中CO2含量升高时,藻类的无机碳吸收机制启动,CCMs下调,导致藻细胞对![]() 利用能力下降,使原用于
利用能力下降,使原用于![]() 转移和利用的能量减少并转化用于光合作用,进而提高光合效率,促进硅藻生长[26]。本研究中,酸化条件下(CO2含量0.08%),中肋骨条藻各叶绿素荧光参数因Fe(Ⅲ)浓度的不同而存在差异,Fe(Ⅲ)含量为3.0、4.0 μg/L时对中肋骨条藻光合活性略有促进作用,但与CO2含量为0.038%时无显著性差异,而Fe(Ⅲ)含量为1.5、2.0 μg/L时则显著抑制其光合活性。表明高CO2含量并不能显著促进中肋骨条藻的光化学活性及生长。究其原因,可能是因中肋骨条藻的光合作用和生长已达到饱和[27],故CO2含量升高而节约的原本用于吸收
转移和利用的能量减少并转化用于光合作用,进而提高光合效率,促进硅藻生长[26]。本研究中,酸化条件下(CO2含量0.08%),中肋骨条藻各叶绿素荧光参数因Fe(Ⅲ)浓度的不同而存在差异,Fe(Ⅲ)含量为3.0、4.0 μg/L时对中肋骨条藻光合活性略有促进作用,但与CO2含量为0.038%时无显著性差异,而Fe(Ⅲ)含量为1.5、2.0 μg/L时则显著抑制其光合活性。表明高CO2含量并不能显著促进中肋骨条藻的光化学活性及生长。究其原因,可能是因中肋骨条藻的光合作用和生长已达到饱和[27],故CO2含量升高而节约的原本用于吸收![]() 的能量对藻类光合作用和生长的促进效果甚微[7]。潘静[28]研究表明,在酸化条件下适应25代后,中肋骨条藻比生长率显著下降,最大光合作用速率降低,生长受到明显抑制,在一定程度上也证明了上述推论。可见,CO2含量升高对浮游植物的影响与不同种类的生理特性有着密切关系,藻类的生长是一系列复杂的生理活动,CO2含量升高可能会提高其光合速率,但同时也会改变呼吸速率等其他生命过程,效果如何取决于最终效应的平衡。
的能量对藻类光合作用和生长的促进效果甚微[7]。潘静[28]研究表明,在酸化条件下适应25代后,中肋骨条藻比生长率显著下降,最大光合作用速率降低,生长受到明显抑制,在一定程度上也证明了上述推论。可见,CO2含量升高对浮游植物的影响与不同种类的生理特性有着密切关系,藻类的生长是一系列复杂的生理活动,CO2含量升高可能会提高其光合速率,但同时也会改变呼吸速率等其他生命过程,效果如何取决于最终效应的平衡。
3.2 Fe(Ⅲ)对中肋骨条藻生长的影响
Fe离子是浮游植物生命过程中必需的微量营养元素,是其生长的重要限制因子之一。Fe离子浓度过低,会使光合作用传递链中所有含Fe离子的细胞色素含量下降,藻类PSⅡ的光合作用效率及能量转化效率显著下降[29]。在缺Fe离子条件下,三角褐指藻的Fv/Fm显著降低,而重新加入Fe离子24 h后,Fv/Fm恢复到原来水平[30];Fe离子浓度为10-9~10-6 mol/L时,随着Fe离子浓度的增加,对尖刺菱形藻Pseudonitzschia pungens光合放氧和叶绿素合成起到促进作用[31]。本研究中,在CO2含量为0.038%的条件下,不同浓度的Fe(Ⅲ)从第4天开始对中肋骨条藻的各叶绿素荧光参数产生显著的促进作用;海水酸化(CO2含量0.08%)后,1.5、2.0 μg/L Fe(Ⅲ)对中肋骨条藻各叶绿素荧光参数自第1天开始产生显著的抑制作用,并持续至培养结束,而Fe(Ⅲ)浓度为3.0、4.0 μg/L的组中肋骨条藻相应叶绿素荧光参数指标水平与CO2含量0.038%时低浓度Fe(Ⅲ)(1.5、2.0 μg/L)组相当,Fe(Ⅲ)对其光合作用的影响快于对生长的影响,推测是浮游植物首先通过光合作用准备足够的物质和能量,而后生长才能进行。而在CO2含量为0.08%的酸化条件下,低浓度Fe(Ⅲ)抑制其正常的光合反应过程,这可能是由于酸化条件下浮游植物对Fe离子的吸收率降低[18]、细胞膜氧化还原特性及相关酶活性改变[8]引起的,而高浓度Fe(Ⅲ)则可通过增大捕光色素复合体的面积来促进光吸收,进而提高光合作用速率及生长。
浮游植物通过光能来同化无机碳的过程是海洋物质循环和能量流动的重要基础,它们把溶解态CO2转化为颗粒态,是“生物泵”的一个重要生物学过程。海洋从大气中吸收CO2的量依赖于生物泵,也依赖于酸化所产生的效应。海水酸化和其他环境因子对浮游植物的影响与其种类特性、细胞大小及对环境适应能力有关,海洋酸化对浮游植物生理过程影响的差异必然会引起浮游植物群落结构变化。
4 结论
1)CO2含量为0.038%条件下,较低Fe(Ⅲ)浓度可以显著促进中肋骨条藻生长,海水酸化(CO2含量0.08%)后,需要较高Fe(Ⅲ)浓度才能保持相似增长水平。
2)CO2含量为0.038%条件下,中肋骨条藻细胞PSⅡ光化学活性随Fe(Ⅲ)浓度升高而增加;海水酸化(CO2 0.08%)后,仅Fe(Ⅲ)浓度为3.0、4.0 μg/L时对光化学活性表现出促进作用,并与0.038% CO2含量下相当;相同Fe(Ⅲ)浓度下,酸化会引起藻细胞PSⅡ光化学活性降低。
[1] GATTUSO J P,MAGNAN A,BILL R,et al.Ocranography.Contrasting futures for ocean and society from different anthropogenic CO2 emissions scenarios[J].Science,2015,349(6243):aac4722.
R,et al.Ocranography.Contrasting futures for ocean and society from different anthropogenic CO2 emissions scenarios[J].Science,2015,349(6243):aac4722.
[2] 张锦峰.海洋酸化与海岸带生源要素和微量元素归趋及形态的相互作用研究[D].烟台:中国科学院烟台海岸带研究所,2016.
ZHANG J F.Interaction between fate/speciation of nutrient/trace elements and ocean acidification in coastal zone[D].Yantai:Yantai Institute of Coastal Zone Research,Chinese Academy of Sciences,2016.(in Chinese)
[3] 尹文露,崔东遥,李莹莹,等.中间球海胆丙酮酸激酶(PK)基因克隆及其对海水酸化的响应[J].大连海洋大学学报,2020,35(3):360-367.
YIN W L,CUI D Y,LI Y Y,et al.Cloning and response of pyruvate kinase(PK)gene to seawater acidification in sea urchin Strongylocentrotus intermedius[J].Journal of Dalian Ocean University,2020,35(3):360-367.(in Chinese)
[4] RUTTIMANN J.Sick seas[J].Nature:International Weekly Journal of Science,2006,442(7106):978-980.
[5] RIEBESELL U,ZONDERVAN I,ROST B,et al.Reduced calcification of marine plankton in response to increased atmospheric CO2[J].Nature,2000,407(6802):364-367.
[6] DASON J S,COLMAN B.Inhibition of growth in two dinoflagellates by rapid changes in external pH[J].Canadian Journal of Botany,2004,82(4):515-520.
[7] 毛雪微,刘光兴,王为民,等.CO2浓度升高对三角褐指藻和旋链角毛藻种群生长的影响[J].中国海洋大学学报(自然科学版),2016,46(3):60-66.
MAO X W,LIU G X,WANG W M,et al.Effect of elevated CO2 on the population growth of Phaeodactylum tricornutum and Chaetoceros curvisetus[J].Periodical of Ocean University of China(Natural Science Edition),2016,46(3):60-66.(in Chinese)
[8] 高坤山.海洋酸化正负效应:藻类的生理学响应[J].厦门大学学报(自然科学版),2011,50(2):411-417.
GAO K S.Positive and negative effects of ocean acidification:physiological responses of algae[J].Journal of Xiamen University(Natural Science Edition),2011,50(2):411-417.(in Chinese)
[9] CAMPBELL J E,FISCH J,LANGDON C,et al.Increased temperature mitigates the effects of ocean acidification in calcified green algae(Halimeda spp.)[J].Coral Reefs,2016,35(1):357-368.
[10] OLISCHL GER M,I
GER M,I IGUEZ C,KOCH K,et al.Increased pCO2and temperature reveal ecotypic differences in growth and photosynthetic performance of temperate and Arctic populations of Saccharina latissima[J].Planta,2017,245(1):119-136.
IGUEZ C,KOCH K,et al.Increased pCO2and temperature reveal ecotypic differences in growth and photosynthetic performance of temperate and Arctic populations of Saccharina latissima[J].Planta,2017,245(1):119-136.
[11] SOGIN E M,PUTNAM H M,ANDERSON P E,et al.Metabolomic signatures of increases in temperature and ocean acidification from the reef-building coral,Pocillopora damicornis[J].Metabolomics,2016,12(4):1-12.
[12] DOMINGUES R B,GUERRA C C,GALV O H M,et al.Short-term interactive effects of ultraviolet radiation,carbon dioxide and nutrient enrichment on phytoplankton in a shallow coastal lagoon[J].Aquatic Ecology,2017,51(1):91-105.
O H M,et al.Short-term interactive effects of ultraviolet radiation,carbon dioxide and nutrient enrichment on phytoplankton in a shallow coastal lagoon[J].Aquatic Ecology,2017,51(1):91-105.
[13] WU Y P,GAO K S.Combined effects of solar UV radiation and CO2-induced seawater acidification on photosynthetic carbon fixation of phytoplankton assemblages in the South China Sea[J].Chinese Science Bulletin,2010,55(32):3680-3686.
[14] SUNDA W,HUNTSMAN S.Effect of pH,light,and temperature on Fe-EDTA chelation and Fe hydrolysis in seawater[J].Marine Chemistry,2003,84(1/2):35-47.
[15] SANTANA-CASIANO J M,GONZ LEZ-D
LEZ-D VILA M,MILLERO F J.Oxidation of nanomolar levels of Fe(Ⅱ)with oxygen in natural waters[J].Environmental Science & Technology,2005,39(7):2073-2079.
VILA M,MILLERO F J.Oxidation of nanomolar levels of Fe(Ⅱ)with oxygen in natural waters[J].Environmental Science & Technology,2005,39(7):2073-2079.
[16] MCKNIGHT D M,KIMBALL B A,RUNKEL R L.pH dependence of iron photoreduction in a rocky mountain stream affected by acid mine drainage[J].Hydrological Processes,2001,15(10):1979-1992.
[17] 马莎.浮游植物及群落结构对海洋酸化响应的研究[D].上海:上海海洋大学,2018.
MA S.Studies on responses of phytoplankton and community structure to ocean acidification[D].Shanghai:Shanghai Ocean University,2018.(in Chinese)
[18] SHI D L,XU Y,HOPKINSON B M,et al.Effect of ocean acidification on iron availability to marine phytoplankton[J].Science,2010,327(5966):676-679.
[19] 朱逊驰.中国近岸到陆架区典型水体中溶解铁的生物地球化学过程[D].上海:华东师范大学,2018.
ZHU X C.Biogeochemical processes of dissolved iron in typical waters in the nearshore to continental shelf area of China[D].Shanghai:East China Normal University,2018.(in Chinese)
[20] GUILLARD R R,RYTHER J H.Studies of marine planktonic diatoms.I.Cyclotella nana Hustedt,and Detonula confervacea(Cleve)gran[J].Canadian Journal of Microbiology,1962,8:229-239.
[21] BERGES J A,FRANKLIN D J,HARRISON P J.Evolution of an artificial seawater medium:improvements in enriched seawater,artificial water over the last two decades[J].Journal of Phycology,2001,37(6):1138-1145.
[22] IPCC.A contribution of working groups Ⅰ,Ⅱand Ⅲ to the third assessment report of the intergovernmental panel on climate change[D].Cambridge:Cambridge University Press, 2001.
[23] 张媛媛,戴伟,张树林,等.光照历史对小檗碱化感抑藻效应的影响[J].水生态学杂志,2015,36(1):88-93.
ZHANG Y Y,DAI W,ZHANG S L,et al.Effects of light acclimation on allelopathic inhibition of Microcystis aeruginosa by berberine[J].Journal of Hydroecology,2015,36(1):88-93.(in Chinese)
[24] 翟惟东.黄海的季节性酸化现象及其调控[J].中国科学:地球科学,2018,48(6):671-682.
ZHAI W D.Exploring seasonal acidification in the Yellow Sea[J].Science China Earth Sciences Scientia Sinica(Terrae),2018,48(6):671-682.(in Chinese)
[25] GIORDANO M,BEARDALL J,RAVEN J A.CO2 concentrating mechanisms in algae:mechanisms,environmental modulation,and evolution[J].Annual Review of Plant Biology,2005,56:99-131.
[26] RIEBESELL U,WOLF-GLADROW D A,SMETACEK V.Carbon dioxide limitation of marine phytoplankton growth rates[J].Nature,1993,361(6409):249-251.
[27] CHEN X W,GAO K S.Characterization of diurnal photosynthetic rhythms in the marine diatom Skeletonema costatum grown in synchronous culture under ambient and elevated CO2[J].Functional Plant Biology:FPB,2004,31(4):399-404.
[28] 潘静.海洋酸化及UV辐射对硅藻光合作用影响的研究[D].汕头:汕头大学,2011.
PAN J.Studies on the impacts of ocean acidification and UV radiation on the photosynthesis of diatoms[D].Shantou:Shantou University,2011.(in Chinese)
[29] 吕秀平,张栩,康瑞娟,等.Fe3+对铜绿微囊藻生长和光合作用的影响[J].北京化工大学学报(自然科学版),2006,33(1):27-30.
LÜ X P,ZHANG X,KANG R J,et al.Effects of Fe3+ on growth and photosynthesis of Microcystis aeruginosa[J].Journal of Beijing University of Chemical Technology(Natural Science Edition),2006,33(1):27-30.(in Chinese)
[30] GEIDER R J,ROCHE J,GREENE R M,et al.Response of the photosynthetic apparatus of Phaeodactylum tricornutum(Bacillariophyceae)to nitrate,phosphate,or iron starvation[J].Journal of Phycology,1993,29(6):755-766.
[31] 左冬梅,韩志国,武宝玕.铁对尖刺拟菱形藻生长及光合作用的影响[J].暨南大学学报(自然科学与医学版),2002,23(5):81-87.
ZUO D M,HAN Z G,WU B G.Effects of iron on the growth and photosynthesis of red tide diatom Pseudonitzschia pungens Grunow[J].Journal of Jinan University(Natural Science & Medicine Edition),2002, 23(5):81-87.(in Chinese)