盐地碱蓬Suaeda salsa别名严蒿、黄须菜,又名翅碱蓬,隶属于藜科Chenopodiaceae碱蓬属Suaeda,一年生草本植物,主要生长于海滨、湖边、荒漠等盐碱地[1]。盐地碱蓬成熟株高为20~80 cm,茎和叶为绿色或紫红色,有典型的叶片肉质化现象[1]。盐地碱蓬是可食用的食材,具有较好的药用价值[2-4]。此外,盐地碱蓬还是修复改良受污染盐碱土壤的重要植物资源,具有重要的生态价值[5-6]。
中国的渤海、黄海和东海沿岸分布着大面积盐地碱蓬湿地[7]。作为陆地和海洋生态系统间的过渡地带,盐地碱蓬湿地具备多重生态服务功能,能够固定和降解污染物,滞留营养物,保护海岸免受侵蚀,且能够繁衍大量底栖动物,为鸟类提供栖息地,此外,其还具有极高的景观价值,是生态旅游的极佳场所[7]。受土壤盐渍化、水体污染及人类过度开发(筑坝、修路)等因素影响,自2000年起,辽河口滩涂出现盐地碱蓬大面积群落退化现象,使得盐地碱蓬湿地原本具备的防洪抗旱、调节气候和控制污染等环境功能逐步丧失[8-9]。因此,开展辽河口盐地碱蓬湿地修复相关研究具有重要的生态、经济和社会意义。
研究表明,植物能够选择性地招募对其生长和抗逆有益的微生物群系并与之共生[10-11]。在植物组织内部普遍定殖内生细菌,其中一部分就是植物促生菌,其促生机制与植物根际促生菌(plant growth promoting rhizobacteria)相似,能够改变宿主植物激素水平,促进宿主植物吸收营养盐,诱导宿主植物产生“系统抗性”以对抗生物和非生物胁迫等[10-14]。植物内生菌在植物促生和生防保育中的应用一直是研究热点[10]。目前,已报道的有促生作用的植物内生菌种类繁多,宿主来源广泛,促生机制多样。分离自水稻Oryza sativa L.根部的芽孢杆菌属内生细菌Bacillus paralicheniformis能够促进宿主固氮[15];分离自大豆不同组织的多株内生细菌,包括肠杆菌属细菌Enterobacter ludwigii、根癌农杆菌Agrobacterium tumefaciens、黏质沙雷菌Serratia marcescens等,能够拮抗宿主致病真菌和致病细菌[16];分离自鹰嘴豆Cicer arietinum L.根瘤的一株内生细菌枯草芽孢杆菌Bacillus subtilis能够显著改善宿主在盐渍土壤中的生长状况和抗病能力[17]。但有关盐地碱蓬内生细菌对宿主的促生作用鲜有报道。
本研究中,从辽河口湿地野生盐地碱蓬叶片中分离可培养细菌并从中筛选出能够产铁载体、产ACC脱氨酶的潜在促生菌,通过定植接种水培盐地碱蓬幼苗试验,筛选出一株能够显著促进植物根系伸长和株高增长的内生细菌,首次报道了盐地碱蓬内生细菌的促生作用,可望为辽河口盐地碱蓬植被恢复提供菌种资源。
1 材料与方法
1.1 材料
试验用盐地碱蓬植株于2020年8月采自辽宁省盘锦市红海滩国家风景廊道,盐地碱蓬种子于2020年11月采自辽河口潮滩湿地。花土购自大连市花市。
试验用2216E琼脂(HB0132)、2216E培养基(HB0132-1)购自青岛高科园海博生物技术有限公司;革兰氏染色液试剂盒购自北京索莱宝(Solarbio)科技有限公司;PCR反应试剂盒为宝日医(TaKaRa)生物技术有限公司生产的TaKaRa PCR Amplification Kit(R011),PCR引物及测序引物使用通用引物27F(5′AGAGTTTGATCMTGGCTCAG 3′)和 1492R(5′TACGGYTACCTTGTTACGACTT 3′)。
试验用改良霍格兰培养液配方:A类溶液(无菌纯水配制)包含四水硝酸钙 945 mg/L、硝酸钾 506 mg/L和硝酸铵80 mg/L;B类溶液(无菌纯水配制)包含磷酸二氢钾 136 mg/L、七水硫酸镁 493 mg/L、铁盐溶液 2.5 mL和微量元素溶液 5 mL(pH 6.0),其中,铁盐溶液中包含七水硫酸亚铁 2.78 g、乙二胺四乙酸二钠 3.73 g和蒸馏水 500 mL(pH 5.5),微量元素溶液(无菌纯水配置)中包含碘化钾 0.83 mg/L、硼酸 6.2 mg/L、硫酸锰 22.3 mg/L、硫酸锌 8.6 mg/L、氯化钴 0.025 mg/L和硫酸铜 0.025 mg/L。取A类、B类溶液各100 mL,定容至1 L,现配现用。
1.2 方法
1.2.1 盐地碱蓬叶片内生细菌的分离培养 将采集自盘锦红海滩国家风景廊道的盐地碱蓬植株由冰盒带回,将植株地上部分用无菌水冲洗3次,用体积分数为70%的乙醇浸泡1 min,再用无菌水冲洗一次,用无菌镊子取几片盐地碱蓬叶子,置于无菌研砵中加20 mL无菌海水研成匀浆。再将匀浆液用无菌海水进行梯度稀释,分别稀释至10-1、10-2、10-3、10-4、10-5和10-6。对稀释至10-3、10-4、10-5和10-6的匀浆液,分别取0.1 mL涂布到2216E琼脂平板上,置于25 ℃恒温培养箱中培养,24 h后用接种环挑取形态不一样的菌落继续划线培养,重复多次后得到单一菌落。将单菌落用接种环挑取到装有无菌2216E液体培养基的锥形瓶中,25 ℃下以120 r/min摇床培养,每隔4 h取1 mL菌液,用721分光光度计测定OD600 nm(有效读数为0.1~0.8,读数超过0.8的菌液需进行稀释使得读数在0.1~0.8),至菌液OD600 nm 不再增长即细菌进入稳定期时停止取样,绘制生长曲线。取0.75 mL对数生长期菌液(OD600 nm=0.6~0.8)置于冻存管中,加入0.25 mL灭菌甘油,混匀后置于-80 ℃超低冰箱中保存备用。
1.2.2 盐地碱蓬可培养叶片内生细菌的分子鉴定 取1 μL分离获得的盐地碱蓬可培养叶片内生细菌新鲜菌液,加入9 μL无菌水,混匀后于100 ℃下煮沸10 min,取0.5 μL煮沸的菌液作为PCR扩增模板,用通用引物27F和1492R扩增16S rRNA基因。PCR扩增条件为:95 ℃下预变性3 min;95 ℃下循环变性30 s,55 ℃下退火复性30 s,72 ℃下延伸90 s,共进行35个循环;最后在72 ℃下总体延伸7 min,16 ℃下保存。用琼脂糖凝胶电泳检测PCR扩增出一条明晰条带后,将PCR产物直接送至华大基因公司进行测序。将16S rRNA基因序列在NCBI网站进行Nucleotide BLAST(BLASTn)比对,查找同源序列,进行分类鉴定。
1.2.3 盐地碱蓬可培养叶片内生细菌溶磷、解钾和固氮能力的定性试验
1)细菌溶磷能力的定性试验。采用PKO(溶磷菌筛选培养基)平板检测法[18],取1 μL活化好的菌液,将其点种在PKO无机培养基平板中央,28 ℃下倒置培养。7 d后取出平板,观察水解圈的有无,并测量水解圈的直径。具有溶磷功能的细菌会在培养过程中产生水解圈,且溶磷能力越强水解圈越大。
2)细菌解钾能力的定性试验。采用解钾菌筛选培养基平板检测法[19],取1 μL活化好的菌液,将其点种在解钾菌筛选培养基平板的中央,培养及观察过程同细菌溶磷能力定性试验。
3)细菌固氮能力的定性试验。采用阿须贝氏平板检测法[20],取1 μL活化好的菌液,将其点种在阿须贝氏培养基平板中央,28 ℃下倒置培养。7 d后取出平板,观察菌落大小和形态。具有固氮能力的细菌会长出黏稠、半透明、白色或褐色的菌落。
1.2.4 盐地碱蓬可培养叶片内生细菌产铁载体能力的定性试验 采用铬天青(Chrome azurol S,CAS)平板法[21],用接种环挑取菌落接种于 CAS 平板中央,28 ℃下倒置培养2 d。产铁载体菌株表现为在菌苔周围形成橙黄色晕圈,若无橙黄色晕圈产生则表示该菌株无产铁载体能力。
1.2.5 盐地碱蓬可培养叶片内生细菌产ACC(1-氨基环丙烷-1-羧酸,1-aminocyclopropane-1-carboxylate)脱氨酶能力测定 参照Penrose等[22]的方法,用接种环挑取菌落接种至50 mL PAF(Pseudomonas agar F)培养基中,28 ℃下以200 r/min振荡培养 24 h,吸取1 mL菌悬液接种至 50 mL DF(Dwrokin and Foster medium)培养基中,28 ℃下以200 r/min振荡培养24 h。按相同方法将DF培养液转接培养 3 次得菌悬液。梯度稀释该菌悬液(取1 mL菌液加入19 mL无菌ddH2O中,重复3次得到的梯度稀释液),分别取1 mL不同稀释倍数的菌液涂布于 ADF 平板,28 ℃下恒温培养24 h,观察生长情况。在ADF平板有菌落长出的细菌,表示能产ACC脱氨酶,反之则不产ACC脱氨酶。
1.2.6 盐地碱蓬的栽培 于2021年3月,挑选籽粒饱满的盐地碱蓬种子,用自来水浸泡过夜后,将种子撒在装好花土的圆形花盆(直径为20 cm,高为20 cm)中,每盆撒约100粒种子,种子上覆盖0.5~1.0 cm厚度的花土,初次浇水浇透,室外栽培,隔天浇水一次。种子发芽后继续土培3周左右。
1.2.7 水培盐地碱蓬定植接种试验 取-80 ℃下保存的盐地碱蓬可培养叶片内生细菌,接种到1 mL 2216E液体培养基中,25 ℃下以120 r/min摇床培养24 h至菌液浑浊。用接种环取菌液接种至2216E琼脂平板,连续划线后置于25 ℃下培养24 h得到单菌落。取单菌落接种至2216E液体培养基中,25 ℃下以120 r/min摇床培养得到对数生长期菌液(OD600 nm=0.6~0.8),以3 000 g离心5 min,收集菌体,弃上清液,将菌体重悬于适量无菌改良霍格兰培养液至终浓度为106 cells/mL,供定植接种盐地碱蓬幼苗用。
取3周龄盐地碱蓬土培幼苗,用无菌水小心洗净泥土,插置于上覆无菌牛皮纸、下装100 mL无菌改良霍格兰培养液的18个烧杯中,每个烧杯放置10株幼苗,置于光照培养箱(12 h光照∶12 h 黑暗,照度12 000 lx)25 ℃下暂养 1 d,分别测量幼苗根长和株高,再将幼苗转移至含5种盐地碱蓬叶片内生菌的改良霍格兰培养液中,同时设置不加菌的空白对照组。试验共设6组,每组试验设3个平行,置于光照培养箱(12 h光照:12 h 黑暗,照度12 000 lx)25 ℃下继续培养14 d,再次测量幼苗根长和株高,并计算根长伸长值和株高增长值。通过T检验判断感染组幼苗根长伸长值、株高增长值与对照组是否有显著性差异。
1.2.8 盐地碱蓬潜在促生细菌的形态观察 挑取盐地碱蓬潜在促生菌单菌落,接种至1 mL 2216E液体培养基中,25 ℃下以120 r/min摇床培养至对数生长期(OD600 nm=0.6~0.8),取适量菌液涂布于洁净载玻片上,按照索莱宝提供的革兰氏染色液使用说明书步骤进行固定、初染、媒染、脱色、复染,在油镜下镜检。
1.2.9 基于盐地碱蓬潜在促生细菌16S rRNA序列的进化分析 基于盐地碱蓬潜在促生菌16S rRNA基因序列的BLASTn比对结果,选择覆盖度大于91%、一致性大于99.7%且已鉴定到种的同属细菌,同时选择同源性较低的同属其他种细菌,使用MEGA 7软件,用Clustal W对其16S rRNA基因序列进行比对,再使用邻位相接法(Neighbor-Joining)构建系统进化树,自展检验(bootstrap)1 000次。
2 结果与分析
2.1 盐地碱蓬可培养叶片内生细菌的分离鉴定和生长曲线测定
通过2216E琼脂平板划线,从野生盐地碱蓬叶片分离得到6株可培养细菌,编号分别为JY21、JY24、JY32、BJY111、BJY223和BJY323,分别对单株细菌进行16S rRNA基因全长扩增及测序。基于16S rRNA基因序列的BLASTn结果表明:JY21菌与Larsenimonas salina L1-16、Chromohalobacter sp.BG-1-R4菌的同源性最高,在90%覆盖度下一致性均为99.39%,与L.suaedae ST307在90%覆盖度下一致性为99.23%(该细菌是同样分离自盐地碱蓬叶片和茎组织的内生菌[19]);JY24菌与Kushneria 属细菌同源性最高,在98%覆盖度下一致性高于98.50%,包括K.konosiri、K.marisflavi和K.sp.ET2115等;JY32菌未能比对到同源属,与基因库中多株不可培养细菌高度同源;BJY111菌与多株Pseudoalteromonas属细菌在99%覆盖度下一致性高于99.00%,包括P.sp.CF11-6、P.sp.CF14-5和P.ganghwensis WAB2129等;BJY223菌与多株Pseudoalteromonas属细菌在91%覆盖度下一致性均为99.85%,包括P.sp.C82、P.sp.C73和P. lipolytica QS176等,但是BJY223菌与BJY111菌的16S rRNA序列并不一致,推测二者可能是同属不同种的细菌;BJY323菌与多株Enterobacter属细菌在99%覆盖度下一致性高于99.50%,包括E.ludwigii、E.cloacae等。
这6株菌在2216E液体培养基中的生长曲线如图1所示。JY21菌生长延迟期不明显,4 h进入对数生长期,16 h后进入稳定期,对数生长期菌液OD600 nm为0.5~2.0(图1(a));JY24菌生长延迟期较长,至24 h才进入对数生长期,32 h进入稳定期,对数生长期菌液OD600 nm为0.4~2.0(图1(b));JY32菌生长延迟期长,至28 h进入对数生长期,40 h进入稳定期,对数生长期菌液OD600 nm为0.5~3.0(图1(c));BJY111菌生长延迟期短,4 h进入对数生长期,16 h进入稳定期,对数生长期菌液OD600 nm为0.4~2.5(图1(d));BJY223菌培养4 h后进入对数生长期,培养24 h后进入稳定期,对数生长期菌液OD600 nm为0.3~2.5(图1(e));菌株BJY323培养4~12 h,OD600 nm增长较快,从0.23增至1.105,之后增长幅度放缓,但仍持续增长,至44 h进入稳定期(图1(f))。
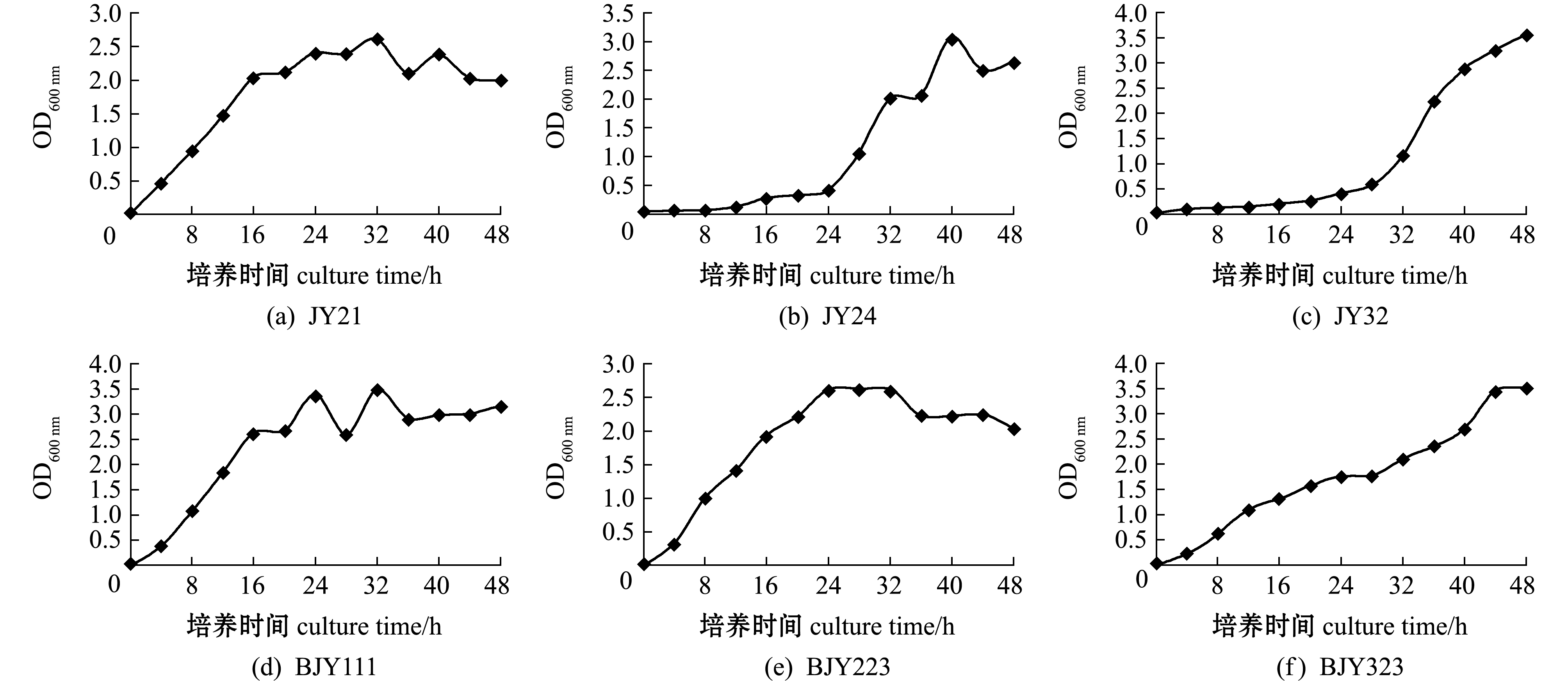
图1 盐地碱蓬叶片可培养细菌生长曲线(25 ℃)
Fig.1 Growth curves of the culturable bacteria isolated from leaves of sea grass Suaeda salsa(25 ℃)
2.2 盐地碱蓬潜在促生菌的体外试验筛选
为筛选盐地碱蓬促生菌,首先用体外平板法检测分离获得的6株盐地碱蓬叶片内生细菌溶磷、解钾、固氮、产铁载体和产ACC脱氨酶能力,结果如表1所示。
表1 盐地碱蓬叶片内生细菌促生潜力的检测结果
Tab.1 Detecting the potential plant growth promoting capabicity of endophytic bacteria from leaves of sea grass Suaeda salsa

菌株编号No.of strain溶磷phosphorus solubilization解钾potassium release固氮nitrogen fixation产铁载体iron carrier production产ACC脱氨酶ACC deaminase synthesisJY21---+-JY24---+-JY32----+BJY111-----BJY223---+-BJY323---++
注:+,阳性;-,阴性。
Note:+,positive,-,negative.
受试细菌在PKO平板和解钾菌筛选培养基平板分别培养7 d后,均未观察到水解圈的产生,显示其不具备溶磷、解钾能力。受试细菌在阿须贝氏平板培养7 d后,均未观察到黏稠、半透明的白色或褐色菌落,说明其不具备固氮能力。
受试细菌在CAS平板培养2 d后,有4株细菌在菌苔周围产生较明显橙黄色晕圈(图2),编号分别为JY21(图2A)、JY24(图2B)、BJY223(图2E)和BJY323(图2F),表明其具备产铁载体的能力;而编号为JY32(图2C)和BJY111(图2D)的两株细菌未在菌苔周围产生橙黄色晕圈,表明其不具备产铁载体的能力。
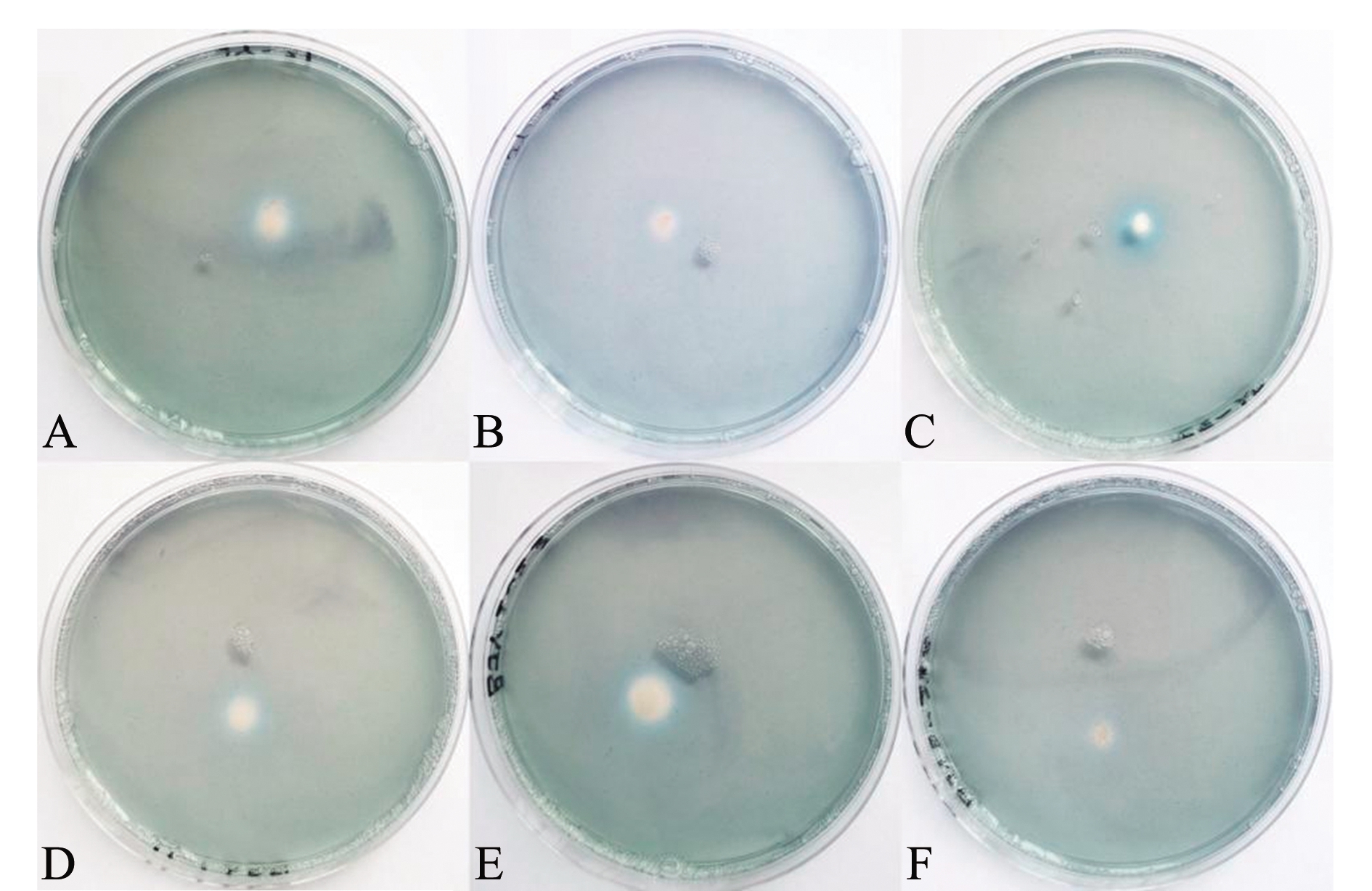
A—JY21;B—JY24;C—JY32;D—BJY111;E—BJY223;F—BJY323.
图2 盐地碱蓬叶片内生细菌的产铁载体能力
Fig.2 Production of iron carriers of endophytic bacteria from leaves of sea grass Suaeda salsa
受试细菌经富集培养,在ADF平板培养24 h后,涂布JY32(图3A)和BJY323(图3B)细菌的ADF平板有单菌落长出,表明其具有产ACC脱氨酶的能力;而涂布其他4株细菌的ADF平板未见菌落长出,说明其不具备产ACC脱氨酶的能力。
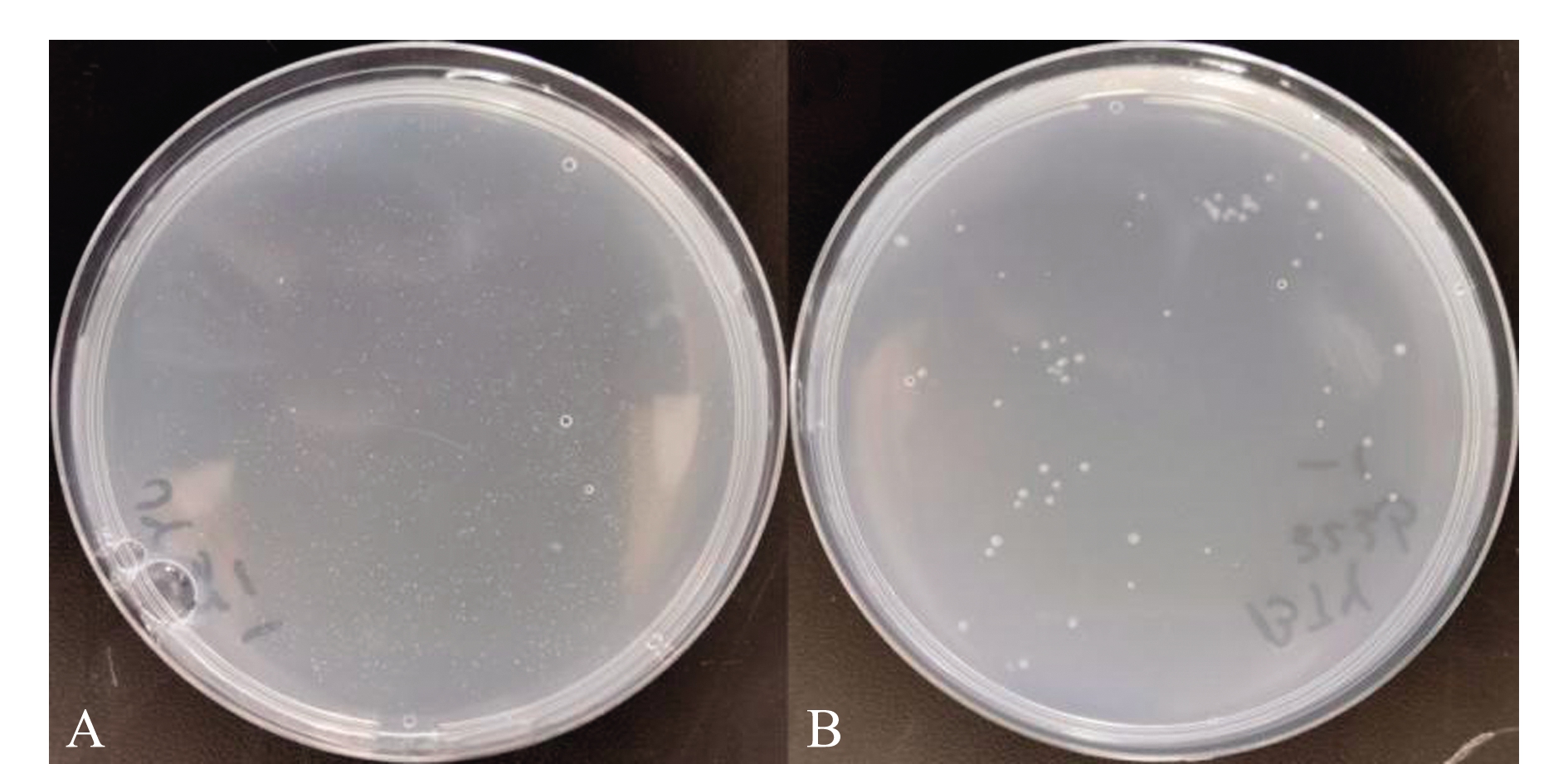
A—JY32;B—BJY323.
图3 盐地碱蓬叶片内生菌的产ACC脱氨酶能力
Fig.3 Production of ACC deaminase of endophytic bacteria from leaves of sea grass Suaeda salsa
根据体外试验结果,盐地碱蓬叶片内生细菌JY21、JY24、JY32、BJY223和BJY323可能具备促生潜力,因此,选取这5株内生细菌进行盐地碱蓬幼苗定植接种试验以验证其促生性能。
2.3 定植接种试验筛选盐地碱蓬潜在促生菌
取上述5株具有产铁载体或产ACC脱氨酶能力的盐地碱蓬内生菌对数生长期菌液(菌液OD600 nm=0.6~0.8),分别定植接种水培盐地碱蓬,定植接种14 d后测定根长伸长值和株高增长值。从表2可见:水培盐地碱蓬幼苗培养14 d后,与对照组相比,定植接种这5株内生菌的盐地碱蓬根长伸长平均值均有提高,其中定植接种JY32、BJY223、BJY323菌的3个试验组盐地碱蓬根长伸长值较高,且定植接种BJY223菌的试验组有极显著差异(P<0.01);与对照组相比,定植接种这5株内生菌的盐地碱蓬株高增长平均值均有提高,其中定植接种JY24、JY32、BJY223菌的试验组盐地碱蓬株高增长较高,且接种JY32、BJY223菌的试验组有极显著差异(P<0.01)。总体来看,分离自野生盐地碱蓬叶片的内生菌BJY223促进水培盐地碱蓬地下部分和地上部分的生长效果最好,是盐地碱蓬潜在促生菌。
表2 盐地碱蓬幼苗根长伸长值和株高增长值
Tab.2 Root elongation value and stem growth value of sea grass Suaeda salsa
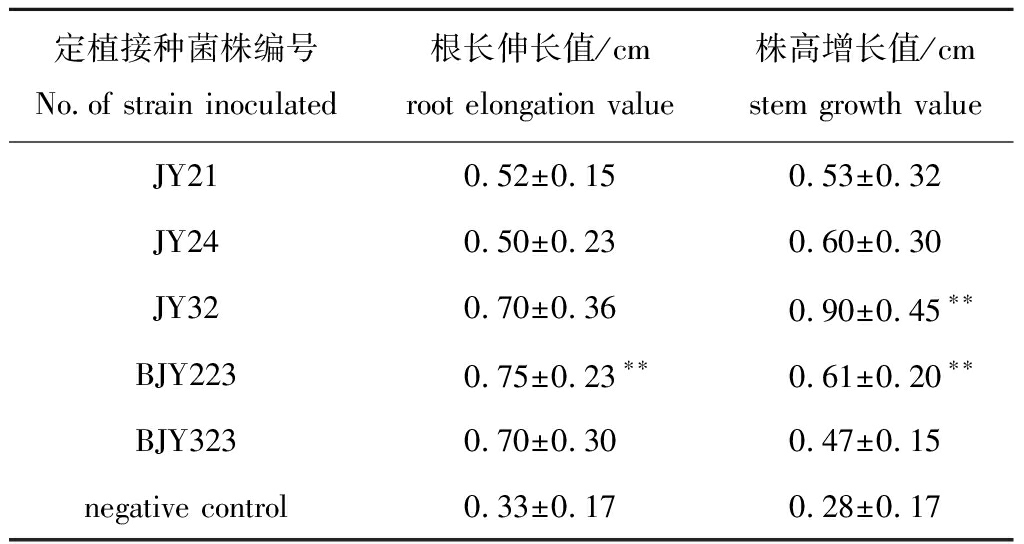
定植接种菌株编号No.of strain inoculated根长伸长值/cmroot elongation value 株高增长值/cmstem growth valueJY210.52±0.150.53±0.32JY240.50±0.230.60±0.30JY320.70±0.360.90±0.45∗∗BJY2230.75±0.23∗∗0.61±0.20∗∗BJY3230.70±0.300.47±0.15negative control0.33±0.170.28±0.17
注:*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01)。
Note: *means significant difference compared with the control(P<0.05);**means very significant difference compared with the control(P<0.01).
2.4 盐地碱蓬潜在促生菌的形态观察和分子鉴定
对BJY223菌进行革兰氏染色,油镜下观察其细胞呈红色、短杆状或曲杆状,据此推断其为革兰氏阴性杆菌(图4)。

图4 盐地碱蓬潜在促生菌BJY223的革兰氏染色图
Fig.4 Gram’s staining picture of the potential sea grass Suaeda salsa growth promoting bacterium BJY223
假交替单胞菌属细菌在1995年作为单独的一个属从交替单胞菌属划分出来,为革兰氏阴性杆菌[24]。选择12株Pseudoalteromonas属不同种细菌与BJY223菌基于16S rRNA基因序列进行系统发育分析(图5),其中包括与BJY223菌高度同源的P.lipolytica 和P.donghaensis,根据系统发育树显示的亲缘远近,在已鉴定到种的假交替单胞菌属细菌中,BJY223菌与P.lipolytica亲缘关系最为接近,其次是P.donghaensis、P.shioyasakiensis等。

图5 基于16S rRNA基因序列的假交替单胞菌属细菌系统进化树
Fig.5 Phylogenetic tree of some members in genus Pseudoalteromonas based on 16S rRNA gene sequence
结合BJY223菌的形态学观察结果与16S rRNA基因序列的亲缘发育分析结果,推断BJY223为假交替单胞菌属细菌,且在已鉴定到种的该属细菌中,与P.lipolytica亲缘关系最为接近,同源性最高(一致性99.85%)
3 讨论
3.1 碱蓬属植物可培养内生细菌的多样性
目前,有关碱蓬属植物内生菌的研究尚不多见。崔春晓等[25]从山东东营滨海盐地碱蓬秋季植株中分离获得15株可培养内生细菌,基于16S rRNA基因序列的BLASTn结果显示,其与Halomonas属(5株)、Chromohalobacter属(4株)、Harerehalobacter属(3株)、Kushneria属(2株)和Bacillus属(1株)细菌最为相似。其中,1株与Chromohalobacter属细菌相似的内生细菌被Xia等[23]于2016年正式鉴定为Larsenimonas suaedae。田锐等[26]系统研究了辽宁盘锦三角洲翅碱蓬Suaeda heteroptera根系可培养细菌多样性,分离获得可培养根系内生菌12株,基于16S rRNA基因序列的BLASTn结果推测,其分别与Zhihengliuella属(3株)、Pseudomonas属(2株)、Kusherneria属(2株)、Planococlus属(1株)、Salinicola属(1株)、Microbulbifer属(1株)、Arthrobacter属(1株)和Paracoccus属(1株)细菌最为相似。
本研究从夏季辽河口湿地野生盐地碱蓬叶片内共分离获得6株可培养内生细菌,其分别与Pseudoalteromonas属细菌(2株)、L.suaedae或Chromohalobacter属细菌(1株)、Chromohalobacter属细菌(1株)、Kushneria属细菌(1株)和Enterobacter属细菌(1株)最为相似,还有1株为不可培养细菌。本研究与前人的研究既有一致性又有独特性,与山东东营盐地碱蓬植株内生细菌类似,本研究从辽河口盐地碱蓬叶片内部也分离出与L.suaedae、Chromohalobacter属和Kusherneria属细菌同源性最高的细菌。值得注意的是,与Kusherneria属细菌高度同源的细菌,既能从盐地碱蓬植株内部分离获得,又能从翅碱蓬植株内部分离获得,提示其可能是广布于碱蓬属植物体内的内生细菌。本研究中也分离获得了与其他属细菌高度同源的可培养盐地碱蓬叶片内生菌。
3.2 植物内生细菌的促生长作用
植物组织内部存在一类有益于植物生长且抗逆的内生细菌,可用于植物的生防保育。在农业上,植物促生菌因其可开发成绿色安全的生物肥料,部分或者全部替代传统的化学制剂,近年来备受关注[27-28]。一方面,植物促生菌通过溶磷、解钾、固氮、产铁载体等能力促进植物吸收营养物质,提高植物在不利环境中对营养物质的吸收能力,使植物获得更高的存活率;另一方面,植物促生菌可以通过生产生长素及ACC脱氨酶促进植物生长,在激素及酶类代谢方面赋予逆境中的植物更强的抗逆能力。Alishahi 等[29]从碱蓬属植物根部分离了多株耐盐且能够固氮的内生细菌,但针对内生细菌的植物促生功能仅做了体外平板试验。
本研究中,对从盐地碱蓬植株中分离出的内生菌进行了溶磷、解钾、固氮、产铁载体及产ACC脱氨酶能力检测试验,试验虽在可培养盐地碱蓬内生菌中未检测出溶磷、解钾、固氮功能,但检测出有几株内生菌具有产铁载体和产ACC脱氨酶能力,其中,具有产铁载体能力的BJY223在定植接种水培盐地碱蓬幼苗试验中,可显著促进幼苗根长伸长和植株生长。由此推测,本研究中分离出的潜在促生菌可能通过产生铁载体来提高植株对营养物质的吸收效率,进而促进植株生长。这也是首次报道了可培养盐地碱蓬叶片内生菌在水培盐地碱蓬体内试验中有促生作用。
3.3 假交替单胞菌属细菌的来源和用途
假交替单胞菌属细菌是海洋细菌,多与真核寄主(包括海洋动物和海洋植物)共生,能产生一系列活性代谢产物,发挥抗菌、溶菌、水解琼脂和除藻等作用,可开发成生防制剂[30]。其部分成员能形成生物膜并释放胞外拮抗剂,有效抑制因无脊椎动物幼虫附着引发的生物污损(biofouling)[31]。如P.lipolytica菌可在海洋中的不锈钢材料上形成抗污损生物膜[25],其分泌的胞外黑脓素(pyomelanin)对厚壳贻贝Mytilus coruscus的幼虫附着及变态发生有抑制作用[32]。一株分离自韩国附近东海海域的P.donghaensis菌能在低温和碱性条件下生产胞外蛋白酶[33]。一株分离自太平洋沉积物中的P.shioyasakiensis菌能产生胞外多糖[34]。已报道有植物促生功能的假交替单胞菌属细菌包括从奥迪尔(Odiel)盐沼节黎属植物Arthrocnemum macrostachyum根际分离的P.rhizosphaera[35]和从海带Laminaria japonica中分离的P.porphyrae菌,后者能够促进农作物种子萌发和植株生长[36]。
本研究中,从辽河口野生盐地碱蓬叶片内分离出一株假交替单胞菌属细菌BJY223,其在实验室条件下具有产铁载体能力,且能显著促进水培盐地碱蓬幼苗的根部伸长和植株生长,可望用于盐地碱蓬植被修复。
4 结论
1)从夏季辽河口湿地野生盐地碱蓬叶片内分离获得6株可培养细菌并对其进行分子鉴定,筛选出4株具备产铁载体潜能的细菌。
2)通过水培盐地碱蓬幼苗定植接种试验,从4株具备产铁载体潜能的细菌中筛选出1株能显著促进幼苗根部伸长和茎部增长的内生菌BJY223,该菌可能是盐地碱蓬促生菌。基于形态学观察和16S rRNA基因全长序列分析,鉴定该株盐地碱蓬促生菌为假交替单胞菌属Pseudoalteromonas细菌,该菌可为辽河口盐地碱蓬植被恢复提供菌种资源。
[1] 中国科学院中国植物志编辑委员会.中国植物志-第二十七卷[M].北京:科学出版社,1979.
Editorial Committee of Flora of China,Chinese Acadamy of Sciences.Flora of China-volume 27[M].Beijing:Science Press,1979.(in Chinese)
[2] 张学杰,樊守金,李法曾.中国碱蓬资源的开发利用研究状况[J].中国野生植物资源,2003,22(2):1-3.
ZHANG X J,FAN S J,LI F Z.Development and utilization of Suaede salsa in China[J].Chinese Wild Plant Resources,2003,22(2):1-3.(in Chinese)
[3] 于海芹,张天柱,魏春雁,等.3种碱蓬属植物种子含油量及其脂肪酸组成研究[J].西北植物学报,2005,25(10):2077-2082.
YU H Q,ZHANG T Z,WEI C Y,et al.Fat contents and fatty acid composition in the seeds of three species of Suaeda[J].Acta Botanica Boreali-Occidentalia Sinica,2005,25(10):2077-2082.(in Chinese)
[4] 赵可夫,李法曾,张福锁.中国盐生植物[M].2版.北京:科学出版社,2013.
ZHAO K F,LI F Z,ZHANG F S.Chinese halophytes[M].2nd edition.Beijing:Science Press,2013.(in Chinese)
[5] 何洁,陈旭,王晓庆,等.翅碱蓬对滩涂湿地沉积物中重金属Cu、Pb的累积吸收[J].大连海洋大学学报,2012,27(6):539-545.
HE J,CHEN X,WANG X Q,et al.The absorption and accumulation of heavy metals Cu,and Pb in tidal wetland sediments by plant Suaeda heteroptera Kitag[J].Journal of Dalian Ocean University,2012,27(6):539-545.(in Chinese)
[6] 刘欢,何洁,樊晓茹,等.原油污染土壤翅碱蓬根际效应和降解的研究[J].大连海洋大学学报,2019,34(2):191-197.
LIU H,HE J,FAN X R,et al.Rhizospheric effect and oil degradation of saline seepweed Suaeda heteroptera in soil contaminated by crude oil[J].Journal of Dalian Ocean University,2019,34(2):191-197.(in Chinese)
[7] 关道明.中国滨海湿地[M].北京:海洋出版社,2012.
GUAN D M.China coastal wetland[M].Beijing:Ocean Press,2012.(in Chinese)
[8] 徐东霞,章光新.人类活动对中国滨海湿地的影响及其保护对策[J].湿地科学,2007,5(3):282-288.
XU D X,ZHANG G X.Impact of human activities on coastal wetlands in China[J].Wetland Science,2007,5(3):282-288.(in Chinese)
[9] 李凤岐,高会旺.环境海洋学[M].北京:高等教育出版社,2013.
LI F Q,GAO H W.Environmental oceanography[M].Beijing:Higher Education Press,2013.(in Chinese)
[10] SANTOYO G,MORENO-HAGELSIEB G,DEL CARMEN OROZCO-MOSQUEDA M,et al.Plant growth-promoting bacterial endophytes[J].Microbiological Research,2016,183:92-99.
[11] HARDOIM P R,VAN OVERBEEK L S,VAN ELSAS J D.Properties of bacterial endophytes and their proposed role in plant growth[J].Trends in Microbiology,2008,16(10):463-471.
[12] EID A M,FOUDA A,ABDEL-RAHMAN M A,et al.Harnessing bacterial endophytes for promotion of plant growth and biotechnological applications:an overview[J].Plants(Basel,Switzerland),2021,10(5):935.
[13] SHORESH M,HARMAN G E,MASTOURI F.Induced systemic resistance and plant responses to fungal biocontrol agents[J].Annual Review of Phytopathology,2010,48:21-43.
[14] NADEEM S M,AHMAD M,ZAHIR Z A,et al.The role of mycorrhizae and plant growth promoting rhizobacteria(PGPR)in improving crop productivity under stressful environments[J].Biotechnology Advances,2014,32(2):429-448.
[15] ANNAPURNA K,GOVINDASAMY V,SHARMA M,et al.Whole genome shotgun sequence of Bacillus paralicheniformis strain KMS 80,a rhizobacterial endophyte isolated from rice(Oryza sativa L.)[J].3 Biotech,2018,8(5):223.
[16] DE ALMEIDA LOPES K B,CARPENTIERI-PIPOLO V,FIRA D,et al.Screening of bacterial endophytes as potential biocontrol agents against soybean diseases[J].Journal of Applied Microbiology,2018,125(5):1466-1481.
[17] EGAMBERDIEVA D,WIRTH S J,SHURIGIN V V,et al.Endophytic bacteria improve plant growth,symbiotic performance of chickpea(Cicer arietinum L.)and induce suppression of root rot caused by Fusarium solani under salt stress[J].Frontiers in Microbiology,2017,8:1887.
[18] 万水霞,王静,李帆,等.玉米根际高效溶磷菌的筛选、鉴定及促生效应研究[J].生物技术通报,2020,36(5):98-103.
WAN S X,WANG J,LI F,et al.Screening and identification of phosphate solubilizing bacteria from maize rhizosphere soil and its growth promoting effect[J].Biotechnology Bulletin,2020,36(5):98-103.(in Chinese)
[19] 中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985.
Department of Microbiology,Institute of Soil Science,Chinese Academy of Sciences.Soil microbiology research method[M].Beijing:Science Press,1985.(in Chinese)
[20] SEN M,SEN S P.Interspecific transformation in Azotobacter[J].Journal of General Microbiology,1965,41(1):1-6.
[21] 赵翔,谢志雄,陈绍兴,等.适合高产铁载体细菌筛选、检测体系的改进与探析[J].微生物学通报,2006,33(6):95-98.
ZHAO X,XIE Z X,CHEN S X,et al.Improvement and analysis in over-siderophores production bacteria filtrating and detecting[J].Microbiology,2006,33(6):95-98.(in Chinese)
[22] PENROSE D M,GLICK B R.Methods for isolating and characterizing ACC deaminase-containing plant growth-promoting rhizobacteria[J].Physiologia Plantarum,2003,118(1):10-15.
[23] XIA Z J,WU H Z,CUI C X,et al.Larsenimonas suaedae sp.nov.,a moderately halophilic,endophytic bacterium isolated from the halophyte Suaeda salsa[J].International Journal of Systematic and Evolutionary Microbiology,2016,66(8):2952-2958.
[24] GAUTHIER G,GAUTHIER M,CHRISTEN R.Phylogenetic analysis of the genera Alteromonas,Shewanella,and Moritella using genes coding for small-subunit rRNA sequences and division of the genus Alteromonas into two genera,Alteromonas(emended)and Pseudoalteromonas gen.nov.,and proposal of twelve new species combinations[J].International Journal of Systematic Bacteriology,1995,45(4):755-761.
[25] 崔春晓,戴美学,夏志洁.盐地碱蓬内生中度嗜盐菌的分离与系统发育多样性分析[J].微生物学通报,2010,37(2): 204-210.
CUI C X,DAI M X,XIA Z J.Phylogenetic diversity of endophytic moderately halophilic bacteria isolated from Suaeda salsa L.[J].Microbiology China,2010,37(2): 204-210.
[26] 田锐,于子超,李作扬,等.辽宁盘锦三角洲翅碱蓬根系及内生细菌群落多样性[J].微生物学通报,2016,43(7):1462-1472.
TIAN R,YU Z C,LI Z Y,et al.Diversity of endophytic and rhizospheric bacteria of Suaeda heteroptera Kitag from Panjin delta in Liaoning province[J].Microbiology China,2016,43(7):1462-1472.
[27] 崔春晓,戴美学,夏志洁.盐地碱蓬内生中度嗜盐菌的分离与系统发育多样性分析[J].微生物学通报,2010,37(2):204-210.
CUI C X,DAI M X,XIA Z J.Phylogenetic diversity of endophytic moderately halophilic bacteria isolated from Suaeda salsa L.[J].Microbiology China,2010,37(2):204-210.(in Chinese)
[28] EMAMI S,ALIKHANI H A,POURBABAEI A A,et al.Effect of rhizospheric and endophytic bacteria with multiple plant growth promoting traits on wheat growth[J].Environmental Science and Pollution Research International,2019,26(19):19804-19813.
[29] ALISHAHI F,ALIKHANI H A,KHOSHKHOLGH-SIMA N A,et al.Mining the roots of various species of the halophyte Suaeda for halotolerant nitrogen-fixing endophytic bacteria with the potential for promoting plant growth[J].International Microbiology,2020,23(3):415-427.
[30] HOLMSTRÖM C,KJELLEBERG S.Marine Pseudoalteromonas species are associated with higher organisms and produce biologically active extracellular agents[J].FEMS Microbiology Ecology,1999,30(4):285-293.
[31] ZENG Z S,GUO X P,CAI X S,et al.Pyomelanin from Pseudoalteromonas lipolytica reduces biofouling[J].Microbial Biotechnology,2017,10(6):1718-1731.
[32] GUO Z W,LIU T,CHENG Y F,et al.Adhesion of Bacillus subtilis and Pseudoalteromonas lipolytica to steel in a seawater environment and their effects on corrosion[J].Colloids and Surfaces B,Biointerfaces,2017,157:157-165.
[33] OH J S,CHOI Y S,ROH D H.Characterization and optimum production condition of extracellular protease from Pseudoalteromonas donghaensis HJ51[J].The Korean Journal of Microbiology,2015,51(1):75-80.
[34] MATSUYAMA H,SAWAZAKI K,MINAMI H,et al.Pseudoalteromonas shioyasakiensis sp.nov.,a marine polysaccharide-producing bacterium[J].International Journal of Systematic and Evolutionary Microbiology,2014,64(Pt 1):101-106.
[35] NAVARRO-TORRE S,CARRO L,RODR GUEZ-LLORENTE I D,et al.Pseudoalteromonas rhizosphaerae sp.nov.,a novel plant growth-promoting bacterium with potential use in phytoremediation[J].International Journal of Systematic and Evolutionary Microbiology,2020,70(5):3287-3294.
GUEZ-LLORENTE I D,et al.Pseudoalteromonas rhizosphaerae sp.nov.,a novel plant growth-promoting bacterium with potential use in phytoremediation[J].International Journal of Systematic and Evolutionary Microbiology,2020,70(5):3287-3294.
[36] DIMITRIEVA G Y,CRAWFORD R L,YÜKSEL G U.The nature of plant growth-promoting effects of a pseudoalteromonad associated with the marine algae Laminaria japonica and linked to catalase excretion[J].Journal of Applied Microbiology,2006,100(5):1159-1169.