中国水产养殖业发展迅速,集约化高密度的养殖模式在提高了水产品产量的同时,也带来了不容忽视的环境污染问题。循环水养殖系统(RAS)被普遍认为是一种既能满足集约化生产需求,又能解决环境污染的有效途径,符合水产养殖业可持续发展的要求[1]。曝气生物滤器(BAF)是RAS常用的核心水处理单元,BAF内部填料表面附着的生物膜可有效去除![]() 等,以减轻对养殖生物的危害[2],然而,在此过程中
等,以减轻对养殖生物的危害[2],然而,在此过程中![]() 的积累对养殖动物的毒性也得到了证实[3]。
的积累对养殖动物的毒性也得到了证实[3]。
传统理论认为,反硝化作用是在缺氧条件下将硝酸盐氮转化为含氮气体的过程,这与循环水养殖系统需维持高溶氧状态以保证高密度养殖过程相矛盾。好氧反硝化过程的发现打破了这一屏障,好氧反硝化细菌Thiosphera pantotropha的分离纯化,开启了好氧反硝化研究的新领域[4]。近年来,越来越多具有好氧反硝化能力的菌株被报道,如好氧反硝化菌Pseudomonas poae NL-4[5]、Zobellella sp.XH5[6]和异养硝化好氧反硝化菌Acinetobacterindicus ZJB20129[7]等。目前,已报道的好氧反硝化细菌主要分离自土壤、淡水湖泊及污水处理系统中,这些菌株在高盐度(>10)环境下好氧反硝化能力会受较大限制[8]。因为高盐度会导致细胞渗透压急剧增加,细胞代谢受到抑制,菌体细胞的酶活性降低,使得该类细菌在处理含盐废水或海水养殖废水时,脱氮效率低下[9]。RAS需要维持较高的溶解氧(DO)浓度,与BAF相比,RAS组合了厌氧反应器、曝气装置的工艺将占用更多的空间并浪费能耗。目前,对于高盐度(约30)、寡营养盐(COD<25 mg/L)条件下的好氧反硝化研究仍较少。因此,筛选具有耐盐及高效脱氮能力的菌株,提高BAF反硝化性能,对于海水RAS尤为重要。
本研究中,从RAS曝气生物滤池中分离得到一株具有高效好氧反硝化性能的菌株HRL-11,在高盐度(31)条件下,研究了溶解氧、C/N和温度等重要因素对该菌株好氧反硝化性能的影响及氮平衡分析,其结果对解决海水氮素污染,尤其是硝酸盐氮积累问题具有良好的实用潜力,并可为高盐度废水好氧条件下硝酸盐生物去除提供技术支持。
菌株分离用生物滤片取自设施渔业教育部重点实验室(大连海洋大学)循环海水养殖系统曝气生物滤池。
1.2.1 菌株筛选 将取自BAF中的生物滤片通过无菌水清洗后,利用灭菌刀片刮取生物膜,并用灭菌生理盐水梯度稀释10-1~10-7,然后均匀涂布于LB固体培养基上,于30 ℃下培养24 h。挑取单克隆菌落接种于反硝化培养基(DM)中培养48 h,然后将菌液在溴百里酚蓝(BTB)固体培养基上划线,在30 ℃条件下培养48 h。挑选BTB培养基变蓝色的单克隆菌株,在BTB培养基上多次划线纯化,直至获得纯化的单克隆菌株,周围无杂菌和伴生菌。将纯化的单克隆菌株,利用体积分数为20%的甘油保存于-80 ℃超低温冰箱中备用。经过分离纯化得到的菌株记为HRL-11。
1.2.2 培养基的配制
DM培养基:包含Na2HPO4 7.9 g/L、KH2PO4 4.5 g/L、MgSO4 0.1 g/L、K2HPO4 4.78 g/L、NaCl 30 g/L、KNO3 0.722 g/L、乙酸钠 3.418 g/L和微量元素3 mL/L(pH 7.1±0.2),其中,微量元素包含ZnSO4·7H2O 3 g/L、H3BO3 1.12 g/L、CaCl2 0.6 g/L、FeSO4·H2O 0.3 g/L、CuSO4·5H2O 1.57 g/L、MgSO4·7H2O 3 g/L和EDTA 25 g/L,DM固体培养基添加20 g/L琼脂[10]。
BTB培养基:在DM培养基基础上添加0.2%百里溴酚蓝(体积分数为1%,溶于乙醇),BTB固体培养基添加20 g/L琼脂。
LB培养基:包含蛋白胨10 g/L、酵母浸粉5 g/L和NaCl 30 g/L,LB固体培养基添加20 g/L琼脂。
1.2.3 菌株的形态观察及16S rDNA鉴定
1)扫描电镜(SEM)观察。取菌液2 mL,以10 000 r/min离心10 min。使用体积分数为3%的戊二醛溶液固定24 h,然后在扫描电镜下观察并拍摄菌株细胞形态。
2)16S rDNA鉴定。将纯化菌株接种于DM培养基中培养48 h,使用TIA amp细菌DNA试剂盒(中国天根)提取细菌基因组DNA,以基因组DNA为模板,扩增引物采用16S通用引物。上游引物27F: 5′AGAGTTTGATCCTGGCTCAG 3′,下游引物1492R: 5′GATACCTTGTTACGACTT 3′。
PCR反应体系(25 μL):Mix 12.5 μL,DNA模板1 μL,上、下游引物各0.5 μL,ddH2O 10.5 μL。反应条件:90 ℃下预变性5 min;94 ℃下循环变性60 s,55 ℃下退火复性60 s,72 ℃下延伸90 s,共进行30个循环;最后在72 ℃下再延伸变性5 min。通过变性凝胶电泳(DGGE)分析PCR产物,PCR产物测序由北京诺禾致源科技股份有限公司完成。
测序结果通过BLAST程序与GenBank数据库比对(https://blast.ncbi.nlm.nih.gov/Blast.cgi)。应用MAGA 6.0软件构建菌株系统发育树(N-J法)。
1.2.4 单一因素对菌株HRL-11碳、氮代谢等性能的影响 分别考察DO、C/N和温度对菌株HRL-11碳、氮代谢等性能的影响。按2%(体积分数)的接种量,吸取对数生长期菌悬液(OD600nm为1.0)1 mL,接种至含有50 mL 灭菌海水(盐度为31)DM培养基的100 mL西林瓶中,以![]() 为唯一碳源,设初始硝酸盐氮
为唯一碳源,设初始硝酸盐氮![]() 质量浓度为100 mg/L。
质量浓度为100 mg/L。
DO试验:体系中的DO通过摇床转速来控制。摇床转速分别设置为90 r/min(初始DO质量浓度5.58 mg/L)、120 r/min(初始DO质量浓度6.87 mg/L)和150 r/min(初始DO质量浓度7.48 mg/L),其余试验条件设置为C/N 10、温度30 ℃、pH 7.0±0.5,在此条件下摇床培养48 h。
C/N试验:将不同质量的乙酸钠分别加入以KNO3为唯一氮源的培养基中,控制C/N值分别为3、5、10、15,其余试验条件设置为温度30 ℃、pH 7.0±0.5、摇速150 r/min(初始DO质量浓度7.48 mg/L),在此条件下培养48 h。
温度试验:培养温度分别设置为20、30、40 ℃,其余试验条件设置为振荡摇速150 r/min、C/N 10、pH 7.0±0.5,在此条件下培养48 h。
每个处理设置3个平行,每隔4 h取样一次,测定菌液样品的OD600nm值以评估细菌的生长性能;然后将菌液样品以8 000 r/min离心10 min,去除细胞抽取上清液,用0.22 μm滤膜过滤,然后测定培养液样品中的溶解态![]() 和
和![]() 等指标以评估细菌脱氮性能,测定总有机碳(TOC)浓度以评估细菌的碳代谢性能。
等指标以评估细菌脱氮性能,测定总有机碳(TOC)浓度以评估细菌的碳代谢性能。
1.2.5 菌株HRL-11氮平衡测试分析 根据单因素试验结果,将菌株接种于盛有50 mL DM培养基的100 mL 西林瓶中,在30 ℃、150 r/min条件下培养48 h。菌液通过超声波细胞粉碎机(JY92-IIN,宁波新芝生物科技股份有限公司)处理。
超声破碎程序如下:超声开、关时间分别为4.0、6.0 s,报警温度为70 ℃,功率为50%,工作总时长为15 min。超声破碎所得破碎悬液以8 000 r/min离心10 min,去除细胞抽取上清液,用0.22 μm滤膜过滤,然后测定培养液样品中的![]() 和
和![]() 质量浓度。细胞内总氮、总有机氮和氮损失计算公式[10]为
质量浓度。细胞内总氮、总有机氮和氮损失计算公式[10]为
细胞内总氮=超声破碎后最终总氮-溶解态最终总氮,
总有机氮=溶解态总氮-硝酸氮-亚硝酸氮-氨氮,
氮损失=(初始总氮-超声破碎后最终总氮)/初始总氮×100%。
1.2.6 指标测定 采用紫外分光光度计(UV-2100,优尼科,中国)测定600 nm 波长下菌液的吸光度。采用连续流动自动分析仪(Quickchem 8500, HACH, USA)测定![]() 和
和![]() 质量浓度。采用总有机碳分析仪TOC-L CPN(Shimadzu, Kyoto, 日本)测定TN和TOC质量浓度。
质量浓度。采用总有机碳分析仪TOC-L CPN(Shimadzu, Kyoto, 日本)测定TN和TOC质量浓度。
菌株HRL-11为革兰氏阴性菌,菌落形态观察显示,该菌落在DM固体培养基上颜色微黄,直径为1.0~1.5 mm,边缘光滑,略微隆起,表面湿润,不透明,与培养基结合不紧密(图1A);扫描电镜观察显示,该细菌呈短杆状,未见鞭毛及芽孢(图1B)。
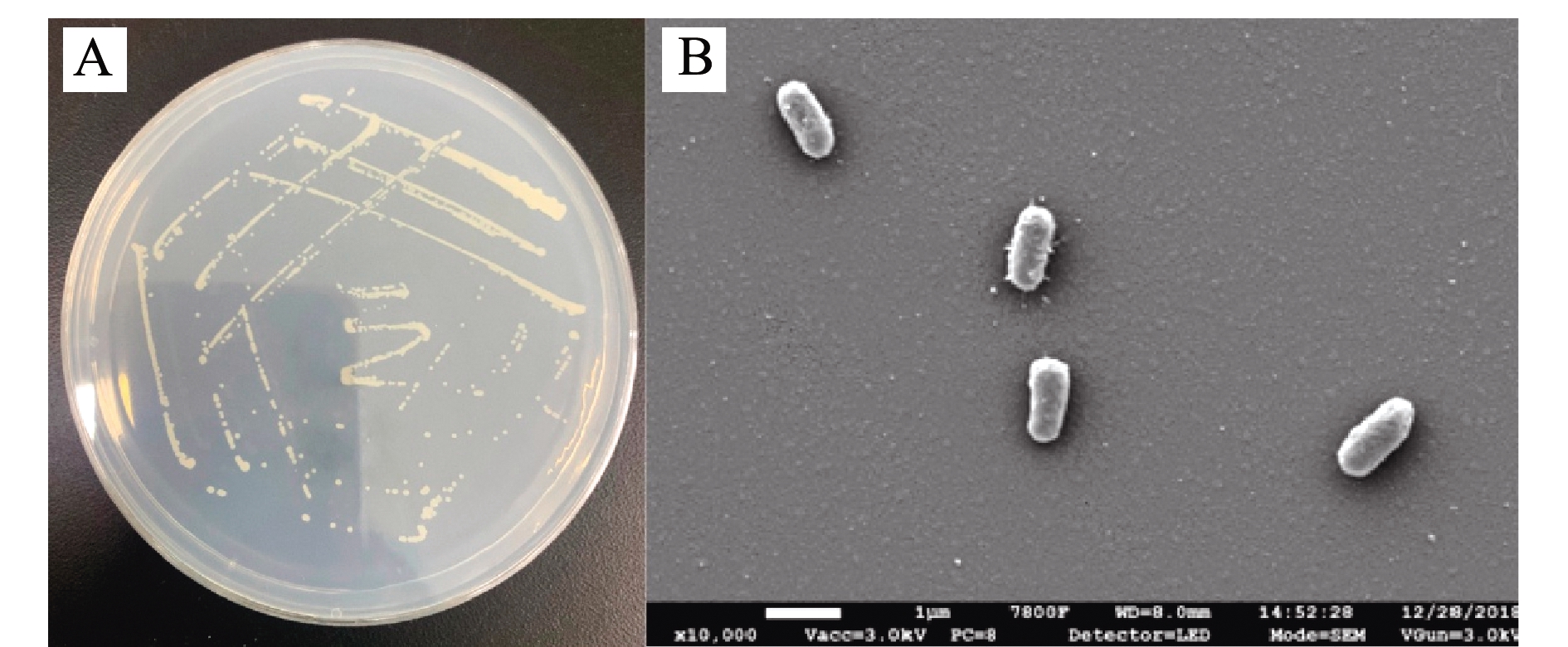
图1 菌株HRL-11的菌落图(A)和电镜图(B)
Fig.1 Colony diagram(A)and SEM(B)images of strain HRL-11
提取菌株HRL-11的总DNA,经16S rRNA基因序列扩增测序得到1 345 bp片段的DNA 序列,在NCBI数据库中BLAST检索显示,菌株HRL-11与多株Halomonas sp.同源性最高,与菌株Halomonas zhaodongensis NEAU-ST10-25一致性为99.8%。系统进化分析显示,HRL-11与Halomonas zhaodongensis 聚为一支,亲缘关系最近(图2)。结合形态学特征及16S rRNA基因序列分析结果,将该菌株鉴定为盐单胞菌属,命名为Halomonas sp.HRL-11。于2019年9月17日,将该菌保存于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.18499。

图2 菌株HRL-11的系统发育树
Fig.2 Phylogenetic tree of strain HRL-11
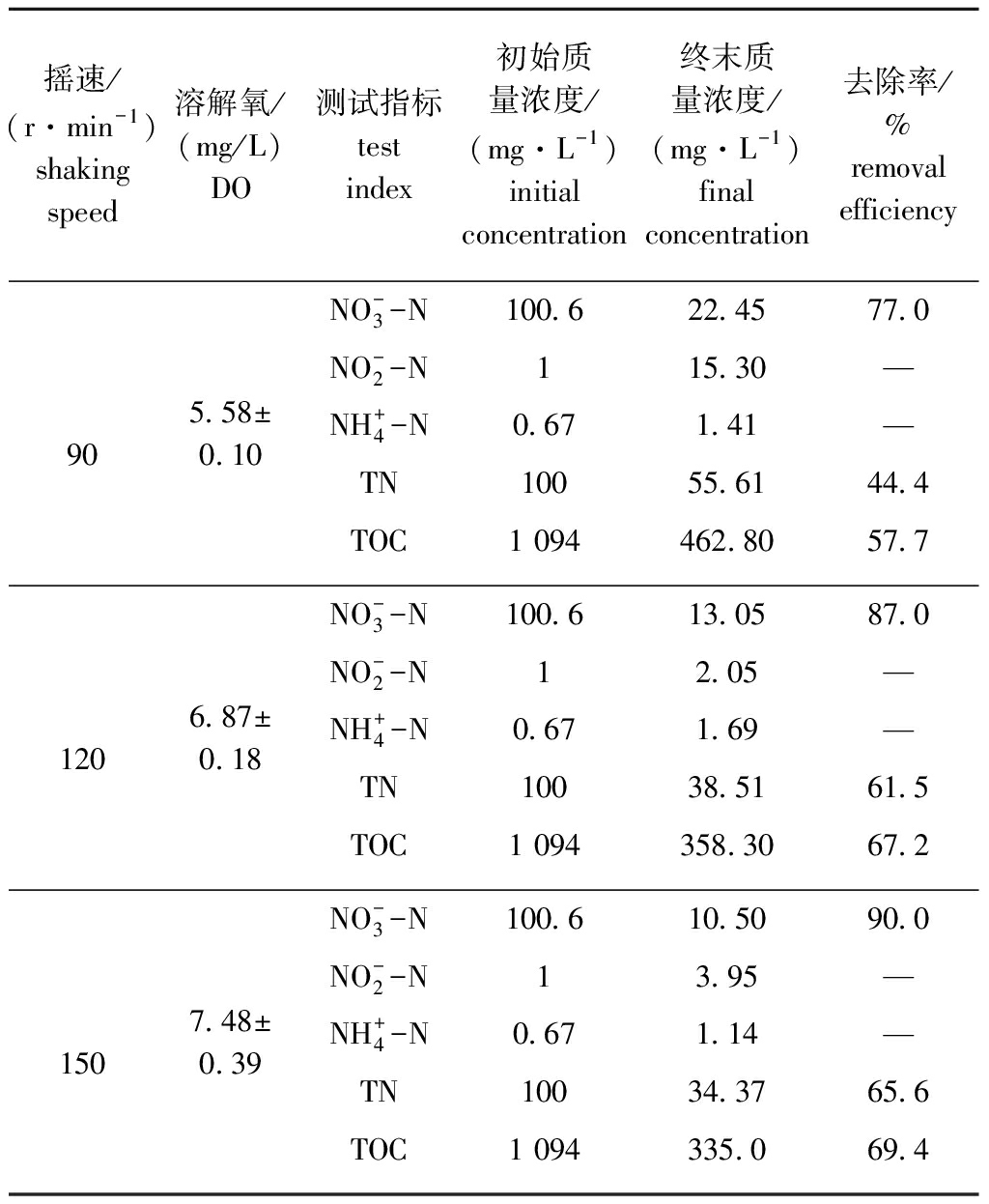
表1显示了摇速(即DO)对HRL-11株好氧反硝化性能及生长的影响。从表1可见:摇速为90 r/min(初始DO质量浓度为5.58 mg/L)时,菌株生长速度缓慢(OD600nm=0.82),且TOC利用率较低,虽然![]() 在48 h时的去除率达到77.0%,但TN的最终去除率仅为
在48 h时的去除率达到77.0%,但TN的最终去除率仅为![]() 存在严重积累,其最终质量浓度仍为15.30 mg/L;随着摇速增至120 r/min,菌株生长更快(OD600 nm=1.23),TOC利用率更高,摇速为120 r/min(初始DO质量浓度为6.87 mg/L)和150 r/min(初始DO质量浓度为7.48 mg/L)时,48 h
存在严重积累,其最终质量浓度仍为15.30 mg/L;随着摇速增至120 r/min,菌株生长更快(OD600 nm=1.23),TOC利用率更高,摇速为120 r/min(初始DO质量浓度为6.87 mg/L)和150 r/min(初始DO质量浓度为7.48 mg/L)时,48 h ![]() 去除率分别为87.0%和90.0%,TN去除效率分别为61.5%和65.6%,其中摇速为150 r/min处理组的OD600 nm值为
去除率分别为87.0%和90.0%,TN去除效率分别为61.5%和65.6%,其中摇速为150 r/min处理组的OD600 nm值为![]() 和TOC 48 h的去除率均达到最高。综上所述,该菌株在摇速150 r/min时好氧反硝化性能最佳。
和TOC 48 h的去除率均达到最高。综上所述,该菌株在摇速150 r/min时好氧反硝化性能最佳。
表1 不同溶解氧条件下氮、碳化合物的去除率(48 h)
Tab.1 Removal efficiency of nitrogen and carbon compounds at different dissolved oxygen concentrations(48 h)
摇速/(r·min-1)shaking speed溶解氧/(mg/L)DO测试指标test index初始质量浓度/(mg·L-1)initial concentration终末质量浓度/(mg·L-1)final concentration去除率/%removal efficiency905.58±0.10NO-3-N100.622.4577.0NO-2-N115.30—NH+4-N0.671.41—TN10055.6144.4TOC1 094462.8057.71206.87±0.18NO-3-N100.613.0587.0NO-2-N12.05—NH+4-N0.671.69—TN10038.5161.5TOC1 094358.3067.21507.48±0.39NO-3-N100.610.5090.0NO-2-N13.95—NH+4-N0.671.14—TN10034.3765.6TOC1 094335.069.4
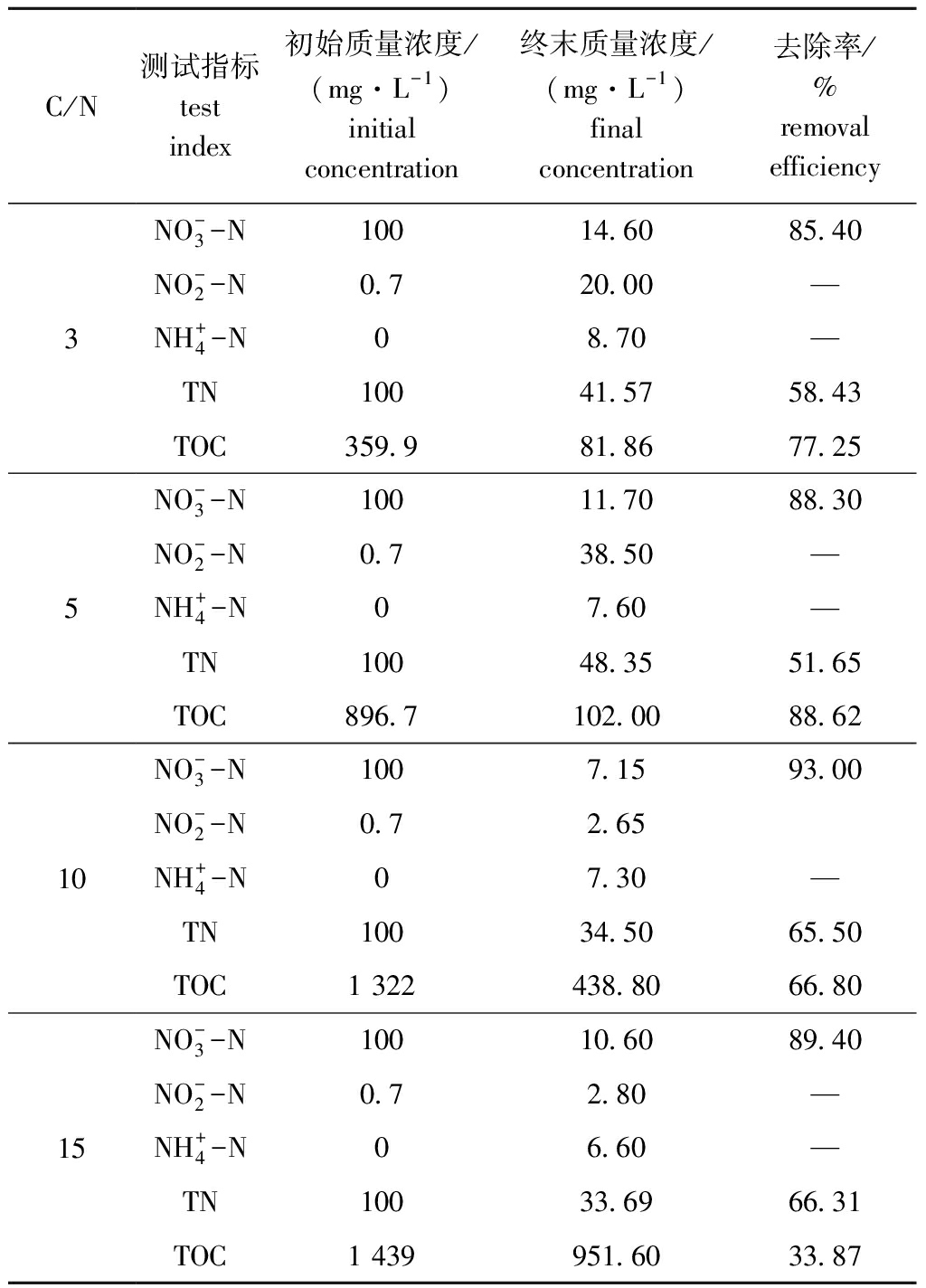
从表2可见:C/N值为3~15时,![]() 的去除率均可达85.4%以上;C/N值分别为3和5时,菌株生长缓慢(OD600 nm分别为0.44和0.65),虽然
的去除率均可达85.4%以上;C/N值分别为3和5时,菌株生长缓慢(OD600 nm分别为0.44和0.65),虽然![]() 最终去除率分别为85.4%和88.3%,但反应体系中
最终去除率分别为85.4%和88.3%,但反应体系中![]() 积累严重;随着C/N值升高至10和15时,菌株快速生长(OD600 nm分别为1.27和1.32),脱氮效率提高,C/N为10时,
积累严重;随着C/N值升高至10和15时,菌株快速生长(OD600 nm分别为1.27和1.32),脱氮效率提高,C/N为10时,![]() 的最终去除率达到最高,为93.0%,高于C/N为15时(89.4%),且C/N 为10的处理组其OD600 nm值为1.27,其
的最终去除率达到最高,为93.0%,高于C/N为15时(89.4%),且C/N 为10的处理组其OD600 nm值为1.27,其![]() 和TOC 48 h的去除率均达到最高。综上所述,该菌株在C/N为10时表现出最佳的好氧反硝化性能。
和TOC 48 h的去除率均达到最高。综上所述,该菌株在C/N为10时表现出最佳的好氧反硝化性能。
表2 不同C/N条件下氮、碳化合物的去除率(48 h)
Tab.2 Removal efficiency of nitrogen and carbon compounds under different C/N ratios(48 h)
C/N测试指标test index初始质量浓度/(mg·L-1)initial concentration终末质量浓度/(mg·L-1)final concentration去除率/%removal efficiency3NO-3-N10014.6085.40NO-2-N0.720.00—NH+4-N08.70—TN10041.5758.43TOC359.981.8677.255NO-3-N10011.7088.30NO-2-N0.738.50—NH+4-N07.60—TN10048.3551.65TOC896.7102.0088.6210NO-3-N1007.1593.00NO-2-N0.72.65NH+4-N07.30—TN10034.5065.50TOC1 322438.8066.8015NO-3-N10010.6089.40NO-2-N0.72.80—NH+4-N06.60—TN10033.6966.31TOC1 439951.6033.87
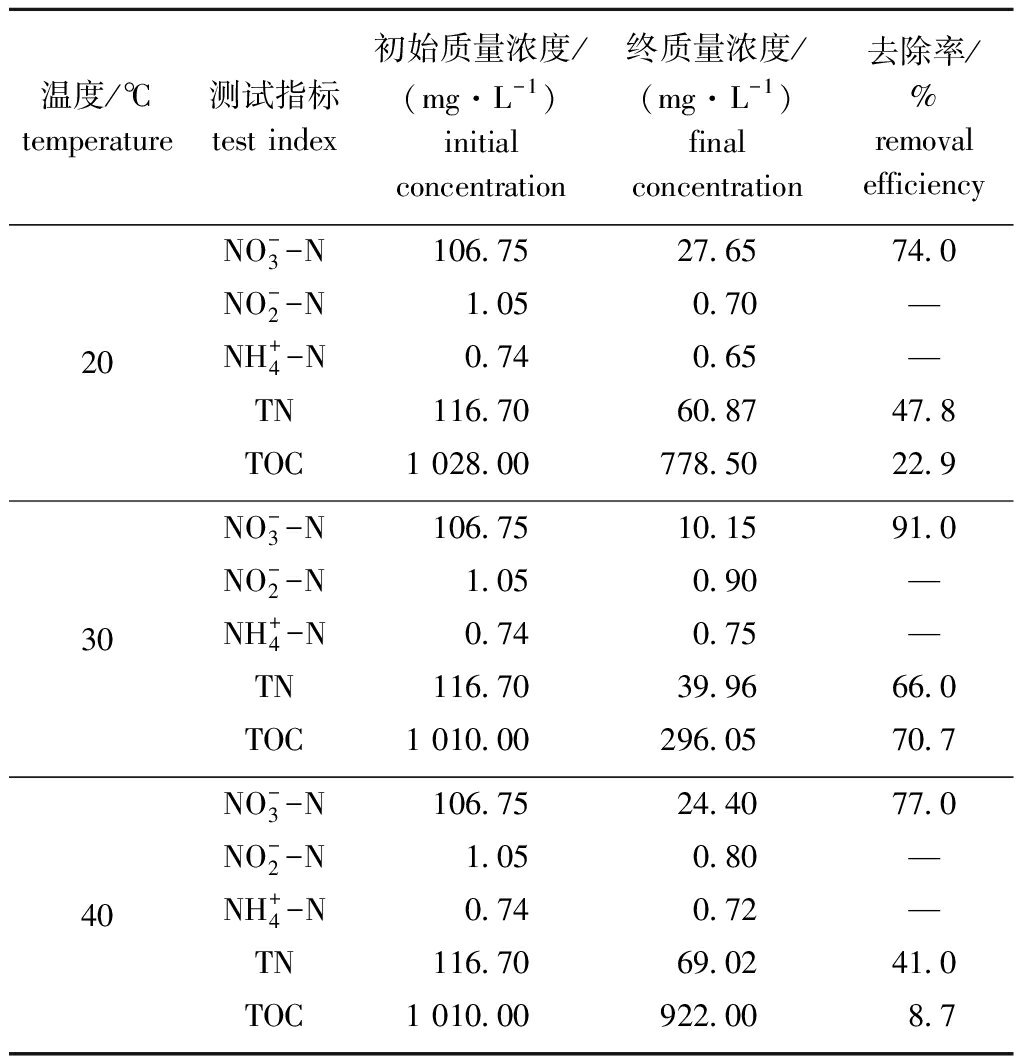
从表3可见:随着温度升高,菌株HRL-11的生长加快;在20 ℃时,HRL-11生长缓慢(OD600 nm=0.36),TOC利用率较低,48 h时仅为![]() 和TN的去除率分别仅为74.0%和47.8%;随着温度升高至30 ℃,HRL-11生长明显加快
和TN的去除率分别仅为74.0%和47.8%;随着温度升高至30 ℃,HRL-11生长明显加快![]() 和TN的去除率也随之增加,HRL-11对
和TN的去除率也随之增加,HRL-11对![]() 和TN的最终去除率均高于40 ℃条件,
和TN的最终去除率均高于40 ℃条件,![]() 的去除率为91.0%,TN和TOC 48 h的去除率分别为66.0%和70.7%,均为最高。
的去除率为91.0%,TN和TOC 48 h的去除率分别为66.0%和70.7%,均为最高。![]() 还原过程中几乎无
还原过程中几乎无![]() 积累,但产生了低浓度的
积累,但产生了低浓度的![]() 种不同温度条件下,均有不同浓度的
种不同温度条件下,均有不同浓度的![]() 产生,但
产生,但![]() 浓度变化不具有明显差异。综上所述,该菌株在温度为30 ℃时表现出最佳好氧反硝化性能。
浓度变化不具有明显差异。综上所述,该菌株在温度为30 ℃时表现出最佳好氧反硝化性能。
表3 不同温度条件下氮、碳化合物的去除率(48 h)
Tab.3 Removal efficiency of nitrogen and carbon compounds at different temperature(48 h)
温度/℃temperature测试指标test index初始质量浓度/(mg·L-1)initial concentration终质量浓度/(mg·L-1)final concentration去除率/%removal efficiency20NO-3-N106.7527.6574.0NO-2-N1.050.70—NH+4-N0.740.65—TN116.7060.8747.8TOC1 028.00778.5022.930NO-3-N106.7510.1591.0NO-2-N1.050.90—NH+4-N0.740.75—TN116.7039.9666.0TOC1 010.00296.0570.740NO-3-N106.7524.4077.0NO-2-N1.050.80—NH+4-N0.740.72—TN116.7069.0241.0TOC1 010.00922.008.7
根据单因素试验结果,将Halomonas sp.HRL-11菌株接种于含有50 mL海水DM培养基的100 mL西林瓶中,在摇速150 r/min(初始DO质量浓度7.48 mg/L)、30 ℃、C/N 10、pH 7.0±0.5最佳培养条件下培养48 h,评价该菌株的好氧反硝化能力,结果如图3所示,在48 h时,OD600nm值为![]() 去除率达到91.5%,TOC和TN去除率分别达到69.4%和65.6%。
去除率达到91.5%,TOC和TN去除率分别达到69.4%和65.6%。
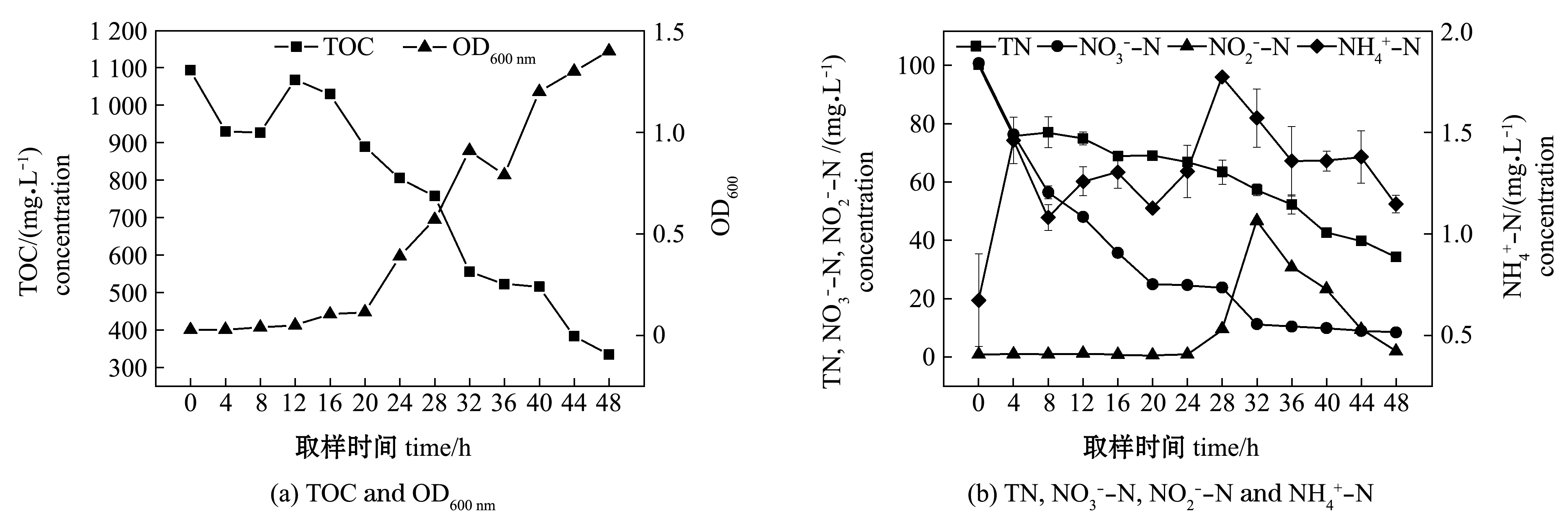
图3 Halomonas sp.HRL-11最佳脱氮条件(150 r/min,30 ℃,C/N 10)下试验系统水质参数的变化
Fig.3 Changes in water quality parameters in the experiment system under the optimal denitrification conditions by Halomonas sp.HRL-11(150 r/min, 30 ℃, C/N 10)
在试验开始阶段,![]() 作为好氧反硝化体系的唯一氮源,培养48 h后,测得溶解态TN浓度为34.37 mg/L,破碎悬液中TN为53.81 mg/L,计算结果表明,19.44%的
作为好氧反硝化体系的唯一氮源,培养48 h后,测得溶解态TN浓度为34.37 mg/L,破碎悬液中TN为53.81 mg/L,计算结果表明,19.44%的![]() 转化为细胞胞内氮;测得溶解态TN中包含的最终
转化为细胞胞内氮;测得溶解态TN中包含的最终![]() 和
和![]() 浓度分别为8.50、2.05、1.10 mg/L,计算结果表明,有机氮浓度为22.72 mg/L(表4),这表明共有25.87%的
浓度分别为8.50、2.05、1.10 mg/L,计算结果表明,有机氮浓度为22.72 mg/L(表4),这表明共有25.87%的![]() 转化为其他含氮产物(如
转化为其他含氮产物(如![]() 和
和![]() 和有机氮),推断其余46.19%的
和有机氮),推断其余46.19%的![]() 转化为气态产物。
转化为气态产物。
表4 Halomonas sp.HRL-11好氧反硝化过程中的氮平衡分析
Tab.4 Nitrogen balance analysis of aerobic denitrification process of Halomonas sp.HRL-11

底物substrate初始TN/(mg·L-1)initial TN concentration溶解态最终TN/(mg·L-1) final dissolved TN concentrationNO-3-NNO-2-NNH+4-N有机氮 organic-N胞内氮/%intracellular-N氮损失/%nitrogen loss硝酸盐nitrate1008.50±0.212.05±0.141.10±0.4222.72±0.3219.44±2.1746.19
本研究中,从海水生物滤池生物滤片上分离得到一株Halomonas sp.HRL-11。根据已有研究,盐单胞菌是一种中度嗜盐细菌,包括70多个物种[11]。研究表明,一些盐单胞菌菌株具有好氧反硝化能力,如Halomonas campisalish 3[12]、Halomonas alkaliphile HRL-9[13]和Halomonas salifodinae Y5[14]等。本研究中的单因素试验结果表明,不同因素(DO、温度和C/N)对菌株HRL-11的好氧反硝化性能有明显影响。
已有研究表明,摇速条件和DO质量浓度对菌株的好氧反硝化能力具有重要的影响[13]。本研究中,当振荡摇速从90 r/min(初始DO质量浓度为5.58 mg/L)提高到150 r/min(初始DO质量浓度为7.48 mg/L)时,![]() 的去除率从77.0%提升至90.0%。摇速对菌株的反硝化能力产生重要影响的原因,可能是不同摇速条件下,反应体系中DO质量浓度不同。不同DO质量浓度影响反硝化菌硝酸盐还原酶的合成和活性,并影响反硝化作用[15],且通常过高与过低的DO质量浓度均会影响细菌生长速率和改变细胞代谢产物,从而影响反硝化效率[16]。本研究中,摇速为150 r/min时(初始DO质量浓度为7.48 mg/L)时,菌株HRL-11在体系中大量生长,好氧反硝化能力表现明显高于其他条件(表1)。由此可见,菌株HRL-11在需要保持较高DO质量浓度的养殖水体净化过程中具有潜在的应用价值。
的去除率从77.0%提升至90.0%。摇速对菌株的反硝化能力产生重要影响的原因,可能是不同摇速条件下,反应体系中DO质量浓度不同。不同DO质量浓度影响反硝化菌硝酸盐还原酶的合成和活性,并影响反硝化作用[15],且通常过高与过低的DO质量浓度均会影响细菌生长速率和改变细胞代谢产物,从而影响反硝化效率[16]。本研究中,摇速为150 r/min时(初始DO质量浓度为7.48 mg/L)时,菌株HRL-11在体系中大量生长,好氧反硝化能力表现明显高于其他条件(表1)。由此可见,菌株HRL-11在需要保持较高DO质量浓度的养殖水体净化过程中具有潜在的应用价值。
有机碳在细菌细胞生长和异养反硝化中起着重要作用[17]。好氧反硝化过程中,菌株不仅需要碳源维持细胞生长,也需要有机碳作为反硝化过程的能源[18]。因此,有机碳对细菌细胞生长和反硝化性能具有重要的作用。本研究中,C/N值为3~5时,TOC利用率较高,但OD600nm值较低,表明体系中细菌密度较低,且最终TN去除率较低。这可能是由于反应后期TOC浓度过低,碳源不足以供给体系中细菌生长繁殖[19],从而导致细菌反硝化率变低,体系中![]() 积累严重[20]。当C/N值为10时,随碳源增加,菌株HRL-11对
积累严重[20]。当C/N值为10时,随碳源增加,菌株HRL-11对![]() 的去除速率明显提高;当C/N值提高到15时,碳源含量进一步增加,然而值得注意的是,菌株HRL-11好氧反硝化性能并未明显增加,硝酸盐去除率略低于C/N为10时,总氮去除效果相近(表2)。这可能是由于用于反硝化菌的碳源已足够,较高的碳氮比导致了碳源过剩,可能导致部分有机物直接嵌入酶结构而影响酶活性[21],从而影响了反硝化效率。因此,C/N值为10时为本研究设定条件下的最优脱氮条件。
的去除速率明显提高;当C/N值提高到15时,碳源含量进一步增加,然而值得注意的是,菌株HRL-11好氧反硝化性能并未明显增加,硝酸盐去除率略低于C/N为10时,总氮去除效果相近(表2)。这可能是由于用于反硝化菌的碳源已足够,较高的碳氮比导致了碳源过剩,可能导致部分有机物直接嵌入酶结构而影响酶活性[21],从而影响了反硝化效率。因此,C/N值为10时为本研究设定条件下的最优脱氮条件。
温度是影响细菌反硝化性能的重要因素之一,因为温度能够影响微生物细胞结构从而影响其生长[22]。好氧反硝化菌的脱氮速率在温度过高和过低时均会被抑制[23],大多数反硝化菌最适生长温度为20~35 ℃[24]。本研究设定条件下,HRL-11在40 ℃时![]() 去除率低于30 ℃,可能是由于高温导致了微生物体内酶等活性物质变性从而对部分细胞的功能产生影响[21]。本研究中,好氧反硝化菌HRL-11在30 ℃时反硝化性能最好,脱氮率明显高于其他温度条件(表3)。这一结果与杨静丹等[16]报道的菌株Klebsiella quasipneumoniae subsp.quasipneumoniae HY3-2最适脱氮温度为30 ℃的结果相似。
去除率低于30 ℃,可能是由于高温导致了微生物体内酶等活性物质变性从而对部分细胞的功能产生影响[21]。本研究中,好氧反硝化菌HRL-11在30 ℃时反硝化性能最好,脱氮率明显高于其他温度条件(表3)。这一结果与杨静丹等[16]报道的菌株Klebsiella quasipneumoniae subsp.quasipneumoniae HY3-2最适脱氮温度为30 ℃的结果相似。
本研究表明,HRL-11株生长和脱氮的最佳条件为温度30 ℃、振荡摇速150 r/min、C/N 10,在最佳条件下菌株HRL-11具有优异的反硝化性能和高效脱氮效率(图3)。此外,菌株HRL-11的氮平衡显示,![]() 含量的19.44%转化为细胞胞内氮,25.87%转化为其他硝化产物(即
含量的19.44%转化为细胞胞内氮,25.87%转化为其他硝化产物(即![]() 和有机氮),以及46.19%的
和有机氮),以及46.19%的![]() 发生了氮损失,即转化为气态产物从系统中排出(表4)。这一结果表明,菌株HRL-11的好氧反硝化作用是试验系统中硝酸盐还原的主要原因。已有研究表明,不同菌株的氮转化途径和程度可能不同,如张进等[25]研究发现,Enterobacter cloacae F2 在对
发生了氮损失,即转化为气态产物从系统中排出(表4)。这一结果表明,菌株HRL-11的好氧反硝化作用是试验系统中硝酸盐还原的主要原因。已有研究表明,不同菌株的氮转化途径和程度可能不同,如张进等[25]研究发现,Enterobacter cloacae F2 在对![]() 去除过程中,约有60%的氮转化为胞内氮,仅有20%的氮被转化为气态氮,可见,菌株E.cloacae F2主要通过同化作用去除氮素。本研究中的菌株HRL-11通过氮还原,将系统中更多的氮转化为气体,彻底从系统中去除,可见,耐盐好氧反硝化菌HRL-11具有较好的脱氮能力。值得注意的是,虽然菌株HRL-11具有耐盐和好氧反硝化能力,可在实验室纯培养条件下取得理想的脱氮效果,然而并不意味着将其直接投加到含氮污水处理系统中就可以产生非常好的处理效果。对脱氮菌株的研究发现,外来菌株的应用过程中常因难以与原生菌株竞争而无法在环境中定殖,存在难以成为微生物群落中优势种的问题[26]。因此,今后应重点研究菌株HRL-11在实际水体环境中的适应能力,开展固定化强化技术研究。此外,为了减少温室气体(N2O)排放,也应分析菌株HRL-11还原硝酸盐氮的气态产物,以及产物与环境条件的关系。
去除过程中,约有60%的氮转化为胞内氮,仅有20%的氮被转化为气态氮,可见,菌株E.cloacae F2主要通过同化作用去除氮素。本研究中的菌株HRL-11通过氮还原,将系统中更多的氮转化为气体,彻底从系统中去除,可见,耐盐好氧反硝化菌HRL-11具有较好的脱氮能力。值得注意的是,虽然菌株HRL-11具有耐盐和好氧反硝化能力,可在实验室纯培养条件下取得理想的脱氮效果,然而并不意味着将其直接投加到含氮污水处理系统中就可以产生非常好的处理效果。对脱氮菌株的研究发现,外来菌株的应用过程中常因难以与原生菌株竞争而无法在环境中定殖,存在难以成为微生物群落中优势种的问题[26]。因此,今后应重点研究菌株HRL-11在实际水体环境中的适应能力,开展固定化强化技术研究。此外,为了减少温室气体(N2O)排放,也应分析菌株HRL-11还原硝酸盐氮的气态产物,以及产物与环境条件的关系。
1)从循环海水养殖系统曝气生物滤池生物滤片上分离得到一株高效耐盐好氧反硝化菌HRL-11,经形态学观察及16S rRNA序列分析鉴定为盐单胞菌属,记为Halomonas sp.HRL-11。
2)在高盐度(31)条件下,振荡摇速为150 r/min(初始DO质量浓度7.48 mg/L)、温度为30 ℃、C/N值为10时,对![]() 的去除率达到92.0%,菌株Halomonas sp.HRL-11表现出最优的好氧反硝化性能,且脱氮过程中亚硝态氮积累量较少。该优化条件对于需要保持较高DO质量浓度的养殖水体净化具有实际应用意义。
的去除率达到92.0%,菌株Halomonas sp.HRL-11表现出最优的好氧反硝化性能,且脱氮过程中亚硝态氮积累量较少。该优化条件对于需要保持较高DO质量浓度的养殖水体净化具有实际应用意义。
3)在优化条件下,菌株Halomonas sp.HRL-11的氮平衡显示,19.44%的![]() 转化为胞内氮,25.87%的
转化为胞内氮,25.87%的![]() 转化为其他硝化产物
转化为其他硝化产物![]() 和有机氮),46.19%的
和有机氮),46.19%的![]() 可能转化为气态产物。表明耐盐好氧反硝化菌Halomonas sp.HRL-11具有较好的脱氮性能,在工业化海水RAS等高盐度废水脱氮处理上具有较大的应用潜力。
可能转化为气态产物。表明耐盐好氧反硝化菌Halomonas sp.HRL-11具有较好的脱氮性能,在工业化海水RAS等高盐度废水脱氮处理上具有较大的应用潜力。
[1] 隗陈征,刘鹰,任纪龙,等.曝气条件对铁基复合填料生物滤器脱氮性能及菌群变化的影响[J].大连海洋大学学报,2021,36(3):470-477.
WEI C Z,LIU Y,REN J L,et al.Effects of aeration conditions on nitrogen removal performance and microbial community changes in biological aerated filter with iron-based composite packing[J].Journal of Dalian Ocean University,2021,36(3):470-477.(in Chinese)
[2] 杨永愿,汪晓军,赵爽,等.沸石曝气生物滤池短程硝化特性及其机制[J].中国环境科学,2017,37(12):4518-4525.
YANG Y Y,WANG X J,ZHAO S,et al.Partial nitrification performance and mechanism of zeolite biological aerated filter for ammonium wastewater treatment[J].China Environmental Science,2017,37(12):4518-4525.(in Chinese)
[3] STEINBERG K,ZIMMERMANN J,STILLER K T,et al.Elevated nitrate levels affect the energy metabolism of pikeperch(Sander lucioperca)in RAS[J].Aquaculture,2018,497:405-413.
[4] ROBERTSON L A,KUENEN J G.Aerobic denitrification:a controversy revived[J].Archives of Microbiology,1984,139(4):351-354.
[5] 郑董兴,高雪晴,范玉婧,等.好氧反硝化菌Pseudomonas poae NL-4吸附-交联固定化及脱氮研究[J].水处理技术,2021,47(12):66-70.
ZHENG D X,GAO X Q,FAN Y J,et al.Study on the immobilization and nitrogen removal performance of aerobic denitrifying bacteria Pseudomonas poae NL-4 by adsorption and cross-linking[J].Technology of Water Treatment,2021,47(12):66-70.(in Chinese)
[6] 徐彬,杨苏文,昝逢宇,等.一株卓贝尔氏菌的分离鉴定及氨氧化特性的优化[J].水处理技术,2020,46(1):73-78,83.
XU B,YANG S W,ZAN F Y,et al.Isolation and identification of a strain of Zobellella sp.and optimization of ammonia oxidation characteristics[J].Technology of Water Treatment,2020,46(1):73-78,83.(in Chinese)
[7] KE X,LIU C,TANG S Q,et al.Characterization of Acinetobacter indicus ZJB20129 for heterotrophic nitrification and aerobic denitrification isolated from an urban sewage treatment plant[J].Bioresource Technology,2022,347:126423.
[8] 孙雪梅,李秋芬,张艳,等.一株海水异养硝化-好氧反硝化菌系统发育及脱氮特性[J].微生物学报,2012,52(6):687-695.
SUN X M,LI Q F,ZHANG Y,et al.Phylogenetic analysis and nitrogen removal characteristics of a heterotrophic nitrifying-aerobic denitrifying bacteria strain from marine environment[J].Acta Microbiologica Sinica,2012,52(6):687-695.(in Chinese)
[9] SONG T,ZHANG X L,LI J,et al.A review of research progress of heterotrophic nitrification and aerobic denitrification microorganisms(HNADMs)[J].The Science of the Total Environment,2021,801:149319.
[10] REN J L,MA H J,LIU Y,et al.Characterization of a novel marine aerobic denitrifier Vibrio spp.AD2 for efficient nitrate reduction without nitrite accumulation[J].Environmental Science and Pollution Research International,2021,28(24):30807-30820.
[11] LIU W F,WU Y T.Simultaneous nitrification,denitrification and electricity recovery of Halomonas strains in single chamber microbial fuel cells for seawater sewage treatment[J].Journal of Environmental Chemical Engineering,2021,9(6):106761.
[12] GUO Y,ZHOU X M,LI Y G,et al.Heterotrophic nitrification and aerobic denitrification by a novel Halomonas campisalis[J].Biotechnology Letters,2013,35(12):2045-2049.
[13] REN J L,WEI C Z,MA H J,et al.The nitrogen-removal efficiency of a novel high-efficiency salt-tolerant aerobic denitrifier,Halomonas alkaliphile HRL-9,isolated from a seawater biofilter[J].International Journal of Environmental Research and Public Health,2019,16(22):4451.
[14] HU J,YAN J B,WU L,et al.Simultaneous nitrification and denitrification of hypersaline wastewater by a robust bacterium Halomonas salifodinae from a repeated-batch acclimation[J].Bioresource Technology,2021,341:125818.
[15] ZHU L,DING W,FENG L J,et al.Isolation of aerobic denitrifiers and characterization for their potential application in the bioremediation of oligotrophic ecosystem[J].Bioresource Technology,2012,108:1-7.
[16] 杨静丹,祝铭韩,刘琳,等.异养硝化-好氧反硝化菌HY3-2的分离及脱氮特性[J].中国环境科学,2020,40(1):294-304.
YANG J D,ZHU M H,LIU L,et al.Isolation and denitrification characteristics of heterotrophic nitrification-aerobic denitrification bacterium HY3-2[J].China Environmental Science,2020,40(1):294-304.(in Chinese)
[17] WAN C L,YANG X,LEE D J,et al.Aerobic denitrification by novel isolated strain using ![]() as nitrogen source[J].Bioresource Technology,2011,102(15):7244-7248.
as nitrogen source[J].Bioresource Technology,2011,102(15):7244-7248.
[18] ZHAO B,CHENG D Y,TAN P,et al.Characterization of an aerobic denitrifier Pseudomonas stutzeri strain XL-2 to achieve efficient nitrate removal[J].Bioresource Technology,2018,250:564-573.
[19] 李雪,刘思彤,陈倩.一株好氧反硝化菌的鉴定及脱氮特性研究[J].北京大学学报(自然科学版),2018,54(6):1276-1282.
LI X,LIU S T,CHEN Q.Identification of an aerobic denitrifier and its denitrification characteristics[J].Acta Scientiarum Naturalium Universitatis Pekinensis,2018,54(6):1276-1282.(in Chinese)
[20] 盛韩微,曹相生.反硝化生物滤池亚硝酸盐积累特性的研究[J].工业安全与环保,2015,41(12):56-58.
SHENG H W,CAO X S.Research on nitrite accumulation in denitrification biofilter[J].Industrial Safety and Environmental Protection,2015,41(12):56-58.(in Chinese)
[21] 王田野,魏荷芬,胡子全,等.一株异养硝化好氧反硝化菌的筛选鉴定及其脱氮特性[J].环境科学学报,2017,37(3):945-953.
WANG T Y,WEI H F,HU Z Q,et al.Isolation and identification of a heterotrophic nitrifying and aerobic denitrifying strain and its denitrification characteristics[J].Acta Scientiae Circumstantiae,2017,37(3):945-953.(in Chinese)
[22] QIN W,LI W G,ZHANG D Y,et al.Ammonium removal of drinking water at low temperature by activated carbon filter biologically enhanced with heterotrophic nitrifying bacteria[J].Environmental Science and Pollution Research International,2016,23(5):4650-4659.
[23] 郭超,尹辉,范奎,等.一株好氧反硝化菌的分离鉴定及脱氮特性研究[J].安全与环境工程,2020,27(4):41-47.
GUO C,YIN H,FAN K,et al.Isolation,identification and nitrogen removal characteristics of aerobic denitrifying bacteria[J].Safety and Environmental Engineering,2020,27(4):41-47.(in Chinese)
[24] 朱云,龚望宝,谢骏,等.好氧反硝化细菌的鉴定及其脱氮特性研究[J].水生生物学报,2020,44(4):895-903.
ZHU Y,GONG W B,XIE J,et al.Identification and denitrification characteristics of the aerobic denitrifying bacteria Pseudomonas furukawaii zs1[J].Acta Hydrobiologica Sinica,2020,44(4):895-903.(in Chinese)
[25] 张进,叶坚,彭焕龙,等.1株耐受Cu2+好氧反硝化菌及其饥饿特性[J].环境科学与技术,2018,41(sup 2):43-50.
ZHANG J,YE J,PENG H L,et al.Cu2+ tolerance and hunger characteristics of an aerobic denitrifying bacterium[J].Environmental Science & Technology,2018,41(sup 2):43-50.(in Chinese)
[26] 苏兆鹏,李赟,潘鲁青,等.一株新型异养硝化-好氧反硝化菌GJWA3的脱氮性能及定量检测[J].中国海洋大学学报(自然科学版),2021,51(10):41-50.
SU Z P,LI Y,PAN L Q,et al.Nitrogen removal performance and quantification of a novel heterotrophic nitrification-aerobic denitrification bacterium Halomonas sp.GJWA3[J].Periodical of Ocean University of China(Natural Science Edition),2021,51(10):41-50.(in Chinese)