红鳍东方鲀Takifugu rubripes是广泛分布于中国、日本、韩国等沿海地区的重要海水养殖经济鱼类[1]。近年来,在红鳍东方鲀的养殖过程中常大规模暴发细菌性疾病[2],其中由哈维氏弧菌Vibrio harveyi引起的病害问题较为严重[3]。哈维氏弧菌是海水中常见的条件致病菌,可感染海水鱼类、甲壳类等生物,感染后病鱼表现为游动缓慢,停止摄食,体表不同程度溃烂,严重时导致死亡[4]。目前,红鳍东方鲀在感染哈维氏弧菌后尚无有效的药物进行治疗,因此,通过研究红鳍东方鲀自身免疫器官和免疫相关基因在抵御哈维氏弧菌感染过程中发挥的作用来寻找新的解决方法意义重大。
脾脏是鱼类重要的免疫器官之一,可参与适应性免疫应答过程,如产生含抗体的细胞及免疫球蛋白、参与抗原处理等[5]。鱼类白细胞介素(interleukin)是由鱼体白细胞或免疫细胞受抗原刺激后产生的一种细胞因子[6],研究发现,白细胞介素-6(IL-6)在红鳍东方鲀体内存在较为广泛,其在传递信息、激活或调节免疫细胞等方面发挥重要作用[7-8]。本研究团队前期的转录组高通量测序数据表明,红鳍东方鲀感染哈维氏弧菌后脾脏中IL-6基因表达水平存在显著性差异,结合差异基因功能富集等分析结果,将IL-6基因选为重点关注的候选基因之一(未发表数据)。
DNA甲基化是在不改变DNA遗传序列的基础上,仅对DNA进行修饰来调控基因表达的生化过程。甲基的加入通常发生在基因的启动子区域内,邻近鸟苷酸的胞嘧啶残基(CpG 位点)位置,成串的CpG位点称为CpG岛[9]。研究发现,许多疾病的发生发展与DNA甲基化调控相关[10]。如细菌感染后会引起宿主发生全基因组和关键免疫调控基因DNA甲基化状态改变[11-12]。因此,DNA甲基化的调控在动物抗病育种中发挥着重要作用[13-15]。目前,关于红鳍东方鲀感染哈维氏弧菌后其重要免疫调控基因的DNA甲基化变化情况尚无报道。本研究中,针对红鳍东方鲀感染哈维氏弧菌后脾脏中IL-6基因DNA甲基化状态的改变展开研究,以期为红鳍东方鲀哈维氏弧菌病的发病机理研究提供参考,也为红鳍东方鲀抗病育种工作提供新思路。
1 材料与方法
1.1 材料
试验用红鳍东方鲀购自大连天正实业有限公司,体质量为(100.5±10.8)g,在水温18~20 ℃条件下暂养一周。哈维氏弧菌为大连市海珍品疾病防控重点实验室细菌库保存的菌株。
1.2 方法
1.2.1 哈维氏弧菌菌液的制备 将活化后的哈维氏弧菌接种在胰蛋白胨大豆琼脂培养基(TSA)上,于28 ℃培养12 h,挑取菌落接种于200 mL胰酪大豆胨液体培养液(TSB)中,放入转速为180 r/min、28 ℃的摇床中培养4~6 h。然后在-4 ℃下以3 000 r/min离心10 min,弃上清,用生理盐水稀释沉淀,采用平板计数法制备成1×107 cfu/mL菌液待用。
1.2.2 试验设计与样品采集 试验分为对照组和浸泡感染组,每组各30尾红鳍东方鲀。浸泡菌液浓度为107 cfu/mL,感染组鱼在菌液中浸泡12 h后转移到无致病性病原的干净海水中继续饲养7 d,而对照组鱼整个试验期间均在无致病性病原的干净海水中饲养。试验期间各组饲养条件不变,每隔2 d换水1/3,保持饲养水质优良。
于试验第7天时进行样品采集。用麻醉剂三卡因甲基磺酸盐(MS222 200 mg/L,Sigma)对鱼进行麻醉,观察记录红鳍东方鲀外观及内脏器官变化情况,采集脾脏分别进行多聚甲醛固定和液氮冷冻保存,以用于后续制作石蜡切片和相关分子试验。
根据攻毒后红鳍东方鲀在游动状态、活力表现和脾脏病变情况等方面表现出的差异,将攻毒后的红鳍东方鲀划分为发病组和未发病组,其中发病组表现为游动缓慢或漂游、触碰反应慢、活力差、脾脏坏死,未发病组各方面表现出与对照组相似状态,游动情况正常、触碰反应快、活力好、脾脏无坏死。
1.2.3 石蜡切片的制作 采用常规石蜡切片法开展脾脏组织学研究。取出固定好的脾脏,经梯度乙醇(70%~100%,均为体积分数)脱水,二甲苯透明,石蜡包埋,制成石蜡切片(厚5 μm),经H.E染色后在显微镜(LEICA DM 4000B LED)下观察并拍照。
1.2.4 实时荧光定量PCR(qPCR) 以β-actin为内参基因、IL-6为目的基因,利用Prmier 5.0设计引物(表1)。引物由生工生物工程(上海)股份有限公司合成,qPCR试验按照莫纳生物技术有限公司的Mon AmpTM Chemo HS qPCR Mix(High Rox)试剂盒说明书进行操作[16]。PCR反应体系(20 μL):10~20 ng/μL cDNA模板1 μL,0.2 μmol/L上、下游引物各0.5 μL,Mon AmpTM Chemo HS qPCR Mix(High Rox)10 μL,去离子水8 μL。PCR反应程序:95 ℃下预变性5 min;95 ℃下变性10 s,60 ℃退火10 s,72 ℃下延伸30 s,共进行40个循环。溶解曲线分析:95 ℃反应15 s,60 ℃反应1 min,95 ℃反应15 s。每组样品设置4个生物学重复。采用 2-ΔΔCt法计算基因相对表达量。
表1 实时荧光定量PCR引物序列
Tab.1 Sequence of primers for Real-time PCR

基因gene引物序列primer sequenceIL-6F: 5′GGAAAACAAGGTGAGGGA 3′R: 5′GGTGGTAGAAGGTGACGG 3′β-actinF: 5′ATCCGTAAGGACCTGTATGC 3′R: 5′AGTATTTACGCTCAGGTGGG 3′
1.2.5 DNA甲基化检测 采用北京全式金生物公司EasyPure® Marine Animal Genomic DNA Kit说明书提取基因组DNA,提取后的DNA送生工生物工程(上海)股份有限公司,利用亚硫酸氢盐测序法(Bisulfite sequencing PCR,BSP)检测启动子区域DNA甲基化情况。基因组DNA按照EZ DNA Methylation-Gold试剂盒说明书进行亚硫酸氢盐转化后,利用UCSC网站(https://genome.ucsc.edu/)查找IL-6基因启动子区域,利用Meth Primer在线软件(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)预测启动子区域CpG岛并设计IL-6基因的BSP引物(F: 5′CAAATACCAATCTACACTAATCTAATCT 3′;R: 5′ACTAACCTTTAAAATAACTATTACAACAC 3′)。后续进行PCR反应,反应体系(50 μL):20~50 ng/μL DNA模板2 μL,10 μmol/L上、下游引物各2 μL,10 μmol/L dNTP(mix)3 μL,10×Taq Buffer(with MgCl2)5 μL,5 U/μL Taq酶0.5 μL,去离子水35.5 μL。PCR反应程序:95 ℃下预变性5 min;94 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸50 s,共进行35个循环;最后在72 ℃下修复延伸8 min。对PCR产物进行克隆测序检测CpG位点甲基化情况,每组样品进行10个克隆。
1.3 数据处理
试验数据均以平均值±标准误(mean±S.E.)表示,用SPSS Statistics 24.0软件对目的基因的相对表达量和DNA甲基化率进行单因素方差分析(one-way ANOVA),用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 组织病理变化
红鳍东方鲀脾脏组织切片如图1所示,相较于对照组(图1A),发病组出现大量的坏死病灶,表现为细胞之间空隙增大(图1B),未发病组无明显病变(图1C)。
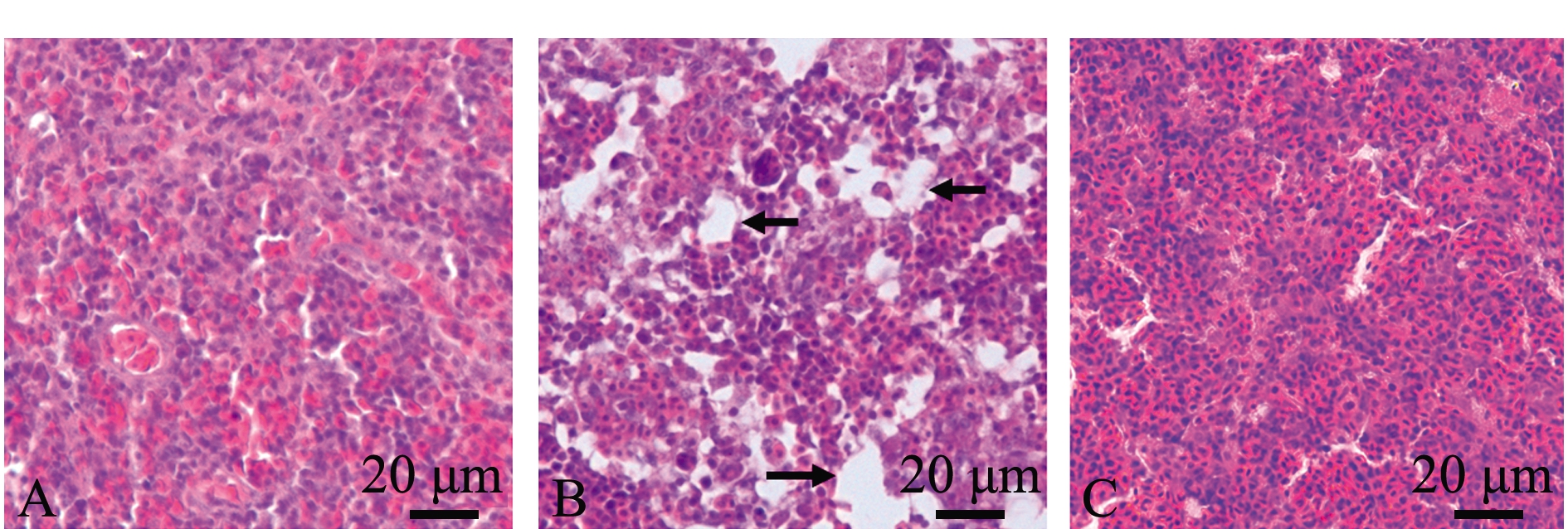
A—对照组;B—发病组;C—未发病组;箭头示坏死区域。
A—control group; B—diseased group; C—non-diseased group; Necrotic areas are indicated by the arrows.
图1 红鳍东方鲀脾脏组织病理变化
Fig.1 Pathological changes of spleen in tiger puffer Takifugu rubripes
2.2 IL-6基因相对表达量变化
IL-6 mRNA相对表达量变化如图2所示,发病组IL-6表达量均显著高于对照组和未发病组(P<0.05),未发病组与对照组相比无显著性差异(P>0.05)。
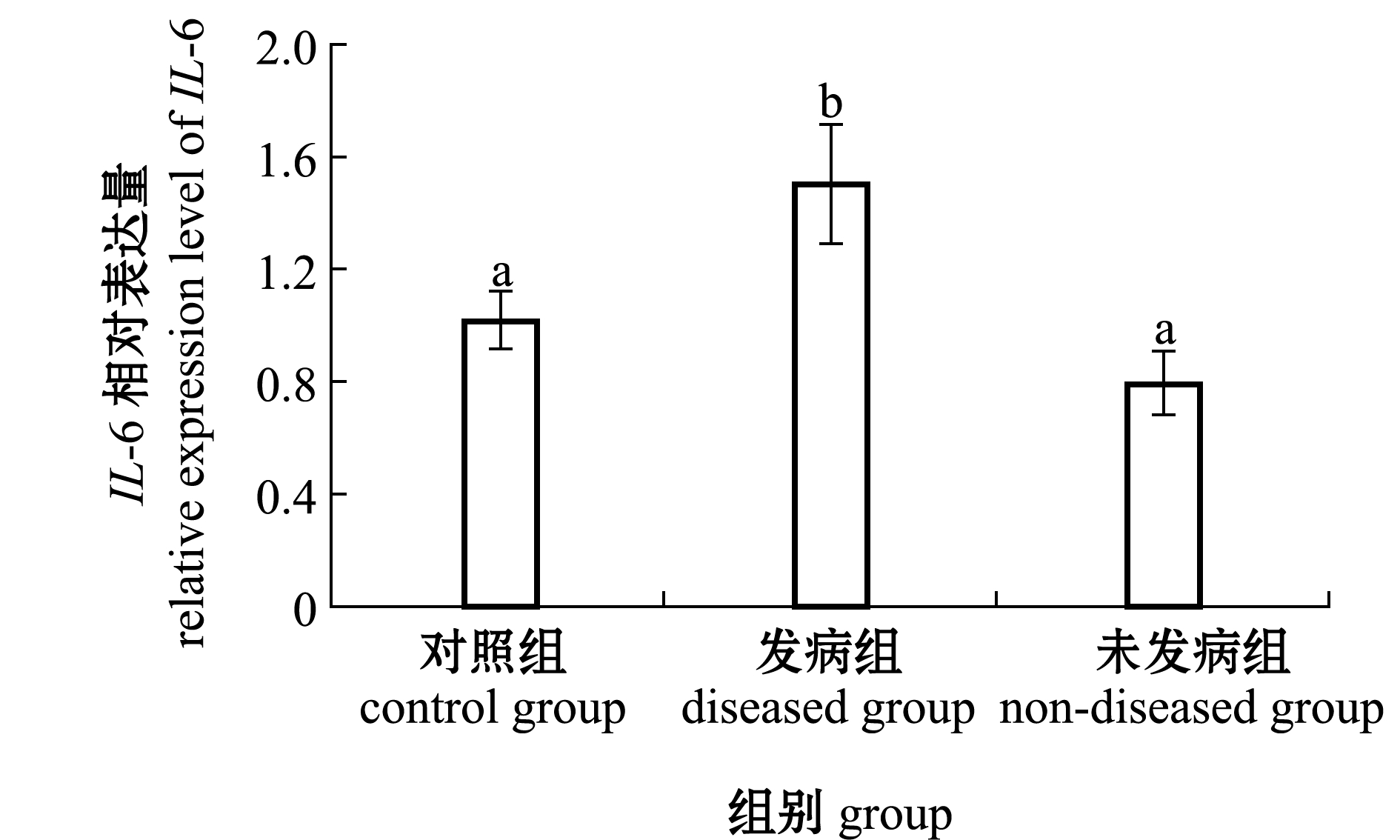
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significant differences in the groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.
图2 哈维氏弧菌感染对红鳍东方鲀脾脏中IL-6 mRNA表达的影响
Fig.2 Effect of Vibrio harveyi infection on the expression of IL-6 in tiger puffer Takifugu rubripes spleen
2.3 IL-6基因启动子区域DNA甲基化变化
因发病组IL-6 mRNA相对表达量显著高于对照组和未发病组,而未发病组与对照组相比无明显差异,故进一步检测IL-6基因启动子区域的DNA甲基化情况,探索其表达量差异是否与启动子区域DNA甲基化水平变化有关。甲基化检测结果显示,在IL-6基因启动子(转录起始位点上游2 000 bp)区域1 815~1 941 bp的位置有一个127 bp 的CpG岛(GC含量>40.0%, Obs/Exp>0.6)(图3(a))。引物扩增区域(1 715~1 948 bp)序列中共有12个CpG位点(图3(b))。
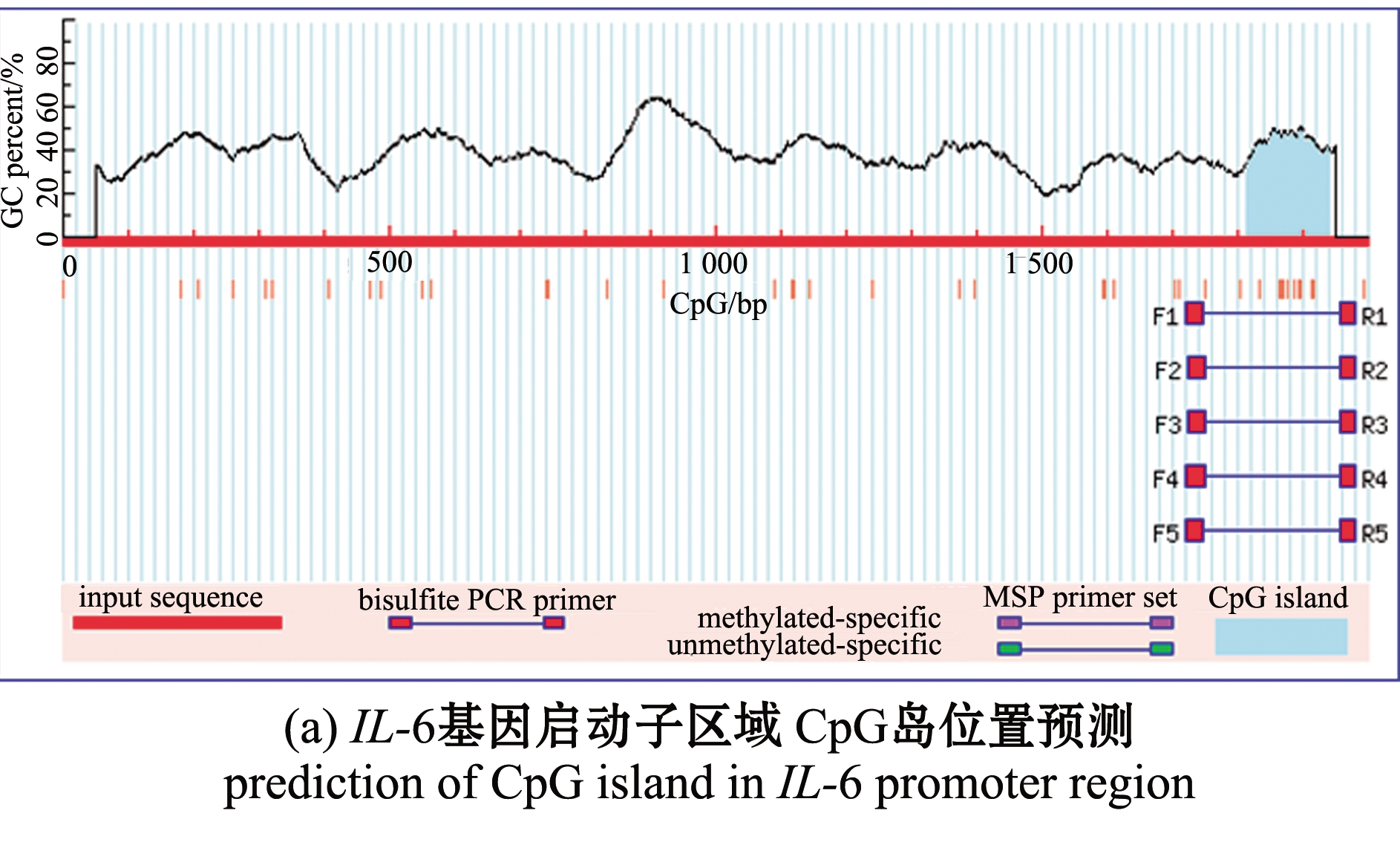
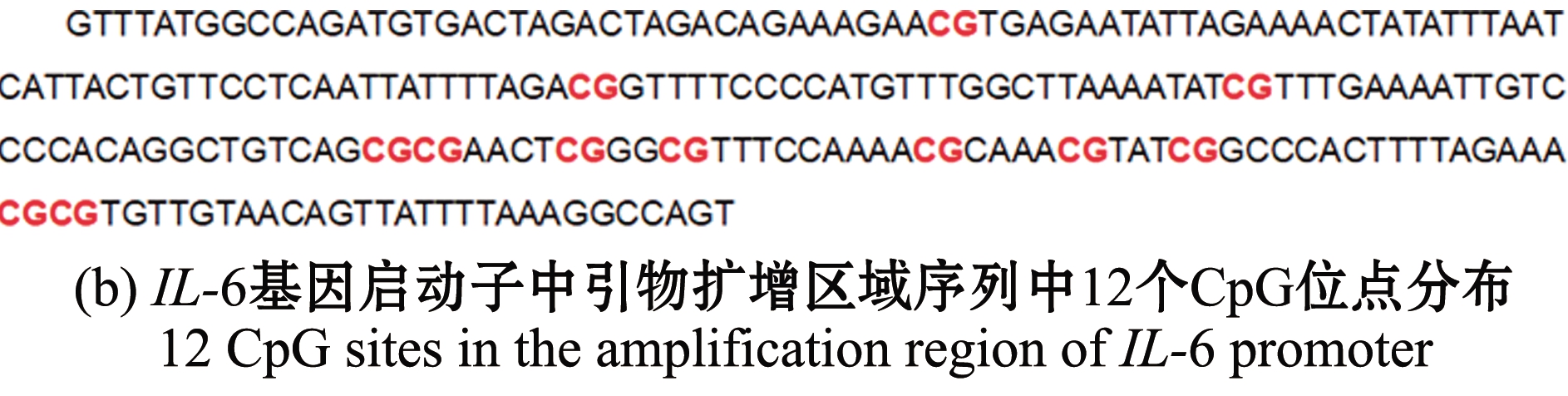
图3 IL-6基因启动子区域CpG岛和引物扩增序列
Fig.3 CpG island and the sequence in the amplification region of IL-6 promoter region
未发病组IL-6基因启动子区域的DNA甲基化水平与对照组相比无明显差异(P>0.05),但显著高于发病组(P<0.05)(图4(a)),具体甲基化位点改变如图4(b)~(d)所示。
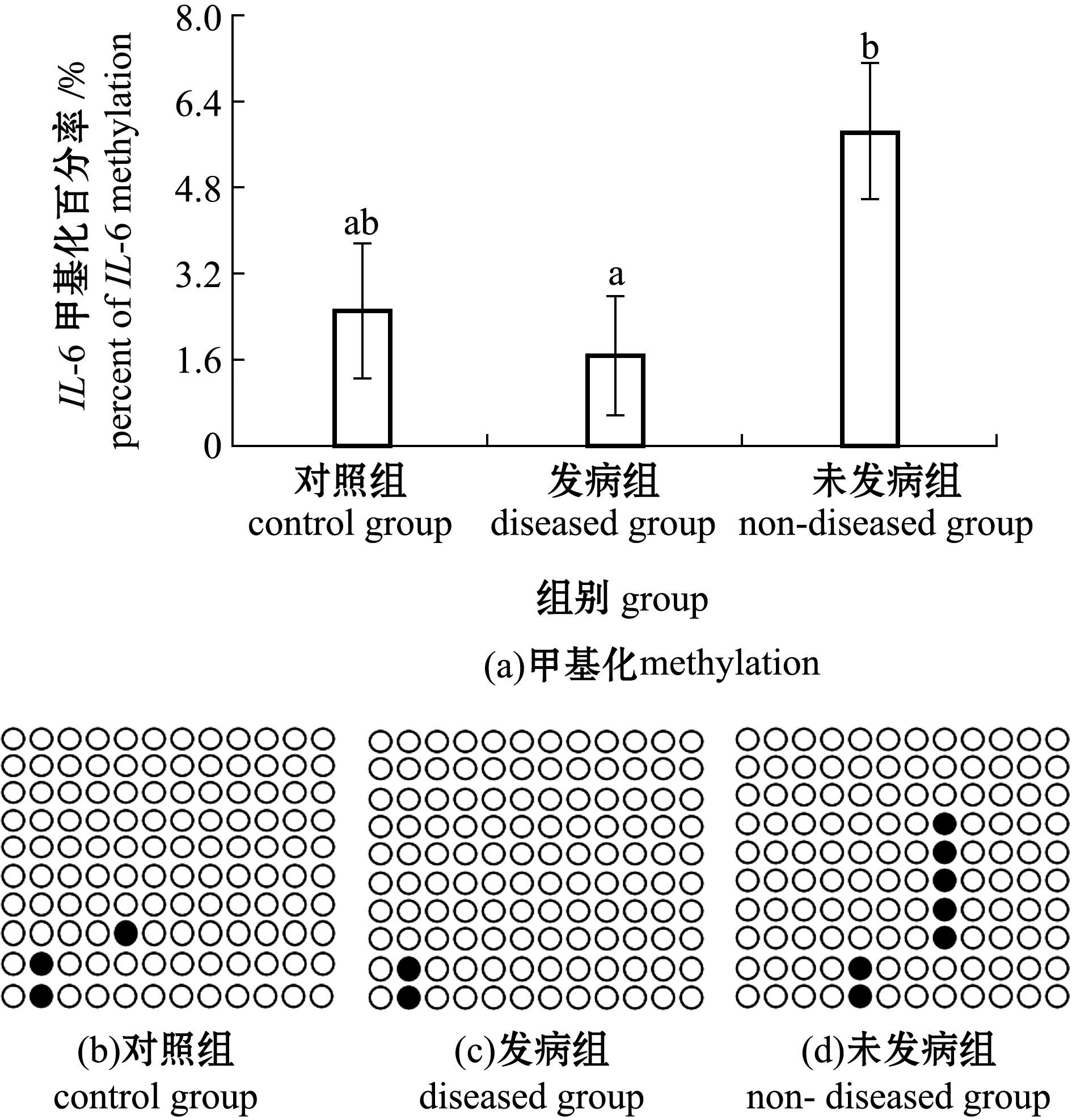
●代表CpG位点发生甲基化,○代表CpG位点未发生甲基化。
● represents methylated CpG sites,and○ represents unmethylated CpG sites.
图4 哈维氏弧菌感染对红鳍东方鲀脾脏中IL-6基因DNA甲基化的影响
Fig.4 Effect of Vibrio harveyi infection on IL-6 methylation in tiger puffer Takifugu rubripes spleen
3 讨论
3.1 感染弧菌后鱼体脾脏的组织病理变化
本研究中红鳍东方鲀感染哈维氏弧菌后,发病组脾脏出现严重的坏死现象,未发病组则无明显损伤。从病理切片上看,未发病组与对照组细胞颜色有所差异,这主要是由于染色的批次时间不同造成的;与对照组相比,未发病组细胞排列紧密、完整,无组织间隙增大的坏死现象,故认为未发病组的脾脏没有受到破坏。细菌感染鱼类通常会导致其脾脏坏死[17-18],蒋自立等[18]研究发现,嗜水气单胞菌Aeromonas hydrophila感染黄颡鱼Pelteobagrus fulvidraco后,其脾脏中也出现组织坏死现象,这与本研究结果类似。鱼类脾脏是红细胞及各种粒细胞产生、储存和成熟的场所,既是重要的免疫器官,也是重要的造血系统[5,19]。徐晓津等[17]研究发现,大黄鱼Larimichthys crocea感染哈维氏弧菌后,其脾脏实质细胞遭到破坏,造血功能衰竭,而造血功能受到影响会加剧鱼体自身免疫力和抗病能力的下降,进而加速鱼体死亡[19]。此外,脾脏组织坏死也可能影响淋巴细胞的成熟和分化,从而影响机体细胞和体液免疫过程,进而对鱼体的整个免疫功能造成影响[20]。本研究中,被哈维氏弧菌感染的红鳍东方鲀个体由于自身免疫能力的不同,导致有的个体脾脏出现坏死,而有的个体无明显损伤。
3.2 感染弧菌后鱼体脾脏IL-6 mRNA相对表达量的变化
IL-6因子主要作用于多种淋巴细胞、巨噬细胞及其他细胞,参与调控机体的免疫反应[21]。本研究表明,当哈维氏弧菌感染鱼体后,可刺激发病组鱼体内IL-6基因的高表达,原因是,在正常机体内IL-6基因相对表达量很低,但当机体受到外源因子刺激后可在短时间内大量表达IL-6基因[22]。同时,IL-6作为一种炎症因子,参与并调节炎症反应过程。研究表明,在哺乳动物和鱼类中IL-6表达量升高能够上调一些促炎症细胞因子(如白细胞介素1β、肿瘤坏死因子α)的表达,进而增强炎症反应[23-24],严重的炎症反应则可导致组织出现坏死的病理变化[25]。本研究中哈维氏弧菌感染后,发病组脾脏出现大量坏死病灶,由此推测,这可能与IL-6基因表达量升高进而促进脾脏中的炎症反应有关。
3.3 DNA甲基化对IL-6 mRNA表达的影响
DNA甲基化的改变在鱼类自身的抗病过程中发挥着直接或间接的作用[13-14]。草鱼Ctenopharyngodon idella抗病毒基因维甲酸诱导基因Ⅰ在出血病抗病个体和易感个体间DNA甲基化水平具有显著性差异[14]。在家禽中也有类似研究,在鸡禽流感感染组和未感染组的脾脏中全基因组甲基化率具有显著差异[15]。DNA甲基化是一种常见的表观遗传学修饰,对于正常基因的表达调控是必需的,与基因表达异常、DNA损伤修复、基因组不稳定性和遗传性状的改变密切相关;甲基的加入特别是发生在启动子区域,会抑制基因的表达,相反,甲基的移除则可能激活和加强基因的表达[26-27]。受苯并芘暴露的影响,斑马鱼Danio rerio脑中锌指结构c4h2基因(zc4h2)的DNA甲基化水平降低,并诱导zc4h2 mRNA高表达[28]。本研究中,未发病组IL-6基因启动子区域DNA甲基化水平显著高于发病组,而相对应的未发病组IL-6 mRNA表达则显著低于发病组。
目前,关于鱼类的DNA甲基化研究已广泛开展,但主要集中在生态毒理和遗传育种等方面[29-30],关于DNA甲基化与经济鱼类疾病相关的研究报道较少。本研究中,从表观遗传水平初步揭示哈维氏弧菌感染后发病组和未发病组脾脏中IL-6基因相对表达量的差异可能与其启动子区域差异DNA甲基化相关,这为今后红鳍东方鲀抗病育种工作提供了新思路。
4 结论
1)红鳍东方鲀个体对哈维氏弧菌感染表现出不同的抗病能力,发病组脾脏出现大量坏死灶,而未发病组脾脏未出现坏死现象。
2)抗病能力不同的红鳍东方鲀IL-6 mRNA表达及启动子区域DNA甲基化水平存在明显差异,未发病组IL-6基因DNA甲基化水平显著高于发病组,而mRNA表达则显著低于发病组。本试验结果为探讨红鳍东方鲀哈维氏弧菌病的发病机制以及分子水平抗病育种提供了新思路。
[1] 苟盼盼,王秀利,窦冬雨,等.红鳍东方鲀不同家系群体的形态性状差异与相关性分析[J].大连海洋大学学报,2019,34(5):674-679.
GOU P P,WANG X L,DOU D Y,et al.Analysis of morphological differences and correlation in three families of tiger puffer Takifugu rubripes[J].Journal of Dalian Ocean University,2019,34(5):674-679.(in Chinese)
[2] 张涛,徐思祺,宋颖.红鳍东方鲀的病害防治简述[J].科学养鱼,2017(6):65-67.
ZHANG T,XU S Q,SONG Y.Disease control of Takifugu rubripes[J].Scientific Fish Farming,2017(6):65-67.(in Chinese)
[3] 王力,张吉鹏,刘美如,等.红鳍东方鲀源哈维弧菌毒力基因检测及分型研究[J].现代农业科技,2018(2):237-239,242.
WANG L,ZHANG J P,LIU M R,et al.Virulence genes detection and BOX-PCR identification of Vibrio harveyi strains isolated from Takifugu rubripes[J].Modern Agricultural Science and Technology,2018(2):237-239,242.(in Chinese)
[4] 王斌,于兰萍,胡亮,等.红鳍东方鲀皮肤溃烂病病原菌的分离与鉴定[J].中国水产科学,2008,15(2):352-358.
WANG B,YU L P,HU L,et al.Isolation and identification of bacteriosis pathogen from cultured Fugu obscurus with canker of skin[J].Journal of Fishery Sciences of China,2008,15(2):352-358.(in Chinese)
[5] 罗智文,董志祥,林连兵,等.鱼类重要免疫器官抗菌机制的研究进展[J].水产科学,2021,40(4):624-634.
LUO Z W,DONG Z X,LIN L B,et al.Advance on immunological mechanisms of important immune organs against pathogenic microorganisms in fish: a review[J].Fisheries Science,2021,40(4):624-634.(in Chinese)
[6] 丰培金.鱼类的白细胞介素研究进展[J].安徽农业科学,2006,34(17):4317-4318,4320.
FENG P J.Recent research progress in the interleukin in fish[J].Journal of Anhui Agricultural Sciences,2006,34(17):4317-4318,4320.(in Chinese)
[7] 高珊,余涛,周景祥,等.鱼类白介素及其受体的研究[J].水产学杂志,2014,27(3):62-64.
GAO S,YU T,ZHOU J X,et al.A review of interleukin and receptors in fish[J].Chinese Journal of Fisheries,2014,27(3):62-64.(in Chinese)
[8] 黄浦江.红笛鲷IL-6基因的克隆及其对哈氏弧菌OmpW DNA疫苗佐剂效应的初步研究[D].湛江:广东海洋大学,2013.
HUANG P J.Molecular cloning of red snapper IL-6 and preliminary study on its adjuvants immunocity on Vibrio harveyi Ompw DNA vaccine[D].Zhanjiang:Guangdong Ocean University,2013.(in Chinese)
[9] OOI S K T,O’DONNELL A H,BESTOR T H.Mammalian cytosine methylation at a glance[J].Journal of Cell Science,2009,122(16):2787-2791.
[10] ROBERTSON K D.DNA methylation and human disease[J].Nature Reviews Genetics,2005,6(8):597-610.
[11] BOBETSIS Y A,BARROS S P,LIN D M,et al.Bacterial infection promotes DNA hypermethylation[J].Journal of Dental Research,2007,86(2):169-174.
[12] PACIS A,TAILLEUX L,MORIN A M,et al.Bacterial infection remodels the DNA methylation landscape of human dendritic cells[J].Genome Research,2015,25(12):1801-1811.
[13] 李立森.草鱼嗜水气单胞菌感染免疫指标变化及基因组DNA甲基化研究[D].上海:上海海洋大学,2017.
LI L S.The changes of immune performance in Aeromonas hydrophila infection and genome-wide methylation analysis of Ctenopharyngodon idella[D].Shanghai:Shanghai Ocean University,2017.(in Chinese)
[14] 尚雪莹.草鱼RLRs家族基因的甲基化状态与草鱼出血病的关联研究[D].杨凌:西北农林科技大学,2016.
SHANG X Y.Correlation studies between methylation of RLRS and resistance/susceptibility to GCRV in grass carp(Ctenopharyngodon idella)[D].Yangling:Northwest A & F University,2016.(in Chinese)
[15] 孟纪伦.H5N1禽流感病毒感染与非感染鸡和鸭不同免疫器官DNA甲基化差异分析[D].长春:吉林大学,2013.
MENG J L.Differential analysis of DNA methylation level between SPF chicken/duck and the chicken/duck infected by H5N1 among different immune organs[D].Changchun: Jilin University,2013.(in Chinese)
[16] 华昕彤,刘鹰,陈冰,等.红鳍东方鲀感染哈氏弧菌前后组织中socs3基因的表达差异分析[J].大连海洋大学学报,2019,34(1):33-40.
HUA X T,LIU Y,CHEN B,et al.Expression of the socs3 gene in tissues of redfin puffer Takifugu rubripes pre-and post challenged with Vibrio harveyi[J].Journal of Dalian Ocean University,2019,34(1):33-40.(in Chinese)
[17] 徐晓津,徐斌,王军,等.哈维氏弧菌人工感染大黄鱼的组织病理学研究[J].厦门大学学报(自然科学版),2009,48(2):281-286.
XU X J,XU B,WANG J,et al.Histopathological studies on Pseudosciaena crocea artificially challenged with Vibrio harveyi[J].Journal of Xiamen University(Natural Science Edition),2009,48(2):281-286.(in Chinese)
[18] 蒋自立,李春涛,张其中,等.黄颡鱼败血症病原菌的分离鉴定与病理组织学观察[J].西南师范大学学报(自然科学版),2012,37(6):77-82.
JIANG Z L,LI C T,ZHANG Q Z,et al.Identification of pathogenic bacteria for septicemia in yellow catfish(Pelteobagrus fulvidraco Richardson)and their histological observation[J].Journal of Southwest China Normal University(Natural Science Edition),2012,37(6):77-82.(in Chinese)
[19] 赵静,王利.感染小肠结肠炎耶尔森菌的黄颡鱼脾脏和肾脏组织病理学观察[J].动物医学进展,2015,36(2):62-64.
ZHAO J,WANG L.Observation of histopathological lesions in spleen and kidney of Pelteobagrus fulvidraco infected with Yersinia enteroclitica[J].Progress in Veterinary Medicine,2015,36(2):62-64.(in Chinese)
[20] 覃江凤,周颖,何丽,等.微囊藻毒素对鱼类免疫毒性的研究进展[J].环境与健康杂志,2019,36(1):68-71.
QIN J F,ZHOU Y,HE L,et al.Microcystins induced immunotoxicity in fish:a review of recent studies[J].Journal of Environment and Health,2019,36(1):68-71.(in Chinese)
[21] 扶晓琴.团头鲂白细胞介素6的表达分析及启动子活性的研究[D].武汉:华中农业大学,2015.
FU X Q.Expression and promoter activity analysis of interleukin 6 gene in blunt snout bream(Megalobrama amblycephala)[D].Wuhan:Huazhong Agricultural University,2015.(in Chinese)
[22] 孙鹤,臧林,王秀利.鱼类部分白介素研究进展[J].河北渔业,2017(5):57-60.
SUN H,ZANG L,WANG X L.Advances in studies of partial interleukin in fish[J].Hebei Fisheries,2017(5):57-60.(in Chinese)
[23] 郭亚飞.草鱼白介素6及其受体的功能鉴定[D].成都:电子科技大学,2017.
GUO Y F.Functional identification of interleukin-6 and its receptor in grass carp(Ctenopharyngodon idella)[D].Chengdu:University of Electronic Science and Technology of China,2017.(in Chinese)
[24] 廖前进.LPLUNC1抑制NF-κB和Stat3信号通路的激活抵抗促炎因子IL-6促进的鼻咽癌发生发展[D].长沙:中南大学,2012.
LIAO Q J.LPLUNC1 suppress the initiation and progression of NPC induced by proinflammatory cytokine IL-6 via inhibiting the activation of NF-κB and Stat3 pathways[D].Changsha:Central South University,2012.(in Chinese)
[25] 叶仕根,高东旭,倪萍.水生动物病理学实验[M].杨凌:西北农林科技大学出版社,2018:12-13.
YE S G,GAO D X,NI P.Aquatic animal pathology experiment[M].Yangling:Northwest A & F University Press,2018:12-13.(in Chinese)
[26] DEMURA M,BULUN S E.CpG dinucleotide methylation of the CYP19 I.3/II promoter modulates cAMP-stimulated aromatase activity[J].Molecular and Cellular Endocrinology,2008,283(1/2):127-132.
[27] SYED A,HEW K,KOHLI A,et al.Air pollution and epigenetics[J].Journal of Environmental Protection,2013,4(8A):114-122.
[28] GAO D X,WANG C G,XI Z H,et al.Early-life benzo[a]pyrene exposure causes neurodegenerative syndromes in adult zebrafish(Danio rerio)and the mechanism involved[J].Toxicological Sciences,2017,157(1):74-84.
[29] 王昊泽,王秀利.DNA甲基化及其在水产养殖动物中的应用研究进展[J].河北渔业,2017(8):48-53.
WANG H Z,WANG X L.Research progress of methylation and its application in aquaculture animals[J].Hebei Fisheries,2017(8):48-53.(in Chinese)