核因子E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)属于CNC亮氨酸拉链转录激活因子(CNC-basic leucine zipper, CNC-bZIP)家族,Nrf2受Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)的调控,并调节其下游的靶基因表达,参与机体氧化应激、炎症反应、神经性疾病、肿瘤及线粒体功能等免疫调节反应[1-3]。近年来,研究人员已鉴定出200多个Nrf2靶基因[4]。在水产动物中,敲除Nrf2基因的斑马鱼Danio rerio细胞对金属或其他氧化源表现出更高的敏感度[5];注射Nrf2激动剂叔丁基对苯二酚可明显干扰长牡蛎Crassostrea gigas和洛氏鱥Rhynchocypris lagowskii的抗氧化能力[6-7];重金属和PAHs混合暴露会引起厚壳贻贝Mytilus coruscus Nrf2表达水平显著升高[8]。此外,氨基酸营养代谢会影响Nrf2-Keap1信号通路,例如,饲料中缺乏色氨酸、烟酸、胆碱、泛酸和叶酸等营养物质,会导致草鱼Ctenopharyngodon idella Nrf2的表达下降,而饲料中适宜的精氨酸水平可使团头鲂Megalobrama amblycephala幼鱼肠道Nrf2基因表达水平上调,且Mn-SOD、GPx等抗氧化酶基因的相对表达水平与Nrf2基因相对表达水平呈正相关[9-10]。由此可见,Nrf2基因参与了动物体的营养代谢和免疫调节等生理活动[11]。
马氏珠母贝Pinctada fucata martensii是中国重要的经济贝类,同时也是培育海水珍珠的重要贝种[12-13]。近年来,气候变化、环境污染等问题给珍珠养殖业带来较大冲击[14]。因此,深入了解马氏珠母贝的免疫调节机制对贝类健康养殖具有重要理论与实践意义。鉴于Nrf2基因在免疫应激与营养免疫调节中的重要作用,本研究中通过克隆获得马氏珠母贝Nrf2基因完整的CDS序列,分析其序列特征,利用荧光定量PCR检测该基因在不同组织、不同免疫刺激和营养条件下的表达水平,以期为深入研究其作用机理提供基础资料。
1 材料与方法
1.1 材料
试验贝均取自广东省徐闻县大井村海区,选取同批规格一致、健康的2龄马氏珠母贝个体(壳长62.73 mm±6.46 mm)作为全组织qPCR的材料。随机选取10只马氏珠母贝,解剖并剪取肠道、足、外套膜、闭壳肌、鳃、肝胰腺和性腺组织,经液氮速冻后于-80 ℃下保存备用。
1.2 方法
1.2.1 总RNA提取及cDNA 的合成 使用Trizol 法分别提取肠道、足、性腺、外套膜、鳃、闭壳肌和肝胰腺的总RNA,先利用10 g/L琼脂糖凝胶电泳方法验证其完整性和污染情况,运用核酸分析仪测定总RNA的浓度和纯度,用于制备Real-time Quantitaty PCR(qRT-PCR)分析所需要的cDNA,制备方法参考Revert Aid Premium Reverse Transcriptase合成试剂盒操作指南。根据本课题组转录组数据库中获得的Nrf2基因序列,利用Primer Premier 5.0 软件设计特异性引物,用于基因CDS片段的扩增和qRT-PCR(表1)。
表1 试验用引物序列
Tab.1 Sequences of the primers used in the test

引物primer序列(5′-3′)sequence (5′-3′)Nrf2-F1ATCATCCTTGGACAAACTGCCNrf2-R1CTGGAGATAGCATTGTCAGGTTCNrf2-F2CCATTCACCAGTCTCTCCATCCNrf2-R2ATGGAGAGACTGGTGAATGGGβ-actin-FCGGTACCACCATGTTCTCAGβ-actin-RGACCGGATTCATCGTATTCCNrf2-qRT-FCTGGAGATAGCATTGTCAGGTTCNrf2-qRT-RTAACTGGAGGTAACGATAATGCG
1.2.2 马氏珠母贝Nrf2基因CDS片段克隆 利用已设计出的特异性引物对马氏珠母贝Nrf2基因进行PCR扩增,使用10 g/L琼脂糖电泳检测PCR产物,并连接到PMD19-T vector上,再转化到大肠杆菌Escherichia coli DH5α感受态细胞(北京全式金生物技术有限公司),对阳性克隆菌落进行PCR检测,委托生工生物(上海)股份有限公司进行测序。
1.2.3 马氏珠母贝Nrf2基因的序列分析 采用DNAMAN 7.0拼接克隆所获片段,采用NCBI-ORF Finder在线预测Nrf2基因的开放阅读框并翻译出相应氨基酸序列;采用Signal P 4.1预测Nrf2氨基酸序列的信号肽,采用ExPASy-ProtScale分析蛋白的理化性质,采用ExPASy-ProtParam在线分析蛋白的疏水性;采用SMART软件分析蛋白的结构域,采用TMHMM Server 2.0预测氨基酸序列的跨膜结构域;采用SOPMA预测蛋白的二级结构,采用SWISS-MODEL分别预测马氏珠母贝和长牡蛎的Nrf2蛋白的三维结构;通过BLASTX在线同源性搜索比对查找多个物种的Nrf2氨基酸序列,采用DNAMAN 8.0 和Clustal W(http://www.genome.jp/tools/clustalw/)进行同源比对分析;采用MEGA 7.0软件构建系统进化树,自展法(bootstrap)重复检验设置1 000次。
1.2.4 Nrf2基因的组织表达分布 采用qRT-PCR 方法检测Nrf2在贝体肠道、足、性腺、外套膜、鳃、闭壳肌和肝胰腺中的表达,每个样品设置3个重复。反应体系参照北京全式金生物有限公司SYBR® Select Master Mix说明书。采用2-ΔΔCt法计算该基因的相对表达量。
1.2.5 脂多糖(LPS)、肽聚糖(PGN)和聚肌胞苷酸(Poly I:C)刺激后马氏珠母贝鳃中Nrf2的表达变化 挑选200只健康的马氏珠母贝随机分为4组,每组50只贝,其中对照组每只贝注射100 μL 10 μg/mL的磷酸盐缓冲溶液(PBS),另外3组为试验组,每只贝分别注射100 μL 10 μg/mL LPS、PGN、Poly I:C进行刺激。注射后分别于0、6、12、24、48 h随机从各组中取10只贝的鳃组织进行qRT-PCR检测,并计算Nrf2的相对表达量。
1.2.6 5种不同蛋白源饲料投喂后马氏珠母贝鳃中Nrf2的表达变化 分别以小球藻粉、螺旋藻粉、酵母粉、豆粕和玉米蛋白粉为主要蛋白源配制的等氮等脂的5种配合饲料进行喂养试验,其中,饲料的粗蛋白质和粗脂肪含量分别为35%和10%,饲料配方信息详见文献[15]。选取50只体质量为(2.87±0.23)g的马氏珠母贝随机分配到5个试验组,在试验桶中暂养7 d后进行正式养殖试验,水体溶解氧基本保持在5.0 mg/L,水温为20.5~22.5 ℃,盐度为30。试验期间每天换水一次,每6 h投喂一次,每次投喂量为3 g,投喂45 d后,对马氏珠母贝的鳃组织进行取样。以β-actin作为内参基因(表1),使用qRT-PCR方法检测各试验组马氏珠母贝鳃组织中Nrf2基因的表达量,并计算Nrf2的相对表达量。
1.3 数据分析
采用SPSS 19.0 软件对基因相对表达量进行单因素方差分析,用Duncan法进行组间比较,显著性水平设为0.05。
2 结果与分析
2.1 马氏珠母贝Nrf2基因的克隆与序列分析
以马氏珠母贝肝胰腺总RNA为模板,克隆获得Nrf2基因的开放阅读框长度为2 652 bp,编码883个氨基酸(图1);BLASTX比对显示,马氏珠母贝Nrf2氨基酸序列与长牡蛎、虾夷扇贝Patinopecten yessoensis和栉孔扇贝Chlamys farreri等的Nrf2氨基酸序列具有较高同源性(表2)。
表2 马氏珠母贝与其他物种Nrf2氨基酸序列的同源性对比
Tab.2 Homology alignment of Nrf2 amino acid sequence in pearl oyster Pinctada fucata martensii and other species

物种speciesGenBank登录号GenBank ID一致性/%idensify 长牡蛎Crassostrea gigasXP_019920052.148.70虾夷扇贝Patinopecten yessoensisXP_021348784.146.07栉孔扇贝Chlamys farreriAWV55266.140.49褶皱冠蚌Cristaria plicataAZM32563.139.75家牛 Bos taurusBAD81030.125.86鸡 Gallus gallusNP_990448.125.26非洲爪蟾Xenopus tropicalisNP_001007490.125.13斑马鱼 Danio rerioBAC10573.124.40黑头呆鱼Pimephales promelasAWC67580.123.77花鲈Lateolabrax japonicusAMS75114.122.68乌龟 Mauremys reevesiiAFX95917.122.37穴兔Oryctolagus cuniculusQEV88422.122.39冠海豹Cystophora cristataAEC11097.121.78草鱼Ctenopharyngodon idellaART92576.121.75大西洋鲑 Salmo salarACN10720.121.17

灰色阴影表示BRLZ结构域;* 表示终止密码子。
BRLZ domain is shown in shades of gray; Termination codon is indicated by *.
图1 马氏珠母贝Nrf2基因CDS区核苷酸及推导的氨基酸序列分析
Fig.1 CDS nucleoside and encoded amino acid sequence analysis of Nrf2 gene in pearl oyster Pinctada fucata martensii
通过SignalP 4.1和TMHMM Server 2.0在线预测,马氏珠母贝Nrf2氨基酸序列未发现信号肽和跨膜结构域。应用SOPMA预测的Nrf2蛋白二级结构显示,无规则卷曲占54.81%,α-螺旋结构占34.54%,延伸链和β转角分别占7.13%和3.51%。SMART分析显示,Nrf2蛋白属于CNC亮氨酸拉链蛋白家族,其氨基酸序列靠近C端含有一个由65个氨基酸组成的BRLZ结构域(760 aa~824 aa)(图2)。
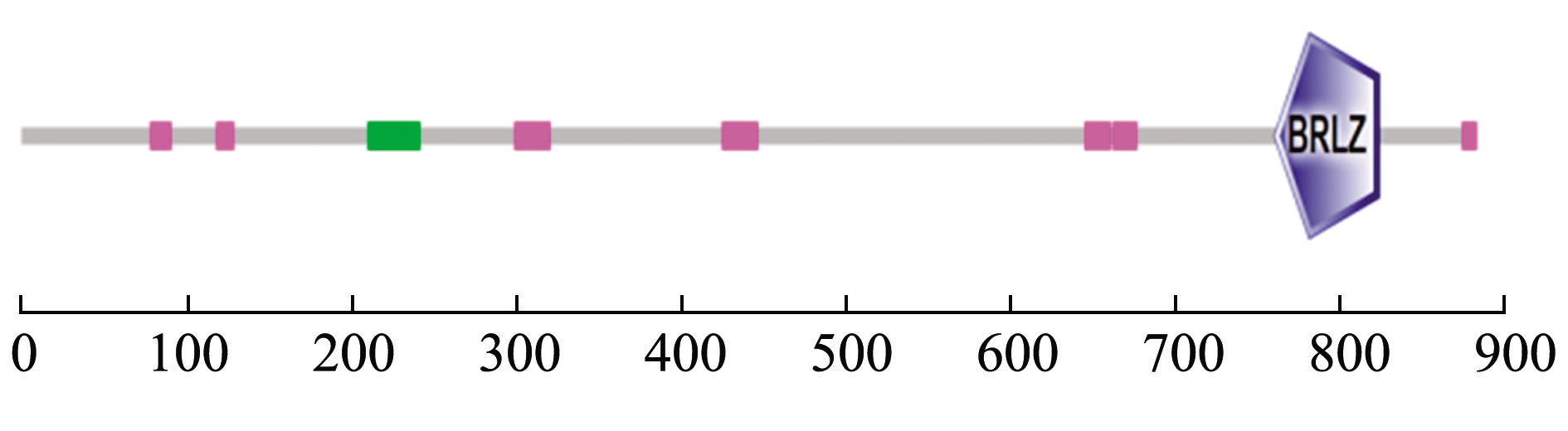
图2 马氏珠母贝Nrf2蛋白的结构域预测
Fig.2 Prediction of domain of Nrf2 protein in pearl oyster Pinctada fucata martensii
2.2 马氏珠母贝Nrf2蛋白的理化性质分析
马氏珠母贝Nrf2蛋白的理论等电点为5.51,相对分子质量为100 150,该蛋白由20种氨基酸组成,其中,含量最高的氨基酸是天冬酰胺(Asn),占9.7%,半胱氨酸(Cys)含量最低,占0.5%。Nrf2蛋白的不稳定系数为60.22,被划分为不稳定蛋白;Nrf2蛋白在第14位达到最高疏水性,疏水指数为2.500,在第245和246位达到最高亲水性,亲水指数为-3.833;该蛋白的脂溶指数与亲水性平均系数分别为66.70和-0.923,属于亲水性蛋白。
2.3 马氏珠母贝Nrf2同源性和系统进化分析
采用DNAMAN 8.0软件将长牡蛎、栉孔扇贝、虾夷扇贝和褶纹冠蚌Cristaria plicata Nrf2与马氏珠母贝的Nrf2氨基酸序列进行多重序列比对,结果如图3所示,不同贝类物种间的BRLZ结构域具有较高的保守性,为83.69%,且马氏珠母贝与长牡蛎的Nrf2氨基酸序列同源性最高。

蓝色为一致氨基酸; 粉色为相似度大于 75%; 青绿色为相似度大于 50%; 黑色方框为BRLZ结构域。
Blue,the coincident amino acids; Pink, the similarity of more than 75%; Turquoise, the similarity of more than 50%; The BRLZ domains are shown in black boxes.
图3 马氏珠母贝Nrf2氨基酸的多重序列比对
Fig.3 Multi-alignment of Nrf2 amino acid sequence in pearl oyster Pinctada fucata martensii
利用NCBI查找与马氏珠母贝Nrf2氨基酸序列同源性较高的15个物种的Nrf2氨基酸序列(表2),使用NJ法在 MEGA 7.0上构建系统进化树。结果显示,进化树分成两大支:马氏珠母贝Nrf2与长牡蛎的亲缘关系最近,其余物种Nrf2氨基酸序列聚为一支(图4)。
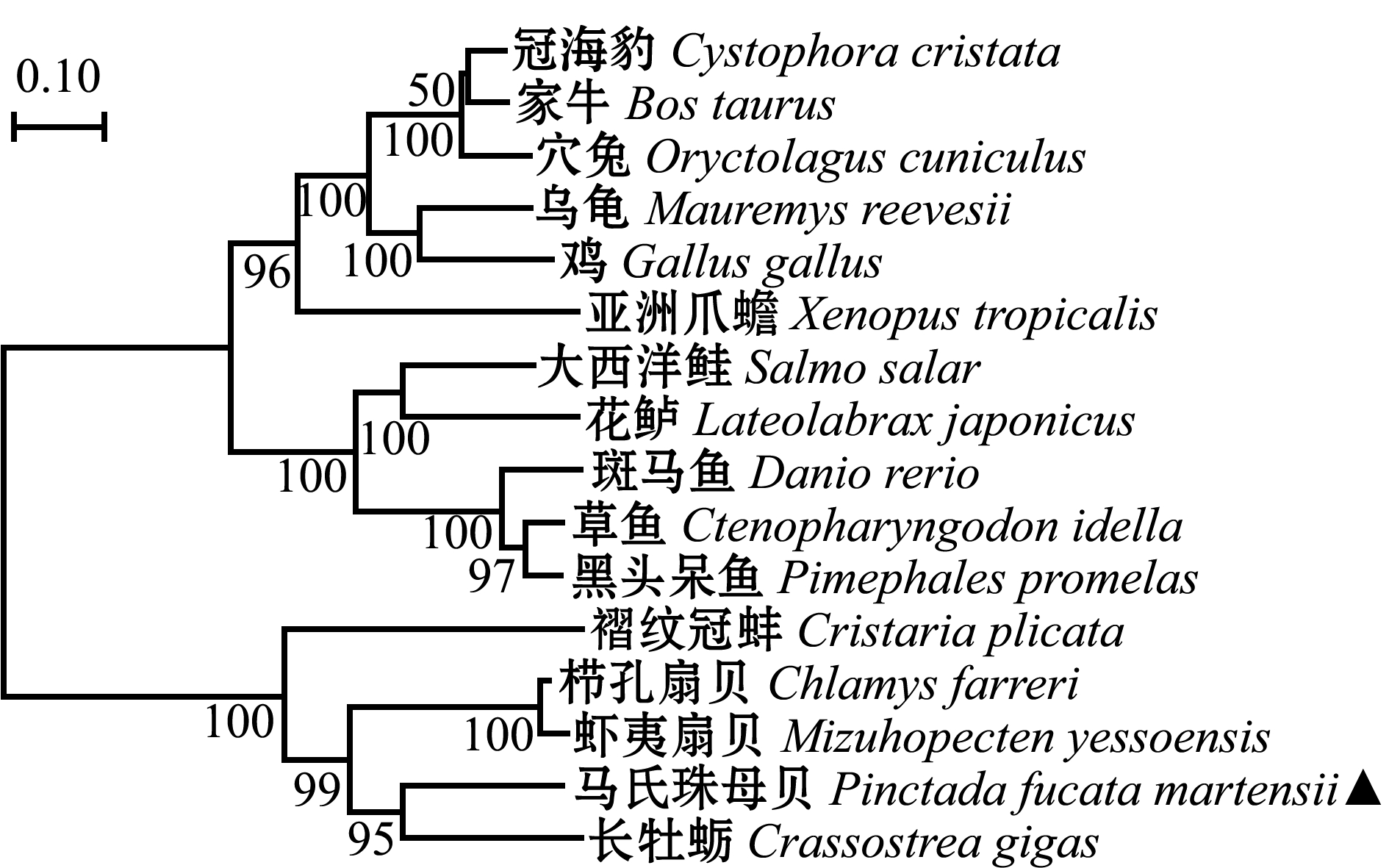
图4 基于NJ法构建的Nrf2氨基酸序列系统进化树
Fig.4 Phylogenetic tree construction of Nrf2 amino acid sequences with the method of NJ
2.4 马氏珠母贝Nrf2蛋白三级结构预测
经过数据库搜索和模板选择,对马氏珠母贝Nrf2和长牡蛎Nrf2进行蛋白分子三级结构分析。结果显示,二者的结构主要以不规则卷曲为主,其次是α-螺旋,对比发现,马氏珠母贝Nrf2蛋白的空间结构保守性较高(图5)。
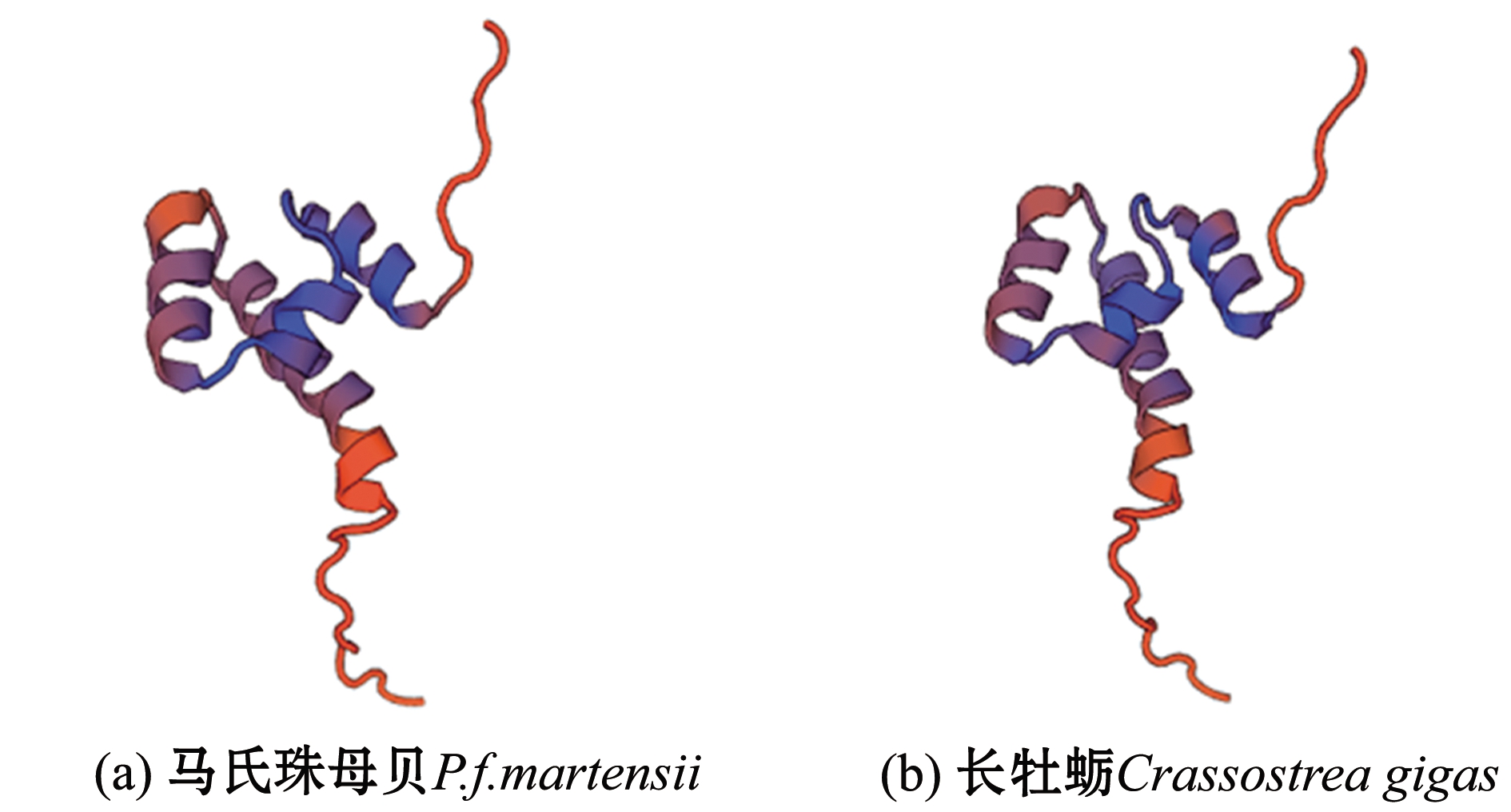
图5 马氏珠母贝和长牡蛎Nrf2蛋白保守域的三维结构
Fig.5 Spatial structure of Nrf2 in pearl oyster Pinctada fucata martensii and Pacific oyster Crassostrea gigas
2.5 马氏珠母贝Nrf2基因的组织表达分析
Nrf2基因在马氏珠母贝7 个组织中的表达结果如图6所示,Nrf2在马氏珠母贝肠道、足、外套膜、闭壳肌、鳃、肝胰腺、性腺中均有表达,其中闭壳肌中的表达水平最低,在闭壳肌、外套膜、足、性腺间不存在显著性差异(P>0.05),在肝胰腺组织中表达量最高,且显著高于其他组织(P<0.05)。
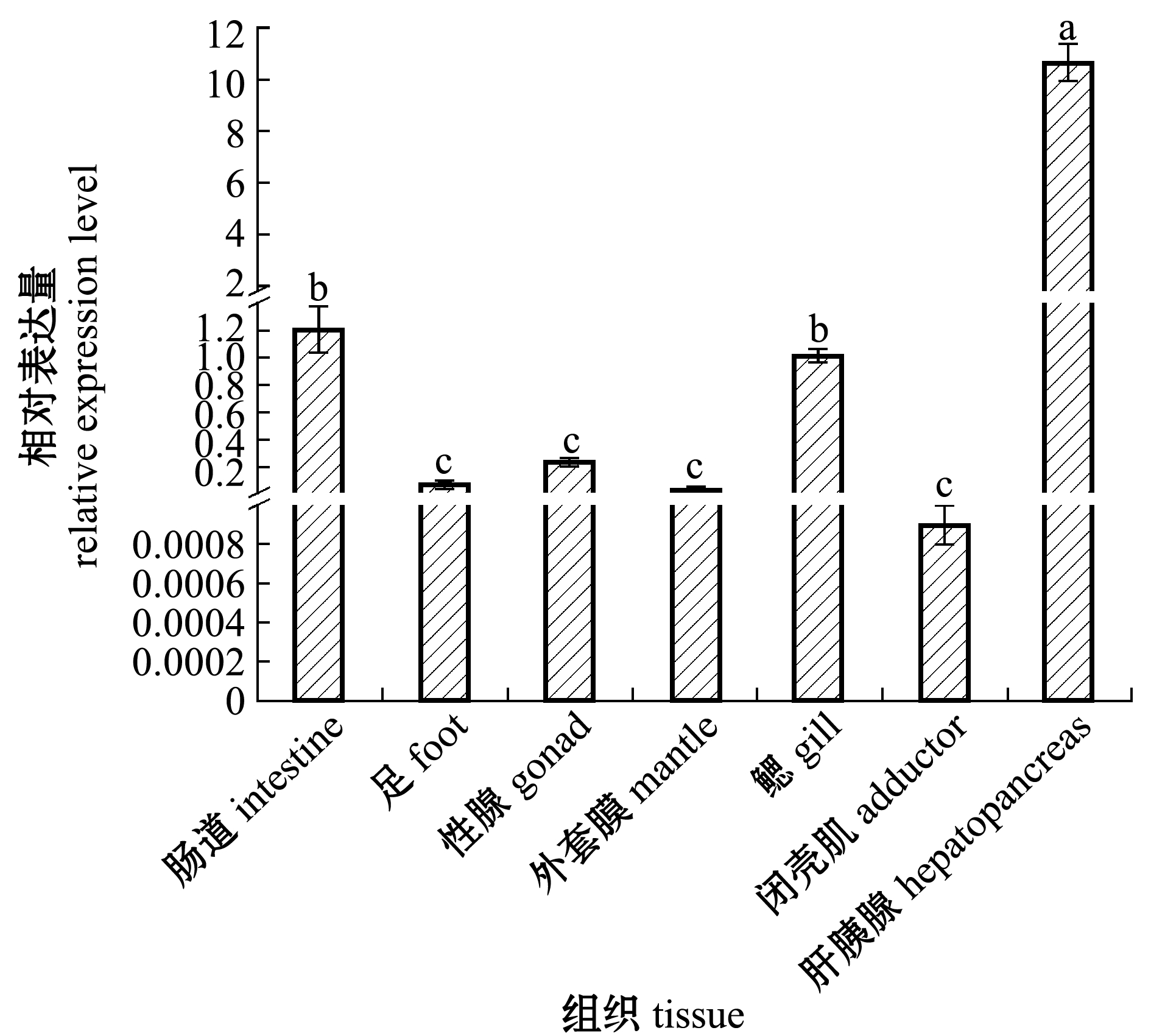
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences,et sequentia.
图6 马氏珠母贝不同组织中Nrf2基因的表达
Fig.6 Expression of Nrf2 in different tissues in pearl oyster Pinctada fucata martensii
2.6 LPS、PGN、Poly I:C刺激后马氏珠母贝鳃中Nrf2基因的表达变化
马氏珠母贝Nrf2经不同免疫刺激后48 h内的时序表达结果如图7所示,与PBS对照组相比,注射LPS、PGN、Poly I:C的各处理组在24 h内Nrf2的表达量无显著性差异(P>0.05),而在48 h时各处理组Nrf2显著上调(P<0.05),且表达量达到最高,分别为0 h PBS对照组的3.8、2.8、3.1倍。由此可见,免疫刺激可以诱导马氏珠母贝鳃中Nrf2表达。
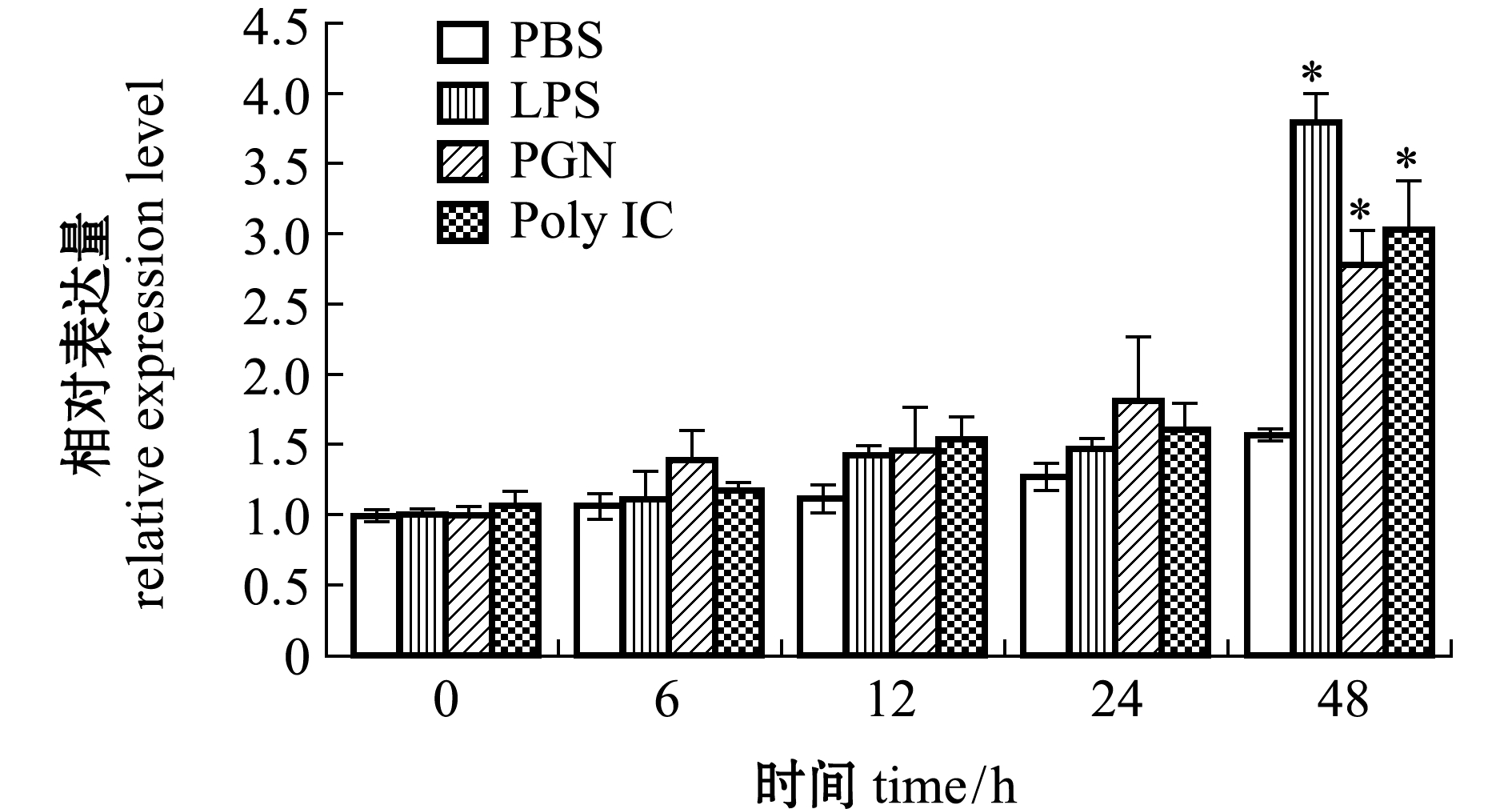
*表示试验组与PBS对照组存在显著性差异(P<0.05)。
* means that there is significant differences between the experimental groups and the PBS control group(P<0.05).
图7 不同免疫刺激后马氏珠母贝Nrf2在不同时间点的表达
Fig.7 Expression of Nrf2 after adductor injected by different immune stimulation at different time points
2.7 不同蛋白源饲料投喂后马氏珠母贝鳃中Nrf2基因的表达变化
比较小球藻粉、螺旋藻粉、酵母粉、豆粕和玉米蛋白粉5种不同蛋白源饲料投喂的马氏珠母贝鳃组织中 Nrf2基因的表达,结果如图8所示,螺旋藻粉、酵母粉和豆粕粉组Nrf2的表达量显著高于小球藻和玉米蛋白粉组(P<0.05)。
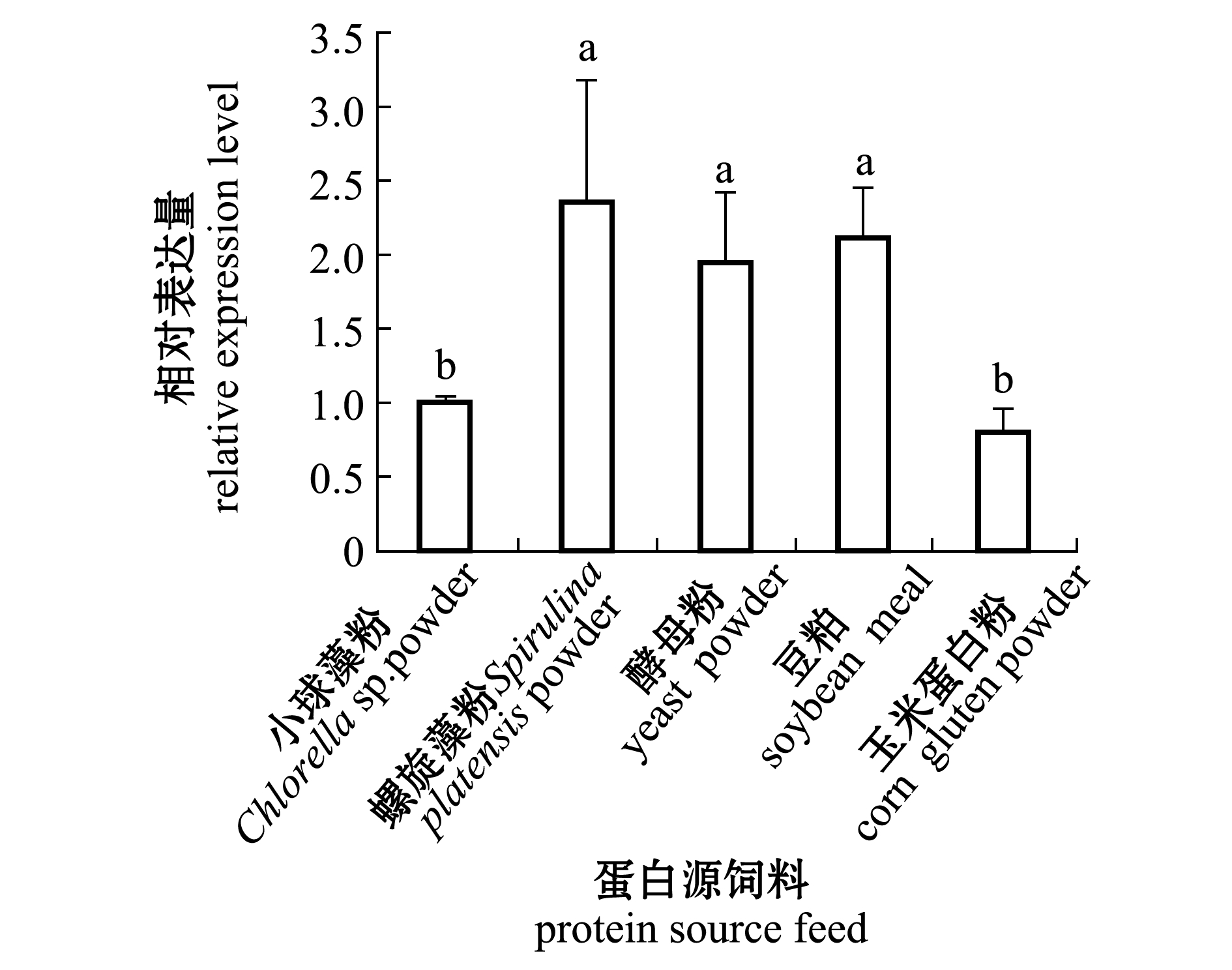
图8 不同蛋白源饲料投喂后马氏珠母贝鳃中Nrf2基因的表达变化
Fig.8 Expression of Nrf2 gene in the gill of pearl oyster Pinctada fucata martensii fed diets containing different protein sources
3 讨论
3.1 马氏珠母贝Nrf2基因序列特征
Nrf2作为调节细胞氧化应激的重要转录因子[16],具有特异性识别并结合多种防御酶基因上抗氧化元件ARE的功能,可以上调下游的一些抗氧化相关靶基因表达,并能与泛素或Keap1的Kelch 结构域相结合,引起Nrf2泛素依赖性降解[17-19]。本研究中,马氏珠母贝Nrf2基因开放阅读框长度为2 652 bp,可编码883个氨基酸,该蛋白的二级结构是由无规则卷曲构成,其氨基酸序列无信号肽和跨膜结构域,且发现其不稳定系数高达60.22,根据蛋白质稳定性的判断标准[20],推断Nrf2蛋白在正常情况下不能在细胞中稳定存在,这是验证正常生理状态下Keap1对Nrf2进行泛素化降解的负控作用的初步条件。经多序列比对和系统进化分析发现,马氏珠母贝Nrf2与长牡蛎的亲缘关系最近,但与哺乳类相比存在较大的进化差异。
3.2 马氏珠母贝Nrf2基因的组织表达
Nrf2是广泛存在于哺乳类、昆虫和鱼类等动物中的一类免疫调节因子,在肝脏、肾、消化腺及鳃等组织中高表达[21-26]。本研究中发现,Nrf2在马氏珠母贝各组织中广泛分布,表明Nrf2在非刺激条件下存在,同时,Nrf2在马氏珠母贝肝胰腺中呈现显著高表达,其次是肠道和鳃。肝胰腺是主要的免疫、解毒器官[27],Nrf2缺乏被证实会增加肝脏的脂质过氧化,在肝脏损伤中发挥保护作用。肠道是机体从外界摄取食物后进行异生物质代谢的场所,通常通过排毒系统将污染物代谢[28]。鳃是滤食器官,不断与水体进行物质交换,容易受到外界病原菌等刺激[29]。推测Nrf2在鳃与肠道中可能参与免疫调节反应。与脊椎动物不同的是,马氏珠母贝等无脊椎动物缺乏适应性免疫[30],因此,深入研究马氏珠母贝Nrf2基因在非特异性免疫中的调控机制具有重要意义。
3.3 马氏珠母贝Nrf2基因的免疫应答比较
LPS、PGN和Poly I:C作为炎症介质可诱导机体分泌出一系列因子来介导炎症反应的发生,并产生大量的自由基,诱发氧化应激[31-34]。本实验室前期研究中已证实Nrf2能够诱导马氏珠母贝NF-κB通路主要信号分子NF-κB诱导激酶(NF-κB-inducing kinase,NIK)和IKB激酶(IKB kinase,IKK),以及下游炎症相关基因的表达,包括肿瘤坏死因子(tumor necrosis factor,TNF)、肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)和脂多糖诱导的肿瘤坏死因子α因子(lipopolysaccharide-induced TNF-alpha factor,LITAF)等[35-36]。Gong等[37]还发现,敲除Nrf2可增加花生四乙烯(AA)对细胞的毒性,降低细胞内GSH水平,增加ROS的产生和脂质过氧化作用,而过表达Nrf2可增强细胞对AA毒性的抵抗力。进一步证明Nrf2参与机体免疫应答。为探究Nrf2在马氏珠母贝免疫响应方面的作用,本研究中分别检测了LPS、PGN和Poly I:C刺激后马氏珠母贝Nrf2基因的时序表达情况,结果显示,Nrf2在刺激后的48 h时显著上调。在翡翠贻贝Perna viridis和菲律宾蛤仔Ruditapes philippinarum中分别进行的腹泻性贝类毒素和多环芳烃暴露试验均表明,Nrf2可通过调控一系列抗氧化基因的表达,介导机体抗氧化防御[4,38]。因此,推测马氏珠母贝经LPS、PGN、Poly I:C刺激出现炎症反应后,Nrf2可以提高机体对免疫刺激的抵抗力,减弱刺激作用从而使细胞进行修复,并将损伤降至最低。本研究结果为Nrf2参与马氏珠母贝天然免疫功能提供了证据,为进一步研究其在马氏珠母贝免疫调控机制中的作用提供了基础资料。
3.4 不同蛋白源饲料投喂后Nrf2基因表达变化
免疫系统和营养代谢间存在密切的联系,当免疫系统被激活后,机体主要从营养物中获得所需代谢底物和能量,并作为形成新免疫细胞、抗体、细胞因子和急性期蛋白等效应物和保护分子如谷胱甘肽合成的前体[39-40]。大量研究表明,维生素、矿物质、脂肪酸、氨基酸等营养素对水产动物的免疫性能、抗病能力起到一定的作用[41]。饲料中较高的脂肪水平,可以通过ROS途径调节凡纳滨对虾Litopenaeus vannamei的生长并增强免疫能力[42];适量氨基酸水平也能改善草鱼幼鱼生长性能,减轻肠道炎症反应,并对鱼体的免疫功能和抗氧化功能产生影响[43]。本实验室前期研究表明,适宜的 VD3 添加水平的饲料能提高马氏珠母贝的免疫力,降低插核手术后育珠贝的死亡率,且适宜的蛋白源饲料也可以增强马氏珠母贝的抗氧化能力[44]。本研究中,Nrf2在以小球藻粉和玉米蛋白粉为蛋白源组中表达量较低,但在其他蛋白源饲料组中呈现显著高表达,这与本实验室前期研究发现的不同蛋白源饲料组中的抗氧化酶活性和抗氧化基因SOD、GPx、CAT等表达情况一致[15],由此推测,Nrf2基因在马氏珠母贝的营养代谢中可能发挥重要作用,其调控机理有待深入研究,这对于推进马氏珠母贝的人工饲料优化和优质品种培育具有重要意义。
4 结论
1)Nrf2基因在马氏珠母贝的肝胰腺、鳃与肠道组织中高表达,推测该基因在这些器官中参与机体免疫调节反应。
2)在LPS、PGN和Poly I:C刺激48 h时马氏珠母贝鳃中Nrf2基因显著高表达,进一步说明Nrf2参与马氏珠母贝的免疫防御功能,但是其具体调控机制需要进一步验证。
3)不同蛋白源饲料投喂后马氏珠母贝鳃中Nrf2的表达量不一,与本实验室前期对不同蛋白源投喂后抗氧化酶活性与抗氧化基因表达的研究情况一致,提示该基因可能参与到马氏珠母贝的营养代谢。
[1] MOI P,CHAN K,ASUNIS I,et al.Isolation of NF-E2-related factor 2(Nrf2),a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/AP1 repeat of the beta-globin locus control region[J].Proceedings of the National Academy of Sciences of the United States of America,1994,91(21):9926-9930.
[2] ITOH K,MIMURA J,YAMAMOTO M.Discovery of the negative regulator of Nrf2,Keap1:a historical overview[J].Antioxidants & Redox Signaling,2010,13(11):1665-1678.
[3] PIANTADOSI C A,CARRAWAY M S,BABIKER A,et al.Heme oxygenase-1 regulates cardiac mitochondrial biogenesis via Nrf2-mediated transcriptional control of nuclear respiratory factor-1[J].Circulation Research,2008,103(11):1232-1240.
[4] WANG H D,PAN L Q,SI L J,et al.The role of Nrf2-Keap1 signaling pathway in the antioxidant defense response induced by PAHs in the clam Ruditapes philippinarum[J].Fish & Shellfish Immunology,2018,80:325-334.
[5] WANG L,GALLAGHER E P.Role of Nrf2 antioxidant defense in mitigating cadmium-induced oxidative stress in the olfactory system of zebrafish[J].Toxicology and Applied Pharmacology,2013, 266(2):177-186.
[6] DANIELLI N M,TREVISAN R,MELLOD F,et al.Contrasting effects of a classic Nrf2 activator,tert-butylhydroquinone,on the glutathione-related antioxidant defenses in Pacific oysters,Crassostrea gigas[J].Marine Environmental Research,2017,130:142-149.
[7] 郑男.洛氏鱥(Rhynchocypris lagowskii(Dybowski,1869))核转录因子Nrf2基因特性及功能分析[D].长春:吉林农业大学,2020.
ZHENG N.Characteristics and functional analysis of nuclear transcription actor Nrf2 gene in Rhynchocypris lagowskii(Dybowski,1869)[D].Changchun:Jilin Agricultural University,2020.(in Chinese)
[8] 唐祖蓉.镉和苯并芘单一及混合暴露对厚壳贻贝抗氧化反应和Nrf2基因表达研究[D].舟山:浙江海洋大学,2019.
TANG Z R.Study of antioxidant responses and Nrf2 transcript levels in Mytilus coruscus exposed to single and mixtures of cadmium and benzo(a)pyrene[D].Zhoushan:Zhejiang Ocean University,2019.(in Chinese)
[9] 冯燕,秦真东,代云佳,等.草鱼核因子E2相关因子2基因克隆分析及其对呼吸爆发的调控作用[J].水产学报,2018,42(2):161-177.
FENG Y,QIN Z D,DAI Y J,et al.Cloning and analysis of nuclear factor E2-related factor 2(Nrf2)and its function in the regulation of respiratory burst in grass carp(Ctenopharyngodon idella)[J].Journal of Fisheries of China,2018,42(2):161-177.(in Chinese)
[10] 徐昊,梁化亮,戈贤平,等.团头鲂必需氨基酸营养研究进展[J].动物营养学报,2020,32(11):5105-5116.
XU H,LIANG H L,GE X P,et al.Research advances on essential amino acid nutrition of blunt snout bream(Megalobrama amblycephala)[J].Acta Zoonutrimenta Sinica,2020,32(11):5105-5116.(in Chinese)
[11] JIANG W D,LIU Y,JIANG J,et al.In vitro interceptive and reparative effects of myo-inositol against copper-induced oxidative damage and antioxidant system disturbance in primary cultured fish enterocytes[J].Aquatic Toxicology,2013,132/133:100-110.
[12] 郑哲,吴宣瑾,焦钰,等.马氏珠母贝TRACP基因的克隆及组织表达[J].广东海洋大学学报,2019,39(3):24-29.
ZHENG Z,WU X J,JIAO Y,et al.Cloning and tissue expression analysis of TRACP gene in Pinctada martensii[J].Journal of Guangdong Ocean University,2019,39(3):24-29.(in Chinese)
[13] 张雨婷,曾嫚玉,马佳仪,等.马氏珠母贝β2肾上腺素能受体(β2AR)分子特征和表达分析[J].广东海洋大学学报,2019,39(4):108-115.
ZHANG Y T,ZENG M Y,MA J Y,et al.Molecular characterization and expression analysis of β2 adrenergic receptor(β2AR)from Pinctada martensii[J].Journal of Guangdong Ocean University,2019,39(4):108-115.(in Chinese)
[14] 陈琨,黄湾,廖永山,等.马氏珠母贝肠道及其养殖水体可培养细菌群落结构[J].广东海洋大学学报,2021,41(1):47-54.
CHEN K,HUANG W,LIAO Y S,et al.Community structure of culturable bacterial communities in the intestine of Pinctada fucata martensii and its aquaculture water[J].Journal of Guangdong Ocean University,2021,41(1):47-54.(in Chinese)
[15] YANG C Y,HAO R J,DENG Y W,et al.Effects of protein sources on growth,immunity and antioxidant capacity of juvenile pearl oyster Pinctada fucata martensii[J].Fish & Shellfish Immunology,2017,67:411-418.
[16] MOTOHASHI H,YAMAMOTO M.Nrf2-Keap1 defines a physiologically important stress response mechanism[J].Trends in Molecular Medicine,2004,10(11):549-557.
[17] 王晓波.褶纹冠蚌Nrf2和MafK基因的表达与功能分析[D].南昌:南昌大学,2018.
WANG X B.Expression and function analysis of Nrf2 and MafK gene of Cristata plicata[D].Nanchang:Nanchang University,2018.(in Chinese)
[18] 柳文秀,胡宝庆,简少卿,等.褶纹冠蚌Keap1基因克隆与表达分析[C]//2017年中国水产学会学术年会论文摘要集.南昌:中国水产学会,2017.
LIU W X,HU B Q,JIAN S Q,et al.Cloning and expression analysis of Keap1 gene of Cristata plicata[C]//Abstracts of papers presented at the 2017 annual meeting of the Chinese Academy of Fisheries.Nanchang:China Society of Fisheries,2017.(in Chinese)
[19] 刘毅,李丽,程磊,等.基于模式生物斑马鱼Nrf2的相关研究进展[J].现代生物医学进展,2018,18(6):1181-1184,1188.
LIU Y,LI L,CHENG L,et al.Research progress of model organism zebrafish Nrf2[J].Progress in Modern Biomedicine,2018,18(6):1181-1184,1188.(in Chinese)
[20] JIANG F J,YUE X,WANG H X,et al.Transcriptome profiles of the clam Meretrix petechialis hepatopancreas in response to Vibrio infection[J].Fish & Shellfish Immunology,2017,62:175-183.
[21] CHO H Y,MARZEC J,KLEEBERGER S R.Functional polymorphisms in Nrf2:implications for human disease[J].Free Radical Biology and Medicine,2015,88:362-372.
[22] WU P,QU B,FENG L,et al.Dietary histidine deficiency induced flesh quality loss associated with changes in muscle nutritive composition,antioxidant capacity,Nrf2 and TOR signaling molecules in on-growing grass carp(Ctenopharyngodon idella)[J].Aquaculture,2020,526:735399.
[23] 倪静,申培,吴拥军,等.Nrf2基因沉默的人支气管上皮细胞模型的建立[J].现代预防医学,2017,44(15):2802-2807,2822.
NI J,SHEN P,WU Y J,et al.Establishment and identification of silence BEAS-2B cells model of Nrf2 genes expression by RNA interference[J].Modern Preventive Medicine,2017,44(15):2802-2807,2822.(in Chinese)
[24] MENEGON S,COLUMBANO A,GIORDANO S.The dual roles of NRF2 in cancer[J].Trends in Molecular Medicine,2016,22(7):578-593.
[25] 芮文娟.Nrf2在小鼠肝脏的脂肪代谢和胆汁淤积症中的作用[D].合肥:安徽医科大学,2016.
RUI W J.The roles Nrf2 in lipid metabolism and cholestasis in mice liver[D].Hefei:Anhui Medical University,2016.(in Chinese)
[26] 刘宗立.大蒲莲猪Nrf2基因克隆、表达分析及其启动子区活性研究[D].泰安:山东农业大学,2018.
LIU Z L.Molecular cloning,expression analysis and transcriptional activity of promoter of gene Nrf2 in Dapulian pig[D].Taian:Shandong Agricultural University,2018.(in Chinese)
[27] MANN G E,NIEHUESER-SARAN J,WATSON A,et al.Nrf2/ARE regulated antioxidant gene expression in endothelial and smooth muscle cells in oxidative stress:implications for atherosclerosis and preeclampsia[J].Acta Physiologica Sinica,2007,59(2):117-127.
[28] HU F X,PAN L Q,XIU M,et al.Bioaccumulation and detoxification responses in the scallop Chlamys farreri exposed to tetrabromobisphenol A(TBBPA)[J].Environmental Toxicology and Pharmacology,2015, 39(3):997-1007.
[29] WIENS M,KORZHEV M,PEROVIC-OTTSTADT S,et al.Toll-like receptors are part of the innate immune defense system of sponges(Demospongiae:Porifera)[J].Molecular Biology & Evolution,2007, 24(3):792-804.
[30] 张庆利.中国明对虾免疫系统中抗氧化相关基因的克隆与表达分析[D].青岛:中国科学院研究生院(海洋研究所),2007.
ZHANG Q L.Cloning and expression analysis of antioxidant genes involving in the immune system in Chinese shrimp Fenneropenaeus chinensis[D].Qingdao:Graduate University of the Chinese Academy of Sciences(Institute of Oceanology),2007.(in Chinese)
[31] 吴振.嗜酸乳杆菌胞壁肽聚糖的免疫调节效应与机理研究[D].南京:南京师范大学,2015.
WU Z.Immunomodulatory effect and mechanism of peptidoglycan on cell wall of Lactobacillus acidophilus[D].Nanjing:Nanjing Normal University,2015.(in Chinese)
[32] 焦钰,梁金婵,谷泽丰,等.脂多糖刺激对马氏珠母贝血细胞DNA甲基化修饰的影响[J].广东海洋大学学报,2020,40(3):7-13.
JIAO Y,LIANG J C,GU Z F,et al.Effect of genomic DNA methylation after lipopolysaccharide stimulation on the homcytes from Pinctada fucata martensii[J].Journal of Guangdong Ocean University,2020,40(3):7-13.(in Chinese)
[33] 陈刚.止痢草油缓解断奶仔猪肠道氧化应激的作用及机制[D].武汉:华中农业大学,2015.
CHEN G.Effect and mechanism of oregano essential oil reduce intestinal oxidative stress in weaned pigs[D].Wuhan:Huazhong Agricultural University,2015.(in Chinese)
[34] LOWES D A,WEBSTER N R,MURPHYM P,et al.Antioxidants that protect mitochondria reduce interleukin-6 and oxidative stress,improve mitochondrial function,and reduce biochemical markers of organ dysfunction in a rat model of acute sepsis[J].British Journal of Anaesthesia,2013,110(3):472-480.
[35] 吴羽媛.马氏珠母贝肿瘤坏死因子受体及其相关因子基因的克隆与功能研究[D].湛江:广东海洋大学,2018.
WU Y Y.The cloning and functional study of tumor necrosis factor receptor and their associated factors genes of Pinctada fucata martensii[D].Zhanjiang:Gongdong Ocean University,2018.(in Chinese)
[36] 何军军.马氏珠母贝免疫效应分子的克隆及功能研究[D].湛江:广东海洋大学,2020.
HE J J.The cloning and functional study of immune effector molecules on Pinctada fucata martensii[D].Zhanjiang:Gongdong Ocean University,2020.(in Chinese)
[37] GONG P F,CEDERBAUMA I.Transcription factor Nrf2 protects HepG2 cells against CYP2E1 plus arachidonic acid-dependent toxicity[J].Journal of Biological Chemistry,2006,281(21):14573-14579.
[38] HE Z B,DUAN G F,LIANG C Y,et al.Up-regulation of Nrf2-dependent antioxidant defenses in Perna viridis after exposed to Prorocentrum lima[J].Fish & Shellfish Immunology,2019,90:173-179.
[39] HUANG Z S,AWEYA J J,ZHU C H,et al.Modulation of crustacean innate immune response by amino acids and their metabolites:inferences from other species[J].Frontiers in Immunology,2020,11:574721.
[40] FERNSTROM J D.Branched-chain amino acids and brain function[J].Journal of Nutrition,2005,135(6):1539S-1546S.
[41] TRICHET V V.Nutrition and immunity:an update[J].Aquaculture Research,2010,41(3):356-372.
[42] ZHANG S P,LI J F,WU X C,et al.Effects of different dietary lipid level on the growth,survival and immune-relating genes expression in Pacific white shrimp,Litopenaeus vannamei[J].Fish & Shellfish Immunology,2013,34(5):1131-1138.
[43] WEN H L,FENG L,JIANG W D,et al.Dietary tryptophan modulates intestinal immune response,barrier function,antioxidant status and gene expression of TOR and Nrf2 in young grass carp(Ctenopharyngodon idella)[J].Fish & Shellfish Immunology,2014,40(1):275-287.
[44] 杨创业.马氏珠母贝人工饲料配方优化及其相关营养代谢研究[D].湛江:广东海洋大学,2019.
YANG C Y.Optimization of formulated diet of pearl oyster Pinctada fucata martensii and its related nutritional metabolism[D].Zhanjiang:Gongdong Ocean University,2019.(in Chinese)