当机体免疫系统正常运作的时候,它扮演着一个强大的“国防军”的角色,能有效抵抗大多数“敌害”微生物的入侵。脊椎动物免疫系统可以分为先天性免疫和适应性免疫,先天性免疫主要依靠机体内外部屏障系统、先天性免疫细胞及体液中存在的抗菌与抗病毒成分来发挥作用,而适应性免疫则是通过T细胞受体(T cell receptor,TCR)和 B细胞受体(B cell receptor,BCR)来识别抗原,继而引发适应性细胞免疫和体液免疫[1]。BCR主要是由存在于B细胞膜表面的免疫球蛋白(immunoglobulin,Ig)构成;而存在于体液中的可溶形式的免疫球蛋白又被称为抗体(antibody,Ab),是介导适应性体液免疫的关键效应分子[2]。
鱼类是在演化上最早具有免疫球蛋白的脊椎动物类群[3]。典型的免疫球蛋白是由两条重链(IgH)和两条轻链(IgL)通过疏水作用结合在一起,并由链间二硫键相连组成的“Y”形四肽链结构,每条重链和轻链各包含一个氨基端(N端)的可变区(V)结构域和一个(轻链)或多个(重链)羧基端(C端)的恒定区(C)结构域。在重链和轻链V区的某些特定位置上,其氨基酸残基的组成和排列顺序相比V区内的其他位置变化更大,称为超变区,又称互补决定区(complementary determinant region,CDR);V区中其他变化较少的部分则称为骨架区(framework region,FR)[4]。免疫球蛋白的类型由其重链恒定区(CH)的氨基酸序列决定,例如,在哺乳动物中总共发现了μ、δ、γ、α和ε 5种免疫球蛋白重链,对应的免疫球蛋白类型分别为IgM、IgD、IgG、IgA和IgE,在硬骨鱼类(teleost)中共发现了μ、δ和τ 3种免疫球蛋白重链,对应的免疫球蛋白类型分别为IgM、IgD和IgT[5]。
不同类型的免疫球蛋白在机体内有着功能分工,它们分别在系统免疫和黏膜免疫中行使特定功能。例如,在哺乳动物中,IgM和IgG在系统免疫中起主要作用,而IgA则在黏膜免疫中发挥作用。在硬骨鱼类中,仅虹鳟Oncorhynchus mykiss的IgM和IgT的功能研究较为深入。尽管前期的研究表明,硬骨鱼类IgM是黏膜免疫中重要的防御因子[6],并且认为IgM是系统和黏膜免疫中的唯一免疫球蛋白类型[7],但是随着IgT的发现及虹鳟IgT免疫功能的揭示,IgT被认为是比IgM更为重要的黏膜免疫球蛋白类型,而IgM主要在系统免疫中发挥作用[8]。随着对硬骨鱼类IgT研究的不断深入,有关IgT亚类的组成、结构和功能,以及IgT起源和演化的研究取得了新的进展。基于此,本文综述了硬骨鱼类IgT的研究进展,以期为更加深入和全面地阐明IgT的免疫功能及鱼类抗感染免疫应答规律提供借鉴和参考。
1 IgT的亚类组成与结构
2005年,研究者在虹鳟和斑马鱼Danio rerio中发现了一种新的IgH基因,分别命名为ighτ[9]和ighζ[10](本文中统称为ighτ),分别编码免疫球蛋白IgT和IgZ(本文中统称为IgT)的重链,自此掀起了对IgT的研究热潮,许多新的发现正改变着人们对硬骨鱼类免疫球蛋白的认知(图1)。在IgT被发现之前,人们认为硬骨鱼类免疫球蛋白重链基因座只是以“易位子”方式排列:VH-Dμ/δ-Jμ/δ-Cμ-Cδ,即VH在5′端,其后是Dμ/δ和Jμ/δ,下游是Cμ和Cδ,分别编码μ链和δ链。而在虹鳟和斑马鱼中发现编码τ链的Dτ-Jτ-Cτ在VH-Dμ/δ-Jμ/δ-Cμ-Cδ之前形成一个特异的“簇”,最终形成VH-Dτ-Jτ-Cτ-VH-Dμ/δ-Jμ/δ-Cμ-Cδ[9]和VH-Dτ-Jτ-Cτ-Dμ/δ-Jμ/δ-Cμ-Cδ[10]基因座。在大西洋鲑Salmo salar中,ighτ的排列方式是多个VH-Dτ-Jτ-Cτ排列在一起构成一簇,即(VH-Dτ-Jτ-Cτ)n-VH-Dμ/δ-Jμ/δ-Cμ-Cδ[11-12],代表了硬骨鱼类IgH基因新的排列方式。目前,已在多种鱼类中发现了IgT,但与IgM不同,硬骨鱼类IgT的CH结构域的数目不尽相同,其中大多数IgT是具有4个CH结构域的典型IgT,然而也有仅含2个或3个CH结构域的短型IgT。此外,部分硬骨鱼类中还发现了由IgM的CH结构域(Cμ)和IgT的CH结构域(Cτ)嵌合而成的嵌合型IgT。硬骨鱼类IgT及其亚类重链的基因结构和恒定区组成如表1所示。
表1 硬骨鱼类IgT及其亚类重链的基因结构和恒定区组成
Tab.1 The igh locus and constant region organization of the heavy chain of teleost IgT and its subclasses
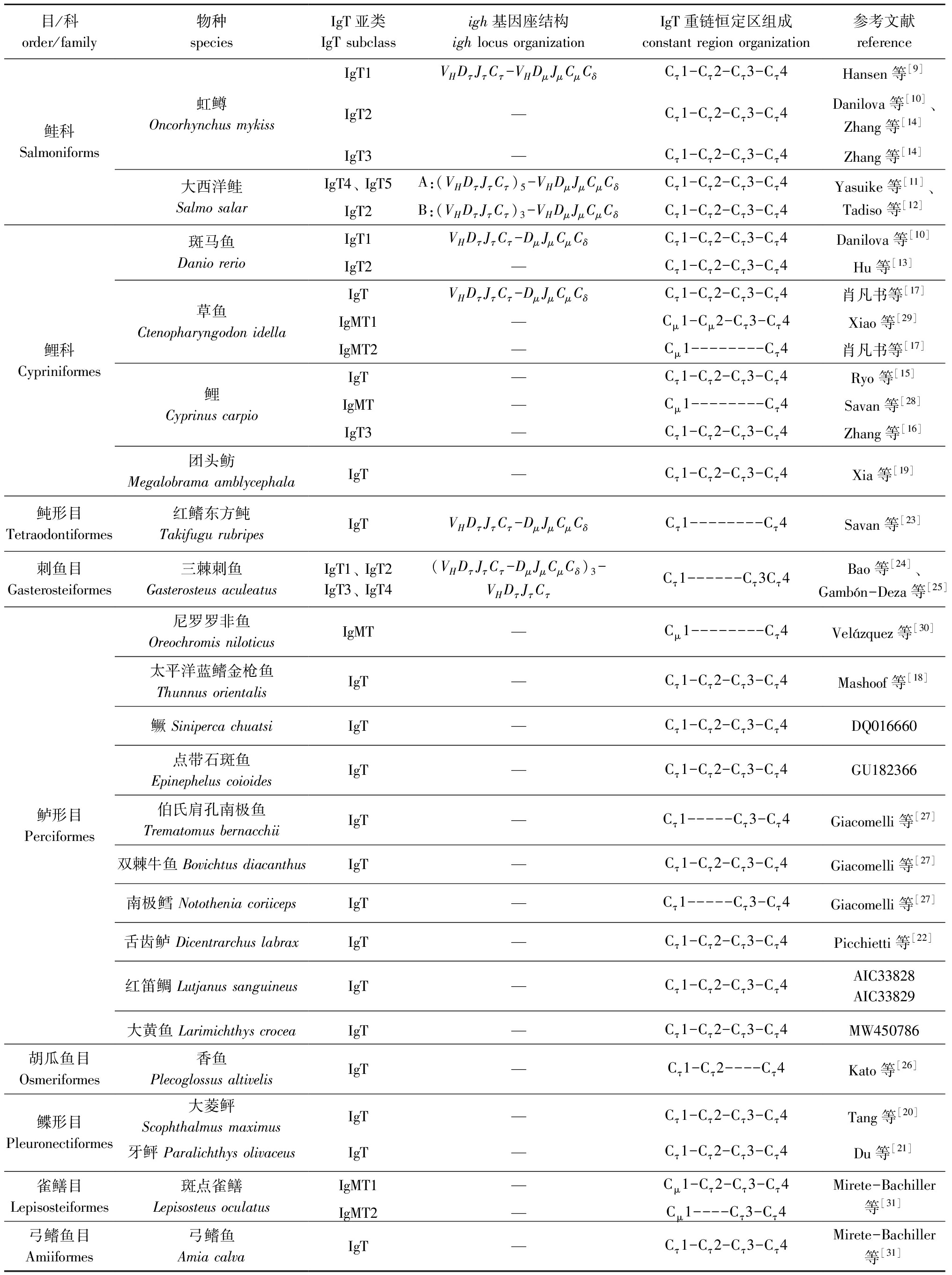
目/科order/family物种speciesIgT亚类IgT subclassigh基因座结构igh locus organization IgT重链恒定区组成constant region organization参考文献reference鲑科Salmoniforms虹鳟Oncorhynchus mykiss大西洋鲑Salmo salarIgT1VHDτJτCτ-VHDμJμCμCδCτ1-Cτ2-Cτ3-Cτ4IgT2—Cτ1-Cτ2-Cτ3-Cτ4IgT3—Cτ1-Cτ2-Cτ3-Cτ4IgT4、 IgT5A:(VHDτJτCτ)5-VHDμJμCμCδCτ1-Cτ2-Cτ3-Cτ4IgT2B:(VHDτJτCτ)3-VHDμJμCμCδCτ1-Cτ2-Cτ3-Cτ4Hansen等[9]Danilova等[10]、Zhang等[14]Zhang等[14]Yasuike等[11]、Tadiso等[12]鲤科Cypriniformes斑马鱼Danio rerio草鱼Ctenopharyngodon idella鲤 Cyprinus carpio团头鲂Megalobrama amblycephalaIgT1VHDτJτCτ-DμJμCμCδCτ1-Cτ2-Cτ3-Cτ4Danilova等[10]IgT2—Cτ1-Cτ2-Cτ3-Cτ4Hu等[13]IgTVHDτJτCτ-DμJμCμCδCτ1-Cτ2-Cτ3-Cτ4肖凡书等[17]IgMT1—Cμ1-Cμ2-Cτ3-Cτ4Xiao等[29]IgMT2—Cμ1--------Cτ4肖凡书等[17]IgT—Cτ1-Cτ2-Cτ3-Cτ4Ryo等[15]IgMT—Cμ1--------Cτ4Savan等[28]IgT3—Cτ1-Cτ2-Cτ3-Cτ4Zhang等[16]IgT—Cτ1-Cτ2-Cτ3-Cτ4Xia等[19]鲀形目Tetraodontiformes红鳍东方鲀Takifugu rubripesIgTVHDτJτCτ-DμJμCμCδCτ1--------Cτ4Savan等[23]刺鱼目Gasterosteiformes三棘刺鱼Gasterosteus aculeatusIgT1、 IgT2IgT3、 IgT4(VHDτJτCτ-DμJμCμCδ)3-VHDτJτCτCτ1------Cτ3Cτ4Bao等[24]、Gambón-Deza等[25]鲈形目Perciformes尼罗罗非鱼Oreochromis niloticusIgMT—Cμ1--------Cτ4Velázquez等[30]太平洋蓝鳍金枪鱼Thunnus orientalisIgT—Cτ1-Cτ2-Cτ3-Cτ4Mashoof等[18]鳜 Siniperca chuatsiIgT—Cτ1-Cτ2-Cτ3-Cτ4DQ016660点带石斑鱼Epinephelus coioidesIgT—Cτ1-Cτ2-Cτ3-Cτ4GU182366伯氏肩孔南极鱼Trematomus bernacchiiIgT—Cτ1-----Cτ3-Cτ4Giacomelli等[27]双棘牛鱼 Bovichtus diacanthusIgT—Cτ1-Cτ2-Cτ3-Cτ4Giacomelli等[27]南极鳕 Notothenia coriicepsIgT—Cτ1-----Cτ3-Cτ4Giacomelli等[27]舌齿鲈 Dicentrarchus labraxIgT—Cτ1-Cτ2-Cτ3-Cτ4Picchietti等[22]红笛鲷 Lutjanus sanguineusIgT—Cτ1-Cτ2-Cτ3-Cτ4AIC33828AIC33829大黄鱼 Larimichthys croceaIgT—Cτ1-Cτ2-Cτ3-Cτ4 MW450786胡瓜鱼目Osmeriformes香鱼Plecoglossus altivelisIgT—Cτ1-Cτ2----Cτ4Kato等[26]鲽形目Pleuronectiformes大菱鲆Scophthalmus maximusIgT—Cτ1-Cτ2-Cτ3-Cτ4Tang等[20]牙鲆 Paralichthys olivaceusIgT—Cτ1-Cτ2-Cτ3-Cτ4Du等[21]雀鳝目Lepisosteiformes斑点雀鳝Lepisosteus oculatusIgMT1—Cμ1-Cτ2-Cτ3-Cτ4IgMT2—Cμ1----Cτ3-Cτ4Mirete-Bachiller等[31]弓鳍鱼目Amiiformes弓鳍鱼Amia calvaIgT—Cτ1-Cτ2-Cτ3-Cτ4Mirete-Bachiller等[31]
注:“—”代表未知。
Note:“—” means unknown.
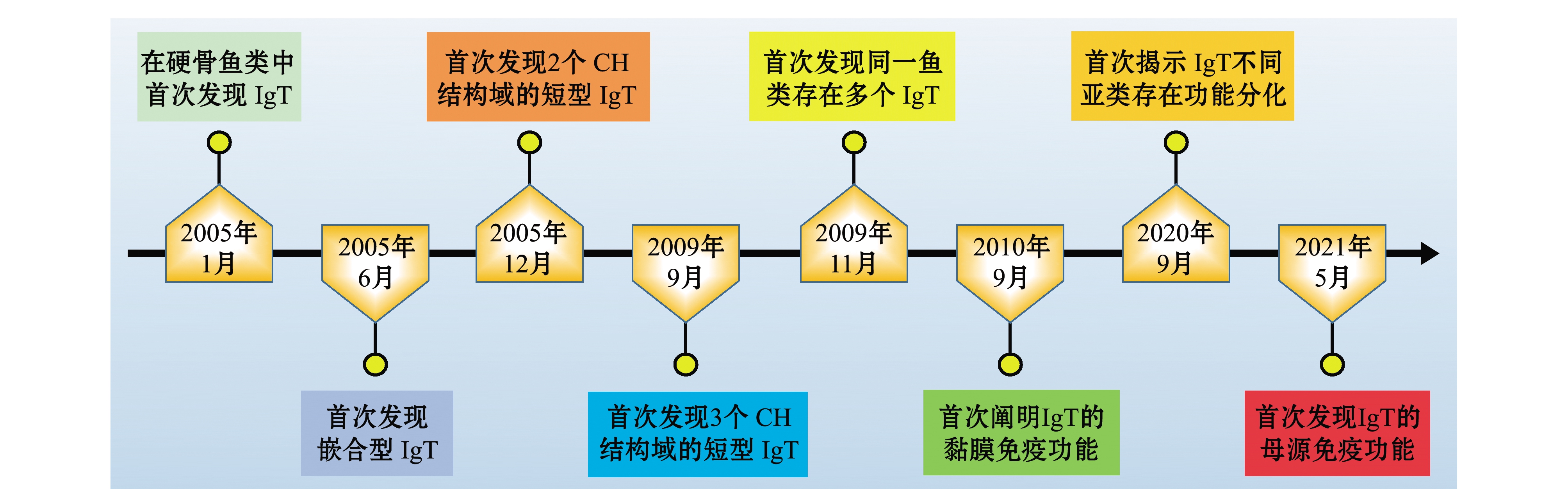
图1 硬骨鱼类IgT研究的重要里程碑
Fig.1 The important research milestones of teleost IgT
1.1 典型IgT——具有4个Cτ结构域的IgT
目前,已在斑马鱼[10,13]、虹鳟[9,10,14]、鲤Cyprinus carpio[15-16]、草鱼Ctenopharyngodon idella[17]、大西洋鲑[11-12]和太平洋蓝鳍金枪鱼Thunnus orientalis[18]等硬骨鱼类中发现了具有4个Cτ结构域的典型IgT,这些典型IgT既有相同之处,又有各自的特点。
在斑马鱼中发现了2个典型IgT,分别是Danilova等[10]2005年发现的IgT1(原文中命名为IgZ)和Hu[13]等2009年发现的IgT2(原文中命名为IgZ-2)。IgT1和IgT2重链的核苷酸序列具有76.5%的一致性,氨基酸序列具有53.5%的一致性,且两者CH4的序列一致性较高,达到80.4%。编码IgT1重链的基因位于VH和Cμ之间,有其独立的D区和J区,形成一个特异的“簇”,排列方式为VH-Dτ-Jτ-Cτ-Dμ/δ-Jμ/δ-Cμ-Cδ,而IgT2重链基因的排列方式尚不清楚。Hansen等[9] 2005年在虹鳟中鉴定出了IgT1,与斑马鱼IgT1相似,编码虹鳟IgT1重链的基因也位于VH和Cμ之间,也有其独立的D区和J区。Danilova等[10]在分析斑马鱼IgT1的同时,在虹鳟中发现了另一个IgT(IgT2)的重链基因片段,后来笔者在虹鳟中证实了IgT2的存在并发现了第三个IgT(IgT3)[14]。IgT1、IgT2和IgT3的重链都含有4个Cτ结构域,其基因座中ighτ3位于ighτ1上游,具有独立的V、D、J基因片段,但ighτ2与 ighτ1和ighτ3的相对位置尚不清楚[14]。此后,草鱼[17]、鲤[15-16]、大西洋鲑[11-12]、太平洋蓝鳍金枪鱼[18]、团头鲂Megalobrama amblycephala[19]、大菱鲆Scophthalmus maximus[20]、牙鲆Paralichthys olivaceus[21]和舌齿鲈Dicentrarchus labrax[22]等硬骨鱼类的典型IgT陆续被鉴定。有趣的是,与大多数硬骨鱼类不同,大西洋鲑有2个相似的重链基因座IgH-A和IgH-B,共含8个ighτ。其ighτ的排列方式是多个V-D-J-C区段排列在一起构成一簇,即(VH-Dτ-Jτ-Cτ)n-VH-Dμ/δ-Jμ/δ-Cμ-Cδ,在IgH-A中有5个ighτ,在IgH-B中有3个ighτ,其Cτ分别为CτA-1~CτA-5和CτB-1~CτB-3,但只有CτA-4、CτA-5和CτB-2的基因序列是完整且有功能的,编码含有4个Cτ结构域的IgT-A4、IgT-A5和IgT-B2[11-12]。
1.2 短型IgT——具有2个或3个Cτ结构域的IgT
与典型IgT不同的是,在红鳍东方鲀Takifugu rubripes[23]、三棘刺鱼Gasterosteus aculeatus[24-25]、香鱼Plecoglossus altivelis[26]、伯氏肩孔南极鱼Trematomus bernacchii[27]和南极鳕Notothenia coriiceps[27]等硬骨鱼类中发现了仅含有2个或3个Cτ结构域的IgT,本文中称之为短型IgT。
2005年,Savan等[23]首次在红鳍东方鲀中鉴定出1种仅编码2个Cτ结构域的ighτ,位于VH和Cμ之间,与斑马鱼ighτ1排列方式相似,结构域分析表明,由这种缺失了Cτ2和Cτ3结构域的IgH链组成的Ig为短型IgT。2010年,Gambón-Deza等[25]发现,三棘刺鱼IgH基因发生了复制,其基因座排列方式为(VH-Dτ-Jτ-Cτ-Dμ/δ-Jμ/δ-Cμ-Cδ)3-VH-Dτ-Jτ-Cτ,共编码4种不同IgT(IgT1、IgT2、IgT3和IgT4)的重链。这4种IgT重链的氨基酸序列一致性高达95%,且都只含有3个Cτ结构域,即Cτ1-Cτ3-Cτ4,为缺失了Cτ2结构域的短型IgT[24]。2015年,Kato等[26]在香鱼中发现了另一种短型IgT,其Cτ结构域的组成为Cτ1-Cτ2-Cτ4,缺失了Cτ3结构域。此后,研究者在伯氏肩孔南极鱼和南极鳕中也发现了只有3个Cτ结构域的短型IgT[27]。
1.3 嵌合型IgT——CH结构域由Cμ和Cτ嵌合而成的IgT
除了上述典型IgT和短型IgT,目前还在鲤[28]、草鱼[17,29]、尼罗罗非鱼Oreochromis niloticus[30]和斑点雀鳝Lepisosteus oculatus[31]中发现了CH结构域由Cμ和Cτ嵌合而成的嵌合型IgT,本文中将其命名为IgMT。
在鲤中发现了1种IgMT,其重链包含2个CH结构域,其中CH1与鲤Cμ1高度相似,而CH2与斑马鱼的Cτ4高度相似,因此,其CH结构域的组成为Cμ1-Cτ4[28]。在草鱼中发现了2种类型的IgMT,本文中分别命名为IgMT1[29]和IgMT2[17]。IgMT1有4个CH结构域,其 CH1和CH2分别与草鱼的Cμ1和Cμ2具有很高的序列一致性,而CH3和CH4分别与草鱼的Cτ3和Cτ4具有很高的序列一致性,因此,其CH结构域的组成为Cμ1-Cμ2-Cτ3-Cτ4;IgMT2只有2个CH结构域,CH1与草鱼Cμ1的序列一致性最高,CH2与草鱼Cτ4的序列一致性最高,因此,其CH结构域的组成为Cμ1-Cτ4。在尼罗罗非鱼中发现了1种IgMT,其重链包含2个CH结构域[30],笔者分析发现,其CH结构域的组成也为Cμ1-Cτ4。在斑点雀鳝中发现了2种IgMT[31],其中一种重链含有4个CH结构域(Cμ1-Cτ2-Cτ3-Cτ4),另一种重链只含有3个CH结构域(Cμ1-Cτ3-Cτ4)。
2 IgT的免疫功能
IgT作为在硬骨鱼类中最新被发现的一类免疫球蛋白,研究其功能具有重要的理论和应用价值。近年来,有关IgT功能的研究表明,IgT既在黏膜免疫中发挥重要作用,又在一定程度上参与了系统免疫应答。
2.1 虹鳟中特异于黏膜免疫的IgT
黏膜组织和器官作为鱼类抵御病原感染的第一道防线,能否在局部完成特异性免疫应答一直是鱼类免疫学研究的重要课题。早期的研究表明,用微粒抗原反复口服免疫鱼后,在皮肤黏液和胆汁中发现了抗原特异性抗体,而在血清中很少发现抗原特异性抗体[32-34];而后,Rombout等[35]在研究鲤肠道免疫功能时,发现肠道巨噬细胞可能在局部或黏膜免疫应答中发挥重要作用。随着鱼类免疫学研究的不断深入,鱼类中存在不依赖于系统免疫的黏膜免疫系统的观点已深入人心,越来越多的学者认为,黏膜免疫系统可独立完成抗原摄取、递呈及抗体分泌,并且局部的免疫应答对抵御病原的入侵起着重要作用[36]。
在IgT被发现之前,人们普遍认为IgM是鱼体对病原做出应答的唯一免疫球蛋白类型,然而2010年笔者发现,虹鳟IgT在肠道黏膜免疫中发挥了比IgM更重要的功能,在虹鳟中是一种特异于黏膜免疫的免疫球蛋白类型[8]。主要有3点证据:
1)IgT主要存在于肠黏液中,肠黏液中IgT的浓度是血清中的两倍,并且肠黏液中IgT与IgM含量的比值是血清中的63倍,而IgM主要存在于血清中;虹鳟的IgT在血清中是以单体形式存在,而在肠黏液中主要以多聚体的形式存在;肠组织中的IgT能与多聚免疫球蛋白受体(pIgR)结合,继而由pIgR转运穿过肠上皮细胞进入到肠腔中的黏液行使功能[8],这一机制与哺乳动物中pIgR转运IgA类似[37-38]。
2)虹鳟中存在一种仅表达IgT的IgT+ B细胞类群,寄生虫感染后肠组织中IgT+ B细胞的数量增加了4.8倍,肠黏液中IgT的含量和抗体滴度分别升高了51倍和160倍[8],而肠组织中IgM+ B细胞的数量和肠黏液中IgM的含量均无明显变化,但血清中IgM的抗体滴度升高了1 264倍,说明IgT主要在黏膜免疫中发挥功能,而IgM主要在系统免疫中发挥功能[8]。
3)虹鳟肠道中48%细菌的表面包被有IgT,而仅24%细菌的表面包被有IgM[8]。因此,鱼类IgT与哺乳动物IgA相似,可在肠腔中结合细菌从而排阻细菌的侵染。后续研究表明,与肠道中结果一致,虹鳟IgT在皮肤、鳃、鼻腔和口咽腔等器官中发挥同等重要的黏膜免疫功能[39-45]。
最新研究表明,虹鳟IgT还在维持黏膜共生微生物稳态中发挥了重要的作用[46]。当耗竭掉IgT后,鳃黏液中细菌微生态发生紊乱,一些条件致病菌显著增加,鳃组织表面细菌发生易位,最终引发组织病变和炎症反应。随着IgT水平的恢复,鳃部细菌的类型及各类群比例也恢复到正常水平,黏膜免疫稳态重新恢复平衡,这揭示了鱼类IgT在防止病原菌入侵和维持黏膜共生微生物稳态中的重要功能。
2.2 功能多样化的IgT
与虹鳟IgT特异于黏膜免疫不同,斑马鱼两个IgT亚类的免疫功能显著分化,并具有一定的互补关系[47]。在细菌感染后,斑马鱼血清、皮肤黏液和鳃黏液中IgT1的浓度显著增加,感染7 d后分别增加了7倍、11倍和10倍,而IgT2在血清中未检测到表达,其浓度只在皮肤黏液和鳃黏液中显著增加,感染7 d后分别增加了43倍和27倍。与此对应的是,感染7 d后,IgT1+ B细胞在脾脏、头肾、外周血、鳃、皮肤和肠道中均有一定增加,尤其是在肠道、脾脏和头肾中增加最为显著,而IgT2+ B细胞则只在鳃、皮肤和肠道等黏膜相关淋巴组织中显著增加,而在头肾、脾脏和外周血中增加很少。这些结果表明,斑马鱼IgT1同时在系统免疫和黏膜免疫中发挥功能,而IgT2则更特异于黏膜免疫[47]。
与研究斑马鱼的结果类似,对鲤IgT的初步研究表明,鲤IgT(原文中命名为IgZ1)在系统免疫器官(胸腺、脾脏和体肾)中的mRNA表达量要高于嵌合体IgMT(原文中命名为IgZ2),而IgMT在黏膜免疫组织(肠和鳃)中的mRNA表达量则要高于IgT[15],这表明鲤IgT可能在系统免疫中发挥更重要的作用,而IgMT可能在黏膜免疫中行使更重要的功能,但仍需要在蛋白和细胞水平的深入研究才能下此定论。
此外,对斑马鱼的最新研究表明,斑马鱼IgT1是重要的母源免疫抗体,在卵巢中高表达,可通过鱼卵传递给后代,对胚胎起到重要的免疫保护作用,而IgM在卵巢和受精卵中均未检测到表达。另外,还可以通过免疫雌性亲鱼来提高受精卵和子代胚胎中抗原特异性IgT1的浓度,从而实现母源免疫[48]。
3 IgT的起源和演化
自IgT被发现至今,只在真骨下纲Teleostei鱼类中发现了IgT的存在,关于IgT的起源还没有一致清晰的描述。近期,Mirete-Bachiller等[31]通过开发一个用于识别编码鱼类免疫球蛋白CH结构域外显子的机器学习软件CHfinder(https://github.com/compimmuno/CHfinder)对辐鳍鱼纲Actinopterygii基因组进行了系统筛查,在全骨下纲Holostei鱼类中发现了IgT的存在,并对IgT的起源进行了阐述。该研究在斑点雀鳝和弓鳍鱼Amia calva基因组中发现了编码4个CH结构域的ighτ,并在斑点雀鳝中发现了另一个只编码3个CH结构域的ighτ,这一发现表明,新鳍亚纲Neopterygii(亦称硬骨鱼亚纲,隶属于辐鳍鱼纲)都具有含4个CH结构域的IgT,打破了IgT只存在于真骨下纲的范式。此外,通过CHfinder发现,辐鳍鱼纲中约有三分之一的鱼类中没有ighτ,包括之前报道不存在IgT的斑点叉尾鮰Ictalurus punctatus和青鳉Oryzias latipes[49-50],这表明ighτ在部分硬骨鱼亚纲鱼类中存在丢失现象。通过CHfinder也没有在多鳍鱼目Polypteriformes和鲟形目Acipenseriformes(均属于辐鳍鱼纲之软骨硬鳞亚纲Chondrostei)这两个古老的类群中发现ighτ的同源基因,这似乎可以证明IgT与硬骨鱼亚纲的出现相一致,起源于距今大约300万年的晚二叠纪(Permian)。早期研究认为,ighτ是通过ighμ的复制而产生,然而这项研究表明,IgT的CH1结构域与IgM的CH1结构域同源,CH2和CH3结构域分别与板鳃亚纲Elasmobranchii(隶属于软骨鱼纲Chondrichthyes)的IgW和IgNAR的CH2和CH3结构域同源性更高,然而CH4结构域与IgM、IgW和IgNAR的差异都较大,表明IgT应具有更古老的起源[31]。
4 存在问题及展望
4.1 硬骨鱼类IgT研究中存在的问题
自2005年以来,有关硬骨鱼类IgT的研究取得了一定进展,已经在多种硬骨鱼类中发现了IgT及其亚类,并且对少数硬骨鱼类IgT的功能进行了深入研究。尽管如此,有关IgT的研究还远未结束,仍然存在许多未知的问题等待进一步解析。
1)不同硬骨鱼类中IgT基因的数量存在较大差异,如大西洋鲑8个IgT重链基因中只有3个基因是完整且有功能的,在三棘刺鱼中发现了4个IgT重链基因,在虹鳟中也发现了3个IgT及其重链基因,但是同一物种存在多个功能性IgT的生物学意义尚不明确。
2)在多种硬骨鱼类中发现了只含有3个甚至是2个CH结构域的短型IgT,以及含有2个(Cμ1-Cτ4)、3个(Cμ1-Cτ3-Cτ4)和4个(Cμ1-Cμ2-Cτ3-Cτ4或Cμ1-Cτ2-Cτ3-Cτ4)CH结构域的嵌合型IgT,但这些短型IgT和各种嵌合型IgT的重链产生机制及其生物学意义还有待阐明。
3)虹鳟存在3个IgT,且早期制备的单克隆抗体能同时识别这3个IgT的重链,表明虹鳟3个IgT可能都是特异于黏膜免疫的免疫球蛋白。然而,斑马鱼的2个IgT中只有IgT2更特异于黏膜免疫,IgT1则同时在系统免疫和黏膜免疫中行使功能,那么同一物种中多个IgT存在系统免疫和黏膜免疫的功能分化是否为普遍现象,目前尚不清楚。
4.2 未来重点研究方向
针对硬骨鱼类IgT的研究现状,提出未来应在以下几方面重点开展研究。
1)IgT的功能有待进一步研究。到目前为止,对于IgT的功能研究还很局限,仅虹鳟和斑马鱼IgT的功能研究较为透彻,许多鱼类的IgT,尤其是短型IgT和嵌合型IgMT针对不同病原的免疫应答规律,以及同一物种中多个IgT是否存在系统免疫和黏膜免疫的功能分化等都还不清楚,亟待进一步研究。
2)IgT重链的基因结构及其产生机制有待进一步研究。免疫球蛋白重链恒定区是重要的功能区,典型、短型和嵌合型IgT的重链恒定区组成差异较大,阐明其重链的基因结构及其产生机制将有助于深入研究IgT的免疫功能。
3)鱼类中是否普遍存在独特表达IgT或其亚类的B细胞有待进一步研究。由于硬骨鱼类没有类别转换,因此,从B细胞层面阐明IgT及其亚类的来源和应答规律,将有助于全面认识IgT在适应性免疫应答中的作用。
4)鱼类IgT的Fc受体(FcτR)的鉴定有待开展。如果鱼类IgT功能的行使也像哺乳类免疫球蛋白一样需要其Fc受体来介导,那么FcτR的鉴定工作就非常值得去开展。而且,鱼类IgT各亚类是否通过不同FcτR介导分别行使不同免疫功能也值得深入研究。
总的来说,关于IgT的认识还比较粗浅,还有很多未知的科学问题亟待人们去探索。对IgT功能的全面解析不仅有助于提高人们对鱼类免疫系统及脊椎动物免疫球蛋白演化的认知水平,还将对鱼类黏膜疫苗的开发和应用产生重要的理论支撑和技术推动作用。
[1] FLAJNIK M F.Comparative analyses of immunoglobulin genes:surprises and portents[J].Nature Reviews Immunology,2002,2(9):688-698.
[2] WARR G W.The immunoglobulin genes of fish[J].Developmental and Comparative Immunology,1995,19(1):1-12.
[3] 肖凡书,聂品.鱼类免疫球蛋白重链基因与基因座的研究进展[J].水产学报,2010,34(10):1617-1628.
XIAO F S,NIE P.Immunoglobulin heavy chain genes and their loci in fish:progress and perspectives[J].Journal of Fisheries of China,2010,34(10):1617-1628.(in Chinese)
[4] AMZEL L M,POLJAK R J.Three-dimensional structure of immunoglobulins[J].Annual Review of Biochemistry,1979,48:961-997.
[5] PARRA D,TAKIZAWA F,SUNYER J O.Evolution of B cell immunity[J].Annual Review of Animal Biosciences,2013,1:65-97.
[6] ROMBOUT J W,BLOK L J,LAMERS C H,et al.Immunization of carp(Cyprinus carpio)with a Vibrio anguillarum bacterin:indications for a common mucosal immune system[J].Developmental and Comparative Immunology,1986,10(3):341-351.
[7] SUNYER J O.Fishing for mammalian paradigms in the teleost immune system[J].Nature Immunology,2013,14(4):320-326.
[8] ZHANG Y A,SALINAS I,LI J,et al.IgT,a primitive immunoglobulin class specialized in mucosal immunity[J].Nature Immunology,2010,11(9):827-835.
[9] HANSEN J D,LANDIS E D,PHILLIPS R B.Discovery of a unique Ig heavy-chain isotype(IgT)in rainbow trout:implications for a distinctive B cell developmental pathway in teleost fish[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(19):6919-6924.
[10] DANILOVA N,BUSSMANN J,JEKOSCH K,et al.The immunoglobulin heavy-chain locus in zebrafish:identification and expression of a previously unknown isotype,immunoglobulin Z[J].Nature Immunology,2005,6(3):295-302.
[11] YASUIKE M,DE BOER J,VON SCHALBURG K R,et al.Evolution of duplicated IgH loci in Atlantic salmon,Salmo salar[J].BMC Genomics,2010,11:486.
[12] TADISO T M,LIE K K,HORDVIK I.Molecular cloning of IgT from Atlantic salmon,and analysis of the relative expression of τ,μ,and δ in different tissues[J].Veterinary Immunology and Immunopathology,2011,139(1):17-26.
[13] HU Y L,XIANG L X,SHAO J Z.Identification and characterization of a novel immunoglobulin Z isotype in zebrafish:implications for a distinct B cell receptor in lower vertebrates[J].Molecular Immunology,2010,47(4):738-746.
[14] ZHANG N,ZHANG X J,CHEN D D,et al.Molecular characterization and expression analysis of three subclasses of IgT in rainbow trout(Oncorhynchus mykiss)[J].Developmental and Comparative Immunology,2017,70:94-105.
[15] RYO S,WIJDEVEN R H M,TYAGI A,et al.Common carp have two subclasses of bonyfish specific antibody IgZ showing differential expression in response to infection[J].Developmental and Comparative Immunology,2010,34(11):1183-1190.
[16] ZHANG F M,LI M J,LV C,et al.Molecular characterization of a new IgZ3 subclass in common carp(Cyprinus carpio)and comparative expression analysis of IgH transcripts during larvae development[J].BMC Veterinary Research,2021,17(1):159.
[17] 肖凡书,许巧情,王欣欣,等.草鱼的两种新型免疫球蛋白基因IgZ-2和IgM-IgZ[J].水产学报,2010,34(12):1891-1900.
XIAO F S,XU Q Q,WANG X X,et al.Novel immunoglobulin heavy chain genes,IgZ-2 and IgM-IgZ in grass carp(Ctenopharyngodon idellus)[J].Journal of Fisheries of China,2010,34(12):1891-1900.(in Chinese)
[18] MASHOOF S,POHLENZ C,CHEN P L,et al.Expressed IgH μ and τ transcripts share diversity segment in ranched Thunnus orientalis[J].Developmental and Comparative Immunology,2014,43(1):76-86.
[19] XIA H,LIU W J,WU K,et al.sIgZ exhibited maternal transmission in embryonic development and played a prominent role in mucosal immune response of Megalabrama amblycephala[J].Fish & Shellfish Immunology,2016,54:107-117.
[20] TANG X Q,DU Y,SHENG X Z,et al.Molecular cloning and expression analyses of immunoglobulin tau heavy chain(IgT)in turbot,Scophthalmus maximus[J].Veterinary Immunology and Immunopathology,2018,203:1-12.
[21] DU Y,TANG X Q,ZHAN W B,et al.Immunoglobulin tau heavy chain(IgT)in flounder,Paralichthys olivaceus:molecular cloning,characterization,and expression analyses[J].International Journal of Molecular Sciences,2016,17(9):1571.
[22] PICCHIETTI S,BUONOCORE F,ORTIZ N N,et al.IgT and IgD from sea bass(Dicentrarchus labrax):localization of expressing and immunoreactive cells in lymphoid tissues[J].Fish & Shellfish Immunology,2016,53:77.
[23] SAVAN R,AMAN A,SATO K,et al.Discovery of a new class of immunoglobulin heavy chain from fugu[J].European Journal of Immunology,2005,35(11):3320-3331.
[24] BAO Y H,WANG T,GUO Y C,et al.The immunoglobulin gene loci in the teleost Gasterosteus aculeatus[J].Fish & Shellfish Immunology,2010,28(1):40-48.
[25] GAMB N-DEZA F,S
N-DEZA F,S NCHEZ-ESPINEL C,MAGAD
NCHEZ-ESPINEL C,MAGAD N-MOMP
N-MOMP S.Presence of an unique IgT on the IGH locus in three-spined stickleback fish(Gasterosteus aculeatus)and the very recent generation of a repertoire of VH genes[J].Developmental and Comparative Immunology,2010,34(2):114-122.
S.Presence of an unique IgT on the IGH locus in three-spined stickleback fish(Gasterosteus aculeatus)and the very recent generation of a repertoire of VH genes[J].Developmental and Comparative Immunology,2010,34(2):114-122.
[26] KATO G,TAKANO T,SAKAI T,et al.Cloning and expression analyses of a unique IgT in ayu Plecoglossus altivelis[J].Fisheries Science,2015,81(1):29-36.
[27] GIACOMELLI S,BUONOCORE F,ALBANESE F,et al.New insights into evolution of IgT genes coming from Antarctic teleosts[J].Marine Genomics,2015,24 Pt 1:55-68.
[28] SAVAN R,AMAN A,NAKAO M,et al.Discovery of a novel immunoglobulin heavy chain gene chimera from common carp(Cyprinus carpio L.)[J].Immunogenetics,2005,57(6):458-463.
[29] XIAO F S,WANG Y P,YAN W,et al.Ig heavy chain genes and their locus in grass carp Ctenopharyngodon idella[J].Fish & Shellfish Immunology,2010,29(4):594-599.
[30] VEL ZQUEZ J,ACOSTA J,LUGO J M,et al.Discovery of immunoglobulin T in Nile tilapia(Oreochromis niloticus):a potential molecular marker to understand mucosal immunity in this species[J].Developmental and Comparative Immunology,2018,88:124-136.
ZQUEZ J,ACOSTA J,LUGO J M,et al.Discovery of immunoglobulin T in Nile tilapia(Oreochromis niloticus):a potential molecular marker to understand mucosal immunity in this species[J].Developmental and Comparative Immunology,2018,88:124-136.
[31] MIRETE-BACHILLER S,OLIVIERI D N,GAMB N-DEZA F.Immunoglobulin T genes in Actinopterygii[J].Fish & Shellfish Immunology,2021,108:86-93.
N-DEZA F.Immunoglobulin T genes in Actinopterygii[J].Fish & Shellfish Immunology,2021,108:86-93.
[32] FLETCHER T C,WHITE A.Antibody production in the plaice(Pleuronectes platessa L.)after oral and parenteral immunization with Vibrio anguillarum antigens[J].Aquaculture,1972,1:417-428.
[33] ROMBOUT J,BERG A A,BERG C,et al.Immunological importance of the second gut segment of carp.III.Systemic and/or mucosal immune responses after immunization with soluble or particulate antigen[J].Journalof Fish Biology,1989,35(2):167-178.
[34] KAWAI K J,KUSUDA R,ITAMI T.Mechanisms of protection in ayu orally vaccinated for vibriosis[J].Fish Pathology,1981,15(3/4):257-262.
[35] ROMBOUT J H,TAVERNE-THIELE A J,VILLENA M I.The gut-associated lymphoid tissue(GALT)of carp(Cyprinus carpio L.):an immunocytochemical analysis[J].Developmental and Comparative Immunology,1993,17(1):55-66.
[36] LIN S H,DAVIDSON G A,SECOMBES C J,et al.Use of a lipid-emulsion carrier for immunisation of dab(Limanda limanda)by bath and oral routes:an assessment of systemic and mucosal antibody responses[J].Aquaculture,2000,181(1/2):11-24.
[37] ORLANS E,PEPPARD J,REYNOLDS J,et al.Rapid active transport of immunoglobulin A from blood to bile[J].The Journal of Experimental Medicine,1978,147(2):588-592.
[38] ORLANS E,PEPPARD J,FRY J F,et al.Secretory component as the receptor for polymeric IgA on rat hepatocytes[J].The Journal of Experimental Medicine,1979,150(6):1577-1581.
[39] XU Z,PARRA D,G MEZ D,et al.Teleost skin,an ancient mucosal surface that elicits gut-like immune responses[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(32):13097-13102.
MEZ D,et al.Teleost skin,an ancient mucosal surface that elicits gut-like immune responses[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(32):13097-13102.
[40] XU Z,TAKIZAWA F,PARRA D,et al.Mucosal immunoglobulins at respiratory surfaces mark an ancient association that predates the emergence of tetrapods[J].Nature Communications,2016,7:10728.
[41] TACCHI L,MUSHARRAFIEH R,LARRAGOITE E T,et al.Nasal immunity is an ancient arm of the mucosal immune system of vertebrates[J].Nature Communications,2014,5:5205.
[42] YU Y Y,KONG W G,YIN Y X,et al.Mucosal immunoglobulins protect the olfactory organ of teleost fish against parasitic infection[J].PLoS Pathogens,2018,14(11):e1007251.
[43] DONG F,YIN G M,MENG K F,et al.IgT plays a predominant role in the antibacterial immunity of rainbow trout olfactory organs[J].Frontiers in Immunology,2020,11:583740.
[44] KONG W G,YU Y Y,DONG S,et al.Pharyngeal immunity in early vertebrates provides functional and evolutionary insight into mucosal homeostasis[J].Journal of Immunology,2019,203(11):3054-3067.
[45] YU Y Y,KONG W G,XU H Y,et al.Convergent evolution of mucosal immune responses at the buccal cavity of teleost fish[J].iScience,2019,19:821-835.
[46] XU Z,TAKIZAWA F,CASADEI E,et al.Specialization of mucosal immunoglobulins in pathogen control and microbiota homeostasis occurred early in vertebrate evolution[J].Science Immunology,2020,5(44):eaay3254.
[47] JI J F,HU C B,SHAO T,et al.Differential immune responses of immunoglobulin Z subclass members in antibacterial immunity in a zebrafish model[J].Immunology,2021,162(1):105-120.
[48] JI J F,HU C B,ZHANG N,et al.New insights into IgZ as a maternal transfer ig contributing to the early defense of fish against pathogen infection[J].Journal of Immunology,2021,206(9):2001-2014.
[49] BENGT N E,QUINIOU S M A,STUGE T B,et al.The IgH locus of the channel catfish,Ictalurus punctatus,contains multiple constant region gene sequences:different genes encode heavy chains of membrane and secreted IgD[J].Journal of Immunology,2002,169(5):2488-2497.
N E,QUINIOU S M A,STUGE T B,et al.The IgH locus of the channel catfish,Ictalurus punctatus,contains multiple constant region gene sequences:different genes encode heavy chains of membrane and secreted IgD[J].Journal of Immunology,2002,169(5):2488-2497.
[50] MAGAD N-MOMP
N-MOMP S,S
S,S NCHEZ-ESPINEL C,GAMB
NCHEZ-ESPINEL C,GAMB N-DEZA F.Immunoglobulin heavy chains in medaka(Oryzias latipes)[J].BMC Evolutionary Biology,2011,11:165.
N-DEZA F.Immunoglobulin heavy chains in medaka(Oryzias latipes)[J].BMC Evolutionary Biology,2011,11:165.