裙带菜Undaria pinnatifida Suringar属褐藻门Phaeophyta褐藻纲Phaeophyceae海带目Laminariales翅藻科Pteridophytae裙带菜属Undaria[1],俗称海芥菜、裙带,素有健康菜、绿色海参之美称,主要分布于辽宁沿海和山东部分地区。裙带菜具有很高的经济价值,含有丰富的蛋白质、维生素和矿物质,同时还含有褐藻酸、甘露醇、褐藻糖胶、高不饱和脂肪酸、岩藻黄素等多种具有独特生理功能的活性成分[2]。裙带菜尤其是孢子叶富含岩藻聚糖硫酸酯,岩藻聚糖硫酸酯也称褐藻糖胶、岩藻多糖,是褐藻和某些棘皮动物中特有的一种含有硫酸基的天然活性多糖。岩藻聚糖硫酸酯具有免疫调节、抗肿瘤、抗氧化、增加肠道益生菌[3]、降血脂[4]、抗血管生成[5]、抑制α-葡萄糖苷酶活性[6]等多重生物活性。近年来,岩藻聚糖硫酸酯的抗炎活性已成为一个研究热点,但是岩藻聚糖硫酸酯分子量大不利于生物体吸收,难以进行消化[7],且从不同藻类中提取的多糖,其化学成分及结构也不同,由于其复杂性,在一定程度上削弱了其所具有的生物活性,也限制了岩藻聚糖硫酸酯在各领域中的应用[8],因此,对更易吸收且结构相对简单的岩藻寡糖的相关研究便逐渐兴起。
岩藻寡糖是将岩藻聚糖硫酸酯通过降解得到的一种低分子聚合物,岩藻寡糖分子量小、溶解性强、能够较好地被生物体吸收,具有免疫调节、抗肿瘤、抗氧化、抗炎、抗病毒等生物活性[9]。但目前岩藻寡糖的制备工艺和开发利用程度还远远不足。常用的岩藻寡糖制备方法有物理降解法、生物降解法和化学降解法。其中,物理降解法操作方便简单、无污染,是一种绿色的制备方法,但该方法制备产率较低且降解效果较差;生物降解法具有绿色环保、产率高、均一性好、反应温和等优势,但目前制备寡糖的优势酶筛选困难且酶解条件仍未确定;化学降解法在岩藻聚糖硫酸酯的降解中引入最早,应用较为普遍,但反应较为剧烈易造成降解不稳定或硫酸基的断裂等问题,所以需对降解条件进行细致优化。
为了有效降解裙带菜岩藻聚糖硫酸酯,并探究其降解产物的抗炎活性,本研究中通过酸解法降解裙带菜岩藻聚糖硫酸酯得到包含岩藻寡糖的降解产物,利用薄层色谱法测定其聚合度并确定其最佳降解条件,利用膜分离技术获得不同分子量的降解产物,测定各组分的总糖含量及硫酸基团含量,并分析酸解裙带菜岩藻聚糖硫酸酯及降解产物对巨噬细胞免疫调节的影响,以期为裙带菜岩藻寡糖的制备及应用提供科学参考。
1 材料与方法
1.1 材料
原料:裙带菜岩藻聚糖硫酸酯(fucoidan,F)来自国家海藻加工技术研发分中心(大连)。
试剂:寡糖标准品购自Sigma公司,ELISA试剂盒、CCK-8试剂、无水对氨基苯磺酸、盐酸萘乙二胺、DMEM培养基、脂多糖、胎牛血清等均购自生工生物工程(上海)股份有限公司。
主要仪器设备:101-2-BS电热恒温鼓风干燥箱(上海跃进医疗器械厂)、FD-4冷冻干燥机(北京博医康实验仪器有限公司)、CL-1A磁力搅拌器(巩义市予华仪器有限公司)、25 μL微量进样器(上海高鸽工贸有限公司)、354酶标仪(Thermo Fisher)、721型分光光度计(上海光谱仪器有限公司)、371 CO2培养箱(Thermo Fisher Scientific LLC)、Sartorius普及型pH计(赛多利斯科学仪器北京有限公司)。
1.2 方法
1.2.1 酸解裙带菜岩藻聚糖硫酸酯工艺优化 采用酸解法,将裙带菜岩藻聚糖硫酸酯(利用复合酶酶解-热水浸提法[10]提取)溶于稀盐酸中,分别在不同温度条件下酸解后取出并冷却至室温,用氢氧化钠调至中性后放入冰箱中冷冻后再放入冻干机中进行冷冻干燥,得到冻干粉。
酸解温度设置为90、95、100、105、110 ℃,时间设置为2、3、4 h,酸解液pH设置为2、3、4。先采用全因子试验,再采用单因素试验设计优化酸解法降解裙带菜岩藻聚糖硫酸酯的工艺。
1.2.2 裙带菜岩藻聚糖硫酸酯降解产物检测 采用薄层色谱法(TLC)[11],分别称取0.01 g寡糖标准品和岩藻聚糖硫酸酯降解产物混合样品溶于1 mL去离子水中,在100 ℃活化30 min后的硅胶板上进行点样,点样量为5 μL,用展开剂(甲醇、正丁醇、水三者的体积比为6∶4∶1)进行展开,用显色剂(苯胺-二苯胺)进行显色,置于105 ℃烘箱烘烤5~6 min,观察显色情况。
1.2.3 裙带菜岩藻聚糖硫酸酯降解产物的分离 采用膜分离法[12],将酸解制得的裙带菜岩藻聚糖硫酸酯降解产物混合液由大到小依次通过不同膜通量的膜组件分离,分别得到相对分子质量范围为400~1 000 (F1)、1 000~3 500 (F2)、3 500~5 000 (F3)、5 000~10 000 (F4)及10 000 以上(F5)5个组别的降解产物,其中F1、F2为岩藻寡糖。
1.2.4 裙带菜岩藻聚糖硫酸酯及降解产物纯度测定
总糖含量:取F及F1~F5样品配制成0.05 mg/mL的溶液,采用苯酚-硫酸法[13]进行测定。硫酸基团含量:取0.1 g F及F1~F5样品加入10 mL 2 mol/L的HCl,采用氯化钡明胶法[14]进行测定。
1.2.5 岩藻聚糖硫酸酯及降解产物对巨噬细胞抗炎活性的影响
1)对RAW264.7细胞活力的影响。采用CCK-8法[15],在450 nm波长下测定含F及F1~F5样品的试验组、不含样品的调零组及不含细胞与样品的空白组的吸光度值。细胞存活率计算公式为
细胞存活率=[(试验组OD值-空白组OD值)/(调零组OD值-空白组OD值)]×100%。
通过上述公式计算出各分子量样品组的细胞存活率,从而反映岩藻聚糖硫酸酯及降解产物对RAW264.7巨噬细胞活力的影响。
2)对LPS诱导RAW264.7细胞释放NO的影响。NO不仅是一种调节炎症的介质,还是一种气体信号分子[16]。采用Griess法[17],在540 nm波长下测定F及F1~F5样品组、空白组及阴性对照组的吸光度值,绘制NO标准曲线。通过NO反应标准曲线计算出各样品组的NO浓度,从而反映RAW264.7细胞释放NO的能力大小。
3)对LPS诱导RAW264.7细胞分泌炎症因子1L-1β、1L-6、1L-10和TNF-α的影响。采用ELISA法[18-19],于450 nm波长下测定各样品组、空白组及阴性对照组的吸光度值。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示(n=3),采用SPSS 25.0软件对试验中所得的数据进行单因素方差分析,并用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 裙带菜岩藻聚糖硫酸酯酸解程度的检测
利用薄层色谱法对不同酸解条件下得到的降解产物进行检测。从图1可见:90、95、100、105、110 ℃降解温度下,样品在pH为2时有明显的条带出现,降解效果较好,说明pH对岩藻聚糖硫酸酯降解有影响,酸解液pH值小的降解效果较好;时间与温度因素对降解的影响不大,但降解温度为110 ℃,pH为3、4,水解时间为3、4 h时的4个组经过高温长时间的处理能改善降解效果。对比发现,pH为2,水解时间为4 h,降解温度为90、95 ℃时的2个试验组得到的样品中寡糖含量较高,其次是降解温度为90~110 ℃,酸解液pH为2,水解时间为2、3、4 h的13个试验组,以及降解温度为110 ℃,pH为3、4,水解时间为3、4 h的4个试验组得到的样品中寡糖含量较低,剩余26组试验得到的样品中寡糖含量非常低(图1)。综上所述,降解温度为90、95 ℃,pH为2,水解4 h为降解制备优化条件,对于最优工艺的确定还需要进一步研究。
从图2可见,样品在pH为2的条件下分别在90、95 ℃下降解4 h后,A、B两组谱带趋势均有较好的稳定性,但B组条件下降解产物中的寡糖分子量更小。可以看出,在酸解液酸性较弱的条件下,在一定范围内升高降解温度可以提高降解岩藻聚糖硫酸酯的降解效果。由此得出,裙带菜岩藻聚糖硫酸酯最优酸解条件为95 ℃、pH 2、处理4 h。
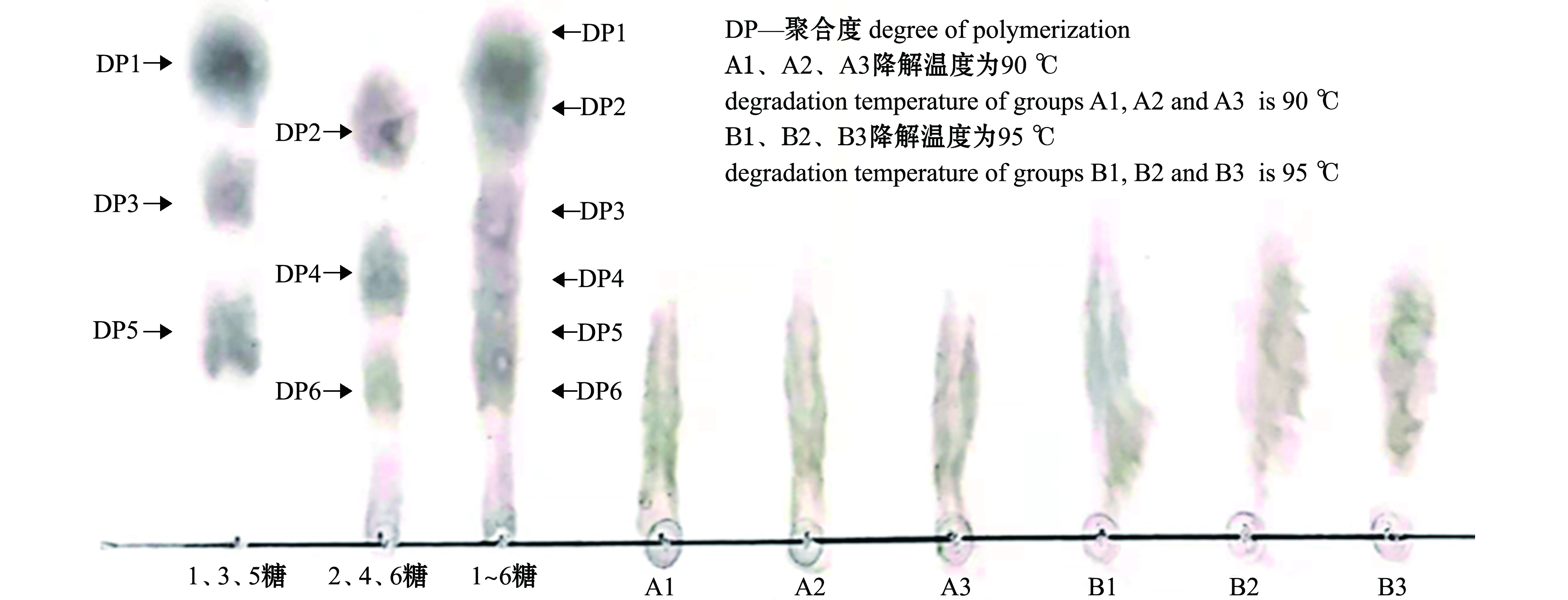
图2 90、95 ℃酸解温度条件下的降解产物薄层层析图谱(pH 2,处理4 h)
Fig.2 Thin-layer chromatograms of degradation products under 90 and 95 ℃ acidolysis temperatures(pH 2 for 4 h)

DP代表聚合度,单糖代表聚合度分别为3、5、7的寡糖,双糖代表聚合度分别为2、4、6的寡糖,混糖代表聚合度分别为2~7的寡糖。DP stands for degree of polymerization,monosaccharides are the oligosaccharides with polymerization degrees of 3,5 and 7,respectively,disaccharides are the oligosaccharides with polymerization degrees of 2,4 and 6,respectively,and mixed sugars are the oligosaccharides with polymerization degrees of 2-7,respectively.
图1 全因子试验优化酸解工艺条件的降解产物薄层层析图谱
Fig.1 Thin layer chromatogram of degradation products under optimization acid hydrolysis process conditions by full factor test
2.2 裙带菜岩藻聚糖硫酸酯及其降解产物成分
将酸解制得的裙带菜岩藻聚糖硫酸酯降解产物混合液依次通过截留相对分子量为10 000、5 000、3 500、1 000、400的膜组件进行分离,分别得到不同分子量段的5个组分,将5个不同分子量段的F1~F5组分冻干,并计算得率,再利用苯酚-硫酸法和氯化钡明胶法分别测定F及F1~F5组分的总糖含量和硫酸基团含量。从表1可见,裙带菜岩藻寡糖的总回收率为13.53%(F1与F2之和)。郭娟娟[20]利用酶法制备к-卡拉胶寡糖,以4 mL/min流速,1.0 g/mL上样浓度,1 mL进样体积,流动相为0.1 mol/L碳酸氢铵为最佳分离纯化参数,纯品得率为5.02%。经对比,此方法的寡糖纯度及得率比本试验中的低,由此可见,优化酸解工艺制备裙带菜岩藻寡糖效果较好,寡糖的损失率低且有效保留了硫酸基团。
表1 裙带菜岩藻聚糖硫酸酯及降解产物成分
Tab.1 Composition of fucoidan sulfate and oligosaccharide of sea mustard Undaria pinnatifid %
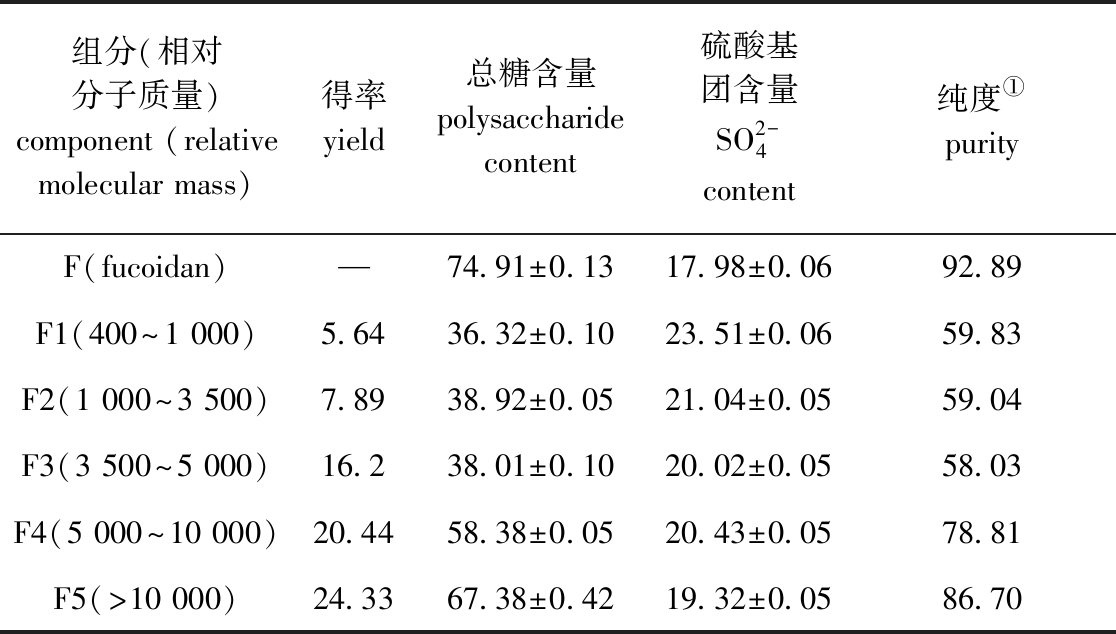
组分(相对分子质量)component (relative molecular mass)得率yield总糖含量polysaccharide content硫酸基团含量SO2-4content纯度①purityF(fucoidan)—74.91±0.1317.98±0.0692.89F1(400~1 000)5.6436.32±0.1023.51±0.0659.83F2(1 000~3 500)7.8938.92±0.0521.04±0.0559.04F3(3 500~5 000)16.238.01±0.1020.02±0.0558.03F4(5 000~10 000)20.4458.38±0.0520.43±0.0578.81F5(>10 000)24.3367.38±0.4219.32±0.0586.70
注:①纯度为总糖含量与硫酸基团含量的总和。
Note:①The purity is the sum of polysaccharide content and sulfate group content.
2.3 裙带菜岩藻聚糖硫酸酯及降解产物对巨噬细胞的抗炎活性
2.3.1 F及F1~F5组分对RAW264.7体外增殖活性的影响 从图3可见,不同质量浓度的F及F1~F5组分对细胞活力的影响有所不同,细胞活力随着质量浓度的升高总体上呈先增大后随之减小的趋势,当质量浓度为6.25~25、100~800 μg/mL时,各组分对巨噬细胞RAW264.7的体外增殖活性影响不大,当质量浓度为50 μg/mL时,对细胞活力有明显促进作用。因此,本试验中选用50 μg/mL作为后续F及F1~F5研究的计量浓度。
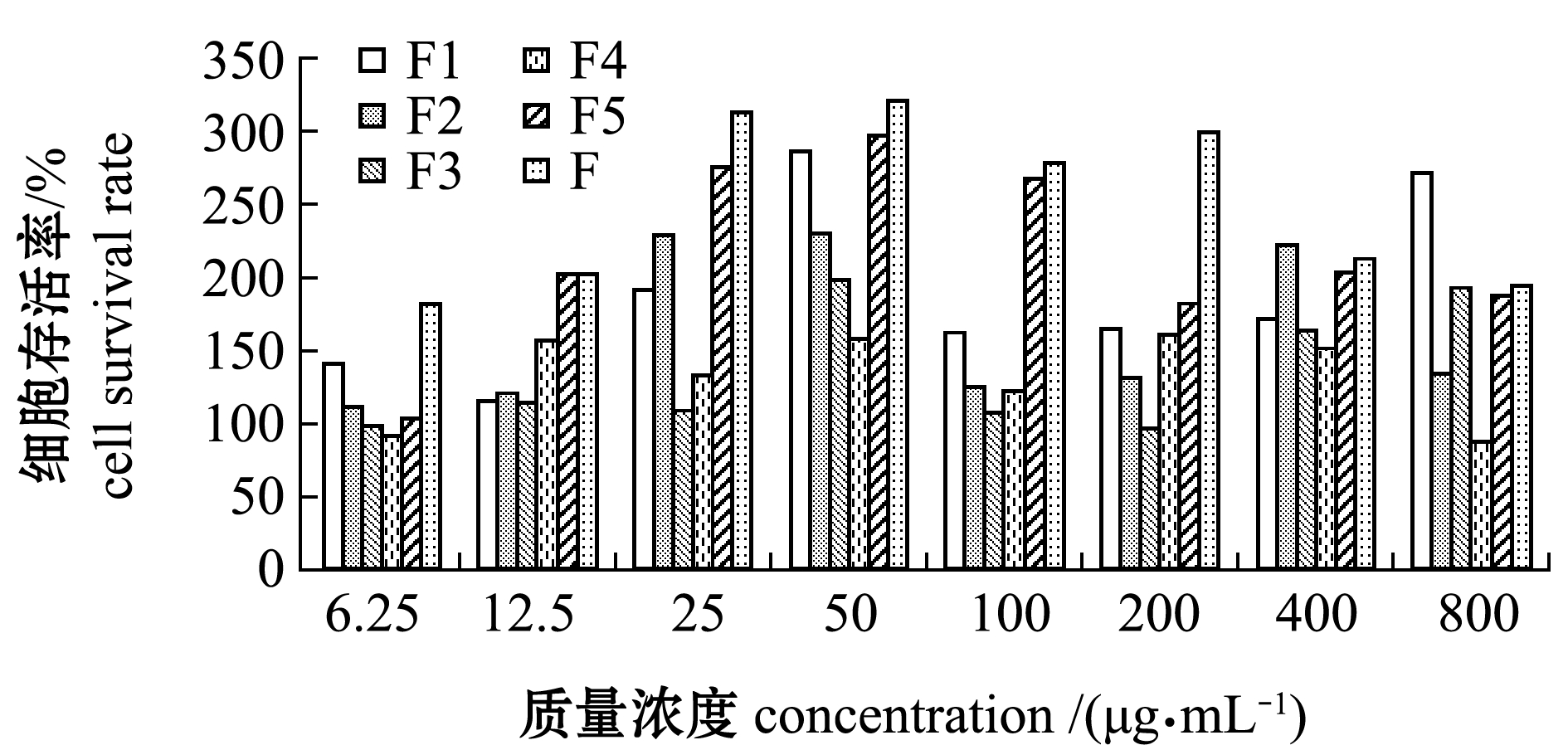
图3 裙带菜岩藻聚糖硫酸酯及降解产物对RAW264.7的体外增殖活性的影响
Fig.3 Effects of sea mustard Undaria pinnatifida fucoidan and its degration oligosaccharides on the proliferation activity of RAW264.7 in vitro
2.3.2 F及F1~F5组分对LPS诱导RAW264.7细胞NO释放量的影响 利用Griess法测定50 μg/mL浓度下F及F1~F5组分对LPS诱导RAW264.7细胞释放NO的影响。从图4可见,与空白对照组相比,LPS促使RAW264.7细胞被激活释放大量NO,而F及F1~F5组分可显著抑制NO的产生,其中F1组分的岩藻寡糖抑制NO产生的作用最为显著。这表明,低分子量裙带菜岩藻寡糖抑制LPS诱导RAW264.7细胞产生过量NO的效果优于多糖。
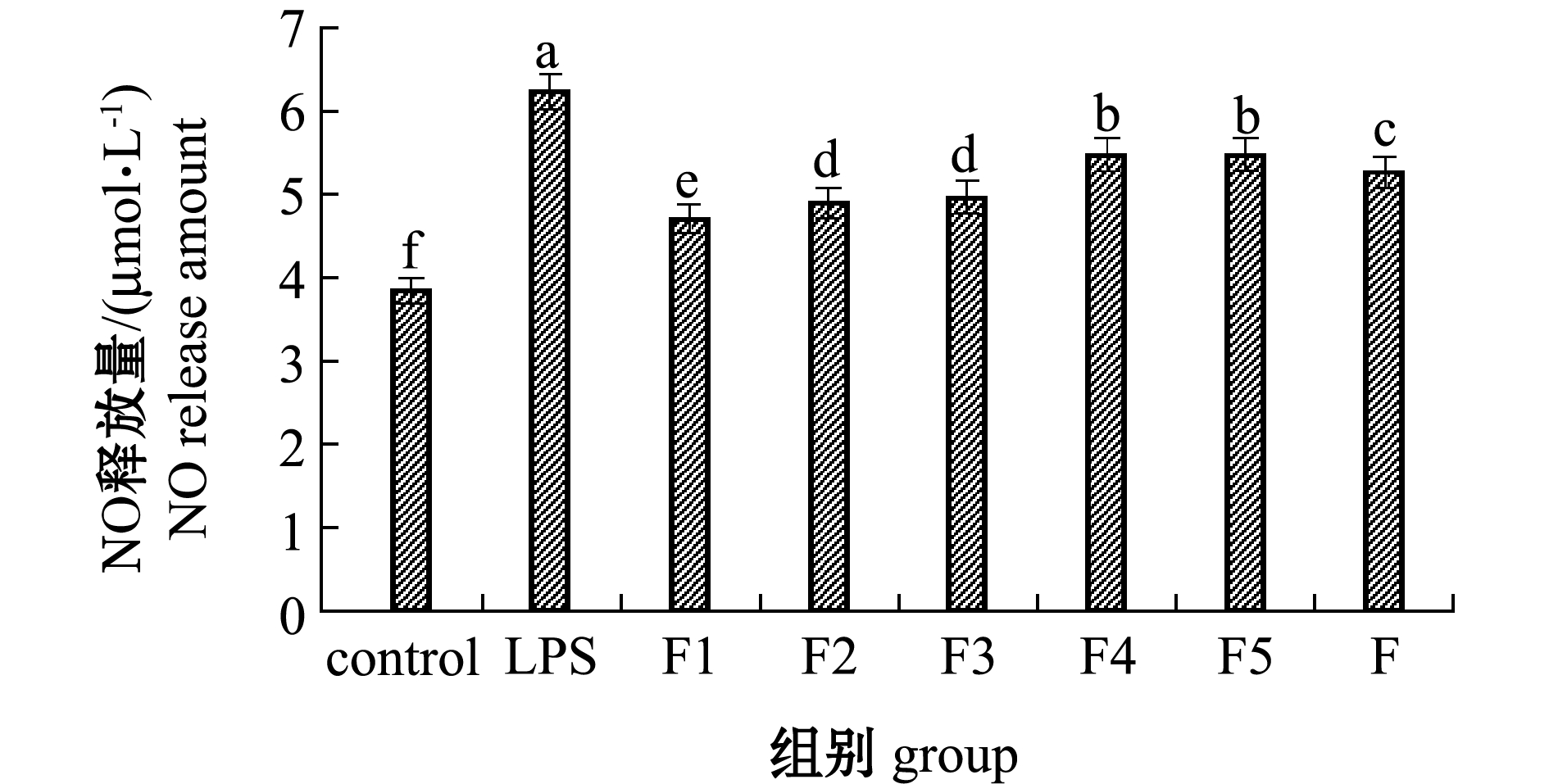
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。The means with different letters are significant differences in different groups at the 0.05 probability level,and the means with the same letter are not significant differences.
图4 岩藻聚糖硫酸酯及降解产物对LPS诱导RAW264.7细胞生成NO的影响
Fig.4 Effects of fucoidan and its degration oligosaccharides on NO production in RAW264.7 cells induced by LPS
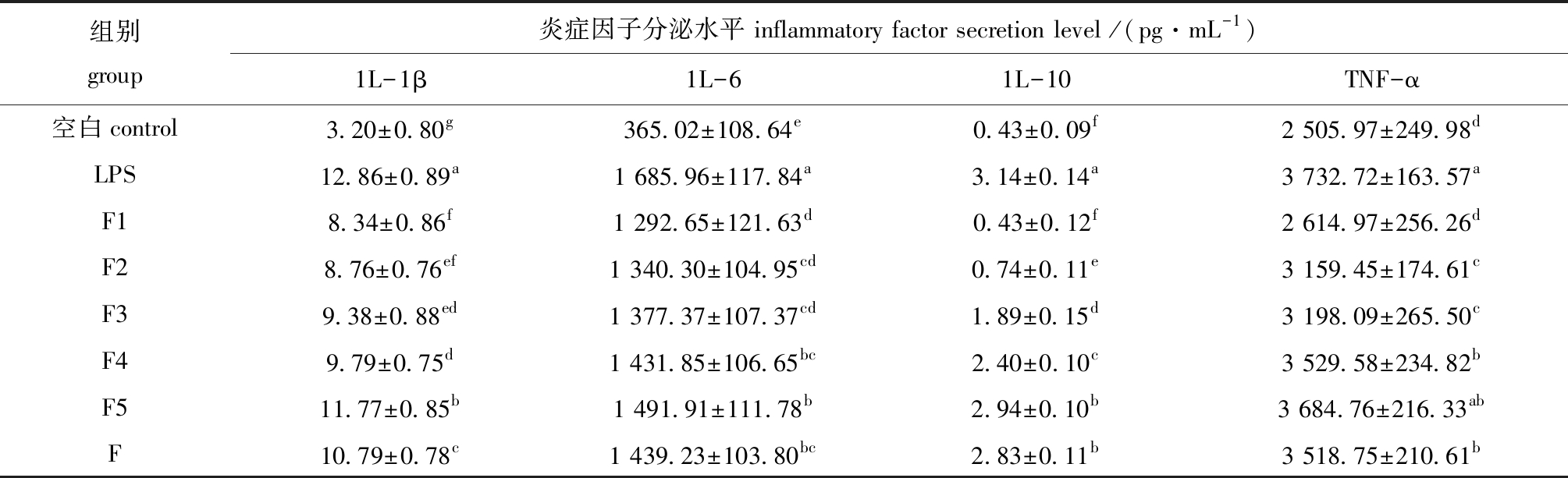
2.3.3 F及F1~F5组分对LPS诱导RAW264.7细胞分泌炎症因子1L-1β、1L-6、1L-10、TNF-α的影响 从表2可见,与空白组相比,LPS能够诱导RAW264.7巨噬细胞分泌大量1L-1β、1L-6、1L-10、TNF-α炎症因子,加入F及F1~F5组分能显著降低1L-1β、1L-6、1L-10炎症因子分泌水平(P<0.05),而加入低分子量的F1、F2、F3、F4、F能显著降低TNF-α炎症因子分泌水平(P<0.05),降低量随着岩藻聚糖硫酸酯分子量减小逐渐增大,其中岩藻寡糖F1对1L-1β、1L-6、1L-10、TNF-α炎症因子的分泌抑制效果最好,F1组1L-10、TNF-α炎症因子的释放水平与空白组效果无显著性差异(P>0.05),这说明添加F1可以使被LPS诱导的RAW264.7细胞分泌炎症因子1L-10、TNF-α恢复到空白水平,表明岩藻寡糖F1抗炎效果极好。
表2 岩藻聚糖硫酸酯及降解产物对LPS诱导RAW264.7细胞分泌炎症因子的影响
Tab.2 Effects of fucoidan and oligosaccharide on lPS-induced secretion of inflammatory cytokines in RAW264.7 cells
组别group炎症因子分泌水平 inflammatory factor secretion level /(pg·mL-1)1L-1β1L-61L-10TNF-α空白control3.20±0.80g365.02±108.64e0.43±0.09f2 505.97±249.98dLPS12.86±0.89a1 685.96±117.84a3.14±0.14a3 732.72±163.57aF18.34±0.86f1 292.65±121.63d0.43±0.12f2 614.97±256.26dF28.76±0.76ef1 340.30±104.95cd0.74±0.11e3 159.45±174.61cF39.38±0.88ed1 377.37±107.37cd1.89±0.15d3 198.09±265.50cF49.79±0.75d1 431.85±106.65bc2.40±0.10c3 529.58±234.82bF511.77±0.85b1 491.91±111.78b2.94±0.10b3 684.76±216.33abF10.79±0.78c1 439.23±103.80bc2.83±0.11b3 518.75±210.61b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters are significantly different at the 0.05 probability level,and the means with the same letter are not significant differences.
综上所述,通过ELISA法验证裙带菜岩藻聚糖硫酸酯及降解产物对LPS诱导RAW264.7巨噬细胞的炎症影响,与LPS诱导的炎症模型组做比较[21],炎症因子缓解程度与岩藻聚糖硫酸酯及降解产物分子量呈相关性,岩藻寡糖的抗炎效果优于岩藻聚糖硫酸酯,分子量越低的寡糖对炎症因子的缓解程度更为显著。
3 讨论
3.1 裙带菜岩藻寡糖的制备
常用的岩藻寡糖制备方法主要有物理降解法、生物降解法和化学降解法,其中化学降解法主要有NaNO2降解、酸降解及氧化降解等方法,而影响酸降解法制备岩藻寡糖效果的因素主要有降解温度、降解时间和酸解液pH。本研究中,根据薄层色谱分析可以确定降解温度95 ℃、pH 2、处理4 h为稀盐酸酸解裙带菜岩藻聚糖硫酸酯优化工艺条件,裙带菜岩藻寡糖的总回收率为13.53%(F1与F2之和)。刘静文等[22]将酸解制得的海带岩藻聚糖硫酸酯粗糖通过自由基氧化降解得到低分子量岩藻聚糖硫酸酯混合物,将该混合物在强阴离子色谱柱中进行梯度洗脱,用透析袋脱盐后冻干得到相对分子量为5 000~10 000的低分子量岩藻聚糖硫酸酯。邹祥等[23]用硫酸将由菌株Kosakonia sp.CCTCCM2018092发酵得到的岩藻多糖发酵液调至pH为2~5,60~90 ℃条件下水解4~8 h后,静置处理后过滤,浓缩、离心、醇沉后得到相对分子量小于10 000的岩藻寡糖。
耿丽华等[24]从海带中提取岩藻聚糖硫酸酯寡糖,结果显示,降解时间对产率影响较小;王莹等[25]利用酸解法降解以海带、墨角藻、裙带等褐藻为原料提取的岩藻多糖得到褐藻聚糖硫酸酯寡糖,结果显示,盐酸浓度越高寡糖产率越高,水浴温度和降解时间的影响较小,与本试验结果有相似之处。但本试验中优化酸解工艺制备裙带菜岩藻寡糖效果更好,寡糖的损失率低且有效保留了硫酸基团,因此,本酸解法具有很强的应用价值。
3.2 裙带菜岩藻寡糖对巨噬细胞的抗炎活性
海洋寡糖在生物体内具有多种结构类型和多种靶标,许多生物活性与其免疫调节功能相关[26]。Xu等[27]对比由不同制备方法制备褐藻胶寡糖与大分子量的褐藻胶时发现,制得的褐藻胶寡糖对巨噬细胞有活化作用,并发现酶解制得的非还原端寡糖具有不饱和双键,可以使NF-кB和MAPK信号通路被激活,诱导NO、ROS和NF-кB、TNF-α的产生,且其活性、分子量、寡糖末端结构与古洛糖醛酸、甘露糖醛酸在分子中的比例相关。褐藻胶寡糖的末端结构和聚合度对其活性有较为显著的影响,褐藻胶及其酶解的寡糖可以诱导RAW264.7细胞分泌含有胆醛酸的TNF-α,活性最强的是古洛糖醛酸八糖和甘露糖醛酸七糖,而酸解产物末端饱和的寡糖活性很低[27],这表明,褐藻胶寡糖通过模式识别受体可增强先天免疫活性。
段慧全等[28]研究裙带菜岩藻聚糖硫酸酯对巨噬细胞的免疫调节作用,把原料分为200、400、800 μg/mL 3个浓度剂量组处理巨噬细胞一定时间,经MTT法检测细胞活性显著增强,中性红比色法检测当浓度为400 μg/mL时,细胞吞噬活性最高达352.3%,ELISA法检测当浓度为800 μg/mL时TNF-α和1L-6的分泌量显著增加,并且TLR4的表达还受岩藻聚糖硫酸酯的作用而上升。张祺等[29]以海参为原料提取岩藻聚糖硫酸酯,在先天性免疫和适应性免疫中都有重要作用,用MTT法检测巨噬细胞增殖情况均好于空白组和葡聚糖处理组且吞噬能力及免疫功能有显著提升,岩藻聚糖硫酸酯还能够调节促炎因子和抗炎因子间的相互作用,通过TLR4、TLR5、TLR9促进MyD88和TRIF的表达,激活NF-kB的表达以进一步调节巨噬细胞的免疫功能。
本研究结果表明,酸解制备的不同分子量段的岩藻聚糖硫酸酯及降解产物均能有效减少RAW264.7 细胞NO、1L-1β、1L-6、1L-10和TNF-α的释放量,与上述文献报道相吻合。本研究中还发现,与LPS诱导的炎症模型组做比较,炎症因子释放缓解程度与岩藻聚糖硫酸酯及降解产物分子量呈相关性,岩藻寡糖抗炎效果优于多糖,且添加岩藻寡糖F1可以使被LPS诱导的RAW264.7细胞分泌炎症因子1L-10和TNF-α量恢复到空白水平,具有极好的抗炎效果。这一发现对于裙带菜岩藻聚糖硫酸酯寡糖的抗炎活性机制及其构效关系的研究有很大推动作用,高抗炎活性的岩藻寡糖具有广阔的市场应用前景,并为褐藻寡糖类产品的开发利用提供了新思路。
4 结论
1)本研究中优化的酸解工艺参数为95 ℃、pH 2、处理4 h,在此条件下酸解裙带菜岩藻聚糖硫酸酯得到的寡糖损失率低,并可有效保留硫酸基团。
2)利用膜分离技术获得不同分子量段的裙带菜岩藻聚糖硫酸酯降解产物,均对巨噬细胞具有一定的抗炎活性,其对炎症因子缓解程度与岩藻聚糖硫酸酯及降解产物分子量呈相关性,且发现岩藻寡糖抗炎效果优于多糖。
[1] 李红艳,王颖,刘天红,等.裙带菜孢子叶营养成分分析及品质评价[J].南方农业学报,2018,49(9):1821-1826.
LI H Y,WANG Y,LIU T H,et al.analysis and evaluation of nutrient composition in sporophyll of Undaria pinnatifida[J].Journal of Southern Agriculture,2018,49(9):1821-1826.(in Chinese)
[2] 郑亦舟,王杰,李倩倩,等.不同产地裙带菜理化成分及功效成分的比较[J].上海师范大学学报(自然科学版),2019,48(2):217-222.
ZHENG Y Z,WANG J,LI Q Q,et al.Comparative study on physicochemical and functional components of Undaria pinnatifida from different location[J].Journal of Shanghai Normal University (Natural Sciences Edition),2019,48(2):217-222.(in Chinese)
[3] MURPHYA P,DAL BELLO F,O’DOHERTY J,et al.The effects of liquid versus spray-dried Laminaria digitata extract on selected bacterial groups in the piglet gastrointestinal tract (GIT)microbiota[J].Anaerobe,2013,21:1-8.
[4] KIM M J,JEON J,LEE J S.Fucoidan prevents high-fat diet-induced obesity in animals by suppression of fat accumulation[J].Phytotherapy Research,2014,28(1):137-143.
[5] 陈焕君.两种岩藻聚糖硫酸酯FP08S2和NDH01抗血管生成的作用机制研究[D].上海:中国科学院大学(中国科学院上海药物研究所),2016.
CHEN H J.Mechanism study underlying anti-angiogenesis effects of two fucoidans,FP08S2 and NDH01[D].Shanghai:University of Chinese Academy of Sciences (Shanghai Institute of Materia Medica),2016.(in Chinese)
[6] 宋海燕,何文辉,张奥,等.褐藻中岩藻聚糖硫酸酯生物学活性的研究进展[J].食品工业科技,2016,37(2):370-373,378.
SONG H Y,HE W Y,ZHANG A,et al.Progress on the biological activities of fucoidan from brown algae[J].Science and Technology of Food Industry,2016,37(2):370-373,378.(in Chinese)
[7] 张仪欣,佟长青,李伟.褐藻生物活性物质研究现状[J].农产品加工,2019(7):78-80,83.
ZHANG Y X,TONG C Q,LI W.The studies of bioactive substances from brown algae[J].Farm Products Processing,2019(7):78-80,83.(in Chinese)
[8] OLIVEIRA C,NEVES N M,REIS R L,et al.A review on fucoidan antitumor strategies:from a biological active agent to a structural component of fucoidan-based systems[J].Carbohydrate Polymers,2020,239:116131.
[9] 毕红霞.岩藻聚糖硫酸酯衍生物的研究进展[J].国际生物医学工程杂志,2010,33(4):254-256.
BI H X.Research progress on derivatives of fucoidan[J].International Journal of Biomedical Engineering,2010,33(4):254-256.(in Chinese)
[10] 何云海,汪秋宽,苏唱.用复合酶酶解-热水浸提法提取裙带菜孢子叶粉岩藻聚糖硫酸酯的工艺研究[J].大连水产学院学报,2007,22(1):53-57.
HE Y H,WANG Q K,SU C.The extracting technology of fucoidan from sporophyll powder of sea mustard (Undaria pinnatifida)suringar by enzymatic hydrolysis[J].Journal of Dalian Fisheries University,2007,22(1):53-57.(in Chinese)
[11] 林嗣翔,叶秀金,陈英.果胶中糖类成分薄层色谱方法的研究[J].中国药品标准,2020,21(6):499-502.
LIN S X,YE X J,CHEN Y.Investigation on the identification of oligose in pectin by TLC[J].Drug Standards of China,2020,21(6):499-502.(in Chinese)
[12] CHEN Y Y,GAO X,WEI Y X,et al.Isolation,purification and the anti-hypertensive effect of a novel angiotensin I-converting enzyme (ACE)inhibitory peptide from Ruditapes philippinarum fermented with Bacillus natto[J].Food &Function,2018,9(10):5230-5237.
[13] 刘舒.三种褐藻中岩藻聚糖硫酸酯的纯化及结构分析[D].大连:大连海洋大学,2013.
LIU S.Studies on the purification and structural characteristics of fucoidan from Costaria costata,Saccarina japonica,Kjellmaniella crassifolia[D].Dalian:Dalian Ocean University,2013.(in Chinese)
[14] 刘玉凤,贾淑颖,刘飞飞,等.不同取代度的硫酸化肠浒苔多糖抗氧化活性研究[J].食品工业科技,2016,37(19):142-147,152.
LIU Y F,JIA S Y,LIU F F,et al.Antioxidant activity of sulfated polysaccharides with different substituting degrees from Enteromorpha intestinalis[J].Science and Technology of Food Industry,2016,37(19):142-147,152.(in Chinese)
[15] 秦庆华,尹承芬,董宁,等.噻唑兰法和CCK-8法检测小鼠淋巴细胞增殖反应的比较[J].感染、炎症、修复,2012,13(4):199-202.
QIN Q H,YIN C F,DONG N,et al.Comparison of murine lymphocyte proliferation response as measured by thiazolyl blue and cell counting kit-8 assays[J].Infection,Inflammation,Repair,2012,13(4):199-202.(in Chinese)
[16] 郐一贺,顾取良,邓慧君,等.冬凌草甲素对LPS诱导Raw264.7巨噬细胞炎症反应的抑制作用[J].广东药科大学学报,2017,33(2):250-254.
KUAI Y H,GU Q L,DENG H J,et al.Inhibition of oridonin on LPS-induced inflammation response in Raw264.7 macrophages[J].Journal of Guangdong Pharmaceutical University,2017,33(2):250-254.(in Chinese)
[17] 辛文妤,张天泰,杜冠华.DL0309对LPS诱导小鼠RAW264.7细胞NO生成及iNOS表达的影响[C]//第十三届中国科协年会生物医药博士论坛论文集.天津:中国药理学会,2011:4.
XIN W Y,ZHANG T T,DU G H.Effect of DL0309 on NO production and iNOS expression induced by LPS in RAW264.7 cells[C]//Proceedings of the 13th annual meeting of China Association for Science and Technology Biomedical Doctor Forum.Tianjin:Chinese Pharmacological Society,2011:4.(in Chinese)
[18] 李宗球.几丁寡糖对RAW264.7小鼠巨噬细胞的免疫调节作用[D].广州:华南理工大学,2020.
LI Z Q.The immune regulation effects of N-acetyl chitooligosaccharides on mouse RAW264.7 macrophages[D].Guangzhou:South China University of Technology,2020.(in Chinese)
[19] ZHU Y J,TIAN Y Y,WANG N,et al.Structure-function relationship analysis of fucoidan from sea cucumber (Holothuria tubulosa)on ameliorating metabolic inflammation[J].Journal of Food Biochemistry,2021,45(1):e13500.
[20] 郭娟娟.κ-卡拉胶寡糖酶法制备及其免疫防御调节机制的研究[D].福州:福建农林大学,2018.
GUO J J.Enzymatic hydrolysis preparation of κ-carrgeenan oligosaccharides and its mechanism in immunologic defense[D].Fuzhou:Fujian Agriculture and Forestry University,2018.(in Chinese)
[21] 刘鹏飞,朱伟,万进,等.人参多糖对LPS诱导小鼠巨噬细胞炎症因子生成的抑制作用及其机制[J].中国实验方剂学杂志,2018,24(14):102-107.
LIU P F,ZHU W,WAN J,et al.Inhibitory effect of ginseng radix et rhizoma polysaccharide on LPS-induced inflammatory factor formation in mouse peritoneal macrophages and its mechanism[J].Chinese Journal of Experimental Traditional Medical Formulae,2018,24(14):102-107.(in Chinese)
[22] 刘静文,史姣霞,谢洁玲,等.海带低分子量岩藻聚糖硫酸酯的制备和抗血小板聚集活性研究[J].中国海洋药物,2017,36(1):19-26.
LIU J W,SHI J X,XIE J L,et al.Preparation and purification of low molecular weight fucoidan from Laminaria japonica with antiplatelet activity[J].Chinese Journal of Marine Drugs,2017,36(1):19-26.(in Chinese)
[23] 邹祥,谌颉,刘超,等.岩藻多糖及其水解寡糖在制备益生菌保护剂中的应用及方法:110106163A[P].2019-08-09.
ZOU X,SHEN J,LIU C,et al.Application and method of fucoidan polysaccharide and its hydrolyzed oligosaccharide in preparation of probiotics protectants:110106163A[P].2019-08-09.(in Chinese)
[24] 耿丽华,金维华,王晶,等.海带褐藻多糖硫酸酯的降解与岩藻寡糖的制备[J].高等学校化学学报,2017,38(12):2193-2197.
GENG L H,JIN W H,WANG J,et al.Fucoidan degradation and preparation of fuco-oligosaccharides from Saccharina japonica[J].Chemical Journal of Chinese Universities,2017,38(12):2193-2197.(in Chinese)
[25] 王莹,寇玲赟,朱德军.一种岩藻寡糖及其制备方法和应用:109970823A[P].2019-07-05.
WANG Y,KOU L Y,ZHU D J.A fuco-oligosaccharide and its preparation method and application:109970823A[P].2019-07-05.(in Chinese)
[26] 赵小亮,王钰婷,肖宁,等.海洋寡糖及其衍生物活性的研究进展[J].生物技术进展,2018,8(6):477-488.
ZHAO X L,WANG Y T,XIAO N,et al.Progress on activities of marine oligosaccharides and their derivatives[J].Current Biotechnology,2018,8(6):477-488.(in Chinese)
[27] XU X,WU X T,WANG Q Q,et al.Immunomodulatory effects of alginate oligosaccharides on murine macrophage RAW264.7 cells and their structure-activity relationships[J].Journal of Agricultural and Food Chemistry,2014,62(14):3168-3176.
[28] 段慧全,高子翔,代培斌,等.Fucoidan对巨噬细胞RAW264.7的免疫调节作用[J].中国微生态学杂志,2017,29(11):1249-1252.
DUAN H Q,GAO Z X,DAI P B,et al.Immunomodulatory effects of fucoidan from Undaria pinnatifida sporophyll on macrophage RAW264.7[J].Chinese Journal of Microecology,2017,29(11):1249-1252.(in Chinese)
[29] 张祺,李学敏,李兆杰,等.海参岩藻聚糖硫酸酯对巨噬细胞的调节作用及信号通路研究[J].中国药理学通报,2015,31(1):87-92.
ZHANG Q,LI X M,LI Z J,et al.Immunomodulatory effects of sea cucumber fucoidan on macrophage and the signaling pathways[J].Chinese Pharmacological Bulletin,2015,31(1):87-92.(in Chinese)