斑马鱼Danio rerio是一种生活在缓慢流水水域的上层鱼类,其生活的水环境植物茂盛、地形复杂,生物栖息地具有很大范围的光亮度和光谱波长分布[1]。复杂水环境中的日间活动方式,表明斑马鱼具有发达的视觉能力[2]。斑马鱼是脊椎动物视觉系统研究中一种典型的模式生物,其视网膜具有与其他脊椎动物相同的神经元类别[3-5]。成年斑马鱼视网膜中拥有视觉感知所必需的视感受器,即视锥细胞和视杆细胞。不同类型的视细胞含有不同的感光色素,从而表现出不同的光谱敏感性,如视杆细胞的敏感峰值为500 nm,U-视锥细胞、S-视锥细胞、M-视锥细胞和L-视锥细胞的敏感峰值分别为362、415、480、570 nm[6]。不同类型视细胞共同作用决定了斑马鱼的光谱敏感性[7-8]。
视网膜电图(ERG)是一种微创性的视觉研究方案,记录了视网膜组织在光诱导下胞外场电位的变化[9],可以用于评估动物的视觉感知[10]。Huges等[3]和Saszik等[8]曾利用视网膜电图技术研究了明适应条件下不同发育阶段斑马鱼的光谱敏感性,发现斑马鱼的明视光谱敏感性随着年龄的增加而增加,且明适应条件下斑马鱼光谱敏感性曲线有4个峰值(360、400、500、580 nm),并且在460、540 nm波长处发现斑马鱼光谱敏感性出现明显的下降趋势。Huges等[3]和Saszik等[8]的研究结果与Robinson等[6]利用分光光度计测试视细胞的光谱敏感性结果一致。Bilotta等[11]曾利用视网膜电图技术研究了暗适应条件下不同发育阶段斑马鱼的光谱敏感性,发现斑马鱼的暗视光谱敏感性会随着年龄变化而变化,且视杆细胞对暗视光谱敏感性的贡献随着年龄的增加而增加。暗适应条件下斑马鱼的光谱敏感性主要由暗视视觉主导[12],而暗视视觉受暗适应状态的影响。Bilotta等[11]在试验设计时暗适应时间设定为60 min,闪光刺激时间间隔设定为15 s,但未考虑斑马鱼暗适应状态和ERG试验中闪光刺激时间间隔对试验结果的影响。为此,本研究中首先探究了斑马鱼ERG试验中暗适应时间和闪光刺激时间间隔对ERG记录的影响,并探究了斑马鱼在暗适应条件下对不同波长刺激光的ERG响应和光谱敏感性,旨在为斑马鱼ERG试验标准化方案的确定和斑马鱼视觉生态研究提供参考。
1 材料与方法
1.1 材料
试验鱼购自上海乙诺水族科技有限公司,为体长3.5~4.0 cm的6月龄成年斑马鱼。
1.2 方法
1.2.1 暂养与管理 试验前,将试验鱼在上海海洋大学海洋科学学院鱼类行为实验室的循环水槽中暂养两周,暂养水槽尺寸为500 cm×80 cm×60 cm。暂养用水为曝气后的自来水,水温为(28±0.5)℃[13],pH为7.0~7.5。每周更换一次循环水槽的过滤棉和30%水体。暂养期间,由4个100 W的全光谱LED灯(上海寸景水族有限公司)提供照明,光照周期为14 h光照(L)∶10 h黑暗(D)(光照时段为8:00—22:00)[14],每天投喂一次人工配合饲料。
1.2.2 刺激光 采用13组10 W的集成LED灯珠作为刺激光源,波长范围包含紫外光和可见光,峰值波长分别设定为340、365、380、400、420、440、460、480、500、520、550、585、620 nm,额定功率为10 W,LED光源参数详见表1。刺激光经液芯光纤传导至试验鱼眼睛处,光路中设置了电子快门和中性密度滤光片。电子快门由上位机控制,用于控制刺激时长和刺激时间间隔。中性密度滤光片用于产生不同刺激强度的光,本试验共设置10组中性密度滤光片,光密度(OD)为0~4.5。试验前,分别利用紫外光功率计(U-20,杭州远方光电)和可见光功率计(TES132,泰仕)测试刺激光源在额定功率下鱼眼处的辐照度。由于不同波长的刺激光在相同辐照度条件下辐射的光子数不同,为了保证不同波长刺激光刺激强度的统一,本文中将辐照度转换为单位时间内通过单位面积的光子数(photons/(s·cm2))。试验时,改变光路中的中性密度滤光片以控制鱼眼处辐照度大小,刺激光的辐照度由小到大,以0.5个lg单位递增(表1)。
表1 集成LED光源参数
Tab.1 Parameters of integrated LED light source
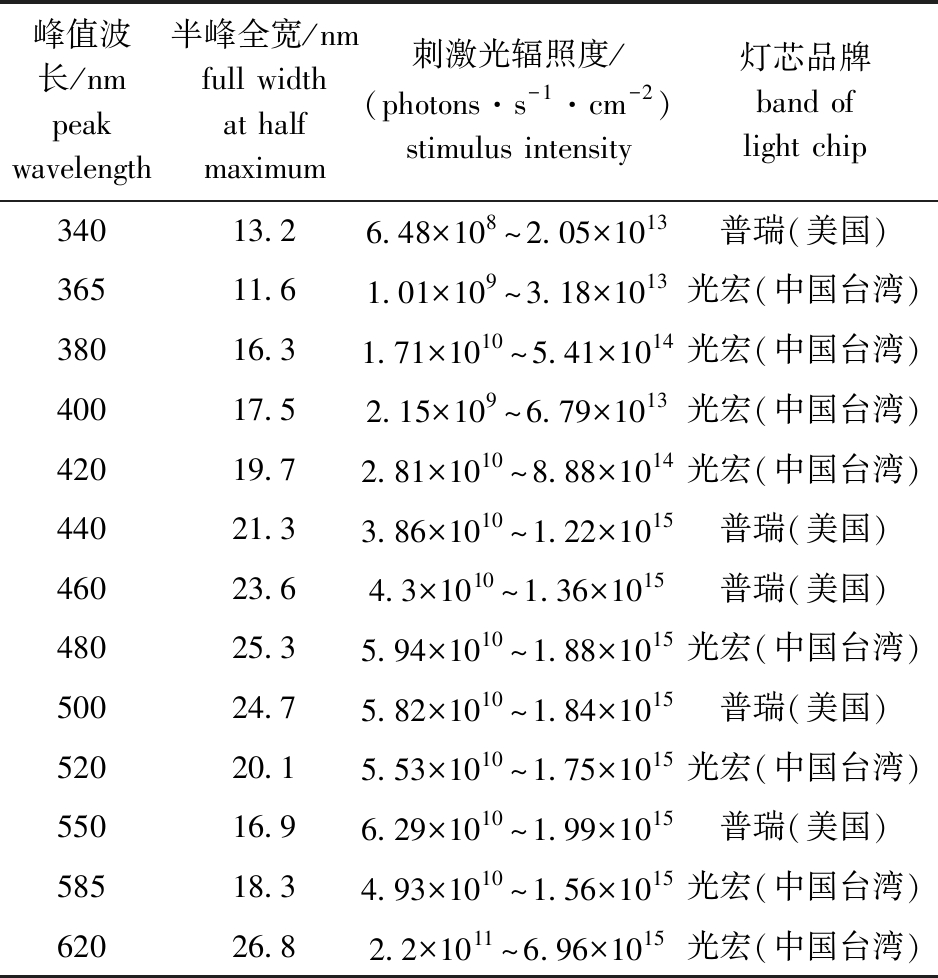
峰值波长/nmpeak wavelength半峰全宽/nmfull width at half maximum刺激光辐照度/(photons·s-1·cm-2)stimulus intensity灯芯品牌band of light chip34013.26.48×108~2.05×1013普瑞(美国)36511.61.01×109~3.18×1013光宏(中国台湾)38016.31.71×1010~5.41×1014光宏(中国台湾)40017.52.15×109~6.79×1013光宏(中国台湾)42019.72.81×1010~8.88×1014光宏(中国台湾)44021.33.86×1010~1.22×1015普瑞(美国)46023.64.3×1010~1.36×1015普瑞(美国)48025.35.94×1010~1.88×1015光宏(中国台湾)50024.75.82×1010~1.84×1015普瑞(美国)52020.15.53×1010~1.75×1015光宏(中国台湾)55016.96.29×1010~1.99×1015普瑞(美国)58518.34.93×1010~1.56×1015光宏(中国台湾)62026.82.2×1011~6.96×1015光宏(中国台湾)
1.2.3 ERG记录装置 ERG记录装置主要包括记录电极、参考电极、前置放大器、带通滤波器、消噪器、数据采集分析系统、法拉第笼、环形水槽、微操纵器和上位机等。记录电极为直径0.25 mm的铂金丝电极,参考电极为直径0.25 mm的医用钢针电极(西安富德医疗,中国)。ERG记录时,通过手动微操纵器(KITE-R,WPI,美国)调整和固定记录电极与参考电极,使记录电极紧密接触鱼眼,参考电极插入试验鱼颅骨中央处。记录电极顶端弯曲成“O”形,避免电极尖端紧密接触鱼眼时损伤试验鱼视网膜。试验时在鱼眼处滴入人工泪液以维持鱼角膜湿润,且保证记录电极与角膜接触良好。试验前后均需将电极浸泡于体积分数75%的医用乙醇中进行消毒和去除电极上黏附的杂质。
电极记录的ERG信号经前置放大器(NL 104,CED,英国)进行差分放大后输入带通滤波器(NL 125,CED,英国)进行滤波。本试验中设置带通滤波器的低频截止频率为0.5 Hz,高频截止频率为100 Hz。滤波后的ERG信号经消噪器(Humbug,加拿大)滤除信号中50 Hz的工频噪声后,传入生物电信号采集分析系统(Micro3-1401,CED,英国)进行模数转换和处理。最终ERG信号传导至上位机进行显示和保存。上位机软件采用Spike 2 V8.00(CED),系统采样频率为300 Hz。
1.2.4 试验鱼预处理 试验时,将完成暗适应的试验鱼浸泡于0.4 g/L MS-222溶液中进行麻醉[2]。待试验鱼鳃盖停止张合后,迅速在其躯干背部注射0.02 mL浓度为50 mg/kg的戈拉碘铵(加拉碘铵)溶液[2]。将试验鱼一侧朝上固定于法拉第笼中圆形水槽内的平台上,并用富氧的0.1 g/L MS-222溶液进行人工灌流,灌流液水温为28 ℃[3]。麻醉和注射加拉碘铵溶液的目的是抑制试验鱼的肌肉活动,保障电极的稳定接触和避免肌肉活动所产生电信号干扰。人工灌流的目的是保障试验期间试验鱼的氧气供应和维持试验鱼麻醉状态。
1.2.5 ERG记录试验 试验在上海海洋大学海洋科学学院鱼类电生理实验室中进行,为了避免昼夜节律对斑马鱼ERG记录的影响,试验在9:00—17:00时段进行。
1)不同暗适应时间下的ERG记录。随机选取30尾生长状态一致且健康有活力的成年斑马鱼分别置于避光水箱中暗适应10、20、30、40、50、60、70、80、90、100、110、120 min后,以给定刺激光(波长为500 nm,强度为1.84×1013photons/(s·cm2),刺激时长为300 ms[8]),记录30尾斑马鱼在不同暗适应时间下的ERGs。
2)不同闪光刺激时间间隔下的ERG记录。随机选取30尾生长状态一致且健康有活力的成年斑马鱼,暗适应100 min后,以给定刺激光(光条件同上),刺激时长为300 ms[8],分别以10、20、30、40、50、60、70、80、90、100 s的时间间隔连续刺激眼睛10次,记录30尾斑马鱼在不同闪光刺激时间间隔下的ERGs。
3)不同波长刺激光下的ERG记录。随机选取30尾生长状态一致且健康有活力的成年斑马鱼,暗适应100 min后,记录其在不同波长(340~620 nm)和不同强度(OD值为0~4.5)光刺激下的ERGs。为了避免系统误差,同一尾斑马鱼在相同刺激条件下刺激3次(刺激时间间隔60 s),结果取3次刺激的ERG响应平均值。试验时,不同刺激波长的顺序随机确定,且在不同波长组之间测试试验鱼对波长500 nm、辐照度1.84×1013photons/(s·cm2)刺激光的标准响应,以进行数据校正。
1.2.6 不同暗适应时间、刺激时间间隔对斑马鱼视网膜电图的影响试验 以视网膜电图的b波振幅作为斑马鱼视网膜对刺激光的响应,记录不同刺激条件下的视网膜电图响应。试验结果数据均以平均值±标准差(mean±S.D.)表示。
1)暗适应时间对ERG的影响。30尾斑马鱼在10~120 min暗适应时间下的ERG b波振幅进行t检验(P=0.05),当ERG b波振幅的组间无显著性差异时(P>0.05),则认为暗适应时间对斑马鱼ERG响应不再产生影响。
2)闪光刺激时间间隔的影响。参考Kanmizutaru等[15]方法,刺激时间间隔对ERG响应的影响率(α)计算公式为
α=(R1-R10)/R1×100%。
(1)
其中:α为影响率(%);R1为第1次刺激的ERG响应;R10为第10次刺激的ERG响应。
对30尾斑马鱼在10~100 s闪光刺激时间间隔下的ERG响应R1和R10进行配对样本t检验,当R1和R10无显著性差异时(P>0.05),认为此时的刺激时间间隔对斑马鱼ERG响应无影响。
1.2.7 斑马鱼光谱敏感性的计算 通过绘制斑马鱼的ERG响应和刺激光辐照度二者对数之间的函数关系,找出其线性响应区间,并在线性范围内确定斑马鱼的标准响应振幅。参考Demarco等[16]方法,通过插值法计算出每个波长刺激光下产生标准响应的lg(辐照度)值,即为斑马鱼在不同波长下的光谱敏感性。
2 结果与分析
2.1 斑马鱼的ERG
图1显示了刺激光波长为500 nm、lg(辐照度)分别为11.0、11.5和12.0时,斑马鱼暗视ERG波形。试验中刺激时长设为300 ms[8],图中on和off代表光刺激的开始和结束。从图1可见,斑马鱼ERG响应振幅随着刺激光lg(辐照度)的增加而增加。从图中还观察到3种ERG波形成分,包括刺激瞬间出现的a波、随之出现的振动幅度较大且增势迅猛的b波以及在刺激结束后才出现的d波。ERG b波振幅明显,反映了斑马鱼双极细胞的电活动[17],代表了其第一层具有颜色分辨能力的视网膜神经元[18]。因此,本文中以ERG b波振幅作为斑马鱼视网膜对刺激光的响应,即ERG响应。
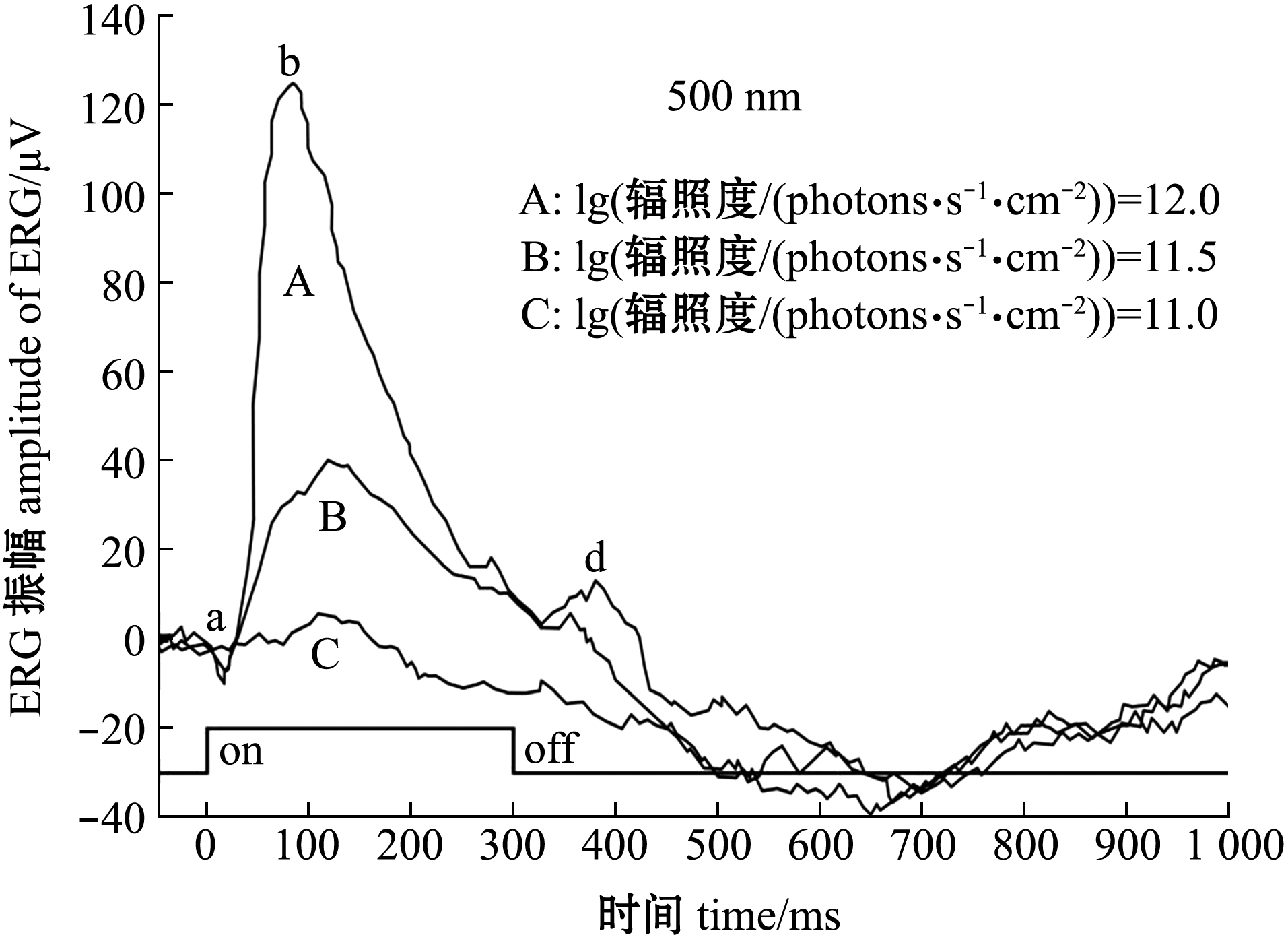
图1 不同强度光刺激下斑马鱼的视网膜电图(ERGs)
Fig.1 ERGs of zebrafish stimulated by different light intensities
2.2 不同暗适应时间下的ERG响应
图2显示了30尾成年斑马鱼暗适应10~120 min时的ERG振幅。从图2可见,ERG振幅随着暗适应时间的延长而逐渐增大,并在90 min后趋于稳定。t检验结果显示,暗适应时间大于90 min后ERG响应组间无显著性差异(P>0.05),表明斑马鱼暗视ERG记录时至少需要暗适应90 min。
2.3 不同闪光刺激间隔时间下的ERG响应
图3显示了暗适应100 min的30尾成年斑马鱼在闪光刺激时间间隔为10~100 s时的ERG响应R1和R10。从图3可见,R10随着刺激时间间隔的延长而逐渐增加,并不断趋于R1值。对30尾斑马鱼的R1和R10两组数据进行配对t检验,发现闪光刺激间隔时间大于50 s时,30尾斑马鱼的R1和R10两组数据间无显著性差异(P>0.05)。这表明,连续的闪光刺激时间间隔大于50 s不会改变斑马鱼的暗适应状态,从而不影响后续ERG响应。
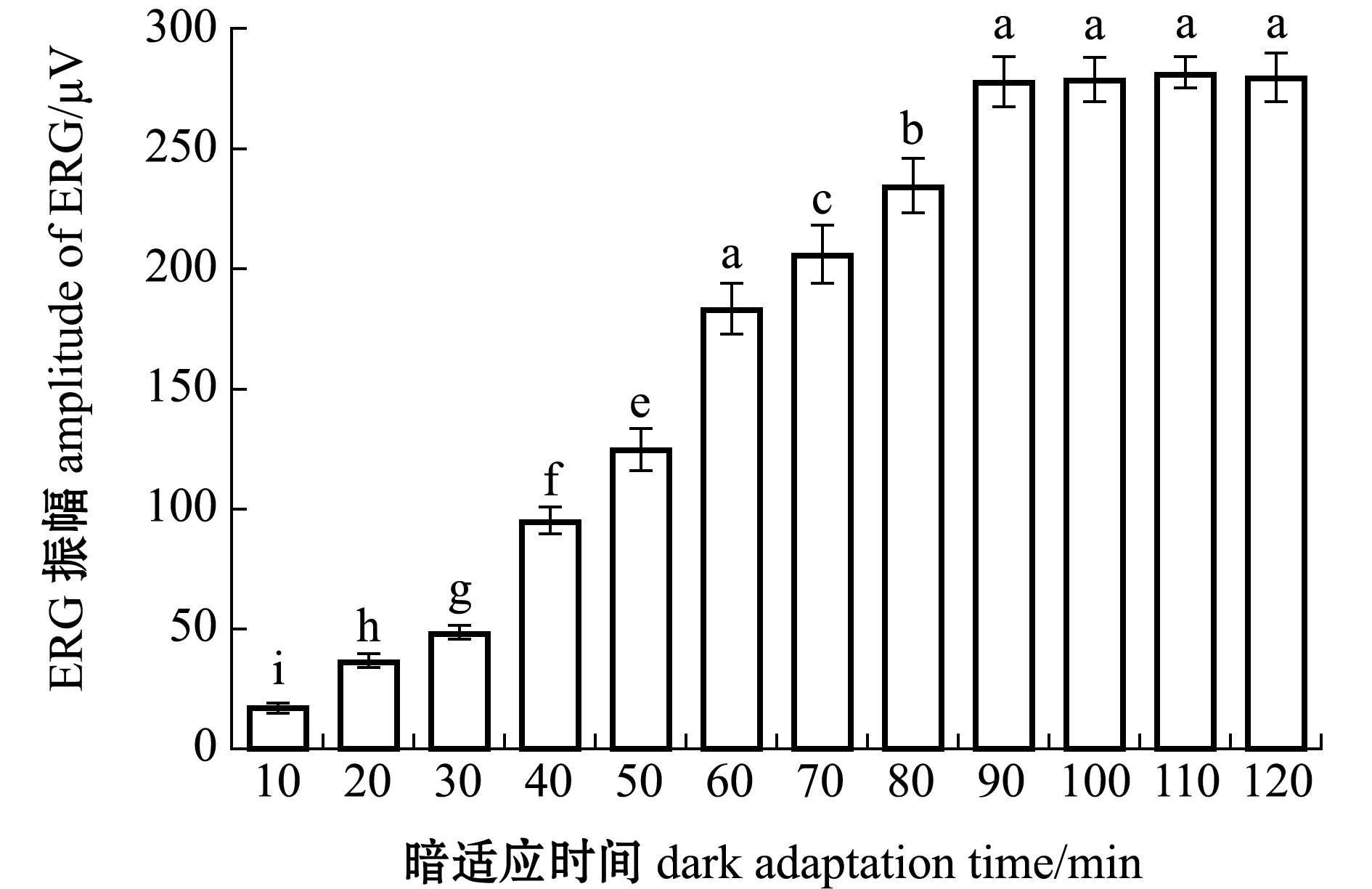
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图2 不同暗适应时间下的ERG响应
Fig.2 ERG amplitudes at different dark adaptation time
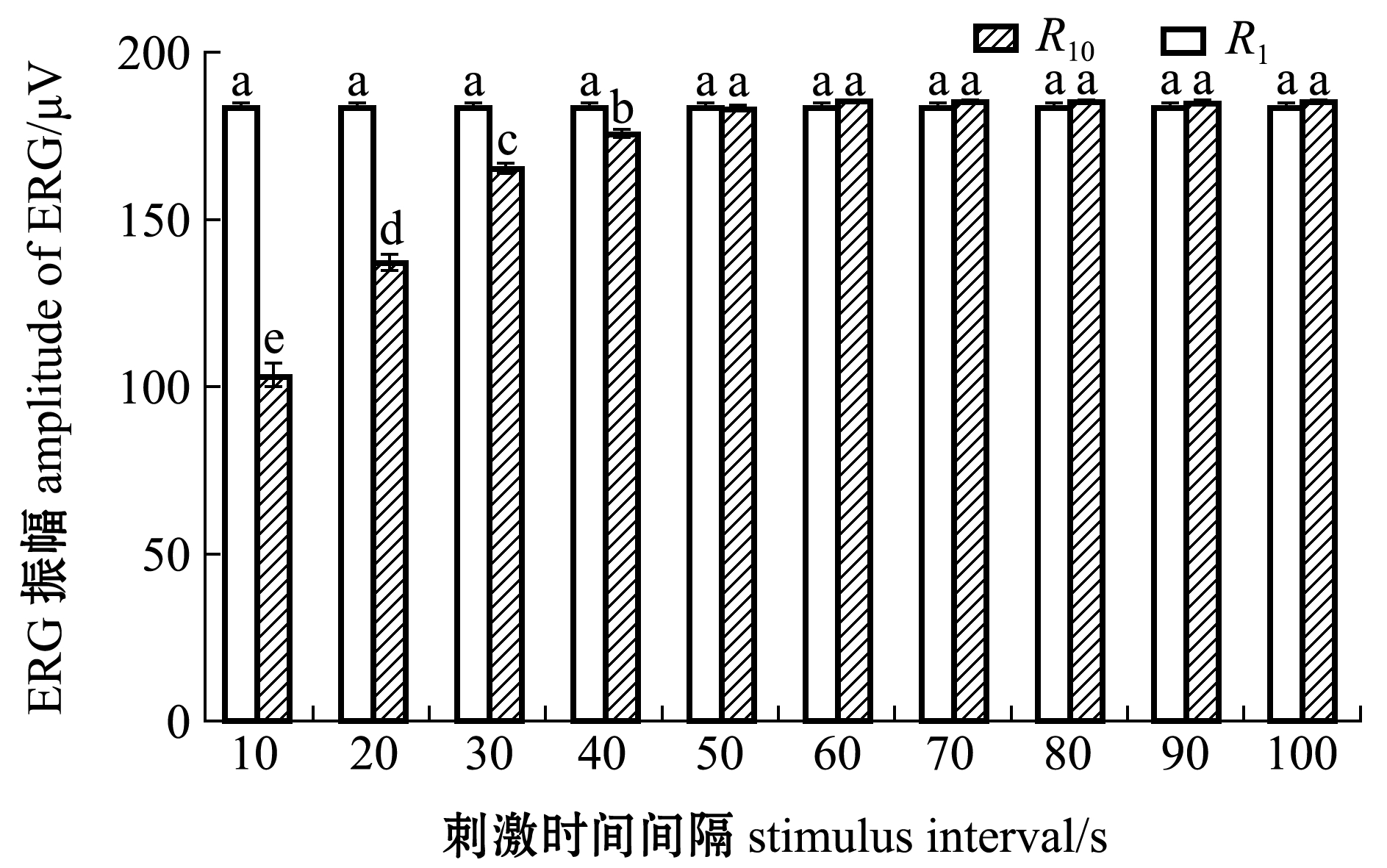
图3 不同光刺激时间间隔下的EGR响应R1和R10
Fig.3 EGR R1 and R10 under different light stimulus intervals
绘制30尾暗适应100 min的成年斑马鱼在闪光刺激时间间隔为10~100 s时的EGR影响率α。从图4可见:随着刺激时间间隔的延长EGR影响率呈现递减的趋势,并最终趋于0;刺激时间间隔分别为10、20、30、40、50 s时,EGR影响率分别为43.63%、25.32%、10.7%、5.1%、0.98%,刺激时间间隔大于60 s时,影响率趋于0。这表明,连续的闪光刺激时间间隔大于60 s时影响率趋于0,结合R1和R10两组数据的配对t检验结果分析,发现斑马鱼ERG试验中刺激时间间隔大于50 s时连续闪光刺激并不影响后续ERG响应。
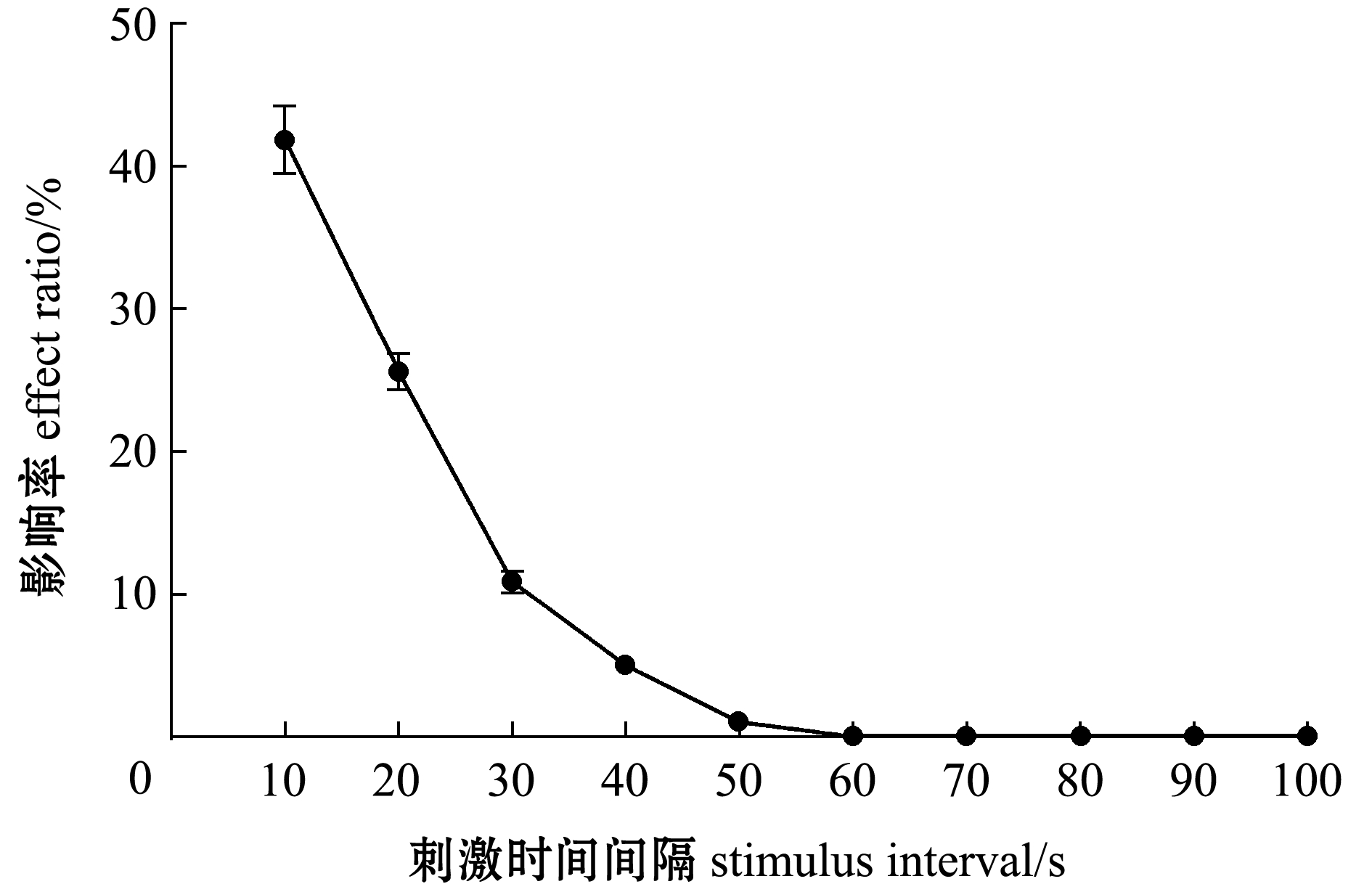
图4 不同光刺激时间间隔对EGR响应的影响率
Fig.4 ERG effect ratio of different time intervals of light stimulation
2.4 斑马鱼光谱敏感性
为了确定斑马鱼ERG标准响应振幅,对不同刺激条件下的斑马鱼ERG响应取对数,并绘制了ERG响应与辐照度二者对数(lg)间的关系(图5),从图中的离散数据可以判断二者呈线性相关。利用最小二乘法对二者的数据进行线性回归分析,结果显示,13组波长下lg(ERG响应)与lg(辐照度)的数据和最佳拟合线性方程之间拟合程度高,决定系数R2均大于0.95,且其中12组波长拟合方程的剩余标准差均小于0.1,仅420 nm波长组拟合方程的剩余标准差高于0.1,为0.113。紫外光波段(340、365、380 nm)线性拟合方程的斜率分别为0.56、0.52、0.59,可见光波段(400~620 nm)线性拟合方程的斜率为0.67~0.88。不同刺激波长斜率之间的差异未发现一致的趋势。
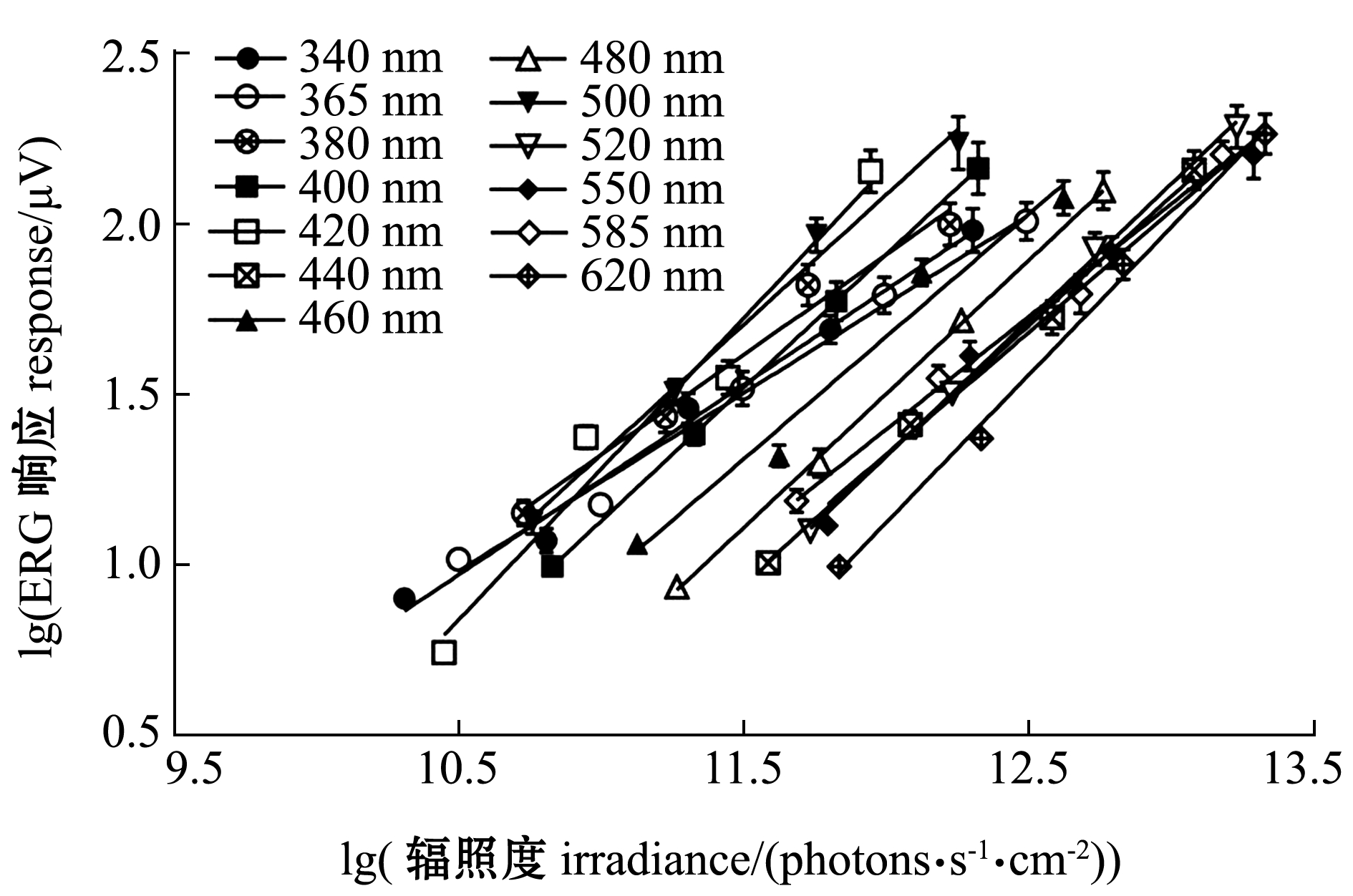
图5 不同波长下ERG响应与辐照度的关系
Fig.5 Function relationship between response and irradiance at different wavelengths
由图5可以判断,50 μV(其lg值约1.7)的ERG响应处在线性响应区间内,且始终高于噪声水平。因此,本文以50 μV的ERG响应作为标准响应,计算斑马鱼的光谱敏感性。对30尾斑马鱼在13组不同波长下的lg(ERG响应)与lg(辐照度)数据进行插值(R2>0.95),计算产生50 μV标准响应的lg(辐照度),并根据该lg(辐照度)值绘制斑马鱼的绝对光谱敏感性函数(图6)。从图6可见:斑马鱼暗视光谱敏感性在可见光波段(400~700 nm)峰值出现在500 nm处,在365 nm处(紫外光波段)发现了斑马鱼第二敏感峰值,365 nm的紫外敏感峰值相较于500 nm可见光敏感峰值低了约0.28个lg单位;斑马鱼的暗视光谱敏感性在可见光波段与视紫红质的光谱吸收曲线拟合较好,而视紫红质是斑马鱼视杆细胞的感光色素,说明可见光波段的光谱敏感性由斑马鱼视杆细胞主导。
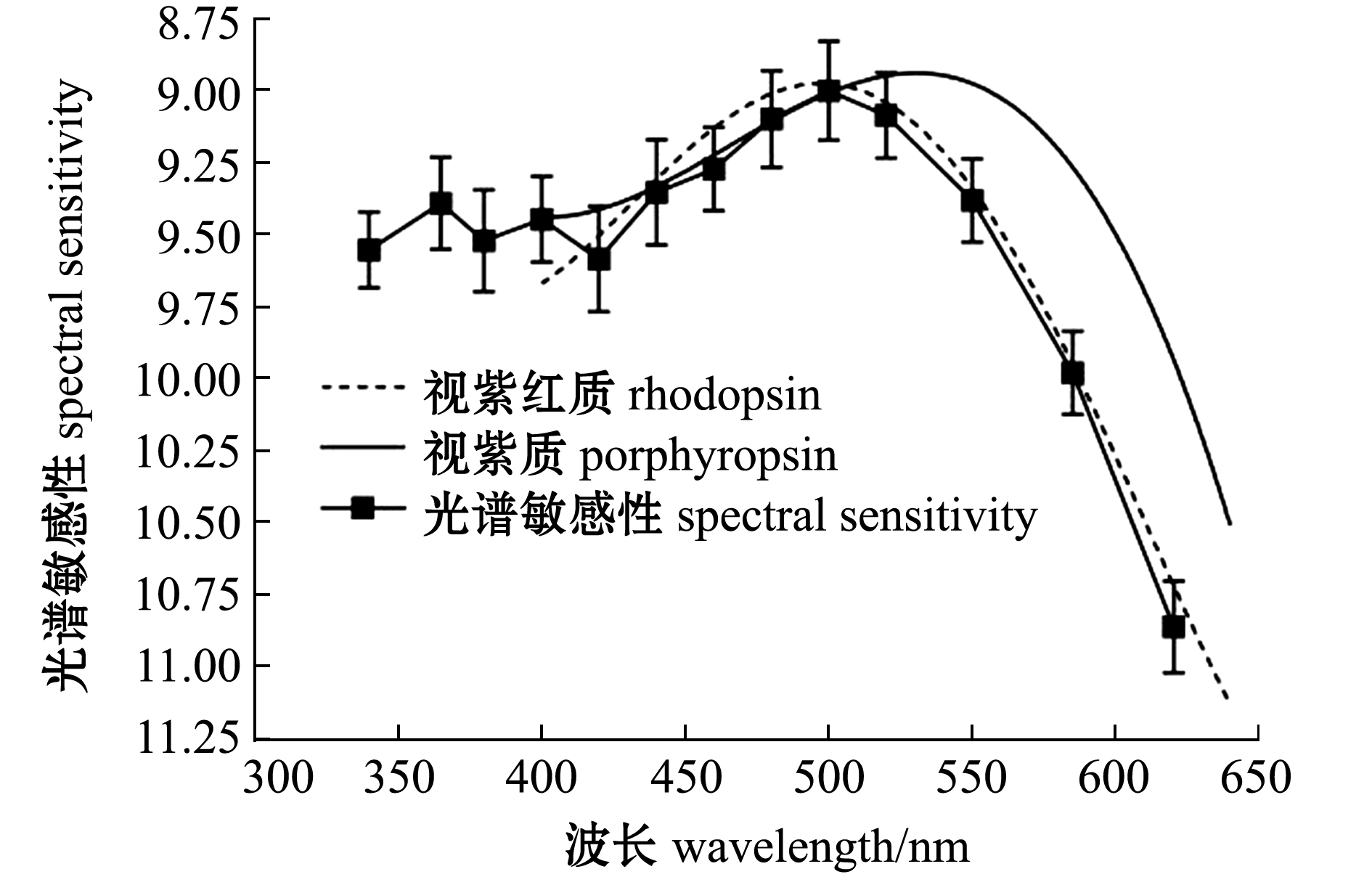
图6 斑马鱼的暗视光谱敏感性
Fig.6 Scotopic spectral sensitivity of zebrafish
3 讨论
3.1 斑马鱼暗视ERG的最佳试验参数
人类从明亮的环境进入完全黑暗的环境,眼睛需要20~30 min完全暗适应,而从黑暗环境进入明亮的环境仅需5 min左右就能完全明适应[19]。国际临床视觉电生理学会(ISCEV)明确规定,进行人体临床明视ERG记录至少需要明适应10 min,进行人体临床暗视ERG记录至少需要暗适应20 min[20]。明适应过程耗费时间较短,在一般动物试验中容易满足。而暗适应过程耗费时间较长,在试验设计时过长的暗适应时间将影响试验进程,而较短的暗适应时间则无法满足试验需要,可能导致试验误差。在动物ERG试验中并没有明确的明、暗适应时间标准,因此,明确斑马鱼ERG试验的明、暗适应时间有助于增加试验的准确性,也有助于斑马鱼ERG标准化试验方案的确定。本研究表明,暗适应时间对ERG影响显著,ERG振幅随着暗适应时间的延长而逐渐增大,且暗适应时间为10 min和90 min时的ERG振幅的差异高至260 μV(图2)。ERG振幅在暗适应时间达到90 min后趋于稳定,表明暗适应90 min后,斑马鱼进入完全暗适应状态。ERG试验中需要对暗适应的斑马鱼进行连续的闪光刺激,而连续的闪光刺激可能会激活斑马鱼明视视觉系统,从而改变斑马鱼的暗适应状态,进而导致ERG响应发生变化,影响ERG评估的准确性。因此,明确不影响后续ERG记录的闪光刺激时间间隔对于增加ERG试验的准确性也具有重要的意义。本研究中发现,连续的闪光刺激时间间隔为50 s时影响率为0.98%,闪光刺激时间间隔大于60 s时影响率趋于0(图4),由此可见,斑马鱼暗视ERG试验中大于50 s的闪光刺激时间间隔是较好的选择。在斑马鱼ERG试验中,除了暗适应时间和闪光刺激时间间隔外,昼夜节律也可能对ERG记录产生影响[21]。
3.2 暗适应条件下斑马鱼的光谱敏感性
成年斑马鱼拥有发达的视觉系统[22-23],其视觉系统可分为视杆视觉系统(暗视)和视锥视觉系统(明视)两个子系统[12]。暗适应条件下,视杆视觉系统是主导斑马鱼视觉的系统[12]。视杆细胞中含有视紫质和视紫红质两种感光色素,视紫质的光谱吸收峰值波长为523 nm,视紫红质的光谱吸收峰值波长为500 nm[24]。本研究表明,暗适应条件下斑马鱼对可见光的光谱敏感性峰值与视紫红质光谱吸收峰值波长一致,且斑马鱼在可见光波段的光谱敏感性曲线与视紫红质的光谱吸收曲线基本吻合,说明暗适应条件下斑马鱼的光谱敏感性主要由视杆细胞中的视紫红质决定。而温度和光线会影响鱼类视杆细胞中视紫质和视紫红质的比率[25],可能会导致不同环境下的斑马鱼光谱敏感性存在差异。此外,不同发育阶段对斑马鱼的光谱敏感性也有影响,如斑马鱼幼鱼在14 dpf(受精时长)时的光谱敏感性峰值为540 nm,而发育到24 dpf时光谱敏感性峰值向短波迁移,为500 nm[11]。本研究结果显示,暗适应的斑马鱼成鱼对可见光的光谱敏感性峰值也为500 nm,说明斑马鱼视杆细胞在24 dpf时可能已经基本发育完全。Douglas等[26-27]认为,生活在水深大于200 m的深水鱼类对470~490 nm波长的光最敏感,而生活在200 m以内浅水的中上层鱼类对490~520 nm的波长最敏感。鱼类视觉系统在长期进化过程中具有适应性特征,斑马鱼光谱敏感性可能是其在长期进化过程中适应了其生活的中上层水层光环境的结果。
3.3 暗适应条件下斑马鱼的紫外敏感性
本研究表明,暗适应状态的斑马鱼不仅对可见光敏感,也表现出对紫外光敏感,在斑马鱼的暗视光谱敏感性的紫外光波段发现了一个敏感峰值(约365 nm处)(图6),且该峰值的波长比视紫红质峰值吸收光谱(500 nm)或视紫质峰值吸收光谱(523 nm)低得多,说明斑马鱼的紫外敏感性并非由视杆细胞介导。而U-视锥细胞视色素的光谱吸收峰值波长为362 nm[6],紫外波段的光谱敏感峰值(365 nm)与U-视锥细胞的峰值吸收光谱(362 nm)相匹配[6],表明暗适应条件下的斑马鱼紫外光谱敏感性由U-视锥细胞介导。这一结果表明,暗适应条件下,斑马鱼的U-视锥细胞参与了暗视视觉,因此,可以判断斑马鱼的短波视觉类型属于Losey等[28]提出的紫外特化型短波视觉。U-视锥细胞是斑马鱼视觉系统中非常重要的组成成分,占总视细胞数的25%,且U-视锥细胞是最先发育的视细胞[6,29]。斑马鱼明视视觉中U-视锥细胞的参与有着重要的生态原因,斑马鱼生活的浅水水域紫外线含量丰富。基于U-视锥细胞的紫外视觉可以增强对猎物的探测能力,有利于斑马鱼生存[30]。而斑马鱼暗视视觉中U-视锥细胞的参与并不意味着斑马鱼在暗适应条件下具有色觉,而是有助于斑马鱼的暗视光谱敏感性功能。暗适应的斑马鱼通过视杆细胞和U-视锥细胞共同作用,扩大了其暗视视觉光谱敏感范围。此外,视锥细胞相对视杆细胞而言对光更为敏感,暗视视觉中U-视锥细胞的参与也有助于增加斑马鱼暗视视觉的灵敏度[28]。
4 结论
1)斑马鱼暗适应90 min以上,其暗视ERG响应趋于稳定。
2)连续的闪光刺激时间间隔大于50 s时不影响后续暗视ERG响应的记录。
3)本试验条件下,暗适应的斑马鱼对可见光(400~700 nm)的光谱敏感性峰值为500 nm,对UV的光谱敏感性峰值为365 nm。其视网膜中的视杆细胞和U-视锥细胞共同参与了暗视视觉,增加了暗视光谱敏感范围,提高了暗视视觉的灵敏度。
[1] ENGESZER R E,PATTERSON L B,RAO A A,et al.Zebrafish in the wild:a review of natural history and new notes from the field[J].Zebrafish,2007,4(1):21-40.
[2] MATSUMOTO T,IHARA H,ISHIDA Y,et al.Spectral sensitivity of juvenile chub mackerel (Scomber japonicus)in visible and ultraviolet light[J].Fish Physiology and Biochemistry,2010,36(1):63-70.
[3] HUGHES A,SASZIK S,BILOTTA J,et al.Cone contributions to the photopic spectral sensitivity of the zebrafish ERG[J].Visual Neuroscience,1998,15(6):1029-1037.
[4] 蔡畅,王丛丛,吴智超,等.Cas9-CRISPR敲除hae3基因对斑马鱼血红蛋白生成的影响[J].大连海洋大学学报,2015,30(6):573-579.
CAI C,WANG C C,WU Z C,et al.Effect of knocking out hae3 gene using Cas9-CRISPR on hemoglobin of zebrafish Danio rerio[J].Journal of Dalian Ocean University,2015,30(6):573-579.(in Chinese)
[5] 狄治朝,周涛,许强华.低氧胁迫与常氧条件下斑马鱼鳃中热休克蛋白基因家族的表达差异比较[J].大连海洋大学学报,2018,33(6):690-695.
DI Z C,ZHOU T,XU Q H,et al.Expression comparisons of heat shock proteins gene in gills of zebrafish exposed to both normoxia and hypoxia[J].Journal of Dalian Ocean University,2018,33(6):690-695.(in Chinese)
[6] ROBINSON J,SCHMITT E A,H ROSI F I,et al.Zebrafish ultraviolet visual pigment:absorption spectrum,sequence,and localization[J].Proceedings of the National Academy of Sciences of the United States of America,1993,90(13):6009-6012.
ROSI F I,et al.Zebrafish ultraviolet visual pigment:absorption spectrum,sequence,and localization[J].Proceedings of the National Academy of Sciences of the United States of America,1993,90(13):6009-6012.
[7] BROCKERHOFF S E,RIEKE F,MATTHEWS H R,et al.Light stimulates a transducin-independent increase of cytoplasmic Ca2+ and suppression of current in cones from the zebrafish mutant nof[J].Journal of Neuroscience,2003,23(2):470-480.
[8] SASZIK S,BILOTTA J,GIVIN C M.ERG assessment of zebrafish retinal development[J].Visual Neuroscience,1999,16(5):881-888.
[9] PITK NEN M.Ex vivo and corneal electroretinogram in temperature determination and functional characterization of the retina[D].Helsinki:Aalto University,2020.
NEN M.Ex vivo and corneal electroretinogram in temperature determination and functional characterization of the retina[D].Helsinki:Aalto University,2020.
[10] WURZIGER K,LICHTENBERGER T,HANITZSCH R.On-bipolar cells and depolarising third-order neurons as the origin of the ERG-b-wave in the RCS rat[J].Vision Research,2001,41(8):1091-1101.
[11] BILOTTA J,SASZIK S,SUTHERLAND S E.Rod contributions to the electroretinogram of the dark-adapted developing zebrafish[J].Developmental Dynamics:An Official Publication of the American Association of Anatomists,2001,222(4):564-570.
[12] MAKHANKOV Y V.Assessment of outer retinal function in genetically modified zebrafish larvae by electroretinography (ERG)[D].Zurich:ETH Zürich,2005.
[13] NÜSSLEIN-VOLHARD C,DAHM R.Zebrafish[M].Oxford:Oxford University Press,2002.
[14] 刘春晓,吕为群,杨志刚,等.TGF-β/Smad信号通路响应光周期变化参与调控斑马鱼卵巢发育[J].南方水产科学,2019,15(3):68-75.
LIU C X,LÜ W G,YANG Z G,et al.TGF-β/Smad signaling pathway responding to photoperiod for participation in regulation of zebrafish ovarian development[J].South China Fisheries Science,2019,15(3):68-75.(in Chinese)
[15] KANMIZUTARU T,ANRAKU K,TOYODA S.Light perception capability of pallial eyes in Japanese moon scallop Amusiumjaponicumas determined by electroretinogram[J].Nippon Suisan Gakkaishi,2005,71(6):928-934.
[16] DEMARCO JR P J,POWERS M K.Sensitivity of ERG components from dark-adapted goldfish retinas treated with APB[J].Brain Research,1989,482(2):317-323.
[17] EVAN D,MILLER R F.Light-evoked potassium activity in mudpuppy retina:its relationship to the b-wave of the electroretinogram[J].Brain Research,1978,154(2):388-394.
[18] KANEKO A,TACHIBANAM.Double color-opponent receptive fields of carp bipolar cells[J].Vision Research,1983,23(4):381-388.
[19] LAMB T D,PUGH JR E N.Dark adaptation and the retinoid cycle of vision[J].Progress in Retinal and Eye Research,2004,23(3):307-380.
[20] 阴正勤.应重视全视野视网膜电图在眼科临床的应用[J].中华眼底病杂志,2009,25(6):409-412.
YING Z Q.The importance of clinical application of full-field electroretinography in ophthalmology[J].Chinese Journal of Ocular Fundus Diseases,2009,25(6):409-412.(in Chinese)
[21] REN J Q,LI L.A circadian clock regulates the process of ERG b-and d-wave dominance transition in dark-adapted zebrafish[J].Vision Research,2004,44(18):2147-2152.
[22] EASTER JR S S,NICOLA G N.The development of vision in the zebrafish (Danio rerio)[J].Developmental Biology,1996,180(2):646-663.
[23] 杨宁,邢怡桥.氧诱导视网膜病变动物模型[J].中华实验眼科杂志,2018,36(1):61-64.
YANG N,XING Y Q.Animal models of oxygen-induced retinopathy[J].Chinese Journal of Experimental Ophthalmology,2018,36(1):61-64.(in Chinese)
[24] SCHWANZARA S A.The visual pigments of freshwater fishes[J].Vision Research,1967,7(3/4):121-148.
[25] MUNZ F W,MCFARLAND W N.Evolutionary adaptations of fishes to the photic environment[M]//CRESCITELLI F,DVORAK C A,EDER D J,et al.The visual system in vertebrates.Berlin:Springer,1977:193-274.
[26] DOUGLAS R H,PARTRIDGE J C.On the visual pigments of deep-sea fish[J].Journal of Fish Biology,1997,50(1):68-85.
[27] DOUGLAS R H,PARTRIDGE J C,MARSHALL N J.The eyes of deep-sea fish I:lens pigmentation,tapeta and visual pigments[J].Progress in Retinal and Eye Research,1998,17(4):597-636.
[28] LOSEY G S,MCFARLAND W N,LOEW E R,et al.Visual biology of Hawaiian coral reef fishes:I.ocular transmission and visual pigments[J].Copeia,2003,2003(3):433-454.
[29] BRANCHEK T,BREMILLERR.The development of photoreceptors in the zebrafish,Brachydanio rerio:I.structure[J].Journal of Comparative Neurology,1984,224(1):107-115.
[30] FRATZER C,DÖRR S,NEUMEYER C.Wavelength discrimination of the goldfish in the ultraviolet spectral range[J].Vision Research,1994,34(11):1515-1520.