斑鳢叉头框转录因子基因Foxl2的克隆表达及性类固醇激素刺激下的表达响应
吴燕铎1,2,欧密1,高丹丹1,2,陈昆慈1,2,罗青1,刘海洋1,赵建1,2*
(1.中国水产科学研究院珠江水产研究所 农业农村部热带亚热带水产资源利用与养殖重点实验室,广东 广州 510380;2.上海海洋大学 水产与生命学院,上海 201306)
摘要:为探究叉头框转录因子Foxl2基因(forkhead transcription factor gene 2)在斑鳢Channa maculata性腺发育过程中的作用,采用RT-PCR和RACE技术克隆出斑鳢Foxl2基因,利用qRT-PCR解析Foxl2基因在雌雄斑鳢1龄成鱼组织、不同发育时期性腺中的表达情况,以及外源性激素诱导后雌雄斑鳢性腺中Foxl2的表达变化,通过酶联免疫法测定性腺不同发育时期雌雄斑鳢血清中的雌性激素(estrogen,E)总含量,并利用免疫组化技术检测性腺中Foxl2蛋白表达的细胞类型。结果表明:克隆获得斑鳢Foxl2 cDNA序列全长为1 939 bp,开放阅读框(ORF)为921 bp,共编码306个氨基酸;组织表达分析显示,Foxl2在卵巢中表达量最高且极显著高于精巢(P<0.01),但在鳃和脑组织中雄鱼表达量显著高于雌鱼(P<0.05);性腺发育时期表达分析显示,Foxl2在卵巢中表达量高于精巢,且在孵化出膜后105 d时,卵巢中表达量达到最高,精巢中表达量最低,两者表达量存在极显著性差异(P<0.01),血清中雌激素总含量变化与之相似;免疫组织化学检测显示,Foxl2蛋白表达于斑鳢卵巢成熟卵母细胞周围的颗粒细胞,精巢中未检测到Foxl2表达信号;经外源性类固醇激素17α-乙炔基雌二醇(17α-ethynylestradio,EE2)和17α-甲睾酮(17α-methyltestosterone,MT)处理后,卵巢中Foxl2的表达均受到抑制,但精巢中表达水平被EE2上调,被MT下调。研究表明,Foxl2基因在斑鳢性腺中呈现明显的性别二态性表达,推测其参与卵巢的发育和维持,通过外源激素诱导,Foxl2可能响应性类固醇激素的调节,本研究从mRNA和蛋白层面初步揭示了Foxl2在斑鳢性腺发育中的重要作用,为深入研究其性别分化机制及性别控制技术提供了科学参考。
关键词:斑鳢;Foxl2基因;克隆;性类固醇激素;mRNA表达分析
中图分类号:S 917.4
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2021-066
文章编号:2095-1388(2022)01-0049-12
收稿日期:2021-03-17
基金项目:财政部和农业农村部:国家现代农业产业技术体系资助(CARS-46);国家自然科学基金(31902351);国家重点研发计划“蓝色粮仓科技创新”项目(2018YFD0901201)
作者简介:吴燕铎(1996—),女,硕士研究生。E-mail:ydwu_1902448082@163.com
通信作者:赵建(1982—),男,博士,副研究员。E-mail:zhaojian@prfri.ac.cn
斑鳢Channa maculata俗称生鱼、财鱼和文鱼,主要分布于珠江流域,以及福建和海南岛各水系,有“两广生鱼”之称。斑鳢隶属于鲈形目Perciformes鳢科Channidae鳢属Channa,其肉嫩味美、肌间刺少,具有适应性强、耐低氧等特点及生肌补血、滋补调养等功效,是一种经济价值较高的鱼类,同时也是中国重要的出口鱼类之一[1]。斑鳢雄性个体的生长明显优于雌性个体,因此,培育具有生长优势的全雄群体将显著提高单位面积的养殖产量,从而提高经济效益。目前,杂交鳢的全雄育种已实现[2],斑鳢作为全雄杂交鳢的父本也已经可以进行性别控制,但其性别分化和性腺发育机制仍不清楚,相关研究相对较少,仅卓孝磊[3]采用组织学方法研究发现,雌性杂交鳢性别分化最早发生于仔鱼出膜后13 d,雄性杂交鳢性别分化发生于仔鱼出膜后29 d,其初级卵母细胞和初级精母细胞的出现,分别发生在出膜后27、34 d。为了更精准地开展鳢的性别调控,需深入研究其性别分化和性腺发育过程中的关键因子。
Foxl2(forkhead transcription factor gene 2)是最早发现的脊椎动物卵巢分化标记基因之一,属于Fox家族的重要成员,在进化过程中非常保守,参与调控脊椎动物卵巢发育与形态维持[4]。Fox(forkhead box)属叉头框转录因子家族,因与果蝇头部基因的叉头结构相似而得名[5],具有101个氨基酸组成的翼状螺旋结构。该家族基因涉及诸如脊椎动物的胚胎发育、细胞周期调控、糖类与脂类代谢、生物老化、免疫调节等多种生物学过程[6]。Foxl2基因在哺乳动物卵巢发育及卵巢功能维持方面发挥重要作用,被认为是卵泡发育所必需的细胞因子[7]。在鸟类中,Foxl2基因主要在生长卵泡的颗粒细胞中表达,并参与调控芳香化酶[8]。在两栖动物皱皮蛙Rana rugosa中,Foxl2蛋白定位于卵母细胞周围的体细胞中,并在卵巢分化早期起关键作用[9]。
许多鱼类的生长具有性别二态性,因此,鱼类性别分化机制一直是研究的热点。Foxl2基因在硬骨鱼类中广泛存在,对多种鱼类研究发现,Foxl2基因主要在性腺、脑和鳃中表达,且卵巢中表达量最高,其表达呈现明显的性别二态性[10]。对青鳉Oryzias latipes[11]、革胡子鲇Clarias gariepinus[12]和尼罗罗非鱼Oreochromis niloticus[13]的研究表明,卵巢分化及发育过程中,Foxl2蛋白持续表达于颗粒细胞,推测该蛋白参与卵巢分化和卵巢功能的维持。Li等[14]对罗非鱼敲除Foxl2基因后发现,雌性个体缺失Foxl2,会导致卵原细胞不同程度退化、Cyp19a1a表达量减少和血清中雌激素含量下降,从而导致罗非鱼完全性逆转。该结果表明,Foxl2基因可以通过调控芳香化酶的表达水平进而影响鱼类性别分化的方向。此外,用性类固醇激素处理虹鳟Oncorhynchus mykiss[15]、稀有鮈鲫Gobiocypris rarus[16]、南方鲇Silurus meridionalis[17]和红鳍东方鲀Takifugu rubripes[18]的研究发现,添加雌激素将上调Foxl2 mRNA表达水平,而雄激素处理则下调该基因表达水平。在对斑鳢性别控制研究中发现,性类固醇激素处理可改变斑鳢性别分化的方向,而Foxl2基因在其中的作用尚未明确。
本研究中,以斑鳢为研究对象,分析了斑鳢Foxl2基因组织表达和不同发育时期性腺中的表达模式,并研究了其在外源性类固醇激素处理下雌雄斑鳢性腺中Foxl2的表达响应,初步探索了Foxl2基因在斑鳢性别分化和性腺发育中的调控作用,以期为斑鳢性别分化机制和性腺发育提供基础资料,并为鳢科鱼类单性育种生产实践提供科学参考。
1 材料与方法
1.1 材料
试验用斑鳢均源自广东省佛山市南海区百容水产良种有限公司,试验用成鱼及幼鱼分别暂养于该公司水泥池(4 m×4 m×2 m)中,每天8∶00、17∶00投喂人工配合颗粒饲料,养殖期间水温为24~28 ℃。
1.2 方法
1.2.1 试验设计与样品的采集处理
1)Foxl2 mRNA在斑鳢不同组织中的表达试验。取1龄成鱼斑鳢,雌雄各3尾,体长为(40.5±3.0)cm,体质量为(995.5±255.5)g,经MS222麻醉剂(Sigma,美国)麻醉(麻醉剂量为1.25 g/mL)后,用无酶的剪刀、镊子取其鳃、肝、脾、肠、中肾、肌肉、头肾、卵巢、精巢、心脏、下丘脑和脑12种组织,用于检测Foxl2 mRNA在斑鳢不同组织中的表达情况。
2)不同发育时期性腺中Foxl2基因表达和血清中雌性激素(estrogen,E)总含量测定试验。取孵化出膜45(第Ⅰ期)、75(第Ⅱ期)、105(第Ⅲ期)、135(第Ⅲ期)、165(第Ⅳ期)、195(第Ⅳ期)和365 d(第Ⅳ期)(均处于发育时期)的斑鳢幼鱼[19],剪取少量尾鳍提取基因组DNA,根据赵建等[20]性染色体连锁标记方法鉴定斑鳢遗传性别。每个时期取雌、雄鱼各5尾,取其性腺,用于检测Foxl2在性腺不同发育时期斑鳢性腺组织中的表达情况。从上述不同发育时期的斑鳢尾柄静脉处抽血0.5~2 mL,4 ℃下静置4~6 h后,以3 000 r/min离心20 min,收集上层血清于-20 ℃下保存,用于检测不同发育时期雌、雄斑鳢血清中雌性激素总含量。
3)外源激素处理后性腺中Foxl2的表达变化试验。将300尾出膜75 d的斑鳢随机分成3组,每组100尾,饲养在3个水泥池中,试验鱼体长为(14.8±0.3)cm,体质量为(61.2±3.8)g。通过开展预试验对试验溶剂进行筛选,发现玉米油充当溶剂时,对鱼体无副作用。因此,对照组注射玉米油,2个处理组分别注射17α-乙炔基雌二醇(17α-ethynylestradio,EE2,Aladdin,上海)和17α-甲睾酮(17α-methyltestosterone,MT,Aladdin,上海)两种性激素。EE2和MT粉末均先用少量无水乙醇溶解,再加入玉米油配制成6 mg/mL的工作液。EE2和MT激素处理组的注射剂量均为10 μg/g(体质量),对照组注射等量玉米油,从腹鳍基部腹腔注射。每组在注射后24、48、72、96、120、144 h,直接用消毒的剪刀镊子剖开腹部取其性腺。每个时间点至少保证每组雌、雄鱼各取5尾,用于检测外源性类固醇激素处理后性腺中Foxl2的表达变化。
将以上样品组织放入冻存管,迅速投入液氮中速冻后置于-80 ℃冰箱保存备用。
4)细胞定位分析试验。取出膜105 d的斑鳢雌、雄性腺组织浸于波恩氏液中,固定24 h后转入75%乙醇(体积分数,下同)中,4 ℃下保存备用。
1.2.2 RNA提取和cDNA的合成 采用Trizol法(Invitrogen,美国),提取斑鳢成鱼卵巢总RNA,采用10 g/L琼脂糖凝胶电泳检测RNA的完整性,采用超微量分光光度计(NanoDrop2000,博奥生物,北京)检测其浓度和纯度(OD260 nm/OD280 nm≥1.8、OD260 nm /OD230 nm≥1.0,表示RNA质量良好);利用六碱基随机引物(TaKaRa,日本)和M-MLV逆转录酶(Promega,美国)合成第一条cDNA链;按照SMARTTM RACE cDNA Amplification扩增试剂盒(TaKaRa,日本)说明书,合成5′RACE和3′RACE cDNA。分别提取斑鳢成鱼各个组织、性腺发育时期、对照组与激素处理组的性腺组织RNA,采用ReverTra Ace qPCR RT试剂盒(Toyobo,日本)将各RNA逆转录为cDNA样品,-20 ℃下保存备用。
1.2.3 斑鳢Foxl2 cDNA的全长克隆及序列分析 根据实验室前期完成的斑鳢转录组数据[19],获得预测的斑鳢Foxl2基因序列,利用Primer 5.0软件设计上、下游引物Foxl2-F1和Foxl2-R1,以斑鳢成鱼卵巢cDNA为模板,扩增获得Foxl2基因的部分序列;再以合成的5′RACE和3′RACE cDNA为模板,根据所得部分序列设计5′RACE和3′RACE的上、下游引物,PCR扩增获得Foxl2基因的5′UTRs和3′UTRs;最后将所得Foxl2的部分序列与5′UTRs和3′UTRs拼接后,设计上、下游特异性引物Foxl2-F2和Foxl2-R2,进行PCR扩增验证。PCR反应体系(20 μL):2×Taq-Master Mix 10 μL(CWBio,北京),10 μmol/L上、下游引物各0.8 μL,500 ng/μL cDNA模板0.5 μL,ddH2O 7.9 μL。反应条件:94 ℃下预变性2 min;94 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸90 s,共进行39个循环;最后在72 ℃下再延伸10 min,4 ℃下保存。PCR产物经10 g/L琼脂糖凝胶电泳检测后,根据Gel Extraction Kit(Omega,美国)对目的条带进行纯化回收。回收的PCR产物与pMD19-T载体(TaKaRa,日本)连接后,转化至感受态细胞DH5α(TaKaRa,日本)。在含氨苄的LB固体培养基中37 ℃培养12 h,将筛选的阳性克隆测序。经测序验证,获得Foxl2 cDNA全长序列。所用引物见表1。
表1 基因克隆和qRT-PCR引物
Tab.1 Primers for gene cloning and qRT-PCR

引物primer引物序列sequence(5′-3′)Foxl2-F1ATGATGGCCACGTACCAFoxl2-R1TTAAATATCAATCCTCGTGTGTAFoxl2-5′RoutGGAGTACGGCGGTTTCTGGGACGFoxl2-5′RinTGTGTTGCTGTCATGGATCATTATGGFoxl2-3′FoutCGTGACCAAACACTCGGCGTTACACFoxl2-3′FinGCCTCTTGTCCTGGTTGTGAACTATGTFoxl2-F2CAACTTTGTATTCCCGCAFoxl2-R2TGTTTTGAAATCACAGGAATFoxl2-qFGAGAAAAATAAAAAAGGTTGGCAFoxl2-qRCGGCGTCTCCTGTAGTTCCβ-actin-qFGCAAGCAGGAGTATGATGAGβ-actin-qRTTGGGATTGTTTCAGTCAGTEF1α-qFGGGACACCCACAATAACATCCEF1α-qRCCAGGCATACTTGAAGGAGC
通过Sequence Manipulation Suite(SMS)(http://www.bio-soft.net/sms/)分析斑鳢Foxl2基因的核苷酸和氨基酸序列,使用简单模块化体系结构研究工具(SMART)(http://www.bio-soft.net/sms/)预测蛋白质结构域特征;通过NCBI(http://www.ncbi.nlm.nih.gov/)中的BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对斑鳢与其他物种的Foxl2 ORF氨基酸序列进行同源比对,并通过ClustalX 2.1(http://www.ebi.ac.uk/tools/clustalx2.1)序列进一步进行多重比对分析;采用MEGA 5.0(http://www.megasoftware.net/)软件中的邻近连接法(Neighbor-Joining,NJ)构建系统进化树,采用自展法(Bootstrap)1 000次来检验树中各节点的置信度。
1.2.4 斑鳢Foxl2基因的组织表达 根据所得斑鳢Foxl2 cDNA序列,设计跨内含子的上、下游特异性引物,以成鱼各组织和不同发育时期性腺组织cDNA为模板,以β-actin(GenBank登录号:KX655845)及EF1α基因(GenBank登录号:KY427701)[21]作为内参基因(表1),利用Applied Biosystems Step One Plus Real-Time PCR System(ABI,美国)进行实时荧光定量PCR(qRT-PCR),每个样品设置3个重复。根据两种内参基因所得Ct值求其平均值,并作为平均内参值,再与目的基因Ct值进行计算,采用2-△△Ct方法计算Foxl2的相对表达量。组织表达分析时,以雄鱼鳃组织的表达水平作为PCR的基线(1.0),不同组织相对表达量为相对于鳃中表达的比率;发育时期表达分析时,以雌鱼出膜45 d的卵巢表达水平作为PCR的基线(1.0),不同发育时期性腺的相对表达量为相对于45 d卵巢表达的比率。同时,以对照组、EE2和MT处理24、48、72、96、120、144 h的性腺组织cDNA为模板,以β-actin及EF1α作为内参基因,检测对照组、EE2处理组和MT处理组的表达情况,采用2△△Ct方法计算Foxl2的相对表达量。
qRT-PCR反应体系(20 μL):SYRB Green Ⅰ(Toyobo,日本)10 μL,10 μmol/L正、反向引物各0.8 μL,500 ng/μL cDNA 1 μL,ddH2O 7.4 μL。每个试验样品设置3个重复。扩增程序:94 ℃下预变性2 min;94 ℃下变性15 s,60 ℃下退火30 s,72 ℃下延伸30 s,共进行36个循环。熔解曲线程序:94 ℃下反应15 s,60 ℃下反应30 s,94 ℃下反应15 s。
1.2.5 斑鳢血清中雌性激素(E)总含量测定 利用酶联免疫法(ELISA)检测不同发育时期雌、雄斑鳢血清中E的含量,具体操作参考试剂盒(货号ml003454,96T)说明书。采用MultiskanTM FC酶标仪(Thermo Fisher,美国)在450 nm波长下测定吸光度(OD值),通过绘制标准曲线得出公式并计算各样品中E的含量。雌激素检测试剂盒购自上海酶联生物科技有限公司。
1.2.6 细胞定位分析 取出用波恩氏液固定的雌、雄斑鳢性腺组织标本保存于75%乙醇中,用由低到高浓度梯度乙醇脱水,用二甲苯透明,浸蜡后进行石蜡包埋,5 μm厚度连续切片。组织切片经二甲苯脱蜡后,放入0.01 mol/L pH 6.0柠檬酸钠缓冲液(Sigma,美国)中,微波抗原修复15 min;滴加体积分数为5%的牛血清,置于37 ℃下湿盒中封闭15 min;滤纸吸去血清后,直接滴加斑鳢Foxl2多克隆抗体(PBS稀释比例为1∶50),37 ℃下孵育1 h,阴性对照用未免疫兔血清代替一抗;PBS反复洗脱后,滴加HRP Goat Anti-Rabbit二抗(PBS稀释比例为1∶2 000),37 ℃下孵育30 min;用PBST和PBS分别洗脱3次,每次5 min;DAB(Millipore,美国)显色后,用苏木素进行复染,常规洗脱后封片,最后利用倒置荧光成像系统(Nikon Ri2,日本)进行显微观察与拍照。一抗斑鳢Foxl2多克隆抗体根据农业农村部热带亚热带水产资源利用与养殖重点实验室提供的蛋白质序列,人工合成目的基因插入表达载体,由武汉戴安生物技术有限公司制备完成,经过Western blot验证,抗体特异性良好。HRP Goat Anti-Rabbit二抗购自美国赛默飞公司。
1.3 数据处理
采用Excel 2019软件对qRT-PCR和血清中雌性激素总含量的试验数据进行统计分析,试验数据均采用平均值±标准误(mean±S.E.)表示。使用SPSS 24.0软件对试验数据进行单因素方差分析,显著性水平设为0.05。
2 结果与分析
2.1 斑鳢Foxl2基因序列分析
克隆得到斑鳢Foxl2基因的cDNA序列全长为1 939 bp(GenBank登录号:MW574989),包括210 bp 5′UTRs、921 bp开放阅读框及808 bp 3′UTRs,共编码306个氨基酸(aa),含有2个RNA不稳定基序(attta)和2个多聚腺苷酸序列(aataa),Forkhead domain区域位于47 aa~135 aa处(图1)。
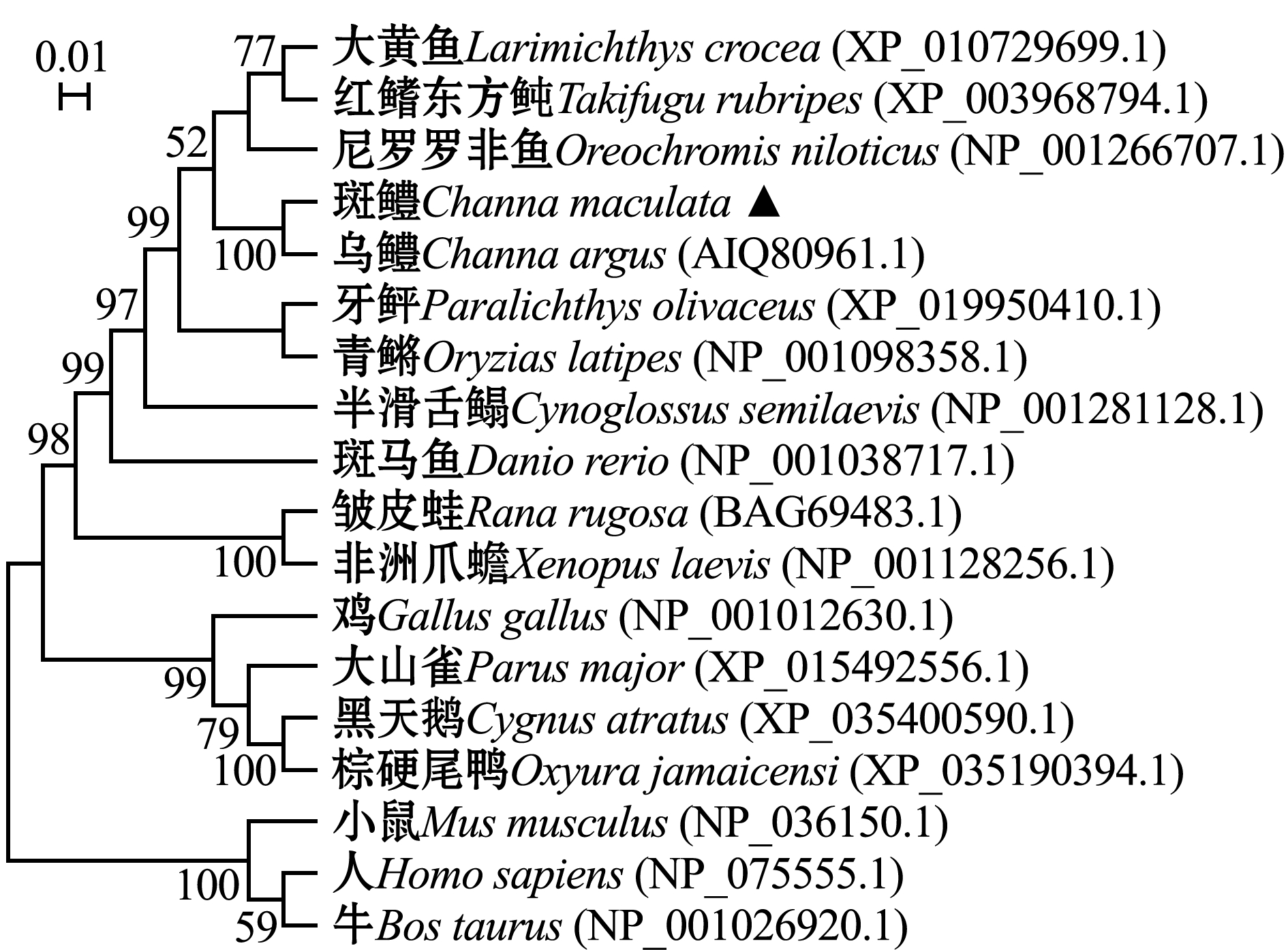
与其他物种Foxl2氨基酸序列同源性比对显示(图2),斑鳢Foxl2氨基酸序列与硬骨鱼类具有同源性,其中,与乌鳢Channa argus氨基酸序列一致性达到99.67%,与大黄鱼Larimichthys crocea、尼罗罗非鱼、青鳉Oryzias latipes、黄鳝Monopterus albus的序列一致性达到90%以上,与热带爪蟾Xenopus tropicalis、斑马鱼Danio rerio(Foxl2a)、鸡Gallus gallus的序列一致性达到80%以上,与人类Homo sapiens、小鼠Mas musculus、牛Bos taurus等哺乳动物的序列一致性分别为56.38%、58.09%、55.82%。
采用MEGA 5.0软件以邻近法构建系统发育树,结果如图3所示,系统进化树可分为4个大支,其中,硬骨鱼类Foxl2氨基酸序列聚为一支,斑鳢Foxl2与乌鳢的亲缘关系最近,然后与两栖类聚为一支,与鸟类、哺乳类的亲缘关系最远。系统发育树结果显示,斑鳢Foxl2的系统进化关系与传统物种进化地位基本一致。
2.2 Foxl2 mRNA在斑鳢成鱼组织中的表达分布
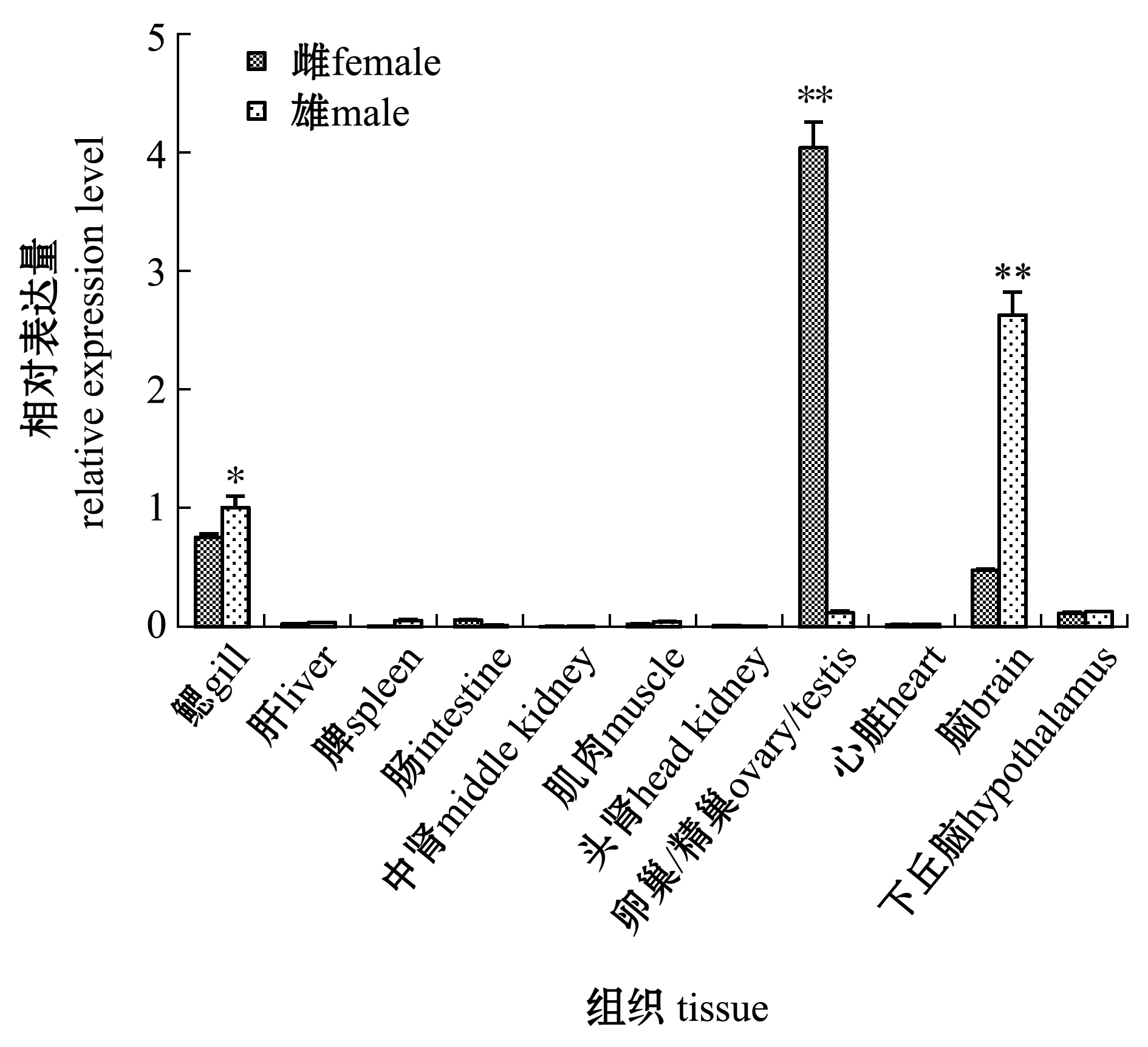
通过qRT-PCR技术,检测1龄斑鳢雌鱼、雄鱼各组织中Foxl2基因的表达情况。从图4可见:Foxl2在斑鳢卵巢中的表达量最高且极显著高于精巢(P<0.01);在鳃和脑中均有表达,其中雄鱼鳃中的表达量显著高于雌鱼(P<0.05),雄鱼脑中的表达量极显著高于雌鱼(P<0.01);在其他组织中几乎不表达。
2.3 Foxl2 mRNA在不同发育时期性腺中的表达
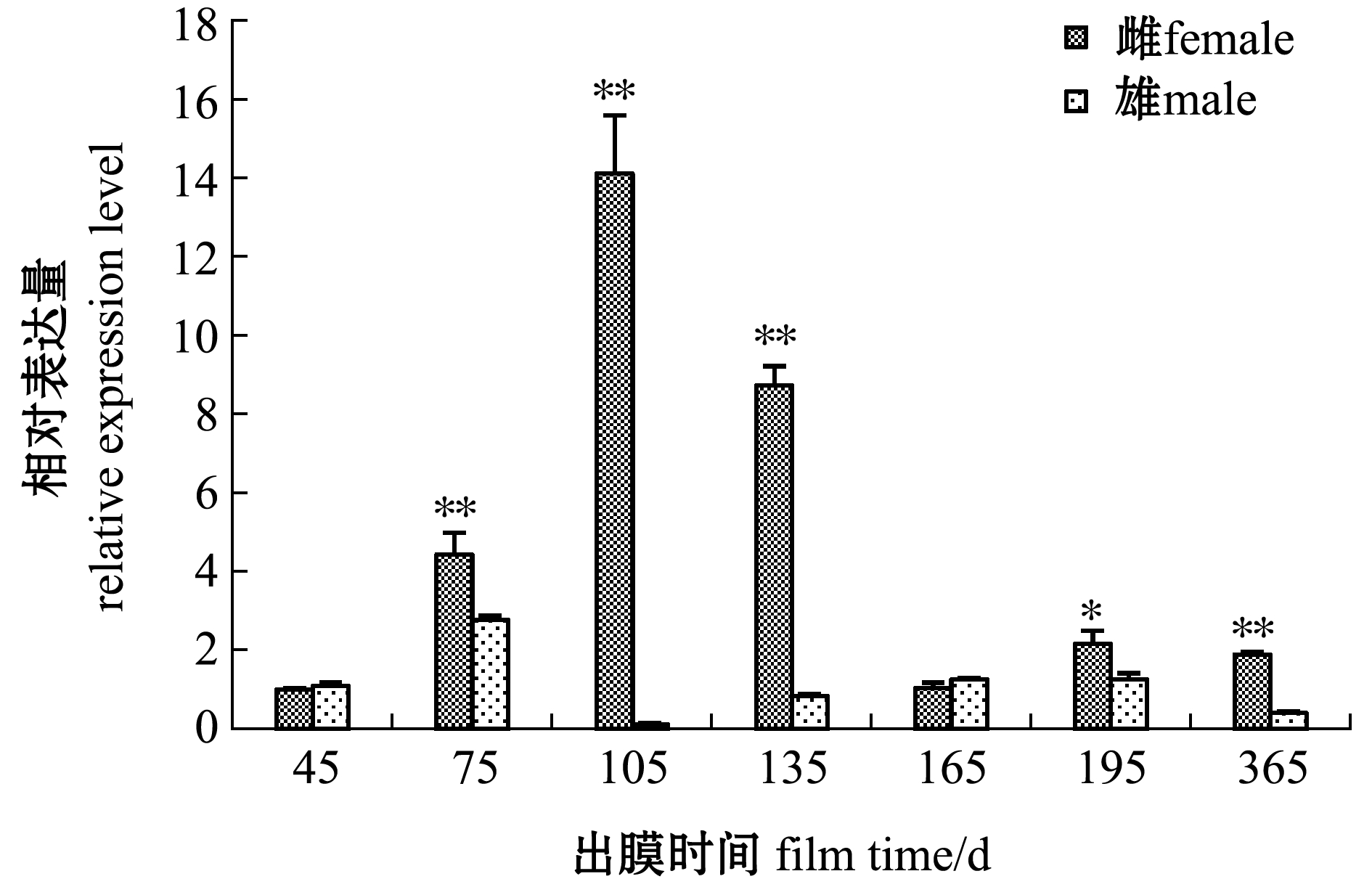
从图5可见:在不同发育时期,Foxl2在斑鳢卵巢中的表达量大多显著高于精巢(P<0.05),仅在出膜45、165 d时稍低于精巢(P>0.05);在雌性个体中,随着性腺发育时期的延长卵巢中Foxl2的表达先上升,在出膜105 d时表达量达到最高且极显著高于精巢(P<0.01),此时Foxl2雌性表达量约为雄性的117.41倍,随后缓慢下降至稍高于起始水平;在雄性个体中,精巢中Foxl2的表达量在出膜75 d时达到最高水平且极显著低于卵巢(P<0.01),随后下降至105 d时的最低水平,然后缓慢上升,一直保持较低水平的表达。
2.4 Foxl2蛋白在斑鳢性腺中的表达细胞类型
为进一步定位Foxl2蛋白在斑鳢性腺中的表达部位,采用免疫组织化学方法对出膜105 d的斑鳢精巢与卵巢进行免疫检测。通过组织切片发现,斑鳢性腺在出膜105 d时已经完成分化,卵巢中存在卵原细胞、初级卵母细胞、成长期卵母细胞和成熟卵母细胞,且以成长期卵母细胞为主;精巢中存在精原细胞、精母细胞、精细胞和精子,且精子数量较多。在卵巢成熟卵母细胞周围的颗粒细胞中,检测到Foxl2蛋白的表达,呈现明显较强的阳性信号(图6D、E、F),在其他细胞中未检测到信号;在精巢所有细胞中都未检测到Foxl2蛋白的表达信号(图6J、K,L);此外,斑鳢卵巢(图6A、B、C)与精巢(图6G、H、I)的阴性对照中均未检测到阳性信号。
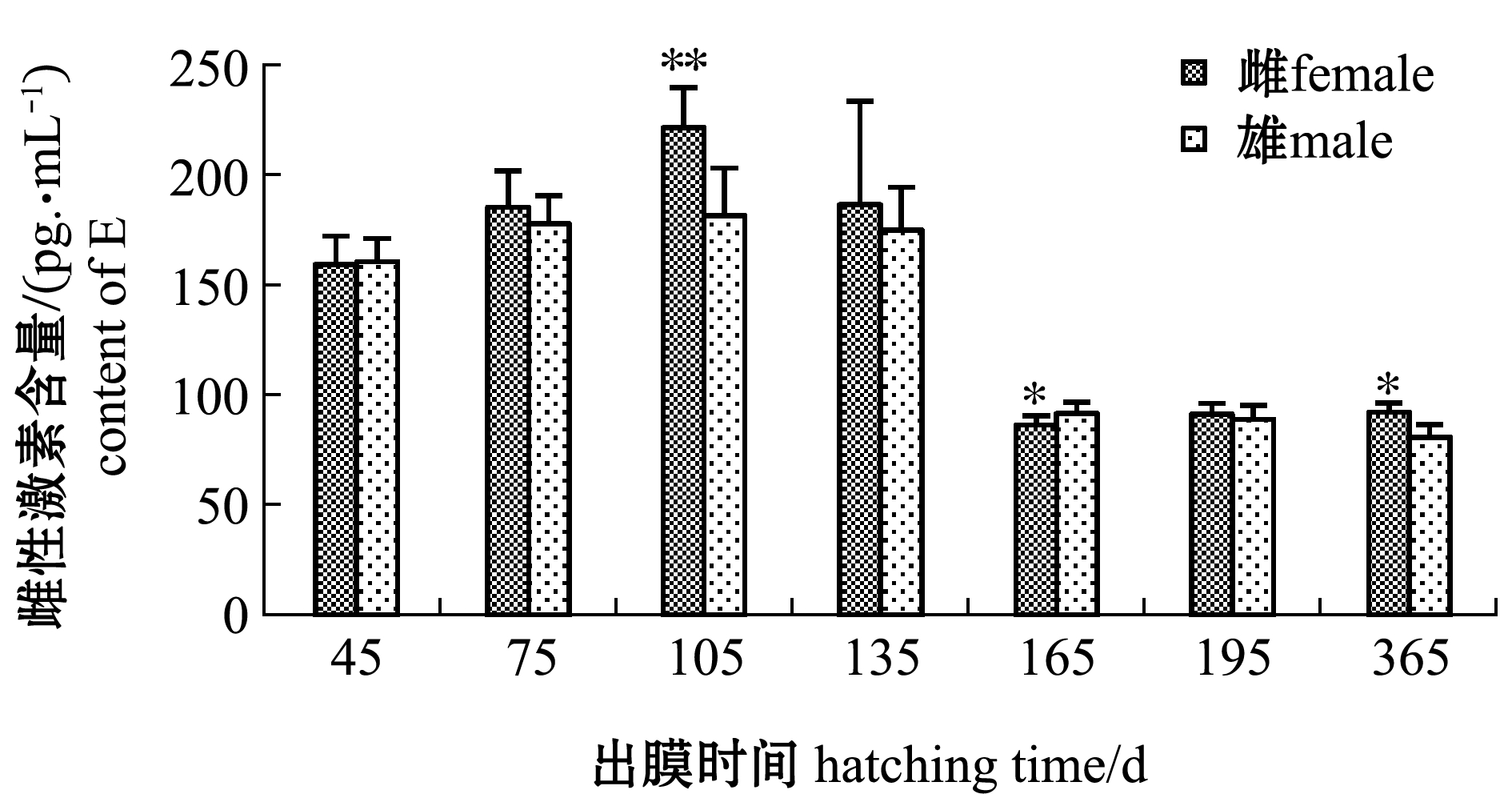
2.5 不同发育时期斑鳢血清中雌性激素总含量变化
从图7可见:在不同发育时期,雌性个体血清中雌性激素总含量总体上高于雄性,血清中E水平呈现先上升后下降趋势,但在出膜45、165 d时,雄性个体血清中E含量分别高于雌性,这与性腺不同发育时期卵巢中Foxl2基因的表达相似;出膜105 d时,雌性斑鳢血清中的E含量达到最高且极显著性高于雄性个体(P<0.01)。
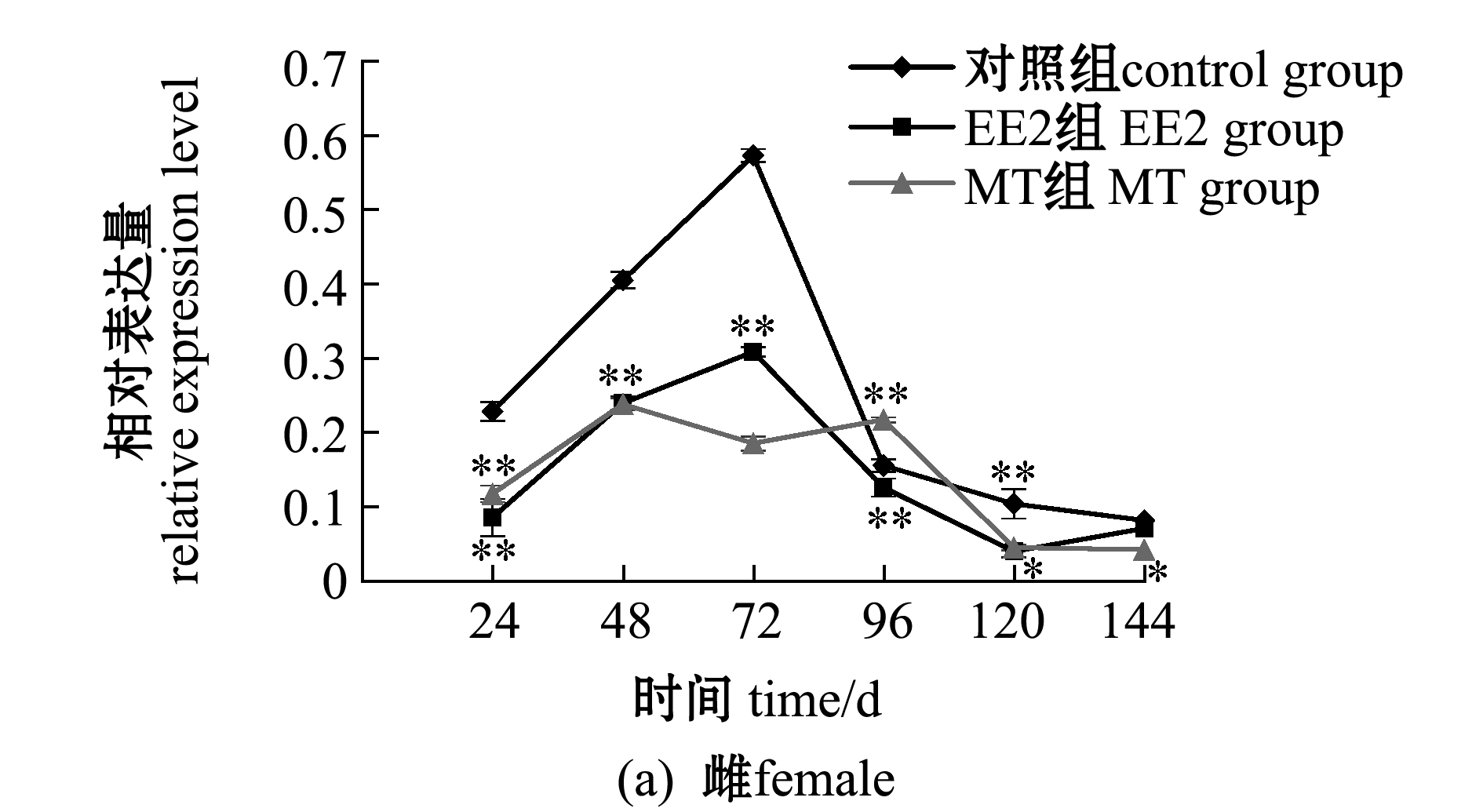
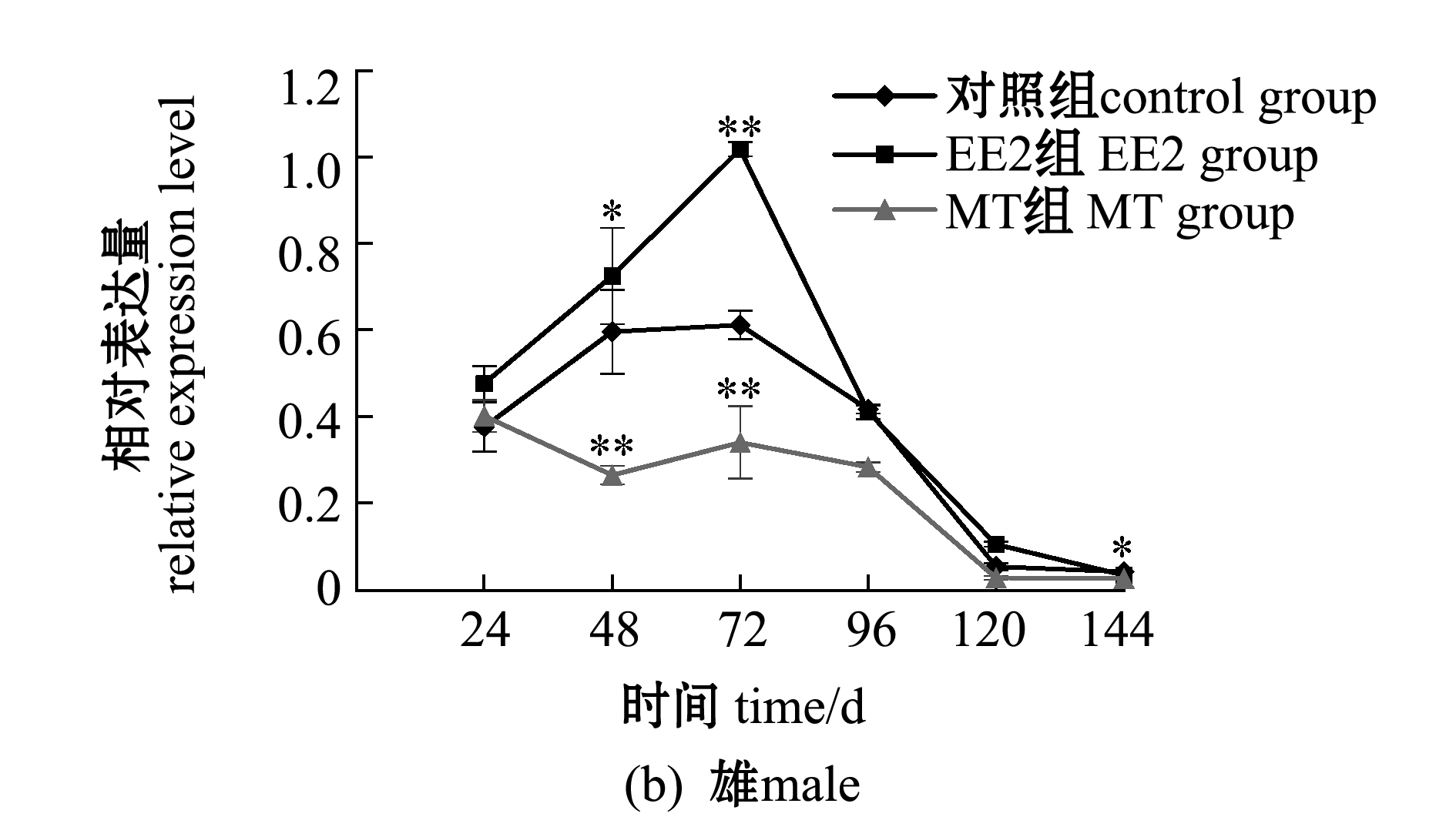
2.6 EE2、MT处理对性腺中Foxl2表达的影响
以对照组Foxl2基因表达量为参照,分析EE2和MT处理24、48、72、96、120、144 h后,75日龄斑鳢雌、雄性腺中Foxl2的表达(图8)。
从图8(a)可见:在雌性斑鳢中,注射EE2和MT后,卵巢中Foxl2的表达受到抑制,EE2处理组的Foxl2表达先缓慢上升,72 h时达到最高峰,随后下降至初始表达水平,MT处理组的Foxl2表达呈现波动变化,但其表达量总体低于对照组;注射EE2和MT后144 h内,Foxl2的表达量总体上低于对照组,但在注射MT后96 h时,MT处理组Foxl2的表达量极显著高于对照组(P<0.01);除此之外,120 h内,EE2和MT处理均极显著下调了卵巢中Foxl2 mRNA表达水平(P<0.01)。
从图8(b)可见:在雄性斑鳢中,EE2处理组精巢中的Foxl2表达量总体上高于对照组和MT组,MT处理组的Foxl2表达量总体上低于对照组或与对照组水平持平;注射EE2后,Foxl2的表达显著上升,72 h时出现峰值,此时EE2极显著上调了精巢中Foxl2的表达(P<0.01),随后逐渐下降至对照组水平;随着时间的变化,对照组呈现先上升后下降的趋势;而注射MT后,精巢中Foxl2的表达一直呈下降趋势,最后下降至对照组水平,这说明其表达被抑制。
3 讨论
3.1 Foxl2基因在斑鳢不同组织和性腺发育时期的表达变化
Foxl2基因是雌性发育过程中的一个关键因子。大多数硬骨鱼类性腺中,Foxl2基因呈现明显的性别二态性表达模式,并在脑和鳃组织中有不同程度地表达[10,22-25](表2)。
表2 不同鱼类中Foxl2基因的组织表达比较
Tab.2 Comparison of expression of Foxl2 gene in tissues of different fishes

物种species研究结果research result参考文献reference极边扁咽齿鱼Platypharodon extremus卵巢中高表达,雌鱼脑组织中的表达量高于雄鱼,但在鳃组织中,雄鱼的表达量高于雌鱼杨濯羽等[22]乌鳢Channa argus卵巢中高表达,雄鱼脑和鳃组织中的表达量均高于雌鱼Wang等[23]稀有鮈鲫Gobiocypris rarus卵巢、脑、鳃组织中均有表达,雌鱼脑和鳃组织中的表达量高于雄鱼王雪芹[24]南方鲇Silurus meridionalis卵巢的表达量显著高于精巢,且雌鱼脑和鳃组织的表达量高于雄鱼吴风瑞[10]白斑狗鱼Esox lucius卵巢中高表达,鳃和脑组织中均有不同程度的表达唐露等[25]
本研究表明,Foxl2基因在斑鳢卵巢中高度特异性表达,其mRNA表达水平极显著高于精巢,说明Foxl2在斑鳢中的表达和其他鱼类一样,表现出明显的性别二态性。同时,本试验中Foxl2在斑鳢脑和鳃组织中均有较高程度的表达,且雄鱼的表达量显著高于雌鱼,这一结果与对乌鳢的研究结果完全一致;同时,该结果也与极边扁咽齿鱼Platypharodon extremus[22]和白斑狗鱼Esox lucius[25]雄鱼鳃中表达量高于雌鱼的结果一致。综上所述,Foxl2基因可能不仅对斑鳢卵巢分化起到一定的调控作用,还可能参与脑-垂体-性腺轴的调节。对网纹石斑鱼Epinephelus merra[26]、三斑海猪鱼Halichoeres trimaculatus[4]的研究也得出相似的结果。此外,本研究中斑鳢鳃中Foxl2的表达水平较高,推测与鳃的发育有关,该部分内容尚需进一步研究。
Foxl2蛋白主要表达于青鳉雌性发育性腺中的体细胞;成体中,Foxl2蛋白定位在卵巢卵泡细胞,包括颗粒细胞、鞘膜细胞和卵母细胞周围的体细胞[11,27]。对革胡子鲇[12]、黄鳝Monopterus albus[28]和尼罗罗非鱼[13]的研究证实,Foxl2蛋白的表达仅限于颗粒细胞,而在卵母细胞中不表达;对乌鳢成熟性腺中Foxl2蛋白定位发现,在卵母细胞周围的颗粒细胞中检测到Foxl2蛋白表达,这与对早期性腺的研究结果一致[23]。本研究中,斑鳢Foxl2蛋白主要在成熟卵母细胞周围的颗粒细胞中表达,而在卵母细胞中不表达。这与对黄鳝、青鳉、乌鳢的研究结果相同,推测Foxl2可能对斑鳢卵细胞维持具有重要作用。
对尼罗罗非鱼[13]和刀鲚Coilia nasus[29]的研究发现,Foxl2基因在卵巢发育早期开始表达,随着卵巢的发育,其表达量逐渐增加,在卵巢发育后期Foxl2的表达量逐渐降低;对青鳉的研究表明,Foxl2表达量在卵巢发育初期至接近成熟期略微升高[11];在出膜49 d的大黄鱼卵巢中,Foxl2基因开始持续高表达,随后在出膜123 d之后下降至高于起始表达水平,精巢中,前期Foxl2表达量处于较低水平,出膜84 d时表达量有所上升,随后下降至较低水平的表达,其表达量始终远低于卵巢[30];在金钱鱼Scatophagus argus[31]精巢中,Foxl2的表达量在起始达到最大值后,随后出现较低表达甚至不表达。本研究表明,在斑鳢性腺发育过程中,Foxl2的表达量同样存在上述时空差异性,Foxl2基因在卵巢发育过程中持续上升表达,在出膜105 d时,卵巢中以成长期卵母细胞为主,处于卵巢发育的第Ⅲ期,此时Foxl2的表达量达到最高;随着卵巢的发育,接近成熟期时,即卵巢中以成熟卵母细胞为主,处于卵巢发育的第Ⅳ期,Foxl2表达量逐渐降低,出膜365 d时下降至稍高于起始表达水平;精巢中Foxl2的表达量显著低于卵巢,其表达呈现波动变化且一直维持较低水平的表达。由此推测,该基因可能在斑鳢卵巢中起促进卵母细胞成长成熟的作用。
3.2 斑鳢血清中雌性激素总含量的变化
雌激素是一种由内分泌系统产生的多效性类固醇激素,在脊椎动物中的作用主要是促进性腺的发育和生殖细胞的成熟。周惠强[32]对大刺鳅Mastacembelus armatus研究发现,雌、雄鱼血清中雌性激素含量随着性腺发育逐渐增加,第Ⅴ期时达到最大值,成熟期(第Ⅵ期)开始下降至较低水平;何飞祥[33]研究发现,在金钱鱼性腺发育过程中,雌鱼中雌激素水平整体比雄鱼高,雌鱼雌激素水平从Ⅱ期至Ⅳ期逐渐增加,而雄鱼血清中雌激素含量从Ⅲ期至Ⅳ期呈现上升的趋势,两者均在Ⅳ期达到最大值后出现下降;闫浩[34]对滩头雅罗鱼Tribolodon brandti研究显示,雌鱼血清中雌性激素含量随卵巢的发育而不断升高,雄鱼血清中雌激素含量总体上低于雌性,两者均在第Ⅳ期达到峰值,到达成熟期后呈下降趋势。本研究中,斑鳢雌性激素水平的变化与上述研究结果类似,雌、雄鱼血清中雌性激素水平呈现先上升后下降的趋势,且雌性个体血清中的雌性激素含量整体高于雄性,随着性腺的发育,在卵巢发育的第Ⅲ期(出膜105 d),雌雄鱼血清中雌性激素总含量均达到最高,且雌鱼血清中雌性激素总含量极显著高于雄性个体,到达成熟期第Ⅳ期后,雌性个体中的激素水平则逐渐下降,推测雌性激素在斑鳢雌鱼的性腺发育和维持性别特征方面发挥着重要作用[35]。
3.3 外源性激素对斑鳢Foxl2基因表达的影响
外源性类固醇激素一般用来探究对性别相关基因的表达调节作用以及获得性逆转个体。本研究中,外源性类固醇激素的注射可以引起斑鳢Foxl2在雌、雄鱼性腺中的表达变化,说明Foxl2可能是通过响应类固醇激素调节调控斑鳢性腺的分化和发育。本研究中发现,雄性个体中EE2处理后Foxl2 mRNA的表达水平被上调,MT处理后则下调。Foxl2是雌性高表达基因,EE2处理后雄性Foxl2的表达出现上调,说明雌激素促进了雄鱼中Foxl2的表达,这与对虹鳟[36]、稀有鮈鲫[16]、黄颡鱼Pelteobagrus fulvidraco[37]的研究结果一致。在雌性斑鳢中,EE2和MT均抑制Foxl2的表达,这与南方鲇[17]、稀有鮈鲫[38]中EE2促进Foxl2表达的研究结果相悖。李国超[39]在探究不同浓度雌二醇处理对斑马鱼雌性相关基因的表达影响中推测,外源激素浓度过高,会抑制内源激素的分泌,从而影响雌性相关基因的表达;朱阳阳等[40]利用不同浓度雌二醇处理雄性大黄鱼的研究结果与其类似。因此,推测注射EE2后,雌性体内雌激素过高,通过负反馈机制抑制了雌性斑鳢内源雌激素的分泌,故而雌性斑鳢中Foxl2的表达也受到抑制。吕晴霁[41]对出膜90 d的斜带石斑鱼研究发现,投喂MT后,Foxl2的表达量较对照组出现了下降;李广丽等[42]对出膜18 d的胡子鲇Clarias fuscus研究表明,MT处理后,下调了Foxl2 mRNA的表达水平,这与对斑鳢的研究结果一致。
4 结论
1)Foxl2基因在斑鳢性腺中的表达模式呈现明显的性别二态性,且其表达量随着卵巢发育时期变化,这说明Foxl2基因在斑鳢卵母细胞成长成熟和维持卵巢正常发育过程中起重要作用。
2)外源性激素EE2促进斑鳢精巢中Foxl2的表达,MT抑制Foxl2的表达,说明Foxl2可响应性类固醇激素的调节,推测Foxl2基因在斑鳢性别分化与性腺发育中起重要作用,但需要进一步研究予以证实。
3)Foxl2蛋白主要在斑鳢成熟卵母细胞周围的颗粒细胞中表达,推测Foxl2可能通过颗粒细胞对生殖细胞发挥作用。
参考文献:
[1] 石琼,范明君,张勇.中国经济鱼类志[M].武汉:华中科技大学出版社,2015:274-276.
SHI Q,FAN M J,ZHANG Y.Chinese economic fish journal[M].Wuhan:Huazhong University of Science and Technology Press,2015:274-276.(in Chinese)
[2] OU M,YANG C,LUO Q,et al.An NGS-based approach for the identification of sex-specific markers in snakehead (Channa argus)[J].Oncotarget,2017,8(58):98733-98744.
[3] 卓孝磊.杂交鳢[乌鳢(Channa argus)♂×斑鳢(C.maculate)♀] 性腺分化与发育的研究[D].广州:华南农业大学,2009.
ZHUO X L.Studies on the gonadal differentiation and development of hybrid snakehead northern snakehead (Channa argus)♂ ×Taiwan snakehead (C.maculate)♀ [D].Guangzhou:South China Agricultural University,2009.(in Chinese)
[4] KOBAYASHI Y,HORIGUCHI R,NOZU R,et al.Expression and localization of forkhead transcriptional factor 2 (Foxl2)in the gonads of protogynous wrasse,Halichoeres trimaculatus[J].Biology of Sex Differences,2010,1(1):3.
[5] 高丽丽,刁小明,李云,等.中华鳖Foxl2基因克隆及外源性激素对其表达的影响[J].水生生物学报,2019,43(1):45-51.
GAO L L,DIAO X M,LI Y,et al.Molecular cloning and expression of Foxl2 gene induced by exogenous hormone in the Pelodiscus sinensis[J].Acta Hydrobiologica Sinica,2019,43(1):45-51.(in Chinese)
[6] UHLENHAUT N H,TREIER M.Forkhead transcription factors in ovarian function[J].Reproduction,2011,142(4):489-495.
[7] CHEN H J,PALMER J S,THIAGARAJAN R D,et al.Identification of novel markers of mouse fetal ovary development[J].PLoS One,2012,7(7):e41683.
[8] KOBA N,OHFUJI T,HA Y,et al.Profiles of mRNA expression of Foxl2,P450arom,DMRT1,AMH,P450c17,SF1,ERα and AR,in relation to gonadal sex differentiation in duck embryo[J].The Journal of Poultry Science,2008,45(2):132-138.
[9] OSHIMA Y,UNO Y,MATSUDA Y,et al.Molecular cloning and gene expression of Foxl2 in the frog Rana rugosa[J].General and Comparative Endocrinology,2008,159(2/3):170-177.
[10] 吴风瑞.南方鲇Foxl2基因克隆、表达及其在性腺分化中作用的初步研究[D].重庆:西南大学,2007.
WU F R.Molecular cloning,gene expression of Foxl2 and its possible role in sex gonadal differentiation in southern catfish,Silurus meridionalis Chen[D].Chongqing:Southwest University,2007.(in Chinese)
[11] NAKAMOTO M,MATSUDA M,WANG D S,et al.Molecular cloning and analysis of gonadal expression of Foxl2 in the medaka,Oryzias latipes[J].Biochemical and Biophysical Research Communications,2006,344(1):353-361.
[12] SRIDEVI P,SENTHILKUMARAN B.Cloning and differential expression of Foxl2 during ovarian development and recrudescence of the catfish,Clarias gariepinus[J].General and Comparative Endocrinology,2011,174(3):259-268.
[13] WANG D S,KOBAYASHI T,ZHOU L Y,et al.Molecular cloning and gene expression of Foxl2 in the Nile tilapia,Oreochromis niloticus[J].Biochemical and Biophysical Research Communications,2004,320(1):83-89.
[14] LI M H,YANG H H,LI M R,et al.Antagonistic roles of Dmrt1 and Foxl2 in sex differentiation via estrogen production in tilapia as demonstrated by TALENs[J].Endocrinology,2013,154(12):4814-4825.
[15] BARON D,COCQUET J,XIA X H,et al.An evolutionary and functional analysis of Foxl2 in rainbow trout gonad differentiation[J].Journal of Molecular Endocrinology,2004,33(3):705-715.
[16] JIANG W B,YANG Y H,ZHAO D M,et al.Effects of sexual steroids on the expression of foxl2 in Gobiocypris rarus[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2011,160(4):187-193.
[17] LIU Z H,WU F R,JIAO B W,et al.Molecular cloning of double sex and mab-3-related transcription factor 1,forkhead transcription factor gene 2,and two types of cytochrome P450 aromatase in southern catfish and their possible roles in sex differentiation[J].Journal of Endocrinology,2007,194(1):223-241.
[18] HU P,LIU B,MA Q,et al.Expression profiles of sex-related genes in gonads of genetic male Takifugu rubripes after 17β-estradiol immersion[J].Journal of Oceanology and Limnology,2019,37(3):1113-1124.
[19] OU M,CHEN K C,GAO D D,et al.Comparative transcriptome analysis on four types of gonadal tissues of blotched snakehead (Channa maculata)[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2020,35:100708.
[20] 赵建,陈昆慈,朱新平,等.用于斑鳢性别鉴定的SNP位点及其检测方法:106119378B[P].2019-01-01.
ZHAO J,CHEN K C,ZHU X P,et al.SNP loci and their detection methods for sex identification of Channa maculata:106119378B[P].2019-01-01.(in Chinese)
[21] MAO H,CHEN K,ZHU X,et al.Identification of suitable reference genes for quantitative real-time PCR normalization in blotched snakehead Channa maculata[J].Journal of Fish Biology,2017,90(6):2312-2322.
[22] 杨濯羽,娄忠玉,王太,等.极边扁咽齿鱼Foxl2基因的克隆及组织表达[J].甘肃畜牧兽医,2018,48(9):58-61.
YANG Z Y,LOU Z Y,WANG T,et al.Cloning and tissue expression of Foxl2 gene from Platypharodon extremus[J].Gansu Animal Husbandry and Veterinary Medicine,2018,48(9):58-61.(in Chinese)
[23] WANG D D,ZHANG G R,WEI K J,et al.Molecular identification and expression of the Foxl2 gene during gonadal sex differentiation in northern snakehead Channa argus[J].Fish Physiology and Biochemistry,2015,41(6):1419-1433.
[24] 王雪芹.稀有鮈鲫Foxl2基因的克隆及内分泌干扰物对其表达的影响[D].杨凌:西北农林科技大学,2013.
WANG X Q.Molecular cloning and characterization of Foxl2 gene and its response to endocrine disrupting chemicals in rare minnow[D].Yangling:Northwest A &F University,2013.(in Chinese)
[25] 唐露,胡琼,赵瑞阳,等.白斑狗鱼(Esox lucius)Foxl2基因克隆及其表达[J].贵州农业科学,2020,48(5):97-101.
TANG L,HU Q,ZHAO R Y,et al.Cloning and expression of Foxl2 gene in Esox lucius[J].Guizhou Agricultural Science,2020,48(5):97-101.(in Chinese)
[26] ALAM M A,KOBAYASHI Y,HORIGUCHI R,et al.Molecular cloning and quantitative expression of sexually dimorphic markers Dmrt1 and Foxl2 during female-to-male sex change in Epinephelus merra[J].General and Comparative Endocrinology,2008,157(1):75-85.
[27] WANG D S,KOBAYASHI T,ZHOU L Y,et al.Foxl2 up-regulates aromatase gene transcription in a female-specific manner by binding to the promoter as well as interacting with ad4 binding protein/steroidogenic factor 1[J].Molecular Endocrinology,2007,21(3):712-725.
[28] HU Q,GUO W,GAO Y,et al.Molecular cloning and analysis of gonadal expression of Foxl2 in the rice-field eel Monopterus albus[J].Scientific Reports,2014,4(1):6884.
[29] FANG D A,YANG X J,FENG X T,et al.Foxl2 combined with Cyp19a1a regulate the spawning upstream migration in Coilia nasus[J].Gene,2019,710:310-315.
[30] 林爱强.大黄鱼性别特异分子标记及部分性别相关基因的初步研究[D].厦门:集美大学,2017.
LIN A Q.Study of sex-specific molecular markers and some sex-related genes in large yellow croaker (Larimichthys crocea)[D].Xiamen:Jimei University,2017.(in Chinese)
[31] LIU H F,MU X J,GUI L,et al.Characterization and gonadal expression of Foxl2 relative to Cyp19a genes in spotted scat Scatophagus argus[J].Gene,2015,561(1):6-14.
[32] 周惠强.大刺鳅(Mastacembelus armatus)繁殖生物学研究[D].广州:广州大学,2019.
ZHOU H Q.Reproductive biology of Mastacembelus armatus[D].Guangzhou:Guangzhou University,2019.(in Chinese)
[33] 何飞祥.金钱鱼雌雄性腺转录组分析及性类固醇激素水平的研究[D].湛江:广东海洋大学,2019.
HE F X.Transcriptome analysis of male and female gonads and study on sex steroid hormone in spotted scat (Scatophagus argus)[D].Zhanjiang:Guangdong Ocean University,2019.(in Chinese)
[34] 闫浩.两类生殖激素在滩头雅罗鱼性腺发育周期中的作用研究[D].上海:上海海洋大学,2017.
YAN H.Study on the role of two kinds of reproductive hormones in gonadal developmental cycle of Tribolodon brandti[D].Shanghai:Shanghai Ocean University,2017.(in Chinese)
[35] 徐文刚,唐永政,张建柏,等.黑边石斑鱼卵巢周年发育及血清中性激素含量的变化[J].大连海洋大学学报,2020,35(5):657-662.
XU W G,TANG Y Z,ZHANG J B,et al.Annual ovarian development and changes in the concentration of serum sex hormones in blacktip grouper Epinephelus fasciatus[J].Journal of Dalian Ocean University,2020,35(5):657-662.(in Chinese)
[36] VIZZIANO-CANTONNET C,BARON D,MAH S,et al.Estrogen treatment up-regulates female genes but does not suppress all early testicular markers during rainbow trout male-to-female gonadal transdifferentiation[J].Journal of Molecular Endocrinology,2008,41(5):277-288.
S,et al.Estrogen treatment up-regulates female genes but does not suppress all early testicular markers during rainbow trout male-to-female gonadal transdifferentiation[J].Journal of Molecular Endocrinology,2008,41(5):277-288.
[37] 王欣欣.17α-乙炔基雌二醇对黄颡鱼稚鱼性逆转的诱导作用及关键基因筛选[D].扬州:扬州大学,2019.
WANG X X.Induced effects of 17α-ethinylestradiol on sex reversal of yellow catfish larvae(Pelteobagrus fulvidraco)and screening of key genes during sex reversal[D].Yangzhou:Yangzhou University,2019.(in Chinese)
[38] 袁聪.17α-乙炔基雌二醇对稀有鮈鲫性别特异性基因表达的影响[D].杨凌:西北农林科技大学,2014.
YUAN C.Effects of 17α-ethinylestradiol on the expression of gender-special genes in Gobiocypris rarus[D].Yangling:Northwest A &F University,2014.(in Chinese)
[39] 李国超.17β-雌二醇对斑马鱼的毒性研究[D].北京:中国农业科学院,2015.
LI G C.Toxicity of 17-beta-estradiol for zebrafish[D].Beijing:Chinese Academy of Agricultural Sciences,2015.(in Chinese)
[40] 朱阳阳,张梦,叶坤,等.17β-雌二醇对大黄鱼性别分化相关基因表达的影响[J].集美大学学报(自然科学版),2019,24(6):401-408.
ZHU Y Y,ZHANG M,YE K,et al.Effects of 17β-estradiol on the expression of genes related to sex differentiation of the large yellow croak[J].Journal of Jimei University (Natural Science Edition),2019,24(6):401-408.(in Chinese)
[41] 吕晴霁.foxl2和foxl3在斜带石斑鱼性腺发育及性逆转过程中的表达研究[D].广州:华南农业大学,2018.
LYU Q J.Expression of foxl2 and foxl3 during gonadal development and sex reversal induced by MT in grouper (Epinephelus coioides)[D].Guangzhou:South China Agricultural University,2018.(in Chinese)
[42] 李广丽,邓思平,王文达,等.性类固醇激素对胡子鲇性分化的影响[[J].水生生物学报,2013,37(6):1020-1027.
LI G L,DENG S P,WANG W D,et al.Effects of sex steroid hormones on sex differentiation of Clarias fuscus[J].Acta Hydrobiologica Sinica,2013,37(6):1020-1027.(in Chinese)
Molecular cloning,expression and response of Foxl2 gene induced by sex steroid hormones in blotched snakehead Channa maculata
WU Yanduo1,2,OU Mi1,GAO Dandan1,2,CHEN Kunci1,2,LUO Qing1,LIU Haiyang1,ZHAO Jian1,2*
(1.Key Laboratory of Tropical and Subtropical Fishery Resources Application and Cultivation,Ministry of Agriculture and Rural Affairs,Pearl River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510380,China;2.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China)
Abstract:In order to explore the role of Foxl2 gene (forkhead transcription factor gene 2)in gonadal development in blotched snakehead Channa maculata,the Foxl2 gene was cloned by qRT-PCR and RACE (rapid amplification of cDNA ends)techniques in this study.The expression levels of Foxl2 qRT-PCR were detected in different adult tissues including gill,liver,spleen,intestine,middle kidney,muscle,head kidney,ovary,testis,heart,hypothalamus,and brain of XX female and XY male individuals and in the developmental stages of gonads.The expression changes were also analyzed in Foxl2 in gonads of female and male blotched snakehead exposed to exogenous sex hormone treatment (17α-ethynylestradio (EE2)and 17α-methyltestosterone (MT)),and the total contents of serum estrogen (E)were determined in males and females at developmental stages by ELISA.Furthermore,the cell types that Foxl2 protein were expressed in the gonads were detected by immunohistochemistry.The results showed that the full-length cDNA sequence of Foxl2 was found to be 1 939 bp,including 921 bp open reading frame(ORF),encoding 306 amino acids.Tissue expression analysis revealed that the maximal expression levels of Foxl2 was observed in ovaries of 105 d old blotch snakehead post hatching,with significantly different Foxl2 expression levels in ovaries and testis (P<0.01).There was higher expression of Foxl2 in gills and brain in male than that in female individuals (P<0.05).During gonadal development,the transcription of Foxl2 were higher in ovaries than that in testis,with the maximal Foxl2 levels in ovaries of 105 d blotch snakehead post hatching,and with the minimal in testis at that time (P<0.01).The total contents of serum estrogen were similar to the Foxl2 expression during gonadal development.Immunohistochemical detection showed that Foxl2 protein was expressed in granulosa cells around mature oocytes of ovaries,and no signal was detected in testis in blotch snakehead.The expression of Foxl2 was inhibited in ovaries of blotch snakehead exposed to exogenous sex steroid hormone EE2 and MT,but the up-regulated expression level in testis exposed to EE2 and down-regulated expression level in testis exposed to MT.The findings indicated that Foxl2 had obvious sexual dimorphism in the gonads of blotch snakehead,suggesting that Foxl2 be involved in the development and maintenance of ovary.The exogenous sex hormone treatment indicated that Foxl2 was responsive for the regulation of sex steroid hormones.The Foxl2 played an important role in gonadal development of blotch snakehead from mRNA and protein levels,which laid a foundation for the further understanding of the mechanism of sex differentiation and provided a scientific basis for the sex control technology of blotch snakehead.
Key words:Channa maculata;Foxl2 gene;clone;sex steroid hormone;mRNA expression analysis





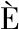 S,et al.Estrogen treatment up-regulates female genes but does not suppress all early testicular markers during rainbow trout male-to-female gonadal transdifferentiation[J].Journal of Molecular Endocrinology,2008,41(5):277-288.
S,et al.Estrogen treatment up-regulates female genes but does not suppress all early testicular markers during rainbow trout male-to-female gonadal transdifferentiation[J].Journal of Molecular Endocrinology,2008,41(5):277-288.