硬骨鱼类性腺发育和成熟主要受到下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal axis,HPG轴)为中心的内分泌系统及外界环境因子的综合影响[1-2]。鱼类受到水温和光照等环境因子刺激后,在下丘脑合成促性腺激素释放激素(gonadotropin-releasing hormone,GnRH),GnRH诱导垂体合成促性腺激素(gonadotropins,GtHs),GtHs中的β亚基单元有两种类型,即促卵泡激素(follicle stimulating hormone,FSHβ)和黄体生成素(luteinizing hormone,LHβ)。FSHβ和LHβ随血液到达性腺后,诱导性腺合成类固醇激素,包括雌二醇(17β-estradiol,E2)和睾酮(testosterone,T),从而促进排卵和排精[1]。有研究表明,鱼类性腺发育成熟过程中,FSHβ和LHβ激素起着关键作用[3-6]。
五条鰤Seriola quinqueradiata隶属于鲈形目Perciformes鲈亚目Percoidei鲹科Carangidae鰤亚科Seriolinae鰤属Seriola,俗称章雄鱼、青甘鱼、平安鱼、油甘鱼等,是暖温带海洋中上层大型掠食性鱼类,具有体型大、生长快和肉质佳等特点,有较高的经济价值和市场前景,其分布于日本海至中国台湾以南海域,在中国黄海、渤海和东海均有分布[7]。已有研究表明,五条鰤通常在4—5月产卵,对其亲鱼进行19 ℃以上水温调节的同时,持续短光照(8L∶16D)1个月后再调整为长光照(18L∶6D)1个月,进行水温调节后可以比自然条件下提前2个月诱导其性成熟[8],这表明采用人工调控水温和光照时间有可能促进其提前成熟和产卵,缩短养殖周期,减少越冬消耗,从而降低养殖成本。为此,本试验中以五条鰤为研究对象,在以往试验的基础上加以改进,综合运用水温和光照调节,比较了各阶段试验鱼的性腺指数、性腺发育频率变化、脑垂体中fshβ和lhβ基因含量的差异,以及血清中类固醇激素E2和T含量的变化,探讨了环境因子对其性腺发育成熟的影响,以期为五条鰤的人工繁殖和苗种生产提供科学依据。
1 材料与方法
1.1 材料
试验用鱼为从日本五岛市购买的同批次卵孵化的性腺尚未发育成熟的雌性五条鰤成鱼,将其运输至长崎大学环中国东海环境资源研究所。于2018年1月5日将其饲养在2个容积为90 000 L的八角形水槽中,每个水槽放置20尾,共计40尾。
1.2 方法
1.2.1 试验设计 水槽为开放式流水养殖,盐度为29~31,pH为7.8~8.3,溶解氧为5 mg/L以上,保持24 h增氧。试验从2018年1月20日开始,3月20日结束。2个水槽分别设为对照组和处理组,其中,对照组为自然水温和光照条件饲养,温度变化为9.2~12.4 ℃,光照周期为12L∶12D。处理组对其进行环境调节,以日光灯作为光源,放置在试验池上方大约2 m处,每平方米放置2根日光灯管,并在四周用黑布遮挡以避免外界干扰,水面光照度约2 500 lx,利用开、关灯控制光照时间,光照周期为10L∶14D;进行开放式流水养殖并用温度调节器保持水温恒定为20 ℃。试验期间在光照条件下每天早晚各投食一次,观察鱼的摄食情况并记录每日的摄食量,所用饲料为鰤鱼1300(Feedone,日本)。试验期间无个体死亡。
1.2.2 样品的采集 试验开始时及试验进行1个月和2个月后,每月采样一次,从对照组和处理组每次各取5尾。用2-苯氧乙醇将鱼麻醉后,测量其全长和体质量。从尾柄部采血约5 mL,血液在12 000 g、4 ℃下离心20 min后,取上层血清保存于-80 ℃超低温冰箱中。采血后解剖取其性腺,测定质量后将其立即置于波恩试剂中固定24 h,后于体积分数为70%的乙醇中保存用于组织学分析。
性腺指数(GSI,%)计算公式为
GSI=WG/WB×100%。
其中:WG为生殖腺质量(g);WB为体质量(g)。
随后打开头盖骨取出脑垂体,将其保存在200 μL RNAlater试剂(Ambion,日本)中后于4 ℃下保存,一周后废弃RNAlater试剂,转移至-80 ℃超低温冰箱中长期保存,用于qRT-PCR试验。
1.2.3 性腺的组织学观察 组织学分析步骤参照Shein等[9]的方法。对五条鰤性腺进行常规梯度乙醇脱水、二甲苯透明、石蜡包埋和连续切片,厚度为5 μm。采用苏木精-伊红(H.E)染色,中性树胶封片,用光学显微镜(Olympus FX380型)观察并拍照,以各个体中卵母细胞最发达阶段为性腺的发育阶段。参照文献[10-12]中的方法及试验需要,将其卵母细胞发育分为3个时相,其中,第Ⅰ时相为性腺发育未成熟阶段,第Ⅱ和第Ⅲ时相为性腺发育成熟阶段。
1)第Ⅰ时相(初级卵母细胞生长期,primary yolk stage,Py)。细胞体积小;细胞质少,显强嗜碱性;核仁1~2个,分布在核的中央或边缘。细胞质被苏木精染色深,核呈现巨大化,核中出现许多较小的核仁。
2)第Ⅱ时相(次级卵母细胞生长期,secondary yolk stage,Sy),大生长期。核周细胞质出现油滴,环形带状分布,并向胞质边缘扩散;双层滤泡膜。卵母细胞快速生长,卵黄球迅速累积,并占细胞质的大半。
3)第Ⅲ时相(次级卵母细胞生长晚期,tertiary yolk stage,Ty),大生长晚期。卵黄颗粒形成,油滴增多,逐渐充满细胞质;细胞质中已经积累了大量卵黄,但核移动还尚未开始。
1.2.4 脑垂体中fshβ和lhβ基因含量的检测
1)总RNA的提取与反转录。取冻存的五条鰤脑垂体组织,参照TRIzol试剂盒(Life Technologies Corp.,美国)说明书进行总RNA提取,经10 g/L琼脂凝胶电泳检测RNA完整度,用分光光度计(NanoDrop 2000,美国Thermo Scientific公司)检测RNA浓度。根据Transcriptor first strand cDNA synthesis(德国Roche Diagnostic公司)说明书操作,取500 ng脑垂体总RNA作为反转录模板合成第一链cDNA,用于PCR的扩增。
2)脑垂体中fshβ和lhβ基因实时荧光定量检测。参照Higuchi等[13]的方法,根据GenBank中五条鰤fshβ(LC102206)和lhβ(LC102207)基因序列,用Primer Express软件设计荧光定量引物,由美国Integrated DNA Technologies公司合成,引物序列如表1所示。
表1 实时荧光定量PCR反应中的引物序列
Tab.1 Sequences of primers for quantitative real-time PCR

基因 gene引物方向primer orientation序列(5′-3′) sequence (5′-3′)扩增长度/bp amplicon正向引物forwardTCCACCATATGTGCAGGACAGTfshβ探针引物probeAGGACCCGGTCTACATCAGCGACTA91反向引物reverseAGTCCCCGTTACAGGTCTTCTG正向引物forwardCGCAGTGGAAACCACCATCTlhβ探针引物probeCTGCATCACCAAGGACCCCGT102反向引物reverseTCCCGGTACGTGCACACAT
fshβ和lhβ基因测定按照FastStart Essential DNA Probe Master(Roche Diagnostics,Mannheim,Germany)试剂盒说明书操作。PCR反应体系(共10 μL):cDNA模板2.5 μL,Probe Master(2×concentrate)5 μL,探针引物(Primer-F 10 pmol/μL,Primer-R 10 pmol/μL,Probe 5 pmol/μL)0.5 μL,灭菌超纯水2 μL。在Light Cycler® 480进行PCR反应。反应程序:95 ℃下预变性10 min;95 ℃下变性15 s,60 ℃下延伸1 min,共进行45个循环;95 ℃下加温 5 s,65 ℃ 下熔解1 min;最后在50 ℃下冷却30 s。PCR反应后获得熔解曲线,检测数据用绝对定量法进行统计分析。
1.2.5 血清中雌二醇和睾酮含量的检测 参照文献[13-14]中的检测方法。即将冷冻的血清样品经过4 ℃解冻后再次离心取得上层血清,然后血清经过甲醇-乙醚低温冷冻蒸发系统进行类固醇的提纯,经过3次冷冻蒸发后的血清样品可用于检测。采用Estradiol EIA Kit和Testosterone EIA Kit的EIA(Enzyme immunoassy)酶联免疫试剂盒(均购自Cayman Chemical公司)测定E2和T的含量。
1.3 数据处理
试验数据均以平均值±标准差(mean ± S.D.)表示。采用SPSS 23.0软件对试验数据进行统计分析,采用Kolmogorov-Smirnov法进行正态分布检测,利用ANOVA检验及Tukey’s HSD法进行差异性比较分析,显著性水平设为0.05。
2 结果与分析
2.1 对照组和处理组五条鰤体长、体质量、性腺质量和性腺指数的差异
从表2可见:试验期间,对照组和处理组中不同采样时间点间鱼的体长和体质量无显著性差异(P>0.05);随着试验的进行,各组性腺质量和性腺指数均呈增加趋势,试验进行1个月(2018-02-20)和2个月(2018-03-20)后,处理组鱼的性腺质量和性腺指数均显著高于对照组(P<0.05)。
表2 试验期间对照组和处理组五条鰤的体长、体质量、性腺质量和性腺指数差异
Tab.2 Differences in total length,body mass,gonad mass,and GSI in yellowtail Seriola quinqueradiata between control group and treatment groups during experimental period
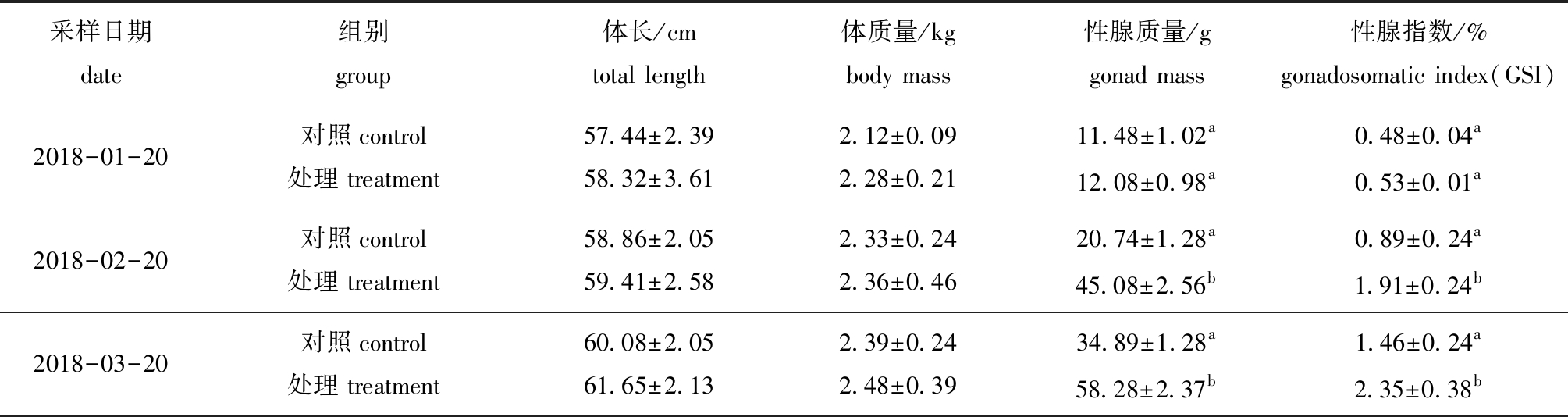
采样日期date组别group体长/cmtotal length体质量/kgbody mass性腺质量/ggonad mass性腺指数/%gonadosomatic index(GSI)2018-01-20对照control 处理 treatment 57.44±2.3958.32±3.612.12±0.092.28±0.2111.48±1.02a12.08±0.98a0.48±0.04a0.53±0.01a2018-02-20对照control 处理 treatment 58.86±2.0559.41±2.582.33±0.242.36±0.4620.74±1.28a45.08±2.56b0.89±0.24a1.91±0.24 b2018-03-20对照control 处理 treatment 60.08±2.0561.65±2.132.39±0.242.48±0.3934.89±1.28a58.28±2.37b1.46±0.24a2.35±0.38 b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
2.2 对照组和处理组五条鰤性腺发育差异
五条鰤性腺在不同发育阶段的切片如图1所示,试验期间,对照组鱼的性腺发育在各采样阶段均为初级卵母细胞生长期(图1A)。处理组鱼的性腺在不同发育阶段的比例变化如图2所示。试验开始时,处理组中5尾鱼性腺发育均为初级卵母细胞生长期(图1B,图2);1个月后,5尾鱼中3尾鱼为次级卵母细胞生长期,2尾鱼为次级卵母细胞生长晚期(图1C,图2);2个月后,5尾鱼中2尾鱼为次级卵母细胞生长期,3尾鱼为次级卵母细胞生长晚期(图1D,图2)。

A和B—第I时相;C—第Ⅱ时相;D—第Ⅲ时相。Py—初级卵母细胞生长期;Sy—次级卵母细胞生长期;Ty—次级卵母细胞生长晚期。A and B—the phase I;C—the phaseⅡ;D—the phase Ⅲ.Py—growth phase of primary oocyte;Sy—growth phase of secondary oocyte;Ty—later growth phase of secondary oocyte.
图1 五条鰤性腺在不同发育阶段的切片图
Fig.1 Histological sections of yellowtail Seriola quinqueradiata at different gonadal developmental stages
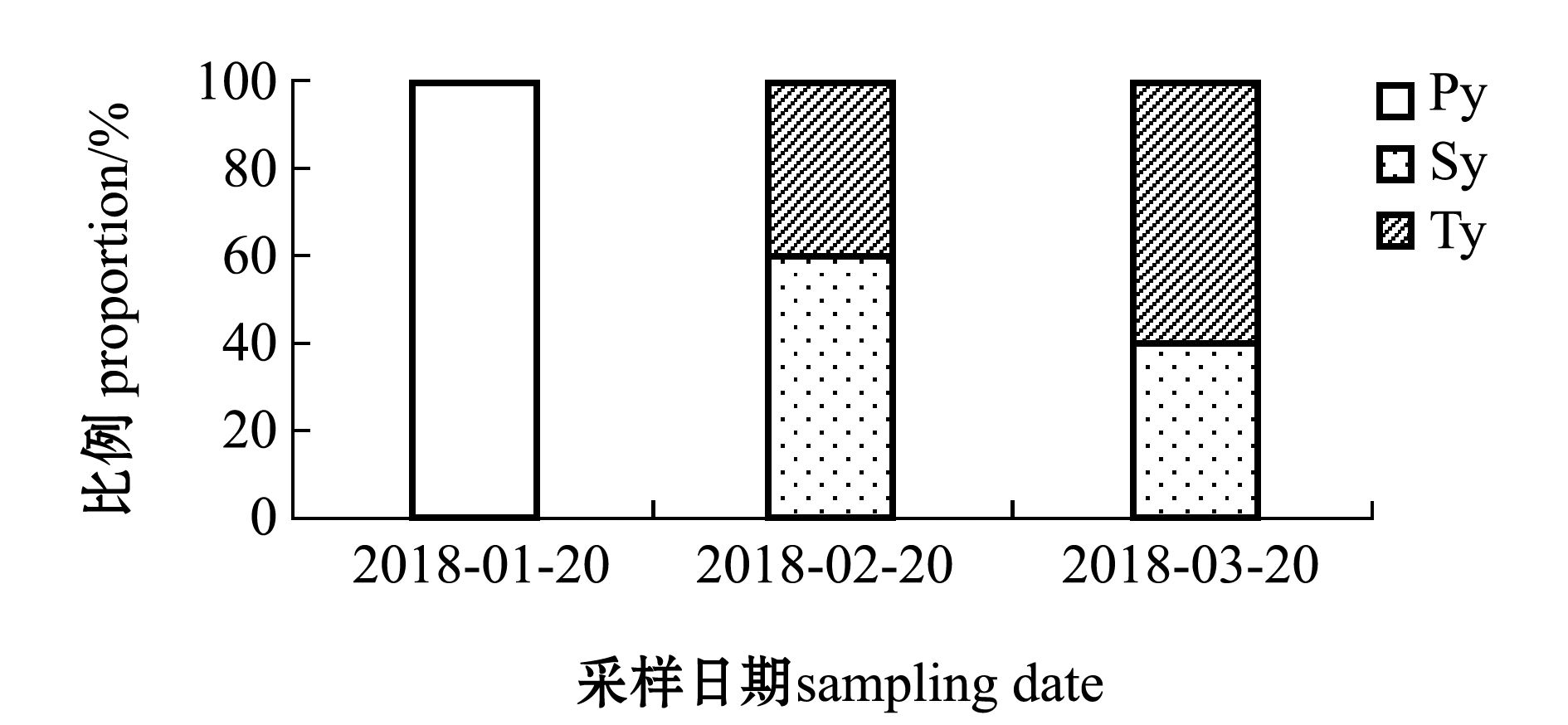
图2 处理组五条鰤性腺在不同发育阶段的比例变化
Fig.2 Changes in the proportion of different gonadal developmental stages of yellowtail Seriola quinqueradiata in the treatment groups
2.3 各组五条鰤脑垂体fshβ和lhβ基因含量变化
从图3可见:试验期间,对照组五条鰤脑垂体fshβ和lhβ基因含量均无显著性变化(P>0.05);随着试验的进行,各组fshβ和lhβ基因含量均呈增加趋势,试验进行1个月(2018-02-20)和2个月(2018-03-20)后,处理组试验鱼脑垂体中fshβ基因含量显著高于对照组(P<0.05),试验进行2个月后,处理组脑垂体中lhβ基因含量显著高于对照组(P<0.05)。
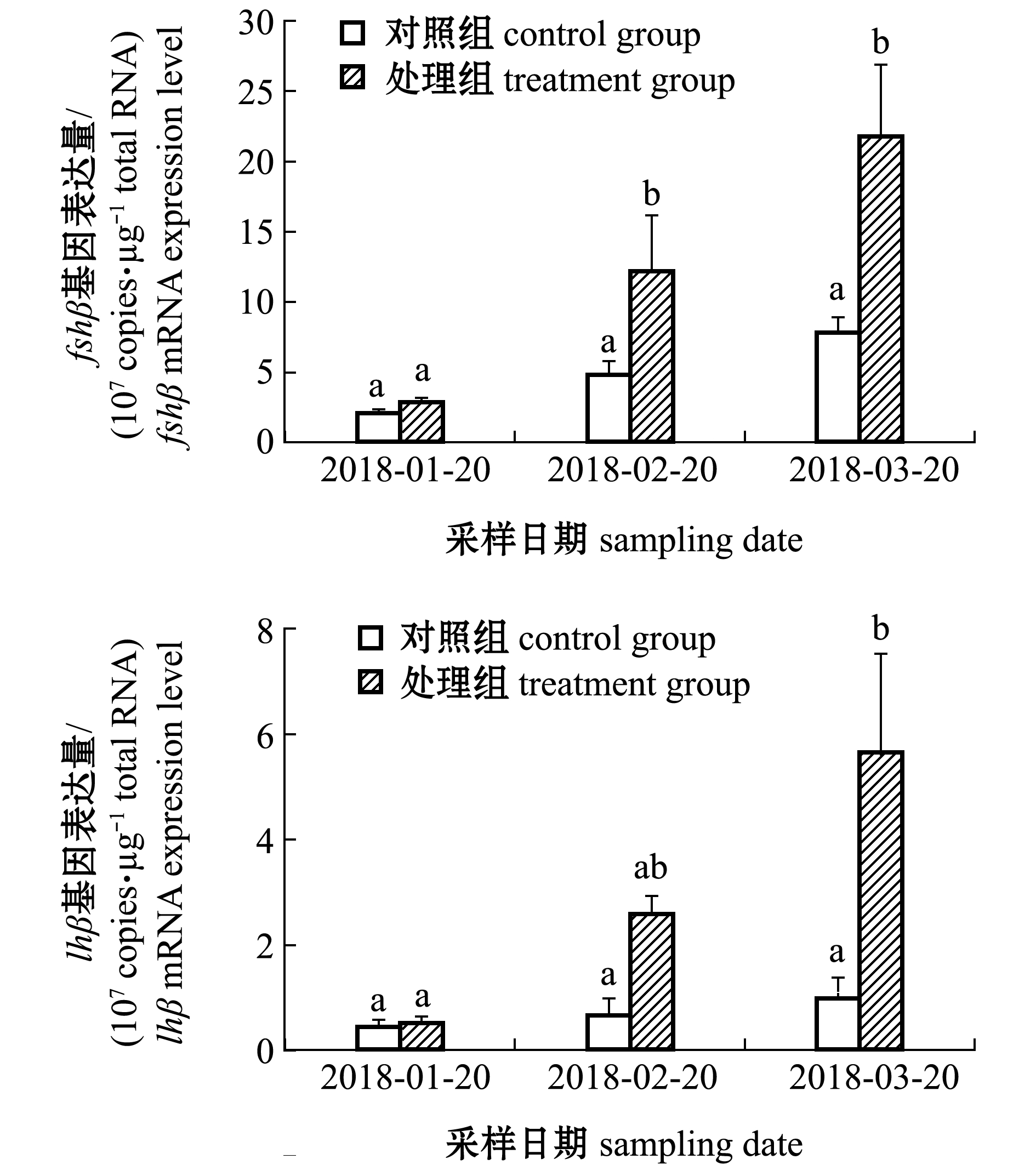
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母或无字母者表示组间无显著性差异(P>0.05)。The means with the different letters are significantly different between groups at the 0.05 probability level,and means with the same letter or without letters are not significantly different between groups at the 0.05 probability level.
图3 各组五条鰤脑垂体fshβ和lhβ基因含量变化
Fig.3 Changes in fshβ and lhβ genes content in each group of yellowtail Seriola quinqueradiata
2.4 对照组和处理组五条鰤血清E2和T含量差异
从表3可见:试验期间,对照组五条鰤血清E2和T含量均无显著性变化(P>0.05);随着试验的进行,各组E2和T含量总体呈增加趋势,试验进行1个月(2018-02-20)和2个月(2018-03-20)后,处理组中五条鰤血清E2和T含量均显著高于对照组(P<0.05)。
表3 试验期间各组五条鰤血清E2和T含量的差异
Tab.3 Differences in the concentrations of serum E2 and T in yellowtail Seriola quinqueradiata in each group during experimental period ng/mL
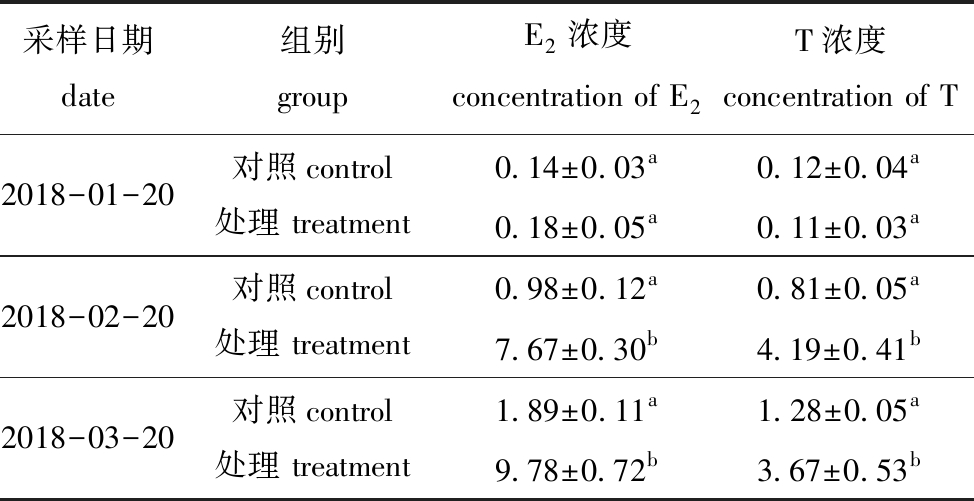
采样日期 date组别 groupE2浓度 concentration of E2T浓度 concentration of T2018-01-20对照control处理 treatment 0.14±0.03a0.18±0.05a0.12±0.04a0.11±0.03a2018-02-20对照control 处理 treatment0.98±0.12a7.67±0.30b0.81±0.05a4.19±0.41b2018-03-20对照control 处理 treatment 1.89±0.11a9.78±0.72b1.28±0.05a3.67±0.53b
3 讨论
3.1 水温和光照调节对五条鰤性成熟的影响
本试验期间,对照组中五条鰤的性腺发育一直处于未成熟阶段,但通过水温和光照的调节,处理组中鱼的性腺在试验进行1个月和2个月后均处于成熟阶段,且GSI均显著增加,这表明综合运用水温20 ℃和光照(10L∶14D)调节有助于促进五条鰤性腺发育成熟。研究表明,在秋冬季节通过综合运用水温(15~18 ℃)和光照(15L∶9D)调节,能成功诱导红鳍东方鲀Takifugu rubripes提前达到性成熟[15]。大西洋鲑Salmo salar在水温12.7 ℃和持续光照饲养条件下,其生长和成熟比例均获得显著提高[16]。在2龄鲈Dicentrarchus labrax中,持续短光照比自然光照或长光照更能加速其性腺发育成熟并产卵[17]。此外,通过提高水温和延长光照时间,可促使牙鲆Paralichthys olivaceus亲鱼提前 1~5个月成熟和产卵[18]。恒温26 ℃条件下有助于加速赤点石斑鱼Epinephelus akaara生长从而提前达到性成熟,而28 ℃水温反而降低其性成熟比例[19-20],由此表明,合适的水温可能会加快鱼类新陈代谢,从而促进其性腺发育成熟。但光照调节对红点鲑Salvelinus alpinus性成熟的比例无影响[21]。本试验结果表明,通过水温和光照综合调节有助于促进五条鰤性成熟,可能原因是水温促进五条鰤新陈代谢从而促进其提前发育成熟,但水温和光照中何种因子起主要作用还有待进一步研究。
3.2 水温和光照调节对五条鰤脑垂体中fshβ和lhβ基因含量及血清中E2和T含量的影响
本试验中,通过水温和光照的调节,处理组五条鰤脑垂体中fshβ基因含量在试验进行1个月和2个月后显著高于对照组,lhβ基因含量在2个月后显著高于对照组,这表明合适的水温和光照有利于促进fshβ和lhβ含量的增加。研究表明,当条件从长光照变为短光照时,山女鳟Oncorhynchus masou下丘脑中GnRH[22]及脑垂体中fshβ和lhβ基因含量增加[23],从而促进性成熟。恒温26 ℃条件下有助于加速赤点石斑鱼提前达到性成熟,主要原因为适宜的水温利于促进脑垂体中fshβ和lhβ基因含量显著增加[19]。这表明,本试验中五条鰤性腺能提前发育成熟,可能与水温和光照有利于促进其脑垂体中fshβ和lhβ含量的增加有关。
此外,本试验中通过水温和光照的调节,处理组五条鰤血清中E2和T含量在试验进行1个月和2个月后均显著高于对照组,这表明合适的水温和光照有利于促进E2和T含量的增加。已有研究表明,斜带石斑鱼E.coioides血清中E2和T的浓度在繁殖季节(6月)显著增加,且GSI迅速提高,这表明E2能够诱导肝细胞中卵黄磷蛋白的合成,促进卵巢发育成熟[24]。在乌苏里拟鲿Pseudobagrus ussuriensis中,雌鱼血清的E2和T在5月份达到最高值;雄鱼的E2在5月份达到最高值,而T的最高值则出现在4月份,这表明雌、雄鱼性腺发育成熟度与E2和T基本同步[25]。在太平洋鳕Gadus macrocephalus性腺发育成熟期,其血清中E2和T含量变化显著,且与GSI变化趋势呈正相关,这说明E2和T对太平洋鳕的性腺发育成熟具有重要作用[26]。这表明,本试验中,五条鰤性腺能提前发育成熟可能与水温和光照有利于促进其血清中E2和T含量的增加也有关。
已有研究表明,鱼类发育过程中,E2是促进卵黄磷蛋白合成的重要激素,T是合成E2的前体,E2和T的合成受到脑垂体中fshβ和lhβ的调节,并随fshβ和lhβ分泌的增加而增加[1-2]。因此,本试验中五条鰤性成熟可能是由于水温和光照调节促进脑垂体中fshβ和lhβ含量的增加,进而促进血清中E2和T含量上升,最终诱导性成熟。类似的结果出现在牙汉鱼Odontesthes bonariensis中,当光照周期由8L∶16D调整到16L∶8D时,脑垂体中gpα、fshβ和lhβ含量显著增加,血清中E2和T浓度亦显著上升[27]。在高体鰤Seriola dumerili中,当光照周期由6L∶18D调整到18L∶6D时,血清中E2浓度有增加的倾向,gpα、fshβ和lhβ基因含量增加[28]。
综上可见,在今后五条鰤的人工繁殖中,可以考虑综合运用水温和光照调节,以促进其脑垂体中fshβ和lhβ基因含量及血清中E2和T含量的增加,从而加速诱导其性腺发育成熟。
4 结论
1)综合运用水温20 ℃和光照(10L∶14D)调节有助于促进五条鰤性腺发育成熟。
2)综合运用水温20 ℃和光照(10L∶14D)调节有助于促进五条鰤脑垂体中fshβ和lhβ基因含量及血清中E2和T含量的增加,从而加速诱导其性腺发育成熟。
[1] 魏华,吴垠.鱼类生理学[M].2版.北京:中国农业出版社,2011:253-289.
WEI H,WU Y.Fish physiology[M].2nd edition.Beijing:China Agricultural Press,2011:253-289.(in Chinese)
[2] 温海深,林浩然.环境因子对硬骨鱼类性腺发育成熟及其排卵和产卵的调控[J].应用生态学报,2001,12(1):151-155.
WEN H S,LIN H R.Effect of environmental factors on gonadal maturation as well as its ovulation and spawning in teleosts[J].Chinese Journal of Applied Ecology,2001,12(1):151-155.(in Chinese)
[3] MIRANDA L A,STRÜSSMANN C A,SOMOZA G M.Immunocytochemical identification of GtH1 and GtH2 cells during the temperature-sensitive period for sex determinationin pejerrey,Odontesthes bonariensis[J].General and Comparative Endocrinology,2001,124(1):45-52.
[4] WONG T T,ZOHAR Y.Novel expression of gonadotropin subunit genes in oocytes of the gilthead seabream (Sparus aurata)[J].Endocrinology,2004,145(11):5210-5220.
[5] WU Y S,HE Z,ZHANG L H,et al.Ontogeny of immunoreactive LH and FSH cells in relation to early ovarian differentiation and development in protogynous hermaphroditic ricefield eel Monopterus albus[J].Biology of Reproduction,2012,86(3):93.
[6] SHIMIZU A,HAMAGUCHI M,ITO H,et al.Appearances and chronological changes of mummichog Fundulus heteroclitus FSH cells and LH cells during ontogeny,sexual differentiation,and gonadal development[J].General and Comparative Endocrinology,2008,156(2):312-322.
[7] 任燕,石存斌,常藕琴,等.五条鰤源美人鱼发光杆菌杀鱼亚种的分离鉴定及药物敏感试验[J].广东农业科学,2012,39(22):148-152.
REN Y,SHI C B,CHANG O Q,et al.Identification of Photobacterium damselae subsp.piscicida from diseased yellowtail (Seriola quinqueradiata)and the sensitivity to antimicrobial agents[J].Guangdong Agricultural Sciences,2012,39(22):148-152.(in Chinese)
[8] MUSHIAKE K,KAWANO K,KOBAYASHI T,et al.Advanced spawning in yellowtail,Seriola quinqueradiata,by manipulations of the photoperiod and water temperature[J].Fisheries Science,2008,64(5):727-731.
[9] SHEIN N L,CHUDA H,ARAKAWA T,et al.Ovarian development and final oocyte maturation in cultured sevenband grouper Epinephelus septemfasciatus[J].Fisheries Science,2004,70(3):360-365.
[10] 徐文刚,唐永政,张建柏,等.黑边石斑鱼卵巢周年发育及血清中性激素含量的变化[J].大连海洋大学学报,2020,35(5):657-662.
XU W G,TANG Y Z,ZHANG J B,et al.Annual ovarian development and changes in the concentration of serum sex hormones in blacktip grouper Epinephelus fasciatus[J].Journal of Dalian Ocean University,2020,35(5):657-662.(in Chinese)
[11] 崔丹,刘志伟,刘南希,等.金钱鱼性腺发育及其组织结构观察[J].水产学报,2013,37(5):696-704.
CUI D,LIU Z W,LIU N X,et al.Histological study on the gonadal development of Scatophagus argus[J].Journal of Fisheries of China,2013,37(5):696-704.(in Chinese)
[12] 王盈颖.赤点石斑鱼和青石斑鱼性分化过程中性腺发育的研究[D].厦门:厦门大学,2015.
WANG Y Y.The study of sexul differentiation and gonadal development in the Hong Kong grouper Epinephelus akaara and the yellow grouper E.awoara[D].Xiamen:Xiamen University,2015.(in Chinese)
[13] HIGUCHI K,GEN K,IZUMIDA D,et al.Changes in plasma steroid levels and gene expression of pituitary gonadotropins,testicular steroidogenesis-related proteins and insulin-like growth factors during spermatogenesis of the yellowtail Seriola quinqueradiata[J].Fisheries Science,2017,83(1):35-46.
[14] 左永松,仲地政人,中村将,等.HCG与LHRHa对雌性蜂巢石斑鱼产卵期间生理变化的影响及比较[J].上海海洋大学学报,2013,22(6):841-848.
ZUO Y S,NAKACHI M,NAKAMURA M,et al.Impacts of artificial maturation inducing hormone HCG and LHRHa on the physiological fluctuation of female honeycomb grouper,Epinephelus merra,during its spawning season and comparison between the two hormones[J].Journal of Shanghai Ocean University,2013,22(6):841-848.(in Chinese)
[15] TAKAOKA O,FURUTA S,GOUDA M,et al.Induced spawing of cultured tiger puffer in winter and fall[J].Bulletin of the Fisheries Laboratory of Kinki University,1998,6:167-170.
[16] IMSLAND A K,HANDELAND S O,STEFANSSON S O.Photoperiod and temperature effects on growth and maturation of pre-and post-smolt Atlantic salmon[J].Aquaculture International,2014,22(4):1331-1345.
[17] PRAT F,ZANUY S,BROMAGE N,et al.Effects of constant short and long photoperiod regimes on the spawning performance and sex steroid levels of female and male sea bass[J].Journal of Fish Biology,1999,54(1):125-137.
[18] 木云雷,刘悦,王鉴,等.水温和光照对牙鲆亲鱼性腺成熟和产卵的影响[J].大连水产学院学报,1999,14(2):62-65.
MU Y L,LIU Y,WANG J,et al.Effects of water temperature and photoperiod on maturation and spawn of flounder (Paralichthys olivaceus)[J].Journal of Dalian Fisheries University,1999,14(2):62-65.(in Chinese)
[19] 徐文刚,唐永政,张建柏,等.恒温高温调节对赤点石斑鱼幼鱼的生长、性腺发育以及gnrh、fshβ和lhβ基因表达的影响[J].中国水产科学,2021,28(1):19-28.
XU W G,TANG Y Z,ZHANG J B,et al.Effects of regulation of constant high water temperature on growth and gonadal development,as well as gnrh,fshβ,and lhβ gene expression in the juvenile red spotted grouper Epinephelus akaara[J].Journal of Fishery Sciences of China,2021,28(1):19-28.(in Chinese)
[20] OH S B,LEE C H,LEE Y D.Induction of puberty in red spotted grouper,Epinephelus akaara by water temperature[J].Journal of Aquaculture Research &Development,2018,9(5):1000537.
[21] FRANTZEN M,ARNESEN A M,DAMSGÅRD B,et al.Effects of photoperiod on sex steroids and gonad maturation in Arctic charr[J].Aquaculture,2004,240(1/2/3/4):561-574.
[22] AMANO M,HYODO S,KITAMURA S,et al.Short photoperiod accelerates preoptic and ventral telencephalic salmon GnRH synthesis and precocious maturation in underyearling male masu salmon[J].General and Comparative Endocrinology,1995,99(1):22-27.
[23] AMANO M,OKUMOTO N,KITAMURA S,et al.Salmon gonadotropin-releasing hormone and gonadotropin are involved in precocious maturation induced by photoperiod manipulation in underyearling male masu salmon,Oncorhynchus masou[J].General and Comparative Endocrinology,1994,95(3):368-373.
[24] 赵会宏,刘晓春,刘付永忠,等.斜带石斑鱼雌鱼卵巢发育与血清性类固醇激素的生殖周期变化[J].中山大学学报(自然科学版),2003,42(6):56-59,63.
ZHAO H H,LIU X C,LIUFU Y Z,et al.Seasonal cycles of ovarian development and serum sex steroid levels of female grouper Epinephelus coioides[J].Acta Scientiarum Naturalium Universitatis Sunyatseni,2003,42(6):56-59,63.(in Chinese)
[25] 贾一何,黄鹤忠,李倩倩,等.池养乌苏里拟鲿雌雄鱼生长及周年性激素与性腺发育研究[J].海洋科学,2012,36(3):61-66.
JIA Y H,HUANG H Z,LI Q Q,et al.Growth and seasonal changes of sex steroids level and gonad development in female and male Pseudobagrus ussuriensis[J].Marine Sciences,2012,36(3):61-66.(in Chinese)
[26] 王浩,李兴源,李吉方,等.太平洋鳕性腺发育成熟期内分泌生理特征[J].中国海洋大学学报,2016,46(7):21-26.
WANG H,LI X Y,LI J F,et al.Endocrine physiological characteristics of Gadus macrocephalus during gonadal maturation[J].Periodical of Ocean University of China,2016,46(7):21-26.(in Chinese)
[27] MIRANDA LA,STRÜSSMANN C A,SOMOZA G M.Effects of light and temperature conditions on the expression of GNRH and GTH genes and levels of plasma steroids in Odontesthes bonariensis females[J].Fish Physiology and Biochemistry,2009,35(1):101-108.
[28] NYUJI M,HAMADA K,KAZETO Y,et al.Photoperiodic regulation of plasma gonadotropin levels in previtellogenic greater amberjack (Seriola dumerili)[J].General and Comparative Endocrinology,2018,269:149-155.