半滑舌鳎Cynoglossus semilaevis Günther隶属于鲽形目Pleuronectiformes舌鳎科Cynoglossidae舌鳎属Cynoglossus,是一种暖温性近海底层鱼类,其味道鲜美、肉质细嫩、营养丰富,深受消费者青睐。随着人们生活水平的提高,对半滑舌鳎的需求量不断增大,推动了半滑舌鳎养殖业的迅速发展。目前,半滑舌鳎已成为中国北方沿海地区重要的海水工厂化养殖品种,2018年产量达1.2万t[1]。但是,随着养殖规模不断扩大,病害也日趋严重,病害已经成为半滑舌鳎养殖业的重大威胁。多种细菌性病原,包括溶藻弧菌[2]、哈维氏弧菌[3]、海藻希瓦氏菌[4]、海分枝杆菌[5]、美人鱼发光杆菌[6-7]等被报道。此外,也发现了病毒性病原[8]。
2020年9月,天津市滨海新区某半滑舌鳎养殖场发生病害,发病速度慢,发病20 d后累计死亡率为15%。患病鱼表现除反应迟钝、离群独游外,显著的特征为脱肛,肠套叠。为了探明其病因,从患病鱼肾脏分离到一株疑似病原,本研究中采用组织病理学、生理生化反应及分子生物学等方法对病原进行了鉴定,并筛选出敏感性药物,这是半滑舌鳎肠套叠症状的首次报道,以期为今后该病的有效防控提供技术支撑。
1 材料与方法
1.1 材料
试验鱼:体长10~15 cm的患病半滑舌鳎从天津市滨海新区的某海水养殖场收集,将濒死的鱼装入氧气袋后被快速送往实验室进行诊断和病原分离;体长8~10 cm的健康半滑舌鳎由天津市天世农海水养殖有限公司提供,无发病史。
主要试剂:脑心浸液培养基(BHI)购自英国Oxoid公司,药敏纸片购自杭州微生物试剂有限公司,DNA分子Marker和2×Taq Master Mix购自宝生物工程(大连)有限公司,引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 病原的分离 用75%乙醇(体积分数,下同)棉球反复擦拭病鱼体表后,在无菌操作台中对病鱼进行解剖,用接种环分别从患病鱼的肾和脾中取少量样品划线接种于脑心浸液培养基(BHI)和血平板,于28 ℃下培育48 h后进行观察,选取优势菌的单菌落进一步划线纯化,得到优势菌株并命名为ST-2020-2。取患病鱼的鳍条、鳃、黏液等样品在显微镜下进行寄生虫检查。
1.2.2 组织病理切片观察 取患病鱼肠、肝、肾、脾等组织,用中性甲醛固定,乙醇梯度脱水,石蜡包埋,切成5 μm厚度,然后进行苏木精伊红染色(H.E),同时取正常鱼组织作为对照。
1.2.3 人工感染试验 将菌株ST-2020-2划线接种于BHI平板,于28 ℃下培养24 h后,挑取单菌落接种于BHI液体培养基中。28 ℃、150 r/min振荡培养24 h后,以6 000 g离心10 min后收集细菌,利用无菌PBS将细菌浓度调整至1.2×107 cfu/mL。将60尾健康的半滑舌鳎随机分为2组(每组30尾),试验组每尾鱼腹腔注射0.1 mL 菌悬液,对照组每尾鱼注射0.1 mL无菌PBS。试验鱼在22 ℃循环水养殖系统中养殖14 d,每天观察试验鱼的发病和死亡情况,统计死亡数,濒死的鱼进行病原菌分离和鉴定。
1.2.4 病原的生理生化特性测试 将菌株ST-2020-2接种于BHI和血平板进行菌落形态观察,按照东秀珠等[9]的方法对分离菌株进行生理生化测试,包括革兰氏染色、运动性、37 ℃生长、溶血性、氧化酶反应和葡萄糖发酵等。
1.2.5 病原的16S rDNA序列分析 利用引物(27F)5′AGAGTTTGATCCTGGCTCAG 3′和(1492R)5′TACGGCTACCTTGTTACGCTT 3′对菌株ST-2020-2的16S rRNA序列进行PCR扩增[10]。PCR反应程序:95 ℃下预变性6 min;94 ℃下变性1 min,52 ℃下复性1 min,72 ℃下延伸2 min,共进行30个循环;最后在72 ℃下温育6 min。扩增产物送生工生物工程(上海)股份有限公司进行测序,测序结果与NCBI 数据库中已登录GenBank的基因片段进行同源性比较,并利用MEGA 4.1 软件构建系统发育树。
1.2.6 药物敏感性试验 采用K-B药敏纸片法测定菌株ST-2020-2的药物敏感性[11]。将0.1 mL 108 cfu/mL ST-2020-2菌悬液涂布于BHI平板,然后将氨苄西林(10 μg)、链霉素(10 μg)、四环素(30 μg)等16种药敏纸片黏贴在平板上,28 ℃下培养18~24 h后测定抑菌圈直径,按产品说明书判定对药物的敏感度。
2 结果与分析
2.1 自然发病鱼症状
患病鱼主要症状表现为食欲下降、游泳异常,离群后游至水体表层,对外界反应迟钝。体表黏液增多,鳍条充血,腹部膨胀,脱肛(图1A),腹腔内有大量积水,部分鱼肠道充血(图1B),肠道套叠明显(图1C),10尾患病鱼共检查到8尾有肠套叠现象。

A—脱肛,鳍条基部出血;B—肠道充血;C—肠套叠。A—rectal prolapse and hyperemia at the base of the fins;B—hyperemia in intestinal tract;C—intussusception.
图1 患病半滑舌鳎的典型症状
Fig.1 Typical symptom of half-smooth tongue sole with intussusception disease
2.2 病理分析
通过病理切片观察发现,患病半滑舌鳎脾脏中部分细胞坏死,并出现大量空泡,此外,发现大量直径约为30 μm的小型结节(图2B);肾脏中白细胞增多,肾小管上皮细胞坏死、解体(图2D);肠道肌肉层松弛,肌肉层和黏膜层中有大量的红细胞聚集,肠绒毛和肠黏膜组织腐烂并脱落(图2F)。

A—正常脾脏组织;B—患病脾脏,部分细胞坏死,出现大量空泡,含有大量小型结节(★所示);C—正常肾脏组织;D—患病肾脏,白细胞增多,肾小管上皮细胞坏死、解体(★所示);E—正常肠道组织;F—患病肠道,肌肉层和黏膜层中有大量的红细胞聚集(★所示),肠绒毛和肠黏膜组织腐烂脱落。A—normal spleen appearance;B—diseased spleen,showing numerous necrotic cells and abundant nodules (stars);C—normal kidney appearance;D—diseased kidney,showing vacuolar degeneration and necrosis of epithelial cells of renal tubule (stars);E—normal intestinal tract;F—diseased intestinal tract,showing intestinal villi and mucosal tissue largely rotted and separated from the lining of the intestine,and red blood cell accumulation in the muscle layer and mucous layer(stars).
图2 患病半滑舌鳎组织病理变化
Fig.2 Histopathological changes of diseased half-smooth tongue sole
2.3 病原的分离和鉴定
利用显微镜进行寄生虫检测,除体表黏液和鳃丝有少量纤毛虫外,其他部位未检测到寄生虫。从肾脏中分离到一株细菌,将其命名为ST-2020-2。将该菌在BHI平板上28 ℃下培养48 h后,菌落呈圆形、湿润、扁平、光滑、淡黄色、不透明、边缘整齐,菌落直径为1.5~2.0 mm,在TCBS培养基上不生长。
通过生理生化试验发现,菌株ST-2020-2为革兰氏阴性杆菌,无运动性,不溶血,37 ℃不生长,氧化酶和VP反应阳性,能利用葡萄糖,不能利用蔗糖、阿拉伯糖、鼠李糖、甘露醇、蜜二糖(表1)。
PCR扩增获得菌株ST-2020-2的16S rDNA序列,片段大小约1 500 bp,在NCBI的登录号为(MW850501)。利用NCBI 数据库比对分析,结果表明,该菌株与Photobacterium damselae subsp.piscicida PN510(登录号AY147860)和Photobacterium damselae subsp.piscicida CVD1(登录号AY147856)菌株的一致性均为100%。将该菌与GenBank中相近种16S rDNA基因进行匹配排列,构建系统发育树,结果表明,菌株ST-2020-2先与美人鱼发光杆菌杀鱼亚种聚成一支,然后与美人鱼发光杆菌美人鱼亚种聚为一大支(图3)。结合生理生化特征和分子生物学分析,将ST-2020-2鉴定为美人鱼发光杆菌杀鱼亚种Photobacterium damselae subsp.piscicida。
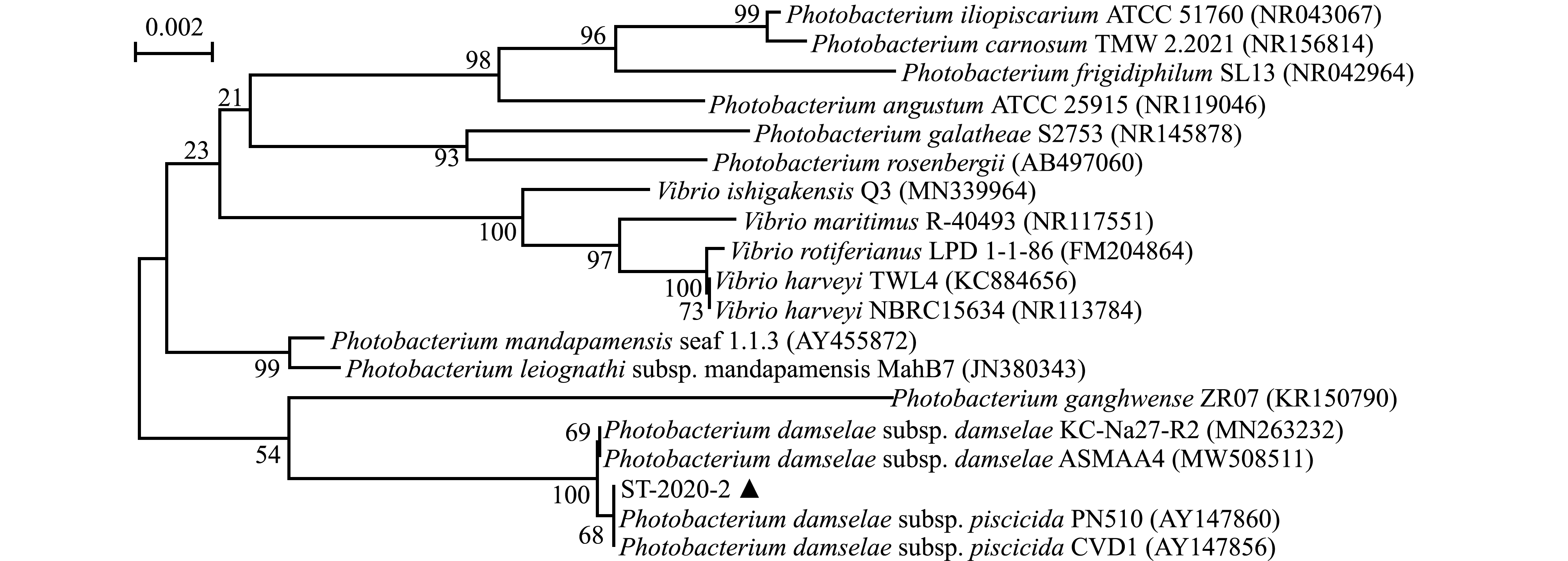
图3 基于邻接法构建的不同物种16S rDNA系统进化树
Fig.3 Phylogenetic tree of the 16S rDNA sequences in different species based on Neighbor-joining method
2.4 人工感染试验
从人工感染后的第3天开始,半滑舌鳎开始出现死亡,至第14天时,试验组半滑舌鳎的累计死亡率为90%,对照组在第2天时有1尾死亡,可能是人为操作不慎造成,累计死亡率为3.33%(图4)。死亡鱼的主要症状为腹部膨胀,腹水。从濒死半滑舌鳎肾脏和脾脏分离细菌,发现菌落形态单一,随机挑取单菌落进行纯化,命名为ST-2020-3,其生理生化反应结果与菌株ST-2020-2完全一致(表1)。
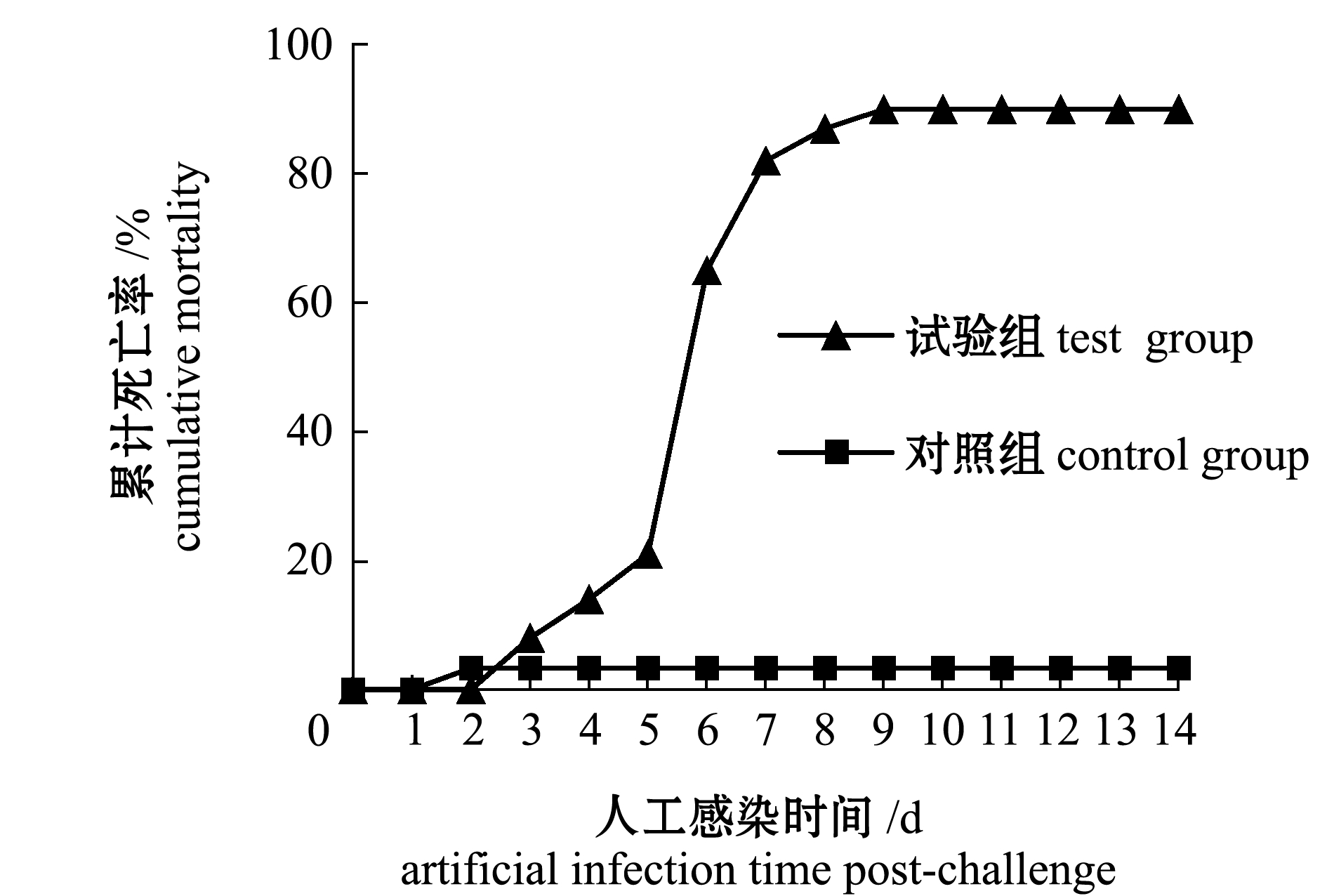
图4 人工感染半滑舌鳎的累计死亡率
Fig.4 Cumulative mortalities of experimentally infected half-smooth tongue sole
表1 菌株ST-2020-2和ST-2020-3的生理生化反应结果
Tab.1 Physiological and biochemical identification of isolated strains ST-2020-2 and ST-2020-3

生化项目 biochemical itemST-2020-2ST-2020-3革兰氏染色gram stain--运动性motility--37 ℃生长 growth at 37 ℃--氧化酶oxidase++VP反应 Voges-Proskauer reaction++吲哚产生indole production--H2S产生H2S production--柠檬酸盐citrate utilization--溶血性hemolysisγγ葡萄糖glucose++蔗糖sucrose--阿拉伯糖arabinose--鼠李糖rhamnose--甘露醇mannitol--蜜二糖melibiose--山梨醇sorbitol--
注:+表示阳性;-表示阴性;γ表示γ型溶血。
Note:+,positive;-,negative;γ,γ hemolysis.
2.5 药物敏感性试验
菌株ST-2020-2的药敏试验结果如表2所示,在测定的16种抗生素中,菌株ST-2020-2除了对链霉素、环丙沙星和氟苯尼考敏感外,对四环素、卡那霉素、氨苄西林中度敏感,对新霉素、多黏菌素、复方新诺明等10种药物具有耐药性。
表2 菌株ST-2020-2对16种抗生素的敏感性分析
Tab.2 Sensitivity of strain ST-2020-2 to 16 kinds of antibiotics
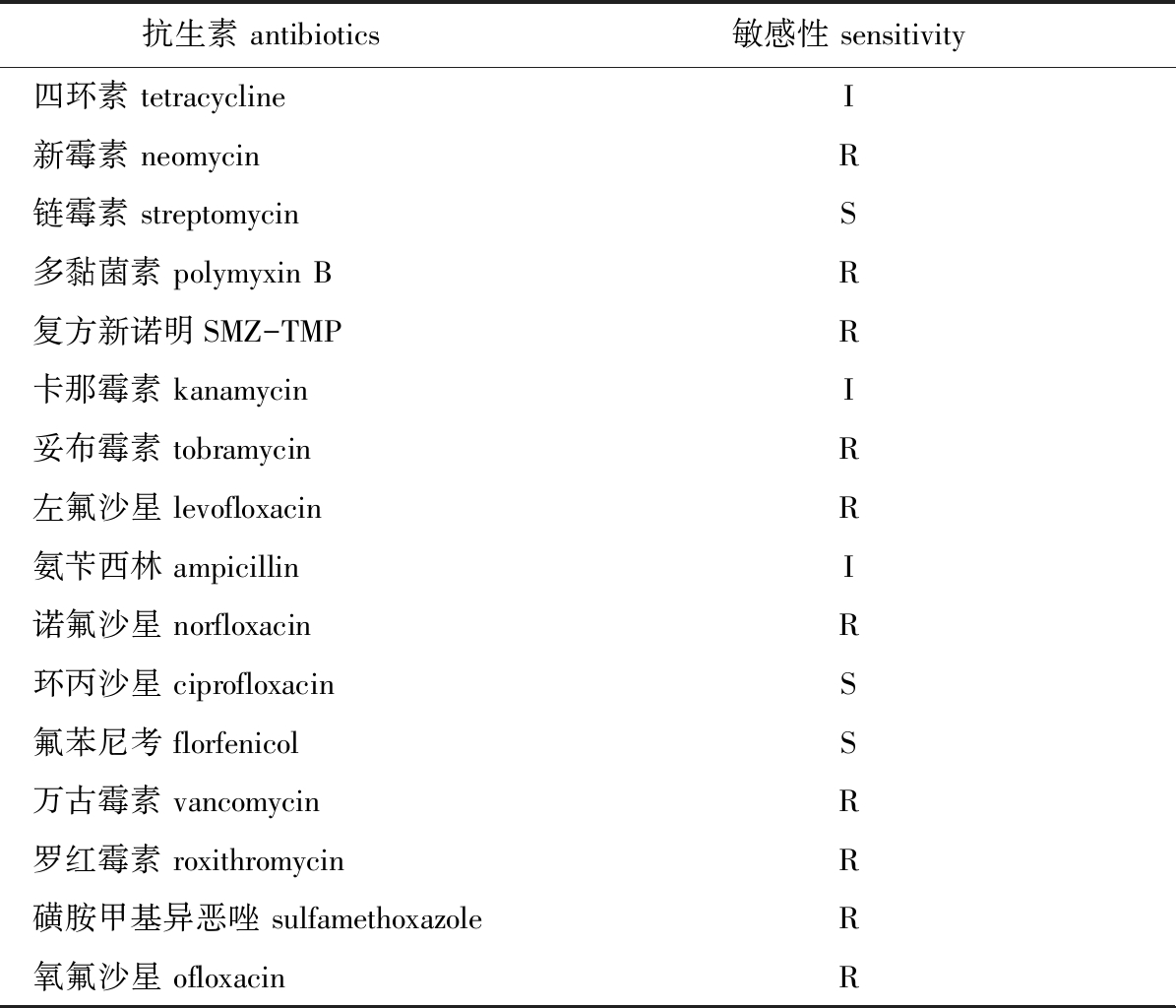
抗生素 antibiotics敏感性 sensitivity四环素 tetracyclineI新霉素 neomycinR链霉素 streptomycinS多黏菌素 polymyxin BR复方新诺明SMZ-TMPR卡那霉素 kanamycinI妥布霉素 tobramycinR左氟沙星 levofloxacinR氨苄西林 ampicillinI诺氟沙星 norfloxacinR环丙沙星 ciprofloxacinS氟苯尼考 florfenicolS万古霉素 vancomycinR罗红霉素 roxithromycinR磺胺甲基异恶唑 sulfamethoxazoleR氧氟沙星 ofloxacinR
注:S—敏感;I—中度耐药;R—耐药。
Note:S—sensibility;I—moderate drug resistance;R—drug resistance.
3 讨论
3.1 美人鱼发光杆菌的致病性
美人鱼发光杆菌包括美人鱼发光杆菌杀鱼亚种Photobacterium damselae subsp.piscicida和美人鱼发光杆菌美人鱼亚种Photobacterium damselae subsp.damselae两个亚种,美人鱼亚种以前被称为美人鱼弧菌,具有弧菌的部分特性,37 ℃能生长,能感染多种海洋鱼类和人类,引起人类伤口感染和坏死性筋膜炎[11-13]。杀鱼亚种曾被称为杀鱼巴斯德氏菌Pasteurella piscicida,37 ℃不能生长,故对人没有致病性[14],是鱼类巴斯德氏菌病亦称类结节症的病原,对多种养殖鱼类有高致病性,鰤Seriola quinqueradiata[15]、大黄鱼Pseudosciaena crocea[16]、龙胆石斑鱼Epinephelus lanceolatus[17]、金头鲷Sparus aurata[18]、军曹鱼Rachycentron canadum[19]、卵形鲳鲹Trachinotus ovatus[20]、豹纹鳃棘鲈Plectropomus leopardus[21]、大菱鲆Scophthalmus maximus[22]和半滑舌鳎[6]等海水鱼类都能被其感染。美人鱼发光杆菌杀鱼亚种因宿主范围广、死亡率高而被认为是世界范围内海水养殖中最具威胁性的细菌性病原之一,给欧洲、美国、日本和中国等国家和地区的海水养殖业造成了重大经济损失[23]。
本试验中,从患病半滑舌鳎肾脏中分离到大量菌落形态一致的细菌,通过生理生化反应和分子生物学分析,将分离菌株ST-2020-2鉴定为美人鱼发光杆菌杀鱼亚种。通过回感试验,发现该菌株能引起半滑舌鳎发病并导致90%的死亡率,这说明菌株具有较强的致病性,是导致半滑舌鳎套肠症病害的病原。研究表明,美人鱼发光杆菌杀鱼亚种携带溶血素基因,能分泌溶血素,在血平板中呈现α或β溶血[20-21]。溶血素可以溶解动物血液中的红细胞,从而对动物组织造成损伤,是细菌的主要毒力因子之一。本试验中分离的菌株ST-2020-2虽不具备溶血性,但同样能导致半滑舌鳎的发病和死亡,这表明美人鱼发光杆菌杀鱼亚种还存在其他重要的致病因子。此外,本研究中分离到的无溶血性的美人鱼发光杆菌杀鱼亚种是否代表一种新的血清型还有待进一步研究,这为今后该菌血清型的分析提供了材料。
本研究中,通过回感试验证明了分离菌株ST-2020-2的致病性,但在被人工感染的半滑舌鳎中未能观察到肠套叠现象,肠套叠是指动物的部分肠管及肠系膜套入邻近肠腔所致的一种绞窄性肠梗阻,并导致肠内容物通过障碍。婴幼儿和猪、犬、羊等的肠套叠是一种比较常见的病症[24-27]。该症状在鱼类中较为少见,目前,仅见于斑点叉尾鮰和罗非鱼发生肠套叠的报道,并从这两种患病鱼体内分离到嗜麦芽寡养单胞菌Stenotrophomonasm altophilia[28]、迟缓爱德华氏菌Edwardsiella ictaluri[29]、嗜水气单胞菌Aeromonas hydrophila[30-31]、温和气单胞菌Aeromonas sobria[32]、荧光假单胞菌Pseudomonas fluoresces[33]和海豚链球菌Streptococcus iniae[34]等病原菌,这些细菌都是鱼类的常见病原,在人工感染试验中都能导致斑点叉尾鮰或罗非鱼发生病害和死亡,但在实验室内都很难复制出典型的肠套叠症状,本试验中的结果与之类似。这可能是由于鱼类产生肠套叠症状是一个复杂的机理过程,需要多种因素共同发挥作用。此外,也有学者提出,也可能是先发生肠套叠现象然后才造成细菌感染[33],由于某些原因造成鱼类肠道血流减少后,容易对肠道黏膜造成损伤,从而引起肠道蛋白酶类参与的肠黏膜自溶,导致肠道不规则收缩、套叠、断裂等现象,为继发感染创造了条件[35]。因此,这些病原菌与肠套叠症状发生的因果关系还需要进一步研究。
3.2 美人鱼发光杆菌病害的控制
研究表明,患病鱼肾脏和脾脏中产生肉眼可见的白色结节是感染美人鱼发光杆菌的典型症状[15-16,20-21]。本试验中,在患病半滑舌鳎体内并未观察到此现象,通过组织病理切片,在脾脏中观察到直径约30 μm 的小结节,这可能与脾和肾出现白色结节是个缓慢的感染过程相关,随着病害的持续,小结节之间会逐渐融合形成大结节[5],由此推测,患病鱼还处于发病初期。由于内脏结节的形成使药物难以渗透,从而加大了药物治疗的难度,有学者提出在尚未形成结节前,通过杀菌抑菌进行预防是最为有效的措施[36],因此,在发病初期分离病原菌并开展药物敏感性试验十分必要。本试验中,通过药物敏感性试验发现,在测定的16种药物中,分离菌株ST-2020-2对13种药物呈现耐药或中度耐药。邓益琴等[37]检测了35株从海水鱼中分离的美人鱼发光杆菌对15种抗生素的敏感性,结果显示,35株菌表现出27种耐药谱,多重耐药率(菌株耐抗生素种类>3)达到60%。这可能与水产养殖业中大量使用和滥用这些抗生素有关。为了减少抗生素的使用,应采用其他的控制手段,更多地关注疫苗的使用。
综上所述,本研究中首次报道了半滑舌鳎套肠症,从患病鱼体内分离出疑似病原,经鉴定为美人鱼发光杆菌杀鱼亚种,通过药敏试验筛选了敏感药物,为该病的防治提供了技术支撑。
4 结论
1)从患套肠症半滑舌鳎体内分离疑似病原,综合生理生化特征和16S rDNA基因序列分析将其鉴定为美人鱼发光杆菌杀鱼亚种,该分离菌株能引起健康半滑舌鳎发病,致死率为90%,说明美人鱼发光杆菌杀鱼亚种是导致半滑舌鳎套肠症病害的病原。
2)分离菌株美人鱼发光杆菌杀鱼亚种对链霉素、环丙沙星、氟苯尼考敏感,对四环素、卡那霉素、氨苄西林中度敏感,对新霉素、多黏菌素、复方新诺明等10种药物具有耐药性,说明分离菌株具有多重耐药。今后应采取多种防控措施,为鱼类养殖业的可持续发展提供技术支撑。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2019中国渔业统计年鉴[M].北京:中国农业出版社,2019.
Fishery and Fishery Administration of the Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Station,China Fisheries Society.2019 China fishery statistics yearbook[M].Beijing:China Agriculture Press,2019.(in Chinese)
[2] 张晓君,秦国民,阎斌伦,等.半滑舌鳎病原鳗利斯顿氏菌表型及分子特征研究[J].海洋学报,2009,31(5):112-122.
ZHANG X J,QIN G M,YAN B L,et al.Phenotype and molecular characteristics of Listonella anguilla,a pathogen of semi-smooth tongue sole[J].Acta Oceanologica Sinica,2009,31(5):112-122.(in Chinese)
[3] GAO G S,ZHANG Y Y,SHI Q M,et al.Isolation and identification of the pathogen causing skin ulcer disease in Cynoglossus semilaevis Gunther and its sensitivity to Chinese herbal medicine[J].Agricultural Science &Technology,2015,16(10):2221-2224,2276.
[4] HAN Z R,SUN J F,LV A J,et al.Isolation,identification and characterization of Shewanella algae from reared tongue sole,Cynoglossus semilaevis Günther[J].Aquaculture,2017,468:356-362.
[5] LUO Z,LI J,ZHANG Z G,et al.Mycobacterium marinum is the causative agent of splenic and renal granulomas in half-smooth tongue sole (Cynoglossus semilaevis Günther)in China[J].Aquaculture,2018,490:203-207.
[6] WANG Y,HAN Y,LI Y,et al.Isolation of Photobacterium damselae subsp.piscicida from diseased tongue sole (Cynoglossus semilaevis Günther)in China[J].Acta Microbiologica Sinica,2007,47(5):763-768.
[7] SHAO P,YONG P Z,ZHOU W L,et al.First isolation of Photobacterium damselae subsp.damselae from half-smooth tongue sole suffering from skin-ulceration disease[J].Aquaculture,2019,511:734208.
[8] XIAO P,JIANG M,LIU Y,et al.Splenic necrosis signs and pathogen detection in cultured half-smooth tongue sole,Cynoglossus semilaevis Günther[J].Journal of Fish Diseases,2015,38(1):103-106.
[9] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
DONG X Z,CAI M Y.Handbook of systematic identification of common bacteria[M].Beijing:Science Press,2001.(in Chinese)
[10] LANE D J.16S/23S rRNA sequencing[M]//STACKEBRANDT E,GOODFELLOW M.Nucleic acid techniques in bacterial systematics.NewYork:John Wiley &Sons Ltd,1991:115-175.
[11] RIVAS A J,LEMOS M L,OSORIO C R.Photobacterium damselae subsp.damselae,a bacterium pathogenic for marine animals and humans[J].Frontiers in Microbiology,2013,4:283.
[12] CLARRIDGE J E,ZIGHELBOIM-DAUM S.Isolation and characterization of two hemolytic phenotypes of Vibrio damsela associated with a fatal wound infection[J].Journal of Clinical Microbiology,1985,21(3):302-306.
[13] YAMANE K,ASATO J,KAWADE N,et al.Two cases of fatal necrotizing fasciitis caused by Photobacterium damsela in Japan[J].Journal of Clinical Microbiology,2004,42(3):1370-1372.
[14] RIVAS A J,BALADO M,LEMOS M L,et al.The Photobacterium damselae subsp.damselae hemolysins damselysin and HlyA are encoded within a new virulence plasmid[J].Infection and Immunity,2011,79(11):4617-4627.
[15] 畑井喜司雄,小川和夫.新鱼病图谱[M].任晓明,译.北京:中国农业大学出版社,2007.
HATAI K,OGAWA K.Atlas of new fish disease[M].REN X M,Trans.Beijing:China Agricultural University Press,2007.(in Chinese)
[16] 张飞,苏永全,王军,等.大黄鱼(Pseudosciaena crocea)源美人鱼发光杆菌(Photobacterium damselae)的分离鉴定及致病性研究[J].海洋与湖沼,2012,43(6):1202-1208.
ZHANG F,SU Y Q,WANG J,et al.Studies on the isolation,identification and virulence of Photobacterium damselae isolated from Pseudosciaena crocea[J].Oceanologia et Limnologia Sinica,2012,43(6):1202-1208.(in Chinese)
[17] 张晓君,秦国民,陈翠珍,等.龙胆石斑鱼源美人鱼发光杆菌的生物学特性与系统发育学分析[J].渔业科学进展,2009,30(3):38-43.
ZHANG X J,QIN G M,CHEN C Z,et al.Biological characteristics and phylogenetic analysis of Photobacterium damselae subsp.damselae from Epinephelus lanceolatus[J].Progress in Fishery Sciences,2009,30(3):38-43.(in Chinese)
[18] ROMALDE J L.Photobacterium damselae subsp.piscicida:an integrated view of a bacterial fish pathogen[J].International Microbiology,2002,5(1):3-9.
[19] LIU P C,LIN J Y,LEE K K,et al.Virulence of Photobacterium damselae subsp.piscicida in cultured cobia Rachycentron canadum[J].Journal of Basic Microbiology,2003,43(6):499-507.
[20] 王瑞旋,冯娟,苏友禄,等.卵形鲳鲹美人鱼发光杆菌杀鱼亚种的分离鉴定[J].中国水产科学,2010,17(5):1020-1027.
WANG R X,FENG J,SU Y L,et al.Isolation of Photobacterium damselae subsp.piscicida from diseased golden pompano (Trachinotus ovatus Linnaeus)and its drug sensitivity[J].Journal of Fishery Sciences of China,2010,17(5):1020-1027.(in Chinese)
[21] 徐晓丽,尤宏争,姚学良,等.豹纹鳃棘鲈类结节症病原的分离鉴定[J].水产科学,2019,38(2):254-259.
XU X L,YOU H Z,YAO X L,et al.Isolation and identification of pathogen in leopard coraltrout Plectropomus leopardus with nodular disease[J].Fisheries Science,2019,38(2):254-259.(in Chinese)
[22] 吴同垒,张志强,李巧玲,等.大菱鲆源美人鱼发光杆菌杀鱼亚种的分离鉴定[J].中国兽医学报,2018,38(2):301-306.
WU T L,ZHANG Z Q,LI Q L,et al.Isolation and identification of Photobacterium damselae subsp.piscicida from Scophthalmus maximus[J].Chinese Journal of Veterinary Science,2018,38(2):301-306.(in Chinese)
[23] BARNES A C,DOS SANTOS N M S,ELLIS A E.Update on bacterial vaccines:Photobacterium damselae subsp.piscicida[J].Developments in Biologicals,2005,121:75-84.
[24] 马岩,鲁莹,黄艳智,等.腺病毒感染与肠套叠的相关性[J].国际儿科学杂志,2017,44(7):507-509.
MA Y,LU Y,HUANG Y Z,et al.The correlation between adenovirus infection and intussusception[J].International Journal of Pediatrics,2017,44(7):507-509.(in Chinese)
[25] 张方林,陈德利,陈本云,等.犬肠套叠病例剖析[J].中国兽医杂志,2008(3):70-71.
ZHANG F L,CHEN D L,CHEN B Y,et al.Analysis of canine intussusception cases[J].Chinese Journal of Veterinary Medicine,2008(3):70-71.(in Chinese)
[26] 王振荣.绵羊肠套迭的诊断与治疗[J].当代畜禽养殖业,2014(2):22-24.
WANG Z R.Diagnosis and treatment of sheep intussusception[J].Modern Animal Husbandry,2014(2):22-24.(in Chinese)
[27] 李尧清,秦建琼,田英,等.猪肠吻合术后复合性肠套迭一例[J].四川动物,2000,19(5):50.
LI Y Q,QIN J Q,TIAN Y,et al.A case of compound intussusception after porcine enterostomy[J].Sichuan Journal of Zoology,2000,19(5):50.(in Chinese)
[28] 汪开毓,耿毅,黄小丽,等.斑点叉尾鮰Ictalurus punctatus(Rifinesque)传染性套肠症(infectious intussusception)[J].现代渔业信息,2006,21(9):3-8.
WANG K Y,GENG Y,HUAG X L,et al.Channel catfish Ictalurus punctatus (Rifinesque)infectious intussusception[J].Modern Fisheries Information,2006,21(9):3-8.(in Chinese)
[29] 刘堂水,汪成竹,陈昌福.斑点叉尾鮰细菌性病原的分离与鉴定[J].华中农业大学学报,2006,25(5):550-554.
LIU T S,WANG C Z,CHEN C F.Isolation and identification of pathogenic bacteria from channel catfish,Ictalurus punctatus[J].Journal of Huazhong Agricultural University,2006,25(5):550-554.(in Chinese)
[30] 童桂香,黎小正,韦信贤,等.斑点叉尾鮰套肠症的病原鉴定及其药敏特性[J].大连水产学院学报,2009,24(6):475-481.
TONG G X,LI X Z,WEI X X,et al.Identification and antibiotic sensitivity of pathogen of intussusception disease found in channel catfish Ictalurus punctatus[J].Journal of Dalian Fisheries University,2009,24(6):475-481.(in Chinese)
[31] 邓小红,牛志伟,龙苏,等.罗非鱼套肠病病原菌的分离鉴定及药敏试验[J].广西畜牧兽医 2015,31(3):152-154.
DENG X H,NIU Z W,LONG S,et al.Isolation,identification and drug sensitivity test of the pathogen of tilapia nest disease[J].Guangxi Journal of Animal Husbandry Veterinary Medicine,2015,31(3):152-154.(in Chinese)
[32] 彭亚,刘杰,胡大胜,等.斑点叉尾鮰肠套叠症病原菌的分离鉴定及药敏试验[J].淡水渔业,2014,44(4):67-72.
PENG Y,LIU J,HU D S,et al.Identification and drug sensitive test of the pathogenic bacteria isolated from Ictalurus punctatus intussusceptions disease[J].Freshwater Fisheries,2014,44(4):67-72.(in Chinese)
[33] 刘金玉,杨五名,李爱华,等.斑点叉尾鮰套肠症的病原学初步研究[J].水生生物学报,2008,32(6):824-831.
LIU J Y,YANG W M,LI A H,et al.Preliminary study on the etiology of channel catfish intussusception disease[J].Acta Hydrobiologica Sinica,2008,32(6):824-831.(in Chinese)
[34] 余晓丽,陈明,李超,等.斑点叉尾鮰暴发性海豚链球菌病的研究[J].大连水产学院学报,2008,23(3):185-191.
YU X L,CHEN M,LI C,et al.Ictalurus punctatus outbreak infected by bacterium Streptococcus iniae[J].Journal of Dalian Fisheries University,2008,23(3):185-191.(in Chinese)
[35] DURBOROW R M,HANSON L.Severed intestine in channel catfish[J].Journal of Wildlife Diseases,1988,24(1):146-149.
[36] 张永嘉.黄鳍鲷结节病病理组织学研究[J].海洋与湖沼,1991,22(6):561-565.
ZHANG Y J.Histopathological studies on the tuberculosis of black bream,Sparus latus Houttuyn[J].Oceanologia et Limnologia Sinica,1991,22(6):561-565.(in Chinese)
[37] 邓益琴,徐力文,张亚秋,等.我国华南沿海海水养殖鱼类病原菌美人鱼发光杆菌(Photobacterium damselae)分离株的毒力基因和耐药性分析[J].微生物学报,2020,60(11):2606-2619.
DENG Y Q,XU L W,ZHANG Y Q,et al.Analysis of virulence genes and antibiotic resistance of Photobacterium damselae isolated from marine fishes in coastal South China[J].Acta Microbiologica Sinica,2020,60(11):2606-2619.(in Chinese)