海盘虫Haliotrema sp.隶属于扁形动物门Platyhelminthes单殖亚纲Monogenea锚首虫科Ancyrocephalidae海盘虫属Haliotrema,是海水鱼类常见的寄生虫[1],常寄生于石斑鱼、真鲷、大黄鱼、鲈、东方鲀等海水养殖鱼类鳃上,严重感染后会导致养殖鱼类发病,甚至大量死亡。根据Boeger等[2]和Kritsky等[3]分类系统描述的海盘虫,种类已超过100多种,国内已报道发现50多种[4]。海盘虫具有一定的宿主特异性,如黑鲷海盘虫H.kurodai寄生于黄鳍鲷Acanthopagrus latus、黑鲷A.schlegelii,约氏海盘虫H.johnii寄生于紫红笛鲷Lutjanus argentimaculatus、勒氏笛鲷L.russellii、金带笛鲷L.vaigiensis,鲬海盘虫H.platycephali寄生于鲬Platycephalus indicus等[1]。国内外关于海盘虫研究主要集中在分类鉴定和宿主方面[5-10],而相关海盘虫病病原研究报道较少,仅张剑英等[11]报道石斑鱼海盘虫H.epinepheli引发赤点石斑鱼Epinephelus akaara和真鲷Pagrus major发生海盘虫病。有关双斑东方鲀海盘虫病病原鉴定、流行病学调查和组织病理研究等目前尚未见详细报道,因此,有必要对双斑东方鲀海盘虫病进行系统性研究。
双斑东方鲀Takifugu bimaculatus是一种已在福建沿海规模化养殖的特色经济鱼类,其肉质细嫩、鲜美,深受消费者喜欢[12]。随着双斑东方鲀养殖高密度化或管理措施不当,易导致海盘虫病暴发,如果生产上未采取防治措施,会造成幼鱼和成鱼大量死亡,给东方鲀养殖业造成严重经济损失。为了对双斑东方鲀海盘虫病深入了解,本项目组于2016年6月—2019年6月,对福建省海水鱼类苗种繁育科研中试基地池塘养殖的双斑东方鲀海盘虫病流行情况进行调查,利用虫体形态学观察和分子生物学检测相结合的方法对发生病原进行鉴定,并观察了病鱼鳃组织病理变化情况,通过研究确认了双裂海盘虫H.bilobatus为福建池塘养殖的双斑东方鲀海盘虫病感染病原,这是双裂海盘虫引起双斑东方鲀疾病在国内的首次报道,该研究成果可为海水鱼类海盘虫病病原鉴定和防控提供科学参考依据。
1 材料与方法
1.1 材料
试验用患病双斑东方鲀鱼取自福建省海水鱼类苗种繁育科研中试基地养殖池塘。
主要试剂:DNA试剂盒购自上海捷瑞生物工程有限公司;PCR扩增引物由英潍捷基(上海)贸易有限公司合成;固定液购自武汉赛维尔生物科技有限公司;乙醇购自西陇科学股份有限公司;海水细菌培养基2216E和弧菌培养基(TCBS)购自北京陆桥技术股份有限公司。
1.2 方法
1.2.1 流行病学调查及临床检查 于2016年6月—2019年6月期间调查池塘养殖的双斑东方鲀海盘虫病流行发生、发病鱼大小、病鱼感染、发病期间死亡及病鱼活动情况,了解发病时池塘水温、盐度等水质理化情况。取临床典型症状的病鱼(濒死)解剖,观察病鱼体表体征、鳃及内脏器官,描述体表、鳃丝及脏器典型性表观病理特征。
每次发病期间,剪取30尾以上病鱼的半鳃,置解剖镜(Olympus-SZX12)下检查,并采集虫体和计数,按文献方法确认病鱼虫体感染强度[13]:轻度感染(半鳃感染量≤10枚,用“+”表示);中度感染(10<半鳃感染量<50枚,用“++”表示);重度感染(半鳃感染量≥50枚,用“+++”表示)。
1.2.2 细菌检查 无菌操作条件下,从病鱼的鳃、肝脏、脾脏和肾脏等器官组织分离细菌,划线接种于2216E平板培养基和弧菌选择性培养基(TCBS)上,置于恒温箱(28 ℃)倒置培养24~48 h,观察细菌生长情况。
1.2.3 病原虫体形态学观察与特征鉴定 剪取病鱼半鳃片置于培养皿,经体积分数为30%的乙醇处理后,在解剖镜下用解剖针随机轻挑拨离30条微麻醉虫体,用吸管吸取虫体置于玻片,制成水浸片置于光学显微镜(Lw200-20T)下观察并拍照,描述虫体形态特征,并测量虫体、交接器、中央大钩、联结片和边缘小钩等分类特征的大小,即平均值和范围值。
1.2.4 分子生物学分析
1)虫体DNA提取、模板制备及18S rDNA和28S rDNA序列扩增。依形态学鉴定结果,随机选取用体积分数为95%的乙醇保存的虫体(采集),清洗,TE 缓冲液(pH 8.0)浸泡过夜后,分别装入1.5 mL Eppendorf 管中,用DNA 提取试剂盒(捷瑞GK4002-100)提取虫体DNA,于-20 ℃下保存备用。以虫体DNA为模板,采用核糖体基因的18S rDNA和28S rDNA序列扩增。
18S rDNA序列扩增引物[14]:Worm-A,5′GCGAATGGCTCATTAAATCAG 3′;Worm-B,5′CTTGTTACGACTTTTACTTCC 3′。PCR扩增反应体系(50 μL):DNA模板2 μL,PCRMix 25 μL,上、下游引物(Worm)各2 μL,ddH2O 19 μL。PCR反应条件:94 ℃下预变性3 min;94 ℃下变性30 s,52 ℃下复性30 s,72 ℃下延伸120 s,共进行40个循环;最后在72 ℃下温育10 min,4 ℃下保存。
28S rDNA序列扩增引物[15]:C1-28S-F,5′ACCCGCTGAATTTAAGCAT 3′;D2-28S-R,5′TGGTCCGTGTTTCAAGAC 3′。PCR扩增反应体系(50 μL):DNA模板2 μL,PCRMix 25 μL,上、下游引物(C1-28S)各2 μL,ddH2O 19 μL。PCR反应条件:94 ℃下预变性5 min;94 ℃下变性30 s,55 ℃下复性30 s,72 ℃下延伸90 s,共进行35个循环;最后在72 ℃下温育7 min,4 ℃下保存。18S rDNA和28S rDNA序列的PCR扩增产物各自用15 g/L琼脂糖凝胶电泳进行检测。
2)扩增产物序列比对和系统发育树构建。18S rDNA和28S rDNA 的PCR扩增产物送至Invitrogen 公司进行测序。将测得的基因序列经BLAST程序与核酸数据库(GenBank)序列进行比对分析。基于18S rDNA和28S rDNA基因序列从GenBank数据库选取相似、相近的单殖吸虫序列(含本研究中测得序列),利用ClustalX 1.83软件对选取序列进行多重匹配比对并聚类分析,用MEGA 7.0软件邻接法(Neighbor-Joining)构建系统发育树。
1.2.5 鳃组织病理观察 取病鱼鳃于波恩氏液中固定,然后将固定后的鳃用梯度乙醇脱水,二甲苯溶液透明,石蜡包埋,经连续切片、脱蜡,苏木精-伊红(H.E)染色,干燥后用中性树胶封片,最后将封片置于光学显微镜下观察并拍照。
2 结果与分析
2.1 流行病学调查及病鱼临床症状
2016年6月—2019年6月调查期间,福建省海水鱼类苗种繁育科研中试基地池塘养殖的双斑东方鲀每年均会发生海盘虫病,发病水温为23~31 ℃,盐度为1.019~1.022,发病时间多在春末夏初(5—6月)和秋季(9—10月),幼鱼和成鱼都会发病,该病有时与车轮虫病并发(表1)。
发病期病鱼虫体感染情况:幼鱼阶段(体长7.6~8.0 cm),病鱼平均半鳃感染量为26枚/尾,感染强度属于中度感染,发病情况严重;而成鱼阶段(19.3~21.5 cm),病鱼严重发病时平均半鳃感染量分别为164、176枚/尾,感染强度属于重度感染;严重发病时,幼鱼和成鱼虫体感染率均为100%(表1)。该病发病初期,发病鱼少量死亡;发病高峰期,出现大量死亡;如果未采取防控措施,该病累计死亡率可达70%以上。
表1 2016年6月—2019年6月池塘养殖双斑东方鲀海盘虫病的发生情况
Tab.1 Occurrence of haliotremasis in twin-spot puffer Takifugu bimaculatus cultured in ponds from June 2016 to June 2019
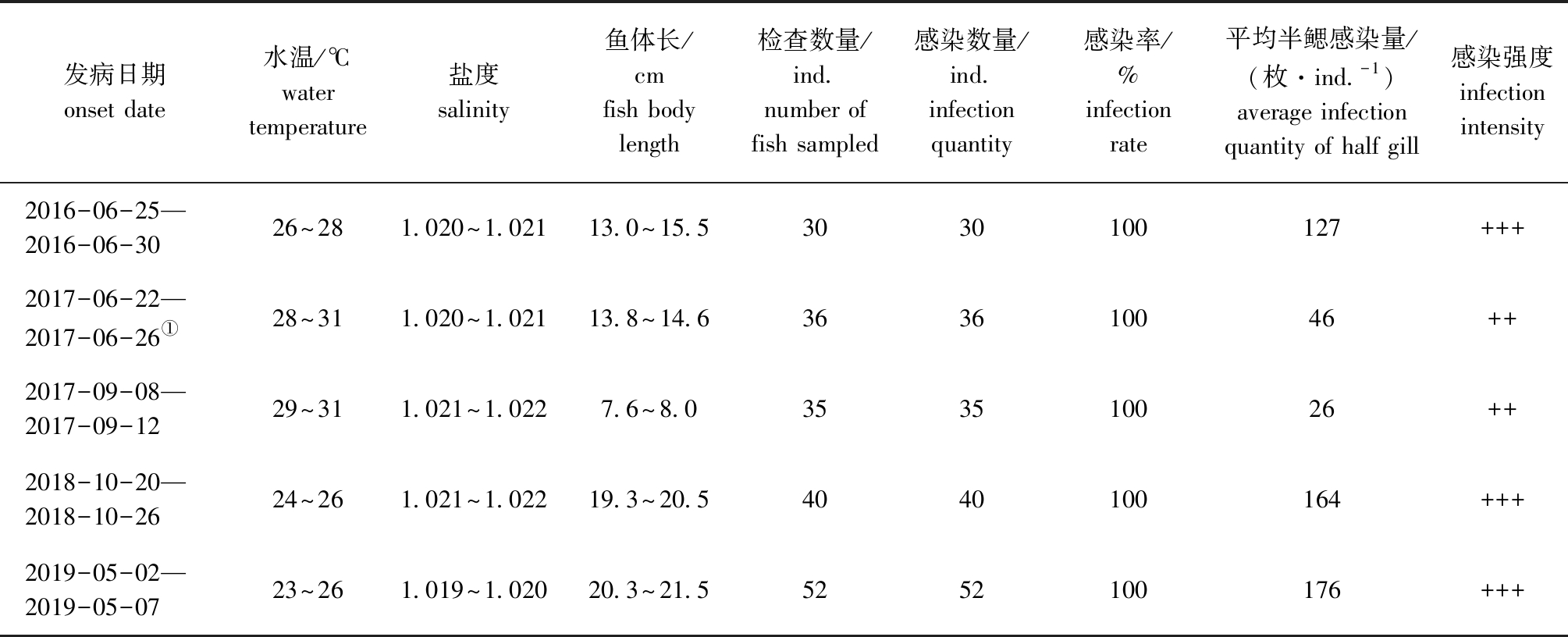
发病日期onset date水温/℃water temperature盐度salinity鱼体长/cmfish bodylength检查数量/ind.number of fish sampled感染数量/ind.infection quantity感染率/%infection rate平均半鳃感染量/(枚·ind.-1) average infection quantity of half gill感染强度infection intensity2016-06-25—2016-06-3026~281.020~1.02113.0~15.53030100127+++2017-06-22—2017-06-26①28~311.020~1.02113.8~14.6363610046++2017-09-08—2017-09-1229~311.021~1.0227.6~8.0353510026++2018-10-20—2018-10-2624~261.021~1.02219.3~20.54040100164+++2019-05-02—2019-05-0723~261.019~1.02020.3~21.55252100176+++
注:①伴发车轮虫病;++表示中度感染;+++表示重度感染。
Note:① concomitant trichodinasis;++,moderate infection;+++,severe infection.
发病时病鱼活动情况:病鱼缓游于水面,动作异常、迟缓,食欲减退或不摄食。外观病鱼体色苍白,体形消瘦,尾鳍和臀鳍缺损(图1A);解剖内脏发现其肝脏、脾脏充血严重(图1B);取鳃镜检发现,鳃丝上有大量单殖吸虫虫体,虫体扁平而长,用后吸器吸附固着鳃,虫体不断地伸缩摆动,移动时做尺蠖状动作(图1C);病鱼鳃片黏液多,部分鳃有虫卵,虫卵一端有极丝(图1D)。除了2017年6月发生海盘虫病的病鱼有拌生车轮虫外,其余几次发病时间显微镜检病鱼体表皮肤、鳍条和内脏器官等组织,未发现有其他病原体寄生。
2.2 细菌分离培养
取所采病鱼的鳃、肝脏、脾脏和肾脏等器官组织病料,接种于2216E平板和TCBS培养基进行细菌分离培养,28 ℃下恒温培养48 h后,所接种的培养基均未观察到优势致病菌。
2.3 病原虫体初步观察
2016年6月—2019年6月发病期间采集的病原虫体经显微镜观察,虫体大小约1 mm左右,内部结构清晰、典型(图2A):头器3对,前端有眼点2对,后一对眼点明显大于前一对,咽呈椭圆形;交接器简单,基部连接于杯形基座;后吸器与前体部区分明显,具2对中央大钩、2根联结片和7对边缘小钩;卵黄腺沿肠支分布于身体两侧,肠支简单,明显地分开,但在身体后端汇合。病原虫体符合锚首虫科海盘虫属特征[1],确定该寄生虫为海盘虫。结合病鱼特征、感染虫体形态和鳃虫数量情况,确认双斑东方鲀感染海盘虫病[11]。
2.4 海盘虫病病原形态学鉴定
上述发病期间,病原经形态学检查确认为同一种海盘虫虫体,该虫体较大,体长1.058 mm,中部宽0.225 mm,体长与体宽比约为4.7,咽直径0.075 mm(图2A);后吸器几丁质结构由2对中央大钩、2个联结片和7对边缘小钩组成(图2B);腹中央大钩粗壮,基部膨大,内外突分化,腹中央大钩长0.048 mm,钩柄宽0.035 mm,钩尖长0.018 mm(图2B(g));腹联结片棒状,近中部具两突起,两端稍细,长0.068 mm,中间宽0.016 mm(0.014~0.017 mm)(图2B(h));背中央大钩粗壮,基部膨大,外侧有裂刻,内外突分化明显,背中央大钩长0.046 mm,钩柄宽0.036 mm,钩尖长0.017 mm(图2B(i));背联结片呈“弓”形,两端膨大分叉,长0.060 mm,中间宽0.010 mm(0.009~0.011 mm)(图2B(j));7对边缘小钩,为形态相似的胚钩,钩尖凸起,长0.011 mm(图2B(k));交接器为细长弯管,长0.085 mm,基部稍膨大,连接于杯形基座,有圆形支持片(图2C)(表2)。
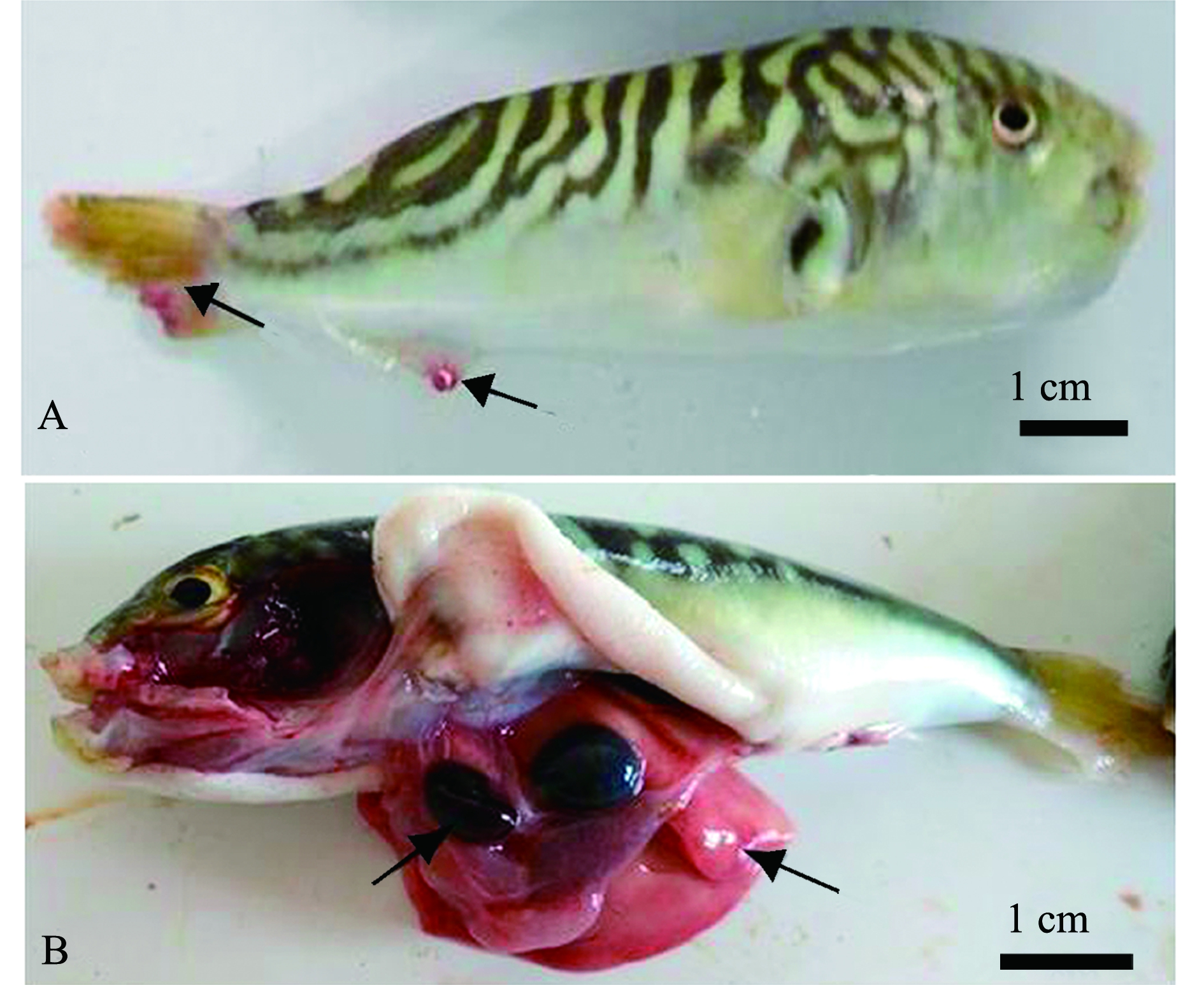
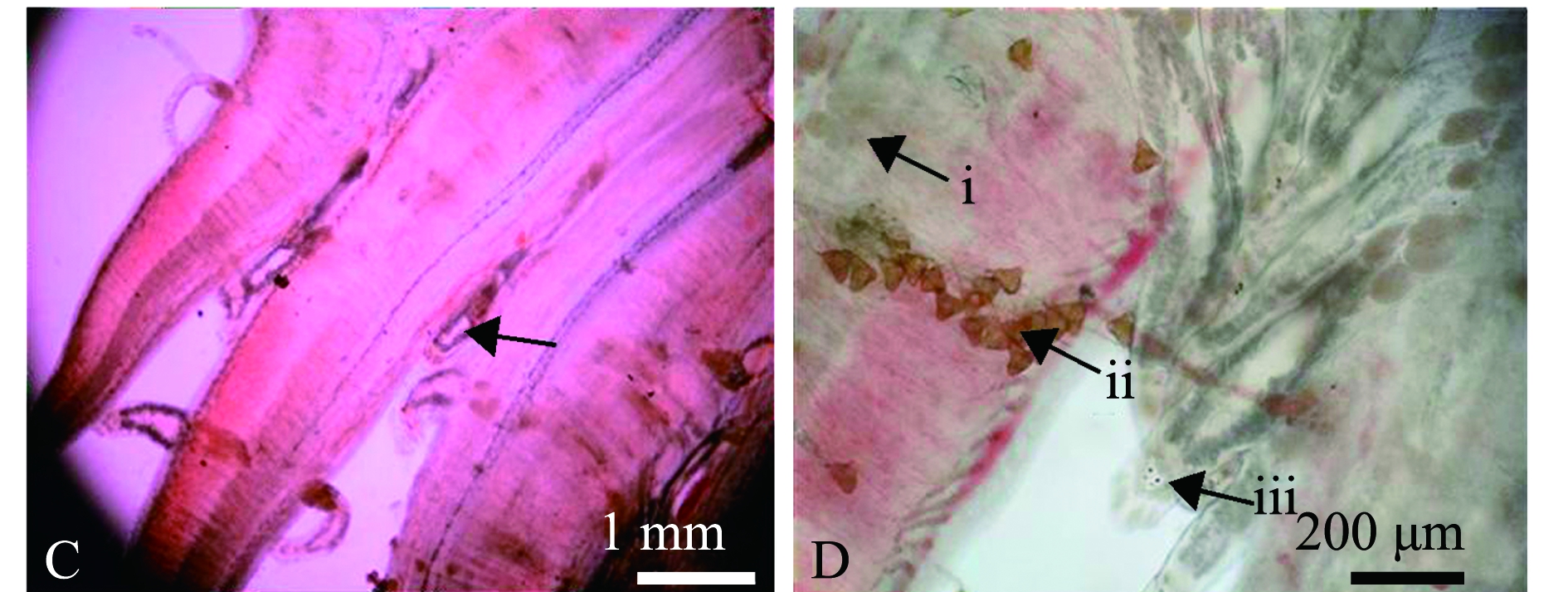
A—病鱼体型消瘦,尾鳍、臀鳍缺损;B—肝脏、脾脏充血;C—鳃上有大量的海盘虫;D—鳃丝分布虫卵及黏液(ⅰ—黏液,ⅱ—虫卵,ⅲ—虫体)。A—sick fish with emaciated body,defect of caudal and anal fins;B—severely hemorrhagic liver and spleen;C—a large number of Haliotrema sp.on the gills;D—worm eggs and mucus on gill filaments(ⅰ—mucus,ⅱ—worm eggs,ⅲ—worm body).
图1 患海盘虫病的双斑东方鲀
Fig.1 Twin-spot puffer Takifugu bimaculatus with haliotremasis
通过与已报道的海盘虫测量值进行比对发现(表2),本文描述虫种除了虫体和咽径稍大外,与文献[16]描述的双裂海盘虫最相似,包括几丁质结构(背、腹中央大钩、联接片和边缘小钩)形态和量度相似,背中央大钩外侧有裂刻,交接器为简单细长弯管,连接杯形基座,有一圆形支持片。
表2 寄生于不同宿主的海盘虫形态特征比较
Tab.2 Morphological comparison of parasite Haliotrema sp.from different hosts mm
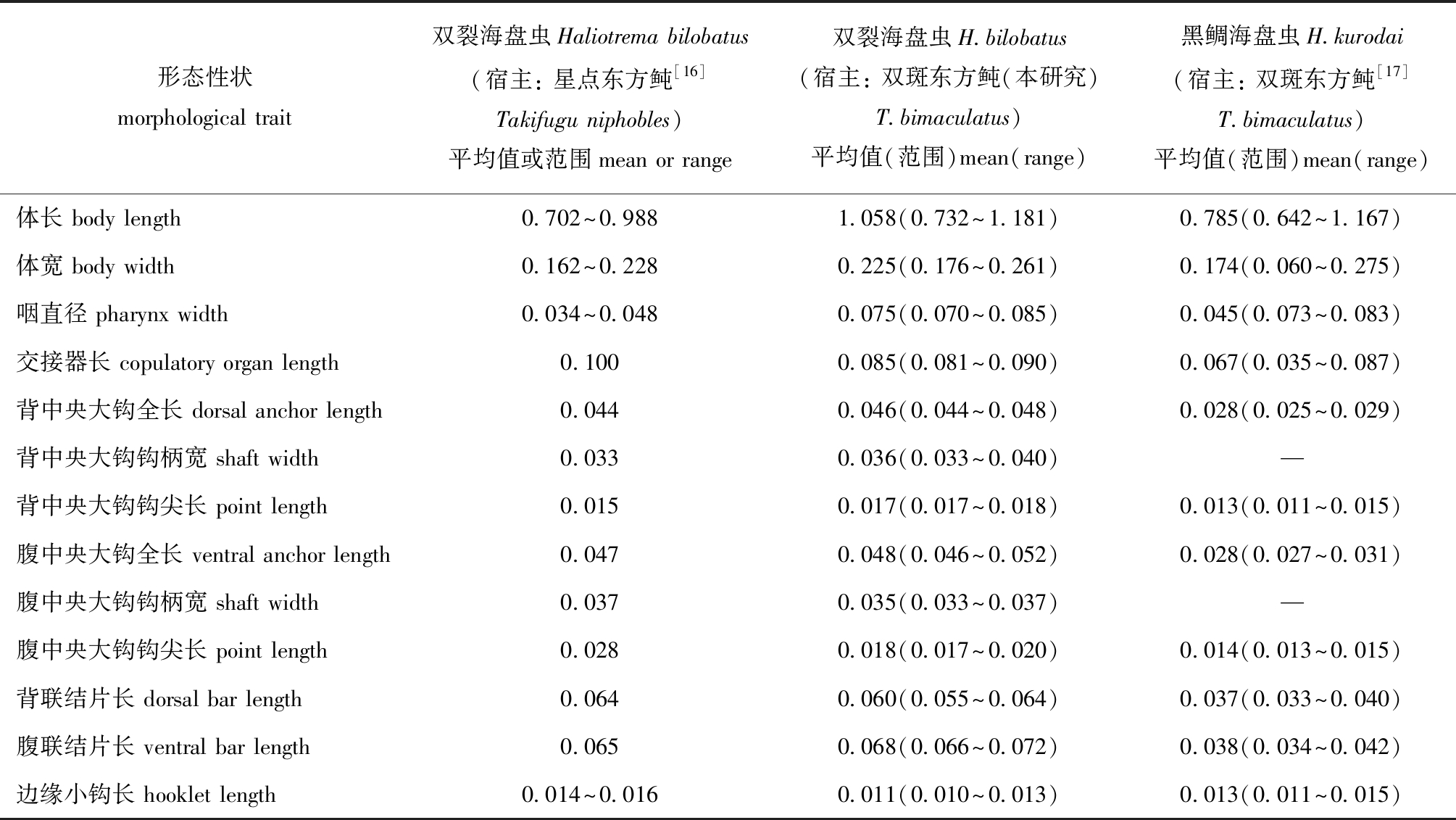
形态性状morphological trait双裂海盘虫Haliotrema bilobatus(宿主: 星点东方鲀[16]Takifugu niphobles)平均值或范围mean or range双裂海盘虫H.bilobatus(宿主: 双斑东方鲀(本研究)T.bimaculatus)平均值(范围)mean(range)黑鲷海盘虫H.kurodai(宿主: 双斑东方鲀[17]T.bimaculatus)平均值(范围)mean(range)体长 body length0.702~0.9881.058(0.732~1.181)0.785(0.642~1.167)体宽 body width0.162~0.2280.225(0.176~0.261)0.174(0.060~0.275)咽直径 pharynx width0.034~0.0480.075(0.070~0.085)0.045(0.073~0.083)交接器长 copulatory organ length0.1000.085(0.081~0.090)0.067(0.035~0.087)背中央大钩全长 dorsal anchor length0.0440.046(0.044~0.048)0.028(0.025~0.029)背中央大钩钩柄宽 shaft width0.0330.036(0.033~0.040)—背中央大钩钩尖长 point length0.0150.017(0.017~0.018)0.013(0.011~0.015)腹中央大钩全长 ventral anchor length0.0470.048(0.046~0.052)0.028(0.027~0.031)腹中央大钩钩柄宽 shaft width0.0370.035(0.033~0.037)—腹中央大钩钩尖长 point length0.0280.018(0.017~0.020)0.014(0.013~0.015)背联结片长 dorsal bar length0.0640.060(0.055~0.064)0.037(0.033~0.040)腹联结片长 ventral bar length0.0650.068(0.066~0.072)0.038(0.034~0.042)边缘小钩长 hooklet length0.014~0.0160.011(0.010~0.013)0.013(0.011~0.015)
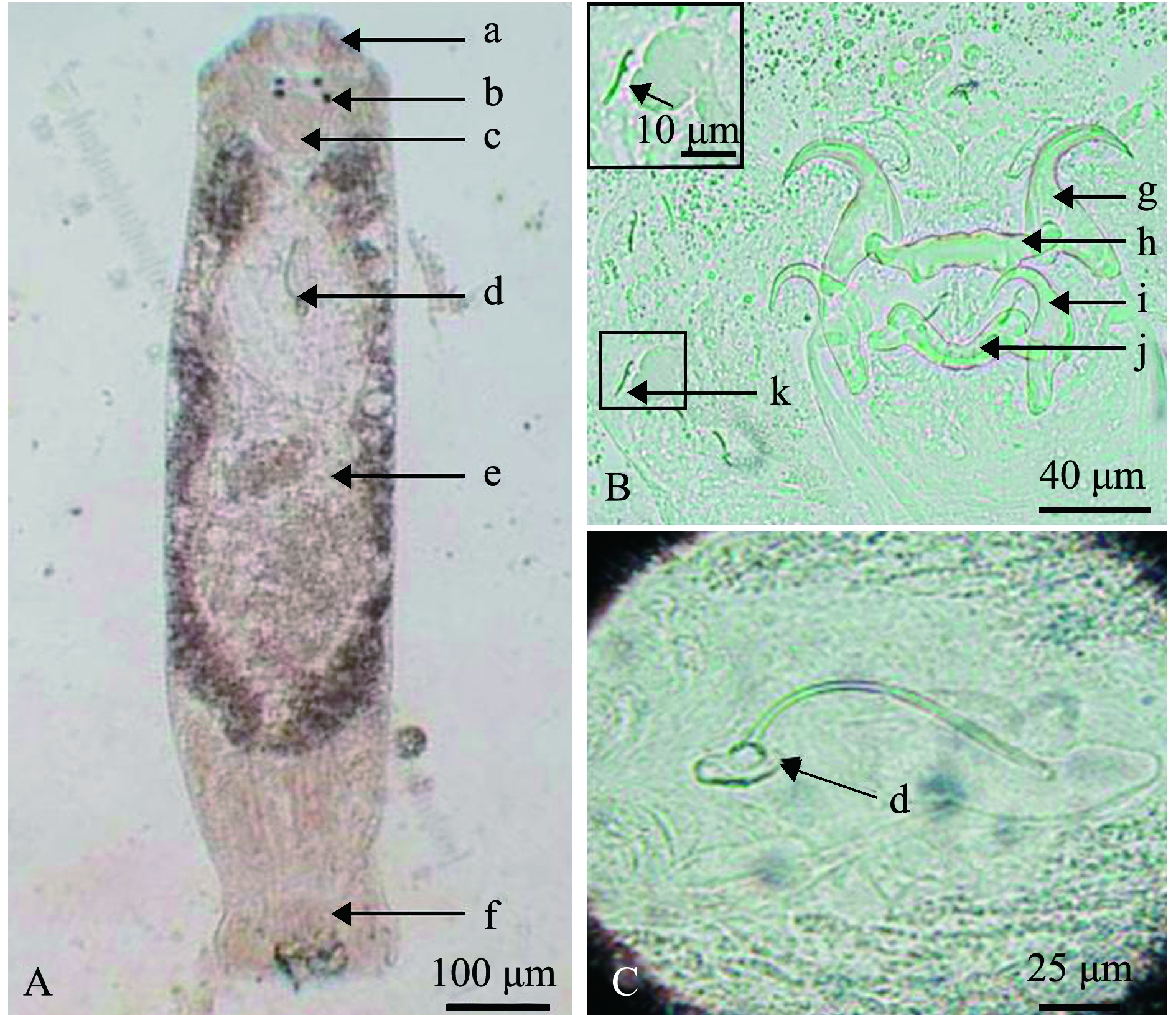
A—虫体整体图;B—后吸器几丁质结构;C—交接器。a—头器;b—眼点;c—咽;d—交接器;e—卵黄腺;f—后吸器;g—腹中央大钩;h—腹联结片;i—背中央大钩;j—背联结片;k—边缘小钩。A—dorsal view of a whole worm;B—chitin structure of haptor;C—copulatory complex.a—head organ;b—eyespot;c—pharynx;d—copulatory complex;e—vitelline gland;f—haptor;g—ventral anchor;h—ventral bar;i—dorsal anchor;j—dorsal bar;k—hooklet.
图2 双裂海盘虫的显微观察
Fig.2 Microscopic observation of parasite Haliotrema bilobatus
故认为二者是同一虫种,属于双裂海盘虫H.bilobatus,而双斑东方鲀为其宿主新记录。
2.5 虫体18S rDNA序列分析
测得虫体18S rDNA序列长度为1 282 bp,上传序列至GenBank数据库(编号ZL-2019,登录号MN309840.1),通过BLAST比对,结果显示,编号ZL-2019的虫体18S rDNA序列与数据库中栉齿刺尾鲷海盘虫H.ctenochaeti (登录号EU836220.1)、丝蝴蝶鱼海盘虫H.aurigae (登录号AY820610.1)和大棘海盘虫H.macracantha(登录号EU836229.1)等基因序列相似,一致性达97.68%~98.30%,这表明该虫体为海盘虫虫种。
选取18S rDNA序列相似度高的海盘虫虫种绘制系统发育树,结果显示,双裂海盘虫单为独立分支,然后与丝蝴蝶鱼海盘虫、大棘海盘虫等聚为一支,这表明与他们亲缘关系较近(图3)。
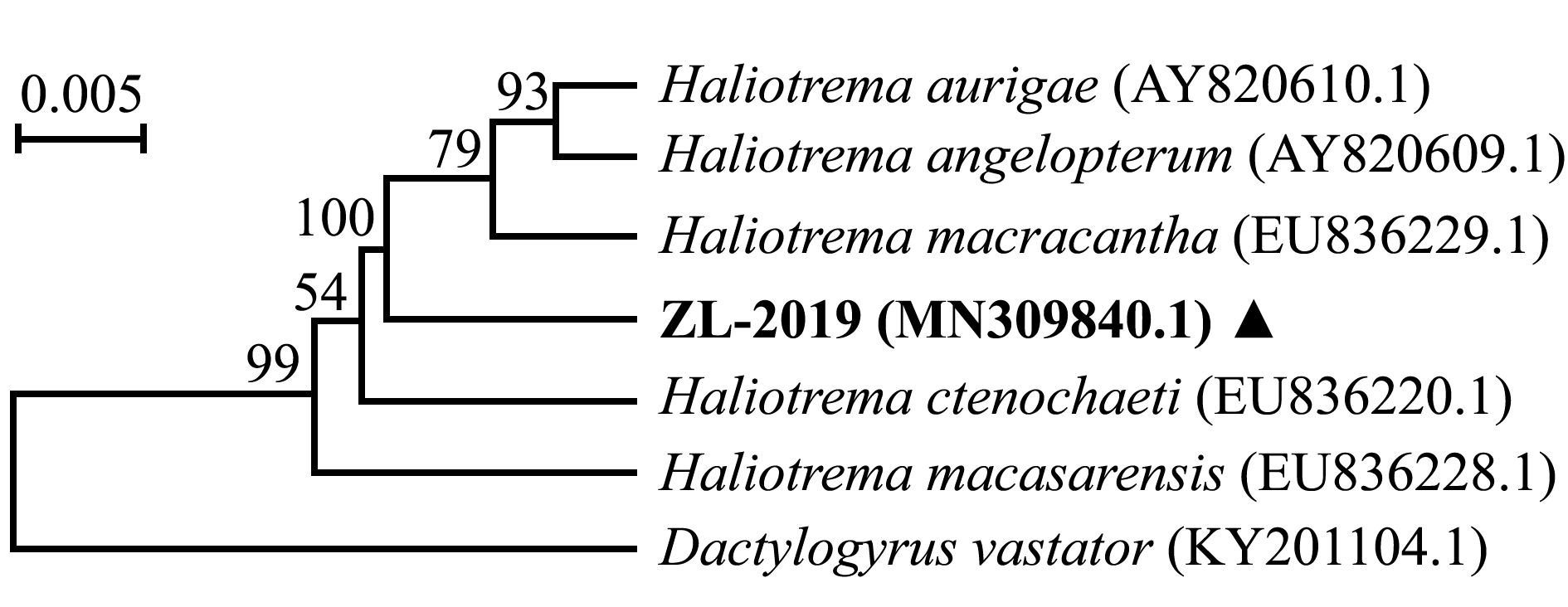
图3 基于18S rDNA序列构建的海盘虫系统发育树
Fig.3 Phylogenetic tree of Haliotrema sp.based on the gene sequence of 18S rDNA
2.6 虫体28S rDNA序列分析
测得虫体28S rDNA(C1~D2区)核酸片段长度为886 bp,上传序列至GenBank数据库(编号ZL-2019,登录号MN310381.1),通过BLAST比对,结果显示,编号ZL-2019的虫体28S rDNA序列与数据库中镰茎海盘虫H.sicklocirrus (登录号KJ571015.1)基因序列最相似,但一致性仅为90.28%,而与东沙海盘虫H.dongshaense (登录号KJ571014.1)、丝蝴蝶鱼海盘虫H.aurigae (登录号EU836198.1)一致性分别为88.49%和88.26%,为基因数据库未登记海盘虫属虫种。
选取相似或相近的12种单殖吸虫28S rDNA序列构建系统发育树(图4),结果显示,虫体ZL-2019首先单为独立分支,然后与镰茎海盘虫、东沙海盘虫、丝蝴蝶鱼海盘虫等海盘虫聚为一大支,这表明虫体ZL-2019与他们的亲缘关系相对较近;而大钩海盘虫H.magnihamus、大弯管海盘虫H.grossecurvitubus、驼背鲈海盘虫H.cromileptis等海盘虫聚为另一大支,这表明虫体ZL-2019与他们的亲缘关系较远。
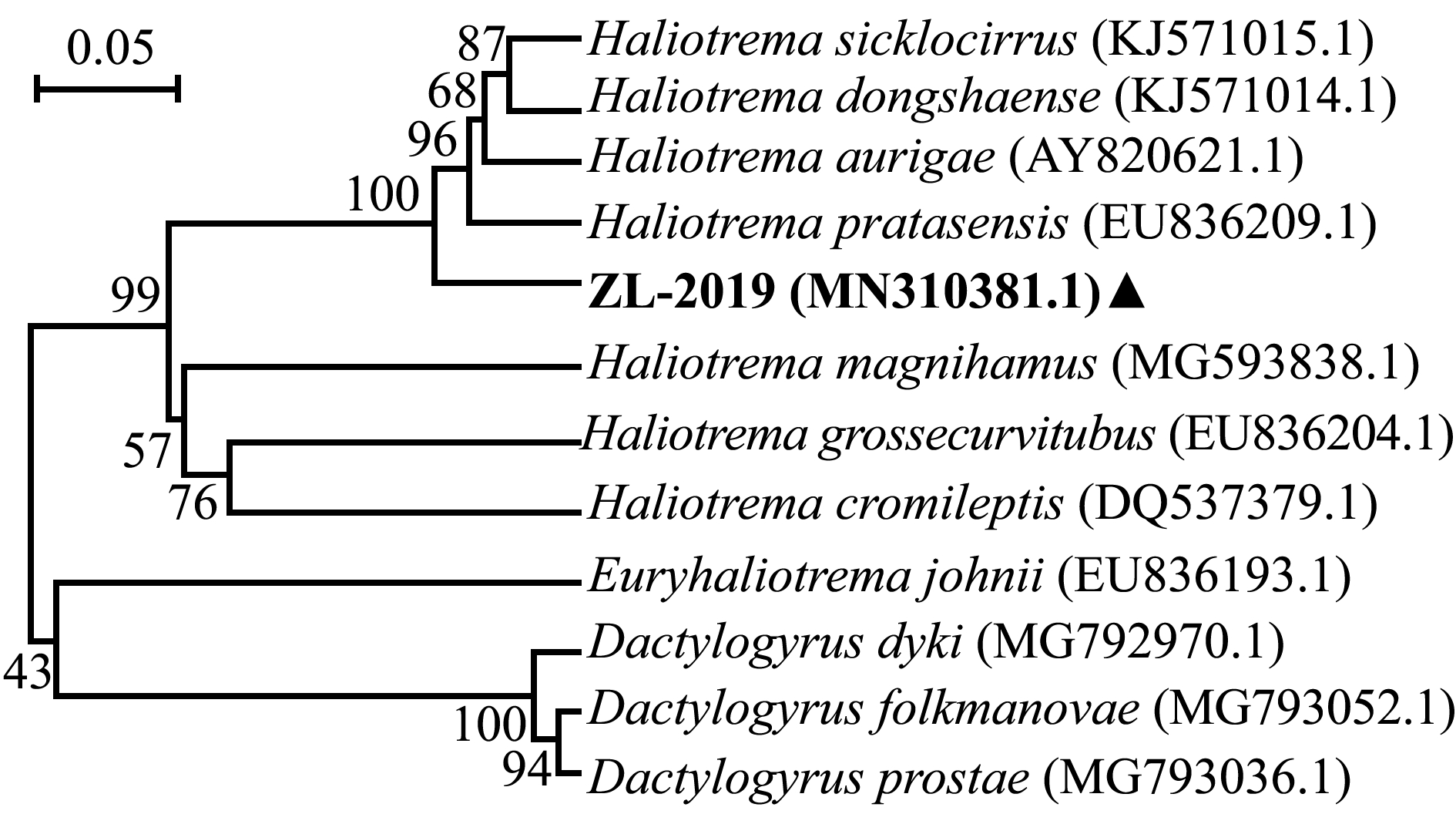
图4 基于28S rDNA序列(C1~D2区)构建的海盘虫及其他外类群系统发育树
Fig.4 Phylogenetic tree of Haliotrema sp.and out groups based on the gene sequence of 28S rDNA (C1-D2 dormain)
2.7 鳃组织病理学观察
双斑东方鲀发生海盘虫病,病变损害最严重的器官是鳃。通过病鱼鳃组织病理学观察,发现海盘虫虫体依托中央大钩或边缘小钩寄生于鳃丝基部(图5A),或鳃丝中部(图5B),或次级鳃丝组织软骨上(图5C),并机械挤压导致次级鳃丝变形,鳃小片倾斜排列且扭曲,破坏了鳃丝组织完整性;寄生周围区域的初级鳃丝上皮组织出现增生或肿胀,甚至造成有的上皮细胞脱落,引起鳃丝局部损伤(图5A、B)。感染严重时,虫体寄生区域鳃小片上皮细胞坏死,鳃小片不完整或崩解,鳃小片毛细血管断裂、出血,大量黏液浸润鳃丝,鳃丝间弥散解离细胞和黏液(图5C~E);而与虫体寄生处相对侧的鳃上皮组织增生、增厚严重(图5E)。

A—感染虫体寄生于鳃丝基部;B—感染虫体寄生鳃丝中部;C—感染虫体寄生于鳃丝软骨;D、E—虫体严重感染时,鳃病变严重;F—鳃感染海盘虫和车轮虫。a—虫体;b—中央大钩;c—鳃小片;d—上皮细胞;e—鳃丝软骨;f—黏液;g—红细胞;h—毛细血管;i—车轮虫。A—parasites colonizing on the base of gill filaments;B—parasites colonizing on the middle of gill filaments;C—parasites colonizing on the gill filament cartilage;D and E—the pathological changes in the gill after severe infection with Haliotrema bilobatus;F—gills infected with Haliotrema and Trichodina.a—worm;b—anchor;c—gill lamella;d—epithelial cell;e—gill filament cartilage;f—mucus;g—red blood cell;h—capillary;i—Trichodina.
图5 病鱼鳃组织病理切片图
Fig.5 Histological sections (H.E)of gills of the diseased fish
3 讨论
3.1 双斑东方鲀海盘虫病病原鉴定
海盘虫种类繁多,形态相近,目前种类鉴定和分类主要依据虫体后吸器和交接器的几丁质结构 [4-10]。本研究中,根据现有虫体形态学证据和几丁质结构特征将双斑东方鲀海盘虫病病原鉴定为双裂海盘虫。双裂海盘虫首次被描述记录于1953年[18],于1970年正式确认为H.bilobatus,其宿主记录为斑点鸡笼鲳Drepane punctata[19],国内学者于1993年发现该虫体,并命名为双裂海盘虫[1],袁少颖[16]于2006年发现星点东方鲀T.niphoble为其宿主记录。本研究中则首次确认双裂海盘虫能引起养殖的双斑东方鲀发病,且双斑东方鲀为其新的宿主记录。生产过程中,作者还发现同一池塘养殖的菊黄东方鲀T.flavidus也会感染双裂海盘虫病,这表明该虫对东方鲀属鱼类具有高度的宿主特异性。
因单殖吸虫种间几丁质结构细微、差异小,常因试验方法、观察角度(显微)及测量误差等因素造成研究者描述形态有差异[20],且宿主、地理分布和生活水温等变化也可造成同一虫种形态结构变异[21],故依赖形态学进行种类鉴别比较烦琐、困难,单纯依靠几丁质形态结构特征鉴定阐明虫种间亲缘关系也有一定局限性[22]。近年来,分子生物学技术广泛应用于单殖吸虫分类鉴定和系统发育研究[23-26],包括利用18S rDNA、28S rDNA和rDNA-ITS等靶基因序列分析,该技术为海盘虫属种类鉴别、种间亲缘关系和系统发育等研究提供有效补充途径[27]。为了对双斑东方鲀海盘虫病病原的了解更加全面,本研究中在形态学鉴别基础上,选用单殖吸虫界常用的核糖体18S rDNA和28S rDNA作为分子标记,对病原进行分子生物学测定,结果表明,双裂海盘虫为NCBI基因数据库未登记海盘虫属虫种,其18S rDNA序列与栉齿刺尾鲷海盘虫、丝蝴蝶鱼海盘虫等虫体相似,一致性达97.68%~98.30%;而28S rDNA序列与镰茎海盘虫最相似,但有9.72%的差异,与镰茎海盘虫、东沙海盘虫和丝蝴蝶鱼海盘虫等亲缘关系较近。
3.2 双斑东方鲀海盘虫病的发生
海盘虫病是鱼类养殖生产上主要致死性病害之一,主要危害是大量虫体寄生于鳃上,造成养殖鱼类鳃黏液增多,呼吸困难,食欲减退而死亡,或导致其他病原(包括车轮虫(图5F)、刺激隐核虫、瓣体虫等)继发感染从而造成死亡。鳃是鱼类最重要的呼吸器官,是鱼体与外界气体交换的场所,具有参与渗透调节和氯化物排泄等功能[28]。从患病鱼鳃组织病理学分析,双裂海盘虫大量感染导致双斑东方鲀病鱼鳃受损严重,其损伤结果为虫体用后吸器固着于鳃并做尺蠖式移动,造成鳃丝机械损伤,致使上皮组织增生,大量黏液浸润,甚至引起鳃病变或出血,阻碍鳃组织与外界环境气体交换,影响了鳃渗透调节、排泄等功能;重度感染,引起鳃组织坏死、崩解,导致病鱼呼吸困难,造成鱼体缺氧死亡。该研究结果与李立伟等[13]报道的花鲈逆转指环虫病病理学、李海燕等[29]报道的叉尾斗鱼关睾虫病鳃组织病理学、苏翠莲[30]报道的黄鳍鲷鳞盘虫病鳃组织病理学中多钩类单殖吸虫病鳃病理的研究结果基本一致。
不同生长发育阶段的双斑东方鲀均可发生海盘虫病,但海盘虫感染强度不同,幼鱼阶段中度感染即可严重发病,成鱼阶段则需重度感染才能严重发病,这可能与不同生长发育阶段宿主鱼耐受程度及鳃面积大小有关。有研究报道[31-32]认为,单殖吸虫平均感染强度与宿主鱼体长呈显著正相关,而双裂海盘虫感染强度是否与双斑东方鲀体长呈正相关还有待进一步考证。郝翠兰等[33]认为,单殖吸虫对宿主鱼不同鳃片具有明显选择性,而本研究中发现双裂海盘虫对双斑东方鲀左、右鳃腔的分布无选择性,但对左、右鳃腔的居中鳃片有寄生偏好。作者在2016—2019年常规调查期间,福建漳浦东坂、云霄前江等东方鲀池塘养殖主产区在春末夏初和秋季也时有发生由双裂海盘虫感染引起双斑东方鲀海盘虫病,这表明双裂海盘虫感染是池塘养殖双斑东方鲀发生海盘虫病的主要病因。刘君[17]研究发现,黑鲷海盘虫可大量寄生于海区网箱养殖的双斑东方鲀鳃上,其交接器呈“S”状,背联结片呈倒“V”形,腹联结片呈“一”字形,与双裂海盘虫差异明显,联结片和中央大钩度量均比双裂海盘虫小(表2)。但本研究中在池塘养殖双斑东方鲀过程中未发现有黑鲷海盘虫感染,猜测发生海盘虫病病原种类可能与东方鲀养殖环境相关。目前生产上可用渔用敌百虫或甲苯咪唑等抗单殖吸虫药物(敏感鱼类慎用)对海水养殖鱼类海盘虫病进行有效防治,同时,还需要伴饲投喂抗生素以防止病鱼发生继发性细菌感染。
国内外对于海水养殖鱼类海盘虫病的流行病学、病原鉴定和组织病理学的研究较少,所以本研究中开展具有一定的实践意义,该研究可为海水养殖鱼类海盘虫病的病原鉴定和防控提供技术参考依据。
4 结论
1)本研究中确认了双裂海盘虫为福建池塘养殖双斑东方鲀海盘虫病的感染病原,这是双裂海盘虫引起双斑东方鲀海盘虫病在国内的首次报道。该病在春末夏初和秋季易发。
2)从鳃组织病理学分析,双裂海盘虫大量感染导致发生海盘虫病的双斑东方鲀病鱼鳃受损严重。重度感染会引起鳃组织坏死、崩解,导致病鱼呼吸困难而死亡。
[1] 张剑英,杨廷宝,刘琳,等.中国海洋鱼类单殖吸虫[M].北京:中国农业出版社,2001:81-125.
ZHANG J Y,YANG T B,LIU L,et al.Monogenea of Chinese marine fishes[M].Beijing:China Agriculture Press,2001:81-125.(in Chinese)
[2] BOEGER W A,KRITSKY D C.Phylogeny and a revised classification of the Monogenoidea Bychowsky,1937 (Platyhelminthes)[J].Systematic Parasitology,1993,26:1-32.
[3] KRITSKY D C,STEPHENS F.Haliotrema abaddon sp.(Monogenoidea:Dactylogyridae)from the gills of wild and maricultured West Australian dhufish Glaucosoma hebraicum (Teleostei:Glaucosomatidae),in Australia[J].Journal of Parasitology,2001,87(4):749-754.
[4] 李海燕.鱼类海盘虫属两新种(单殖亚纲,锚首虫科)[J].华南师范大学学报(自然科学版),2005,37(3):27-31.
LI H Y.Description of two new species Haliotrema (Monogenea,Ancyrocephalidae)of fishes[J].Journal of South China Normal University (Natural Science Edition),2005,37(3):27-31.(in Chinese)
[5] 潘骏.海南岛海水鱼类单殖吸虫研究:Ⅳ.海盘虫属两新种[J].热带海洋学报,2000,19(2):33-38.
PAN J.Monogenoidea of marine fishes from Hainan Island Ⅳ.Two new species of Haliotrema from South China Sea[J].Journal of Tropical Oceanography,2000,19(2):33-38.(in Chinese)
[6] WANG W B,LIU L,ZHOU Y X.Description of four new species of Haliotrema Johnston &Tiegs (Monogenea,Ancyrocephalidae)[J].Acta Zootaxonomica Sinica,2003,28(1):24-29.
[7] 李海燕,陈颖洁.广东海水鱼类寄生海盘虫属两新种的记述[J].海洋科学,2005,29(5):50-53.
LI H Y,CHENY J.Description of two new species of the genus Haliotrema from marine fishes in Guangdong[J].Marine Sciences.2005,29(5):50-53.(in Chinese)
[8] 李海燕,余炼文,严旭章,等.锚首虫科(单殖亚纲)两种海盘虫的形态研究[J].广州大学学报(自然科学版),2005,4(3):237-239.
LI H Y,YU L W,YAN X H,et al.Morphological study of two species of Haliotrema Johnston and Tiegs of the family Ancyrocephalidae (Monogenea)[J].Journal of Guangzhou University (Natural Science Edition),2005,4(3):237-239.(in Chinese)
[9] 李海燕,颜心茂.两种海盘虫(包括一新种)及一种宽海盘虫的记述[J].广西师范大学学报(自然科学版),2007,25(3):97-100.
LI H Y,YAN X M.Description of two species (including one new species)of genus Haliotrema and one species of genus Euryhaliotrema[J].Journal of Guangxi Normal University (Natural Science Edition),2007,25(3):97-100.(in Chinese)
[10] WANG W B.A new species and two new records of Haliotrema (Monogenea,Ancyrocephalidae)from marine fishes in Hainan Island,China[J].Acta Zootaxonomica Sinica,2007,32(1):17-20.
[11] 张剑英,邱兆祉,丁雪娟,等.鱼类寄生虫与寄生虫病[M].北京:科学出版社,1999:162-164.
ZHANG J Y,QIU Z Z,DING X J,et al.Parasites and parasitic diseases of fishes[M].Beijing:Science Press,1999:162-164.(in Chinese)
[12] 尤颖哲.双斑东方鲀精子冷冻保存方法探究[J].渔业现代化,2017,44(1):35-39.
YOU Y Z.Research on cryopreservation of Takifugu bimaculatus spermatozoa[J].Fishery Modernization,2017,44(1):35-39.(in Chinese)
[13] 李立伟,杨文川.花鲈逆转指环虫病病理学研究[J].厦门大学学报(自然科学版),2002,41(2):234-238.
LI L W,YANG W C.Microhabitats and histopathology of Dactylogyrus inversus (Monogenea:Dactylogyridae)infection in perch,Lateolabra japonicus[J].Journal of Xiamen University (Natural Science Edition),2002,41(2):234-238.(in Chinese)
[14] LITTLEWOOD D T J,OLSON P D.Small subunit rDNA and the Platyhelminthes:signal,noise,conflict and compromise:LITTLEwood D T J and BRAY R A (eds).Interrelationships of the Platyhelminthes[M].London:Taylor and Francis,2001:262-278.
[15] HASSOUNA N,MICHOT B,BACHELLERIE J P.The complete nucleotide sequence of mouse 28S rRNA gene.Implications for the process of size increase of the large subunit rRNA in higher eukaryotes[J].Nucleic Acids Research,1984,12(8):3563-3583.
[16] 袁少颖.南海(北部)海洋鱼类部分单殖吸虫区系研究[D].广州:中山大学,2006:14-31.
YUAN S Y.Study on fauna of some monogenea from South China Sea[D].Guangzhou:Sun Yat-sen University,2006:14-31.(in Chinese)
[17] 刘君.厦门海域野生及养殖鱼类单殖吸虫调查研究[D].厦门:厦门大学,2007:39-42.
LIU J.Studies on monogeneans of wild and cultured fishes in Xiamen sea area[D].Xiamen:Xiamen University,2007:39-42.(in Chinese)
[18] YAMAGUTI S.Parasitic worms mainly form Celebes Part 2 Monogenetic trematodes of fishes[J].Acta Medicinae Okayama,1953,8:203-256.
[19] BIKHOVSKI B E,NAGIBINA L F.On the new and little known species of the genus Haliotrema Johnston &Tiegs,1922 (Monoganoidea)[J].Zoologicheskii Zhumal,1970,49(12):1789-1801.
[20] 丁雪娟,廖翔华,李安兴,等.单殖吸虫分子系统学研究进展[J].寄生虫与医学昆虫学报,2005,12(2):112-118.
DING X J,LIAO X H,LI A X,et al.Advance in the studies of molecular systematics of Monogenea[J].Acta Parasitologica et Medica Entomologica Sinica,2005,12(2):112-118.(in Chinese)
[21] ROKICKA M,LUMME J,ZIETARA M S.Identification of Gyrodactylus ectoparasites in Polish salmonid farms by PCR-RFLP of the nuclear ITS segment of ribosomal DNA (Monogenea,Gyrodactylidae)[J].Acta Parasitologica,2007,52(3):185-195.(in Chinese)
[22] 丁雪娟.多钩类单殖吸虫的分子系统学研究[D].广州:中山大学,2003:1-9.
DING X J.Studies on the molecular systematics of Polyonchoinea Monogenea[D].Guangzhou:Sun Yat-sen University,2003:1-9.(in Chinese)
[23] 温卫栋,汪博良,贾舒安,等.额尔齐斯河银鲫寄生指环虫18S rDNA序列测定及系统发育研究[J].水生态学杂志,2015,36(3):95-100.
WEN W D,WANG B L,JIA S A,et al.18S rDNA sequence determination and phylogenetic study of parasitic Dactylogyrus in Carassius auratus gibelio in Ergis River[J].Journal of Hydroecology,2015,36(3):95-100.(in Chinese)
[24] 赵江山,焦丽,郝翠兰,等.额尔齐斯河北方四钩虫的28S和ITS1 rDNA序列测定及其系统发育分析[J].中国兽医科学,2013,43(7):668-671.
ZHAO J S,JIAO L,HAO C L,et al.Sequencing and phylogenetic analysis of Tetraonchus borealis inferred from 28 S and ITS1 rDNA sequences in Ergis River[J].Chinese Veterinary Science,2013,43(7):668-671.(in Chinese)
[25] 李冉冉,李文祥,吴旭东,等.金鱼寄生三代虫的形态学及基于rDNA ITS序列的分子鉴定[J].水生生物学报,2014,38(5):903-909.
LI R R,LI W X,WU X D,et al.Identification of Gyrodactylus species in goldfish (Carassius auratus)through morphological study and the analysis of the rDNA ITS sequence[J].Acta Hydrobiologica Sinica,2014,38(5):903-909.(in Chinese)
[26] 谢志胜,马江霞,杨昆明,等.图丽鱼寄生破坏古氏虫的形态描述及系统发育[J].渔业科学进展,2019,40(3):87-93.
XIE Z H,MA J X,YANG K M,et al.Morphological description and molecular phylogeny of the Gussevia asota parasite on Astronotus ocellatus[J].Progress in Fishery Sciences,2019,40(3):87-93.(in Chinese)
[27] 孙媛.南海北部鱼类单殖吸虫区系及分子系统学研究[D].广州:中山大学,2007:109-126.
SUN Y.Studies on the fauna and molecular phylogeny of some monogeneans from the fishes of the north part of South China Sea[D].Guangzhou:Sun Yat-sen University,2007:109-126.(in Chinese)
[28] 林浩然.鱼类生理学[M].广州:广东高等教育出版社,1999:66-124.
LIN H R.Fish physiology[M].Guangzhou:Guangdong Higher Education Press,1999:66-124.(in Chinese)
[29] 李海燕,香咏瑜.叉尾斗鱼关睾虫(单殖亚纲)病的鳃组织病理学研究[J].中国水产科学,2006,13(5):829-833.
LI H Y,XIANG Y Y.Gill histopathology of Heteronchleidus (Monogenea:Ancyrocephalidae)infection in Macropodus opercularis[J].Journal of Fishery Sciences of China,2006,13(5):829-833.(in Chinese)
[30] 苏翠莲.厦门海域鱼类单殖吸虫物种资源、病理学及分子系统学研究[D].厦门:厦门大学,2009:54-60.
SU C L.Studies on species diversity,histopathology and molecular phylogenetics of fish monogeneans in Xiamen sea area[D].Xiamen:Xiamen University,2009:54-60.(in Chinese)
[31] LO C M,MORAND S,GALZIN R.Parasite diversity host age and size relationship in three coral-reef fishes from French Polynesia[J].International Journal for Parasitology,1998,28(11):1695-1708.
[32] 曾碧健,黄建荣,杨廷宝.大亚湾海域石斑鱼(Epinephelus spp.)寄生单殖吸虫群落结构研究[J].海洋与湖沼,2017,48(2):406-414.
ZENG B J,HUANG J R,YANG T B.The community structure of monogeneans from Epinephelus spp.in Daya Bay,South China Sea[J].Oceanologia et Limnologia Sinica,2017,48(2):406-414.(in Chinese)
[33] 郝翠兰,岳城,殷建国,等.额尔齐斯河高体雅罗鱼指环虫的空间分布[J].干旱区研究 2015,32(4):766-771.
HAO C L,YUE C,YIN J G,et al.Spatial distribution of Dactylogyrus on the gills of Leuciscus idus in Ergis River,China[J].Arid Land Research,2015,32(4):766-771.(in Chinese)