恩诺沙星(enrofloxacin, ENR)是第三代喹诺酮类抗菌药物,也是第一个动物专用的抗生素[1]。因其对大多数革兰氏阴性菌、革兰氏阳性菌等均有抑制作用,且具有毒副作用小、抗菌力强、体内分布广等特点,《渔药使用规范》(SC/T 1132—2016)将其列为水产养殖用处方药之一[2],并广泛应用于水产养殖病害防控中[3]。ENR在动物体内会发生脱乙基反应,生成具有活性的代谢产物环丙沙星(ciprofloxacin, CIP)。CIP药理作用类似ENR,因CIP存在明显种属差异,容易产生耐药性且毒副作用强,《无公害食品渔用药物使用准则》(NY 5071—2002)已将其列为禁用渔药。《食品安全国家标准食品中兽药最大残留限量》(GB31650—2019)将水产动物中ENR及其代谢产物CIP的总残留限量定为100 μg/kg[4]。
虹鳟Oncorhynchus mykiss是全世界养殖最多的鱼类之一[5],也是中国重要水产养殖品种[6]。嗜水气单胞菌Aeromonas hydrophila、鲁氏耶尔森氏菌Yersinia ruckeri、恶臭假单胞菌Pseudomonas putida和荧光假单胞菌P.fluorescens等革兰氏阴性菌感染虹鳟会导致败血症、肠口红等疾病[7],对虹鳟养殖业造成了巨大经济损失[5,8]。ENR被普遍用于虹鳟等鱼类养殖生产中的病害防控和治疗,但因缺乏代谢和残留规律研究,加之随意用药现象普遍存在,导致养殖产品药物残留超标事件时有发生[9-10]。药物不合理使用,不仅影响水产品质量安全,还会产生耐药性,并对生态环境可持续发展造成影响[11-12]。目前,对罗非鱼Oreochromis niloticus[13]、鲤Cyprinus carpio[14-15]、克氏原螯虾Procambarus clarkii[16]、大黄鱼Larimichthys crocea[17]、杂交鲟Acipenser schrenckii♂×Huso dauricus♀[18]、中华绒螯蟹Eriocheir sinensis[19]、日本鳗鲡Anguilla japonica[20]和鲫Carassius auratu gibelio [21-22]等水产动物体内ENR的代谢特征已开展了部分研究,国外针对大西洋鲑和虹鳟苗种也开展了低剂量药浴和注射研究[23-26],但虹鳟养殖生产中不同给药剂量的代谢特征比较研究尚未见报道。本研究中,探究了不同给药剂量下ENR及其主要代谢产物CIP在虹鳟6个组织中的代谢过程和残留消除规律,并对其药物代谢动力学特征进行比较,旨在为水产养殖中ENR的合理使用及休药期制定提供科学依据。
1 材料与方法
1.1 材料
试验用虹鳟购自河北省涞源县某养殖场,平均体质量为(70.48±5.41) g,经确认,该养殖场未使用过喹诺酮类药物。试验在北京市水产科学研究所小汤山冷水鱼养殖基地进行。试验前将虹鳟暂养10 d,水温为(15±2) ℃,水体连续曝气且循环过滤,溶解氧质量浓度为6.5 mg/L以上,3 d换水一次,每次换1/2养殖水体。按照鱼体质量2%每日早、中、晚各投喂饲料一次,及时排出残饵和污物,试验前3 d停止投喂。
仪器:Thermo TSQ高效液相色谱-串联质谱仪、HCB 1002型电子天平、AB265-S型分析天平、H-2050R型离心机、H/T16MM型离心机、N-EVAP1/2型氮吹仪和MS3bsic型涡旋振荡器。
药品与试剂:恩诺沙星原药购自北京鑫洋水产高新技术有限公司,经检测,纯度为94.6%;恩诺沙星标准品(纯度99.5%)和环丙沙星标准品(纯度95.0%)购自德国Dr.Ehrenstorfer GmbH公司;氘代恩诺沙星标准品(纯度99.8%)和氘代环丙沙星标准品(纯度99.8%)购自德国Witega公司。甲醇、乙腈、甲酸为色谱纯(德国Merck公司),醋酸铵为色谱纯(美国Fluka公司),无水硫酸钠和正己烷为分析纯(北京化工厂)。
1.2 方法
1.2.1 给药方式 《新编渔药手册》[27]对于ENR在鱼类细菌性疾病中的指导用量为20~50 mg/kg鱼体质量,参照上述推荐剂量,本研究中分别选择20 mg/kg作为低剂量和50 mg/kg作为高剂量,进行虹鳟单次混饲口灌后的代谢残留比较研究。
试验共挑选上述暂养健康虹鳟257尾,分为两组,其中,低剂量组126尾,随机分为21个亚组,每组6尾;高剂量组132尾虹鳟,随机分为22个亚组,每组6尾。采用混饲口灌给药法给药,无回吐者放回养殖缸中进行试验研究,试验期间虹鳟养殖管理同暂养时期。
1.2.2 样品采集 口灌药物后,低剂量组分别于给药后0.25、0.5、1、2、4、8、12、24、48、72、96、144、192、240、312、384、456、528、576、768、888 h共21个点采样,每个采样点采集6尾鱼,分别采集其血液、肝脏、肾脏、肌肉、皮肤、剩余其他组织(除上述5种组织外全部其他组织混合物)6种样品。高剂量组除增加1 008 h采样点外,其他采样点与低剂量组一致。使用经3‰肝素钠(质量分数,下同)润洗的注射器从鱼尾部采集1 mL血样,置于离心管(经3‰肝素钠润洗),混合均匀后以8 000 r/min离心10 min,取上层即为血浆样品。肌肉、肝脏、皮肤、剩余其他组织各采集约10 g,肝脏和肾脏采集全部组织。全部样品放入-80 ℃超低温冰箱中冷冻待测。另选择6尾未给药虹鳟,采集对应6类组织样品作为空白对照。
1.2.3 样品前处理 样品处理及药物浓度测定参照《水产品中17种磺胺类及15种喹诺酮类药物残留量的测定液相色谱-串联质谱法》(农业农村部1077号公告-1—2008)优化后进行。
1.2.4 色谱、质谱条件 色谱柱为Hypersil GOLD C18(2.1 mm×150 mm,5 μm),以A(0.1%甲酸溶液,含5 mmol/L醋酸铵)和B(乙腈)为流动相,二者体积比为88∶12进行梯度洗脱,流速为300 μL/min,进样量为10 μL,室温。
离子源为电喷雾(ESI)离子源,离子化模式为正离子,监测方式为选择反应监测(SRM),电喷雾电压为3 200 V,鞘气为45 units,辅气为15 units,离子源温度为350 ℃,源内碰撞诱导解离电压为10 V。
1.2.5 标准曲线制备 配制质量浓度为0.01、0.02、0.05、0.10、0.20、0.50、1.00、2.00 μg/mL的ENR和CIP混合标准工作液,供液相色谱-串联质谱仪测定,采用内标法定量。以3倍基线噪音药物的浓度为最低检测限。
1.2.6 回收率、精密度测定 采用加标回收法测定。分别取虹鳟空白对照组血浆1.0 mL及肌肉、皮肤、肝脏、肾脏和剩余组织1.0 g,分别加入质量浓度为50、100、200 μg/L的混合标准工作液,按照“1.2.3节”方法处理样品,每个浓度设3个平行。将上述3个浓度的同一样品于1 d内分别重复进样5次并分5 d测定,计算3个浓度水平响应值峰面积的变异系数(CV)。
1.3 数据处理
采用GraphPad Prism 8.0软件计算时间浓度曲线,采用DAS 2.0软件计算ENR和CIP药代动力学参数。
2 结果与分析
2.1 分析方法验证
2.1.1 恩诺沙星和环丙沙星的标准曲线 ENR的标准曲线方程为
Y=-0.321 1+0.069 6X,R2 =0.999 9;
CIP的标准曲线方程为
Y=0.091 9+0.024 1X,R2 =0.999 9。
对5种空白对照组织的基线噪音值取平均值,求得该方法中ENR和CIP的检测限均为1 μg/L。
2.1.2 回收率 50、100、200 μg/L(低、中、高)3个质量浓度添加水平在虹鳟6种组织中的回收率结果见表1,ENR的回收率为78.14%~108.80%,CIP的回收率为76.06%~106.04%。
表1 虹鳟6种组织中恩诺沙星和环丙沙星的提取回收率
Tab.1 Recovery rate of ENR and CIP in six tissues of rainbow trout

药物drug质量浓度/(μg·L-1)concentration血浆/%plasma肌肉/%muscle肝脏/%liver肾脏/%kidney剩余组织/%carcass皮肤/%skin恩诺沙星ENR50108.8078.1493.96103.9198.92102.5310088.0894.9396.17104.59106.5097.61200102.3695.02102.74104.24102.17100.77环丙沙星CIP5085.3376.0699.08106.04102.0385.0910094.0791.5885.55102.0887.8487.3420093.8584.5696.82104.9498.5093.26
2.1.3 精密度 50、100、200 μg/L(低、中,高)3个质量浓度添加水平的精密度测定结果见表2,其中,两种药物的日内变异系数均小于6%,日间变异系数均小于7%。
表2 恩诺沙星和环丙沙星的日内和日间变异系数
Tab.2 Coefficient of variation(CV) of ENR and CIP in intra-day and inter-day
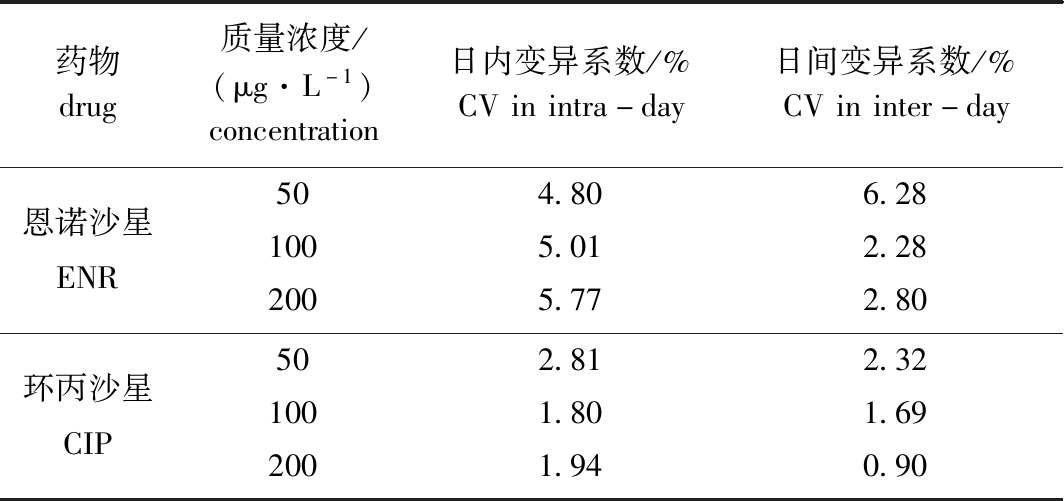
药物drug质量浓度/(μg·L-1)concentration日内变异系数/%CVinintra-day日间变异系数/%CVininter-day恩诺沙星ENR504.806.281005.012.282005.772.80环丙沙星CIP502.812.321001.801.692001.940.90
2.2 两种剂量下ENR和CIP在虹鳟各组织中的药代动力学特征
采用DAS 2.0非房室模型进行分析,获得各个组织和器官的药代动力学参数,两种剂量下ENR和CIP的药代动力学曲线见图1。从图1可见:ENR主要分布于肾脏中,其含量远高于其他5种组织,其次为剩余组织和皮肤;低剂量组ENR在肝脏、肌肉、皮肤、肾脏、剩余组织和血浆中的含量分别在停药后8、24、48、72、4、8 h时达到峰值,分别为13.349、11.164、23.378、114.196、33.762 mg/kg和3.361 mg/L;高剂量组ENR在肝脏、肌肉、皮肤、肾脏、剩余组织和血浆中的含量分别在停药后8、8、48、48、1、8 h时达到峰值,分别为43.302、35.909、53.315、305.098、121.254 mg/kg和8.456 mg/L。
两种剂量下,CIP药物均主要分布于肝脏中,并分别在8、48 h时出现双峰现象;低剂量下,CIP在肝脏、肌肉、皮肤、肾脏、剩余组织和血浆中的含量分别在停药后48、72、72、72、48、48 h时达到峰值,分别为6.372、0.932、0.564、1.440、1.658 mg/kg和0.196 mg/L;高剂量下,CIP在肝脏、肌肉、皮肤、肾脏、剩余组织和血浆中的含量分别在停药后48、48、48、48、48、8 h时达到峰值,分别为8.634、1.840、0.907、3.004、2.442 mg/kg和0.663 mg/L(图1)。
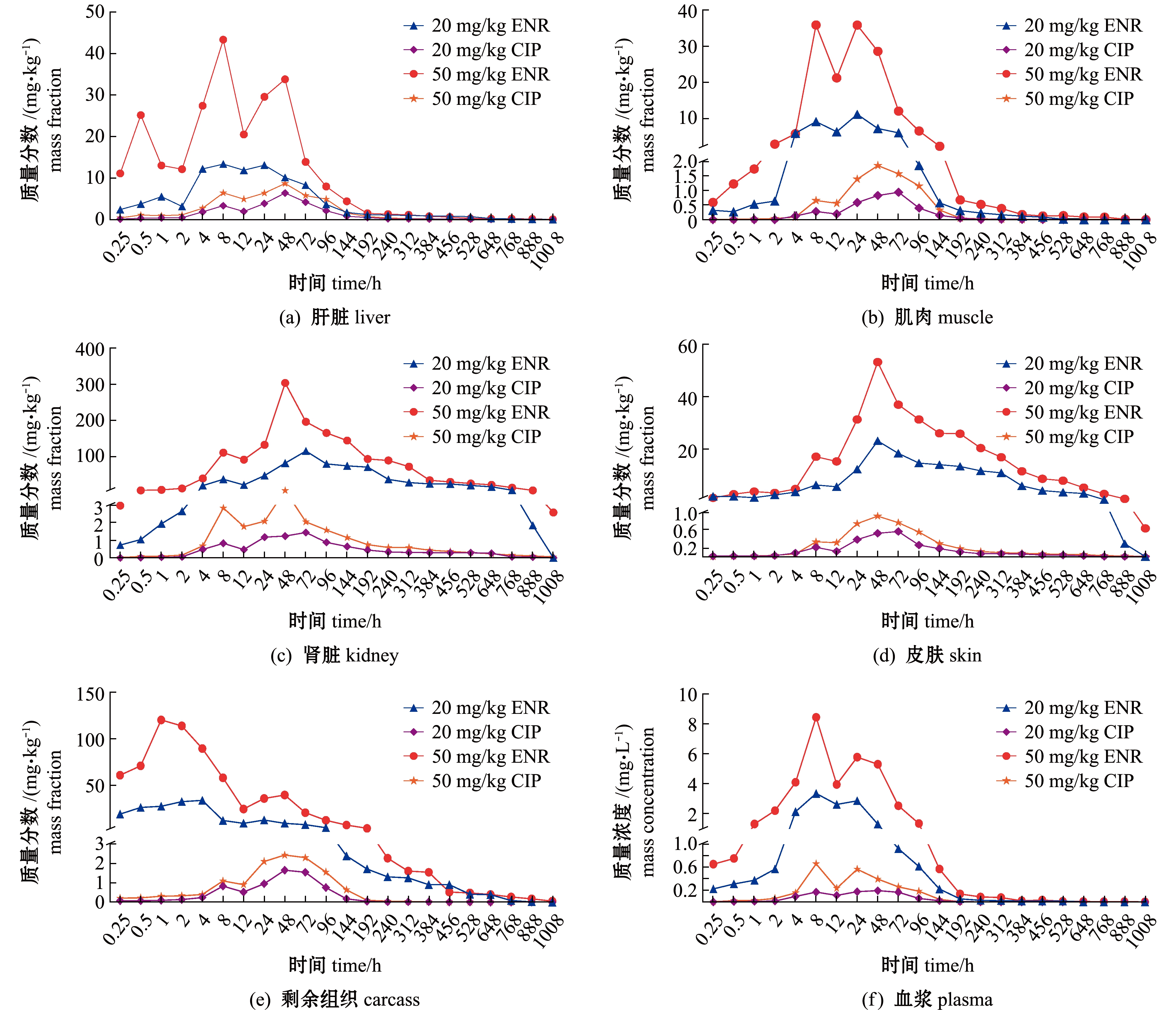
图1 两种剂量下ENR和CIP在虹鳟6种组织中的药时曲线
Fig.1 Concentration-time curves of ENR and CIP in six tissues under two concentrations
两种剂量下,ENR和CIP在各组织中的药代动力学参数如表3~表6所示。低剂量下,ENR在6种组织中Vd为0.121~47.234 L/kg,高剂量下Vd为0.162~49.000 L/kg,可见,随着剂量的增加,ENR分布更加广泛(表3、表4)。低剂量下,CIP在6种组织中Vd为5.341~52.328 L/kg,高剂量下Vd为9.329~87.958 L/kg,可见,随着剂量增加,CIP在各组织中的Vd值逐渐变大(表5、表6)。两种剂量下,ENR和CIP在血浆中的Vd值大于其他5种组织(50 mg/kg CIP血浆除外),可见药物分布最为广泛,渗透量最大(表3~表6)。
表3 20 mg/kg剂量下虹鳟体内ENR的药代动力学参数
Tab.3 Pharmacokinetic parameters of ENR in rainbow trout Oncorhynchus mykiss exposed to ENR at a dose of 20 mg/kg
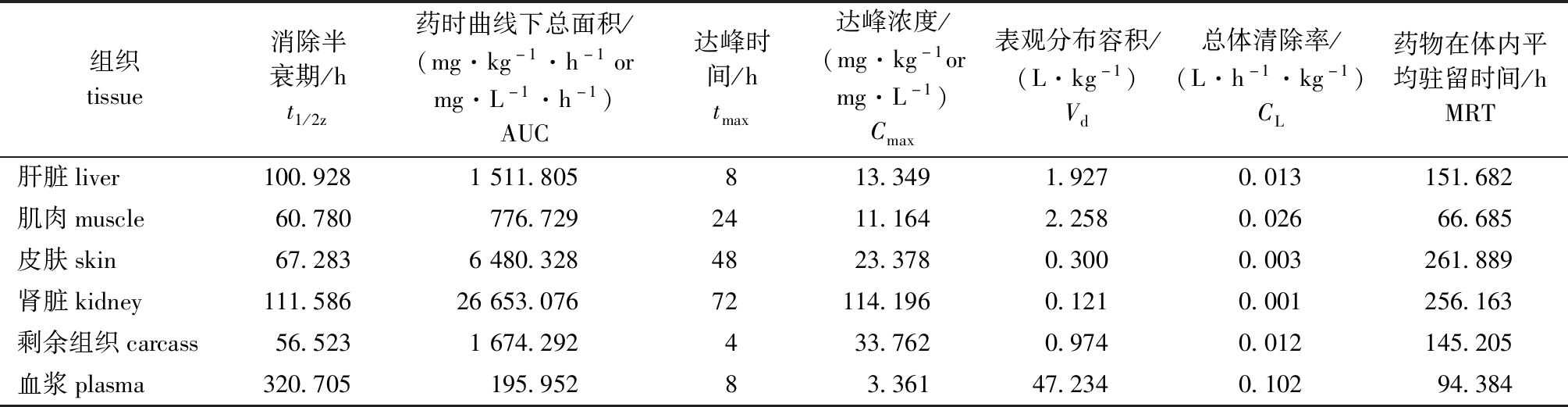
组织tissue消除半衰期/ht1/2z药时曲线下总面积/(mg·kg-1·h-1ormg·L-1·h-1)AUC达峰时间/htmax达峰浓度/(mg·kg-1ormg·L-1)Cmax表观分布容积/(L·kg-1)Vd总体清除率/(L·h-1·kg-1)CL药物在体内平均驻留时间/hMRT肝脏liver100.9281511.805813.3491.9270.013151.682肌肉muscle60.780776.7292411.1642.2580.02666.685皮肤skin67.2836480.3284823.3780.3000.003261.889肾脏kidney111.58626653.07672114.1960.1210.001256.163剩余组织carcass56.5231674.292433.7620.9740.012145.205血浆plasma320.705195.95283.36147.2340.10294.384
表4 50 mg/kg剂量下虹鳟体内ENR的药代动力学参数
Tab.4 Pharmacokinetic parameters of ENR in rainbow trout Oncorhynchus mykiss exposed to ENR at a dose of 50 mg/kg

组织tissue消除半衰期/ht1/2z药时曲线下总面积/(mg·kg-1·h-1ormg·L-1·h-1)AUC达峰时间/htmax达峰浓度/(mg·kg-1ormg·L-1)Cmax表观分布容积/(L·kg-1)Vd总体清除率/(L·h-1·kg-1)CL药物在体内平均驻留时间/hMRT肝脏liver204.1933066.081843.3024.8050.016104.162肌肉muscle115.6392454.126835.9093.4000.02067.671皮肤skin102.40512739.7114853.3150.5800.004269.064肾脏kidney121.85254370.46148305.0980.1620.001230.609剩余组织carcass201.8344614.9321121.2543.1550.011103.512血浆plasma325.593479.42488.45649.0000.10468.574
表5 20 mg/kg剂量下虹鳟体内CIP的药代动力学参数
Tab.5 Pharmacokinetic parameters of CIP in rainbow trout Oncorhynchus mykiss exposed to ENR at a dose of 20 mg/kg
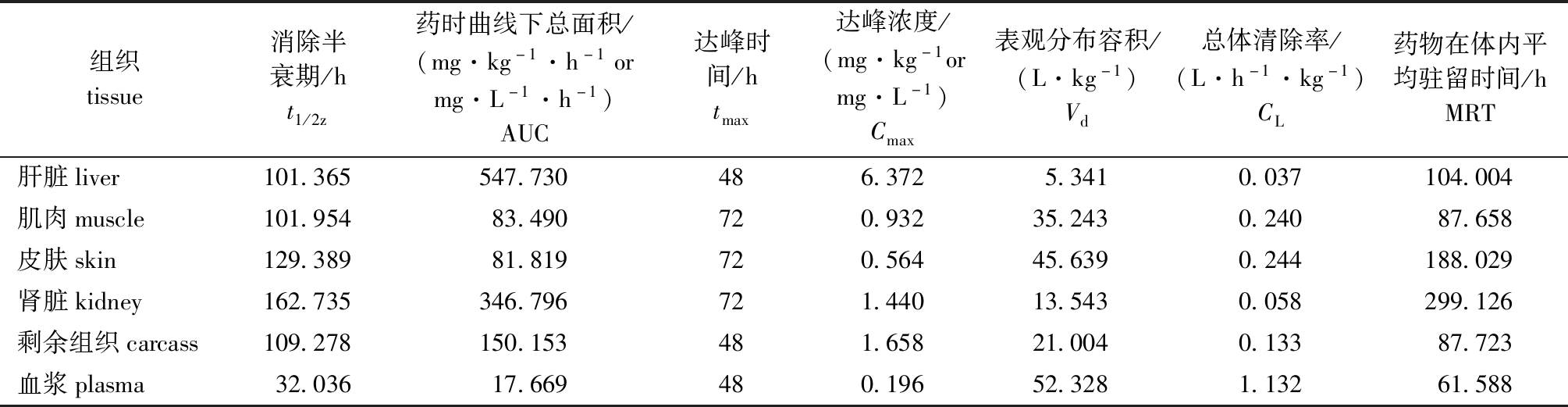
组织tissue消除半衰期/ht1/2z药时曲线下总面积/(mg·kg-1·h-1ormg·L-1·h-1)AUC达峰时间/htmax达峰浓度/(mg·kg-1ormg·L-1)Cmax表观分布容积/(L·kg-1)Vd总体清除率/(L·h-1·kg-1)CL药物在体内平均驻留时间/hMRT肝脏liver101.365547.730486.3725.3410.037104.004肌肉muscle101.95483.490720.93235.2430.24087.658皮肤skin129.38981.819720.56445.6390.244188.029肾脏kidney162.735346.796721.44013.5430.058299.126剩余组织carcass109.278150.153481.65821.0040.13387.723血浆plasma32.03617.669480.19652.3281.13261.588
表6 50 mg/kg剂量下虹鳟体内CIP的药代动力学参数
Tab.6 Pharmacokinetic parameters of CIP in rainbow trout Oncorhynchus mykiss exposed to ENR at a dose of 50 mg/kg
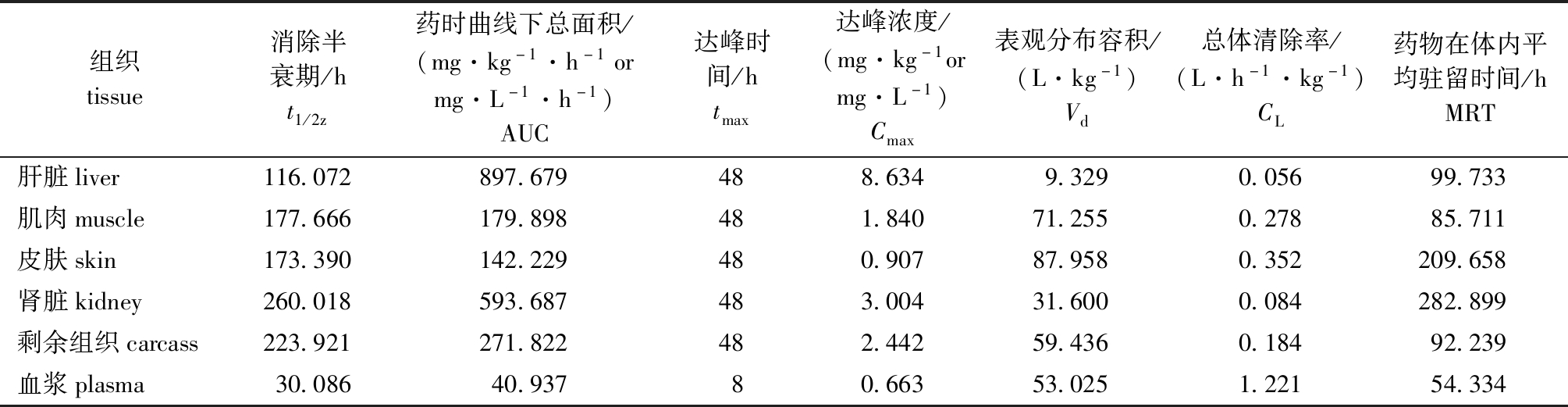
组织tissue消除半衰期/ht1/2z药时曲线下总面积/(mg·kg-1·h-1ormg·L-1·h-1)AUC达峰时间/htmax达峰浓度/(mg·kg-1ormg·L-1)Cmax表观分布容积/(L·kg-1)Vd总体清除率/(L·h-1·kg-1)CL药物在体内平均驻留时间/hMRT肝脏liver116.072897.679488.6349.3290.05699.733肌肉muscle177.666179.898481.84071.2550.27885.711皮肤skin173.390142.229480.90787.9580.352209.658肾脏kidney260.018593.687483.00431.6000.084282.899剩余组织carcass223.921271.822482.44259.4360.18492.239血浆plasma30.08640.93780.66353.0251.22154.334
2.3 ENR和CIP在虹鳟体内的残留特征
2.3.1 ENR 从图1可见,两种剂量下不同组织中ENR残留呈现如下特征:低剂量组肝脏中ENR在给药后24~144 h下降明显,含量由13.081 mg/kg降至1.70 mg/kg,后缓慢消除;高剂量组在48~192 h下降明显,含量由33.772 mg/kg下降至1.495 mg/kg。低剂量组肌肉中ENR在24~144 h下降明显,含量由11.164 mg/kg 降至0.572 mg/kg,高剂量下ENR在该时间段同样下降快速,含量由35.844 mg/kg降至2.311 mg/kg。低剂量组皮肤中ENR在48 h开始下降,消除速度较为平缓,888 h时检出含量为0.291 mg/kg;高剂量组ENR在48 h时达到峰值53.315 mg/kg后开始下降,在1 008 h时含量为0.631 mg/kg。低剂量组肾脏中ENR在72 h达到峰值后开始下降,在给药后888 h含量为1.841 mg/kg;高剂量组ENR含量在48 h达到峰值305.098 mg/kg,随后消除速度较快,下降明显。低剂量组剩余组织ENR在4~144 h下降较为明显,后持续消除,速度较为平缓;高剂量组在1 h时达到峰值,至12 h时快速下降。低剂量组血浆ENR含量在24~144 h时下降明显,后消除速度趋于平缓,含量由2.865 mg/L降至0.223 mg/L;高剂量组在24 h时出现第二个峰值后开始下降,至144 h区间下降速度较快,后期趋于平缓。低剂量下ENR在6种组织中的t1/2z为56.523~320.705 h,高剂量下为102.405~325.593 h。整体而言,在高剂量试验条件下各组织中ENR的t1/2z高于低剂量组。
2.3.2 CIP 口灌ENR后,虹鳟肝脏、肌肉、皮肤、肾脏、剩余组织和血浆中均可检测到代谢物CIP。两种剂量下不同组织中CIP的残留呈现如下特征:高低剂量组肝脏组织CIP含量均在停药后48 h时达到峰值后进入消除阶段,48~144 h消除较为快速,随后药时曲线斜率趋缓,CIP进入缓慢降解过程,且高低剂量组分别在456、528 h时CIP含量低于检测限。低剂量组肌肉组织CIP含量于72 h时达到峰值后缓慢下降,高剂量组在48 h时达到峰值后进入降解阶段,高低剂量组均于192 h时下降至检测线以下。低剂量组皮肤组织CIP于72 h时开始降解,高剂量组于48 h时开始消除,均至240 h时低于检测限以下。低剂量组肾脏组织中CIP于72 h时开始消除,96 h低于检测限;高剂量组CIP于48 h时开始消除,192 h时低于检测限。剩余组织高低剂量组CIP均于48 h时开始消除,高剂量组消除速度快于低剂量组,高低剂量组分别于240、192 h时低于检测限。血浆中CIP高剂量组于24 h、低剂量组于48 h时开始消除,分别于144、96 h时低于检测限。低剂量下CIP在6种组织中的t1/2z为32.036~162.735 h,高剂量下相应组织t1/2z为30.086~260.018 h;低剂量组肝脏、肌肉、皮肤、肾脏和剩余组织消除速度快于高剂量组,但血浆中高剂量组快于低剂量组(表5、表6)。
2.3.3 ENR+CIP 高剂量组药物代谢消除速度较低剂量组慢。低剂量组用药后888 h(37 d)鱼体肝脏、肌肉、皮肤、肾脏、剩余组织和血浆中ENR与CIP含量之和分别为47.079、ND(未检出)、294.731、1 892.800、21.769 μg/kg和ND;高剂量组用药1 008 h(42 d)后鱼体肝脏、肌肉、皮肤、肾脏、剩余组织和血浆中ENR与CIP含量之和分别为59.421、ND、639.093、2 628.919、57.691 μg/kg和2.231 μg/L;肌肉中ENR与CIP之和的含量,低剂量组在给药后768 h(32 d)、高剂量组在给药后1 008 h(42 d)低于检测限。
3 讨论
3.1 给药方式与采样方案
鱼类药物代谢残留研究,给药方式主要有注射、拌饲投喂、口灌和药浴等4种。注射是使抗生素进入血流最直接、最有效的给药方式,因需要更多时间和劳动力,适用于处理高价值动物,如家畜和观赏鱼[28],不适用于养殖鱼类。拌饲投喂和药浴相对操作简便,但拌饲投喂主要是将药物混入饲料后投喂,不同试验动物个体间因摄食能力、社会等级地位等行为学特征,导致不同个体间摄入药物量差异较大,对研究结果准确性影响较大[29]。药浴是通过水体给药,难以获得鱼体实际摄入药物量数据,且存在需要较高药物用量才能达到预期效果,以及水体细菌会产生耐药性等缺点[30]。本研究中采用混饲口灌方式给药,不仅可以做到每条试验鱼体给药量精确可控,且操作相对简便,减少了试验误差,有效保障了试验结果的准确性,值得后续研究推广使用。
在鱼体代谢组织选择上,本试验中采样组织与以往研究相比,除传统血液及肌肉、肝脏、肾脏、皮肤等组织外,额外增加除上述组织外的所有剩余其他组织,即该研究获得了药物在整个鱼体中的代谢残留特征,据笔者所知上述研究思路目前尚不多见。如此设计主要因中国养殖水产动物种类众多,使用药物种类繁杂,加之养殖环境和模式多样,解决水产动物药物代谢残留问题,恐不能穷尽所有鱼药组合,解决产业需求有赖于基于生理药代动力学模型(physiologically based pharmacokinetic model,PBPK model)的鱼类药物代谢残留技术研究[31]。生理药代动力学模型是基于物质平衡原理,将整个鱼体作为一个有机整体,不同组织代表一个单独的房室,房室间借助于血液循环连接形成闭环,以此模拟机体药物代谢过程,实现药物代谢残留的预测和外推[32]。本研究中正是基于此原理,将虹鳟作为有机整体进行了全部组织中药物代谢残留规律研究,在获得代谢特征和残留规律的同时,也为鱼类药物代谢残留PBPK模型的构建提供基础数据。
3.2 药代动力学特征
药物达峰浓度(Cmax)和达峰时间(tmax)是反映药物在鱼体中吸收程度和速度的2个重要参数。本研究中,高剂量组ENR在虹鳟肌肉、肾脏和剩余组织中的tmax均比低剂量组短,且高剂量组肝脏、肌肉、皮肤、肾脏、剩余组织和血浆中的Cmax分别为43.302、35.909、53.315、305.098、121.254 mg/kg和8.456 mg/L,均大于低剂量组相应组织的Cmax值(分别为13.349、11.164、23.378、114.196、33.762 mg/kg和3.361 mg/L)。其代谢物CIP在高剂量组肌肉、肾脏和皮肤等组织的tmax也同样均短于低剂量组,且CIP在高剂量组肝脏、肌肉、皮肤、肾脏、剩余组织和血浆中的Cmax均大于低剂量组相应组织的Cmax。上述结果表明,高剂量给药情况下,ENR及其代谢物CIP在虹鳟体内的吸收程度及速度均大于低剂量组。Stoffregen等[33]对大西洋鲑幼鱼分别进行5、10 mg/kg两种剂量ENR口灌比较研究,同样呈现高剂量组组织中ENR的tmax短于低剂量组的特征。在中国对虾中对氟苯尼考等氯霉素类药物进行高剂量(16 mg/kg)和低剂量(8 mg/kg)比较,同样发现高剂量组肌肉和肝胰脏组织药物Cmax浓度远高于低剂量组[34]。可见,同一药物在不同养殖品种或不同药物间增加给药剂量,均能促进药物吸收速度和程度。
AUC是反映组织器官对药物吸收和药物在机体内分布量大小的参数。本研究中高低两种剂量下,ENR在肾脏中的AUC值均大于其他组织,表明虹鳟肾脏中的药物吸收分布量、吸收速度和程度均高于其他5种组织。另一方面,本研究中两种ENR浓度下,鱼体肾脏中药物含量均远大于其他5种组织,且肝脏中检测出CIP含量均最高,这与ENR在欧洲鳗鲡Anguilla anguilla[35]、金鳟Oncorhynchus mykiss[36]和三疣梭子蟹Portunus trituberculatus[37]中的检出结果一致,由此说明,对部分水产动物而言,药物经肝脏代谢肾脏排泄的理论[38]同样适用。
消除半衰期(t1/2z)反映了药物在机体组织器官中的消除速度。本研究中,高剂量给药下ENR在虹鳟肝脏、肌肉、皮肤、肾脏、剩余组织和血浆中t1/2z分别为204.193、115.639、102.405、121.852、201.834、325.593 h,均高于低剂量下对应组织的t1/2z值100.928、60.780、67.283、111.586、56.523、320.705 h,由此说明,高剂量给药下ENR在虹鳟体内所需消除时间更长,且两种给药剂量下虹鳟肌肉、肝脏和血液的t1/2z均显著高于50 mg/kg ENR在罗非鱼对应3个组织的t1/2z值(15.61、16.83、17.19 h)[13]。导致差异产生的原因,除物种间因素外,考虑到本研究中虹鳟为冷水性鱼类,试验水温为(15±2)℃,罗非鱼为热带品种,试验水温为(27±2)℃,笔者认为更多可能是不同养殖温度所致,由此提醒后续研究中应更多关注温度等环境因素的影响。本研究中ENR给药后,虹鳟肝脏和肾脏中ENR及CIP均出现双峰现象,这与ENR在短盖巨脂鲤Colossoma brachypomum[39]和异育银鲫Carassius auratus gibelio[40]体内变化规律一致,原因可能是ENR在虹鳟体内同样存在肝肠循环,但此论点还有待进一步验证。
3.3 给药方案与休药期
药物剂量决定药物对宿主和病原体作用的强度[41],剂量偏小不仅达不到治疗疾病的目的,还极有可能产生耐药性,剂量过大则对养殖动物和生态环境均存在毒性风险,且容易导致药残超标,引发食品安全问题。研究表明,ENR对大多数病原菌的最低抑菌浓度(minimum inhibitory concentration,MIC)为0.16 mg/L,对最不敏感的链球菌MIC为0.25~0.45 mg/L[42-43]。当抗菌药物Cmax/MIC=10时即可发挥最大治疗效果,并减少耐药性的产生[44]。以最不敏感链球菌MIC为依据,本研究中,低剂量给药下虹鳟肝脏、肌肉、皮肤、肾脏、剩余组织和血浆中Cmax/MIC值分别为29.664~53.396、24.809~44.656、51.951~93.512、253.769~456.784、75.027~135.048、7.468~13.444,高剂量下相应组织中Cmax/MIC值分别为96.226~173.208、79.798~143.636、118.478~213.260、677.996~1220.392、269.453~485.016、18.791~33.824,即两种剂量下虹鳟各组织中药物Cmax/MIC的平均值均大于10,由此表明,在20 mg/kg单次给药下,ENR对最不敏感链球菌也能达到最大抑制作用。国外学者在ENR药代动力学研究中,多采用5 mg/kg或10 mg/kg给药剂量,研究结果所得血药浓度均能达到理想的抑菌效果[23-26]。考虑到养殖生产多为连续给药,笔者建议在实际养殖生产中,推荐按照20 mg/kg鱼体质量甚至更低的ENR给药剂量,这样既能满足对疾病的有效治疗和控制,也可大幅降低用药及生产成本,减少药物残留超标风险,同时对养殖水域生态环境和药物耐药性预防等均具有积极意义。
在20、50 mg/kg两种剂量下虹鳟肌肉中ENR与CIP之和分别在用药后768 h(32 d)和1 008 h(42 d)低于中国食品安全国家限量标准100 μg/kg[4],即ENR休药期分别为480、630 ℃·d,接近或高于现行中国水产养殖用药明白纸(2020年2号)中对ENR休药期标准500 ℃·d的要求。而现实生产中,ENR通常按20~50 mg/kg剂量连续给药5~7 d,实际所需休药期应大于本研究结果。另一方面,有关虹鳟休药期,Lucchetti等[26]研究认为,ENR休药期应为816 ℃·d;对于其他养殖品种,梁俊平等[45]通过20 mg/kg剂量给大菱鲆口服和李佳蔚等[46]通过20 mg/kg剂量给黑裙口服研究,分别给出720 ℃·d和630 ℃·d时休药期建议。综上,中国现有ENR 500 ℃·d的规定不能保障养殖产品质量安全,建议适当延长休药期。
4 结论
1)以20、50 mg/kg ENR生产实际使用剂量对虹鳟进行单次混饲口灌,不同组织均可检测出代谢物CIP,且两种剂量下均为肾脏中ENR含量最高,肝脏中CIP含量最高。
2)增大ENR给药剂量能显著增加鱼体组织中药物浓度,高剂量下ENR消除速率较快,但残留时间更长。
3)ENR 20 mg/kg剂量单次给药下,虹鳟各组织中药物Cmax均能达到理想的抑菌效果,建议中国实际养殖生产中ENR使用剂量降为20 mg/kg鱼体质量甚至更低。
4)在(15±2)℃下,建议ENR 20 mg/kg剂量对虹鳟单次口服给药休药期不低于32 d(即480 ℃·d),50 mg/kg剂量下休药期不低于42 d(即630 ℃·d)。现有500 ℃·d的休药期标准存在引发水产品质量安全风险,应适当延长。
[1] 黄铢玉,方龙香,宋超,等.不同温度和pH对恩诺沙星及其代谢产物环丙沙星在渔业下层水体中消除规律的影响[J].中国农学通报,2020,36(21):132-139.
HUANG Z Y,FANG L X,SONG C,et al.Temperature and pH: effect on the elimination rule of enrofloxacin and its metabolite ciprofloxacin in fishery lower water bodies[J].Chinese Agricultural Science Bulletin,2020,36(21):132-139.(in Chinese)
[2] 中华人民共和国农业农村部.SC/T 1132—2016 渔药使用规范[S].北京:中国农业出版社,2016.
Ministry of Agriculture and Rural Affairs of the People’s Republic of China.SC/T 1132-2016 Fishery drug use standard[S].Beijing:China Agriculture Press,2016.(in Chinese)
[3] 叶建美,吴康,吴洪丽,等.恩诺沙星抗菌效果及药代动力学研究进展[J].湖北农业科学,2015,54(23):5813-5816.
YE J M,WU K,WU H L,et al.Research progress of pharmacokinetics and pharmacodynamics of enrofloxacin[J].Hubei Agriculture Sciences,2015,54(23):5813-5816.(in Chinese)
[4] 中华人民共和国农业农村部,中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 31650—2019 食品安全国家标准 食品中兽药最大残留限量[S].北京:中国标准出版社,2019:15-16.
Ministry of Agriculture and Rural Affairs of the People’s Republic of China,National Health Commission of the People’s Republic of China,State Administration for Market Regulation.GB31650-2019 National food safety standard maximum residue limits for veterinary drugs in foods[S].Beijing:China Standards Press,2019:15-16.(in Chinese)
[5] CORUM O,TERZI E,CORUM D D,et al.Pharmacokinetic/pharmacodynamic integration of marbofloxacin after oral and intravenous administration in rainbow trout (Oncorhynchus mykiss)[J].Aquaculture,2020,514:734510.
[6] 唐嘉嘉,李诗钰,李安兴.鲑鳟鱼类寄生虫病研究进展与展望[J].渔业科学进展,2020,41(6):200-210.
TANG J J,LI S Y,LI A X.Research progress and prospects of parasitic diseases in salmon and trout[J].Progress in Fishery Sciences,2020,41(6):200-210.(in Chinese)
[7] ÖZTURK R Ç,ALTINOK I.Bacterial and viral fish diseases in Turkey[J].Turkish Journal of Fisheries and Aquatic Sciences,2014,14(1):275-297.
[8] CABELLO F,GODFREY H P,TOMOVA A,et al.Antimicrobial use in aquaculture re-examined:its relevance to antimicrobial resistance and to animal and human health[J].Environmental Microbiology,2013,15(7):1917-1942.
[9] 罗钦,钟茂生,朱品玲,等.3种养殖淡水鱼兽药残留及其食用健康风险评价[J].食品安全质量检测学报,2020,11(22):8253-8259.
LUO Q,ZHONG M S,ZHU P L,et al.Veterinary drug residues and edible health risk assessment of 3 kinds of cultured freshwater fish[J].Journal of Food Safety and Quality,2020,11(22):8253-8259.(in Chinese)
[10] 朱晓玲,张菊,刘杰,等.湖北省水产品兽药残留状况分析[J].食品安全质量检测学报,2021,12(1):69-77.
ZHU X L,ZHANG J,LIU J,et al.Analysis of veterinary drug residues in aquatic products of Hubei Province[J].Journal of Food Safety and Quality,2021,12(1):69-77.(in Chinese).
[11] VIGNESH R,KARTHIKEYAN B S,PERIYASAMY N,et al.Antibiotics in aquaculture:an overview[J].South Asian Journal of Experimental Biology,2011,1(3):114-120.
[12] 宋红波,吴光红,沈美芳,等.恩诺沙星在水产品中残留的风险评估[J].渔业现代化,2008,35(5):39-42.
SONG H B,WU G H,SHEN M F,et al.Risk evaluation of enrofloxacin in aquatic product[J].Fishery Modernization,2008,35(5):39-42.(in Chinese)
[13] 徐维海,林黎明,朱校斌,等.恩诺沙星及其代谢产物在吉富罗非鱼、中国对虾体内的残留规律研究[J].水产科学,2004,23(7):5-8.
XU W H,LIN L M,ZHU X B,et al.Residues of enrofloxacin and its metabolite in Jifu tilapia and Penaeus chinensis[J].Fisheries Science,2004,23(7):5-8.(in Chinese)
[14] 李改娟,刘艳辉,祖岫杰,等.不同给药方式下培氟沙星在鲤体内的药代动力学研究[J].大连海洋大学学报,2014,29(4):386-390.
LI G J,LIU Y H, ZU X J,et al.Pharmacokinetics of pefloxacin in carp after a single intramuscular and oral administration[J].Journal of Dalian Ocean University,2014,29(4):386-390.(in Chinese)
[15] 李改娟,刘艳辉,戴欣,等.不同水温联合用药中恩诺沙星在鲤体内的药代动力学及残留的影响[J].吉林农业大学学报,2017,39(4):471-476.
LI G J,LIU Y H,DAI X,et al.Effects of combined drug administration at different water temperature on pharmacokinetics and residues of enrofloxacin in carp[J].Journal of Jilin Agricultural University,2017,39(4):471-476.(in Chinese)
[16] 王欢,许荔立,陈孝煊,等.不同温度下恩诺沙星在克氏原螯虾体内的药代动力学[J].华中农业大学学报,2021,40(1):112-119.
WANG H,XU L L,CHEN X X,et al.Pharmacokinetics of enrofloxacin in Procambarus clarkii at different temperatures[J].Journal of Huazhong Agricultural University,2021,40(1):112-119.(in Chinese)
[17] 张天闻.连续药饵投喂方式下恩诺沙星及其代谢物环丙沙星在大黄鱼体内的残留消除研究[J].渔业研究,2020,42(1):29-35.
ZHANG T W.Residue elimination of enrofloxacin and its metabolite ciprofloxacin in Larimichthys crocea at multiple dosages[J].Journal of Fisheries Research,2020,42(1):29-35.(in Chinese)
[18] 郭娇娇,潘红艳,杨虎,等.恩诺沙星在杂交鲟体内的药物代谢动力学[J].大连海洋大学学报,2011,26(4):362-366.
GUO J J,PAN H Y,YANG H,et al.Pharmacokinetics of enrofloxacin in sturgeon Acipenser schrenckii [J].Journal of Dalian Ocean University,2011,26 (4):362-366.(in Chinese)
[19] 郑宗林,叶金明,李代金,等.恩诺沙星及其代谢产物在中华绒螯蟹血淋巴中的比较药代动力学[J].海洋渔业,2011,33(1):74-82.
ZHENG Z L,YE J M,LI D J,et al.On comparative pharmacokinetic of enrofloxacin in hemolymph of Chinese mitten-handed crab, Eriocheir sinensis[J].Marine Fisheries,2011,33(1):74-82.(in Chinese)
[20] 张德云,匡维华,郑映钦.恩诺沙星在日本鳗鲡体内残留消除规律研究[J].水产科学,2007,26(4):210-213.
ZHANG D Y,KUANG W H,ZHENG Y Q.Studies on elimination of enrofloxacin residues and its metabolites in eel tissues[J].Fisheries Science,2007,26(4):210-213.(in Chinese)
[21] SHAN Q,WANG J X,WANG J,et al.Pharmacokinetic/pharmacodynamic relationship of enrofloxacin against Aeromonas hydrophila in crucian carp (Carassius auratus gibelio)[J].Journal of Veterinary Pharmacology and Therapeutics,2018,41(6):887-893.
[22] 范晶晶.恩诺沙星在鲫鱼体内的药动学及其体外抗菌后效应研究[D].上海:上海海洋大学,2017.
FAN J J.The pharmacokinetics of enrofloxacin in crucian carp and the post-antibiotic effect in vitro[D].Shanghai: Shanghai Ocean University,2017.(in Chinese)
[23] ![]() N,MESSINA M J,PRIETO G,et al.Pharmacokinetics and tissue disposition of enrofloxacin in rainbow trout after different routes of administration[J].Xenobiotica,2020,50(10):1236-1241.
N,MESSINA M J,PRIETO G,et al.Pharmacokinetics and tissue disposition of enrofloxacin in rainbow trout after different routes of administration[J].Xenobiotica,2020,50(10):1236-1241.
[24] KYUCHUKOVA R,MILANOVA A,PAVLOV A,et al.Comparison of plasma and tissue disposition of enrofloxacin in rainbow trout (Oncorhynchus mykiss) and common carp (Cyprinus carpio) after a single oral administration[J].Food Additives & Contaminants:Part A,2015,32(1):35-39.
[25] BOWSER P R,WOOSTER G A,STLEGER J,et al.Pharmacokinetics of enrofloxacin in fingerling rainbow trout (Oncorhynchus mykiss)[J].Journal of Veterinary Pharmacology and Therapeutics,1992,15(1):62-71.
[26] LUCCHETTI D,FABRIZI L,GUANDALINI E,et al.Long depletion time of enrofloxacin in rainbow trout (Oncorhynchus mykiss)[J].Antimicrobial Agents and Chemotherapy,2004,48(10):3912-3917.
[27] 农业农村部《新编渔药手册》编撰委员会.新编渔药手册[S].北京:中国农业出版社,2005:208-209.
Editorial board of “A new handbook of medicines for aquatic animals” of Ministry of Agriculture and Rural Affairs.A new handbook of medicines for aquatic animals[S].Beijing:China Agriculture Press,2005:208-209(in Chinese).
[28] YANONG R P E.Use of antibiotics in ornamental fish aquaculture[EB/OL].UF/IFAS Extension,2006:84.http://www.doc88.com/p-9833178981987.html.
[29] TERZI E,CORUM O,BILEN S,et al.Pharmacokinetics of danofloxacin in rainbow trout after different routes of administration[J].Aquaculture,2020,520:734984.
[30] QUESADA S P,PASCHOAL J A R,REYES F G R.Considerations on the aquaculture development and on the use of veterinary drugs:special issue for fluoroquinolones-a review[J].Journal of Food Science,2013,78(9):R1321-R1333.
[31] 程波,艾晓辉,常志强,等.水产动物药物代谢残留研究及创新发展方向——基于PBPK模型的残留预测技术[J].中国渔业质量与标准,2017,7(6):42-47.
CHENG B,AI X H,CHANG Z Q,et al.Direction of innovation and development for the study on drug metabolism residues of aquatic animals—the prediction technique based on PBPK model[J].Chinese Fishery Quality and Standards,2017,7(6):42-47.(in Chinese)
[32] XU N,LI M,CHOU W C,et al.A physiologically based pharmacokinetic model of doxycycline for predicting tissue residues and withdrawal intervals in grass carp (Ctenopharyngodon idella)[J].Food and Chemical Toxicology,2020,137:111-127.
[33] STOFFREGEN D A,WOOSTER G A,BUSTOS P S,et al.Multiple route and dose pharmacokinetics of enrofloxacin in juvenile Atlantic salmon[J].Journal of Veterinary Pharmacology and Therapeutics,1997,20(2):111-123.
[34] 王群,何玉英,李健.氟苯尼考在中国对虾体内消除规律的研究[J].中国海洋大学学报,2007,37(2):251-254,242.
WANG Q,HE Y Y,LI J.Elimination of florfenicol in Fenneropenaeus chinensis[J].Periodical of Ocean University of China,2007,37(2):251-254,242.(in Chinese)
[35] 余培建.药浴给药恩诺沙星及其代谢产物在欧洲鳗鲡体内的药代动力学研究[J].福建水产,2007(4):38-43.
YU P J.Pharmacokinetics of enrofloxacin and its metabolites in European eel (Anguilla anguilla) after bath treatment[J].Journal of Fujian Fisheries,2007(4):38-43.(in Chinese)
[36] 陈琛,卢彤岩,王荻,等.诺氟沙星在金鳟体内的药物代谢动力学研究[J].水产学杂志,2011,24(4):25-28,58.
CHEN C,LU T Y,WANG D,et al.Pharmacokinetics of enorfloxacin in rainbow trout Oncorhynchus mykiss[J].Chinese Journal of Fisheries,2011,24(4):25-28,58.(in Chinese)
[37] 余开,赵青松,陈寅儿,等.恩诺沙星在三疣梭子蟹主要组织中的代谢动力学[J].生物学杂志,2011,28(4):21-25.
YU K,ZHAO Q S,CHEN Y E,et al.Pharmacokinetics of enrofloxacin in main tissues of Portunus trituberculatus[J].Journal of Biology,2011,28(4):21-25.(in Chinese)
[38 ] 苏成业,韩国柱.临床药物代谢动力学[M].北京:科学出版社,2003:8-29.
SU C Y,HAN G Z.Pharmacokinetics of clinical drugs[M].Beijing:Science Press,2003:8-29.(in Chinese)
[39] LEWBART G,VADEN S,DEEN J,et al.Pharmacokinetics of enrofloxacin in the red pacu (Colossoma brachypomum) after intramuscular,oral and bath administration[J].Journal of Veterinary Pharmacology and Therapeutics,1997,20(2):124-128.
[40] 方星星,刘秀红,丁相卿,等.恩诺沙星在异育银鲫体内的组织分布及消除规律[J].南京农业大学学报,2012,35(4):110-114.
FANG X X,LIU X H,DING X Q,et al.Distribution and elimination of enrofloxacin in allogynogenetic silver crucian carp,Carassius auratus gibelio[J].Journal of Nanjing Agricultural University,2012,35(4):110-114.(in Chinese)
[41] 简纪常,吴灶和,陈刚.恩诺沙星在眼斑拟石首鱼体内的药物代谢动力学[J].中国兽医学报,2005,25(2):195-197.
JIAN J C,WU Z H,CHEN G.Pharmacokinetics of enrofloxacin in Sciaenops ocellatus[J].Chinese Journal of Veterinary Science,2005,25(2):195-197.(in Chinese)
[42] BOWSER P R,HOUSE M.In vitro sensitivity of some fish pathogens to the quinolones nalidixic acid and oxolinic acid the fluoroquinolone enrofloxacin[J].Bulletin-European Association of Fish Pathologists,1990,10(2):48-49.
[43] WALKER R D.The use of fluoroquinolones for companion animal antimicrobial therapy[J].Australian Veterinary Journal,2000,78(2):84-90.
[44] CRAIG W A.Pharmacokinetic/pharmacodynamic parameters:rationale for antibacterial dosing of mice and men[J].Clinical Infectious Diseases,1998,26(1):1-12.
[45] 梁俊平,李健,张喆,等.肌注和口服恩诺沙星在大菱鲆体内的药代动力学比较[J].水生生物学报,2010,34(6):1122-1129.
LIANG J P,LI J,ZHANG Z,et al.Pharmacokinetics of enrofloxacin in turbot (Scophthalmus maximus) after a single intramuscular and oral administration[J].Acta Hydrobiologica Sinica,2010,34(6):1122-1129.(in Chinese).
[46] 李佳蔚,刘慧慧,于召强,等.恩诺沙星在黑鲪体内的药物代谢动力学研究[J].中国渔业质量与标准,2012,2(1):52-57.
LI J W,LIU H H,YU Z Q,et al.Pharmacokinetics of enrofloxacin in Sebastodes fuscescen[J].Chinese Fishery Quality and Standards,2012,2(1):52-57.(in Chinese)