凡纳滨对虾Litopenaeus vannamei壳薄体肥、肉质鲜美、含肉率高、营养丰富,与斑节对虾Penaeus monodon和日本对虾P.japonicus并称为世界三大对虾养殖品种[1]。近年来,随着中国水产养殖业的持续发展,凡纳滨对虾养殖产量持续增加,对饲料的需求也不断上涨,作为饲料主要原料的鱼粉和鱼油,由于资源短缺、价格高,限制了其在饲料中的使用[2],然而,当用廉价而资源丰富的植物蛋白源替代鱼粉时,养殖动物的健康就会受到一定影响,尤其会导致动物肠道产生一些病理变化[3-4]。
近年来,有机酸作为一种高效、无污染、无残留的保健型饲料添加剂,在水产养殖中越来越受到欢迎。大量研究表明,有机酸能降低胃肠道的pH值,促进营养物质的消化,从而提高饲料的利用率,并促进动物的生长[5]。此外,有机酸还能抗菌、抑菌,并能提高机体的抗氧化能力,提高鱼虾的免疫力、抗病能力[6-8]。林雪等[9]研究发现,饲料中添加0.2%(质量分数,下同)以柠檬酸和延胡索酸为主要成分的酸化剂,可显著提高罗非鱼血清T-AOC、ACP及AKP活性,提高了鱼体的抗氧化性能和免疫功能, 增强了抗应激能力,同时还能在柠檬酸和延胡索酸的协同作用下调节代谢过程,减少有害微生物对宿主的伤害。栗雄高[1]研究发现,在凡纳滨对虾饲料中添加0.2%~0.3%柠檬酸能促进凡纳滨对虾生长,提高消化酶活性和免疫功能,并通过促进虾肠道内有益菌的繁殖抑制有害菌繁殖,使肠道菌群结构向有益方面改变,促进维生素、钙等元素的吸收,从而提高了水产动物的抗病能力和抵抗力。尚卫敏等[10]发现,在饲料中添加柠檬酸和乳酸可以提高草鱼Ctenopharyngodon idellus血清超氧化物歧化酶、谷胱甘肽过氧化物酶和溶菌酶活性,提高草鱼的抗氧化能力和免疫功能。罗玲等[7]和魏朝青等[8]均研究发现,丁酸钠可以提高团头鲂Megalobrama amblycephala和大菱鲆Scophthalmus maximus的抗氧化能力。Ringø[11]发现,在北极鲑Salvelinus alpinus日粮饲料中补充丙酸钠可降低棕榈酸含量,促进生长和消化。
本试验中,选取柠檬酸钠、丁酸钠、丙酸钠和延胡索酸4种有机酸,研究了其对凡纳滨对虾生长、免疫和肠道健康的影响,以期为促进对虾养殖业健康发展提供有益参考。
1 材料与方法
1.1 材料
养殖试验在天津市西青区畜牧基地水产局养殖试验示范基地进行,试验用凡纳滨对虾由试验基地提供。
1.2 方法
1.2.1 试验饲料制备 试验设正对照组(记为D0,含24%进口鱼粉和18%豆粕的基础饲料,为高鱼粉组)和负对照组(记为D1,含12%进口鱼粉和36%豆粕,为低鱼粉组),在负对照组饲料基础上分别添加0.3%柠檬酸钠、0.3%丁酸钠、0.3%丙酸钠和0.3%延胡索酸(均为质量分数,下同),记为D2、D3、D4、D5,并以正对照组为参考补充赖氨酸和蛋氨酸,制成等氮等能的6种试验饲料。试验饲料组成及营养成分水平见表1、表2(能量为计算值,其余为实测值)。饲料制作过程中,将所有饲料原料粉碎后过198 μm孔径筛,然后加入鱼油、磷脂、鱿鱼膏和蒸馏水,混合均匀后制成直径为2 mm的硬性颗粒饲料,最后自然冷却风干后收放在密封袋中,置于4 ℃冰箱中保存备用。
表1 试验饲料原料组成
Tab.1 Ingredients of the experimental diets w/%
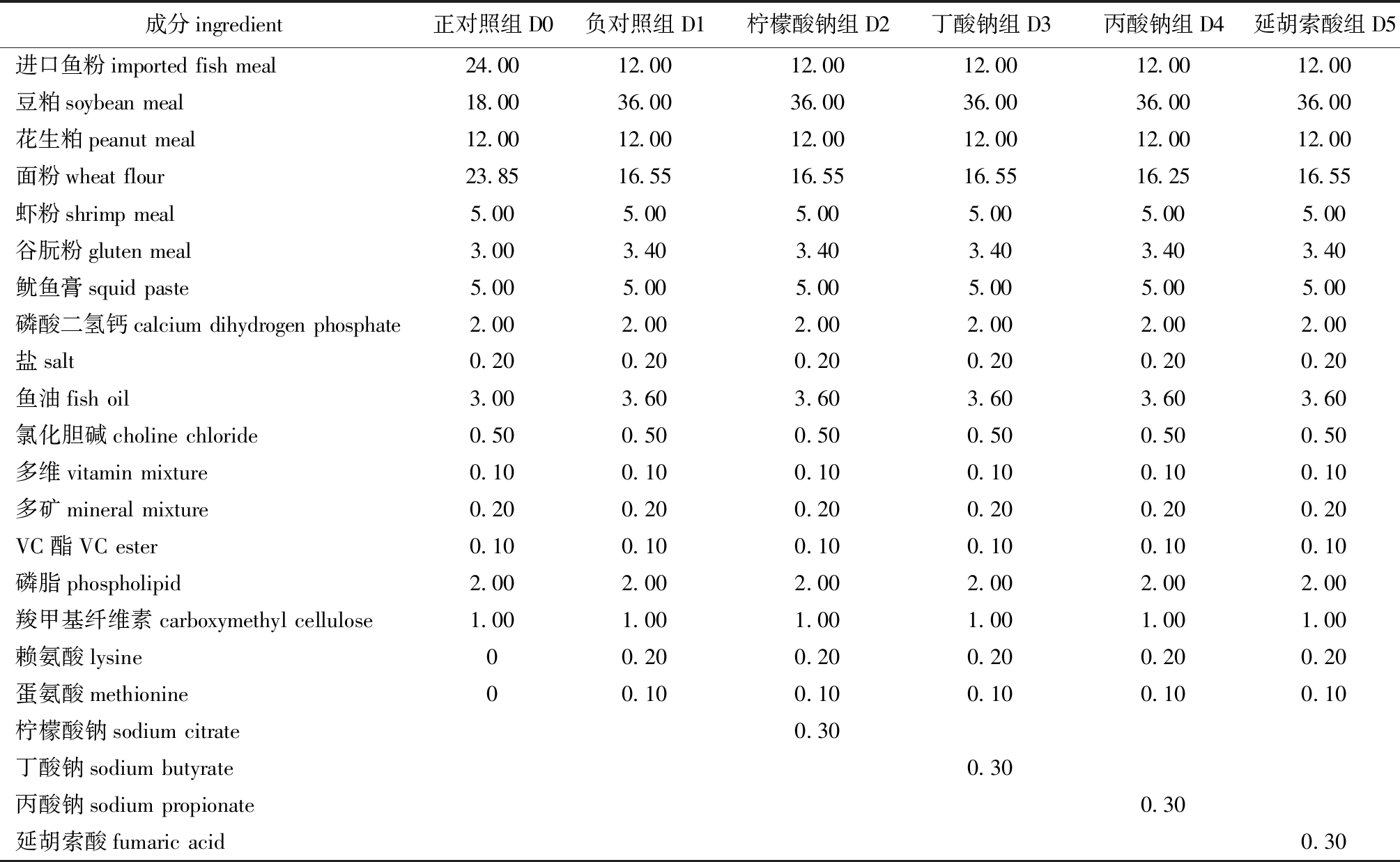
成分ingredient正对照组D0负对照组D1柠檬酸钠组D2丁酸钠组D3丙酸钠组D4延胡索酸组D5进口鱼粉importedfishmeal24.0012.0012.0012.0012.0012.00豆粕soybeanmeal18.0036.0036.0036.0036.0036.00花生粕peanutmeal12.0012.0012.0012.0012.0012.00面粉wheatflour23.8516.5516.5516.5516.2516.55虾粉shrimpmeal5.005.005.005.005.005.00谷朊粉glutenmeal3.003.403.403.403.403.40鱿鱼膏squidpaste5.005.005.005.005.005.00磷酸二氢钙calciumdihydrogenphosphate2.002.002.002.002.002.00盐salt0.200.200.200.200.200.20鱼油fishoil3.003.603.603.603.603.60氯化胆碱cholinechloride0.500.500.500.500.500.50多维vitaminmixture0.100.100.100.100.100.10多矿mineralmixture0.200.200.200.200.200.20VC酯VCester0.100.100.100.100.100.10磷脂phospholipid2.002.002.002.002.002.00羧甲基纤维素carboxymethylcellulose1.001.001.001.001.001.00赖氨酸lysine00.200.200.200.200.20蛋氨酸methionine00.100.100.100.100.10柠檬酸钠sodiumcitrate0.30丁酸钠sodiumbutyrate0.30丙酸钠sodiumpropionate0.30延胡索酸fumaricacid0.30
表2 试验饲料营养成分(干质量)
Tab.2 Nutrient content of experimental diets(dry mass)

组别group粗蛋白质/%crudeprotein粗脂肪/%crudelipid粗灰分/%crudeash水分/%moisture总能/(kJ·g-1)energypH正对照positivecontrol(D0)42.6212.7810.407.5115.285.98负对照negativecontrol(D1)42.5513.049.697.7415.366.09柠檬酸钠sodiumcitrate(D2)42.8513.1210.127.6815.475.99丁酸钠sodiumbutyrate(D3)42.9712.879.537.3015.395.96丙酸钠sodiumpropionate(D4)42.4712.7710.157.6515.246.14延胡索酸fumaricacid(D5)42.9212.8410.207.5415.375.80
1.2.2 试验设计与养殖管理 选取大小均匀、体格健康的对虾720尾随机分成6组,每组设3个平行,共用18个网箱(100 cm×100 cm×150 cm),每个网箱投放40尾试验虾(体质量为7.54 g±0.40 g),养殖周期为42 d。养殖期间,水温为24~30 ℃,pH为8.42~8.88,溶解氧为7.11~8.97 mg/L,亚硝酸盐≤0.01 mg/L,氨氮≤0.2 mg/L。
1.2.3 样品采集 养殖试验结束时,对试验虾禁食24 h,称重计数。使用经抗凝剂润洗过的1 mL无菌注射器从虾头胸甲腹窦采集血液样本,置于2 mL含有EDTA-2Na的离心管中,以3 000 r/min离心10 min,取血清于-80 ℃超低温冰箱中保存。于无菌环境中取出肠道内容物置于冻存管中,液氮速冻后置于-80 ℃超低温冰箱中保存。
1.2.4 生长指标测定与计算 增重率(WGR,%)、特定生长率(SGR,%/d)、饲料系数(FCR)计算公式分别为
WGR=(mt-m0)/W0×100%,
(1)
SGR=(lnmt-lnm0)/t×100%,
(2)
FCR=F/(mt-m0)。
(3)
其中:m0、mt分别为试验初始和终末凡纳滨对虾的总质量(g);F为养殖过程投饵干质量(g);t为养殖时间(d)。
1.2.5 血清抗氧化及免疫指标测定 根据南京建成生物工程研究所相应试剂盒操作说明书检测凡纳滨对虾血清酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LSZ)、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量。
1.2.6 肠道及内容物多样性测定 将凡纳滨对虾肠道内容物在北京科学院微生物研究所基因组研究中心进行测序分析。将检测合格的微生物DNA样本对其指定区域进行PCR扩增、文库制备、文库质检、定量,使用设定的TAG序列进行样本区分。采用Illumina Hiseq 2500高通量测序平台对检测合格的文库进行测序。基于优化序列进行OTU聚类分析和物种分类注释,基于OTU聚类结果进行多样性指数分析。
1.3 数据处理
1.3.1 测序基本数据处理 采用Flash软件对原始数据进行拼接,拼接得到的序列采用Trimmomatic进行质量过滤,用UCHIME去除嵌合体,最终得到高质量的Tags序列。在一致性97%的水平上对序列进行聚类,以测序所有序列数的0.005%作为阈值过滤OTU。
1.3.2 统计分析 所有数据均采用平均值±标准差(mean ± S.D.)表示。采用SPSS 19.0软件对试验数据进行单因素方差分析(one-way ANOVA),再用Duncan 法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 凡纳滨对虾生长性能的变化
从表3可见:与正对照组(高鱼粉组)相比,负对照组(低鱼粉组)凡纳滨对虾的终末体质量、增重率、特定生长率均显著降低(P<0.05),饲料系数显著升高(P<0.05);而在负对照组基础上,添加0.3%丁酸钠与0.3%柠檬酸钠,凡纳滨对虾的增重率和特定生长率均显著高于负对照组(P<0.05),饲料系数显著低于负对照组(P<0.05),添加0.3%丙酸钠和0.3%延胡索酸,凡纳滨对虾终末体质量、增重率和特定生长率与负对照组无显著性差异(P>0.05);添加有机酸后,丁酸钠组终末体质量、增重率和饲料系数与正对照组无显著性差异(P>0.05),但特定生长率较正对照组显著提高(P<0.05),柠檬酸钠组对虾终末体质量、特定生长率与正对照组无显著性差异(P>0.05)。由此可见,添加柠檬酸钠和丁酸钠缓解了高豆粕替代鱼粉造成的凡纳滨对虾增重率和特定生长率的下降。
表3 豆粕替代鱼粉并添加有机酸对凡纳滨对虾生长性能的影响
Tab.3 Effects of fish meal replaced by soybean meal and supplemented with different organic acids on growth performance of Pacific white leg shrimp Litopenaeus vannamei

组别group初始体质量/ginitialbodymass终末体质量/gfinalbodymass增重率/%massgainrate特定生长率/(%·d-1)specificgrowthrate饲料系数foodconversionratio正对照positivecontrol7.59±0.50757.00±64.16a218.20±8.95a2.69±0.03b1.14±0.10d负对照negativecontrol7.53±0.41587.00±59.03bc181.64±6.12c2.36±0.04c1.40±0.01b柠檬酸钠sodiumcitrate7.44±0.32660.67±38.07abc198.19±4.61b2.62±0.11b1.29±0.06c丁酸钠sodiumbutyrate7.46±0.58710.33±76.92ab224.59±7.44a2.83±0.02a1.16±0.03d丙酸钠sodiumpropionate7.65±0.36531.67±102.65c179.07±6.74c2.44±0.05c1.52±0.03a延胡索酸fumaricacid7.59±0.56592.00±62.79bc178.07±1.89c2.41±0.07c1.37±0.02bc
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
2.2 凡纳滨对虾血清抗氧化及免疫指标的变化
从表4可见:与正对照组(高鱼粉组)相比,负对照组(低鱼粉组)凡纳滨对虾血清ACP、AKP、SOD、LSZ活性均显著降低(P<0.05),MDA含量显著升高(P<0.05);与负对照组相比,添加0.3%柠檬酸钠后,凡纳滨对虾血清ACP、AKP和LSZ活性均显著升高(P<0.05),MDA含量显著降低(P<0.05),SOD活性呈现上升趋势但无显著性差异(P>0.05);与负对照组相比,添加0.3%丁酸钠后,血清ACP、SOD和LSZ活性显著升高(P<0.05),MDA含量显著降低(P<0.05);与负对照组相比,添加0.3%丙酸钠和0.3%延胡索酸后,AKP和SOD活性均显著降低(P<0.05),LSZ活性显著升高(P<0.05),丙酸钠组MDA含量显著降低(P<0.05);添加有机酸后,除柠檬酸钠和丁酸钠组ACP外,各组ACP、AKP、SOD、LSZ酶活性均显著低于正对照组(P<0.05)。
表4 豆粕替代鱼粉并添加有机酸对凡纳滨对虾抗氧化及免疫指标的影响
Tab.4 Effects of fish meal replaced by soybean meal and supplemented with different organic acids on anti-oxidation and immunity of Pacific white leg shrimp Litopenaeus vannamei
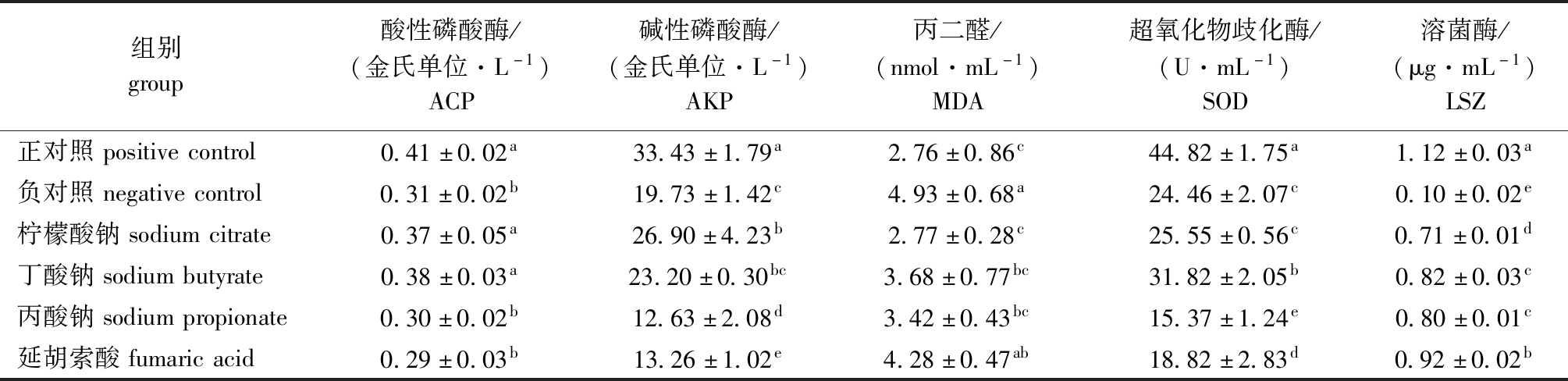
组别group酸性磷酸酶/(金氏单位·L-1)ACP碱性磷酸酶/(金氏单位·L-1)AKP丙二醛/(nmol·mL-1)MDA超氧化物歧化酶/(U·mL-1)SOD溶菌酶/(μg·mL-1)LSZ正对照positivecontrol0.41±0.02a33.43±1.79a2.76±0.86c44.82±1.75a1.12±0.03a负对照negativecontrol0.31±0.02b19.73±1.42c4.93±0.68a24.46±2.07c0.10±0.02e柠檬酸钠sodiumcitrate0.37±0.05a26.90±4.23b2.77±0.28c25.55±0.56c0.71±0.01d丁酸钠sodiumbutyrate0.38±0.03a23.20±0.30bc3.68±0.77bc31.82±2.05b0.82±0.03c丙酸钠sodiumpropionate0.30±0.02b12.63±2.08d3.42±0.43bc15.37±1.24e0.80±0.01c延胡索酸fumaricacid0.29±0.03b13.26±1.02e4.28±0.47ab18.82±2.83d0.92±0.02b
2.3 凡纳滨对虾肠道内容物菌群微生物Alpha多样性的变化
从表5可见:测序样本中覆盖率均大于99%,因而测序结果可代表凡纳滨对虾肠道内容物中微生物的真实情况;各组凡纳滨对虾肠道内容物的OTU数目、Chao1指数、香农指数(Shannon)和辛普森指数(Simpson)均无显著性差异(P>0.05);添加0.3%柠檬酸钠和0.3%丁酸钠后,OTU数目、Chao1指数、Shannon指数和Simpson指数值与正对照组内容物菌群数值最相近,添加0.3%丙酸钠和0.3%延胡索酸后,物种丰富度及物种多样性均较正对照组升高,与负对照组接近。
表5 豆粕替代鱼粉并添加有机酸对凡纳滨对虾肠道内容物菌群生物Alpha多样性的影响
Tab.5 Effects of fish meal replaced by soybean meal and supplemented with different organic acids on biological Alpha diversity of microflora in the intestinal contents of Pacific white leg shrimp Litopenaeus vannamei

组别groupOTU数目OTUnumberChao1指数Chao1index香农指数Shannonindex辛普森指数Simpsonindex覆盖率coverage正对照positivecontrol986.00±130.981130.39±65.177.15±1.470.96±0.060.99±0.01负对照negativecontrol1064.67±19.351161.86±24.237.80±0.300.98±0.010.99±0.00柠檬酸钠sodiumcitrate976.00±56.311142.88±25.766.41±1.530.89±0.130.99±0.00丁酸钠sodiumbutyrate1027.33±56.571146.86±56.417.26±0.870.97±0.020.99±0.00丙酸钠sodiumpropionate1077.00±49.031182.46±22.977.67±0.540.98±0.010.99±0.00延胡索酸fumaricacid1033.33±27.431159.02±21.987.08±0.920.98±0.070.99±0.00
2.4 凡纳滨对虾肠道内容物菌群结构分析
2.4.1 基于门水平的菌群结构分析 各组肠道内容物菌群结构在门水平上的组成如图1所示,6个组的菌群在门水平上,主要由变形菌门Proteobacteria、蓝藻门Cyanobacteria、放线菌门Actinobacteria、疣微菌门Verrucomicrobia、浮酶菌门Planctomycetes和厚壁菌门Firmicutes组成,相对丰度均达到94%以上,但是在各组所占比例有所不同。变形菌门、蓝藻门、放线菌门、疣微菌门、浮酶菌门和厚壁菌门6个优势菌门在正对照组的占比分别为46.72%、11.48%、12.24%、12.49%、10.40%、1.42%,在负对照组的占比分别为35.13%、18.28%、8.31%、18.01%、12.91%、2.19%,在柠檬酸钠组的占比分别为38.09%、7.27%、33.53%、5.70%、7.61%、3.13%,在丁酸钠组的占比分别为24.37%、21.88%、7.51%、26.37%、14.40%、1.19%,在丙酸钠组的占比分别为28.73%、23.57%、9.62%、17.68%、14.44%、1.38%,在延胡索酸组的占比分别为33.09%、17.93%、19.88%、10.45%、10.94%、2.09%。与正对照组相比,负对照组放线菌门的相对丰度有所下降,而浮酶菌门和蓝藻门的相对丰度有所上升。在负对照组中添加0.3%柠檬酸钠后,浮酶菌门和蓝藻门的相对丰度低于负对照组,放线菌门的相对丰度高于负对照组;添加0.3%丁酸钠和0.3%丙酸钠后,浮酶菌门和蓝藻门的相对丰度高于负对照组和正对照组,放线菌门的相对丰度低于负对照组和正对照组;添加0.3%延胡索酸后,浮酶菌门的相对丰度低于负对照组,放线菌门和蓝藻门的相对丰度高于负对照组和对照组。综上,添加0.3%柠檬酸钠和0.3%延胡索酸后,凡纳滨对虾的肠道内容物物种丰度与正对照组相似。

图1 凡纳滨对虾肠道内容物基于门水平的菌群组成
Fig.1 Composition of microflora in the intestinal contents of Pacific white leg shrimp Litopenaeus vannamei on phylum level
2.4.2 基于科水平的菌群结构分析 各组肠道内容物菌群结构在科水平上的组成如图2所示,丰度超过0.25%的菌科有15个,其中,主要优势种有软骨杆菌科Chthoniobacterales、扁平菌科Planctomycetaceae、红杆菌科Rhodobacteraceae、肠杆菌科Enterobacteriaceae、长颈菜科Golenkinia longispicula和希氏藻科Shewanellaceae等。

图2 凡纳滨对虾肠道内容物基于科水平的菌群组成
Fig.2 Composition of the microflora in intestinal contents of Pacific white leg shrimp micro florain Litopenaeus vannamei on family level
2.5 凡纳滨对虾肠道内容物菌群差异性分析
2.5.1 肠道内容物菌群相对丰度分布 用相对丰度的常用对数(logarithm of relative abundance,LDA)值统计不同组别中有显著作用的微生物类群,柱状图长度代表显著差异物种的影响大小。如图3所示,肠杆菌科在正对照组中显著上调,漆草科Lachnospiraceae和未培养细菌unculturedbacterium在负对照组中显著上调,双歧杆菌科Bifidobacteriaceae在柠檬酸钠组中显著上调,梭杆菌科Fusobacteriaceae在丁酸钠组中显著上调,0319_6G20菌科在丙酸钠组中显著上调,类杆菌目Bacteroidales在延胡索酸组中显著上调。这表明,添加不同的有机酸影响肠道菌群不同种类的丰度。

图3 不同处理组对虾肠道内容物显著差异菌群相对丰度
Fig.3 Relative abundance of the significantly different microflora in the intestinal contents of Pacific white leg shrimp Litopenaeus vannamei in different treatment groups
2.5.2 在科水平上不同组的显著差异菌群相对丰度比较 从表6可见:丁酸钠组的梭杆菌科相对丰度高于其他组,但各组间无显著性差异(P>0.05);柠檬酸钠组的双歧杆菌科和类杆菌科相对丰度最高,且显著高于其他组(P<0.05);正对照组的肠杆菌科相对丰度最高,柠檬酸钠组次之;负对照组的漆草科相对丰度分布最高,其次是柠檬酸钠组。由此可见,添加0.3%柠檬酸钠提高了肠杆菌、双歧杆菌、类杆菌的组内相对丰度,添加0.3%丁酸钠提高了梭杆菌的相对丰度。
表6 豆粕替代鱼粉并添加有机酸对凡纳滨对虾肠道内容物显著差异菌群科水平相对丰度的影响
Tab.6 Effects of fish meal replaced by soybean meal and supplemented with different organic acids on the bacterial relative abundance in the significantly different microflora in the intestinal contents in Pacific white leg shrimp Litopenaeus vannamei on family level

组别group肠杆菌科Enterobacteriaceae漆草科Lachnospiraceae双歧杆菌科Bifidobacteriaceae梭杆菌科Fusobacteriaceae0319-6G20菌科0319-6G20类杆菌目Bacteroidales正对照positivecontrol0.1141±0.14630.0005±0.0003abc0.0002±0.0001bc0.0003±0.00010.0001±0.0000b0.0003±0.0002b负对照negativecontrol0.0114±0.00480.0014±0.0005a0.0008±0.0005ab0.0007±0.00000.0001±0.0000b0.0011±0.0009ab柠檬酸钠sodiumcitrate0.0472±0.02220.0013±0.0011ab0.0011±0.0006a0.0002±0.00010.0000±0.0000b0.0017±0.0014a丁酸钠sodiumbutyrate0.0033±0.00080.0003±0.0001bc0.0001±0.0001c0.0019±0.00140.0002±0.0001a0.0004±0.0001b丙酸钠sodiumpropionate0.0073±0.00510.0001±0.0001c0.0001±0.0001c0.0013±0.00090.0002±0.0001a0.0003±0.0000b延胡索酸fumaricacid0.0053±0.00190.0004±0.0004bc0.0003±0.0003bc0.0013±0.00160.0001±0.0000b0.0006±0.0000ab
2.5.3 Dadogram进化分支图 Lefse进化分支图如图4所示,其中,由内至外辐射的圆圈代表了由门至属的分类级别。在不同分类级别上的每一个小圆圈代表该水平下的一个分类,小圆圈直径大小与相对丰度大小成正比。无显著性差异的物种统一着色为黄色,差异物种跟随组进行着色,红色节点表示在红色组别中起到重要作用的微生物类群,绿色节点表示在绿色组别中起到重要作用的微生物类群,其他圈颜色意义类同。结果显示,肠杆菌在正对照组发生富集,JG35_K1_AG5和漆草科菌在负对照组发生富集,双歧杆菌在柠檬酸钠组发生富集,梭杆菌在丁酸钠组发生富集,0319_6G20菌科在丙酸钠组发生富集,类杆菌在延胡索酸组发生富集,这与图3显示结果一致。

图4 从门到属的Lefse进化分支图
Fig. 4 Lefse evolutionary branch diagram from phylum to genus
3 讨论
3.1 饲料中添加有机酸对凡纳滨对虾生长性能的影响
有机酸在水产动物养殖饲料中起着诱食剂的作用,在鱼虾类饲料中添加有机酸能够促进鱼虾摄食,促进水产动物生长[1]。本试验中发现,与正对照组(高鱼粉组)相比,负对照组(低鱼粉组)凡纳滨对虾的生长受到了抑制,而在负对照组基础上添加0.3%柠檬酸和0.3%丁酸钠后,凡纳滨对虾的特定生长率和增重率均较负对照组显著升高,饲料系数显著降低,且与高鱼粉的正对照组相比,0.3%丁酸钠组凡纳滨对虾也体现出了生长优势。这表明,柠檬酸和丁酸钠能够缓解高豆粕对凡纳滨对虾带来的生长抑制,并有效促进其生长。与此相似,Liu等[12]研究表明,丁酸钠不仅能改善鱼类生长性能,增加肠道吸收面积,而且能减轻固有层混合白细胞的浸润,证明有机酸对鱼类肠道免受豆粕的损伤有积极作用,从而促进鱼类生长。齐鑫等[13]、孙浪等[14]、张晓晓等[15]分别在鲟、湘云鲫、凡纳滨对虾饲料中添加丁酸钠也出现相似结果。栗雄高[1]、潘庆等[16]、Sarker 等[17]和 Khajepour等[18]则在凡纳滨对虾、罗非鱼、鲷和达氏鳇饲料中添加柠檬酸同样出现相似结果。相关研究表明,延胡索酸(又称富马酸)也可作为饲料添加剂,张玲等[19]发现,添加0.6%以柠檬酸、磷酸、富马酸为主要成分的酸化剂可显著提高草鱼特定生长率,降低饲料系数。本试验中,低鱼粉饲料中添加0.3%丙酸钠和延胡索酸,凡纳滨对虾的生长性能与负对照组无显著性差异,这与石泽[20]在无鱼粉饲料中添加富马酸后对建鲤的生长性能、营养物质与粗蛋白质消化率无显著性影响的结果一致,潘庆等[21]对罗非鱼的研究中也得出相似结果。而Bjerkeng 等[22]则报道饲料中添加乙酸钠、丙酸钠和丁酸钠的混合物对大西洋鲑生长性能无显著影响。研究结果出现差异的原因,可能是由于添加有机酸盐水平或者动物种类不同,饲粮蛋白质含量不同,酸的结合力就不同,消耗有机酸盐的量也不同。
3.2 饲料中添加有机酸对凡纳滨对虾血清抗氧化及免疫指标的影响
凡纳滨对虾主要依靠非特异免疫系统防御病害因子,其中,最重要的免疫应答因子有ACP、AKP、LSZ[6]。LSZ有杀菌、抗炎、抗病毒等作用,MDA是脂质过氧化与氧化损伤最重要的产物[23-24],其含量反映了生物体的脂质过氧化水平,其含量降低代表机体抗氧能力的提高[24]。SOD对机体的氧化与抗氧化平衡起着至关重要的作用。SOD和MDA都是表现机体抗氧化能力的重要指标。Zhu等[25]研究发现,在植物蛋白源饲料中补充有机酸,能显著降低黄鲇血清SOD和CAT活性以及肝脏中CAT活性,这表明,有机酸能保护鱼体免受植物蛋白源引起的氧化损伤。本试验中,负对照组对虾血清ACP、AKP、SOD、LSZ活性较正对照组均显著降低,MDA含量显著升高,说明在饲料中添加过高含量的豆粕会降低凡纳滨对虾的非特异性免疫应答,同时降低对虾机体的抗氧化能力,造成对虾免疫系统的失衡,从而影响对虾的生长与免疫能力,这与段晶等[26]的研究结果一致。本试验中,在负对照组饲料基础上添加0.3%柠檬酸钠和0.3%丁酸钠后,ACP、AKP、SOD、LSZ活性较负对照组均有升高,MDA含量降低,基本达到正对照组的水平,添加0.3%丙酸钠后,MDA含量较负对照组显著降低,甚至达到正对照组水平。这表明,在饲料中添加有机酸能够延缓饲料的氧化,减少水产饲料的浪费,且能缓解豆粕对凡纳滨对虾造成的机体损伤,降低因豆粕替代引起的MDA含量的增加,从而提高其抗氧化的能力和免疫功能,这与尚卫敏等[10]、石泽[20]、张晓晓等[15]研究结果一致。
3.3 饲料中添加有机酸对凡纳滨对虾肠道内容物微生物菌群的影响
肠道内容物菌群与对虾肠道健康有着密切的关系。本试验中,在负对照组中添加0.3%柠檬酸钠和0.3%丁酸钠,肠道内容物菌群的物种丰富度和多样性与正对照组最相似,但添加0.3%丙酸钠和0.3%延胡索酸物种丰富度及物种多样性与负对照组接近。同时,柠檬酸钠组和丁酸钠组的饲料pH与正对照组最接近,丙酸钠组的饲料pH较正对照组偏高,而延胡索酸组的饲料pH相比于正对照组偏低。这说明肠道内容物的菌群丰富度与多样性可能与饲料pH有关。石泽[20]研究发现,在饲料中添加有机酸盐可造成饲料中pH在一定程度上有所降低,同时研究发现,只有柠檬酸组的建鲤在摄食0.5 h后前肠食糜pH有降低的趋势。而Su等[27]研究发现,在凡纳滨对虾饲料中添加0.25%~0.30%的柠檬酸能提高肠道消化酶活性,从而改善其生长性能。这表明,饲料pH可以影响肠道内容物的pH,通过激活蛋白酶影响肠道内容物的菌群变化,影响对虾肠道对营养物质的吸收,从而影响对虾的生长,Gao等[28]的研究结果中也证实了有机酸对肠道菌群平衡具有积极作用。
有机酸还可以促进肠道有益菌群的增殖,抑制有害菌的繁殖,进而提高免疫能力。研究表明,有机酸和挥发油混合物对肠道菌群有较好的影响,可提高太平洋对虾的免疫应答和抗病性[29]。本试验中,各组在门水平上的菌群主要由变形菌门、蓝藻门、放线菌门、疣微菌门、浮酶菌门、厚壁菌门组成,这与吴金凤等[30]、李可等[31]的研究结果一致,证明凡纳滨对虾肠道内容物菌群组成具有一定的保守性,蓝藻门的丰度偏高可能是由于饲养环境为室外水体,对虾的摄食并不完全来自养殖饲料,对虾摄食水体中的藻类,使得对虾肠道内容物的多样性增高。本试验中发现,饲料中添加过高水平的豆粕降低了放线菌的丰度,在低鱼粉水平下添加0.3%柠檬酸钠后提高了放线菌的丰度,科水平上双歧杆菌和类杆菌在柠檬酸钠组发生富集且显著高于正对照组,表明柠檬酸钠促进双歧杆菌和类杆菌的增长,这与王丽娜等[24]的研究结果一致,说明柠檬酸钠有利于双歧杆菌和乳酸菌等有益菌的繁殖增长,对大肠杆菌和沙门菌属等有害菌具有抑制作用;梭杆菌在丁酸钠组发生富集,其次是丙酸钠组和延胡索酸组,表明丁酸钠促进梭杆菌的增殖,同时也表明添加不同的有机酸会影响肠道不同种类菌群的丰度,这与曾晨爔等[23]的研究结果相符;根瘤菌依附于植物生长,在负对照组漆草科和根瘤菌显著高于其他组,可能与负对照组中的蓝藻门数量高有关。本试验中,肠道菌群的结果与生长、免疫方面的结果体现了一致性,低鱼粉饲料中添加柠檬酸钠和丁酸钠后不仅可以促进凡纳滨对虾生长、提高抗病力,还可以调节肠道菌群的平衡。
4 结论
1)本试验条件下,高比例豆粕替代鱼粉后,凡纳滨对虾生长受到抑制,免疫力降低,优势菌群丰度下降,尤其以放线菌门最为突出。
2)高比例豆粕替代鱼粉并添加有机酸后,凡纳滨对虾生长、免疫力得到了不同程度的提高,并能改善肠道菌群的平衡。综合分析,4种有机酸中以丁酸钠和柠檬酸钠添加效果最佳。
[1] 粟雄高.柠檬酸和微生态制剂对凡纳滨对虾生长、消化酶活性和免疫性能的影响[D].上海:上海海洋大学,2012.
LI X G.Effects of citric acid and microecologics on growth performance,digestive enzyme activity and immunity of white shrimp,Litopenaeus vannamei[D].Shanghai:Shanghai Ocean University,2012.(in Chinese)
[2] KIRON V.Fish immune system and its nutritional modulation for preventive health care[J].Animal Feed Science and Technology,2012,173(1/2):111-133.
[3] BAEVERFJORD G,KROGDAHL A.Development and regression of soybean meal induced enteritis in Atlantic salmon,Salmo salar L.,distal intestine:a comparison with the intestines of fasted fish[J].Journal of Fish Diseases,1996,19(5):375-387.
[4] HEDRERA M I,GALDAMES J A,JIMENEZ-REYES M F,et al.Soybean meal induces intestinal inflammation in zebrafish larvae[J].PLoS One,2013,8(7):e69983.
[5] CUVIN-ARALAR M L A,LUCKSTAEDT C,SCHROEDER K,et al.Effect of dietary organic acid salts,potassium diformate and sodium diformate on the growth performance of male Nile tilapia Oreochromis niloticus[J].Bulletin of Fish Biology,2011,13(1/2):33-40.
[6] 胡丹,韩庆,徐金石,等.有机酸在水产养殖中的应用[J].现代农业科技,2018(17):222-224.
HU D,HAN Q,XU J S,et al.Application of organic acids in aquaclture[J].Xiandai Nongye Keji,2018(17):222-224.(in Chinese)
[7] 罗玲,易德玮,杨坤明,等.饲料中添加微囊丁酸钠对高密度养殖条件下团头鲂生长性能、非特异性免疫力及肝功能的影响[J].动物营养学报,2018,30(7):2865-2871.
LUO L,YI D W,YANG K M,et al.Effects of microencapsulated sodium butyrate on growth performance,nonspecific immunity and hepatic function of blunt snout bream under high density culture condition[J].Chinese Journal of Animal Nutrition,2018,30(7):2865-2871.(in Chinese)
[8] 魏朝青,周慧慧,王璇,等.高植物蛋白质饲料中添加丁酸钠对大菱鲆幼鱼生长性能、营养物质表观消化率及肝脏抗氧化功能的影响[J].动物营养学报,2017,29(9):3392-3402.
WEI C Q,ZHOU H H,WANG X,et al.Effects of adding different levels of sodium butyrate in high plant protein diets on growth performance,nutrient apparent digestibility coefficients and liver antioxidant function of juvenile turbot(Scophthalmus maximus L.)[J].Chinese Journal of Animal Nutrition,2017,29(9):3392-3402.(in Chinese)
[9] 林雪,段静娜,赵玉蓉,等.不同组成酸化剂对罗非鱼生长性能和抗氧化及肝脏代谢酶活性的影响[J].饲料工业,2019,40(8):51-55.
LIN X,DUAN J N,ZHAO Y R,et al.Effects of different composition of acidifier on growth performance and antioxidant capacity and hepatic metabolic enzymes activity of tilapia[J].Feed Industry,2019,40(8):51-55.(in Chinese)
[10] 尚卫敏,朱根廷,陈任孝,等.酸化剂对草鱼生长和非特异性免疫能力的影响[J].淡水渔业,2011,41(5):56-61.
SHANG W M,ZHU G T,CHEN R X,et al.Effects of acidifiers on the growth performance and non-specific immunity of Ctenopharyngodon idellus[J].Freshwater Fisheries,2011,41(5):56-61.(in Chinese)
[11] RINGØ E.Effects of dietary lactate and propionate on growth and digesta in Arctic charr,Salvelinus alpinus (L.)[J].Aquaculture,1991,96(3/4):321-333.
[12] LIU Y,CHEN Z C,DAI J H,et al.Sodium butyrate supplementation in high-soybean meal diets for turbot (Scophthalmus maximus L.):effects on inflammatory status,mucosal barriers and microbiota in the intestine[J].Fish & Shellfish Immunology,2019,88:65-75.
[13] 齐鑫,陈永光,张燕,等.丁酸钠对鲟鱼幼鱼摄食及生长的影响[J].河北渔业,2019(9):14-15,20.
QI X,CHEN Y G,ZHANG Y,et al.Effects of sodium butyrate on growth performance of the juvenile sturgeon Acipenser baeri[J].Hebei Fisheries,2019(9):14-15,20.(in Chinese)
[14] 孙浪,刘臻,郝光,等.丁酸钠对湘云鲫蛋白质代谢及其相关基因表达的影响[J].动物营养学报,2013,25(11):2775-2782.
SUN L,LIU Z,HAO G,et al.Effects of sodium butyrate on protein metabolism and its related gene expression of triploid crucian carp(Carassius auratus tripl)[J].Chinese Journal of Animal Nutrition,2013,25(11):2775-2782.(in Chinese)
[15] 张晓晓,汪多,田相利,等.包膜丁酸钠对凡纳滨对虾生长和血清非特异性免疫酶活性的影响[J].中国海洋大学学报,2017,47(sup 1):27-34.
ZHANG X X,WANG D,TIAN X L,et al.Effects of coated sodium butyrate on growth performance and serum non-specific immunity enzymes of Litopenaeus vannamei[J].Periodical of Ocean University of China,2017,47(sup 1):27-34.(in Chinese)
[16] 潘庆,谭永刚,毕英佐,等.柠檬酸对罗非鱼生长、体成分和消化酶活性的影响[J].中国水产科学,2004,11(4):344-348.
PAN Q,TAN Y G,BI Y Z,et al.Effects of citric acid on growth,whole body composition and activities of digestive enzymes in hybrid tilapia Oreochromis niloticus×O.aureus[J].Journal of Fishery Sciences of China,2004,11(4):344-348.(in Chinese)
[17] SARKER S A,SATOH S,KIRON V.Supplementation of citric acid and amino acid-chelated trace element to develop environment-friendly feed for red sea bream,Pagrus major[J].Aquaculture,2005,248(1/2/3/4):3-11.
[18] KHAJEPOUR F,HOSSEINI S A.Citric acid improves growth performance and phosphorus digestibility in Beluga (Huso huso) fed diets where soybean meal partly replaced fish meal[J].Animal Feed Science and Technology,2012,171(1):68-73.
[19] 张玲,张卫东,赵德福,等.酸化剂在草鱼饲料中的应用效果研究总结[J].河南水产,2017(6):12-13.
ZHANG L,ZHANG W D,ZHAO D F,et al.Research summary about application effect of acidifier in feed of the grass carp[J].Henan Shuichan,2017(6):12-13.(in Chinese)
[20] 石泽.蛋白酶、有机酸对异育银鲫(Carassius auratus gibelio)和建鲤(Cyprinus carpio var.Jian)生长、营养物质利用率的影响[D].上海:上海海洋大学,2016.
SHI Z.Effects of proteases and organic acids on the growth and nutrient utilization of allogynogenetic silver crucian carp (Carassius auratus gibelio) and Jian carp (Cyprinus carpio var.Jian)[D].Shanghai:Shanghai Ocean University,2016.(in Chinese)
[21] 潘庆,谭永刚,毕英佐,等.酸制剂对罗非鱼生长和饲料利用的影响[J].水产学报,2004,28(6):682-688.
PAN Q,TAN Y G,BI Y Z,et al.Effects of acid supplements on growth and feed utilization in tilapia Oreochromis niloticus×O.aureus[J].Journal of Fishries China,2004,28(6):682-688.(in Chinese)
[22] BJERKENG B,STOREBAKKEN T,WATHNE E.Cholesterol and short-chain fatty acids in diets for Atlantic salmon Salmo salar (L.):effects on growth,organ indices,macronutrient digestibility,and fatty acid composition[J].Aquaculture Nutrition,1999,5(3):181-191.
[23] 曾晨爔,林茂,李忠琴,等.基于16S rRNA基因扩增子测序分析日本囊对虾肠道菌群结构与功能的特征[J].微生物学通报,2020,47(6):1857-1866.
ZENG C X,LIN M,LI Z Q,et al.The structural and functional characteristics of the gut microbiota of Marsupenaeus japonicus as revealed by 16S rRNA gene amplicon sequencing[J].Microbiology China,2020,47(6):1857-1866.(in Chinese)
[24] 王丽娜,高飞,朱晓彤,等.不同有机酸对断奶仔猪肠道厌氧培养微生物菌群的影响[J].华南农业大学学报,2015,36(6):9-14.
WANG L N,GAO F,ZHU X T,et al.Effects of different organic acids on anaerobically cultured intestinal microflora in weaned piglets[J].Journal of South China Agricultural University,2015,36(6):9-14.(in Chinese)
[25] ZHU Y,DING Q L,CHAN J,et al.The effects of concurrent supplementation of dietary phytase,citric acid and vitamin D3 on growth and mineral utilization in juvenile yellow catfish Pelteobagrus fulvidraco[J].Aquaculture,2015,436:143-150.
[26] 段晶,吴莉芳,王婧瑶,等.不同大豆蛋白源替代鱼粉对洛氏鱥生长、非特异性免疫及蛋白质代谢酶活力的影响[J].大连海洋大学学报,2019,34(6):804-810.
DUAN J,WU F L,WANG J Y,et al.Effects of replacing fish meal with different soybean proteins on growth performance,non-specific immune indices and protein metabolism in Rhynchocypris lagowskii Dybowski[J].Journal of Dalian Ocean University,2019,34(6):804-810.(in Chinese)
[27] SU X G,LI X Q,LENG X J,et al.The improvement of growth,digestive enzyme activity and disease resistance of white shrimp by the dietary citric acid[J].Aquaculture International,2014,22(6):1823-1835.
[28] GAO Y,HE J,HE Z L,et al.Effects of fulvic acid on growth performance and intestinal health of juvenile loach Paramisgurnus dabryanus (Sauvage)[J].Fish & Shellfish Immunology,2017,62:47-56.
[29] HE W Q,RAHIMNEJAD S,WANG L,et al.Effects of organic acids and essential oils blend on growth,gut microbiota,immune response and disease resistance of Pacific white shrimp (Litopenaeus vannamei) against Vibrio parahaemolyticus[J].Fish & Shellfish Immunology,2017,70:164-173.
[30] 吴金凤,熊金波,王欣,等.肠道菌群对凡纳滨对虾健康的指示作用[J].应用生态学报,2016,27(2):611-621.
WU J F,XIONG J B,WANG X,et al.Intestinal bacterial community is indicative for the healthy status of Litopenaeus vannamei[J].Chinese Journal of Applied Ecology,2016,27(2):611-621.(in Chinese)
[31] 李可,郑天凌,田蕴,等.南美白对虾肠道微生物群落的分子分析[J].微生物学报,2007,47(4):649-653.
LI K,ZHENG T L,TIAN Y,et al.Bacterial community structure in intestine of the white shrimp,Litopenaeus vannamei[J].Acta Microbiologica Sinica,2007,47(4):649-653.(in Chinese)