大口黑鲈Micropterus salmoides又称加州鲈,原产于美国加利福尼亚州密西西比河水系,中国台湾于20世纪70年代引进,并于1983年人工繁殖获得成功,经过30多年的发展,目前大口黑鲈已成为国内特色淡水鱼品种之一,具有广阔的市场前景。大口黑鲈性成熟年龄为1龄以上,性腺1年成熟一次,且多次产卵,产卵季节为2—7月[1]。2019年,华南和华东地区春天天气较为异常,雨水较多,受天气、虫害、疾病等因素的影响,大口黑鲈苗期损耗较往年严重,后期苗种补给需求量较大[2],因此,开展大口黑鲈延后繁育技术研究、提高仔鱼成活率迫在眉睫。
研究发现,温度[3-4]、光周期[5-6]、养殖密度、盐度[4]均能显著影响水产动物的性腺发育,如低温可延缓水产动物的性腺发育,在饲料中添加维生素A、C、E[7]、中草药[8]、益生菌[9]等添加剂均可提高水产动物的繁殖性能。然而,目前益生菌在水产动物繁殖中的应用主要集中在斑马鱼Danio rerio[10-11]、南美白对虾Litopenaeus vannamei[12]、观赏鱼[9,13]等,有关复合益生菌在可食用鱼类繁养殖方面的研究较少。为此,本试验中通过降低水温延缓卵巢发育,开展了不同水平复合益生菌对大口黑鲈延后繁殖性能、生理指标及仔鱼成活率影响的研究,以期为大口黑鲈亲鱼保卵(即延后繁育)提供一定的技术指导,同时也为常年进行大口黑鲈繁育提供可能,以利于维持大口黑鲈市场价格稳定。
1 材料与方法
1.1 材料
试验用鱼取自天津蓝科水产养殖有限公司自行培育的1冬龄大口黑鲈亲鱼,挑选体格健壮、无伤病的亲鱼300尾(雌雄各150尾),其中雌鱼体质量为550~665 g,雄鱼体质量为500~573 g,雌鱼性腺分期在Ⅳ期初。
复合益生菌制剂由酵母菌Saccharomyces、乳酸菌Lactobacillus、芽孢杆菌Bacillus subtilis subsp等多种益生菌及其代谢物复配而成,活菌总数≥2×1010 CFU/g,购自洛阳欧科拜克生物技术股份有限公司。注射用促黄体素释放激素A2(LHR-A2)、多潘立酮(DOM)、绒促性腺素(Ⅰ)(HCG)购自宁波三生生物科技有限公司。
1.2 方法
1.2.1 试验设计 2020年7月初,将经过暂养的150组亲鱼随机平均分配到15个养殖池(5.0 m×2.7 m×1.0 m)中,雌雄鱼分别用隔网隔开。试验共分5组,每组设3个平行。试验用饲料以大口黑鲈专用配合饲料为基础饲料,其营养成分见表1。在基础饲料中分别添加0、0.1%、0.3%、0.5%、0.7%(均为质量分数,下同)的复合益生菌制剂,制得5组试验饲料。
表1 基础饲料营养成分含量
Tab.1 Nutrient composition content of basic diet
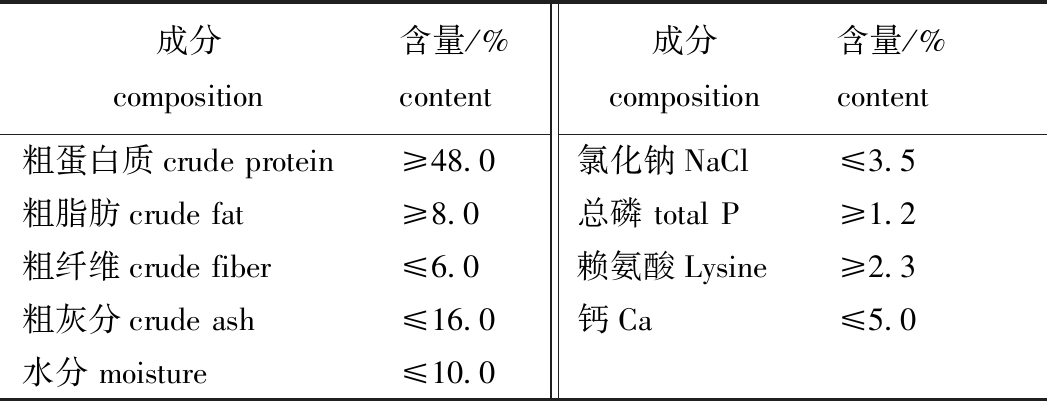
成分composition含量/%content成分composition含量/%content粗蛋白质crudeprotein≥48.0氯化钠NaCl≤3.5粗脂肪crudefat≥8.0总磷totalP≥1.2粗纤维crudefiber≤6.0赖氨酸Lysine≥2.3粗灰分crudeash≤16.0钙Ca≤5.0水分moisture≤10.0
亲鱼培育期间,水温控制在17.5 ℃以下,溶解氧(DO)≥5 mg/L,在车间内自然光照下养殖(顶部面积遮光5/6);每日于9:00~10:00、14:00~15:00各投喂一次,日投喂量为鱼体质量的0.5%,具体投喂量根据天气及亲鱼摄食情况做调整;每日换水1/3,具体根据水温、水质情况做调整;试验周期为30 d。
亲鱼在17.5 ℃以下培育30 d后,通过增减顶部光照面积调节水温,3 d内水温升至21.5~22.5 ℃。采用一针注射法对亲鱼胸鳍基部进行激素注射,雌鱼注射剂量DOM为5 mg/kg,LRH-A2为5 μg/kg,HCG为1 500 IU/kg,雄鱼注射剂量减半。催产完成后,将水位由原来的70 cm调至45~50 cm,将各养殖池中隔网撤出,池底每平方米放置1个产卵框(经过处理的棕榈片用铁丝固定在框上),池内雌雄鱼随机交配,自然产卵。催产完成后,隔天开始产卵,于每日9:00、16:00查看产卵情况,及时将产卵棕片放入孵化池中孵化。孵化用水为曝气24 h的地下井水,孵化水温控制在23~24 ℃,DO为7.0~8.5 mg/L。记录产卵开始后5 d内的产卵量(每个棕片上的卵粒数)、受精率,以及对应的孵化率、仔鱼成活率。
1.2.2 样品采集与分析 亲鱼在17.5 ℃以下培育30 d后,停喂24 h,从每个养殖池随机选取4尾亲鱼(雌雄各2尾),麻醉后称量其体质量,用1 mL无菌注射器(注射器用1%的肝素钠溶液润洗)从尾静脉采血,转移至2 mL离心管中,在4 ℃下以3 000 g 离心5 min,取上清液放入干净离心管中,置于冰水混合物中保存备用。解剖并取出雌鱼肝脏置于保鲜自封袋内,于冰水混合物中保存备用。取出性腺,称重,并统计卵巢中卵粒数。棕榈片挂卵后,标记并记录卵粒总数及未受精卵粒数(白色死卵计为未受精卵)。待孵化破膜后,移出棕榈片,统计初孵仔鱼数量,并计算孵化率。仔鱼平游后统计仔鱼数量,计算平游后仔鱼成活率。待产卵结束后,即连续一周未产卵后,每个养殖池随机选取2尾雌鱼,按照上述方法取肝脏组织,于冰水混合物中保存备用。
1.2.3 指标测定与计算 相关指标计算公式为
性腺指数=性腺质量(g)/鱼体质量(g)×100%,
怀卵量=单位质量卵巢内的卵粒数(eggs/g)×
卵巢质量(g),
受精率=(1-未受精卵粒数/卵粒总数)×100%,
孵化率=(初孵仔鱼数/受精卵数)×100%,
仔鱼成活率=平游仔鱼数/初孵仔鱼数×100%。
产卵前后雌鱼肝脏组织酸性磷酸酶(ACP)、碱性磷酸酶(AKP)活力测定试剂盒均由北京索莱宝科技有限公司提供,产卵前雌鱼肝脏组织和血浆中总超氧化物歧化酶(T-SOD)活力测定试剂盒由南京建成生物工程研究所提供,严格按照说明书进行测定,每个样品设3个平行。
1.3 数据处理
试验数据均采用平均值±标准差(mean±S.D.)表示,采用 SPSS Statistics 20软件进行单因素方差分析(One-way ANOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同水平复合益生菌下大口黑鲈的繁殖性能
从表2可见:在进行大口黑鲈延后繁育即亲鱼强化培育期间,亲鱼未出现死亡;雌鱼的性腺指数、怀卵量、相对怀卵量随着饲料中复合益生菌添加水平的增加逐渐增大,并于0.5%水平时达到峰值;亲鱼的性腺指数、怀卵量、相对怀卵量在各试验组间均无显著性差异(P>0.05)。
表2 不同水平复合益生菌对大口黑鲈繁殖性能的影响
Tab.2 Effects of different levels of compound probiotics on reproductive performance of largemouth bass Micropterus salmoides

益生菌添加量/%levelofcompoundprobiotics雌雄鱼成活率/%survivalrateofmaleandfemale雌鱼性腺指数/%femalegonadosomaticindex雄鱼性腺指数/%malegonadosomaticindex怀卵量/(104eggs)fecundity相对怀卵量/(egg·g-1)relativefecundity01004.38±1.130.58±0.143.82±0.6254.99±7.580.11004.34±0.510.47±0.074.33±0.8375.79±14.560.31005.18±0.520.68±0.234.91±1.4478.33±22.710.51005.23±0.030.50±0.055.52±1.1378.45±17.360.71004.29±1.790.54±0.154.07±1.0064.38±12.26
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母或无标注者表示组间无显著性差异(P>0.05),下同。
Note: The means with different letters within the same column are significantly different at the 0.05 probability level, and the means with the same letter or no letter within the same column are not significant differences, et sequentia.
2.2 产卵前后雌鱼肝脏中AKP、ACP活力的变化
从图1可见:产卵前,雌鱼肝脏中AKP活力随饲料中复合益生菌添加量的增加逐渐增强,添加量为0.5%时AKP活力达到峰值,0.3%、0.5%添加组雌鱼肝脏中AKP活力显著高于其他组(P<0.05);产卵后,不同试验组雌鱼肝脏中AKP活力均显著低于产卵前(P<0.05),其中0.3%添加组雌鱼肝脏中AKP活力显著高于其他组(P<0.05)。

注:标有不同字母者表示同一发育阶段或组织不同益生菌添加量组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters in the same development stage or tissue are significantly different in between compound probiotics groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.
图1 产卵前后不同试验组雌鱼肝脏中AKP活力的变化
Fig.1 Changes in AKP activity in liver of female in different experimental groups before and after spawning
从图2可见:产卵前,雌鱼肝脏中ACP活力随饲料中复合益生菌添加量的增加而逐渐增强,添加量为0.5%时达到峰值;产卵后,不同试验组雌鱼肝脏中ACP活力均显著低于产前(P<0.05)。0.5%、0.7%添加组雌鱼肝脏ACP活力随着饲料中复合益生菌添加量的增多而显著降低(P<0.05)。

图2 产卵前后不同试验组雌鱼肝脏中ACP活力的变化
Fig.2 Changes in ACP activity in liver of female in different experimental groups before and after spawning
2.3 产卵前雌鱼肝脏和血浆中T-SOD活力的变化
从图3可见:产卵前,不同试验组雌鱼肝脏中T-SOD活力无显著性差异(P>0.05),其中,0.7%添加组内差异较大;血浆中T-SOD活力随复合益生菌添加量的增加而逐渐增强,添加量为0.5%时达到峰值,0.3%、0.5%添加组T-SOD活力显著高于其他组(P<0.05)。
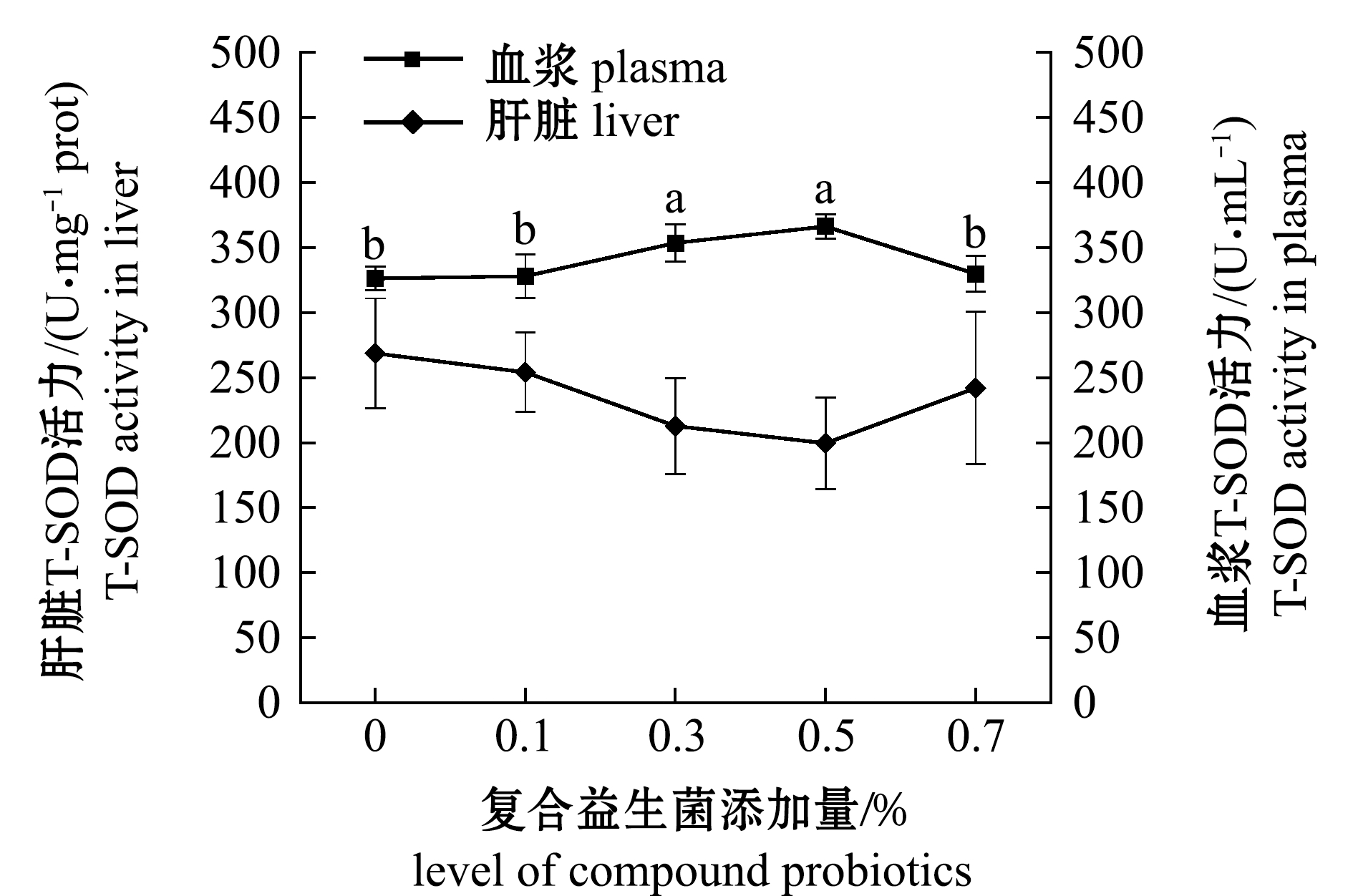
图3 产卵前不同试验组雌鱼肝脏和血浆中T-SOD活力变化
Fig.3 Changes in T-SOD activity in liver and plasma of female in different experimental groups before spawning
2.4 不同水平复合益生菌对受精率、孵化率、仔鱼成活率的影响
从表3可见:0.3%、0.5%添加组第一批产卵量、受精率、孵化率、仔鱼成活率均高于其他组,不同组间产卵量、受精率、孵化率无显著性差异(P>0.05),仅0.5%添加组仔鱼成活率显著高于对照组和0.1%添加组(P<0.05)。
表3 不同水平复合益生菌对大口黑鲈受精率、孵化率、仔鱼成活率的影响
Tab.3 Effects of different levels of compound probiotics on fertilization rate, hatching rate and larval survival rate of largemouth bass Micropterus salmoides
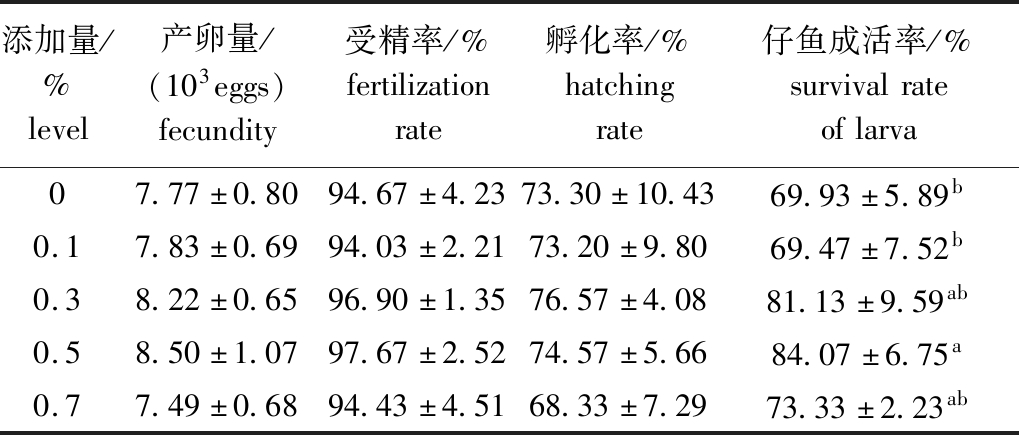
添加量/%level产卵量/(103eggs)fecundity受精率/%fertilizationrate孵化率/%hatchingrate仔鱼成活率/%survivalrateoflarva07.77±0.8094.67±4.2373.30±10.4369.93±5.89b0.17.83±0.6994.03±2.2173.20±9.8069.47±7.52b0.38.22±0.6596.90±1.3576.57±4.0881.13±9.59ab0.58.50±1.0797.67±2.5274.57±5.6684.07±6.75a0.77.49±0.6894.43±4.5168.33±7.2973.33±2.23ab
3 讨论
3.1 复合益生菌对大口黑鲈延后繁殖性能的影响
研究发现,饲料中添加适量益生菌可显著提高水产动物的性腺指数、怀卵量[9-13]。本研究中,雌鱼的性腺指数、怀卵量、相对怀卵量随饲料中复合益生菌添加量的增加逐渐增大,并于0.5%水平时达到峰值,这与Ghosh等[13]的研究结果一致,该研究在鲤Cyprinus carpio的肠道中分离出枯草芽孢杆菌Bacillus subtilis,配制出4种不同浓度的配合饲料进行投喂,养殖周期1年,结果表明,该益生菌具有较好的抗菌活性,添加适量的枯草芽孢杆菌可显著改善孔雀鱼Poecilia reticulate、墨西哥莫利鱼Poecilia sphenops、绿色剑尾鱼Xiphophorus helleri和南方鸭嘴鱼Xiphophorus maculates的性腺指数及雌鱼繁殖力,然而亲鱼的繁殖性能对枯草芽孢杆菌不存在高浓度依赖性。另外,本研究中试验组间各项繁殖性能指标无显著性差异,分析原因可能有3点:其一,试验开始前已进行亲鱼的挑选工作,亲鱼性腺发育良好,投喂复合益生菌配合饲料意在保卵;其二,复合益生菌配合饲料饲喂周期为30 d,时间较短;其三,物种间存在差异。在生产实践中发现,大口黑鲈延后繁殖试验中雌鱼的性腺指数均低于自然繁育期间的性腺指数,而在饲料中添加适量的复合益生菌可有效提高雌鱼的性腺指数、怀卵量、相对怀卵量,这对大口黑鲈车间内延后繁育工作具有一定的参考价值。
3.2 复合益生菌对大口黑鲈产卵、孵化、仔鱼成活率的影响
大口黑鲈性腺1年成熟一次,且多次产卵,卵质随着批次的后延而变差。为此,本研究中仅采用第一批产出的受精卵统计产卵量、孵化率及仔鱼成活率,结果发现,复合益生菌添加量为0.3%、0.5%时,产卵量、受精率、孵化率和仔鱼成活率均高于其他试验组,其中,仔鱼成活率显著高于空白组与0.1%添加组,这与Abasali等 [14] 的研究结果一致,该研究表明,适量乳酸菌可显著提高子代的成活率,然而对仔鱼的体质量及畸形率无显著性影响。韩丽等[15]研究发现,饲料中添加枯草芽孢杆菌制剂虽不影响母猪繁殖性能,但可增强机体对蛋白质的利用和免疫力,降低仔猪腹泻率。分析其原因,复合益生菌的摄入可改善亲鱼的肠道菌群,并使其发挥积极作用,如降解食物组分,产生适量的维生素B,刺激免疫系统,产生消化酶和保护性酶,从而增强了亲鱼的免疫力[16],同时,维生素B的增加还能降低子代的死亡率[17],这也就解释了适量复合益生菌可提高仔鱼成活率的原因,然而这一观点仍需要进一步验证。此外,本研究中还发现,产卵量、受精率、孵化率、仔鱼成活率的提升对复合益生菌的高含量不存在依赖性,这与Ghosh等 [13]的研究结果一致。生产实践中发现,在饲料中添加适量的复合益生菌可显著提高子代的成活率,这为提升大口黑鲈车间内延后繁育苗种质量提供了一种可能。
3.3 复合益生菌对雌鱼生理指标的影响
磷酸酶在生物体内普遍存在,参与体内多种生理活动。其中,AKP酶参与物质交换、吸收转运,其活性增强标志着动物机体代谢旺盛;ACP是细胞溶解酶体内的水解酶之一,其活性增强往往表明细胞的解体[18]。目前,关于复合益生菌对动物免疫指标AKP、ACP活性的影响研究,主要集中在生长性能方面[19-21],而有关繁殖性能方面的研究较少。
本研究中聚焦于注射激素前亲鱼免疫指标受不同水平复合益生菌的影响程度,研究表明,产卵前不同试验组雌鱼肝脏中AKP、ACP活力均随饲料中复合益生菌添加量的增加(0.1%~0.5%)逐渐增强,当添加量为0.5%时AKP活力达到峰值。这与张崇英等[21]的研究结果一致,该研究表明,添加一定量的复合益生菌可有效提高南美白对虾的ACP和AKP活力。然而同蓝海恩等[19]、刘淑兰等[20]的研究结果不一致。刘淑兰等[20]研究发现,饲料中添加芽孢杆菌、酵母菌等复合益生菌对大西洋鲑Salmo salar肝脏与血清中的AKP活力均无显著性影响;蓝海恩等[19]研究发现,饲料中添加枯草芽孢杆菌、乳酸菌、酵母菌(三者的比例1∶2∶1)制得的复合益生菌,试验组断奶仔猪血液免疫指标AKP显著低于对照组。综合分析以上结论,推测研究结果不一致的原因可能与动物生长阶段、组织功能及复合益生菌菌含量高低有关。
大口黑鲈在同一繁殖周期内分批产卵,其卵母细胞发育不同步。叶泽雄等[22]研究发现,越冬期高背鲫Carassius auratus肝脏处于营养积累阶段,当肝脏营养足够时,性腺进入迅速发育期,此时肝脏因供给性腺发育所需营养而快速收缩到最小。在整个产卵期内,雌鱼亲鱼在肝脏中合成大量的卵黄原蛋白等营养物质,这些营养物质通过血液循环运输到卵巢,促进卵巢的发育成熟[23]。卵巢中的AKP和ACP酶主要位于滤泡细胞内,其活性增强同卵母细胞成熟、排放直接相关。随着卵球的成熟,直到临产前,其活性持续增强。刘梦迪等[24]研究发现,随着银鲳Pampus argenteus卵巢的发育,肝脏中AKP活力呈下降趋势,肝脏中的ACP 活力呈先上升后显著下降的单峰型,银鲳卵巢、肝脏、肌肉中AKP和ACP活力变化表现出协同性,产卵后活力均一直下降。本研究中产卵前不同试验组大口黑鲈雌鱼肝脏中AKP、ACP活力均显著高于产卵后,同样也证实了这一点。
SOD是抗氧化防御系统所必需的酶之一,可作为活性氧清除剂参与清除体内自由基氧离子和过氧化氢分子,从而消除其中间产物对细胞的伤害,并能够增强机体的防御能力和免疫功能[25]。本研究中发现,饲料中添加0.3%、0.5%的复合益生菌制剂时,产卵前雌鱼血浆中T-SOD活力显著高于其他试验组,且不存在高含量依赖性,这与桂琳等[26]、彭涛等[27]的研究结果一致。桂琳等[26]研究发现,复合益生菌(由枯草芽孢杆菌、纳豆芽孢杆菌Bacillus natto、干酪乳杆菌Cactobacillus casei和产朊假丝酵母菌Candidautilis组成)添加量为1 000、2 000 mg/kg时可显著提高草鱼血清中SOD酶活力,但添加量为3 000 mg/kg时,会降低其酶活力。彭涛等[27]研究发现,饲料中添加0.4%的复合益生菌制剂(由植物乳杆菌、酵母菌组成,两者活菌数分别为2.0×106 、1.0×106 CFU/mL)可显著提高舍饲山羊血清T-SOD活力。以上研究结果均说明,在饲料中添加适量的复合益生菌可提高机体抗氧化功能,增强机体的防御能力和免疫功能,减少养殖过程中病害的发生,从而间接提高子代的成活率。
4 结论
1)饲料中添加适量的复合益生菌后,雌鱼的性腺指数、怀卵量和相对怀卵量可随之增大,但无显著性差异,这表明饲料中添加复合益生菌对大口黑鲈亲鱼延后繁殖性能无显著性影响。
2)饲料中添加适量的复合益生菌可显著提高仔鱼的成活率,有效提高第一批产卵量、受精率和孵化率。
3)产卵前雌鱼肝脏中AKP、ACP活力均显著大于产卵后。饲料中添加适量的复合益生菌,可显著增强产卵前雌鱼肝脏中AKP、ACP活力及血浆中T-SOD活力,这表明复合酶益生菌可通过改善亲鱼的肠道菌群,增强亲鱼肝脏中AKP、ACP活力及血浆中T-SOD活力,以提高子代的成活率,这将为复合益生菌在亲鱼延后繁育工作中的使用提供一定的科学参考和数据支撑。
4)综合各项指标,复合益生菌适宜添加量为0.5%。然而,复合益生菌在水产动物繁育工作中的作用机制目前仍是空白,今后需从其他组织生化指标、免疫指标等互作机理方面进行深入探讨。
[1] 常州市水产学会.名优水产品养殖实用新技术——鳜鱼 长吻鮠 异育银鲫 瓦氏黄颡鱼 翘嘴红鲌 加州鲈鱼:上册[M].南京:东南大学出版社,2006:100-121.
Changzhou Society of Fisheries.New practical techniques for the cultivation of famous and high quality aquatic products—Siniperca chuatsi,Leiocassis longirostris,Carassius auratus gibelio,Pelteobagrus vachelli,Erythroculter ilishaeformis and Micropterus salmoides:volume I[M].Nanjing:Southeast University Press,2006:100-121.(in Chinese)
[2] 李晓欣.2019年加州鲈种业观察(下)[EB/OL].[2019-07-10].https://www.sohu.com/a/325881712_120044901.
LI X X.Observation of perch seed industry in 2019 (Part Two) [EB/OL].[2019-07-10].https://www.sohu.com/a/325881712_120044901.(in Chinese)
[3] 李庆华,孙建,李仰真,等.营养强化和控光控温对大菱鲆亲鱼性腺发育及卵子质量的影响[J].南方农业学报,2013,44(6):1030-1035.
LI Q H,SUN J,LI Y Z,et al.Effects of nutrition enhancement,light and temperature control on gonad development and ovum quality in Scophthalmus maximus spawner[J].Journal of Southern Agriculture,2013,44(6):1030-1035.(in Chinese)
[4] 周梦颖.养殖密度、盐度和温度对罗氏沼虾性别分化和早期性腺发育的影响[D].上海:上海海洋大学,2014.
ZHOU M Y.Effect of stocking density,salinity and temperature on sex differentiation and early gonadal development on Macrobrachium rosenbergii[D].Shanghai:Shanghai Ocean University,2014.(in Chinese)
[5] 祝斐,张志勇,徐献明,等.光周期对松江鲈鱼生长和性腺发育影响的初步研究[J].海洋科学,2016,40(9):32-38.
ZHU F,ZHANG Z Y,XU X M,et al.Preliminary study on growth and gonadal development of reared under different photoperiods[J].Marine Sciences,2016,40(9):32-38.(in Chinese)
[6] RODR GUEZ L,BEGTASHI I,ZANUY S,et al.Development and validation of an enzyme immunoassay for testosterone:effects of photoperiod on plasma testosterone levels and gonadal development in male sea bass(Dicentrarchus labrax L.) at puberty[J].Fish Physiology and Biochemistry,2000,23(2):141-150.
GUEZ L,BEGTASHI I,ZANUY S,et al.Development and validation of an enzyme immunoassay for testosterone:effects of photoperiod on plasma testosterone levels and gonadal development in male sea bass(Dicentrarchus labrax L.) at puberty[J].Fish Physiology and Biochemistry,2000,23(2):141-150.
[7] 肖登元.饲料中不同水平维生素A、C、E对半滑舌鳎亲鱼繁殖性能及后代质量的影响[D].上海:上海海洋大学,2014.
XIAO D Y.Effects of different levels of dietary vitamin A,C,E on reproductive performance and offspring quality of tongue sole(Cynoglossus semilaevis)[D].Shanghai:Shanghai Ocean University,2014.(in Chinese)
[8] 赵庆凯.中草药对黄鳝性腺发育及性激素分泌的影响[D].南京:南京农业大学,2014.
ZHAO Q K.Effect of Chinese herbal medicine on gonadal development and sex hormone level in Monopterus albus[D].Nanjing:Nanjing Agricutural University,2014.(in Chinese)
[9] 史东杰,胡金有,李文通,等.复合益生菌对锦鲤性腺脂肪酸组成、繁殖力及仔鱼成活率的影响[J].大连海洋大学学报,2020,35(5):680-685.
SHI D J,HU J Y,LI W T,et al.Effects of complex probiotics on fatty acid composition of gonad,fecundity and survival rate of larvae in koi carp Cyprinus carpio[J].Journal of Dalian Ocean University,2020,35(5):680-685.(in Chinese)
[10] 张羽,盛洁,李青,等.嗜酸乳杆菌对斑马鱼子代幼鱼免疫功能的影响[J].动物医学进展,2013,34(11):77-80.
ZHANG Y,SHENG J,LI Q,et al.Effect of L.acidophilus JCM 1132 on immune function of zebrafish(Danio rerio) offspring[J].Progress in Veterinary Medicine,2013,34(11):77-80.(in Chinese)
[11] GIOACCHINI G,MARADONNA F,LOMBARDO F,et al.Increase of fecundity by probiotic administration in zebrafish (Danio rerio)[J].Reproduction,2010,140(6):953-959.
[12] 姚卫军.不同生态条件对凡纳滨对虾亲虾性腺发育的影响[D].湛江:广东海洋大学,2010.
YAO W J.Effects of different ecological conditions on gonad development of Litopenaeus vannamei broodstock[D].Zhanjiang:Guangdong Ocean University,2010.(in Chinese)
[13] GHOSH S,SINHA A,SAHU C.Effect of probiotic on reproductive performance in female livebearing ornamental fish[J].Aquaculture Research,2007,38(5):518-526.
[14] ABASALI H,MOHAMAD S.Effect of dietary supplementation with probiotic on reproductive performance of female livebearing ornamental fish[J].Research Journal of Animal Sciences,2010,4(4):103-107.
[15] 韩丽,孔祥峰,赵越,等.枯草芽孢杆菌对围产期母猪繁殖性能和子代生长的影响[J].动物营养学报,2017,29(12):4440-4446.
HAN L,KONG X F,ZHAO Y,et al.Effects of Bacillus subtilis on reproductive performance of sows and growth of their offspring during perinatal period[J].Chinese Journal of Animal Nutrition,2017,29(12):4440-4446.(in Chinese)
[16] HOLZAPFEL W H,HABERER P,SNEL J,et al.Overview of gut flora and probiotics[J].International Journal of Food Microbiology,1998,41(2):85-101.
[17] WOOSTER G A,BOWSER P R,BROWN S B,et al.Remediation of cayuga syndrome in landlocked Atlantic salmon Salmo salar using egg and sac-fry bath treatments of thiamine-hydrochloride[J].World Aquaculture Society,2000,31(2):149-157.
[18] 傅朝君,鲁大椿,刘宪亭,等.草鱼卵球成熟、排放与碱性磷酸酶、酸性磷酸酶关系的研究[J].淡水渔业,1983(1):24-26,36.
FU Z J,LU D C,LIU X T,et al.Study on the relationship between the maturation and excretion of oocytes and AKP and ACP in grass carp [J].Freshwater Fisheries,1983(1):24-26,36.(in Chinese)
[19] 蓝海恩,麦伟虹,黄焕昌,等.复合益生菌发酵饲料对断奶仔猪生长性能、肠道微生物菌群、血清生化指标和免疫指标的影响[J].中国饲料,2020(15):120-124.
LAN H E,MAI W H,HUANG H C,et al.Effects of compound probiotic fermented feed on growth performance,intestinal microflora,serum biochemical index and immune index of weaned piglets[J].China Feed,2020(15):120-124.(in Chinese)
[20] 刘淑兰,陈娟,李杰,等.复合益生菌制剂对大西洋鲑(Salmo salar)生长、消化酶和非特异性免疫指标的影响[J].渔业科学进展,2017,38(5):100-106.
LIU S L,CHEN J,LI J,et al.Effects of complex-probiotic-preparation on the growth,digestive enzymes and the nonspecific immune indices of Atlantic salmon (Salmo salar)[J].Progress in Fishery Sciences,2017,38(5):100-106.(in Chinese)
[21] 张崇英,刘伟,宋金秋.不同益生菌对大棚养殖南美白对虾生长和免疫力的影响[J].中国饲料,2018(24):80-84.
ZHANG C Y,LIU W,SONG J Q,et al.Effects of probiotic bacterium on the growth performance and immunity of Litopenaeus vannamei in greenhouse[J].China Feed,2018(24):80-84.(in Chinese)
[22] 叶泽雄,叶林,王正印,等.高背鲫性腺与肝脏发育关系试验[J].水产科技,2003(4):25-26.
YE Z X,YE L,WANG Z Y,et al.Relationship between gonad and liver development of Carassius auratus[J].Fisheries Science & Technology,2003(4):25-26.(in Chinese)
[23] QUACKENBUSH L S.Yolk protein production in the marine shrimp Penaeus vannamei[J].Journal of Crustacean Biology,1989,9(4):509-516.
[24] 刘梦迪,周楠楠,王腾飞,等.银鲳卵巢发育与磷酸酶ACP及AKP活性的关系[J].宁波大学学报(理工版),2020,33(6):13-19.
LIU M D,ZHOU N N,WANG T F,et al.Relationship between ovarian development and activities of ACP and AKP in Pampus argenteus[J].Journal of Ningbo University(Natural Science & Engineering Edition),2020,33(6):13-19.(in Chinese)
[25] 狄桂兰,柯才焕,张朝霞,等.鲍体表黏液的几种免疫酶比活力的比较[J].厦门大学学报(自然科学版),2011,50(6):1080-1086.
DI G L,KE C H,ZHANG Z X,et al.Comparison on specific activities of several immune enzymes in the body surface mucus of various abalone species[J].Journal of Xiamen University(Natural Science Edition),2011,50(6):1080-1086.(in Chinese)
[26] 桂琳,王晓清,康银,等.一种复合益生菌对草鱼生长和抗氧化功能的影响[J].淡水渔业,2015,45(5):83-87.
GUI L,WANG X Q,KANG Y,et al.Effects of one compound probiotics on growth and antioxidant function of Ctenopharyngodon idellus[J].Freshwater Fisheries,2015,45(5):83-87.(in Chinese)
[27] 彭涛,郭贝贝,张水印,等.复合益生菌制剂对舍饲山羊育肥性能和血清生化指标的影响[J].动物营养学报,2020,32(1):440-446.
PENG T,GUO B B,ZHANG S Y,et al.Effects of complex-pribiotic-preparation on fattening performance and serum biochemical indexes of captive goats[J].Chinese Journal of Animal Nutrition,2020,32(1):440-446.(in Chinese)