红螯光壳螯虾Cherax quadricarinatus原产于澳大利亚,具有个体大、产量优、生长快、适应性强、经济成本低等养殖优势,在世界范围内广泛养殖并具有广阔的市场前景[1]。自2004年开始,江苏、浙江等养殖区域均出现红螯光壳螯虾感染白斑综合征病毒(White spot syndrome virus,WSSV)后大量死亡的现象,严重制约虾类养殖业的发展[2]。血细胞是螯虾主要的免疫细胞,而血淋巴中存在很多免疫因子,如溶血素、凝集素、抗菌肽等,在保护宿主免受病原微生物侵害中起着重要的作用。而虾类等水产养殖动物在集约化养殖条件下,面临大量的应激,如环境、营养和代谢等,这些容易导致虾类自身免疫力降低从而诱发疾病。研究表明,免疫系统的功能和虾体的营养状态密切相关,营养物质与水产动物的免疫因子有直接联系和相互作用,通过添加营养素来调控虾类养殖动物的营养状态与免疫机能已成为研究热点,有关虾类营养免疫学的研究也受到学者们的关注[3]。
虾类不能自身合成维生素或者合成量很少,难以满足机体所需,故需要从饲料中获得。维生素C(VC)具有抗氧化、抗自由基等多方面的功能,同时还起着增强免疫力的作用[4]。对南美白对虾Litopenaeus vannamei的研究发现,VC能缓解对虾的应激状态[5] ;饲料中添加VC,克氏原螯虾Procambarus clarkia血清酚氧化酶、溶菌酶、酸性磷酸酶活性可显著增强,同时血细胞总数及血细胞呼吸爆发率也有所提升,VC添加组对WSSV侵染后的抵抗性也较对照组有所增强[6];饲料中未添加VC或过量添加VC均会导致凡纳滨对虾Penaeus vannamei血清中酚氧化酶活力、血细胞总数及溶菌酶活性的降低[7];VC可显著提高中国明对虾Fenneropenaeus chinensis幼虾溶菌酶、酸性磷酸酶及过氧化氢酶等免疫酶活性,适量的VC可增强对虾对副溶血弧菌Vibrio parahaemolyticus的抑菌活性,同时对金黄色葡萄球菌Staphylococcus aureus的抵抗力也有所增强[8]。
通过在饲料中添加虾类生长发育中必需的营养物质来增强养殖动物机体免疫机能,不仅可以避免药物治疗的弊端,还能增强机体对病毒的抵御力[9],这对红螯光壳螯虾的大规模健康养殖具有重要意义。本研究中,利用酶化学、分子生物学等方法,研究了WSSV侵染前后,VC对红螯光壳螯虾血淋巴免疫因子及C-lectin基因表达量的影响,探究VC对红螯光壳螯虾免疫性能的作用,以期为螯虾的健康养殖及丰富螯虾的营养免疫学资料提供数据参考。
1 材料与方法
1.1 材料
试验用健康红螯光壳螯虾购自上海市金山区漕泾特种水产养殖基地,挑选规格相近、肢体健全、富有活力的成虾用于正式的养殖试验,试验虾初始体质量为(20.31±2.09)g,体长为(19.88±3.17)cm,共224只。
试验用小鼠(C57/BL6)为华东师范大学生物医学系惠赠,每天定时定量投喂清水和鼠粮。
包膜VC购自上海捷贝斯生物有限公司,VC含量92%,白色微粒。
WSSV病样来源于江苏省某红螯光壳螯虾养殖基地,由浙江省淡水水产研究所鱼类免疫与健康重点开放实验室分离鉴定和保存。将感染后的病虾(PCR 检测WSSV为中国大陆株,呈强阳性)血淋巴等组织按体积比1∶10加入无菌生理盐水后匀浆,-18 ℃下过夜,解冻后在4 ℃下以6 000 r/min离心5 min,然后以10 000 r/min 离心10 min,经微孔滤膜(网目0.22 μm)过滤,所得液体即为WSSV悬液,-80 ℃超低温冰箱中保存备用。
1.2 方法
1.2.1 饲料的配制 以酪蛋白提供蛋白源,阿拉斯加天然鱼油和豆油(二者体积比为2∶3)提供脂肪源,配制7组试验饲料。基础饲料中包含鱼油20 g/kg、豆油30 g/kg、明胶115 g/kg、多维20 g/kg、多矿30 g/kg、胆固醇5 g/kg、酪蛋白450 g/kg、甜菜碱5 g/kg、氯化胆碱5 g/kg和玉米淀粉255 g/kg,在基础料中分别添加0(对照)、100、200、400、800、1 600、3 200 mg/kg的包膜VC,根据等重替代原则,利用微晶纤维素进行调节。将基础饲料所需的原料,粉碎后过网目为198 μm的筛,用双螺旋挤条机制成直径为3.0 mm的颗粒,自然风干后密封冰冻保存备用。红螯光壳螯虾饲料一般营养成分如表1所示。
表1 红螯光壳螯虾饲料一般营养成分
Tab.1 Aproximate nutritional composition of marron Cherax quadricarinatus w/%

VC添加量/(mg·kg-1)VCadditionlevel粗蛋白质crudeprotein粗脂肪crudelipid水分moisture灰分ash总能/(kJ·g-1)grossenergy049.622.8916.952.9119.8910049.873.1817.472.5620.0120049.693.1618.172.5719.7940049.252.9816.042.4720.6080049.132.3616.802.8118.29160049.072.4317.762.8319.90320049.942.8818.912.7019.23
1.2.2 试验设计及饲养管理 将280只螯虾随机分配至28个养殖箱(长×宽×高为1 m×0.5 m×0.5 m)中,每箱8只,试验共设置7组,每组设置4个平行。养殖箱底部放置4~6块瓦片、10根PVC管作为遮蔽物,防止螯虾相互残杀及避免蜕皮期间被食。养殖期间,试验用水为曝气24 h的自来水,溶氧量高于6 mg/L,水温为26 ℃,光周期为14 L∶10 D,每天定时投喂7种试验饲料,日投喂量为螯虾湿质量的3%~4%,根据摄食及残留饲料情况及时调整投喂量,每天定时清除残留饲料及螯虾排泄物,隔天换水一次,换水量为养殖水体的1/3~1/2,养殖周期共8周。
1.2.3 养殖期间不同VC组螯虾血细胞与血淋巴样品的采集及免疫指标的测定 螯虾养殖期间,于第2周、第4周、第6周、第8周,随机从每组各取6只螯虾,冰浴麻醉30 min后,抽取每只虾的血淋巴,将血淋巴与抗凝剂(包含C6H5O7Na3-2H2O 1.76 g、C6H8O7 8.42 g、NaCl 5.96 g、EDTA-2Na 0.74 g,pH 7.3~7.4)按质量比1∶1混匀,4 ℃下以3 500 r/min离心10 min,底部沉淀即为血细胞样品,上清液即为血淋巴样品。分别测定各时间点血淋巴样品的溶血活性、凝集活性、抑菌率及血细胞吞噬活性,然后取其平均值。
1.2.4 WSSV感染试验样品的采集及免疫指标的测定 8周养殖试验结束后,给0、400、800 mg/kg VC添加组每只红螯光壳螯虾人工注射100 μL WSSV病毒悬液,并于病毒侵染后的第0、24、48、96 h分别从每组取1只螯虾,采集血细胞和血淋巴样品,用于血细胞数和免疫指标及基因表达分析。
1.2.5 血涂片的制作 用常规方法制成血涂片,每只红螯光壳螯虾制作5张血涂片,每张随机选取100个细胞(不同视野)分类计数,对不同类型的血细胞随机选取30个,测量细胞和细胞核的长短径,计算细胞的核质比,计算公式为
核质比![]()
(1)
1.2.6 鸡血细胞及小鼠血细胞悬液的制备 从鸡翅下方采集静脉血,用Alsever’s试剂保存,配制成体积分数3%的鸡红细胞悬液,4 ℃下保存,用于血淋巴溶血活性的测定。
从小鼠尾部静脉取血,放入用肝素浸润的试管中,加入质量分数0.9%的生理盐水,配制成体积分数5%的鼠红细胞悬液,4 ℃下保存,用于血淋巴凝集活性的测定。
1.2.7 血细胞吞噬活性的测定 参照李海兵等[10]的方法,取抗凝血与嗜水气单胞菌充分混匀后,28 ℃下孵育40 min,用常规方法制成血涂片,待涂片完全晾干后滴加甲醛固定,用Wright-Geimsa试剂盒染色,油镜下观察涂片并计数。血细胞的吞噬活性(或吞噬率,%)公式计算为
吞噬活性=(100个细胞中吞噬细菌的
血细胞数目/100)×100%。
(2)
1.2.8 RNA的提取及cDNA第一链的合成 采用组织超纯RNA提取试剂盒(MiniBEST Universal RNA Extraction Kit,TaKaRa)提取红螯光壳螯虾各组织中的RNA。用琼脂糖凝胶电泳检测RNA,核酸蛋白仪测定RNA浓度后,用反转录试剂盒(PrimeScript RT Master Mix Perfect Real Time Kit,TaKaRa)反转成cDNA,反应体系10 μL,于-20 ℃下保存。
随机取未进行VC添加试验的1只红螯光壳螯虾,提取其肝胰腺、鳃、肌肉、胃、肠、心脏、脑、触角腺等组织RNA,用于C-lectin mRNA在不同组织中的表达。提取0、400、800 mg/kg VC添加组各个时间段血细胞的RNA,用于VC对WSSV侵染后C-lectin mRNA表达量的分析。
1.2.9 荧光定量(RT-PCR)分析 根据本实验室克隆所得红螯光壳螯虾C-lectin基因cDNA片段(574 kbp),设计特异性引物qLe-F和qLe-R(表2)检测螯虾不同组织中C-lectin mRNA的表达,以及VC对WSSV侵染后各组血细胞中C-lectin基因表达量的影响,以β-actin为内参基因,反应采用qRT-PCR循环(两步法)。反应条件为:95 ℃下预变性2 min;95 ℃下变性15 s,60 ℃下退火30 s,共进行40个循环。
表2 C-lectins基因及内参基因引物序列
Tab.2 Oligonucleotide primers of C-lectins gene and reference genes

引物primer序列sequence(5′-3′)qLe-FAGCACTCCAGGAGTGTTCCqLe-RCCGCCAAGGTAGGAGATCCβ-actin-FTCACCAACTGGGACGACAβ-actin-RGCGGTGGTCGTGAAGGT
1.3 数据处理
试验结果均以平均值±标准差(mean±S.D.)表示,数据采用SPSS 20软件进行单因素方差分析(one-way ANOVA)和Duncan多重比较,采用2-△△Ct法计算mRNA的相对表达量,显著性水平设为0.05。
2 结果与分析
2.1 VC对WSSV侵染后红螯光壳螯虾血细胞数量的影响
人工注射WSSV悬浮液后,选取0、400、800 mg/kg 3个VC添加组,分析WSSV感染后红螯光壳螯虾血细胞总数的变化,结果如表3所示,3组血细胞总数随病毒侵染时间的延长,均呈现减少趋势,至96 h时,800 mg/kg VC添加组血细胞总数最高,且显著高于其他两组(P<0.05)。
表3 VC对WSSV侵染后红螯光壳螯虾血细胞总数的影响
Tab.3 Effects of dietary VC on total hemocyte count of marron Cherax quadricarinatus challenged with WSSV 106 ind./mL

VC添加量/(mg·kg-1)VCadditionlevel0h96h04.16±2.20Ac1.09±0.3Bb4005.93±3.62Aa1.08±0.79Bb8004.31±5.44Ab1.59±0.35Ba
注:同行中标有不同大写字母者表示组间有显著性差异(P<0.05),同列中标有不同小写字母者表示组间有显著性差异(P<0.05),同行或同列标有相同写字母者表示组间无显著性差异(P>0.05),下同。
Note: The means with different capital letters within the same line are significant differences at the 0.05 probability level, the means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letter within the same column or line are not significant differences, et sequentia.
WSSV感染后,红螯光壳螯虾3种类型血细胞数量变化如表4所示。从表4可见:3种类型血细胞所占比例差异显著(P<0.05);0 h时,3个VC添加组中大颗粒细胞(GC)所占比例均最低(P<0.05),其次为透明细胞(HC),而小颗粒细胞(SGC)所占比例均最高(P<0.05);至96 h时,与0 h时不同,3组中透明细胞所占比例均最低(P<0.05),其次为小颗粒细胞,大颗粒细胞所占比例均最高(P<0.05),800 mg/kg VC添加组大颗粒细胞所占比例显著高于其他两组(P<0.05),400 mg/kg VC添加组小颗粒细胞所占比例较高,但与其他组相比无显著性差异(P>0.05)。
表4 VC对WSSV侵染后红螯光壳螯虾3种血细胞数量的影响
Tab.4 Effects of dietary VC on count of three type hemocytes of marron Cherax quadricarinatus challenged with WSSV %
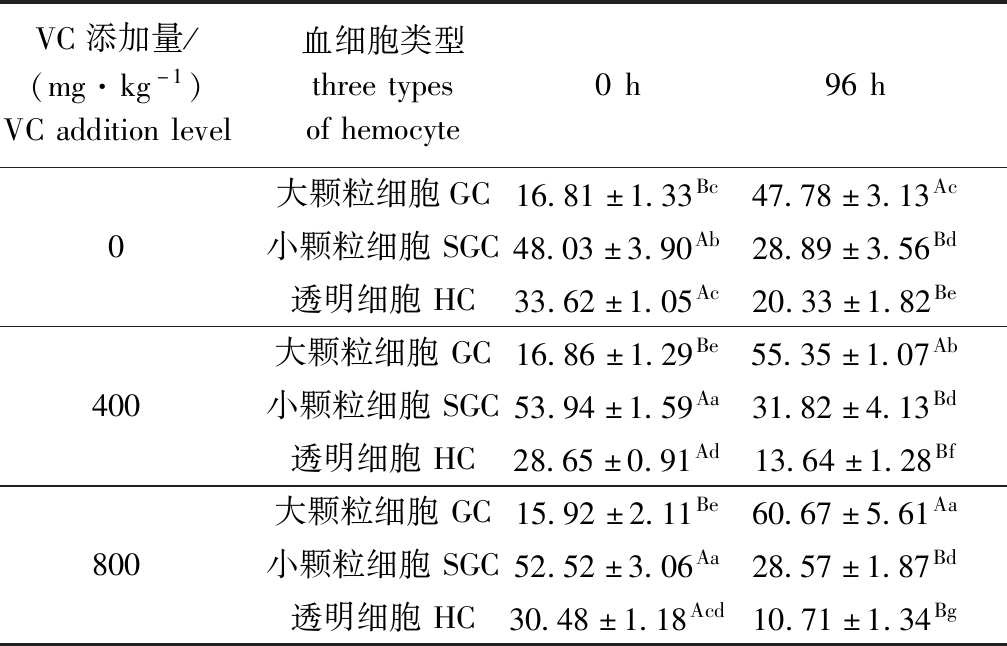
VC添加量/(mg·kg-1)VCadditionlevel血细胞类型threetypesofhemocyte0h96h大颗粒细胞GC16.81±1.33Bc47.78±3.13Ac0小颗粒细胞SGC48.03±3.90Ab28.89±3.56Bd透明细胞HC33.62±1.05Ac20.33±1.82Be大颗粒细胞GC16.86±1.29Be55.35±1.07Ab400小颗粒细胞SGC53.94±1.59Aa31.82±4.13Bd透明细胞HC28.65±0.91Ad13.64±1.28Bf大颗粒细胞GC15.92±2.11Be60.67±5.61Aa800小颗粒细胞SGC52.52±3.06Aa28.57±1.87Bd透明细胞HC30.48±1.18Acd10.71±1.34Bg
2.2 VC对WSSV侵染后红螯光壳螯虾血细胞核质比的影响
WSSV侵染后,红螯光壳螯虾3种类型血细胞核质比表现出不同的变化规律。从表5可见:至96 h时,3个VC添加组大颗粒细胞的核质比均较0 h显著降低(P<0.05),其中800 mg/kg VC添加组大颗粒核质比高于其他两组,但无显著性差异(P>0.05);3组小颗粒细胞核质比均较0 h有所增大(除对照组外),800 mg/kg VC添加组小颗粒细胞核质比显著大于对照组(P<0.05);3组透明细胞核质比显著小于0 h,其中800 mg/kg VC添加组透明细胞核质比显著高于其他两组(P<0.05)。
表5 VC对WSSV侵染后红螯光壳螯虾血细胞核质比的影响
Tab.5 Effects of VC on hemocyte NP of marron Cherax quadricarinatus challenged with WSSV
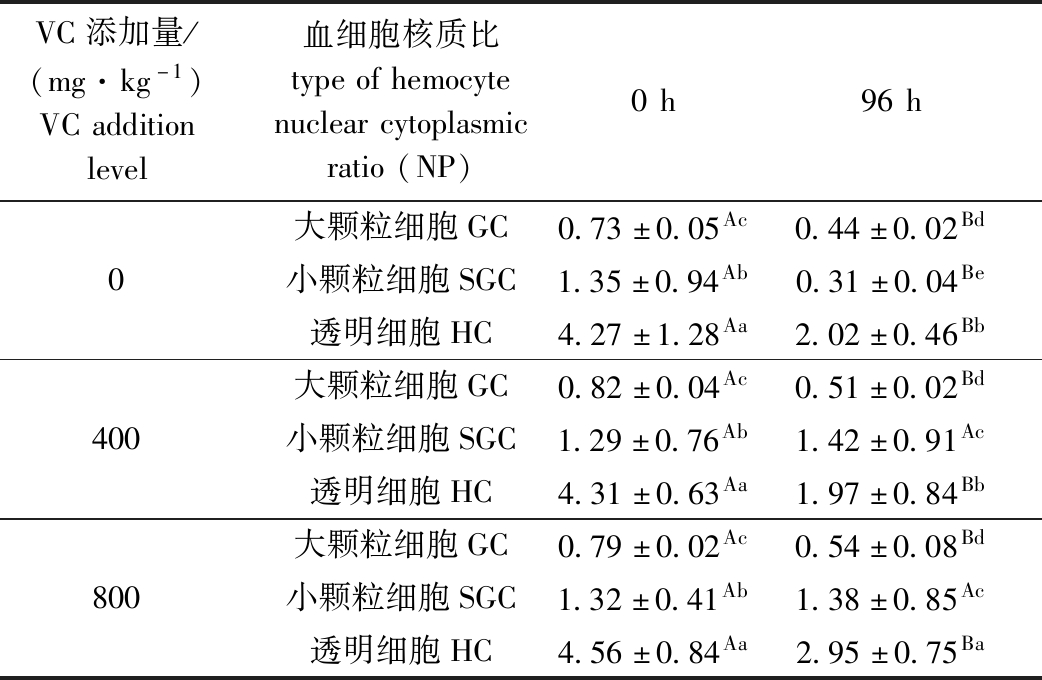
VC添加量/(mg·kg-1)VCadditionlevel血细胞核质比typeofhemocytenuclearcytoplasmicratio(NP)0h96h大颗粒细胞GC0.73±0.05Ac0.44±0.02Bd0小颗粒细胞SGC1.35±0.94Ab0.31±0.04Be透明细胞HC4.27±1.28Aa2.02±0.46Bb大颗粒细胞GC0.82±0.04Ac0.51±0.02Bd400小颗粒细胞SGC1.29±0.76Ab1.42±0.91Ac透明细胞HC4.31±0.63Aa1.97±0.84Bb大颗粒细胞GC0.79±0.02Ac0.54±0.08Bd800小颗粒细胞SGC1.32±0.41Ab1.38±0.85Ac透明细胞HC4.56±0.84Aa2.95±0.75Ba
2.3 VC对养殖期间及WSSV侵染后红螯光壳螯虾血淋巴免疫活性的影响
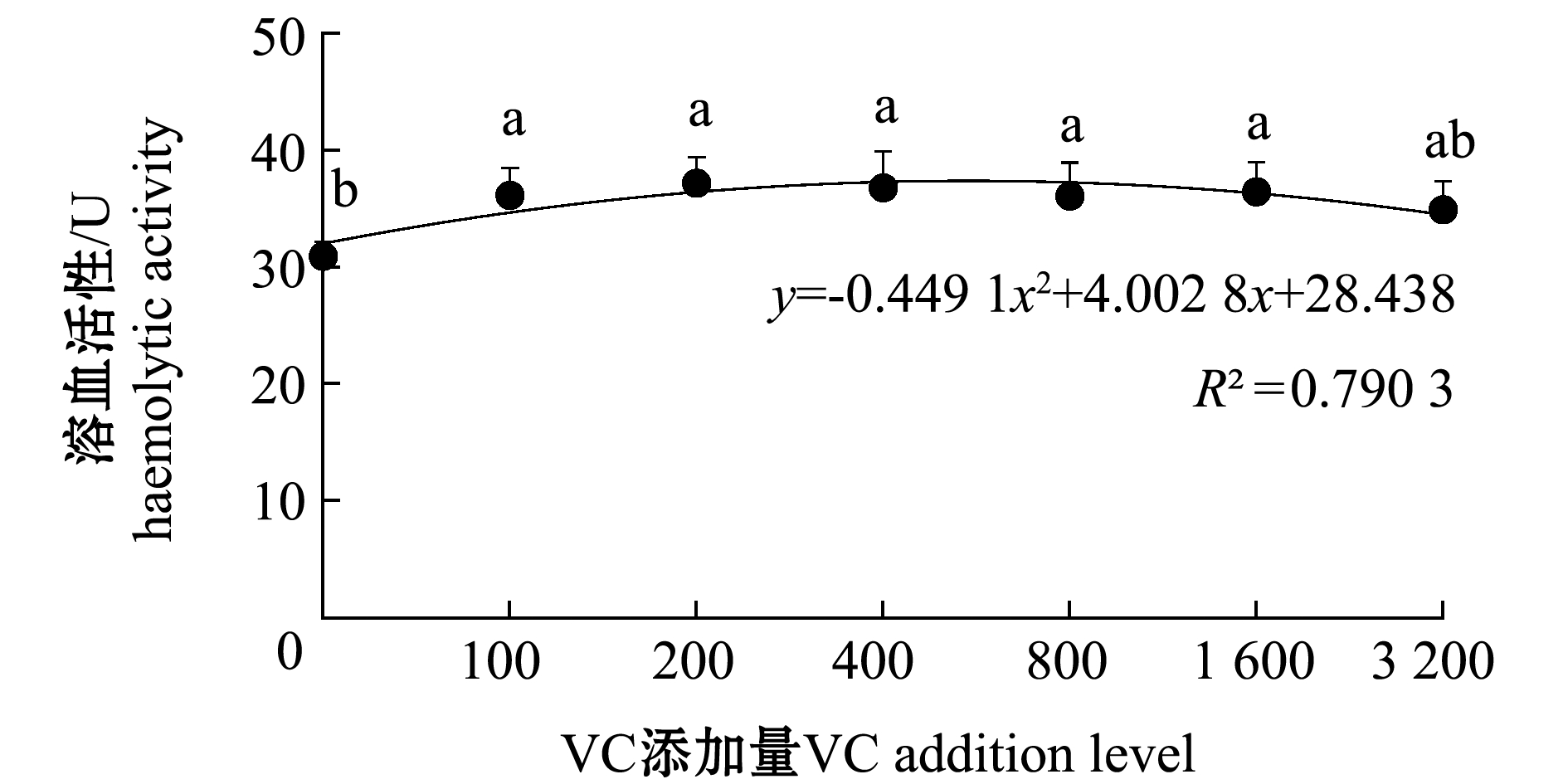
2.3.1 红螯光壳螯虾血淋巴的溶血活性 从图1可见:养殖期间,健康红螯光壳螯虾血淋巴溶血活性随VC添加量的增加呈先增强后降低的趋势;VC添加组血淋巴溶血活性显著高于对照组(除3 200 mg/kg VC添加组外)(P<0.05),但各添加组之间无显著性差异(P>0.05)。
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significant differences at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.
图1 不同水平VC添加组红螯光壳螯虾血淋巴的溶血活性
Fig.1 Hemolytic activity of the hemolymph of marron Cherax quadricarinatus in different levels of VC
从图2可见:受到WSSV侵染后,3组血淋巴溶血活性随侵染时间的延长总体上呈先升高后降低的趋势;至96 h时,血淋巴溶血活降至最低,且3组之间无显著性差异(P>0.05)。

图2 VC对WSSV侵染后红螯光壳螯虾血淋巴溶血活性的影响
Fig.2 Effects of different levels of dietary VC on haemolytic activity in the hemolymph of marron Cherax quadricarinatus challenged with WSSV
2.3.2 红螯光壳螯虾血淋巴的凝集活性 从图3可见:养殖期间,健康红螯光壳螯虾血淋巴凝集活性随VC添加量的增加呈现先增强后减低的趋势;800 mg/kg VC添加组血淋巴凝集活性最高,且显著高于其他两组(P<0.05)。

图3 不同水平VC添加组红螯光壳螯虾血淋巴的凝集活性
Fig.3 Agglutinative activity of the hemolymph of marron Cherax quadricarinatus fed diets containing different levels of VC
从图4可见:受到WSSV侵染后,血淋巴凝集活性随侵染时间的延长总体上呈先升高后降低趋势;800 mg/kg VC添加组血淋巴凝集活性在各时间点均保持在较高水平,至96 h时该组血淋巴凝集活性显著高于其他两组(P<0.05)。
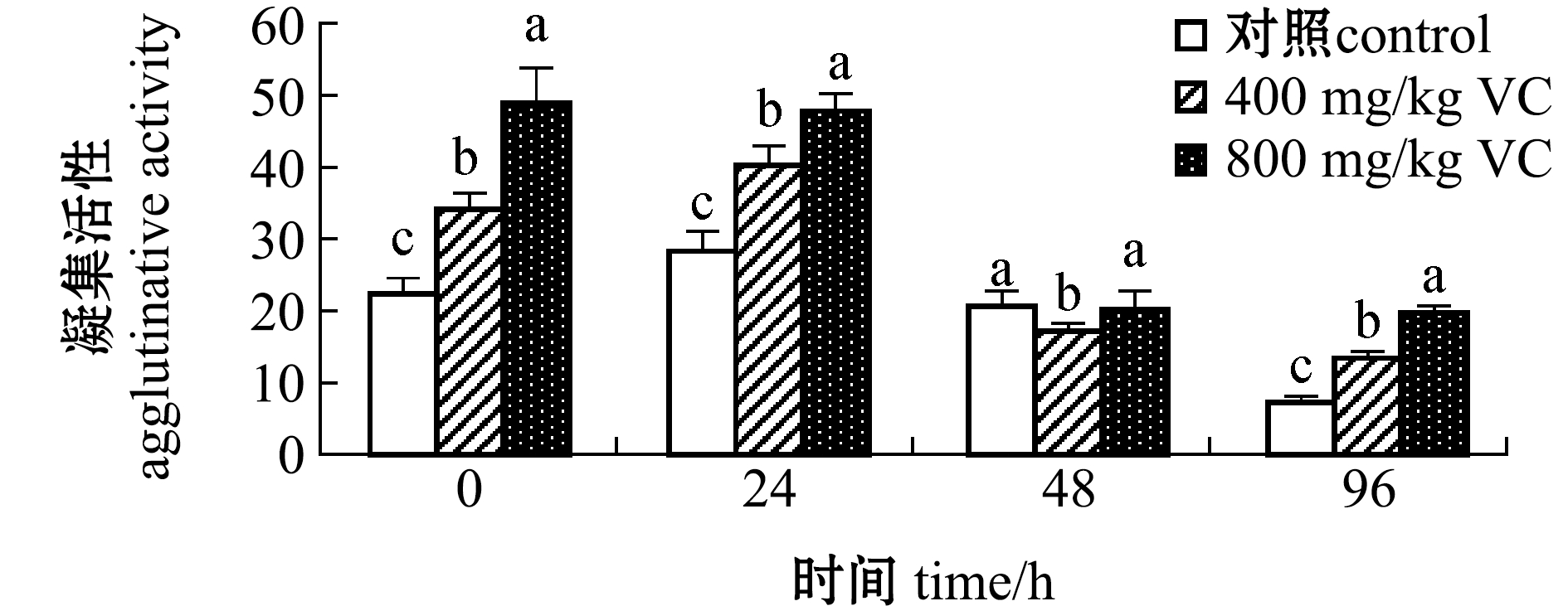
图4 VC对WSSV侵染后红螯光壳螯虾血淋巴凝集活性的影响
Fig.4 Effects of different levels of VC on agglutinative activity in the hemolymph of marron Cherax quadricarinatus challenged with WSSV
2.3.3 红螯光壳螯虾血淋巴的抑菌率 从图5可见:养殖期间,健康红螯光壳螯虾血淋巴抑菌率随VC添加量的增加呈先升高后降低的趋势;VC添加组血淋巴抑菌率均较对照组显著增强(P<0.05),800 mg/kg VC添加组血淋巴抑菌率最高。
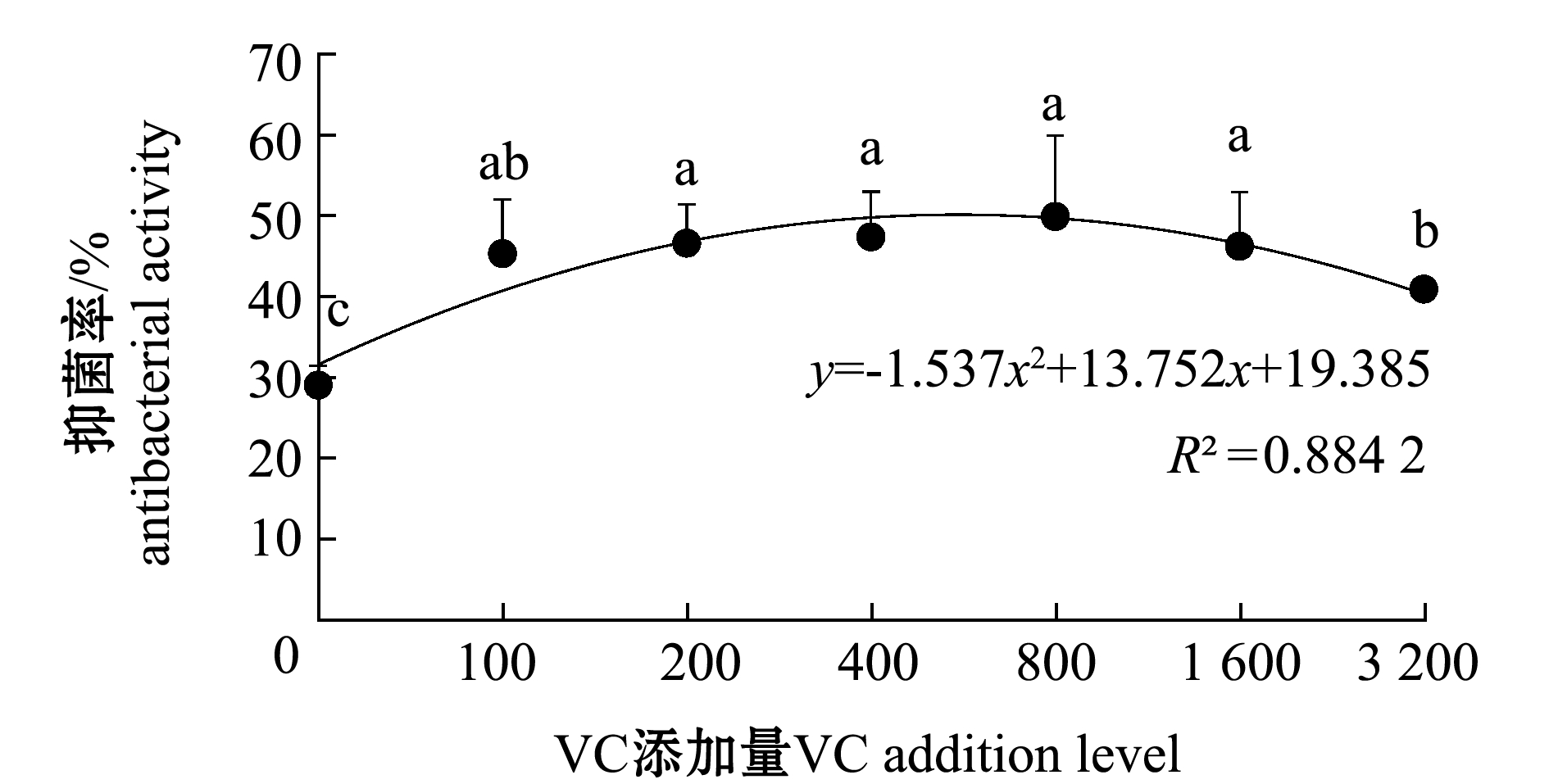
图5 不同水平VC添加组红螯光壳螯虾血淋巴的抑菌率
Fig.5 Antibacterial activity of the hemolymph of marron Cherax quadricarinatus in different levels of VC
从图6可见:受到WSSV侵染后,血淋巴抑菌率随着侵染时间的延长呈现降低趋势;对照组血淋巴抑菌率最低,且显著低于其他两组(P<0.05);至96 h时,400、800 mg/kg VC添加组血淋巴抑菌率显著高于对照组(P<0.05),但这两组间无显著性差异(P>0.05)。

图6 VC对WSSV侵染后红螯光壳螯虾血淋巴抑菌率的影响
Fig.6 Effects of different levels of VC on antibacterial activity in the hemolymph of marron Cherax quadricarinatus challenged with WSSV
2.3.4 红螯光壳螯虾血细胞的吞噬活性 从图7可见:养殖期间,健康红螯光壳螯虾血细胞吞噬活性随VC添加量的增加呈先增强后降低的趋势;VC添加组血细胞吞噬活性均显著高于对照组(P<0.05),当饲料中VC含量超过800 mg/kg后,血细胞的吞噬活性随VC添加量的增加而显著降低(P<0.05)。
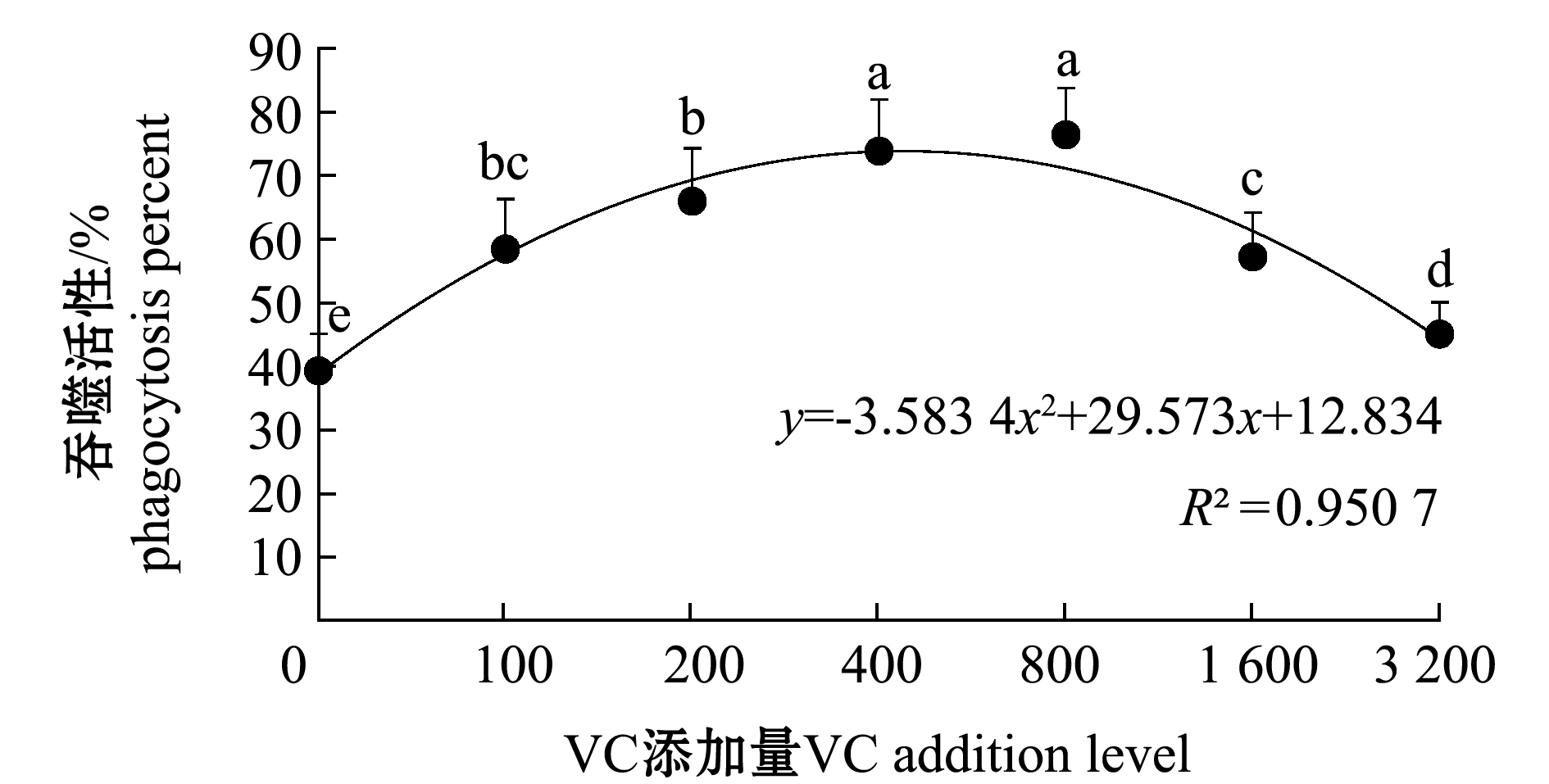
图7 不同水平VC添加组红螯光壳螯虾血细胞的吞噬活性
Fig.7 Phagocytosis percent of the hemocyte of marron Cherax quadricarinatus in different levels of VC
从图8可见:受到WSSV侵染后,对照组血细胞吞噬活性随侵染时间的延长总体上呈先升高后降低的趋势,而VC添加组血细胞吞噬活性则随WSSV侵染时间的延长呈持续降低趋势;至96 h时,800 mg/kg VC添加组血淋巴凝集活性显著高于其他两组(P<0.05)。
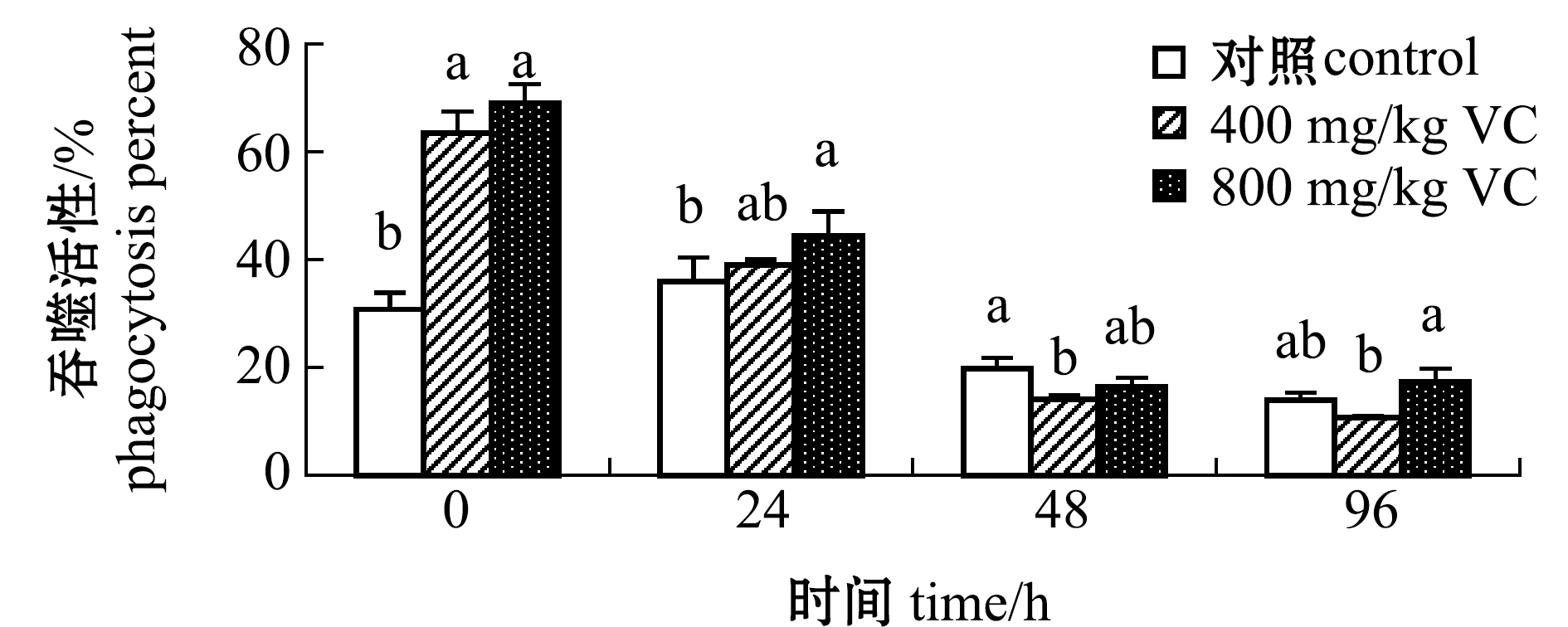
图8 VC对WSSV侵染后红螯光壳螯虾血细胞吞噬活性的影响
Fig.8 Effects of different levels of dietary VC on phagocytosis percent in the hemocyte of marron Cherax quadricarinatus challength with WSSV
2.4 VC对WSSV侵染后红螯光壳螯虾C-lectin基因表达量影响
从图9可见:在未进行VC试验的健康红螯光壳螯虾中,C-lectin基因在血细胞中表达量最高,显著高于其他组织(P<0.05),其次为肝胰腺组织,表达量显著高于除血细胞外的其他组织(P<0.05),C-lectin在脑、触角腺、胃、肌肉组织中几乎不表达。
从图10可见:受到WSSV侵染后,VC添加组C-lectin基因表达量随着侵染时间的延长呈先升高后降低的趋势;至96 h时,3组基因表达量均保持在较低水平,800 mg/kg VC添加组基因表达量显著高于其他两组(P<0.05)。

标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significant differences at the 0.05 probabilitylevel, and the means with the same letters are not significant differences.
图9 C-lectin基因在红螯光壳螯虾不同组织中的相对表达量
Fig.9 qRT-PCR analysis of C-lectin gene expresion in different tissues of marron Cherax quadricarinatus
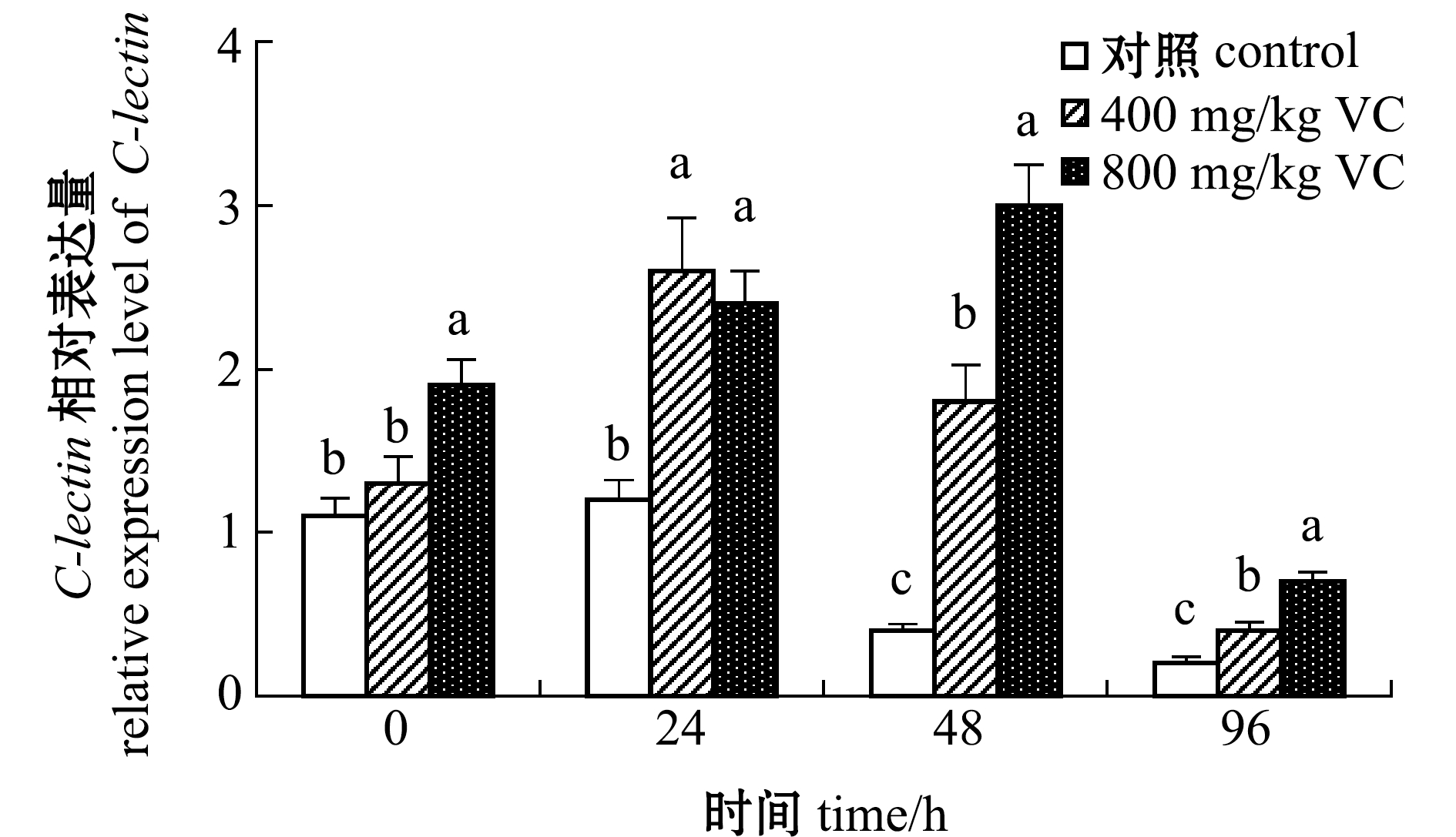
图10 VC对WSSV侵染后红螯光壳螯虾血细胞C-lectin基因相对表达量的影响
Fig.10 Effects of dietary VC on C-lectin gene expression level in the hemocyte of marron Cherax quadricarinatus challength with WSSV
3 讨论
3.1 VC对WSSV侵染后红螯光壳螯虾血细胞总数、血细胞吞噬活性的影响
血细胞是甲壳动物主要的免疫细胞,负责体内的细胞免疫和体液免疫[11]。红螯光壳螯虾血细胞分为大颗粒细胞、小颗粒细胞和透明细胞,不同类型的血细胞在免疫反应中所起的作用不同[12]。血淋巴中溶血素、凝集素、抗菌因子等是甲壳动物重要的免疫因子,在先天免疫中发挥重要的作用。血细胞总数、3种类型血细胞所占比例及血淋巴中免疫因子的变化一定程度上可以反映虾免疫状况[13]。WSSV侵染后,红螯光壳螯虾血细胞总数显著降低,可能与WSSV的增殖和释放最终导致血细胞的破裂有关,而血细胞总数低于正常水平时抵御病毒的能力大大降低[14]。透明细胞具有较强的吞噬能力[15],本研究中WSSV侵染后透明细胞数量的减少一定程度上影响螯虾对于病原微生物的吞噬作用,表现为血细胞总吞噬活性的降低,至96 h时,800 mg/kg VC添加组血细胞吞噬活性略高于对照组,可能与VC一定程度上增强小颗粒细胞或透明细胞的吞噬活性有关,从而表现为血细胞的吞噬活性有所增强,本研究结果与对克氏原螯虾Procambarus clarkii和草鱼 Ctenopharyngodon idella 的研究结果相似[16-17]。而小颗粒细胞负责执行对较大异物的包囊作用,是免疫防御反应中的关键细胞[18],小颗粒细胞的减少会影响螯虾对病原微生物的识别和包囊作用,而大颗粒细胞是酚氧化酶系统的主要储存细胞,在一定条件下,大颗粒细胞中的酚氧化酶原被释放并激活,启动免疫防御的黑化反应,此外,大颗粒细胞还能释放抗菌肽等免疫因子[19]。本试验中,WSSV侵染后大颗粒细胞数量显著增加,但核质比却显著降低,可能影响酚氧化酶系统,这可能与WSSV侵染导致血细胞结构的破坏有直接关系,而WSSV侵染后800 mg/kg VC添加组血细胞总数和大颗粒细胞总数显著高于其他两组,表明VC可在一定程度上增强机体的免疫机能,提高螯虾对于WSSV的抵御能力,这与对斑节对虾Penaeus monodon的研究结果相似[20]。
3.2 VC对WSSV侵染后红螯光壳螯虾血淋巴免疫机能及基因表达水平的影响
溶血素在甲壳动物免疫防御过程中所起的作用类似于脊椎动物的补体系统,可破坏异物细胞,具有一定的可诱导性,在病原微生物的清除中起重要作用[21]。本试验中WSSV侵染后,随着侵染时间的延长溶血活性呈先升高后下降趋势,WSSV表现出较强的抑制作用,可能与WSSV在螯虾体内的作用途径有关,VC添加96 h时,VC组溶血活性较对照组略有升高,红螯光壳螯虾血淋巴中的溶血素可能具有一定的可诱导性,而适量的VC可能对溶血素产生诱导作用,VC的诱导提高了溶血素浓度进而增强了溶血活性。甲壳动物体液免疫中的溶菌酶[22-23]、抗菌肽和凝集素是重要的抗菌物质[24],当机体受到病原微生物刺激时,血细胞会将抗菌物质释放到细胞外,共同发挥抑菌作用[25]。本试验饲料中添加适量VC后,红螯光壳螯虾血淋巴抑菌率增强,意味着机体对嗜水气单胞菌的抵抗力增强,表明VC在机体抵御细菌侵染过程中起到积极作用。本试验中WSSV侵染后,800 mg/kg VC添加组血淋巴中凝集素活性显著高于未添加组,这表明VC可能在机体抵御病毒侵染过程中起到积极作用,抑菌能力的提升可能与VC提高了体液中的溶菌酶、抗菌肽、凝集素及血细胞吞噬活性有关。
凝集素是甲壳动物体内重要的免疫识别因子[26],其作用类似于脊椎动物的抗体,具有高度的调理性,可促进血细胞的吞噬作用[27]。甲壳动物因其种类不同,其对脊椎动物红细胞的凝集作用也存在差异。日本沼虾和南美白对虾[25]血淋巴中凝集素对小鼠红细胞和兔细胞的凝集作用最强。锯缘青蟹Scylla serrata[28]血淋巴中凝集素对小鼠红细胞的凝集作用也最强。结合预试验结果,本研究中选择小鼠红细胞悬液来测定红螯光壳螯虾血淋巴凝集活性,饲料中VC添加量小于或大于800 mg/kg时,螯虾血淋巴中凝集活性均有所降低,表明适量的VC能够增强螯虾血淋巴的凝集活性,可能与VC是凝集素的诱导因子有关。本研究中WSSV侵染后,红螯光壳螯虾血淋巴中凝集活性和血细胞中C-lectin基因表达量在24 h内有明显的上升趋势,但随着病毒侵染时间的延长,基因表达量降低,可能与病毒侵害机体的免疫系统及部分组织导致凝集活性的降低有关,至96 h时,800 mg/kg VC添加组凝集素活性和C-lectin基因表达量均显著高于未添加组,表明VC能在一定程度上增强凝集素的活性和基因表达量,从而提高机体对于WSSV的抵抗力。
结合以上研究结果,表明WSSV侵染后,饲料中添加800 mg/kg的VC能在一定程度上增强红螯光壳螯虾血淋巴的免疫机能、免疫因子的免疫活性及血细胞总数和吞噬作用,提高红螯光壳螯虾对于病毒的抵抗力,但WSSV感染后红螯光壳螯虾的恢复问题需要进一步的研究。
4 结论
1)饲料中添加适量的VC可增强红螯光壳螯虾血淋巴溶血活性、抑菌活性、凝集活性和吞噬活用。
2)WSSV侵染后,螯虾血细胞总数、血淋巴免疫因子活性及C-lectin基因表达量显著降低。
3)饲料中添加800 mg/kg的VC效果最好,可在一定程度上增强螯虾免疫力及对WSSV的抵抗力。
[1] ZUO D,WU D L,MA C A,et al.Effects of white spot syndrome virus infection and role of immune polysaccharides of juvenile Cherax quadricarinatus[J].Aquaculture,2015,437:235-242.
[2] BACH RE E.Shrimp immunity and disease control[J].Aquaculture,2000,191(1/2/3):3-11.
RE E.Shrimp immunity and disease control[J].Aquaculture,2000,191(1/2/3):3-11.
[3] FANG D A,WANG Q,HE L,et al.Characterization of heat shock protein 70 in the red claw crayfish (Cherax quadricarinatus):evidence for its role in regulating spermatogenesis[J].Gene,2012,492(1):138-147.
[4] 叶建生,马甡,王兴强,等.虾类营养免疫学研究进展[J].海洋湖沼通报,2007(4):167-176.
YE J S,MA S,WANG X Q,et al.Advances in nutritional immunology of shrimps[J].Transactions of Oceanology and Limnology,2007(4):167-176.(in Chinese)
[5] 胡俊茹,王安利,曹俊明,等.维生素C对水生动物生长、繁殖及免疫的调节作用[J].水产科学,2009,28(1):40-46.
HU J R,WANG A L,CAO J M,et al.A review: regulation of vitamin C in growth,reproduction and immune in aquatic animals[J].Fisheries Science,2009,28(1):40-46.(in Chinese)
[6] KONG F S H,ZHU Y H,YU H J,et al.Effect of dietary vitamin C on the growth performance,nonspecific immunity and antioxidant ability of red swamp crayfish (Procambarus clarkii)[J].Aquaculture,2021,541:736785.
[7] 周歧存,丁燏,郑石轩,等.维生素C对凡纳滨对虾生长及抗病力的影响[J].水生生物学报,2004,28(6):592-598.
ZHOU Q C,DING J,ZHENG S X,et al.Effect of dietary vitamin C supplementation on growth and anti-disease ability of shrimp,Penaeus vannamei[J].Acta Hydrobiologica Sinica,2004,28(6):592-598.(in Chinese)
[8] 宋理平,周洪琪,黄旭雄,等.VC及其与β-葡聚糖混合物对中国明对虾生长和免疫功能的影响[J].饲料工业,2006,27(4):35-39.
SONG L P,ZHOU H Q,HUANG X X,et al.Effect on VC and mixture of VC and β-glucan on survival and immune function of Fenneropenaeus chinensis juvenile[J].Feed Industry,2006,27(4):35-39.(in Chinese)
[9] 艾春香,陈立侨,温小波.虾蟹类维生素营养的研究进展[J].浙江海洋学院学报(自然科学版),2001,20(增刊1):51-58.
AI C X,CHEN L Q,WEN X B.Advances in the vitamin nutrition of shrimp and crab[J].Journal of Zhejiang Ocean University(Natural Science Edition),2001,20(sup 1):51-58.(in Chinese)
[10] 李海兵,宋晓玲,韦嵩,等.WSSV感染对克氏原螯虾血细胞吞噬和肝胰腺磷酸酶活性的影响[J].渔业科学进展,2011,32(2):78-82.
LI H B,SONG X L,WEI G,et al.Impacts of WSSV on the activity of haemocyte phagocytosis and hepatopancreas phosphatase in Procambarus clarkii[J].Marine Fisheries Research,2011,32(2):78-82.(in Chinese)
[11] 杨丰,李钫.甲壳动物造血机制研究进展[J].应用海洋学学报,2019,38(4):484-489.
YANG F,LI F.Progress in the research of crustacean hematopoiesis[J].Journal of Applied Oceanography,2019,38(4):484-489.(in Chinese)
[12] LEE S Y,SÖDERH LL K.Early events in crustacean innate immunity[J].Fish & Shellfish Immunology,2002,12(5):421-437.
LL K.Early events in crustacean innate immunity[J].Fish & Shellfish Immunology,2002,12(5):421-437.
[13] PERBANDT M,GUTHÖHRLEIN E W,RYPNIEWSKI W,et al.The structure of a functional unit from the wall of a gastropod hemocyanin offers a possible mechanism for cooperativity[J].Biochemistry,2003,42(21):6341-6346.
[14] SUNG H H,HWANG S F,TASI F M.Responses of giant freshwater prawn (Macrobrachium rosenbergii) to challenge by two strains of Aeromonas spp.[J].Journal of Invertebrate Pathology,2000,76(4):278-284.
[15] 褚衍亮,王娜,赵玉林.日本沼虾血清凝集素特性研究[J].水产养殖,2010,31(1):5-9.
CHU Y L,WANG N,ZHAO Y L.Study on the properties of agglutinin in hemolymph of Macrobrnchium nipponese[J].Journal of Aquaculture,2010,31(1):5-9.(in Chinese)
[16] 陈孝煊,吴志新,张厚梅.大黄与黄连对二种淡水虾血细胞吞噬活性的影响[J].水生生物学报,2002,26(2):201-204.
CHEN X X,WU Z X,ZHANG H M.Effect of rheum officinale and coptis chinensis on the phagocytic activity in the hemocytes of crayfish,Procambarus clarkii and Cherax quadricarinatus[J].Acta Hydrobiologica Sinica,2002,26(2):201-204.(in Chinese)
[17] 卢明淼,陈孝煊,吴志新,等.果寡糖对草鱼非特异性免疫功能的影响[J].华中农业大学学报,2010,29(2):213-216.
LU M M,CHEN X X,WU Z X,et al.Effect of fructooligosaccharides on non-specific immunity of Ctenopharyngodon idellus[J].Journal of Huazhong Agricultural University,2010,29(2):213-216.(in Chinese)
[18] LEE M H,SHIAU S Y.Dietary vitamin C and its derivatives affect immune responses in grass shrimp,Penaeus monodon[J].Fish & Shellfish Immunology,2002,12(2):119-129.
[19] SRICHAROEN S,KIM J J,TUNKIJJANUKIJ S,et al.Exocytosis and proteomic analysis of the vesicle content of granular hemocytes from a crayfish[J].Developmental & Comparative Immunology,2005,29(12):1017-1031.
[20] VAN DE BRAAK C B T,BOTTERBLOM M H A,LIU W,et al.The role of the haematopoietic tissue in haemocyte production and maturation in the black tiger shrimp (Penaeus monodon)[J].Fish & Shellfish Immunology,2002,12(3):253-272.
[21] 徐海圣,徐步进.甲壳动物细胞及体液免疫机理的研究进展[J].大连水产学院学报,2001,16(1):49-56.
XU H S,XU B J.Progress on the researches of cellular and humoral immunity of crustacean[J].Journal of Dalian Fisheries College,2001,16(1):49-56.(in Chinese)
[22] MESHRAM S J,MURTHY H S,ALI H,et al.Effect of dietary β-glucan on immune response and disease resistance against Aeromonas hydrophila in giant freshwater prawn,Macrobrachium rosenbergii (de Man.1879)[J].Aquaculture International,2015,23(2):439-447.
[23] 何远法,郁欢欢,迟淑艳,等.酵母培养物对凡纳滨对虾生长性能、非特异性免疫力和抗病力的影响[J].动物营养学报,2016,28(12):4063-4072.
HE Y F,YU H H,CHI S Y,et al.Effects of yeast culture on growth performance,nonspecific immunity and disease resistance of Litopenaeus vannamei[J].Chinese Journal of Animal Nutrition,2016,28(12):4063-4072.(in Chinese)
[24] 王秀英,邵庆均,黄磊.对虾抗菌肽Penaeidins的研究进展[J].华中农业大学学报,2003,22(6):624-629.
WANG X Y,SHAO Q J,HUANG L.Research advances of antimicrobial penaeidins isolated from penaeid shrimp[J].Journal of Huazhong Agricultural University,2003,22(6):624-629.(in Chinese)
[25] 梁青龙,戴聪杰,陈寅山.南美白对虾血清凝集素的凝集活性及部分性质研究[J].水产科学,2005,24(1):13-16.
LIANG Q L,DAI C J,CHEN Y S.Properties of agglutinin in serum of whiteleg shrimp Litopenaeus vanaminas[J].Fisheries Science,2005,24(1):13-16.(in Chinese)
[26] 戴聪杰,陈寅山.福建10种甲壳动物凝集素的研究[J].泉州师范学院学报,2002,20(2):89-94.
DAI C J,CHEN Y S.Study on the 10 crustacean from Fujian for hemagglutination[J].Journal of Quanzhou Normal College,2002,20(2):89-94.(in Chinese)
[27] 李义.甲壳动物免疫学的研究进展[J].水利渔业,2003,23(1):4-6.
LI Y.Advances on the immunological research of crustaceans[J]. Reservoir Fisheries,2003,23(1):4-6.(in Chinese)
[28] 郝珂,钱冬,刘问,等.锯缘青蟹血清凝集素的特性和盐析提取研究[J].淡水渔业,2008,38(4):7-11.
HAO K,QIAN D,LIU W,et al.Studies on characteristics and salting-out extraction of hemolymph lectin from mud crab,Scylla serrate[J].Freshwater Fisheries,2008,38(4):7-11.(in Chinese)