斜带石斑鱼Epinephelus coioides是中国重要的海洋经济鱼类养殖品种,近年来,随着石斑鱼养殖规模的不断扩大,养殖环境恶化,石斑鱼养殖过程中病害频繁发生,其中,主要的细菌性病原为哈维氏弧菌和溶藻弧菌,病毒性病原为虹彩病毒和神经坏死病毒,严重制约了石斑鱼养殖业的发展[1]。
热激蛋白(heat shock proteins, HSPs),又称为热休克蛋白,当生物有机体受到各种生物(病害等)或非生物胁迫(如高温、冷害等)时,该蛋白基因表达上调[2-3]。作为分子伴侣,HSPs能通过磷酸化、甲基化等方式产生多种异构体与不同的蛋白质形成复合物,进而调节蛋白的活性与功能[4],在维持细胞生物活性、稳定细胞结构、修复细胞氧化损伤等方面也发挥着重要作用[5]。此外,HSPs还参与机体抗原提成加工、自身免疫、协同免疫[6],以及通过调节细胞凋亡影响胚胎发育等过程[7]。
目前,HSPs同源物已经在细菌、植物、鱼类和哺乳类动物中相继被鉴定。按相对分子质量的大小可将 HSPs 分为HSP100、HSP90、HSP70、HSP60、HSP40 和小分子HSP等6个超基因家族,其中 HSP70 基因家族蛋白在生物体内分布最广且报道最多。根据其功能不同,可将HSP70蛋白分为参与哺乳动物细胞功能的结构型热激蛋白HSP73、参与多种胁迫响应的诱导型热激蛋白HSP72、定位于内质网的葡萄糖结合蛋白HSPA5 及定位于线粒体的HSPA9 蛋白等 [8]。
对哺乳动物HSP70的功能研究表明,HSP70蛋白在蛋白质的折叠、分解、降解方面具有重要的作用,能与大多数处于未折叠、错误折叠或聚集状态的蛋白质相互作用,主动降解和溶解异常的蛋白质聚集体[9-12]。在免疫反应中,HSP70还能作为先天性和适应性免疫的刺激物,并在某些条件下抑制T细胞介导的炎症反应[13]。
目前,鱼类 HSP22、HSP60、HSP70、HSP90等HSP家族的基因相继被报道,每个HSP家族蛋白序列具有高度的保守性[14]。其中,HSP70家族的多个成员,包括HSPA1、HSPA2、HSPA4、HSPA5、HSPA8、HSPA9、HSPA12 和HSPA14[15]已经在多种鱼类中被鉴定。已有研究表明,水温变化,细菌、病毒感染,低氧等应激因素均可刺激HSP70基因大量表达,HSP70可与变性蛋白结合,随后介导变性蛋白聚合物的降解,从而保护细胞[16]。然而斜带石斑鱼HSP70的功能尚不清楚。
本研究中,克隆了斜带石斑鱼HSP70 基因(EcHSP70),分析了该基因在脂多糖(LPS)与聚肌胞(Poly I∶C)刺激后的表达变化,并表达纯化了EcHSP70重组蛋白,为进一步研究EcHSP70在抗病原感染免疫中的作用奠定了基础。
1 材料与方法
1.1 材料
试验用斜带石斑鱼购自广东省湛江市某水产批发市场,取其肝脏、脾脏、肠、心脏、皮肤、肌肉、鳃、头肾、胸腺、脑等10个部位保存于RNAlater中,并提取其RNA反转录成cDNA后置于冰箱(-20 ℃)中保存。
试验试剂:pGEX-4T-1载体由广东省水产经济动物病原生物学及流行病学重点实验室保存;T4 DNA连接酶、Ex Taq酶、限制性内切酶(Sma I和Xho I)等购自TaKaRa公司(日本);DH5α competent cells和BL21(DE3) competent cells、质粒提取试剂盒等购自生工生物工程(上海)股份有限公司;TransZol Up Plus RNA Kit和相关反转录试剂盒、TransStart Green qPCR SuperMix等购自北京全式金公司;SDS-PAGE凝胶制备试剂盒购自西安晶彩生物科技有限公司;Western blot相关试剂与抗体、10×PBS、1×PBS购自碧云天公司。胰蛋白胨、无水乙醇等均为国药分析纯。
荧光定量所用的斜带石斑鱼脾脏细胞(GS细胞),由华南农业大学秦启伟老师惠赠。LPS购自碧云天公司,Poly I∶C 购自 Apexbio 公司。
蛋白纯化试剂:Washing buffer包含0.5% Triton-100、50 mmol/L Tris (pH 8.0)、300 mmol/L NaCl、10 mmol/L EDTA、10 mmol/L DTT;Resuspend buffer包含50 mmol/L Tris (pH 8.0)、100 mmol/L NaCl、10 mmol/L EDTA、10 mmol/L DTT,均现用现配。
1.2 方法
1.2.1 引物设计与合成及组织RNA提取 利用广东省水产经济病原生物学及流行病学重点实验室斜带石斑鱼转录组数据得到EcHSP70基因的开放阅读框(ORF),利用Primer 5.0软件设计正向引物与反向引物及荧光定量引物(表1)。根据TransZol Up Plus RNA Kit与反转录试剂盒说明书提取斜带石斑鱼组织RNA并反转录为cDNA。
表1 试验所用引物
Tab.1 Primer used in the test
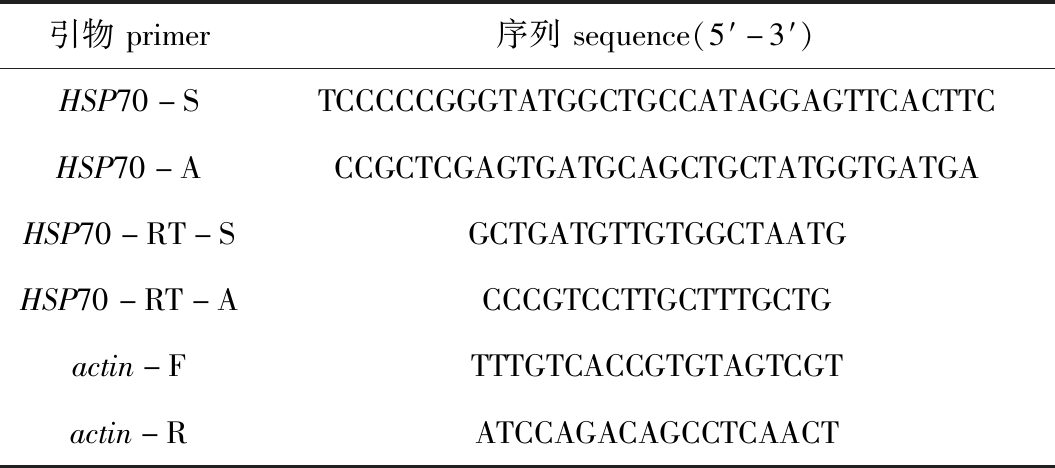
引物primer序列sequence(5′-3′)HSP70-STCCCCCGGGTATGGCTGCCATAGGAGTTCACTTCHSP70-ACCGCTCGAGTGATGCAGCTGCTATGGTGATGAHSP70-RT-SGCTGATGTTGTGGCTAATGHSP70-RT-ACCCGTCCTTGCTTTGCTGactin-FTTTGTCACCGTGTAGTCGTactin-RATCCAGACAGCCTCAACT
1.2.2 LPS、Poly I∶C刺激GS细胞后EcHSP70基因的表达 将GS细胞接种至24孔细胞培养板中,培养至细胞数量约为 1×105个/孔时,分别加入终质量浓度为1 mg/mL的LPS和5 mg/mL的Poly I∶C进行刺激[17],在刺激后0、4、8、12、24、48 h时收集细胞,按照细胞RNA提取试剂盒说明书提取细胞RNA,反转录为cDNA作为荧光定量PCR模板。荧光定量PCR反应体系(10 μL):cDNA模板0.5 μL,上、下游引物(HSP70-RT-S和HSP70-RT-A,10 μmol/L)各1 μL,2×SYBR Green Mix(Roche) 5 μL,dd H2O 2.5 μL。每个样品设置4个复孔,反应程序:95 ℃下预变性10 s;95 ℃下循环变性5 s,58 ℃下退火复性15 s,72 ℃下延伸20 s,共进行34个循环。按照 2-ΔΔCt 法计算基因相对表达量,采用 SPSS 19软件进行统计学分析。
1.2.3 EcHSP70原核表达载体构建 PCR反应体系(20 μL):上、下游引物(HSP70-S和HSP70-A,10 μmol/L)各1 μL,cDNA模板1 μL,EX Taq 10 μL,ddH2O 7 μL。PCR反应程序:94 ℃下预变性5 min;94 ℃下循环变性30 s,55 ℃下退火复性30 s,72 ℃下延伸90 s,共进行35个循环;最后在72 ℃下再延伸10 min,4 ℃下保存备用。
PCR产物经10 g/L琼脂糖凝胶电泳检测后进行胶回收,与表达载体pGEX-4T-1质粒DNA进行SmaⅠ和XhoⅠ双酶切。酶切产物经检测后进行胶回收,用T4 DNA连接酶连接过夜。连接产物转化至DH5α中,利用氨苄西林筛选阳性克隆。阳性克隆经PCR鉴定后送生工生物工程(广州)股份有限公司进行测序。正确的阳性克隆命名为EcHSP70-4T。
1.2.4 EcHSP70-4T载体诱导表达条件的优化 将构建好的EcHSP70-4T重组载体导入到E.coli BL21感受态细胞中,挑取阳性单克隆震荡培养后加入IPTG诱导。根据相关文献资料,对EcHSP70重组蛋白的表达条件进行优化[18],温度设为37、28、16 ℃,IPTG浓度设为1.0、0.6、0.2 mmol/L,并取各组样品进行SDS-PAGE电泳检测。
1.2.5 EcHSP70-4T重组蛋白纯化 取200 mL重组质粒菌液,37 ℃下以1.0 mmol/L IPTG诱导6 h,经破碎后以10 000×g离心30 min,去除上清,用玻璃棒将细菌碎片拨掉,尽量去除细菌碎片,用Washing buffer 洗涤3次,每次洗涤后以10 000×g离心10~20 min,第3次洗涤后用Resuspension buffer 充分重悬包涵体,以10 000×g离心10~20 min,以质量浓度为30 mg/mL 的尿素4 ℃下搅拌溶解后,再以10 000×g离心10~20 min,取上清50 μL制成样品,进行SDS-PAGE电泳检测。
1.2.6 EcHSP70-4T重组蛋白Western blot鉴定 将纯化后的EcHSP70-4T重组蛋白进行SDS-PAGE后,转印到PVDF膜,经质量分数为5%的脱脂奶粉4 ℃下封闭过夜,用TBST洗涤3次(10 min/次),加入小鼠抗GET标签的单克隆抗体(1∶10 000),室温下孵育2 h,再用TBST洗涤4次(10 min/次),加入HRP标记的山羊抗小鼠IgG(H+L)(1∶1 000),室温下孵育2 h,用TBST洗涤4次(10 min/次),采用ECL超敏发光液显影并拍照。
2 结果与分析
2.1 EcHSP70基因原核表达质粒构建
通过PCR扩增斜带石斑鱼HSP70基因,命名为EcHSP70(GenBank登录号:MW411059),扩增产物经过凝胶电泳检测,得到1 521 bp的目的条带(图1),经切胶回收、双酶切连接载体后检测,结果显示,插入的EcHSP70基因结构域完整,表明EcHSP70-4T重组质粒构建成功。
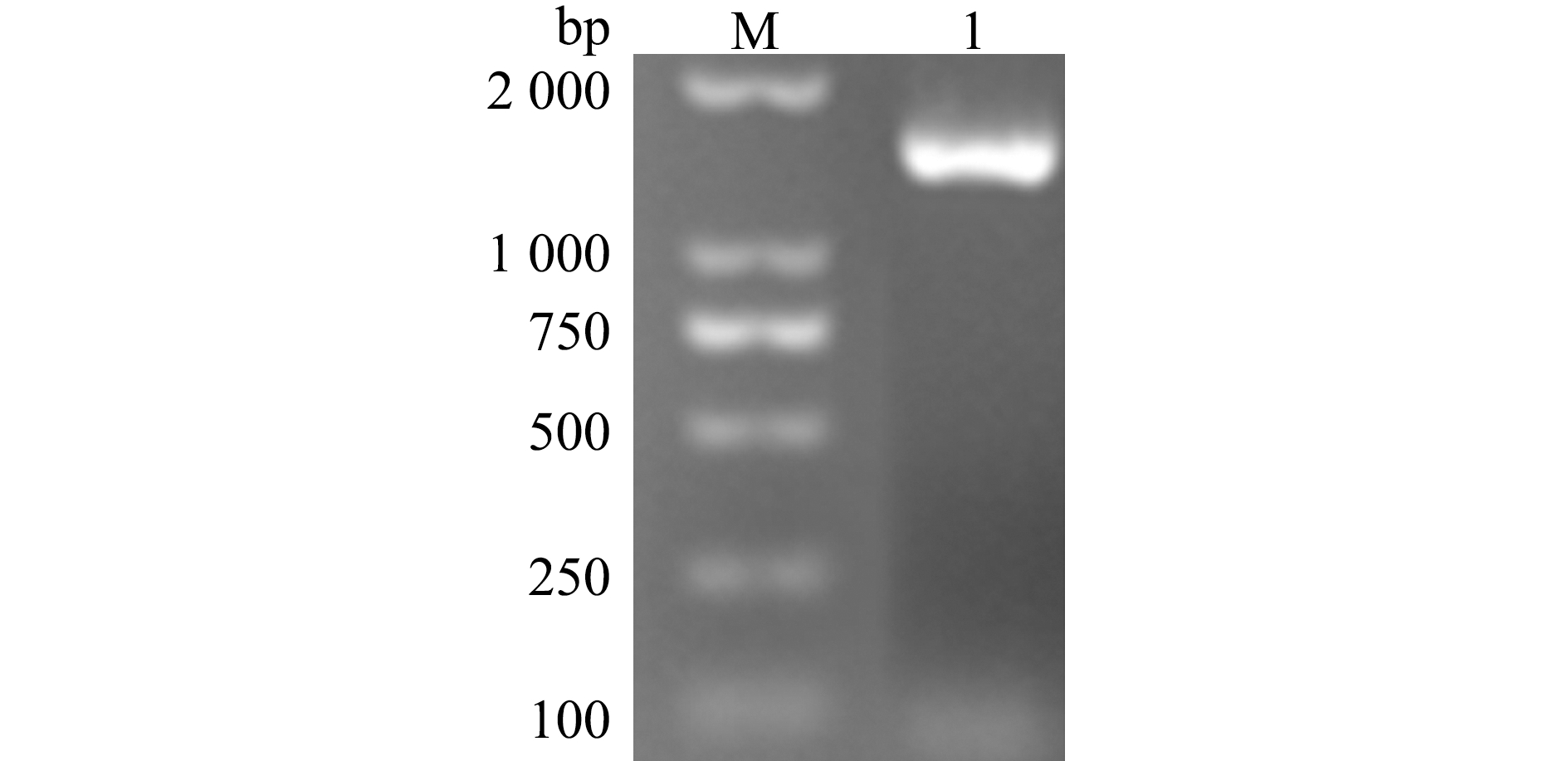
图1 EcHSP70基因的PCR产物
Fig.1 PCR products of EcHSP70 gene
2.2 LPS与Poly I∶C刺激GS细胞后EcHSP70的表达差异
从图2可见:LPS刺激GS细胞后,EcHSP70基因表达上调,在4 h达到最高(P<0.05),随后逐渐降至0 h水平;而Poly I∶C刺激GS细胞后,EcHSP70基因逐渐上升,在12 h时达到峰值。
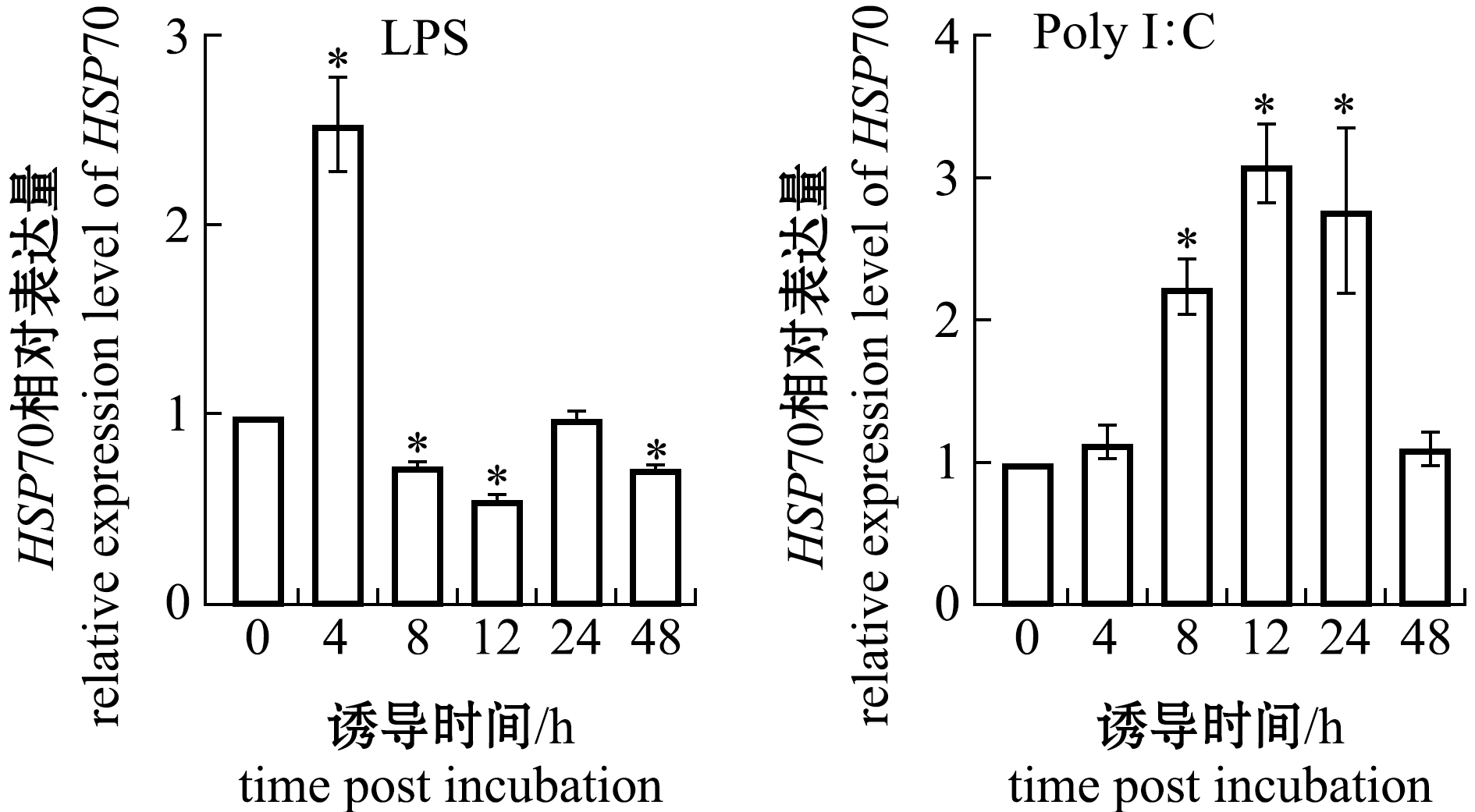
*表示该组与0 h组有显著性差异(P<0.05)。
*indicates significant differences compared to 0 h (P<0.05) .
图2 LPS与Poly I∶C刺激后EcHSP70基因表达模式
Fig.2 Expression profiles of EcHSP70 post LPS and Poly I∶C stimulation
2.3 重组蛋白的诱导表达与可溶性分析
分别取pGEX-4T-1未诱导组与诱导组、EcHSP70-4T未诱导组与诱导组样品经SDS-PAGE电泳检测,结果显示,pGEX-4T-1载体经过诱导后,在相对分子质量为26 000处有明显的GST标签表达,而EcHSP70-4T重组蛋白经过诱导后,其表达的EcHSP70蛋白相对分子质量约为96 000,与预期的目的条带相符(图3)。
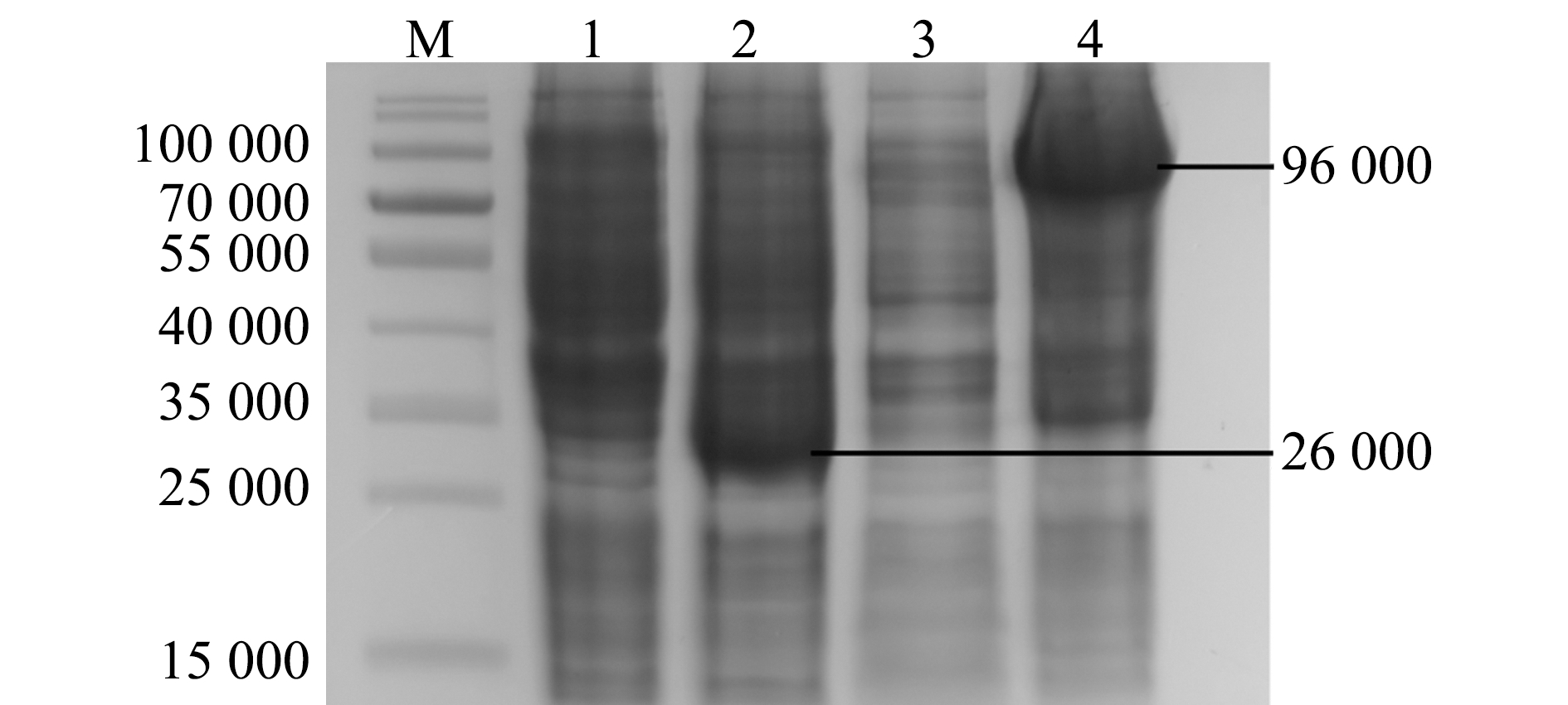
M—蛋白分子量标准;1—pGEX-4T未诱导组;2—pGEX-4T诱导组;3—重组蛋白未诱导组;4—重组蛋白诱导组。
M—protein marker;1—non-reduced pGEX-4T;2—reduced pGEX-4T;3—non-reduced recombinant protein;4—reduced recombinant protein.
图3 EcHSP70-4T重组蛋白的诱导表达与可溶性分析
Fig.3 Induction expression and solubility of EcHSP70-4T recombinant protein
取EcHSP70-4T阳性克隆分别在37、28、16 ℃,以及1.0、0.6、0.2 mmol/L 3个不同IPTG浓度下进行诱导。SDS-PAGE凝胶电泳结果显示,EcHSP70-4T重组蛋白在3个温度下的IPTG诱导组、上清组、沉淀组均有表达,且主要以包涵体形式表达,其中在37 ℃、IPTG为1.0 mmol/L条件下诱导的重组蛋白表达量最高(图4)。
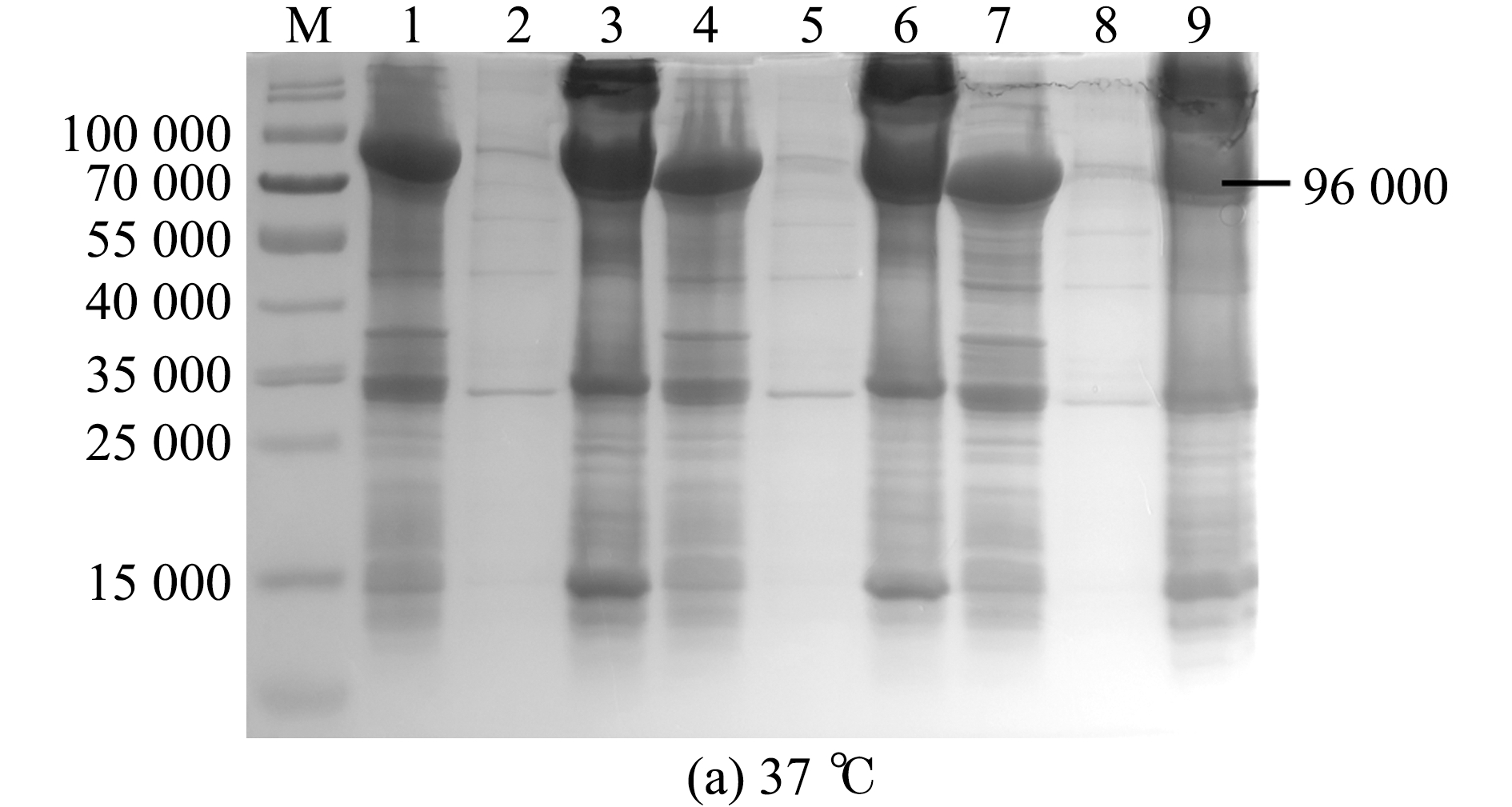
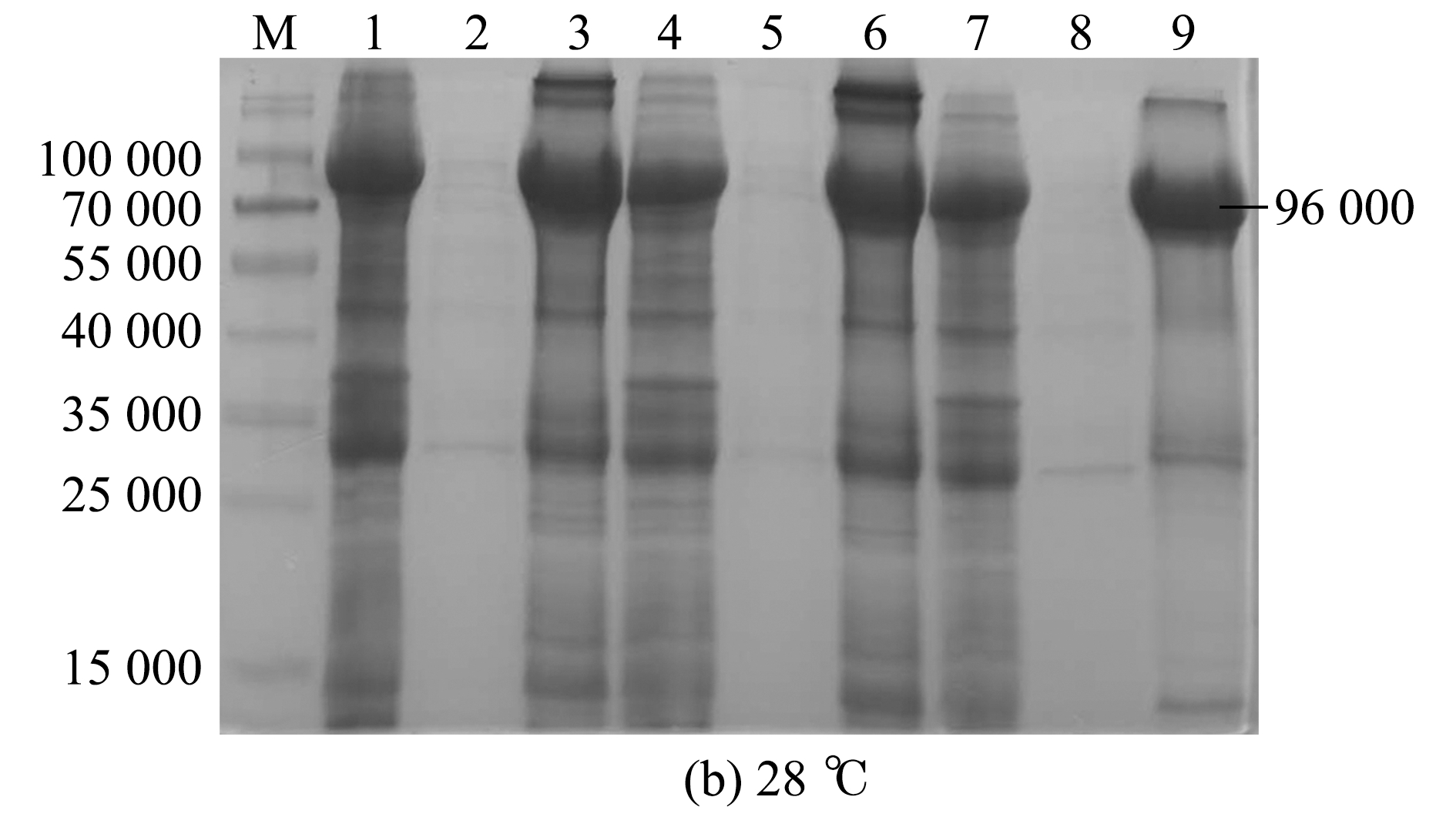
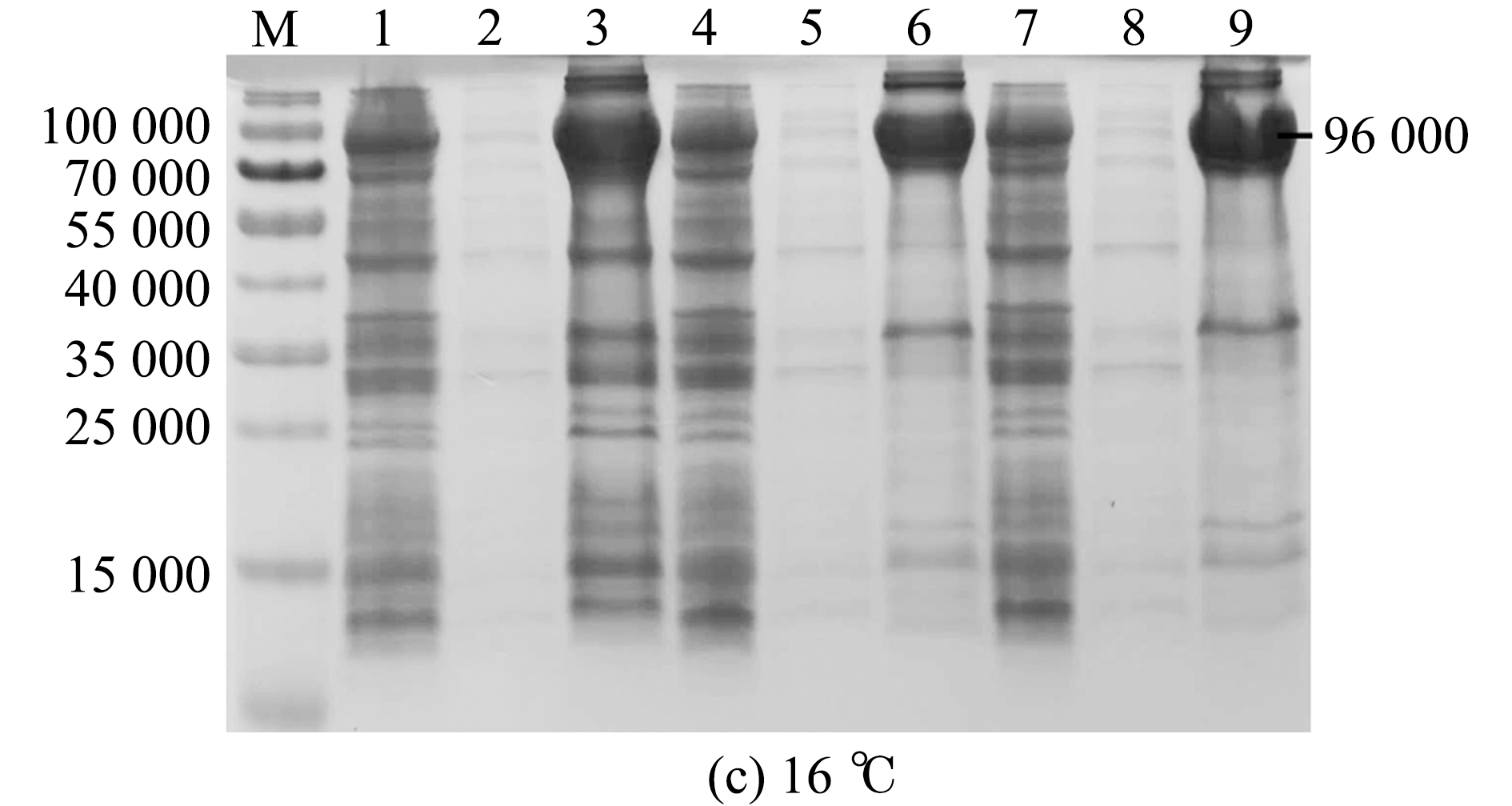
M—蛋白分子量标准;1~3—1.0 mmol/L IPTG诱导组、上清组、沉淀组;4~6—0.6 mmol/L IPTG诱导组、上清组、沉淀组;7~9—0.2 mmol/L IPTG诱导组、上清组、沉淀组。
M—protein marker;1-3—groups of recombinant protein,supernatant,and inclusion induced by 1.0 mmol/L IPTG;4-6—groups of recombinant protein,supernatant,and inclusion induced by 0.6 mmol/L IPTG; 7-9—groups of recombinant protein,supernatant,and inclusion induced by 0.2 mmol/L IPTG.
图4 37、28、16 ℃组EcHSP70-4T重组蛋白IPTG浓度优化
Fig.4 Concentration optimization of recombinant protein of EcHSP70-4T IPTG in 37,28,and 16 ℃ groups
2.4 EcHSP70-4T重组蛋白的纯化
对包涵体进行纯化后,利用SDS-PAGE检测,结果如图5所示,纯化后的包涵体条带较单一,纯度较高,可用于后续试验。
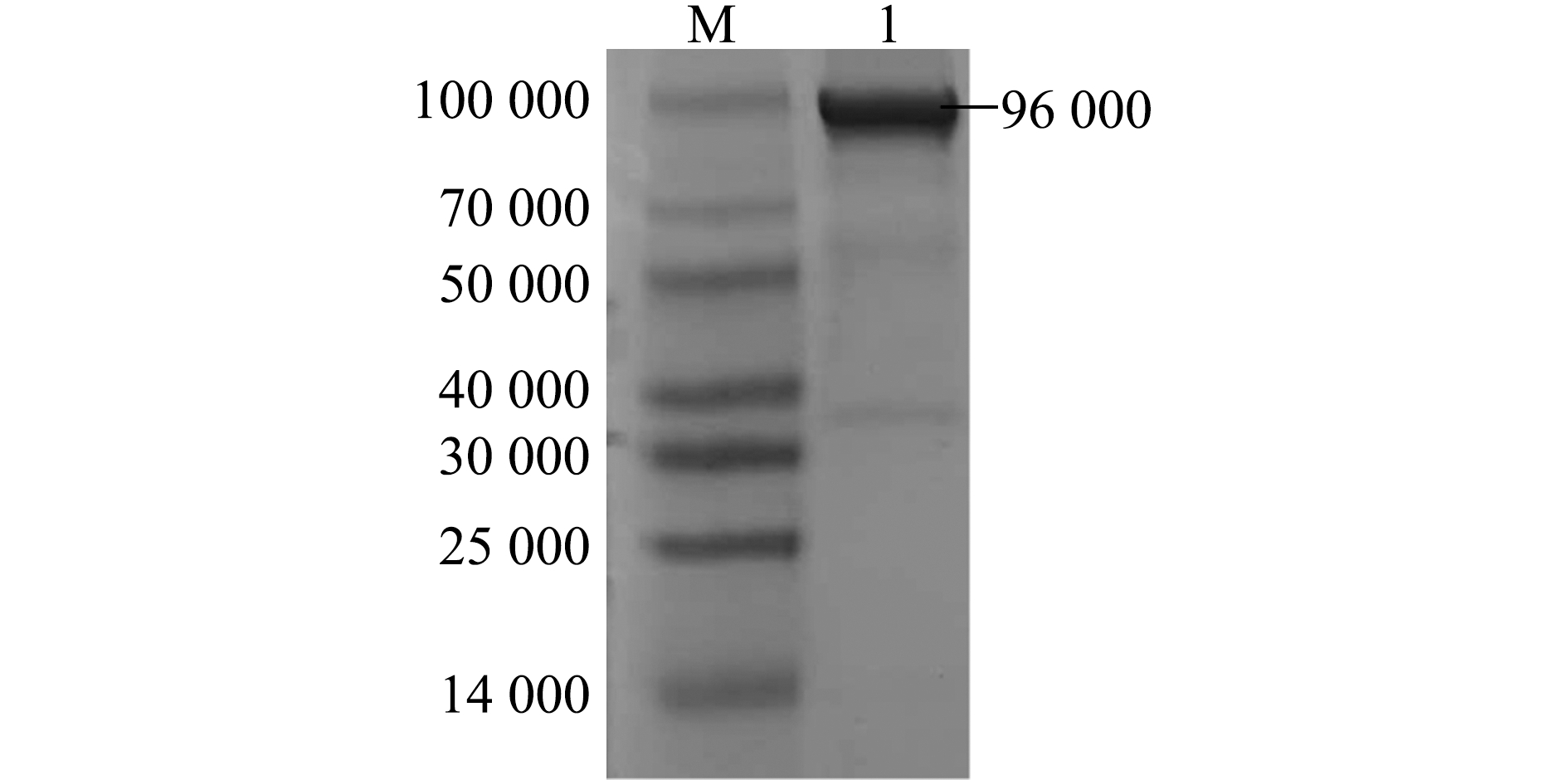
M—蛋白分子量标准;1—纯化的EcHSP70-4T包涵体蛋白。
M—protein marker;1—purified EcHSP70-4T recombinant protein.图5 EcHSP70-4T重组蛋白的纯化
Fig.5 Purification of EcHSP70-4T recombinant protein
2.5 重组蛋白的Western blot 鉴定
纯化后的样品经SDS-PAGE后转印至PVDF膜,进行 Western blot 鉴定,结果如图6所示,在相对分子质量约96 000处有明显的条带,与重组蛋白的大小一致。
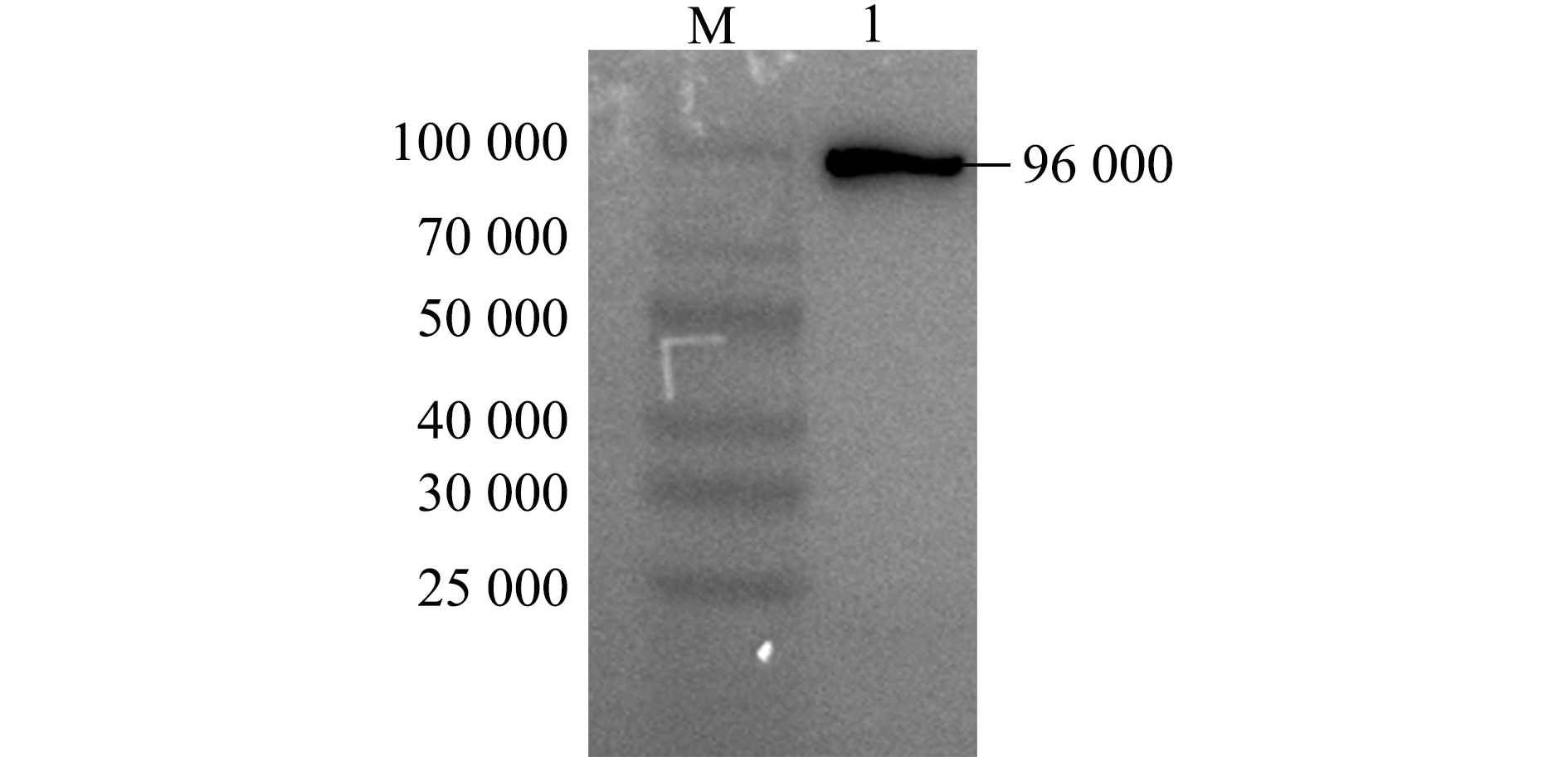
M—蛋白分子量标准;1—纯化的EcHSP70-4T重组蛋白。
M—protein marker; 1—purified EcHSP70-4T recombinant protein.
图6 EcHSP70-4T重组蛋白的Western blot鉴定
Fig.6 Western blot of EcHSP70-4T recombinant protein
3 讨论
3.1 LPS与Poly I∶C刺激GS细胞后EcHSP70基因的表达差异分析
HSP70蛋白在维持细胞稳态过程中发挥着重要作用,热休克、重金属、辐射、紫外线、磁场、细菌、病毒等刺激均可诱导该蛋白的表达[16,19]。LPS作为一种内毒素和重要群特异性抗原,为革兰氏阴性细菌细胞壁的主要成分,能刺激细胞释放炎症因子,诱导细胞凋亡[21-23]。本研究中,LPS刺激斜带石斑鱼脾脏细胞过程中EcHSP70基因的表达趋势,与Cui等[24]利用溶藻弧菌刺激斜带石斑鱼细胞时HSP70基因相对表达量的趋势类似。而Poly I∶C是双链RNA的类似物,能激活TLR3、PKR等细胞表面受体,诱导干扰素表达。Poly I∶C可以被MDA5和TLR3识别,从而激活Ⅰ型IFN的表达[25-26]。本研究表明,EcHSP70可能参与了IFN表达的调控。神经坏死病毒是鱼类养殖中危害严重的一种RNA病毒,已有研究表明,石斑鱼干扰素通路的相关因子如IRF3、MDA5及ISG15等均能影响该病毒的增殖[27],因此笔者推测,EcHSP70可能通过调节IFN的表达参与石斑鱼抗病毒免疫,后续将进一步对EcHSP70的功能展开分析。本研究中,EcHSP70基因在LPS和Poly I∶C刺激后表达上调,表明该分子可能参与了石斑鱼抗感染免疫反应。
3.2 EcHSP70-4T重组蛋白的制备
为了进一步研究HSP70的功能,本研究中构建了EcHSP70的原核表达质粒EcHSP70-4T。pGEX-4T-1 作为一种常用的原核表达载体,所表达的蛋白在N 端带有一个GST标签蛋白,其相对分子质量约为26 000。pGEX-4T-1 载体能在IPTG诱导下高效表达外源蛋白,且表达的融合蛋白又可通过GST 亲和层析柱简便、快速地纯化,得到高纯度的蛋白,所以许多原核表达研究使用pGEX-4T-1载体。
本研究中,诱导EcHSP70-4T重组蛋白表达并经SDS-PAGE检测,结果显示,在接近相对分子质量100 000处出现目的条带,与预期相符。其中,温度为37 ℃,IPTG为终浓度为0.6、1.0 mmol/L的诱导组上清有少量EcHSP70蛋白存在,所有组别的沉淀组与上清组相比,沉淀组在相对分子质量约96 000处有明显条带,说明斜带石斑鱼EcHSP70蛋白主要以包涵体形式表达。后续研究中将对获得的EcHSP70重组蛋白进行复性,并利用复性后的EcHSP70通过GST pull down技术钓取与该蛋白互作的病毒或细胞蛋白,为进一步了解该蛋白在抗病毒免疫中的作用网络及机制奠定基础。
4 结论
1)EcHSP70在LPS和Poly I∶C刺激后表达上调,表明该基因可能参与了石斑鱼抗感染免疫反应。
2)经SDS-PAGE检测,EcHSP70-4T重组蛋白相对分子质量约为96 000,并以包涵体形式表达。
[1] 朱志煌,林克冰,周宸,等.闽南地区斜带石斑鱼(Epinephelus coioides)神经坏死病毒的基因型与分子进化研究[J].渔业研究,2017,39(6):429-436.
ZHU Z H,LIN K B,ZHOU C,et al.The genotyping and molecular evolution analysis of nervous neurosis virus (NNV) in infected Epinephelus coioides in southern Fujian [J].Journal of Fisheries Research,2017,39(6):429-436.(in Chinese)
[2] LINDQUIST S,CRAIG E A.The heat-shock proteins[J].Annual Review of Genetics,1988,22:631-677.
[3] 王明强,张道远.植物热激蛋白70基因家族及其生物学功能研究进展[J].基因组学与应用生物学,2015,34(2):421-428.
WANG M Q,ZHANG D Y.Research advance of heat shock protein 70 gene family and its biological functions in plant [J].Genomics and Applied Biology,2015,34(2):421-428.(in Chinese)
[4] ITO S,NAGATA K.Roles of the endoplasmic reticulum-resident,collagen-specific molecular chaperone Hsp47 in vertebrate cells and human disease[J].Journal of Biological Chemistry,2019,294(6):2133-2141.
[5] YURINSKAYA M M,MIT’KEVICH V A,BARYKIN E P,et al.Heat-shock protein HSP70 protects neuroblastoma cells SK-N-SH from the neurotoxic effects of hydrogen peroxide and the β-amyloid peptide[J].Molecular Biology,2015,49(6):924-927.
[6] JINDAL D G,JINDAL V,JOSHI S,et al.Heat shock proteins in pathology:a review[J].Journal of Pierre Fauchard Academy (India Section),2016,30(3/4):84-87.
[7] KUMAR S,STOKES III J,SINGH U P,et al.Targeting Hsp70:a possible therapy for cancer[J].Cancer Letters,2016,374(1):156-166.
[8] WELCH W J.Mammalian stress response:cell physiology,structure/function of stress proteins,and implications for medicine and disease[J].Physiological Reviews,1992,72(4):1063-1081.
[9] MAYER M P,BUKAU B.Hsp70 chaperones:cellular functions and molecular mechanism[J].Cellular and Molecular Life Sciences,2005,62(6):670-684.
[10] DIAMANT S,BEN-ZVI A P,BUKAU B,et al.Size-dependent disaggregation of stable protein aggregates by the DnaK chaperone machinery[J].Journal of Biological Chemistry,2000,275(28):21107-21113.
[11] MAYER M P.Hsp70 chaperone dynamics and molecular mechanism[J].Trends in Biochemical Sciences,2013,38(10):507-514.
[12] MEIMARIDOU E,GOOLJAR S B,CHAPPLE J P.From hatching to dispatching:the multiple cellular roles of the Hsp70 molecular chaperone machinery[J].Journal of Molecular Endocrinology,2009,42(1):1-9.
[13] STOCKI P,WANG X N,DICKINSON A M.Inducible heat shock protein 70 reduces T cell responses and stimulatory capacity of monocyte-derived dendritic cells[J].Journal of Biological Chemistry,2012,287(15):12387-12394.
[14] BASU N,TODGHAM A E,ACKERMAN P A,et al.Heat shock protein genes and their functional significance in fish[J].Gene,2002,295(2):173-183.
[15] YAN H,LUO M J,YI M H,et al.Identification of a testis-enriched heat shock protein and fourteen members of Hsp70 family in the swamp eel[J].PLoS One,2013,8(6):e65269.
[16] WAGNER M,HERMANNS I,BITTINGER F,et al.Induction of stress proteins in human endothelial cells by heavy metal ions and heat shock[J].The American Journal of Physiology,1999,277(5):L1026-L1033.
[17] 邹子鸿,郑琦,黄瑜,等.尼罗罗非鱼淋巴毒素α基因克隆与表达分析[J].广东海洋大学学报,2019,39(6):1-8.
ZOU Z H,ZHENG Q,HUANG Y,et al. Cloning and expression analysis of gene lymphotoxin α in Nile tilapia (Oreochromis niloticus)[J].Journal of Guangdong Ocean University,2019,39(6):1-8.(in Chinese)
[18] 牛金中,黄瑜,汤菊芬,等.尼罗罗非鱼补体3基因片段的原核表达及条件优化[J].广东海洋大学学报,2018,38(2):80-84.
NIU J Z,HUANG Y,TANG J F,et al.Prokaryotic expression and optimization of complement 3 gene segment in Nile tilapia(Oreochromis niloticus)[J].Journal of Guangdong Ocean University,2018,38(2):80-84.(in Chinese)
[19] DEANE E E,LI J,WOO N Y S.Modulated heat shock protein expression during pathogenic Vibrio alginolyticus stress of sea bream[J].Diseases of Aquatic Organisms,2004,62(3):205-215.
[20] MING J H,XIE J,XU P,et al.Molecular cloning and expression of two HSP70 genes in the Wuchang bream (Megalobrama amblycephala Yih)[J].Fish & Shellfish Immunology,2010,28(3):407-418.
[21] ZHU H P,HUANG H Y,WU D M,et al.Regulatory mechanism of NOV/CCN3 in the inflammation and apoptosis of lung epithelial alveolar cells upon lipopolysaccharide stimulation[J].Molecular Medicine Reports,2020,21(4):1872-1880.
[22] WANG Y Y,SUN S P,ZHU H S,et al.GABA regulates the proliferation and apoptosis of MAC-T cells through the LPS-induced TLR4 signaling pathway[J].Research in Veterinary Science,2018,118:395-402.
[23] LU Z Y,LI Y C,RU J H,et al.Interaction of palmitate and LPS regulates cytokine expression and apoptosis through sphingolipids in human retinal microvascular endothelial cells[J].Experimental Eye Research,2019,178:61-71.
[24] CUI M,ZHANG Q Z,YAO Z J,et al.Molecular cloning and expression analysis of heat-shock protein 70 in orange-spotted grouper Epinephelus coioides following heat shock and Vibrio alginolyticus challenge[J].Journal of Fish Biology,2011,79(2):486-501.
[25] KATO H,TAKEUCHI O,SATO S,et al.Differential roles of MDA5 and RIG-I helicases in the recognition of RNA viruses[J].Nature,2006,441(7089):101-105.
[26] WESCH D,BEETZ S,OBERG H H,et al.Direct costimulatory effect of TLR3 ligand poly(I∶C) on human γδ T lymphocytes[J].The Journal of Immunology,2006,176(3):1348-1354.
[27] HUANG Y H,YU Y P,YANG Y,et al.Antiviral function of grouper MDA5 against iridovirus and nodavirus[J].Fish & Shellfish Immunology,2016,54:188-196.