南极磷虾Euhausia superba属于节肢动物门Arthropoda甲壳动物纲Crustacea磷虾目Euphausiacea磷虾科Euphausiidae磷虾属Euphausia磷虾种Euphausia superb。据评估,南极磷虾现有生物资源量约为3.79亿t[1]。南极海洋生物资源养护委员会(CCAMLR)规定每年南极磷虾的预警捕捞限额为860万t[2]。南极磷虾富含优质蛋白质、脂质、虾青素和甲壳素等物质,并具有非常强的抗氧化活性。近年来,南极磷虾已经成为全球远洋渔业的重要捕捞、加工对象,南极磷虾产品在饲料、化妆品和医药等领域均获得了广泛应用。因此,南极磷虾的高效开发与高值利用具有打造海洋生物战略性新兴产业的巨大潜力。
虾青素Astaxanthin,又称虾黄素,是一种酮式类胡萝卜素。由于虾青素具有良好的功能特性,在水产饲料、保健品、化妆品和医药等领域获得了广泛的应用[3]。根据来源不同,虾青素主要分为天然虾青素和合成虾青素,目前95%的虾青素产品是合成虾青素。随着食品安全和环境保护意识的提升、制备及应用技术的进步及天然虾青素价格的下降,天然虾青素正展现出更好的发展潜力。2017年虾青素的市值已达到5.5亿美元,预计2022年销售额将达到8.0亿美元,2025年有望达到10亿美元[4]。学术界和企业界围绕着虾青素的来源、制备技术及产品应用开展了大量工作,取得了积极进展。目前虾青素产业也面临着原料来源单一、制备方法亟待改进、产品功能急需拓展等问题。南极海域特殊的地理、气候环境赋予了南极磷虾独特的功能特性,巨大的生物资源量赋予了南极磷虾虾青素稳定的来源,因此,南极磷虾可以作为潜在的虾青素原料来源。此外,南极磷虾渔业相较于其他远洋渔业作业环境更加苛刻、产业成本更高,这给南极磷虾产业带来了更大的成本压力[5]。亟待开展以南极磷虾虾青素为代表的功效组分深度开发利用,推动南极磷虾产业的可持续发展。本文系统综述了南极磷虾虾青素研究进展,旨在为南极磷虾虾青素的深度研究和开发利用提供基础信息。
1 虾青素概述
虾青素(3,3′-二羟基-β,β′-胡萝卜素-4,4′-二酮基)属于烯萜类不饱和化合物,分子式为C40H52O4,分子量为596.84,结构如图1所示。虾青素具有较长的共轭双键链,其化学性质不稳定,属于弱极性化合物。由于虾青素化学结构的不同其存在多种异构体(几何和光学),最常见的虾青素几何异构体主要有9-顺式虾青素、13-顺式虾青素和15-顺式虾青素[4]。研究表明,位于虾青素共轭双键链两端的手性碳原子C-3和C-3′分别以R或S的形式存在,分别产生3种光学异构体,即全顺式(3S,3′S)、顺-反式(3S,3′R)和全反式(3R,3′R),其中(3S,3′S)和(3R,3′R)异构体为镜像(对映体)[6]。天然虾青素主要存在于真菌(红法夫酵母等)、藻类(雨生红球藻、绿球藻等)、甲壳动物和鲑鱼等[7]生物中,其主要以游离虾青素、虾青素单酯和虾青素双酯的形式存在[8]。
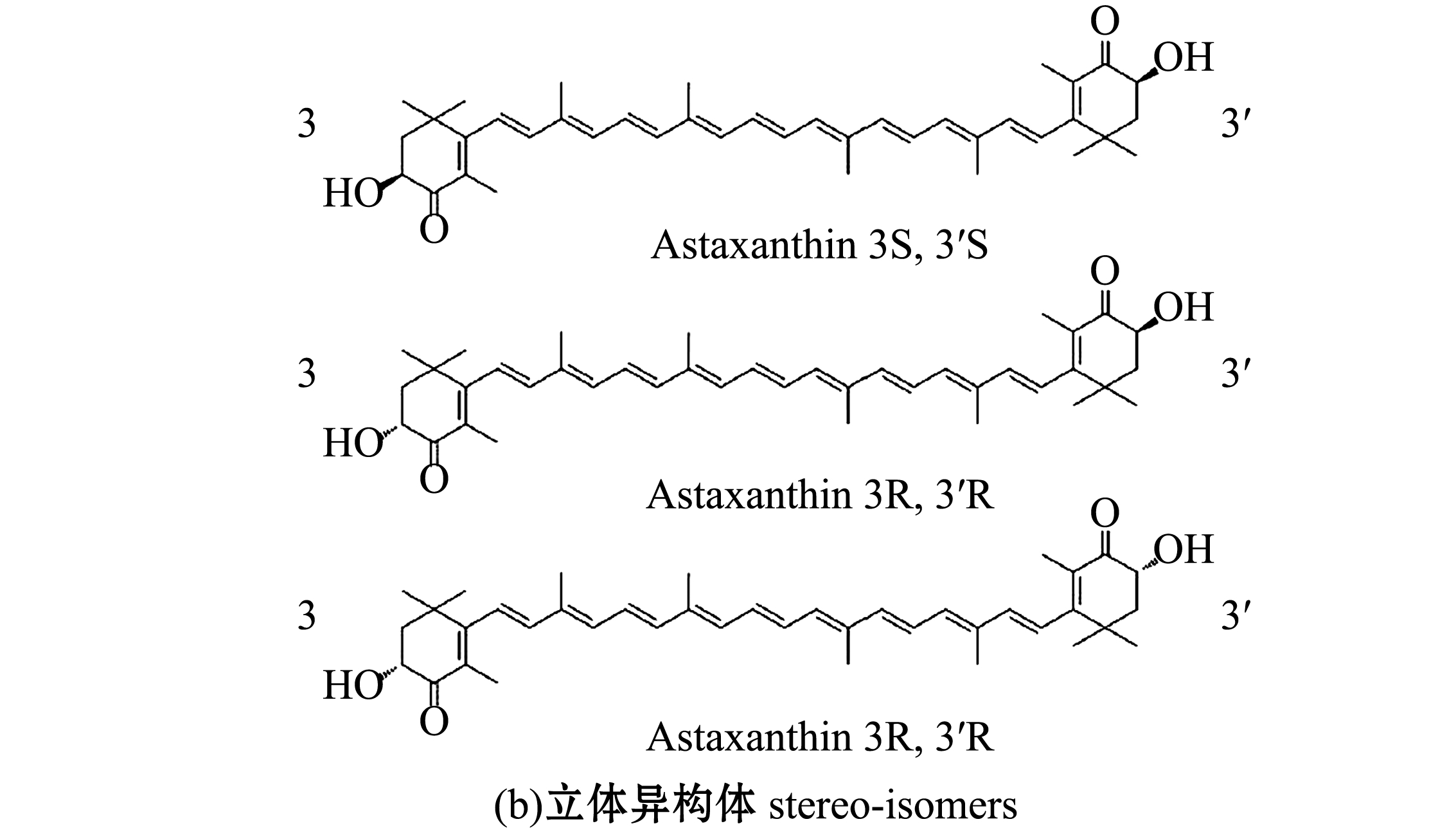
图1 虾青素结构及其立体异构体[4]
Fig.1 Structure and stereo-isomers of astaxanthin[4]
虾青素结构的差异导致其生物活性的不同。研究发现,虾青素双酯与游离虾青素、虾青素单酯相比具有更强的亲脂性,在肠道中的吸收更为活跃,生物利用效价更高[9]。自然环境中,虾青素主要由微藻、细菌、植物和酵母等合成。由于绝大多数动物体内不能直接合成虾青素,也不能把其他类胡萝卜素转化成虾青素,只能通过食物摄入获得。虾青素也被称为“超级维生素E”,主要是由于虾青素的抗氧化活性是β-胡萝卜素的10倍,是α-生育酚的100倍[10]。虾青素具有良好的生物学功效,如抗氧化、抗炎、抗衰老、抗肿瘤、预防心脑血管疾病、抗紫外线辐射、增强免疫能力、改善运动功能等[11]。虾青素还是唯一能穿透血-脑(blood-brain)、血-视网膜(blood-retina)屏障的酮式类胡萝卜素,对于中枢神经系统和脑功能也会产生积极影响,因此,虾青素可以作为一种功能因子应用于不同领域。但现有虾青素稳定性差、生物利用度低,在一定程度上限制了其应用。随着人们食品安全意识的增强及对化学合成食品添加剂的担忧,天然来源虾青素受到了人们的广泛关注。
2 南极磷虾虾青素
南极磷虾虾青素包括游离虾青素、虾青素单酯和虾青素双酯3种形式,主要以(3R,3′R)的形式存在[12]。南极磷虾虾青素的含量为30~40 μg/g。杨澍[13]研究发现,南极磷虾醋的脂肪酸主要以C20:5、C22:6和C18:1为主,含有少量的C16:0和C14:0。深入研究发现,南极磷虾虾青素可以通过淬灭单线态氧和清除自由基发挥抗氧化活性;同时虾青素分子两端各连接有一个紫罗兰酮环,每个紫罗酮环上含有羟基和酮基,这种独特的分子结构使其可以从内到外与细胞膜相连,其多烯链可以捕获细胞膜中的自由基,末端环可以清除细胞膜表面和内部的自由基,表现出比其他类胡萝卜素更好的生物活性[14-17]。但这种结构也使虾青素更容易受到光、热、氧等的作用而遭到破坏,影响其稳定性。南极磷虾虾青素的纯品是暗红棕色粉末,熔点为215~216 ℃;不溶于水,易溶于二氯甲烧、氯仿、二甲基亚砜、丙酮、苯、吡啶等有机溶剂,但在不同有机溶剂中的溶解度有差异。南极磷虾虾青素具有优异的功能特性,巨大而相对稳定的生物资源量,使其成为天然虾青素开发利用的良好选择。
3 南极磷虾虾青素的制备方法
3.1 南极磷虾虾青素提取方法
目前,虾青素的制备主要通过化学合成和天然提取两种方法。化学合成虾青素与天然虾青素在异构体含量、存在状态、生物活性及应用稳定性等方面存在较大差异[4]。现有的虾青素产品主要是化学合成虾青素,约占虾青素总量的95%,价格约为2 000 美元/kg,主要用于水产饲料领域;天然来源虾青素的价格约为5 000 美元/kg,主要用于膳食补充、化妆品和食品添加剂等领域。虾青素的国外生产企业主要有美国的Cyanotech公司和Mera制药公司,日本的FUJI公司、YAMAHA集团和Biogenic公司,印度的Bioprex公司和Parry公司,以色列的Algatech公司,瑞士的Roche公司,德国的BASF公司等;国内生产企业主要有云南爱尔发生物技术股份有限公司、荆州市天然虾青素有限公司和云南云彩金可生物技术有限公司等[4,7,18-19]。
目前,南极磷虾虾青素的提取方法主要包括有机溶剂法、酶解法和超临界CO2萃取法等(表1)。
表1 南极磷虾虾青素提取方法
Tab.1 Extraction methods of Antarctic krill astaxanthin
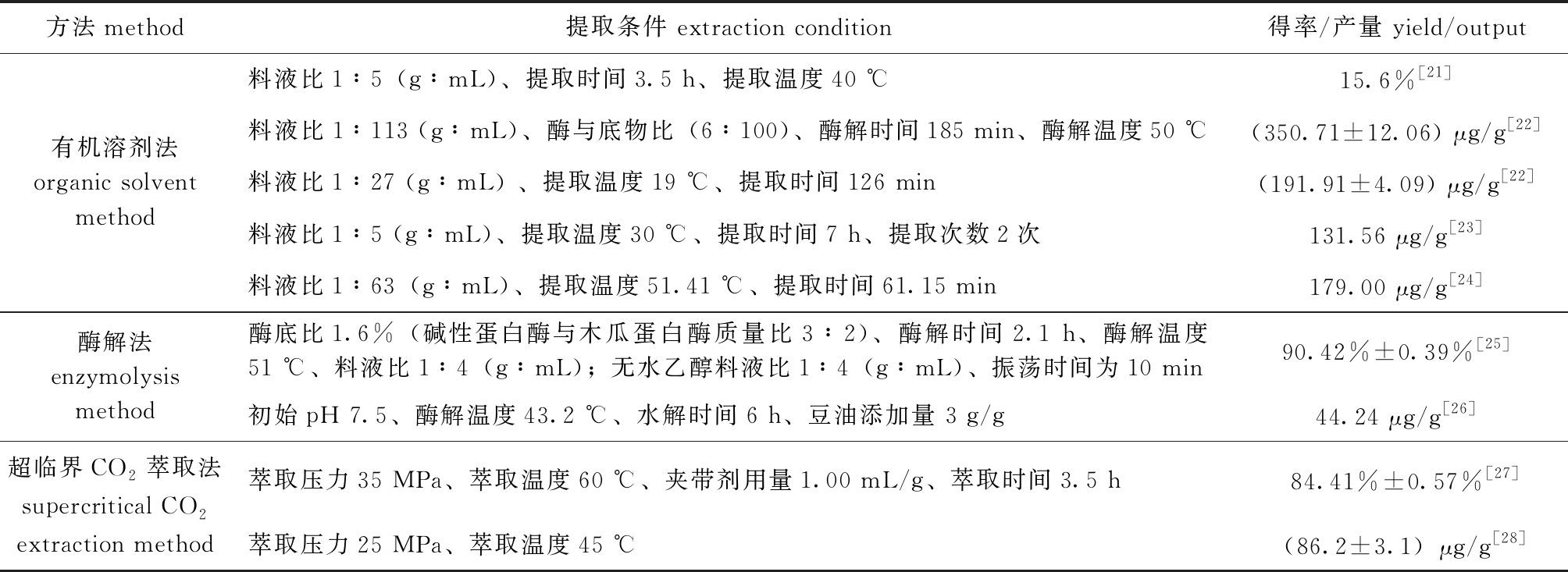
方法method提取条件 extraction condition得率/产量 yield/output有机溶剂法organic solvent method料液比1∶5(g∶mL)、提取时间3.5 h、提取温度40 ℃15.6%[21]料液比1∶113 (g∶mL)、酶与底物比(6∶100)、酶解时间185 min、酶解温度50 ℃(350.71±12.06) μg/g[22]料液比1∶27 (g∶mL) 、提取温度19 ℃、提取时间126 min(191.91±4.09) μg/g[22]料液比1∶5 (g∶mL)、提取温度30 ℃、提取时间7 h、提取次数2次131.56 μg/g[23]料液比1∶63(g∶mL)、提取温度51.41 ℃、提取时间61.15 min179.00 μg/g [24]酶解法enzymolysismethod酶底比1.6%(碱性蛋白酶与木瓜蛋白酶质量比3∶2)、酶解时间2.1 h、酶解温度51 ℃、料液比1∶4(g∶mL);无水乙醇料液比1∶4(g∶mL)、振荡时间为10 min90.42%±0.39%[25]初始pH 7.5、酶解温度43.2 ℃、水解时间6 h、豆油添加量 3 g/g44.24 μg/g[26]超临界CO2萃取法supercritical CO2extraction method萃取压力35 MPa、萃取温度60 ℃、夹带剂用量1.00 mL/g、萃取时间3.5 h84.41%±0.57%[27]萃取压力25 MPa、萃取温度45 ℃(86.2±3.1)μg/g[28]
3.1.1 有机溶剂法 有机溶剂萃取法是目前虾青素提取的主要方法,其优点是得率较高。虾青素为脂溶性色素,溶剂的选择既要考虑虾青素的溶解度又要考虑其极性。常用的有机溶剂主要有甲醇、乙醇、丙酮、异丙醇、二氯甲烷、氯仿、二甲基亚砜等及这些溶剂的组合[20]。但有机溶剂提取法不足之处是有些溶剂具有毒性,存在一定的安全隐患。
宋素梅[21]以酶解后的南极磷虾虾壳残渣和沉淀为原料,比较了不同有机溶剂对总类胡萝卜素提取率的影响。结果表明,虾壳残渣的最佳提取溶剂为丙酮,优化条件下总类胡萝卜素提取率为15.6%;沉淀的最佳提取溶剂为乙醇,最佳提取条件下总类胡萝卜素提取率为73.7%。此外,该研究者还分析了粗提液浓度、皂化温度和碱浓度对游离虾青素含量的影响,获得了合适的皂化条件,优化条件下游离虾青素含量为55.75 μg/mL。于晓[22]以南极磷虾虾壳为材料,比较了不同有机溶剂的提取效果,确定以丙酮为提取剂,优化条件下总类胡萝卜素提取率为(350.71±12.06)μg/g,与丙酮浸提取率(228.90±6.76)μg/g相比提高了53.21%。此外,该研究者还以南极磷虾粉为原料,以酵母菌为发酵剂,优化条件下获得的总类胡萝卜素提取率为(191.91±4.09)μg/g,与丙酮浸提取率(228.90±6.76)μg/g相比提高了24.41%。张晓燕[23]以南极磷虾虾壳为原料,以二氯甲烷为提取剂,利用响应面法优化提取条件,最佳提取条件下虾青素提取率为131.56 μg/g。
有机溶剂直接萃取的效果较好,但耗时长,需要辅助其他技术,常与超声波萃取、超高压萃取、微波萃取等方法联用以提高萃取效率。孙来娣[24]以南极磷虾粉为原料,采用二氯甲烷-甲醇作为提取剂,利用中心组合(Box-Behnken)试验设计优化虾青素提取因素,最佳提取条件下虾青素提取率为179.00 mg/kg。此外,有机溶剂通常具有较低的沸点,也可能会引起食品安全问题。
3.1.2 酶解法 酶解法是一种环境友好的提取技术,具有能耗小、时间短、反应条件温和的优点;常用作前处理方法破坏虾青素与蛋白质的结合,也可与其他方法联合同时提取甲壳素和虾青素。谈俊晓[25]以冷冻南极磷虾为原料,采用碱性蛋白酶和木瓜蛋白酶复合法酶解,以无水乙醇为提取剂,利用响应面优化法研究了虾青素的最佳提取工艺条件,最佳提取条件下虾青素的提取率为90.42%。这表明,采用双酶复合酶解法能够显著提高南极磷虾虾青素的提取效率。Wang等[26]以冷冻南极磷虾和大豆油为原料,利用内源酶的降解作用提取虾青素,提取获得的虾油中虾青素含量为44.24 mg/kg。
3.1.3 超临界CO2萃取法 超临界CO2萃取技术避免了有机溶剂法存在的萃取后溶剂分离的问题。同时由于其具有低黏度、高扩散系数等优异特性,能够更好地从固体样品中进行提取且在较低温度下进行,能够有效防止热敏性物质的降解损失。但超临界CO2萃取法相比有机溶剂萃取法需要更高端且耐高压的设备,投资较大。
翁婷等[27]以冻干的南极磷虾为原料,采用超临界CO2萃取南极磷虾虾青素,结合高效液相色谱法测定样品中虾青素的含量,最佳提取条件下虾青素提取率为84.41%±0.57%。Ali-Nehari等[28]比较了不同压力和温度条件下,超临界CO2与正己烷萃取虾青素得率的差异,结果表明,超临界CO2萃取虾青素的最高产量为(86.2±3.1)μg/g,正己烷萃取虾青素的产量为(103.2±1.3)μg/g。虽然超临界CO2萃取虾青素的产量略低,但不存在正己烷后续回收及回收不彻底引起的问题。
3.1.4 其他方法 Sun等[29]以冷冻南极磷虾为原料,采用可交换亲水性溶剂提取南极磷虾油,试验条件下南极磷虾虾青素最高提取率达到81.44%。
3.2 南极磷虾虾青素纯化方法
初步提取获得的南极磷虾虾青素通常含有低极性脂质、糖脂、有机酸/碱或无机盐等杂质,影响虾青素的色泽、稳定性和应用,还需要进一步纯化。目前,常用的虾青素纯化方法主要有薄层层析法、柱层析法和高效液相色谱法等[8,30]。
3.2.1 薄层层析法 薄层层析法是以涂布于支持板上的支持物作为固定相,以合适的溶剂为流动相,定性/定量样品的一种层析技术。在虾青素分离过程中,通常以硅胶和氧化铝作为固定相,以石油醚、正己烷及丙酮等作为展开剂,实现游离虾青素和虾青素单、双酯的快速分离。
丛心缘[31]考察了11种展开剂体系对虾青素的分离效果,结果发现,正己烷、丙酮、乙酸的体积比为8∶2∶0.2时,分离获得的虾青素双酯、单酯及游离虾青素比移值(retention factor value, Rf)分别为0.86、0.70、0.47。Yamaguchi等[32]利用薄层色谱法测定了南极磷虾虾青素的相对含量,但没有介绍不同形态虾青素含量的准确含量。
3.2.2 柱层析法 柱层析技术又称为柱色谱技术,根据样品混合物中各组分在固定相和流动相中分配系数的不同,可实现不同组分的分离。由于虾青素属于弱极性化合物,与脂肪酸结合的虾青素酯极性更小。因此,采用硅胶为固定相,以石油醚-乙酸乙酯或石油醚-丙酮作为洗脱体系,可实现极性相差较大的游离虾青素、虾青素单酯和双酯的分离。反相-高效液相色谱法(RP-HPLC)已经成为虾青素类化合物和类胡萝卜素分离必须使用的方法之一。目前,常以C18柱或C30柱作为固定相,由于虾青素和虾青素酯是一系列极性相近的疏水性化合物,因此,疏水性较强的C30柱更能与虾青素类化合物有较强的相互作用,分离虾青素酯效果更好。流动相常为甲醇-乙腈体系、甲醇-叔丁基甲醚体系等,需要时常加少量的酸或碱改善峰的对称性。
张莎莎[33]利用硅胶柱层析以石油醚-乙酸乙酯为洗脱剂分离南极磷虾虾青素单酯,提取率为38.14%,采用高效液相薄层色谱获得了纯度较高的虾青素。但该方法只能分别制备虾青素单酯或虾青素双酯,无法一次完成不同形态虾青素的分离。宋素梅[21]发现,大孔吸附树脂AB-8对虾青素的最大吸附量为476.2 μg/g干树脂,乙酸乙酯对虾青素的解吸率为98.7%,并得到动态吸附条件为虾青素上样质量浓度2 μg/mL、上柱速率4 BV/h,优化条件后,皂化液中虾青素的回收率为78.9%,纯度为92.4%;采用硅胶柱进一步纯化虾青素,回收率为92.9%,纯度为97.1%。因此,通过皂化反应将虾青素酯转化为游离虾青素,是分离纯化虾青素、提高最终虾青素产品得率的重要手段。为了减少皂化过程中虾青素的降解损失,姜启兴等[34]以南极磷虾虾壳为原料,以游离虾青素含量为指标,研究了南极磷虾虾壳中虾青素酯的皂化条件,结果表明,最适皂化条件为粗提液浓度0.1 g/mL、皂化温度5 ℃、碱浓度0.02 mol/L、皂化时间12 h,在最适条件下游离虾青素质量浓度为55.75 μg/mL。谈俊晓[25]通过优化确定了南极磷虾虾青素的皂化条件为NaOH-乙醇溶液浓度0.010 mol/L、皂化时间18 h,确定溶剂体系为正庚烷-丙酮-乙醇-水(体积比为5∶4∶6∶5),其固定相保留率为60.15%,在此条件下南极磷虾虾青素提取率为8.04%,纯度为98.12%。
综上所述,南极磷虾虾青素的提取方法与南极磷虾油脂的提取方法在基本原理和技术路线方面都比较相近。现有的有机溶剂提取法存在溶剂残留问题,超临界CO2提取法、薄层色谱法和高效液相色谱法仅适用于实验室规模。因此,虾青素制备方法还需要进一步优化和创新,亟待开发能够实现虾青素规模化生产、分离效果好、产品纯度高的制备方法。未来,南极磷虾虾青素的规模化制备可以与南极磷虾油脂的工业化制备技术相结合而开展。
4 南极磷虾虾青素的结构特征
南极磷虾虾青素的结构特征是决定其生物特性的基础。研究表明,南极磷虾虾青素主要是以酯的形式存在,其中虾青素单酯占25%~35%,双酯占55%~64%[33,35-36]。进一步研究发现,南极磷虾虾青素为全反式结构,以3种立体异构体形式存在,(3S,3′S)、(3R, 3′S)及(3R,3′R)3种立体异构体所占比例分别为10%~20%、10%~20%、60%~70%[13]。丛心缘[31]采用高效液相色谱-高分辨质谱(HPLC-HRMS),定性、定量研究了3种形态的南极磷虾虾青素,共鉴定出27种虾青素酯,其中,含量较高的虾青素双酯是Asta-C14:0/C16:0、Asta-C14:0/C14:0、Asta-C16:0/C16:0,含量较高的虾青素单酯是Asta-C14:0、Asta-C16:0和Asta-C18:1。张莎莎[33]首次报道采用高效液相薄层色谱制备获得(3R,3′R)南极磷虾虾青素和(3R,3′R)南极磷虾虾青素单酯;采用高效液相色谱检测并证实虾青素单酯中仅含一种(3R,3′R)虾青素异构体;采用GC-MS确定南极磷虾虾青素单酯中含12种脂肪酸。黄萌[37]采用液质联用分析游离南极磷虾虾青素样品,确定其相对分子质量为596.3,纯度为99.36%,这与天然虾青素的相对分子质量(596.86)相符,与虾青素标准品的紫外最大吸收波长(476 nm)也相符,故确定目标产物为游离南极磷虾虾青素。周庆新等[38]利用高效液相色谱-质谱法(HPLC-MS)分析了采用60%正己烷-乙醇提取所得南极磷虾油中虾青素分子种组成。其中,酯化态虾青素约占虾青素总量的98.38%,游离态虾青素约占1.62%;鉴定出虾青素双酯12种,总体相对含量达73.5%,超过虾青素单酯及游离态虾青素相对含量;鉴定出虾青素单酯5种,相对含量为24.88%。Lambertsen等[39]采用柱层析和薄层色谱法相结合分析南极磷虾虾青素双酯、单酯和游离态虾青素的相对含量分别为51%、43%和6%,其中酯化态虾青素的相对百分含量约为94%。然而,由于当时条件限制等因素,Takaichi等[35]采用场解吸质谱法(field desorption mass spectrometry, FD-MS)在南极磷虾酯中仅发现了5种脂肪酸(C12:0、C14:0、C16:0、C16:1和C18:1)。
目前,尽管已有一些学者对南极磷虾虾青素结构特征开展了相关研究,但是这些信息还缺乏系统性的分析和总结,还需要开展更多的深入研究,以全面、系统地阐明南极磷虾虾青素的结构特征。
5 南极磷虾虾青素的生物活性
南极磷虾虾青素的生物活性是其结构特征的反映。虾青素进入人体后能否发挥生物活性的关键因素是其吸收利用或储存在人体的比例,其利用率主要受分子结构、食物中的物理结合方式、膳食中脂肪含量,以及胃肠道中胰酶和胆盐含量等因素影响[40]。虾青素在体内通过淋巴系统输送到肝脏,与胆汁酸混合,在小肠内形成胶束,胶束被肠黏膜细胞部分吸收,将虾青素整合到乳糜中,而含有虾青素的乳糜在全身循环中释放进入淋巴后,被脂蛋白脂肪酶消化,乳糜残余物被肝脏和其他组织迅速清除。虾青素的吸收取决于与其一起摄入的食物成分(如脂质的含量和种类),高脂饮食可以增加虾青素的吸收,低脂饮食则减少其吸收。丛心缘[31]开展的D-半乳糖致衰老小鼠抗衰老试验结果表明,南极磷虾虾青素的抗氧化活性优于合成虾青素。目前,关于南极磷虾虾青素在体内消化、吸收、转运及代谢过程的研究还较少,针对不同分子结构的虾青素在生物体内的消化吸收过程及其作用机制研究则更是鲜见报道,今后应开展更多的深入研究。
6 南极磷虾虾青素的定量和定性检测
虾青素主要以游离和酯化的形式存在,游离虾青素只需要充分提取检测各异构体含量或者总量即可,而虾青素酯则需要先将其皂化或酶解成游离虾青素再进行检测。南极磷虾虾青素主要以酯的形式存在,虾青素检测方法是开展南极磷虾虾青素定性和定量研究的关键环节。目前,虾青素检测方法主要有紫外分光光度法(UV)、薄层色谱法(TLC)、激光拉曼光谱法、高效液相色谱法(HPLC)和高效液相色谱-质谱法(LC-MS)等[41]。
6.1 紫外-可见分光光度法
紫外-可见分光光度法是在190~800 nm波长范围内测定物质的吸光度,用于鉴别、杂质检查和定量测定的方法。由于虾青素类化合物在可见光区域内具有特征吸收,因此,可以采用UV 法定量检测。该方法简单快速、适用范围广、成本低,但也存在一定的缺点。采用分光光度法测定的虾青素含量要比高效液相色谱法偏高,原因是除了虾青素之外,其他类胡萝卜素如叶黄素、角黄素和β-胡萝卜素也可能被认为是虾青素,甚至叶绿素和一些虾青素降解产物也被误包含在虾青素中。
6.2 薄层色谱法
薄层色谱法不仅可以用来分离纯化虾青素类化合物,还可以结合扫描分析来定量虾青素。黄萌[37]采用高效薄层色谱法测定南极磷虾油中虾青素含量,该研究中采用高性能硅胶作为固定相,以正己烷-丙酮(体积比为7∶2)为流动相,可以实现10 min内完成分离,并结合TLC扫描仪分析光密度,虾青素回收率为98.53%。
6.3 高效液相色谱法
目前,虾青素的定量多采用高效液相色谱法,利用C18/C30柱,以甲醇/水或甲醇/乙腈体系为流动相,利用外标法定量虾青素含量。孙伟红等[42]首先将样品经无水MgSO4去除水分,以丙酮作为提取溶剂,提取液中加入N-丙基乙二胺填料分散固相萃取净化,经NaOH-甲醇溶液皂化后,以YMC-Carotenoid C30为色谱柱,紫外检测器测定表明,南极磷虾和虾粉中虾青素的定量限分别为2.5、5 mg/kg;在0.1~10 mg/L时,全反式虾青素的线性关系良好(r2>0.999);该方法的加标回收率为77.9%~91.3%,相对标准偏差为3.42%~8.75%。孙来娣[24]以南极磷虾油为原料,先采用固相萃取小柱预分离净化,经NaOH-甲醇溶液皂化,利用YMC-Carotenoid C30色谱柱分离获得3种虾青素同分异构体,该方法的加标回收率为86.1%~94.3%,相对标准偏差为0.79%~1.91%。
6.4 高效液相色谱-质谱联用法
高效液相色谱-质谱联用法结合了液相色谱的分离能力和质谱的高特异性检测的优点。丛心缘等[31]建立了南极磷虾中游离虾青素及虾青素酯的高效液相色谱-高分辨质谱分析方法,利用该方法在南极磷虾中鉴定出9种虾青素单酯和18种虾青素双酯,并利用峰面积法对其进行了定量。
6.5 不同检测方法的优缺点比较
综上所述,南极磷虾及其制品中虾青素的常用检测方法如分光光度法[24]、液相色谱法[43-44]、液相色谱-质谱法[35]和核磁共振波谱法[45]等各有优缺点。分光光度法是较常用的虾青素检测方法,但该法在测定过程中容易受到干扰,难以精确定量;液相色谱法是虾青素检测的主要方法,但存在着虾青素酯难以有效分离、标准品缺少、耗时长等问题,检测过程中如果温度和碱浓度偏高容易引起虾青素的异构化和损失,导致检测结果不准确;液相色谱-质谱法能够用于南极磷虾虾青素酯及脂肪酸的结构鉴定,实现虾青素多种几何异构体的分离,但对人员和设备要求比较高;核磁共振法能够实现虾青素异构体和虾青素酯的结构鉴定和定量分析,但仪器较贵,维护成本较高。
6.6 虾青素检测标准
目前,虾青素检测的方法主要依据2个国标、3个行业标准和1个地方标准[41]。1)国标GB/T 23745—2009。该标准主要用于检测饲料添加剂中虾青素含量,采用分光光度计比色法。2)国标GB/T 31520—2015。该标准主要用于检测红球藻中虾青素含量,采用HPLC方法。3)水产行业标准 SC/T 3053—2019。该标准主要用于检测水产品及其制品中虾青素含量,采用高效液相色谱法。4)出入境检验检疫行业标准SN/T2327—2009。该标准主要用于检测进出口动物源性食品中角黄素、虾青素的含量。5)中国医药保健品进出口商会团体标准T/CCCMHPIE1.21—2016,该标准源于美国药典。6)地方标准DB23/T 1275—2008。该标准主要用于饲料中虾青素含量的测定,采用高效液相色谱法。未来应针对南极磷虾虾青素的结构和理化特性,建立南极磷虾虾青素含量检测方法和标准。
7 南极磷虾虾青素的稳定性
虾青素的稳定性因其含有长共轭不饱和双键而易受光、热、酸、碱、氧及金属离子等影响发生异构化和降解,因此,虾青素的稳定性是虾青素应用并发挥其活性的重要前提。宋素梅[21]研究发现,南极磷虾虾青素在光照条件下很不稳定;随着温度的升高,虾青素损失加快,当温度在60~90 ℃范围时,降解加剧;碱浓度较低时虾青素比较稳定,酸浓度或碱浓度的波动都会引起虾青素的损失;钠、钾、镁、钙、锌和铝离子对虾青素基本没有影响,但铜、亚铁和铁离子对虾青素有明显的破坏作用。为了减缓虾青素的氧化速度,提高虾青素的储藏稳定性,赵永强等[46]以麦芽糊精、羟丙基-β-环糊精(HP-β-CD)为壁材,采用喷雾干燥法对南极磷虾虾青素进行微胶囊化包埋。结果表明,当麦芽糊精与HP-β-CD 壁材质量比为1∶3、虾青素添加量4.76%、聚山梨酯-80 添加量0.87%、固形物含量0.20 g/mL时,虾青素微胶囊包埋率为98.77%,制备获得的虾青素微胶囊水分含量为3.11%±0.11%,溶解度为94.32%±0.08%;稳定性试验表明,微胶囊化虾青素在高温、自然光、有氧条件下,虾青素的保留率分别从28.72%、45.27%、20.76%提高到了78.32%、84.88%和74.97%。这表明,微胶囊化能够明显改善南极磷虾虾青素的溶解性和稳定性。张晓燕[23]采用纳米包载技术包埋虾青素,发现虾青素纳米乳的粒径变大,TEM观察形态呈球形并且分布均匀,但包封率却降低;稳定性试验表明,与游离虾青素相比,虾青素通过纳米包埋后不容易异构降解。
抗氧化试验表明,虾青素经过包埋后能够长期维持虾青素的抗氧化活性。于晓[22]确定了南极磷虾虾青素的贮藏条件为4 ℃或-20 ℃,避光保存,避免接触金属介质或金属盐溶液(中性)。宋玉昆[47]比较了全脂型、甘油三酯型和磷脂型虾油虾青素在不同气体条件(有氧、无氧),不同温度条件(-20、5、25 ℃)贮藏的降解情况。结果表明,相同的贮藏条件下,磷脂型虾油中虾青素的降解速率最快;贮藏温度越高,虾青素的降解速率越快;在氧气贮藏条件下,虾青素的降解速率快于氮气贮藏;南极磷虾虾青素的降解符合一级反应动力学模型,该作者认为,阿伦尼乌斯公式能够较好地解释虾青素酯皂化反应数率常数的变化规律。因此,微胶囊化能够明显改善南极磷虾虾青素对光、热和氧的敏感性。综上所述,南极磷虾虾青素应当在低温、避光、密封条件下保存;有氧状态时,添加α-生育酚对虾青素微胶囊的稳定性有不利作用。Bustos等[48]研究发现,在前25 d微胶囊化对南极磷虾游离虾青素和虾青素单酯稳定性的影响下发挥了积极作用;但是,虾油溶液中的虾青素双酯稳定性较微胶囊化的虾青素更好。然而,25 d后这种情况发生了逆转。为了更好地维持南极磷虾虾青素的稳定性,有效提高南极磷虾虾青素的水溶性和生物利用度,实现靶向释放和定点释放。今后还应开展更多的虾青素脂溶性制剂、包合物、微胶囊和纳米制剂等稳态化保持技术的研究。
8 存在问题及展望
8.1 南极磷虾虾青素研究中存在的问题
南极磷虾虾青素因其天然来源的属性、巨大的生物资源量、良好的功能特性受到广泛关注。近年来,尽管南极磷虾虾青素研究已取得了一定进展,但整体上与雨生红球藻等来源虾青素研究相比还有一定差距,主要存在以下问题:1)南极磷虾虾青素作用机制尚不明确,新功能/新活性有待深入发掘;2)制备技术仍以传统方法为主,产品得率较低,专用性检测方法亟待开发;3)虾青素稳定性及有效载体相关研究薄弱等。
8.2 未来重点研究方向
针对上述问题,建议未来应在以下几方面重点开展研究。
1)机理研究。深入阐明南极磷虾虾青素的抗氧化、免疫调节及代谢机理,发掘其特有的功能特性及作用机制,揭示南极磷虾虾青素及其异构体的体内吸收、转运、选择、代谢路径,丰富和完善南极磷虾虾青素安全性评价,尤其是穿透血-脑、血-视网膜屏障的生理机制,阐明其功效的物质基础。
2)关键技术。开发南极磷虾虾青素的温和、绿色、环境友好型制备关键技术,研究替代传统有机溶剂、强酸、强碱法等制备技术;研发高效、精准的虾青素异构体分离分析技术;积极引入微波、超声和磁等新型技术,提高南极磷虾虾青素规模化制备效率和精准获得目标产物的能力,开发适宜于商业化开发的技术体系。
3)应用研发。基于南极磷虾虾青素的结构特征和理化特性,开展南极磷虾虾青素在复杂应用体系生物活性、稳态化保持和生物利用度技术;优选虾青素有效载体,有效解决南极磷虾虾青素的稳定性、靶向性及缓释性能的瓶颈问题;积极拓展南极磷虾虾青素在食品、饲料、营养品、化妆品和药品等领域的利用。
总之,重点为获得高稳定性和高生物利用度南极磷虾虾青素构型及异构体和稳态化产品的设计提供依据,为南极磷虾虾青素的高值化利用提供新的策略和方案,拓展南极磷虾虾青素的应用领域和范围,更好地造福人类。
[1] ATKINSON A,SIEGEL V,PAKHOMOV E A,et al.A re-appraisal of the total biomass and annual production of Antarctic krill[J].Deep Sea Research Part I:Oceanographic Research Papers,2009,56(5):727-740.
[2] NICOL S,FOSTER J,KAWAGUCHI S.The fishery for Antarctic krill—recent developments[J].Fish and Fisheries,2012,13(1):30-40.
[3] 孙伟红.不同来源虾青素的分离制备及其构效关系研究[D].青岛:中国海洋大学,2015:1-50.
SUN H W.Isolation and preraration of astaxanthin from different sources and the structure-activity relationship [D].Qingdao:Ocean University of China,2015:1-50.(in Chinese)
[4] LI X,WANG X Q,DUAN C L,et al.Biotechnological production of astaxanthin from the microalga Haematococcus pluvialis[J].Biotechnology Advances,2020,43:107602.
[5] SUZUKI T,SHIBATA N.The utilization of Antarctic krill for human food [J].Food Reviews International,1990,6(1):119-147.
[6] QIU D,WU Y C,ZHU W L,et al.Identification of geometrical isomers and comparison of different isomeric samples of astaxanthin[J].Journal of Food Science,2012,77(9):C934-C940.
[7] AMBATI R R,PHANG S M,RAVI S,et al.Astaxanthin:sources,extraction,stability,biological activities and its commercial applications—a review[J].Marine Drugs,2014,12(1):128-152.
[8] NGUYEN K D.Astaxanthin:a comparative case of synthetic vs.natural production[J].Chemical and Biomolecular Engineering Publications and Other Works,2013,1(1):1-11.
[9] 高岩,邢丽红,孙伟红,等.不同来源虾青素提取、纯化及定量检测方法的研究进展[J].食品安全质量检测学报,2020,11(5):1414-1423.
GAO Y,XING L H,SUN W H,et al.Research progress on extraction,purification and quantitative detection methods of astaxanthin from different sources [J].Journal of Food Safety & Quality,2020,11(5):1414-1423.(in Chinese)
[10] HIGUERA-CIAPARA I,FÉLIX-VALENZUELA L,GOYCOOLEA F M.Astaxanthin:a review of its chemistry and applications[J].Critical Reviews in Food Science and Nutrition,2006,46(2):185-196.
[11] FAKHRI S,ABBASZADEH F,DARGAHI L,et al.Astaxanthin:a mechanistic review on its biological activities and health benefits[J].Pharmacological Research,2018,136:1-20.
[12] MAOKA T,KATSUYAMA M,KANEKO N,et al.Stereochemical investigation of carotenoids in the Antarctic krill Euphausia superba[J].Nippon Suisan Gakkaishi,1985,51(10):1671-1673.
[13] 杨澍.南美白对虾中虾青素类化合物在贮藏及加工过程中变化规律的研究[D].青岛:中国海洋大学,2015:5-30.
YANG S.Study on variation law in the storage and processing of astaxanthin compounds in Litopenaeus vannamei [D].Qingdao:Ocean University of China,2015:5-30.(in Chinese)
[14] NAGUIB Y M.Antioxidant activities of astaxanthin and related carotenoids[J].Journal of Agricultural and Food Chemistry,2000,48(4):1150-1154.
[15] ZHAO T,YAN X J,SUN L J,et al.Research progress on extraction,biological activities and delivery systems of natural astaxanthin[J].Trends in Food Science & Technology,2019,91:354-361.
[16] KISHIMOTO Y,YOSHIDA H,KONDO K.Potential anti-atherosclerotic properties of astaxanthin[J].Marine Drugs,2016,14(2):35.
[17] YAMASHITA E.Astaxanthin as a medical food[J].Functional Foods in Health & Disease,2013,3(7):254-258.
[18] LIM K C,YUSOFF F M,SHARIFF M,et al.Astaxanthin as feed supplement in aquatic animals[J].Reviews in Aquaculture,2018,10(3):738-773.
[19] GONG M Y,BASSI A.Carotenoids from microalgae:a review of recent developments[J].Biotechnology Advances,2016,34(8):1396-1412.
[20] ROUTRAY W,DAVE D,CHEEMA S K,et al.Biorefinery approach and environment-friendly extraction for sustainable production of astaxanthin from marine wastes [J].Critical Reviews in Biotechnology,2019,39(4):469-488.
[21] 宋素梅.南极磷虾壳中虾青素的提取与分离纯化[D].无锡:江南大学,2013:20-40.
SONG S M.Extraction and purification of astaxanthin from Antarctic krill shells [D].Wuxi:Jiangnan University,2013:20-40.(in Chinese)
[22] 于晓.南极大磷虾(Euphausia superba)虾青素制备与理化性质的研究[D].青岛:中国海洋大学,2013:5-35.
YU X.Study on extraction and physiochemical properties of Antarctic krill (Euphausia superba) astaxanthin [D].Qingdao:Ocean University of China,2013:5-35.(in Chinese)
[23] 张晓燕.南极磷虾壳中虾青素提取纯化与纳米包载[D].青岛:中国海洋大学,2013:3-30.
ZHANG X Y.Study on the extraction,purification and encapsulation of astaxanthin from Antarctic krill shell [D].Qingdao:Ocean University of China,2013:3-30.(in Chinese)
[24] 孙来娣.南极磷虾产品关键质量指标检测方法的研究[D].青岛:青岛大学,2013:5-35.
SUN L D.Study on the detection method of key quality indexes of Antarctic krill products [D].Qingdao:Qingdao University,2013:5-35.(in Chinese)
[25] 谈俊晓.南极磷虾虾青素制备及稳定性研究[D].上海:上海海洋大学,2018:5-35.
TAN J X.Study on preparation and stability of astaxanthin from Antarctic krill [D].Shanghai:Shanghai Ocean University,2018:5-35.(in Chinese)
[26] WANG L Z,SHEN Y,DU Y J,et al.Recovery of soybean oil containing functional ingredients from Antarctic krill (Euphausia superba) using an improved aqueous enzymatic extraction method[J].European Journal of Lipid Science and Technology,2018,120(8):1800144.
[27] 翁婷,金银哲,陶宁萍,等.南极磷虾中虾青素超临界CO2萃取方法研究[J].天然产物研究与开发,2013,25(10):1404-1410.
WENG T,JIN Y Z,TAO N P,et al.Supercritical carbon dioxide extraction of astaxanthin from Antarctic krill (Euphausia superba) [J].Natural Product Research and Development,2013,25(10):1404-1410.(in Chinese)
[28] ALI-NEHARI A,KIM S B,LEE Y B,et al.Characterization of oil including astaxanthin extracted from krill (Euphausia superba) using supercritical carbon dioxide and organic solvent as comparative method[J].Korean Journal of Chemical Engineering,2012,29(3):329-336.
[29] SUN W W,HUANG W C,SHI B W,et al.Effective Antarctic krill oil extraction using switchable hydrophilicity solvents[J].Marine Life Science & Technology,2020,2(1):41-49.
[30] SOWMYA R,SACHINDRA N M.Evaluation of antioxidant activity of carotenoid extract from shrimp processing byproducts by in vitro assays and in membrane model system[J].Food Chemistry,2012,134(1):308-314.
[31] 丛心缘.南极磷虾中虾青素的分离、鉴定及抗氧化活性研究[D].青岛:中国海洋大学,2019:10-20.
CONG X Y.Isolation,identification and antioxidant activity of astaxanthin from Antarctic krill [D].Qingdao:Ocean University of China,2019:10-20.(in Chinese)
[32] YAMAGUCHI K,MIKI W,TORIU N,et al.The composition of carotenoid pigments in the Antarctic krill Euphausia superba[J].Bulletin of the Japanese Society of Scientific Fisheries,1983,49(9):1411-1415.
[33] 张沙沙.南极磷虾虾青素及虾青素酯分离研究[D].济南:山东师范大学,2015:13-30.
ZHANG S S.Separation of astaxanthin and astaxanthin esters from Antarctic krill [D].Jinan:Shandong Normal University,2015:13-30.(in Chinese)
[34] 姜启兴,宋素梅,夏文水,等.南极磷虾壳中虾青素酯的皂化工艺研究[J].食品工业科技,2014,35(8):233-236.
JIANG Q X,SONG S M,XIA W S,et al.Study on the saponification technique of astaxanthin esters from Antarctic krill shells [J].Science and Technology of Food Industry,2014,35(8):233-236.(in Chinese)
[35] TAKAICHI S,MATSUI K,NAKAMURA M,et al.Fatty acids of astaxanthin esters in krill determined by mild mass spectrometry[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2003,136(2):317-322.
[36] FOSS P,RENSTRØM B,LIAAEN-JENSEN S.Natural occurrence of enantiomeric and Meso astaxanthin:7*-crustaceans including zooplankton[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1987,86(2):313-314.
[37] 黄萌.南极磷虾中虾青素的提取与纯化[M].济南:山东师范大学,2012:5-25.
HUANG M.The extraction and purification of astaxanthin from Antarctic krill (Euphausia superba) [D].Jinan:Shandong Normal University,2012:5-25.(in Chinese)
[38] 周庆新,黄子倩,谷彩霞,等.南极磷虾油中虾青素分子种组成及其消化吸收特性研究[J].食品工业科技, 2021,42(12):347-353.
ZHOU Q X,HUANG Z Q,GU C X,et al.Molecular composition,digestion and absorption characteristics of astaxanthin in Antarctic krill oil[J].Science and Technology of Food Industry,2021,42(12):347-353.(in Chinese)
[39] Lambertsen G,Braekkan O R.Method of analysis of astaxanthin and its occurrence in some marine products[J].Journal of the Science of Food and Agriculture,2010,22(2):99-101.
[40] SY C,GLEIZE B,DANGLES O,et al.Effects of physicochemical properties of carotenoids on their bioaccessibility,intestinal cell uptake,and blood and tissue concentrations[J].Molecular Nutrition & Food Research,2012,59(9):1385-1397.
[41] 张舟艺,曲雪峰,胡文力,等.虾青素的检测及生物活性研究进展[J].食品安全质量检测学报,2020,11(5):1431-1437.
ZHANG Z Y,QU X F,HU W L,et al.Research progress on detection and biological activity of astaxanthin [J].Journal of Food Safety & Quality,2020,11(5):1431-1437.(in Chinese)
[42] 孙伟红,邢丽红,冷凯良,等.高效液相色谱法测定南极磷虾及其制品中虾青素的含量[J].食品安全质量检测学报,2017,8(4):1248-1253.
SUN W H,XING L H,LENG K L,et al.Determination of astaxanthin in Antarctic krill and its products by high performance liquid chromatography [J].Journal of Food Safety & Quality,2017,8(4):1248-1253.(in Chinese)
[43] 孙伟红,冷凯良,邢丽红,等.GPC-HPLC法测定南极磷虾油中虾青素及校正因子计算[J].分析试验室,2013,32(2):26-30.
SUN W H,LENG K L,XING L H,et al.Determination of astaxanthin in Antarctic krill oil by GPC-high performance liquid chromatography and calculation of correction factor [J].Chinese Journal of Analysis Laboratory,2013,32(2):26-30.(in Chinese)
[44] 王松,郝鹏飞,赵鑫鹏,等.高效液相色谱法检测南极磷虾油中总虾青素含量[J].分析测试学报,2016,35(4):482-486.
WANG S,HAO P F,ZHAO X P,et al.Determination of total astaxanthin in Antarctic krill oil by high performance liquid chromatography [J].Journal of Instrumental Analysis,2016,35(4):482-486.(in Chinese)
[45] GRYNBAUM M D,HENTSCHEL P,PUTZBACH K,et al.Unambiguous detection of astaxanthin and astaxanthin fatty acid esters in krill (Euphausia superba Dana)[J].Journal of Separation Science,2005,28(14):1685-1693.
[46] 赵永强,谈俊晓,李来好,等.南极磷虾虾青素微胶囊制备工艺优化及其理化性质研究[J].渔业科学进展,2019,40(5):185-194.
ZHAO Y Q,TAN J X,LI L H,et al.Optimization of the preparation process and the physicochemical properties of Antarctic krill astaxanthin microcapsules [J].Progress in Fishery Sciences.2019,40(5):185-194.(in Chinese)
[47] 宋玉昆.南极磷虾油高真空脱溶及其虾青素贮藏稳定性研究[D].大连:大连工业大学,2015:20-30.
SONG Y K.Effects of vacuum desolventizing process on Antarctic krill oil and stability of astaxanthin during storage [D].Dalian:Dalian Polytechnic University,2015:20-30.(in Chinese)
[48] BUSTOS R,ROMO L,Y
 EZ K,et al.Oxidative stability of carotenoid pigments and polyunsaturated fatty acids in microparticulate diets containing krill oil for nutrition of marine fish larvae [J].Journal of Food Engineering,2003,56(2/3):289-293.
EZ K,et al.Oxidative stability of carotenoid pigments and polyunsaturated fatty acids in microparticulate diets containing krill oil for nutrition of marine fish larvae [J].Journal of Food Engineering,2003,56(2/3):289-293.