南极磷虾Euphausia superba作为一种丰富的海洋生物资源,壳体中含有大量的甲壳素。壳聚糖(chitosan,CS)是甲壳素脱乙酰化后的产物,是天然存在的唯一碱性多糖。目前,商品化CS的来源主要是虾蟹壳。南极磷虾壳薄柔软,处理方便,相比从其他虾类中提取甲壳素所需的时间更短,效率更高[1-3]。因此,南极磷虾壳可以作为CS制备的有效来源。
由于CS在中性pH条件下基本不溶于水,限制了其应用,因此,水溶性CS成为国内外学者的研究热点。孟祥君[4]以CS为原料,氯乙酸为羧甲基试剂,油酸为酰化试剂,制备出羧甲基油酸壳聚糖,两者在pH中性及碱性条件下都是可溶的。Wang等[5]也制备出了比CS具有更好水溶性的O-季铵化壳聚糖。羧甲基壳聚糖(carboxymethyl chitosan,CMC)是CS醚化改性后的重要产品之一,具有比CS更好的生物活性(抗氧化性等)和性能(阻氧、保湿、透气和成膜性等)[6-8]。目前,国内外对CMC的研究非常广泛。郭睿等[9]以CS和氯乙酸为原料,合成了CMC,但所需制备时间为7 h,耗时较长。郑丝柳等[10]利用废弃淡水龙虾壳,采用两步加碱法制备CMC,以二甲亚砜代替异丙醇作为反应溶剂,虽然产物取代度有所提高,但是耗时较长,操作繁琐。Muzzarelli等[11]以乙醛酸为羧甲基化试剂制得了N-CMC,但乙醛酸成本较高,且其后处理条件苛刻。CMC制备的方法较多,但是存在制备时间长、操作繁琐等缺点。
利用微波辅助法制备CS衍生物近年来备受学者关注,与常规加热相比,该方法不仅可以将反应速率提高几个数量级,而且可以显著减少所需的试剂量,从而减少产生的废液量[12]。Liu等[13]用微波辅助法在水溶液中制备了季铵盐CMC,其羧甲基基团和季铵盐基因分别为0.82和0.48,合成过程减少了有机溶剂的使用,表明微波辅助法是一种快速合成水溶性CS衍生物的方法。本研究中,以南极磷虾虾壳作为试验原料,采用微波辅助法代替传统水浴加热方法制备CMC,并通过单因素和正交试验对羧甲基化过程进行工艺优化,分析反应过程中各因素对产物取代度的影响,通过红外光谱(FTIR)和扫描电镜(SEM)对南极磷虾CS和CMC进行了结构表征分析,并对其水溶性和抗氧化能力进行比较,以期为进一步研究南极磷虾CMC的应用提供理论基础。
1 材料与方法
1.1 材料
原料:试验用冷冻南极磷虾购自辽宁省大连海洋渔业集团公司,贮存在超低温冰箱(-80 ℃)中。
试剂:NaOH、盐酸、异丙醇、无水乙醇、甲醇、硫酸亚铁、水杨酸、氯乙酸、30%过氧化氢、1,1-二苯基-2-三硝基苯肼(DPPH)均为分析纯;总抗氧化能力检查试剂盒(FRAP法)为上海碧云天生物技术有限公司产品。
仪器:MM721NG1-P1150美的微波炉(中国美的集团)、H2050R 台式高速冷冻离心机(湘仪离心机仪器有限公司)、JB-1A 型磁力搅拌器(上海精密科学仪器有限公司)、双列四孔恒温水浴锅(上海慧泰仪器制造有限公司)、pH计(梅特勒-托利多仪器有限公司)、DZF-6050型真空干燥箱(上海慧泰仪器制造有限公司)、Nicolet 6700傅立叶红外光谱仪和Hitachi S-3400N扫描电子显微镜。
1.2 方法
1.2.1 壳聚糖的制备
甲壳素提取:将贮存在-80 ℃冰箱内的南极磷虾流水解冻,通过碾压法人工剔除虾肉,将虾壳于60 ℃下烘干,用豆浆机粉碎2 min,得到虾壳粉。称取10.00 g南极磷虾虾壳粉,加入100 mL 5% HCl溶液(均为体积分数,下同),在室温下反应1 h后用蒸馏水洗涤至中性。然后加入100 mL 4% NaOH溶液(均为质量分数,下同),在100 ℃下反应1 h后用蒸馏水洗涤至中性。将得到的甲壳素于60 ℃下烘干。
CS制备:称取5.00 g甲壳素于坩埚中,加入50 mL的45% NaOH溶液,放置在电加热板上加热,加热温度为110 ℃,时间为3 h。反应完毕后将所得CS用蒸馏水洗涤至中性,于60 ℃下真空干燥烘干。采用乌氏黏度计法测定CS分子量,采用酸碱滴定法测定脱乙酰度[14]。得到的CS黏均相对分子质量约为3 63 200,脱乙酰度为90%以上。
1.2.2 微波辅助法制备羧甲基壳聚糖的单因素试验 CMC的制备过程:采用两步加碱法制备CMC。称取5.00 g CS后加入60 mL异丙醇,在室温下溶胀1 h后加入一定量的40% NaOH溶液于30 ℃下搅拌1 h,然后再加入一定量的50%氯乙酸-异丙醇溶液(均为体积分数,下同),设定一定的微波功率和微波时间,待微波加热后再次加入相同量的40% NaOH溶液,在50 ℃条件下反应1 h后,用盐酸溶液调节pH至7.0,以10 000 r/min离心5 min,取上清液后用无水乙醇使CMC沉淀析出,然后用甲醇多次洗涤后于60 ℃下真空干燥,即得南极磷虾CMC。
微波功率和微波时间单因素试验:以5.00 g CS为原料,在微波功率540 W、微波时间20 min、40% NaOH溶液总用量87.5 mL(每次加入43.25 mL)、50%氯乙酸-异丙醇溶液用量40 mL条件下,固定其中3个因素,分别进行不同微波功率、微波时间对所制备的南极磷虾CMC取代度的影响试验,其中,微波功率设置为120、230、385、540、700 W,微波时间设置为10、15、20、25、30 min。
NaOH溶液、氯乙酸-异丙醇溶液用量单因素试验:以5.00 g CS为原料,在微波功率540 W、微波时间25 min、40% NaOH溶液总用量100.0 mL(每次加入50.0 mL)、50%氯乙酸-异丙醇溶液用量40 mL条件下,固定其中3个因素,分别进行不同40% NaOH溶液用量、50%氯乙酸-异丙醇溶液用量对所制备的南极磷虾CMC取代度的影响试验,其中,40% NaOH溶液总用量设置为62.5、75.0、87.5、100.0、112.5 mL(分两次加入),50%氯乙酸-异丙醇溶液用量设置为20、30、40、50、60 mL。
1.2.3 制备CMC的正交试验 根据单因素试验结果,采用4因素3水平正交试验。以正交试验优化后的最佳微波辅助工艺条件制备CMC进行验证试验,并以传统水浴加热辅助工艺(60 ℃、3 h)作为对照。
1.2.4 CMC取代度(DS)的测定 采用电位滴定法进行测定[15],即用0.1 mol/L HCl标准溶液溶解CMC,配制成质量分数为1%的CMC-HCl溶液,再用0.1 mol/L NaOH标准溶液进行滴定,在滴定的同时测定溶液pH,根据下式计算CMC取代度:
A=(V2-V1)c/m,
(1)
DS=0.203A/(1-0.058A)。
(2)
其中: m为样品质量(g);c为NaOH标准溶液浓度(mol/L);V1、V2分别为pH为2.1和4.3时滴定所消耗的NaOH标准溶液的体积(mL);A为样品中羧甲基物质的量(mmol/g);每个乙酰氨基葡萄糖残基的物质的量为0.203 mmol,每毫克当量的羧甲基质量为0.058 g。
1.2.5 南极磷虾CMC结构表征分析
1) 傅立叶红外光谱的测定。采用KBr压片法,对CS和CMC进行测定。将KBr与样品按1∶100进行混合并研磨均匀,光谱扫描在波数4000~400-1内,分辨率为4 cm-1,扫描32次。
2) 扫描电镜观察。采用扫描电子显微镜观察CS和CMC的表面结构。将样品放入真空干燥箱烘干(105 ℃,8 h)后喷金,低真空模式下分别在100倍、1 000倍和2 000倍的全景下观察。
1.2.6 南极磷虾CMC性能分析
1)水溶性能测定。用0.1 mol/L的HCl和NaOH溶液调整水溶液pH为3~12,将样品溶解在不同pH的水溶液中制成5 mg/mL的样品。用紫外可见分光光度计测定溶液在600 nm处的透射率[16]。对于每个测试样品,构建透射率随pH的变化曲线。以蒸馏水的透射率为对照,当透射率小于90%时,认为样品是不溶的。
2)抗氧化能力测定。
清除1,1-二苯基-2-三硝基苯肼(DPPH)自由基的测定:参考Brand-Williams等[17]的方法测定南极磷虾CS和CMC清除DPPH自由基的能力。
清除羟基(·OH)自由基能力的测定:通过Fenton反应,测定南极磷虾CS和CMC清除羟基自由基的能力。具体步骤参考刘红莉[18]的方法。
总抗氧化能力的测定:采用总抗氧化能力试剂盒(FRAP法)测定南极磷虾CS和CMC的总抗氧化能力。
1.3 数据处理
每个试验重复3次,试验数据以平均值±标准差(mean±S.D.)表示。采用 Excel 2010软件处理数据,采用SPSS 23软件对数据进行单因素方差分析(One-way ANOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 微波辅助制备南极磷虾CMC工艺优化试验
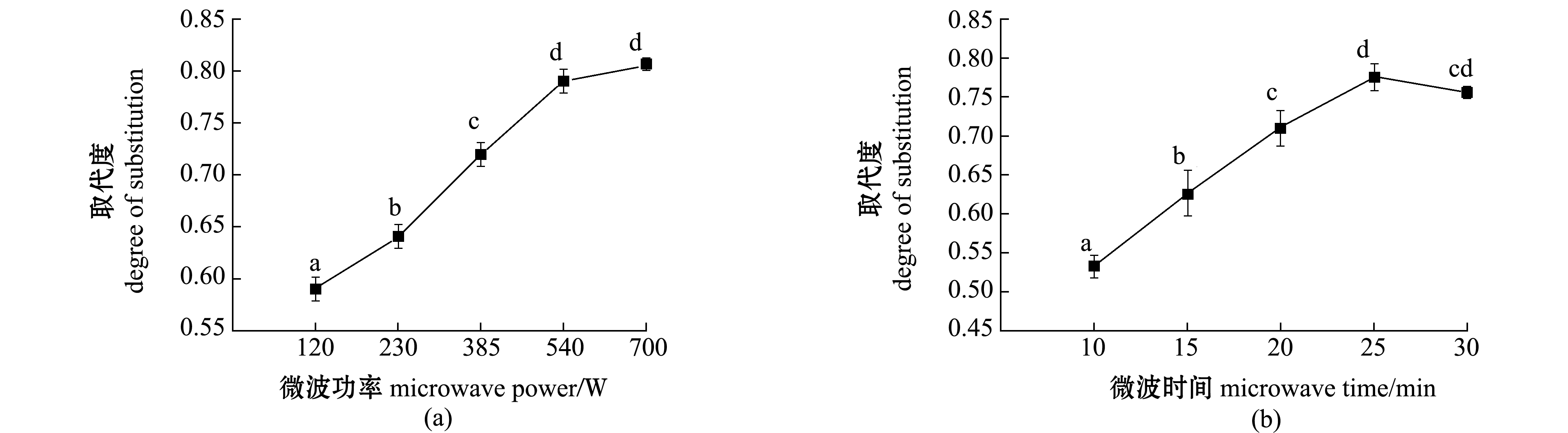
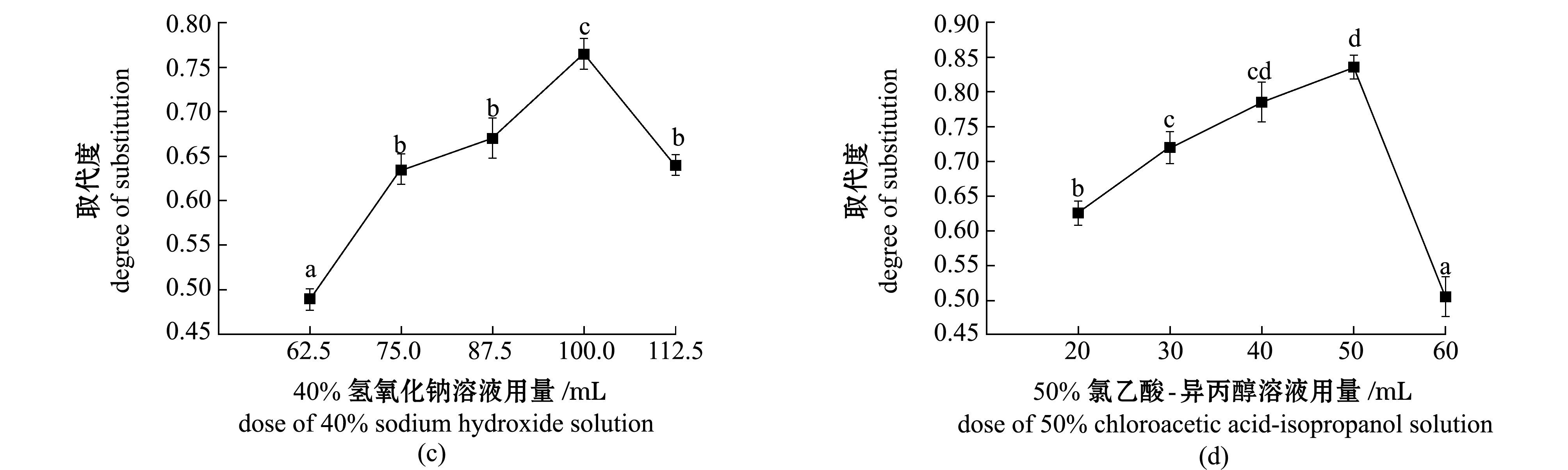
2.1.1 单因素试验结果 从图1(a)可见:随着微波功率的增加,CMC的取代度随之上升;当微波功率为700 W时,CMC的取代度达到最大,为0.80,而微波功率为540 W时CMC取代度为0.79,且与微波功率为700 W时CMC取代度变化无显著性差异(P>0.05)。故本试验条件下,微波功率为540 W时较佳。
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences.
图1 CMC单因素试验结果
Fig.1 Single factor test results of CMC
从图1(b)可见:CMC的取代度随着微波时间的增加呈先升高后下降趋势(P<0.05);当微波时间为25 min时CMC取代度最大(0.78)。故本试验条件下,微波时间为25 min时最佳。
从图1(c)可见:随着40% NaOH溶液总用量的增加,CMC的取代度呈先上升后下降的趋势;当40% NaOH溶液总用量为100 mL时,CMC的取代度最高(0.77)。故本试验条件下,40% NaOH溶液总用量为100 mL时最佳。
从图1(d)可见:随着50%氯乙酸-异丙醇溶液用量的增加,CMC的取代度呈先升高后下降的趋势;当50%氯乙酸-异丙醇溶液用量为50 mL时,CMC取代度达到最大(0.84),且与50%氯乙酸-异丙醇溶液用量为40 mL的CMC取代度(0.79)无显著性变化(P>0.05)。故本试验条件下,50%氯乙酸-异丙醇溶液用量为40 mL时较佳。
2.1.2 正交试验结果 根据单因素试验结果,设置正交试验的4因素3水平如表1所示,正交试验结果和方差结果如表2、3所示。
表1 CMC正交试验因素水平
Tab.1 Factors and levels of orthogonal test
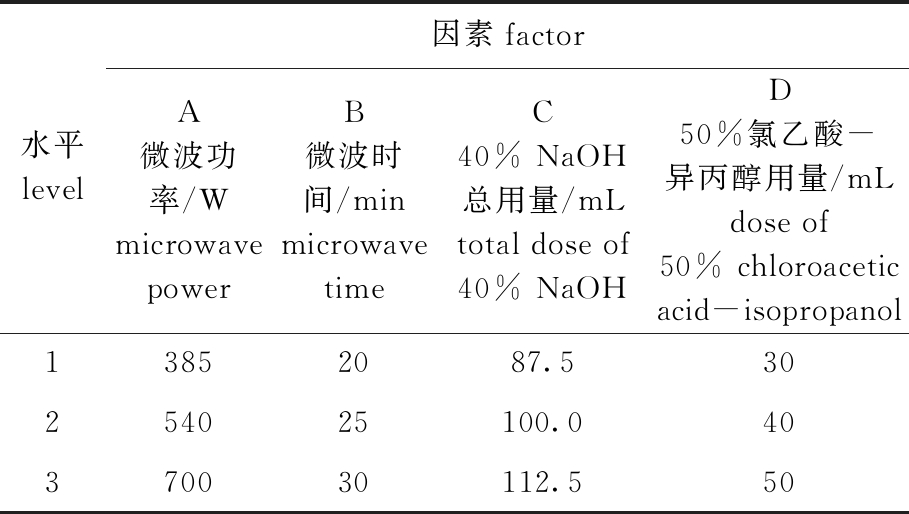
水平level因素factorA微波功率/Wmicrowave powerB微波时间/minmicrowave timeC 40% NaOH总用量/mLtotal dose of 40% NaOHD 50%氯乙酸-异丙醇用量/mLdose of 50% chloroacetic acid-isopropanol 13852087.530254025100.040370030112.550
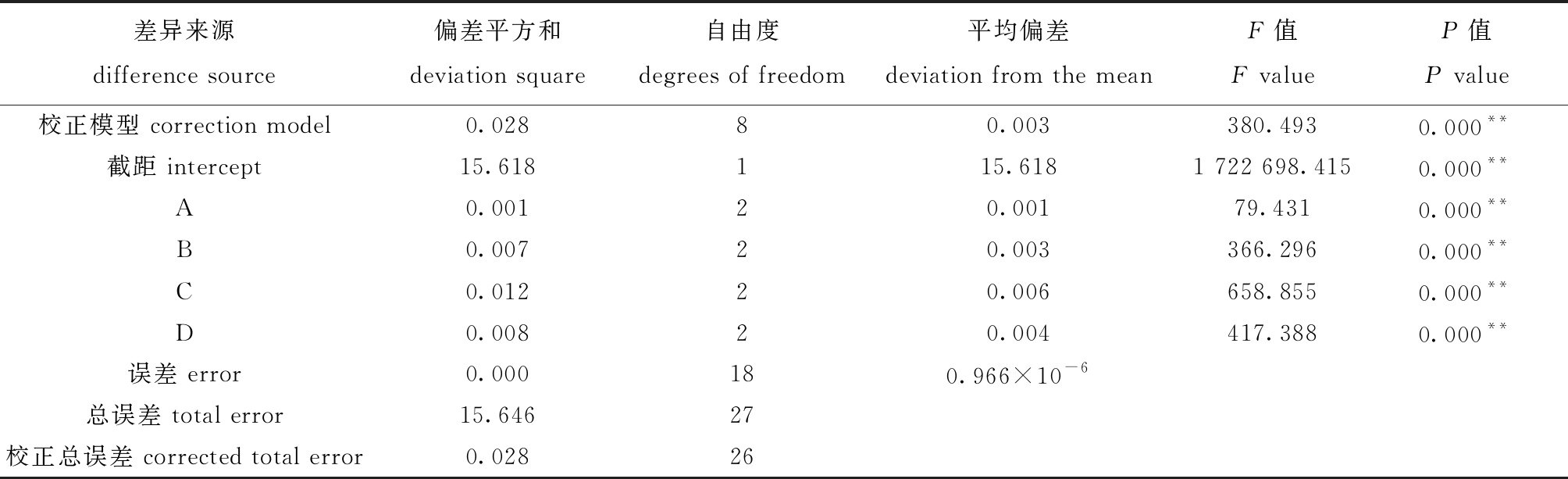
从表2可见,微波功率、微波时间、40% NaOH溶液用量和50%氯乙酸-异丙醇溶液用量4因素对CMC取代度的影响大小依次为C(40% NaOH溶液用量)>D(50%氯乙酸-异丙醇溶液用量)>B(微波时间)>A(微波功率),正交优化后的最优提取条件为 A2B3C2D2, 即微波功率540 W,微波时间30 min,40% NaOH溶液总用量100 mL,50%氯乙酸-异丙醇溶液用量为40 mL。从表3可见,4个因素的P值均为0.000,说明微波功率、微波时间、40% NaOH溶液用量和50%氯乙酸-异丙醇溶液用量对CMC取代度均具有极显著影响(P<0.01)。
表2 CMC正交试验结果
Tab.2 Orthogonal test results of CMC
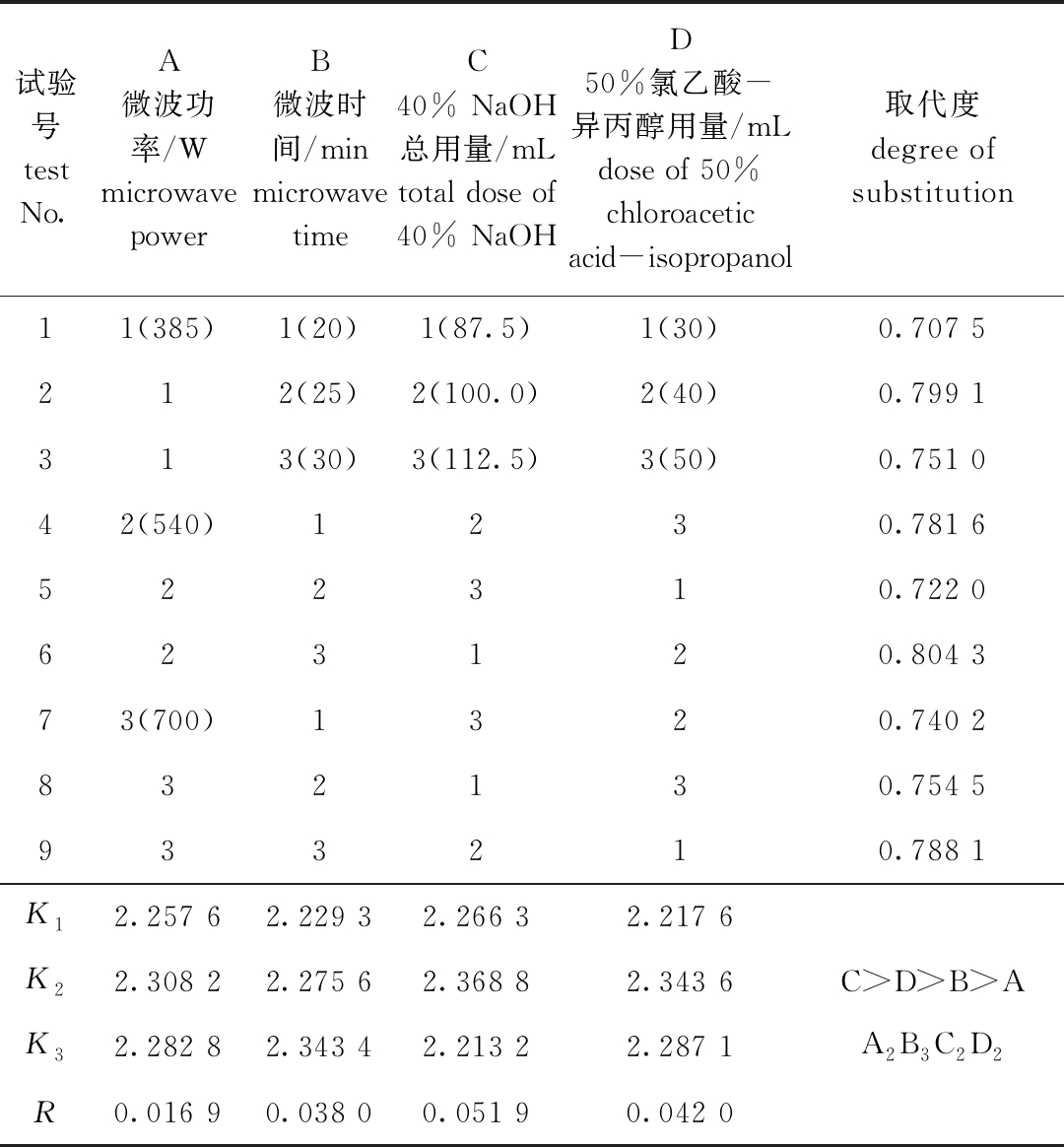
注:K表示各因素各水平的取代度数值总和;R表示极差。
Note: K represents the total value of the substitution degree of each factor at each level; R represents the extreme difference.
试验号test No.A微波功率/Wmicrowave powerB微波时间/minmicrowave timeC40% NaOH总用量/mL total dose of 40% NaOH D50%氯乙酸-异丙醇用量/mLdose of 50% chloroacetic acid-isopropanol 取代度degree of substitution11(385)1(20)1(87.5)1(30)0.707 5212(25)2(100.0)2(40)0.799 1313(30)3(112.5)3(50)0.751 042(540)1230.781 6522310.722 0623120.804 373(700)1320.740 2832130.754 5933210.788 1K12.257 62.229 32.266 32.217 6K22.308 22.275 62.368 82.343 6C>D>B>AK32.282 82.343 42.213 22.287 1A2B3C2D2R0.016 90.038 00.051 90.042 0
表3 CMC的方差分析表
Tab.3 ANOVA table of CMC
注: *表示显著性影响(P<0.05);**表示极显著性影响(P<0.01)。
Note: *means significant effect(P<0.05),** means very significant effect(P<0.01).
差异来源difference source偏差平方和deviation square自由度degrees of freedom平均偏差deviation from the meanF值F valueP值P value校正模型 correction model0.02880.003380.4930.000**截距 intercept15.618115.6181 722 698.4150.000**A0.00120.00179.4310.000**B0.00720.003366.2960.000**C0.01220.006658.8550.000**D0.00820.004417.3880.000**误差 error0.000180.966×10-6总误差 total error15.64627校正总误差 corrected total error0.02826
为验证正交试验结果的准确性,在最佳提取条件下进行3次微波辅助制备CMC试验,结果显示,CMC平均取代度为0.95。而在相同40% NaOH溶液用量和50%氯乙酸-异丙醇溶液用量条件下,采用传统水浴加热(对照)制备的CMC取代度仅为0.68。相比传统的水浴加热,微波辅助制备CMC的方法效率更高,制备的CMC的取代度也更高。
2.2 南极磷虾CMC的结构表征分析
2.2.1 红外光谱分析 从图2可见:在南极磷虾CS图谱中,3 440 cm-1处具有强吸收峰,这个峰是-OH和-NH2的特征吸收峰,可以反映出-OH和-NH2分子内和分子间氢键[19];南极磷虾CS在1 660 cm-1处有吸收峰,这与α-CS的酰胺Ⅰ的特征峰一致;南极磷虾CS的酰胺谱带Ⅱ和Ⅲ分别在1 616、1 328 cm-1处,说明从南极磷虾壳中提取的CS是α-CS[20]。
从图2还可见:与南极磷虾CS的红外光谱相比,南极磷虾CMC在3 450 cm-1处的吸收峰变尖锐,说明南极磷虾CS分子的羟基和氨基上发生了羧甲基化反应[21];南极磷虾CMC分别在1 602、1 427 cm-1处的峰分别对应于羧基的不对称和对称的伸缩振动;南极磷虾CS在1 592 cm-1的氨基吸收带,羧甲基化以后消失,出现了新的1 602 cm-1的酰胺振动峰,这是羧基的不对称伸缩振动,这说明取代反应发生在氨基上[20];位于1 025 cm-1处的CS的C6-OH吸收带消失,而位于1 086 cm-1的C3-OH没有发生变化,说明O-位取代主要发生在C6-OH上[22]。以上结果说明,微波辅助法制备的南极磷虾CMC为N,O-CMC。
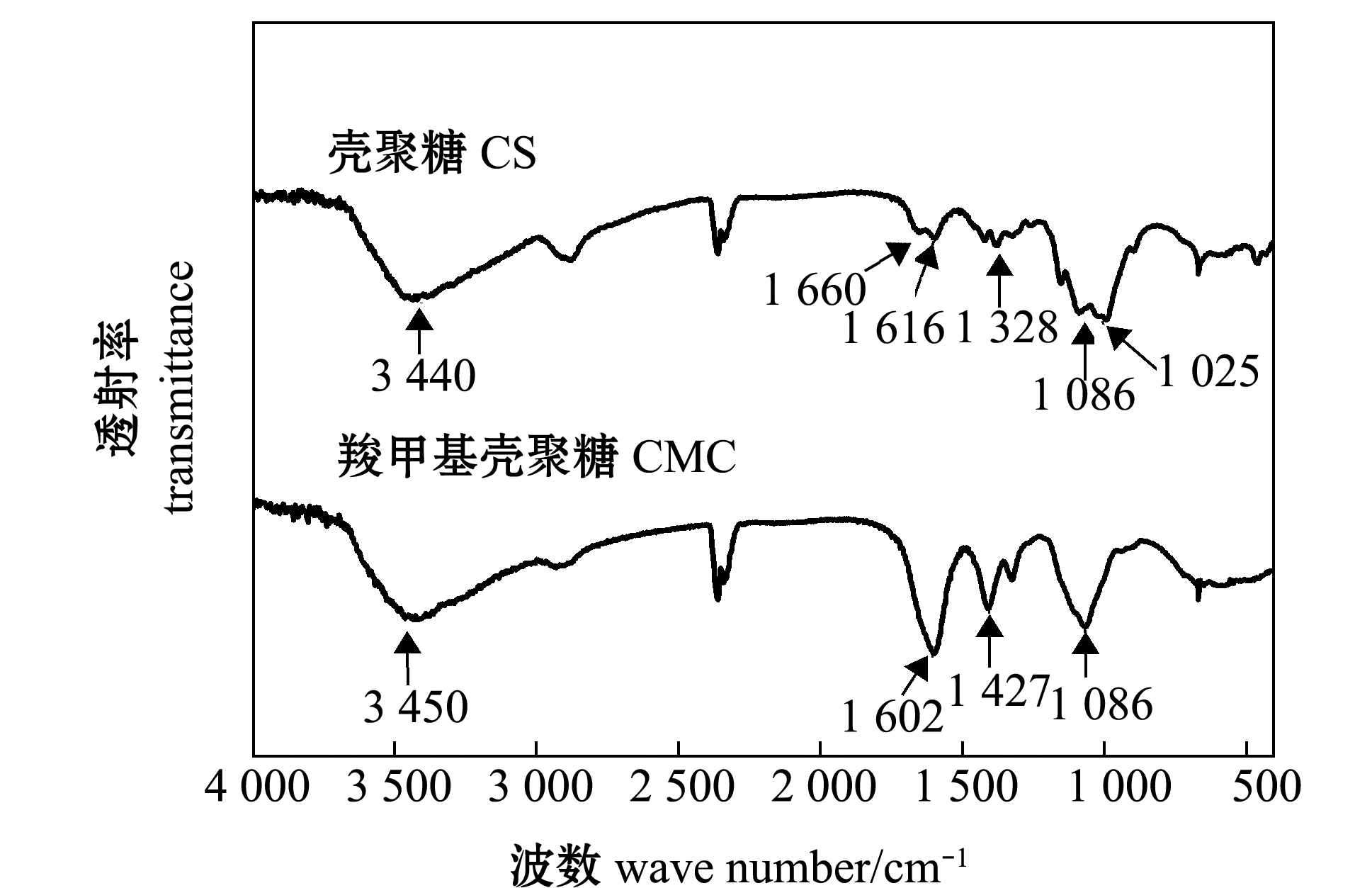
图2 南极磷虾CS和CMC的红外光谱图
Fig.2 Infrared spectra of chitosan and carboxymethyl chitosan in Antarctic krill Euphausia superba shell
2.2.2 扫描电镜分析 图3显示了不同电镜放大倍数下南极磷虾CS和CMC的表面形貌,当放大100倍时,南极磷虾CS呈现片状(图3A),当放大2 000倍时,发现CS表面光滑,但是有明显的层状和微纤维结构(图3C);当放大100倍时,南极磷虾CMC呈现粒状,与CS的片状结构不同(图3D),当放大倍数增加时,发现CMC的表面呈现疏松多孔的形态,孔隙很多,孔径更小(图3E、F)。说明南极磷虾CS在羧甲基化的过程中晶体结构发生变化[23],因此,南极磷虾CMC能更好地溶于水,并且也赋予其更多的性能。

图3 南极磷虾CS和CMC的扫描电镜图
Fig.3 SEM images of CS and CMC of Antarctic krill Euphausia superba
2.3 南极磷虾CMC的性能测试
2.3.1 水溶性能 从图4可见:当pH≤6时,南极磷虾CS的透射率接近100%,说明南极磷虾CS在酸性条件下具有较好的溶解性能;但当pH≥6.5时,CS溶液开始浑浊,此时透射率也逐渐下降,尤其当pH为7~12时,CS溶液开始出现絮状沉淀,此阶段的透射率在20%左右,说明南极磷虾CS在中性和碱性溶液中不溶解。
从图4还可见:当pH为3时,南极磷虾CMC的透射率仅为0.84%,说明此时CMC完全沉淀;当pH≥4时,CMC的透射率一直保持在90%以上,总体来说,南极磷虾CMC具有良好的水溶性能。这说明,相比南极磷虾CS,南极磷虾CMC的溶解范围更广。
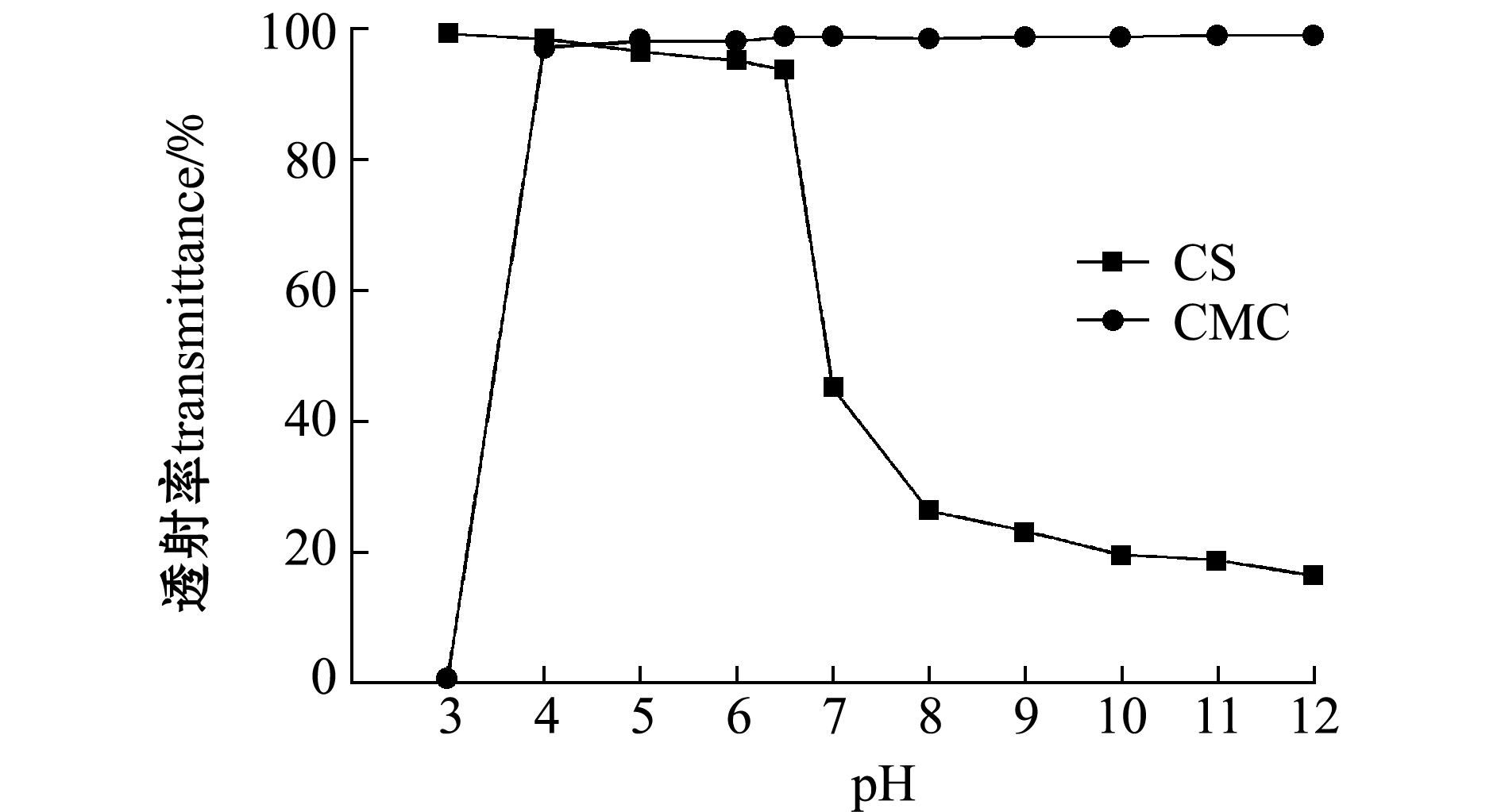
图4 pH对CS和CMC溶液透射率的影响
Fig.4 Influence of pH on the light transmittance of CS and CMC solutions
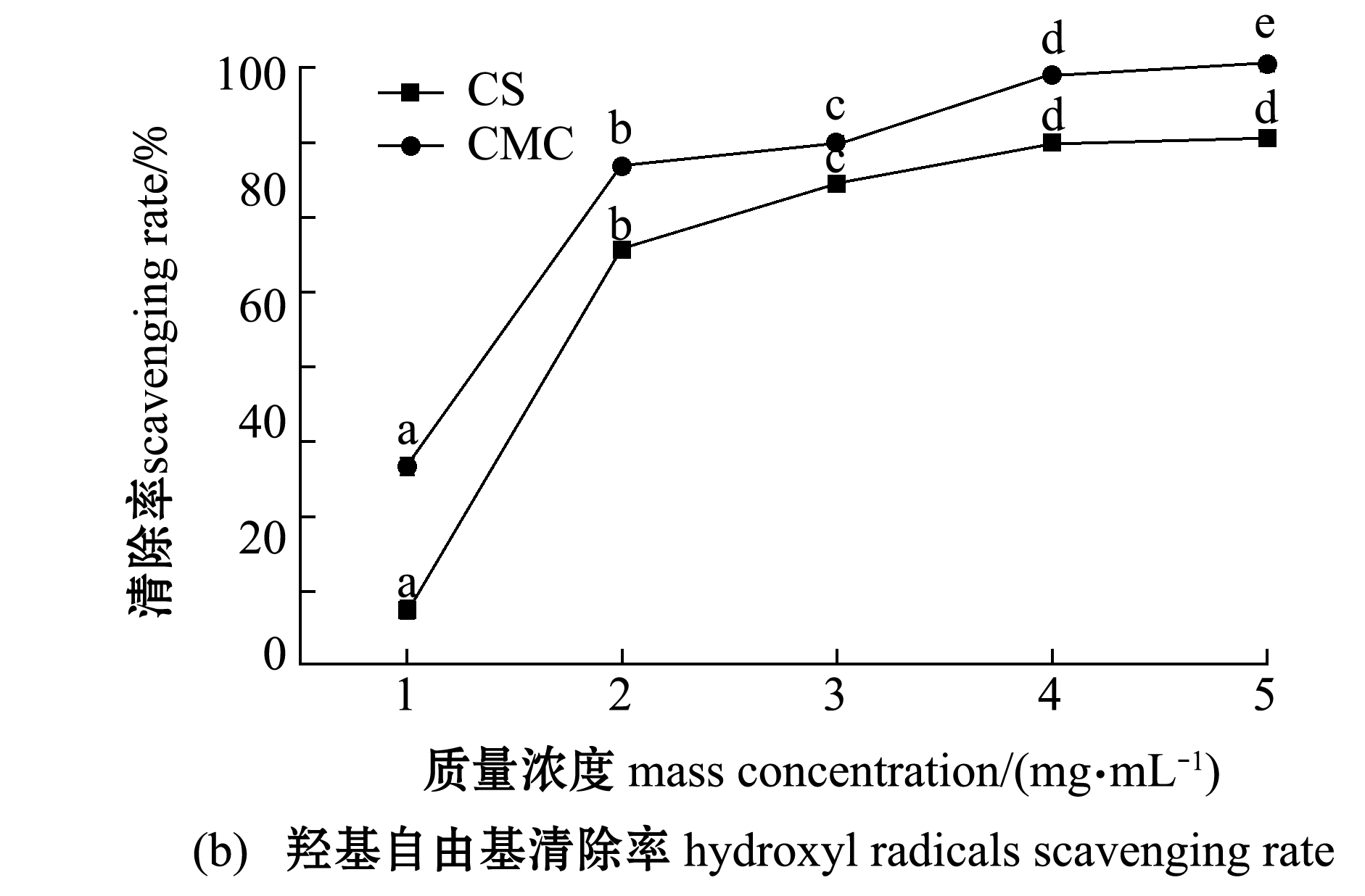
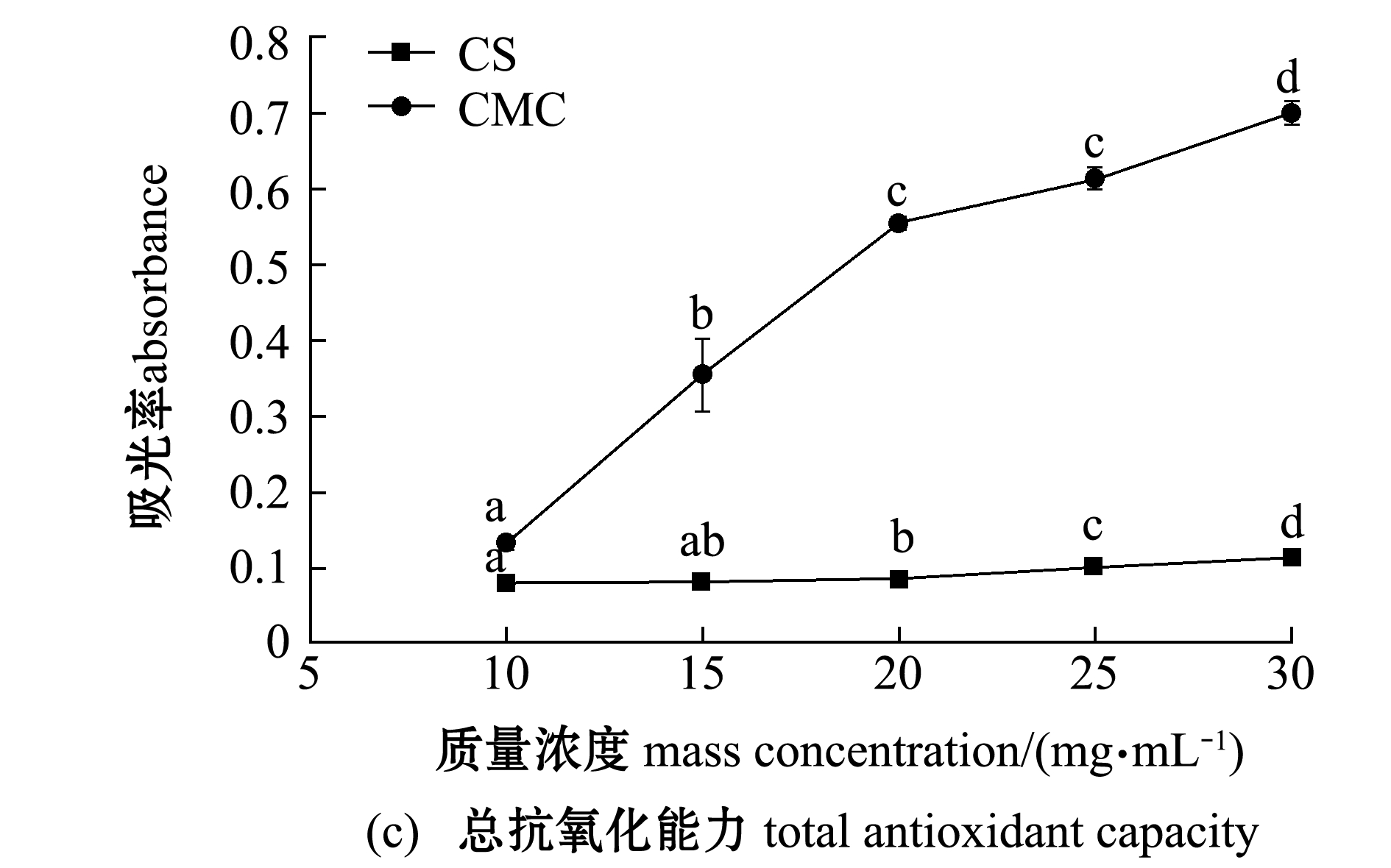
2.3.2 抗氧化能力 从图5(a)可见:随着浓度的增加,CS和CMC对DPPH的清除能力都在增强,呈现正相关的趋势;当CMC质量浓度为1 mg/mL时,对DPPH的清除能力比CS强,但是当质量浓度大于1 mg/mL后,CMC对DPPH的清除能力比CS弱。从图5(b)可见:CMC对羟基自由基的清除能力比CS要好,两者均随着质量浓度的增加,清除率显著提升(P<0.05);样品质量浓度由1 mg/mL增加到2 mg/mL时,CS和CMC的清除率均迅速增加,当质量浓度为2 mg/mL以后,两者的清除率增加速率趋于平缓。从图5(c)可见:CMC的总抗氧化能力远远高于CS;随着质量浓度的升高,CMC的总抗氧化能力迅速增加(P<0.05),而CS的总抗氧化能力始终较低。
3 讨论
3.1 制备工艺对CMC取代度的影响
微波功率和时间是微波辅助方式的重要参数。
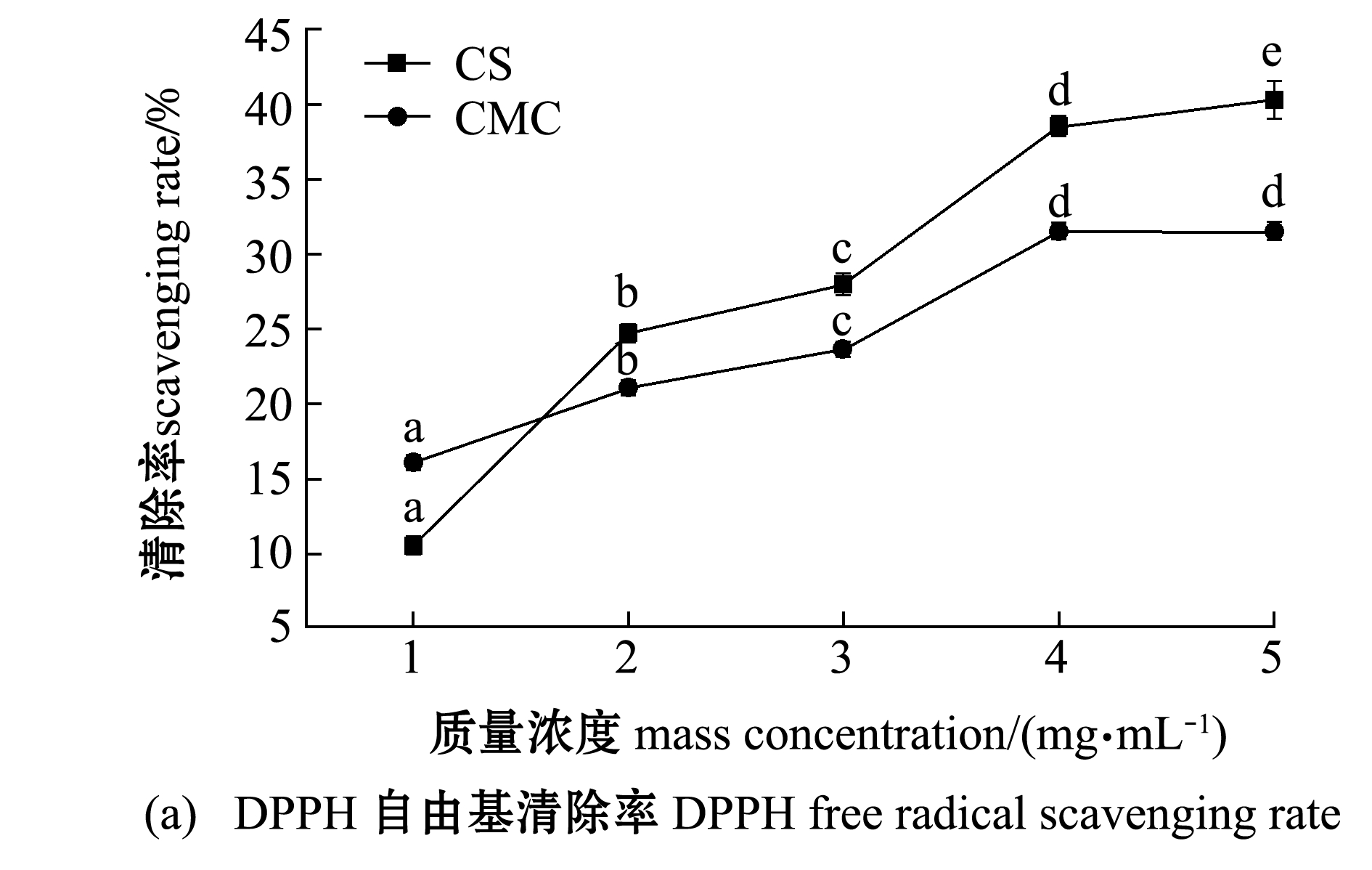
标有不同字母者表示不同浓度间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significant differences in different concentraions at the 0.05 probability level, and the means with the same letter are not significant differences.
图5 CS和CMC的抗氧化能力
Fig.5 Antioxidant ability of CS and CMC
本研究表明,随着微波功率的增大,CMC取代度逐步上升,至540 W后CMC取代度上升趋势逐渐趋于平衡,这可能是因为随着微波功率变大,加热速率逐渐提高,使得反应物分子热运动加剧,-OH和-NH2与羧甲基之间的反应速率亦增加,进而促使产物的取代度得以增加[24]。微波处理时间越长,CMC取代度逐渐增大,直到25 min后出现拐点并开始呈下降趋势,这可能是因为随着反应时间延长,使CS分子得到充分溶胀,其中-OH和-NH2能够得到完全伸展,可以更全面地与羧甲基接触,羧甲基化反应随之增多,故产物的取代度增大。但是若继续延长反应时间,CS可能会发生降解,同时副反应速度加快,反而会使取代度下降。这与王永娟等[25]的研究结果一致。Ge等[26]的研究也有相似结果,即微波时间在20 min后,继续加热并没有使产物的取代度有显著性的提高。
在微波辅助法制备南极磷虾CMC的过程中,需要加入一定量的40% NaOH溶液和50%氯乙酸-异丙醇溶液进行反应。在反应体系中加入100 mL 40% NaOH溶液总用量时,CMC取代度达到最大值,而后逐渐下降,这是因为CS在碱化过程中,随着40% NaOH溶液用量的增大,CS活性中心增多,产物取代度也相应提高。但是当40% NaOH溶液用量超过一定限度时,会促使副反应发生,使CMC的取代度有所降低。这与纪淑娟等[27]的研究结果一致,而在保持NaOH用量一定时,则CS在碱化过程中形成的活性中心一定,当50%氯乙酸-异丙醇溶液用量增加时,所提供的羧甲基增多,发生的羧甲基化反应也随之增加,从而使CMC的取代度增加。但是,当50%氯乙酸-异丙醇溶液用量超过一定限度时,反应的碱性体系被破坏,发生副反应,反而使羧甲基化反应减少,亦导致CMC取代度随之下降。洪燕平[28]和杨军胜等[29]的研究也有类似结果。
3.2 CMC的水溶性和抗氧化性
用微波辅助法制备南极磷虾CMC与传统加热法制备的最大区别在于由微波加热处理代替传统水浴加热,在提高CMC制备效率的同时,也大大提高CMC取代度。本试验中在最优工艺条件下制得的CMC取代度为0.95,比传统水浴加热工艺制得的CMC取代度提高了30%左右,而微波辅助法的制备速率也比传统水浴法提高了86%左右。
为了提高产品的适用性、实用性及操作性,往往希望所制备的CS和CMC在更大的酸碱范围内均具有良好的水溶性。本试验中所制备的南极磷虾CMC在pH为4~12时均具有良好的水溶性,在pH低于4时CMC完全沉淀,表现出极差的水溶性,这可能是因为CMC为两性电解质,具有等电点,在等电点附近时,CMC难溶解并形成白色絮状沉淀[30]。本试验中制备的N,O-CMC在中性和碱性的水溶液中溶解性明显优于CS。黄强等[31]的研究也有类似结论。
就实际应用而言,往往要求CS及其衍生物产品具有较强的抗氧化性。本试验表明,CMC质量浓度与对DPPH自由基的清除能力呈正相关,这是因为CS和CMC中的活性氨基和羟基提供的氢可以与DPPH结合,从而达到清除DPPH的目的。因此,CS和CMC质量浓度越高提供的氢越多,对DPPH自由基清除率就越强。这与刘欢等[32]的研究结果相似。本研究中,CS及CMC随着质量浓度的增加, 其抗氧化活性显著增加,但是质量浓度大于1 mg/mL后,CMC对DPPH的清除能力比CS弱。有研究表明,CMC对DPPH的清除能力与其取代度成反比关系,取代度越大,对DPPH的清除率越低,这是因为CMC氨基和羟基位置引入羧甲基之后,其活性基团不易暴露出来 [33],因此,抗氧化活性变弱。本研究中,CMC对于羟基自由基清除能力比CS较好。可能是因为CS的 N2-O6和O3-O5分子内氢键键能很高,使CS分子结合相对紧密, 会降低氨基基团和羟基基团与外界反应的活性[34],从而导致CS显示出较弱的抗氧化性。本研究中,CMC的总抗氧化能力好于CS,可能是因为羧甲基基团的加入,使得活性氨基和羟基的电子云密度增大[35],有利于CMC与自由基的反应,从而达到增强总抗氧化的作用。吴迪等[33]通过试验,比较N,O-CMC和CS的体外抗氧化能力,结果表明,N,O-CMC对羟基自由基的清除能力和总抗氧化能力优于CS,与本研究结果一致。
4 结论
1) 微波辅助法制备南极磷虾CMC是一种省时高效的制备方法,比传统水浴加热工艺制得的CMC取代度提高30%,制备速率也大幅提高。
2) 南极磷虾CMC具有良好的水溶性,而南极磷虾CS仅在弱酸条件下有较好的水溶性。
3) 南极磷虾CMC的羟基清除能力和总抗氧化能力均优于南极磷虾CS,但DPPH自由基的清除能力CMC略差。
综合表明,本试验制备的南极磷虾CMC是一种具有良好水溶性的抗氧化剂,具有一定的实际应用价值。
[1] 朱国平.南极磷虾种群生物学研究进展Ⅰ-年龄、生长与死亡[J].水生生物学报,2011,35(5):862-868.
ZHU G P.Population biology of Antarctic krill Euphausia superb.I-age,growth and mortality[J].Acta Hydrobiologica Sinica,2011,35(5):862-868.(in Chinese)
[2] 孙雷,周德庆,盛晓风.南极磷虾营养评价与安全性研究[J].海洋水产研究,2008,29(2):57-64.
SUN L,ZHOU D Q,SHENG X F.Nutrition and safety evaluation of Antarctic krill[J].Marine Fisheries Research,2008,29(2):57-64.(in Chinese)
[3] 谈俊晓,赵永强,李来好,等.响应面优化南极磷虾虾青素的复合酶法提取工艺研究[J].大连海洋大学学报,2018,33(4):514-521.
TAN J X,ZHAO Y Q,LI L H,et al.Optimization of multi-enzymatic extraction of astaxanthin from Antarctic krill via response surface methodology[J].Journal of Dalian Ocean University,2018,33(4):514-521.(in Chinese)
[4] 孟祥君.两种水溶性壳聚糖衍生物的制备与抑菌性能研究[D].保定:河北大学,2012.
MENG X J.Preparation and antibacterial activity of two kinds of water-soluble chitosan derivative[D].Baoding:Hebei University,2012.(in Chinese)
[5] WANG C H,LIU W S,SUN J F,et al.Non-toxic O-quaternized chitosan materials with better water solubility and antimicrobial function[J].International Journal of Biological Macromolecules,2016,84:418-427.
[6] 李明春,许涛,辛梅华.壳聚糖及其衍生物的抗菌活性研究进展[J].化工进展,2011,30(1):203-209.
LI M C,XU T,XIN M H.Research progress of antibacterial activity of chitosan and its derivatives[J].Chemical Industry and Engineering Progress,2011,30(1):203-209.(in Chinese)
[7] 张润光,田呈瑞,张有林.复合保鲜剂涂膜对石榴果实采后生理、贮藏品质及贮期病害的影响[J].中国农业科学,2016,49(6):1173-1186.
ZHANG R G,TIAN C R,ZHANG Y L.Effects of multiplex antistaling agent coating on postharvest physiology, storage quality and storage diseases of pomegranate fruit[J]. Scientia Agricultura Sinica,2016,49(6):1173-1186.(in Chinese)
[8] 许牡丹,刘红梅,曾令军.马铃薯淀粉-壳聚糖复合膜对冬枣的保鲜研究[J].食品研究与开发,2010,31(3):170-172.
XU M D,LIU H M,ZENG L J.Study on effects of murphystarch-chitosan blend films on dongzao jujube[J].Food Research and Development,2010,31(3):170-172.(in Chinese)
[9] 郭睿,刘爱玉,郭煜,等.响应面法优化羧甲基壳聚糖的制备工艺[J].精细化工,2016,33(8):872-879.
GUO R,LIU A Y, GUO Y,et al.Process optimization for preparation of carboxymethyl chitosan by response surface methodology[J].Fine Chemicals,2016,33(8):872-879.(in Chinese)
[10] 郑丝柳,徐阳,周颖梅.利用废弃淡水龙虾壳制备羧甲基壳聚糖[J].化工技术与开发,2015,44(7):17-19.
ZHENG S L,XU Y,ZHOU Y M.Synthesis of carboxymethyl chitosan using abandoned shells of crayfish[J].Technology & Development of Chemical Industry,2015,44(7):17-19.(in Chinese)
[11] MUZZARELLI R A A,ILARI P,PETRARULO M.Solubility and structure of N-carboxymethyl chitosan[J].International Journal of Biological Macromolecules,1994,16(4):177-180.
[12] 谯志勇,李明春,辛梅华,等.微波辐射在壳聚糖化学改性中的应用研究进展[J].化工进展,2009,28(3):412-417.
QIAO Z Y,LI M C,XIN M H,et al.Research progress of application of microwave in chitosan modification[J].Chemical Industry and Engineering Progress,2009,28(3):412-417. (in Chinese)
[13] LIU B,WANG X Y,YANG B,et al.Microwave-assisted synthesis of quaternized carboxymethyl chitosan in aqueous solution and its thermal behavior[J].Journal of Macromolecular Science:Part A,2012,49(3):227-234.
[14] 王红昌,孙晓飞.不同分子量高脱乙酰度壳聚糖的制备及表征[J].中国海洋药物,2007,26(1):16-19.
WANG H C,SUN X F.Preparation and characterization of chitosans of high degree of deacetylation with different molecular weights[J].Chinese Journal of Marine Drugs,2007,26(1):16-19.(in Chinese)
[15] 易喻,江威,王鸿,等.羧甲基壳聚糖的制备及性能研究[J].浙江工业大学学报,2011,39(1):16-20.
YI Y,JIANG W,WANG H,et al.Study on preparation and the performance of the carboxymethyl chitosan[J].Journal of Zhejiang University of Technology,2011,39(1):16-20.(in Chinese)
[16] ZHU D,CHENG H H,LI J N,et al.Enhanced water-solubility and antibacterial activity of novel chitosan derivatives modified with quaternary phosphonium salt[J].Materials Science and Engineering:C,2016,61:79-84.
[17] BRAND-WILLIAMS W,CUVELIER M E,BERSET C.Use of a free radical method to evaluate antioxidant activity[J].LWT-Food Science and Technology,1995,28(1):25-30.
[18] 刘红莉.壳聚糖衍生物的合成及其性质研究[D].无锡:江南大学,2017.
LIU H L.Preparation and property of chitosan derivatives[D].Wuxi:Jiangnan University,2017.(in Chinese)
[19] 高献礼,刘安军,王丽霞,等.壳聚糖和N,O-羧甲基壳聚糖抑菌活性的研究[J].中国食品添加剂,2005(1):20-24.
GAO X L,LIU A J,WANG L X,et al.Studies of antibacterial activity of chitosan and N,O-carboxymethyl chitosan[J].China Food Additives,2005(1):20-24.(in Chinese)
[20] 王晶.壳聚糖及羧甲基壳聚糖的清洁制备工艺研究[D].长春:长春工业大学,2019.
WANG J.Research on the clean preparation processes of chitosan and carboxymethyl chitosan[D].Changchun:Changchun University of Technology,2019.(in Chinese)
[21] KUSUMA H S,AL-SA’BANI A F,DARMOKOESOEMO H.N,O-carboxymethyl chitosan:an innovation in new natural preservative from shrimp shell waste with a nutritional value and health orientation[J].Procedia Food Science,2015,3:35-51.
[22] MUZZARELLI R A A,RAMOS V,STANIC V,et al.Osteogenesis promoted by calcium phosphate N,N-dicarboxymethyl chitosan[J].Carbohydrate Polymers,1998,36(4):267-276.
[23] ZHU L,ZOU D Q,FAN Z Q,et al.Properties of a novel carboxymethyl chitosan derived from silkworm pupa[J].Archives of Insect Biochemistry and Physiology,2018,99(2):e21499.
[24] XU T,XIN M H,LI M C,et al.Synthesis,characteristic and antibacterial activity of N,N,N-trimethyl chitosan and its carboxymethyl derivatives[J].Carbohydrate Polymers,2010,81(4):931-936.
[25] 王永娟,牟占军,秦文华,等.羧甲基壳聚糖的制备及其应用研究[J].内蒙古石油化工,2009,35(1):10-12.
WANG Y J,MOU Z J,QIN W H,et al.Preparing carboxymethyl-chitosan and study on its application[J].Inner Mongolia Petrochemical Industry,2009,35(1):10-12.(in Chinese)
[26] GE H C,LUO D K.Preparation of carboxymethyl chitosan in aqueous solution under microwave irradiation[J].Carbohydrate Research,2005,340(7):1351-1356.
[27] 纪淑娟,高倩.水溶性羧甲基壳聚糖制备工艺研究[J].食品工业,2007,28(6):8-10.
JI S J,GAO Q.Studies on the preparation of carboxymethyl chitosan[J].Food Industry,2007,28(6):8-10.(in Chinese)
[28] 洪燕平.壳聚糖及羧甲基壳聚糖生产新工艺研究[D].厦门:厦门大学,2014.
HONG Y P.New production technology of chitosan and carboxymethyl chitosan[D].Xiamen:Xiamen University,2014.(in Chinese)
[29] 杨军胜,刘晓桓.羧甲基壳聚糖的制备新工艺研究[J].粮油加工,2009(4):123-126.
YANG J S,LIU X H.Study on the new technology of carboxymethyl chitosan[J].Cereals and Oils Processing,2009(4):123-126.(in Chinese)
[30] 钟超.N,O-羧甲基壳聚糖的制备及表征[D].北京:北京化工大学,2004.
ZHONG C.Preparation and characterization of N,O-carboxymethyl chitosan[D].Beijing:Beijing University of Chemical Technology,2004.(in Chinese)
[31] 黄强,郑建仙.N,O-羧甲基壳聚糖的制备及其理化特性研究[J].食品与发酵工业,2009,35(7):63-67.
HUANG Q,ZHENG J X.Study on synthesis and properties of N,O-carboxymethyl chitosan[J].Food and Fermentation Industries,2009,35(7):63-67.(in Chinese)
[32] 刘欢,夏光辉,何文兵,等.壳聚糖及其衍生物抗氧化活性的研究[J].食品科技,2015,40(5):274-278.
LIU H,XIA G H,HE W B,et al.Antioxidant activity of chitosan and its derivatives[J].Food Science and Technology,2015,40(5):274-278.(in Chinese)
[33] 吴迪,邹清河,刘辉,等.羧甲基壳聚糖体外抗氧化作用[J].中国医院药学杂志,2013,33(19):1573-1576.
WU D,ZOU Q H,LIU H, et al.Study on the antioxidant activity in vitro of carboxymethyl chitosan[J].Chinese Journal of Hospital Pharmacy,2013,33(19):1573-1576.(in Chinese)
[34] 赵盼,王丽,孟祥红.壳聚糖及其衍生物的抗氧化性能及应用研究进展[J].食品科学,2010,31(15):299-303.
ZHAO P,WANG L,MENG X H.Research progress of antioxidant properties and applications of chitosan and its derivatives[J].Food Science,2010,31(15):299-303.(in Chinese)
[35] ZHAO D K,HUANG J,HU S,et al.Biochemical activities of N,O-carboxymethyl chitosan from squid cartilage[J].Carbohydrate Polymers,2011,85(4):832-837.