肠道不仅是鱼类消化、吸收营养物质的主要场所,同时承担重要的免疫防御功能。尤其是肠道黏膜系统,除了广泛参与水、离子、营养物质的转运和吸收,也是各种病原感染的主要入侵部位[1-3]。因此,肠道内环境平衡对于维持宿主健康和生长至关重要[4]。
动物组织器官中存在多种具有不同生理功能的胞内酶,这些胞内酶在鱼类消化道组织中广泛分布,在维持内环境稳定方面发挥关键作用。在乌鳢Ophiocephalus argus[5]和泥鳅Misgurnus anguillicaudatus[6]的消化道黏膜中广泛存在酸性磷酸酶(ACP)、碱性磷酸酶(ALP)、腺苷三磷酸酶(ATPase)、非特异性酯酶(NSE)、过氧化物酶(POD)、琥珀酸脱氢酶(SDH)等重要胞内酶,这些酶在其食道、胃贲门、胃体、胃幽门、前肠、中肠、后肠等部位具有不同活性。对半滑舌鳎Cynoglossus semilaevis[7]和锦鲤Cyprinus carpio var. koi[8]的研究发现,ACP、ALP、POD、NSE的分布遍及整个肠道组织,但其活性和分布特点在这两种鱼类中明显不同。
黏液细胞普遍存在于水产动物的组织器官中。鱼类中的黏液细胞主要分布在皮肤、鳃及消化道的上皮中。鱼类肠道组织中普遍存在多种类型的黏液细胞,它们在促进消化、维持酸碱平衡与保护黏膜等方面发挥功能。在黄唇鱼Bahaba flavolabiata[9]肠道组织中存在Ⅰ型和Ⅱ型黏液细胞;在半滑舌鳎[7]、锦鲤[8]、卵形鲳鲹Trachinotus ovatus[10]肠道组织中,均观察到Ⅰ、Ⅱ、Ⅲ型3种黏液细胞。由于鱼的种类不同,其食性、生态位特性、营养需求具有差异,所以肠道组织中黏液细胞的类型、数量和分布特点在不同鱼类中差异也较大。
建鲤Cyprinus carpio var. Jian具有生长速度快、抗病能力强、肉质鲜美等特点,已成为鲤养殖的重要优良品种。目前,对建鲤的生长特性[11]、营养需求[12]、养殖模式及技术[13]等方面已开展了广泛研究,但对建鲤肠道组织中胞内酶和黏液细胞的研究尚未见报道。本研究中,首次利用组织化学染色、光密度定量分析技术对建鲤肠道中胞内酶和黏液细胞的分布与组织定位进行了研究,旨在为进一步深入研究建鲤肠道生理功能提供参考依据。
1 材料与方法
1.1 材料
试验用建鲤购自天津市某养殖场,体质量为(150 ± 30)g,体长为(18 ± 1)cm。
1.2 方法
1.2.1 样品的采集与处理 用MS-222将建鲤麻醉后解剖,参照Sun等[8]的方法将肠道分为前、中、后3个肠段,每个肠段分别用解剖刀平均分割为4部分。第一部分在冰冻切片机(Thermo Microm HM 525,MA,USA)上冷冻15 min后使用OCT(optimal cutting temperature compound)包埋,用于ACP组织化学染色;第二部分在质量分数4%的甲醛钙(4 ℃)中固定24 h,用于ALP和NSE染色;第三部分在体积分数25%的戊二醛中固定30 min后,使用OCT包埋,用于POD染色;第四部分在波恩氏液固定8 h,石蜡包埋机包埋,用阿尔辛蓝过碘酸雪夫法(AB-PAS)染色。
所用阴性对照的组织切片进行孵育时,反应液中不加入酶的底物。每个肠段组织选3张切片,每张切片随机选取10个视野进行观察、成像。
1.2.2 酶组织化学 参照Gomori[14]的方法进行ACP染色。切片于37 ℃孵育液中保持60 min,其中孵育液中含有10 mL醋酸缓冲液(0.05 mol/L,pH 5)、10 mg硝酸铅、0.8 g蔗糖、1 mL质量分数3%的β-甘油磷酸钠。孵育完成后用蒸馏水清洗切片,用质量分数1%的硫化铵复染1 min,再次洗涤,用乙醇脱水,经二甲苯透明后封片拍照。
采用NBT/BCIP法测定ALP活性。将组织切片在室温下置于含质量分数5%的硝基蓝四唑(NBT)、质量分数5%的5-溴-4-氯-3-吲哚-磷酸盐(BCIP)、10 mL ALP缓冲液(100 mmol/L NaCl,5 mmol/L MgCl2,100 mmol/L Tris-HCl,pH 9.5)的混合液中孵育20 min。然后用蒸馏水洗涤切片,乙醇脱水,经二甲苯透明后封片拍照观察。
采用二氨基联苯胺(DAB)法测定POD活性。将切片置于含10 mg DAB·4HCl、5 mL蒸馏水、5 mL磷酸缓冲液(0.2 mol/L,pH 7.0)的孵育液中孵育20 min。然后将100 μL的H2O2加入溶液中,在室温下孵育30 min。用亚甲基蓝染色,蒸馏水洗涤,乙醇脱水,经二甲苯透明后封片观察。
采用萘酚AS盐法测定NSE活性[15]。将切片置于含0.1 mL质量分数1%的萘酚AS乙酸盐、10 mL磷酸缓冲液(0.05 mol/L,pH 7.0)、30 mg固红TR盐的溶液中孵育30 min,用质量分数2%的甲基绿染色,蒸馏水洗涤,再用甘油明胶封片拍照。
1.2.3 AB-PAS染色 将组织切片用AB-pH 2.5-PAS染色试剂盒(Solarbio,北京)染色,乙醇脱水,经二甲苯透明后封片观察。每个肠段组织选3张切片,每张切片取10个视野拍照用于数据分析。
1.2.4 光密度定量 使用正置荧光显微镜(Leica DM 4000B)进行镜检拍照。利用Image图像分析软件,对酶组织化学染色阳性部位进行测定和光密度分析,计算平均光密度(ODM),ODM值越高,代表酶活性越强。在400倍镜下计数不同类型的黏液细胞数量,并计算其占相同部位数量的百分比。
1.3 数据处理
试验数据以平均值 ± 标准差(mean ± S.D.)表示,采用SPSS 22软件进行单因子方差分析(One-way ANOVA),用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 酶组织化学染色
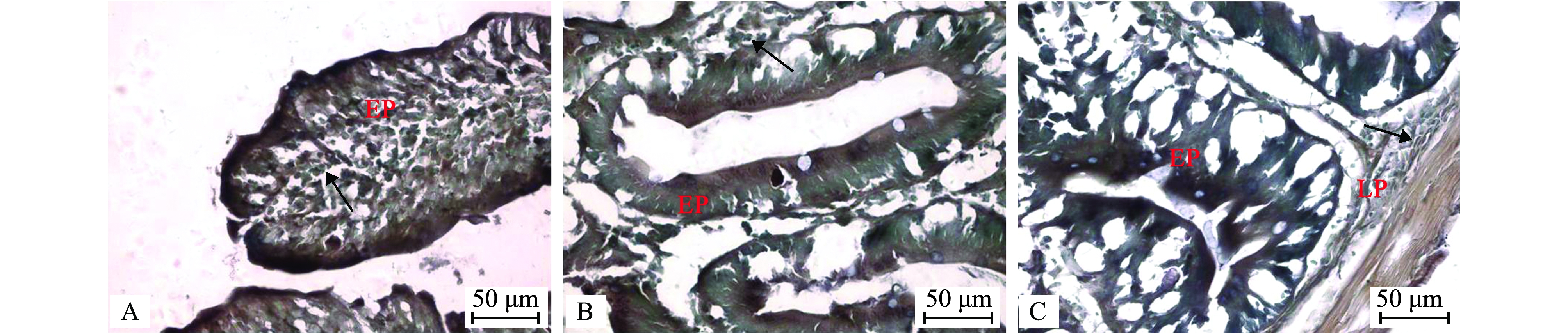
ACP组织化学阳性反应呈棕褐色(图1A~C),广泛分布于整个肠道组织;ACP活性位于前肠(图1A)和后肠(图1C)的肠道上皮细胞核上区,在中肠(图1B)中,主要位于肠道上皮细胞的核上区和固有层。中肠ACP活性显著高于前肠和后肠(P<0.05),但前、后肠间无显著性差异(P>0.05)(表1)。

A—前肠;B—中肠;C—后肠;箭头示ACP活性部位。LP—固有层;EP—上皮细胞。
A—anterior intestine; B—middle intestine; C—posterior intestine; arrows show the ACP active sites. LP—lamina propria; EP—epithelial cell.
图1 ACP在建鲤肠道中的活性和分布
Fig.1 Activity and localization of ACP in the intestine of common carp Cyprinus carpio var. Jian
ALP的活性部位染色结果呈蓝紫色,主要分布于整个肠道上皮的纹状缘、肌层和肌层与黏膜下层的交界处(图2A~C);ALP活性位于中肠(图2B)的柱状上皮细胞,在前肠(图2A)和后肠(图2C)的黏膜固有层中检测到少量ALP分布。中肠ALP活性最高(P<0.05),前肠和后肠ALP活性较低,且两者之间无显著性差异(P>0.05)(表1)。
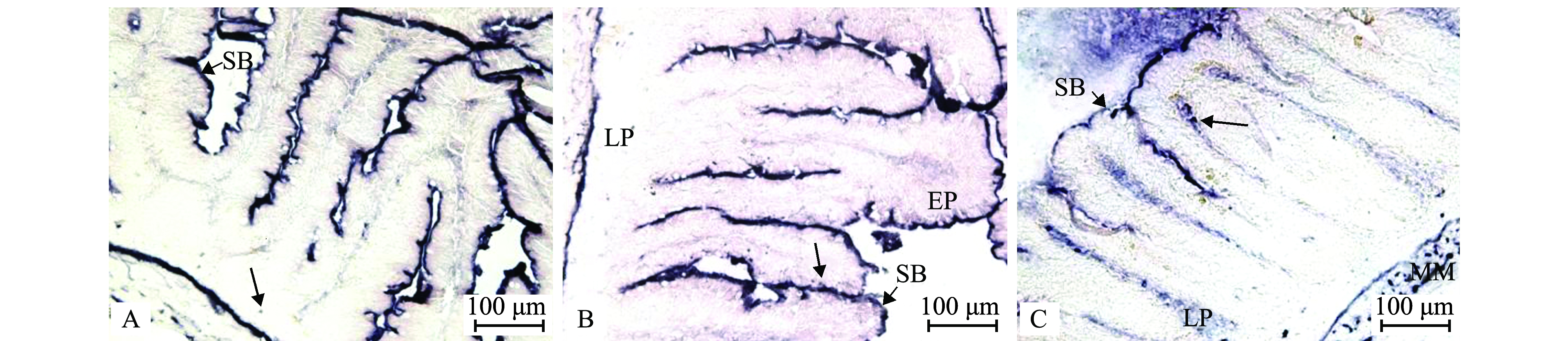
A—前肠;B—中肠;C—后肠。箭头示ALP活性部位。LP—固有层;SB—纹状缘;EP—上皮细胞;MM—黏膜肌层。
A—anterior intestine; B—middle intestine; C—posterior intestine; arrows show the ALP active sites.LP—lamina propria; SB—striated border; EP—epithelial cell; MM—muscularis mucosae.
图2 ALP在建鲤肠道中的活性和分布
Fig.2 Activity and localization of ALP in the intestine of common carp Cyprinus carpio var. Jian
POD的活性反应部位呈茶褐色,根据染色结果发现,在整个肠道黏膜固有层和黏膜肌层中均检测到POD活性(图3A~C)。后肠POD活性最高(P<0.05),中肠和前肠POD活性较低,且两者之间无显著性差异(P>0.05)(表1)。

A—前肠;B—中肠;C—后肠;箭头示POD活性部位。LP—固有层;MM—黏膜肌层。
A—anterior intestine;B—middle intestine;C—posterior intestine; arrows show the POD active sites.LP—lamina propria;MM—muscularis mucosae.
图3 POD在建鲤肠道中的活性和分布
Fig.3 Activity and localization of POD in the intestine of common carp Cyprinus carpio var. Jian
NSE组织化学染色阳性反应呈紫红色,分布于整个肠道组织,尤其在上皮细胞阳性反应更加明显(图4A~C)。光密度定量分析结果显示,NSE活性在后肠中最强,在中肠次之,在前肠中最弱,且3个肠段之间具有显著性差异(P<0.05)(表1)。
表1 建鲤肠道中4种酶活性(ODM)的分布
Tab.1 Distribution of four enzyme activities (optical density) in the intestine of common carp Cyprinus carpio var. Jian
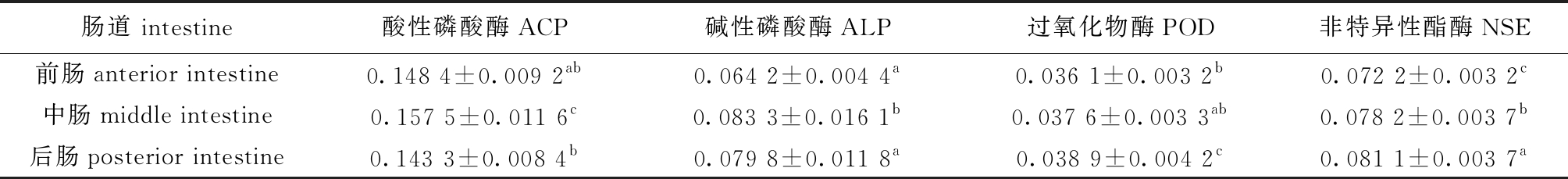
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note: The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences.
肠道 intestine酸性磷酸酶ACP碱性磷酸酶ALP过氧化物酶POD非特异性酯酶NSE前肠anterior intestine0.148 4±0.009 2ab0.064 2±0.004 4a0.036 1±0.003 2b0.072 2±0.003 2c中肠middle intestine0.157 5±0.011 6c0.083 3±0.016 1b0.037 6±0.003 3ab0.078 2±0.003 7b后肠posterior intestine0.143 3±0.008 4b0.079 8±0.011 8a0.038 9±0.004 2c0.081 1±0.003 7a
A—前肠;B—中肠;C—后肠;箭头示NSE活性部位。LP—固有层;EP—上皮细胞。
A—anterior intestine; B—middle intestine; C—posterior intestine; arrows show the NSE active sites.LP—lamina propria; EP—epithelial cell.
图4 NSE在建鲤肠道中的活性和分布
Fig.4 Activity and localization of NSE in the intestine of common carp Cyprinus carpio var. Jian
2.2 AB-PAS染色
AB-PAS染色结果显示:建鲤肠道中分布3种类型黏液细胞,这些黏液细胞均呈椭圆形,散布在整个肠道的上皮细胞和固有层中(图5A~C);Ⅰ型黏液细胞呈蓝紫色,Ⅱ型黏液细胞呈紫红色,Ⅲ型黏液细胞呈深蓝色(图5D~F)。建鲤肠道中3种不同类型黏液细胞的分布数量占比见表2,Ⅰ型黏液细胞在前肠中数量最多(P<0.05),后肠中最少,且中、后肠间无显著性差异(P>0.05);Ⅱ型黏液细胞在中肠中数量最多(P<0.05),在前肠中最少;Ⅲ型黏液细胞数量在前肠中最多,在中肠中最少,且前肠与中肠之间具有显著性差异(P<0.05)。此外,前肠中Ⅰ型黏液细胞数量最多,Ⅲ型黏液细胞次之,Ⅱ型黏液细胞最少,且3种类型的黏液细胞数量存在显著性差异(P<0.05);中肠中Ⅰ型黏液细胞数量最多,Ⅱ型黏液细胞次之,Ⅲ型黏液细胞最少,且3种类型的黏液细胞数量存在显著性差异(P<0.05);后肠中Ⅰ型黏液细胞数量最多(P<0.05),Ⅱ型和Ⅲ型黏液细胞较少。
表2 建鲤肠道不同类型黏液细胞数量占比
Tab.2 Quantity percent of different types of mucous cells in the intestine of common carp Cyprinus carpio var. Jian %

注:同列中标有不同小写字母者表示同一类型黏液细胞数量在不同肠道段间有显著性差异(P<0.05),同行中标有不同大写字母者表示同一段肠道中不同类型黏液细胞数量间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same column in same type of mucous cells are significantly different in different segments of the intestine at the 0.05 probability level, means with different capital letters within the same line in different types of mucous cells in the same segment of the intestine being significantly different at the 0.05 probability level, and the means with the same letter within the same column or line are not significant differences.
肠道 intestineⅠ型type ⅠⅡ型type ⅡⅢ型type Ⅲ前肠anterior intestine67.93±19.58aA8.40±7.33bB19.93±13.15aC中肠middle intestine55.47±17.76bA41.40±12.83aB11.40±7.65bC后肠posterior intestine51.47±11.33bA13.33±10.10bB13.27±6.95abB

在前肠(A)、中肠(B)、后肠(C)中黏液细胞广泛分布,箭头示各种黏液细胞;D为前肠中3种黏液细胞(a—Ⅰ型黏液细胞,b—Ⅱ型黏液细胞,c—Ⅲ型黏液细胞);E为中肠中3种黏液细胞(a—Ⅰ型黏液细胞,b—Ⅱ型黏液细胞,c—Ⅲ型黏液细胞);F为后肠中3种黏液细胞(a—Ⅰ型黏液细胞,b—Ⅱ型黏液细胞,c—Ⅲ型黏液细胞)。LP—固有层;EP—上皮细胞;MM—黏膜肌层。
Mucous cells are widely distributed in the anterior (A), middle (B) and posterior (C) intestines,arrows show the mucous cells; D, three types of mucous cells in anterior intestine (a—type Ⅰ cells, b—type Ⅱ cells, c—type Ⅲ cells); E,three types of mucous cells in middle intestine (a—type Ⅰ cells, b—type Ⅱ cells, c—type Ⅲ cells); F,three types of mucous cells in posterior intestine (a—type Ⅰ cells, b—type Ⅱ cells, c—type Ⅲ cells).LP—lamina propria; EP—epithelial cell; MM—muscularis mucosae.
图5 建鲤肠道中不同类型黏液细胞的分布
Fig.5 Distribution of different types of mucous cells in the intestine of common carp Cyprinus carpio var. Jian
3 讨论
本研究中首次观察了建鲤肠道内ACP、ALP、POD、NSE的组织分布及黏液细胞类型,建鲤肠道中普遍存在这4种胞内酶和3种类型的黏液细胞,但不同部位的酶活性与黏液细胞数量存在差异。
3.1 4种胞内酶在不同肠段中的分布
ACP是溶酶体的一种标志酶,在体内直接参与磷酸基团的转移与代谢。肠道中ACP在营养物质的消化、吸收和运转过程中发挥重要作用,特别是其可以通过催化磷蛋白的水解,广泛参与蛋白质胞内消化和胞饮作用的过程[16-17]。本研究中,ACP在肠道上皮细胞核上区和固有层中广泛分布,这与在锦鲤[8]、褐菖鲉Sebastiscus marmoratus[18]及欧洲鳗鲡Anguilla anguilla[19]中观察到的结果相似;而且建鲤中肠中ACP活性显著高于前肠和后肠,推测其中肠部位具有较强的蛋白质消化吸收功能。
ALP是一种在动物体内广泛分布的非特异性磷酸水解酶,通过主动运输方式参与营养物质的吸收。肠道中ALP活性与脂类的吸收能力存在正相关关系,一般可把ALP作为脂类等营养物质吸收的标志酶[20]。本研究中,在整个肠道上皮纹状缘与中肠的柱状上皮中发现大量ALP活性,这与对欧洲鳗鲡[19]、团头鲂Megalobrama amblycephala[21]和无须鳕Merluccius merluccius[22]的研究结果一致,表明这些部位具有较强的脂类吸收功能。此外,在肌层和肌层与黏膜下层的交界处也发现大量ALP活性,这一结果可能与ALP参与物质的跨膜运输有关[23-24]。ALP活性在建鲤中肠中最高,而在半滑舌鳎[7]前肠中却最高,这种结果的不同可能与不同食性鱼类肠道不同部位功能分化差异有关。
POD是一种具有免疫防御功能的氧化还原酶,其可以催化细胞内有害物质与H2O2反应,生成无害的小分子氧化酚类和胺类等物质,发挥杀伤病原微生物的作用,同时降低细胞内H2O2和有机过氧化物的水平,起到保护宿主细胞的作用[22,25]。本研究中,POD活性广泛存在于整个肠道黏膜的固有层和黏膜肌层中,这与在锦鲤[8]中观察到的结果一致。POD活性在建鲤的后肠中最高,推测这与鱼类后肠承担较为重要的免疫防御功能有关。
NSE是参与脂类物质代谢并促进其消化吸收的一种水解酶[2,15]。本研究中,NSE分布于建鲤整个肠道组织的上皮细胞,表明这些细胞与鱼类脂类物质的代谢关系密切[20]。此外,在建鲤肠道中,NSE活性在后肠中最高,其次是中肠和前肠,这与在杂食性鱼类如锦鲤[8]、无须鳕[22]中观察到的结果一致。由此推测,NSE在肠道组织中的这一分布特点可能在杂食性鱼类中普遍存在。
3.2 黏液细胞在不同肠段中的分布
黏液细胞依据着色差异及细胞形态被分为Ⅰ、Ⅱ、Ⅲ 3种类型。Ⅰ型黏液细胞对AB和PAS呈阳性反应,表明其存在中性黏蛋白和酸性黏蛋白。Ⅱ型黏液细胞只对PAS呈阳性反应,表明其存在糖原、中性黏蛋白和糖蛋白。Ⅲ型黏液细胞只对AB呈阳性反应,表明其存在硫黏蛋白、唾液黏蛋白、蛋白多糖和透明质酸。本研究中,这3种黏液细胞散布于建鲤整个肠道的上皮细胞与固有层中,这与在大多数鱼类如锦鲤[8]、欧洲鳗鲡[26]、欧鲇Silurus glanis[27]中观察到的结果一致。
酸性黏液物质具有调节蛋白质转运与润滑消化道的功能,并维持消化道一定的酸性环境;中性黏液物质主要起保护消化道上皮作用。本研究中,Ⅰ型和Ⅲ型黏液细胞在前肠中显著多于Ⅱ型细胞,表明前肠中酸性黏液物质分泌较多,这有助于鱼类前肠高效地执行其消化功能。建鲤中肠中黏液细胞分布情况与对黄姑鱼Nibea albiflora[28]的研究结果一致,均分布有丰富的Ⅰ型和Ⅱ型黏液细胞,故推测建鲤中肠中含有丰富中性黏蛋白和少量酸性黏多糖。这说明消化吸收功能在建鲤前肠和中肠产生分化,少量酸性黏多糖和大量中性黏蛋白可能预示着中肠的消化作用减弱,而吸收功能增强。后肠内黏液细胞数量最少,主要含Ⅰ型黏液细胞。鱼类后肠容易受到细菌和其他病原体感染,推测建鲤后肠酸性黏液物质和中性黏液物质共同参与免疫防御作用。
4 结论
1)ACP、ALP、POD、NSE 4种胞内酶在建鲤肠道组织中广泛存在,但肠道不同部位的酶活性强弱及分布具有不同特点。
2)在建鲤肠道组织中观察到3种类型的黏液细胞(Ⅰ、Ⅱ、Ⅲ型),主要散布于整个肠道的上皮细胞与固有层中,其数量和相对丰度在不同肠段中具有明显差异。
3)4种胞内酶和黏液细胞在建鲤肠道组织中的分布特点与其肠道的生理功能分化密切相关。
[1] LEDUC A,ZATYLNY-GAUDIN C,ROBERT M,et al.Dietary aquaculture by-product hydrolysates:impact on the transcriptomic response of the intestinal mucosa of European seabass (Dicentrarchus labrax) fed low fish meal diets[J].BMC Genomics,2018,19(1):396.
[2] GROVE S,JOHANSEN R,REITAN L J,et al.Immune- and enzyme histochemical characterisation of leukocyte populations within lymphoid and mucosal tissues of Atlantic halibut (Hippoglossus hippoglossus)[J].Fish & Shellfish Immunology,2006,20(5):693-708.
[3] FAGGIO C,TORRE A,LANDO G,et al.Carbonate precipitates and bicarbonate secretion in the intestine of sea bass,Dicentrarchus labrax[J].Journal of Comparative Physiology B,2011,181(4):517-525.
[4] OU W H,HU H B,YANG P,et al.Dietary daidzein improved intestinal health of juvenile turbot in terms of intestinal mucosal barrier function and intestinal microbiota[J].Fish & Shellfish Immunology,2019,94:132-141.
[5] 谢毓玲,王锦乙,袁保勤,等.乌鳢消化道黏膜6种重要酶的组织化学定位[J].中国组织化学与细胞化学杂志,2016,25(5):416-421.
XIE Y L,WANG J Y,YUAN B Q,et al.Histohemical localization of six essential enzymes in the mucosa of digestive tracts of the Ophiocephalus argus[J].Chinese Journal of Histochemistry and Cytochemistry, 2016,25(5):416-421. (in Chinese)
[6] 曹新芳,黄卉卉,任秋楠,等.泥鳅消化道过氧化物酶、三磷酸腺苷酶、琥珀酸脱氢酶、酸性磷酸酶、碱性磷酸酶及非特异性酯酶的分布与组织定位[J].中国组织化学与细胞化学杂志,2018,27(5):453-458.
CAO X F,HUANG H H, REN Q N,et al.Distribution and histological localization of peroxidase,adenosine triphosphatase,succinate dehydrogenase, acid phosphatase,alkaline phosphatase and non-specific esterase in the digestive tract of Misgurnus anguillicaudatus[J].Chinese Journal of Histochemistry and Cytochemistry,2018,27(5):453-458.(in Chinese)
[7] WANG Y Z,SUN J F,LV A J,et al.Histochemical distribution of four types of enzymes and mucous cells in the gastrointestinal tract of reared half-smooth tongue sole Cynoglossus semilaevis[J].Journal of Fish Biology,2018,92(1):3-16.
[8] SUN J F,WANG Y Z,LV A J,et al.Histochemical distribution of four types of enzymes and mucous cells in the intestine of koi carp (Cyprinus carpio var. koi)[J].Fish Physiology and Biochemistry,2019,45(4):1367-1376.
[9] 赵彦花,区又君,李加儿,等.黄唇鱼消化系统组织结构及黏液细胞分布特征[J].渔业科学进展,2019,40(3):80-86.
ZHAO Y H,OU Y J,LI J E,et al.Histology and distribution of mucous cells in digestive system of Bahaba flavolabiata[J].Progress in Fishery Sciences,2019,40(3):80-86.(in Chinese)
[10] 区又君,李加儿,勾效伟.卵形鲳鲹消化道的形态学、组织学和组织化学[J].大连海洋大学学报,2012,27(1):38-43.
OU Y J,LI J E,GOU X W.Morphological,histological,and histochemical observation of digestive tract in ovate pompano Trachinotus ovatus[J].Journal of Dalian Ocean University,2012,27(1):38-43.(in Chinese)
[11] 刘超,周继术,王在照,等.塘养建鲤背鳍、尾鳍和腹鳍指数的线性体重表征[J].南方农业学报,2020,51(7):1744-1753.
LIU C,ZHOU J S, WANG Z Z,et al.Linear weight characterization of dorsal fin,caudal fin and pelvic fin index of Cyprinus carpiovar Jian in pond[J].Journal of Southern Agriculture,2020,51(7):1744-1753.(in Chinese)
[12] 况文明,马卉佳,钟云飞,等.饲料中补充适宜的大豆纤维改善建鲤的生长性能、生化指标和肠道健康[J].水产学报,2019,43(10):2230-2240.
KUANG W M,MA H J,ZHONG Y F,et al.Effects of dietary fiber levels on growth,biochemical indexes and intestinal health of Cyprinus carpio var. Jian[J].Journal of Fisheries of China,2019,43(10):2230-2240.(in Chinese)
[13] 叶香尘,邹辉,刘康,等.池塘和稻田养殖模式对金边鲤和建鲤肌肉品质的影响[J].水产学报,2020,44(8):1296-1305.
YE X C,ZOU H,LIU K,et al.Effects of pond and paddy field culture models on muscle quality of Jinbian carp and Jian carp(Cyprinus carpio)[J].Journal of Fisheries of China,2020,44(8):1296-1305.(in Chinese)
[14] GOMORI G.Microscopic histochemistry principles and practice[M].Chicago:The University of Chicago Press,1952.
[15] PEARSE A G E.Histochemistry,theoretical and applied,vol 2[M].3rd ed.Edinburgh:Churchill Livingstone,1972.
[16] 王鑫,马桂荣,郑宝灿,等.SL-益生素对小白鼠体重及其单核吞噬细胞功能的影响[J].微生物学报,1995,35(6):455-459.
WANG X,MA G R,ZHENG B C, et al. Effects of SL-probiotic preparation on the body weight and phagocytosis of white mice[J].Acta Microbiologica Sinica,1995,35(6):455-459.(in Chinese)
![]() Z,KUŽIR S,PETRINEC Z,et al.Histochemical distribution of digestive enzymes in intestine of goldline,Sarpa salpa L.1758[J].Journal of Applied Ichthyology,2006,22(1):43-48.
Z,KUŽIR S,PETRINEC Z,et al.Histochemical distribution of digestive enzymes in intestine of goldline,Sarpa salpa L.1758[J].Journal of Applied Ichthyology,2006,22(1):43-48.
[18] 石戈,王健鑫,刘雪珠,等.褐菖鲉消化道的组织学和组织化学[J].水产学报,2007,31(3):293-302.
SHI G,WANG J X,LIU X Z,et al.Study on histology and histochemistry of digestive tract in Sebastiscus marmoratus[J].Journal of Fisheries of China,2007,31(3):293-302.(in Chinese)
[19] KUŽIR ![]() E,NEJEDLI S,et al.Morphological and histochemical study of intestine in wild and reared European eel (Anguilla anguilla L.)[J].Fish Physiology and Biochemistry,2012,38(3):625-633.
E,NEJEDLI S,et al.Morphological and histochemical study of intestine in wild and reared European eel (Anguilla anguilla L.)[J].Fish Physiology and Biochemistry,2012,38(3):625-633.
[20] TENGJAROENKUL B,SMITH B J,CACECI T,et al.Distribution of intestinal enzyme activities along the intestinal tract of cultured Nile tilapia,Oreochromis niloticus L.[J].Aquaculture,2000,182(3/4):317-327.
[21] 权梦雪,罗莹,彭迁迁,等.团头鲂消化道黏膜ACP、ALP、NSE、SDH、ATPase的组织化学定位[J].中国组织化学与细胞化学杂志,2015,24(6):573-577.
QUAN M X,LUO Y,PENG Q Q,et al.Histochemical localization of five kinds of enzymes in the digestive mucosa of Megalobrama amblycephala[J].Chinese Journal of Histochemistry and Cytochemistry,2015,24(6):573-577.(in Chinese)
![]() Z,KUŽIR S,NEJEDLI S,et al.Histochemical distribution of digestive enzymes in hake,Merluccius merluccius L.1758[J].Veterinarski Arhiv,2004,74(4):299-308.
Z,KUŽIR S,NEJEDLI S,et al.Histochemical distribution of digestive enzymes in hake,Merluccius merluccius L.1758[J].Veterinarski Arhiv,2004,74(4):299-308.
[23] ALPERS D H,MAHMOOD A,ENGLE M,et al.The secretion of intestinal alkaline phosphatase (IAP) from the enterocyte[J].Journal of Gastroenterology,1994,29(7):63-67.
[24] ALPERS D H,ZHANG Y,AHNEN D J.Synthesis and parallel secretion of rat intestinal alkaline phosphatase and a surfactant-like particle protein[J].American Journal of Physiology,1995,268(6 Pt 1):E1205-E1214.
[25] 赵柳兰,陈侨兰,杨淞,等.大口黑鲈消化道组织结构及黏液细胞的类型和分布[J].四川农业大学学报,2018,36(4):549-554.
ZHAO L L,CHEN Q L,YANG S,et al.Analysis of the histological structure,the types and distribution of mucous cells of digestive tract in largemouth bass (Micropterus samoides)[J].Journal of Sichuan Agricultural University,2018,36(4):549-554.(in Chinese)
[26] DOMENEGHINI C,ARRIGHI S,RADAELLI G,et al.Histochemical analysis of glycoconjugate secretion in the alimentary canal of Anguilla anguilla L.[J].Acta Histochemica,2005,106(6):477-487.
[27] PETRINEC Z,NEJEDLI S,KUŽIR S,et al.Mucosubstances of the digestive tract mucosa in northern pike (Esox lucius L.) and European catfish (Silurus glanis L.)[J].Veterinarski Arhiv,2005,75(4):317-327.
[28] 辛俭,薛宝贵,楼宝,等.黄姑鱼消化道黏液细胞的类型和分布[J].浙江海洋学院学报(自然科学版),2013,32(1):10-14.
XIN J,XUE B G,LOU B,et al.The type and distribution of mucous cells in the digestive tract of Nibea albiflora[J].Journal of Zhejiang Ocean University(Natural Science Edition),2013,32(1):10-14.(in Chinese)