乌鳢Channa argus隶属于鳢亚目鳢科鳢属鱼类,是中国淡水养殖重要品种之一,其具有出肉率高、抗应激性强、营养价值高等特点,同时具有较高的药用价值[1]。2019年中国渔业统计年鉴显示,全国乌鳢产量高达459.277 t,但随着养殖规模和密度的不断扩大,水体环境持续恶化,导致该鱼发育迟缓,免疫力降低,各种病害频发,其中乌鳢烂身病尤为严重,给乌鳢养殖产业发展造成了极大障碍[2]。目前,已报道引起烂身症状的病原菌有拟态弧菌Vibrio mimicus[3]、嗜水气单胞菌Aeromonas hydrophila[4]、维氏弧菌Vibrio harvey[5]、丝囊霉菌Aphanomyces invadans[6]和维氏气单胞菌Aeromonas veronii[7]等。
维氏气单胞菌隶属于气单胞菌科弧菌属革兰氏阴性厌氧菌,广泛分布于自然界中,是一种人-鱼共患致病菌[8],不仅能引起人类败血症、伤口继发性感染、肠胃炎及脑膜炎,还能感染斑点叉尾鮰Ietalurus punetaus[9]、黄颡鱼Pelteobagrus fulvidraco[10]、加州鲈Micropterus salmoniodes[11]、卵形鲳鲹Trachinotus ovatus[5]、泥鳅Misgurnus anguillicaudatus[12]、黄鳝Monopterus albus[13] 、鳗鲡Anguilla japonica[14]、团头鲂Megalobrama amblycephala[15]和怀头鲇Silurus soldatovi[16]等多种鱼类,给水产养殖产业造成了巨大经济损失。
2020年3月,在中山某乌鳢亲鱼养殖场出现大量患病乌鳢,体表多处出现烂身症状,沿岸浮头,无规则游动,食欲废绝。乌鳢烂身病在中国珠江三角洲地区发现已久,且在春季低温反潮季节持续发病,有些地区发病周期甚至延长至10月底,这对乌鳢养殖业造成了严重影响。调查发现,发病乌鳢养殖基地存在养殖密度过大、投喂分布集中、水质恶化等现象,这些因素都有可能导致乌鳢烂身发生。本研究中,作者从患病乌鳢病灶处分离到一株优势菌,通过16S rRNA测序、生理生化鉴定、药敏分析等试验,对乌鳢烂身病病原菌特征进行了分析,并对该菌株感染后的组织病理变化进行了观察,最后通过回归感染试验确认该菌株为烂身病的主要病原,获得的结果能为乌鳢烂身病的防治提供理论依据,对乌鳢的健康养殖也具有一定的实践指导意义。
1 材料与方法
1.1 材料
患病乌鳢来源于广东中山某亲鱼养殖场。试验所用健康乌鳢鱼苗(体长7~10 cm)购自惠州某乌鳢鱼苗养殖场,暂养于实验室养殖桶,14 d后用于攻毒试验,暂养期间水温控制在28 ℃,每日投喂一次。
常规使用培养基、革兰氏染色试剂盒、细菌生理生化鉴定试剂盒、药敏片等均购自广东环凯微生物科技有限公司。
1.2 方法
1.2.1 病症观察 眼观患病乌鳢体表症状,并记录;随后解剖患病乌鳢体表皮肤、鳃丝、肠道等器官并用相机拍照记录。取病灶周围黏液进行水浸片观察,排除寄生虫和真菌感染后,进行下一步细菌分离纯化。
1.2.2 病原菌分离纯化 用体积分数75%的乙醇对患病乌鳢体表消毒,将濒死与刚死亡的患病乌鳢在无菌操作台进行解剖和初步临床诊断,并对体表病灶部位进行划线分离,28 ℃培养箱中培养10 h,挑取长势与形态规格相似的单个菌落进行扩大培养,并进行后续鉴定分析。
1.2.3 病原菌鉴定
1)革兰氏染色。参考革兰氏染色试剂盒方法步骤,在无菌条件下进行染色及形态观察。
2)生理生化鉴定。按照细菌生理生化鉴定试剂盒说明书,将培养好的菌液添加到生化鉴定管中,于37 ℃下培养24~48 h后观察并记录结果。
3)细菌的16S rRNA序列及其系统发育分析。按照基因组DNA提取试剂盒方法,提取纯化菌株DNA,利用生工生物工程(广州)股份有限公司合成的16S rRNA通用引物27F:AGAGTTTGATCMGGCTCAG和1492R:GGTTACCTTGTTACGACTT 进行PCR扩增,产物经20 g/L琼脂糖电泳检测无误后,送至生工生物工程(广州)股份有限公司进行测序并构建系统发育树。
1.2.4 人工回归感染试验 将此前分离到的疑似病原菌活化,28 ℃下培养12 h,用于后续人工回归感染试验。参考黄浦江等[17]的方法,使用无菌PBS将菌液浓度分别调节至2.0×107、2.0×106 、2.0×105 、2.0×104 CFU/mL,腹腔注射鱼体,每尾注射100 μL,每组30尾,对照组注射等量无菌PBS,接种后连续观察一周,每天记录乌鳢发病情况,参考黄浦江等[1]方法计算半致死浓度(LD50 ),连续观察期间出现死亡病例,及时分离并鉴定病原菌。
1.2.5 病原菌药敏试验 参考黄浦江等[17]的方法, 选取30种抗生素药敏片对致病菌进行药敏试验(判断依据为WS/T125—1999)。
1.2.6 组织病理检验 患病乌鳢体表使用体积分数75%的乙醇进行消毒,取体表病灶处代表性样品,切块置于体积分数4%的组织细胞固定液中,送至武汉塞维尔生物(广州)科技有限公司进行组织病理制片。
2 结果与分析
2.1 患病乌鳢病症观察
眼观患病乌鳢体表主要病变为烂身(图1),体表鳞片脱落(图1A),体表多处出现溃疡灶(图1B),鳃盖处可见糜烂血块(图1C),尾部存在少量出血点(图1D)。解剖观察体内感染情况,发现其腹腔有黄色积液,内部组织未见异常。
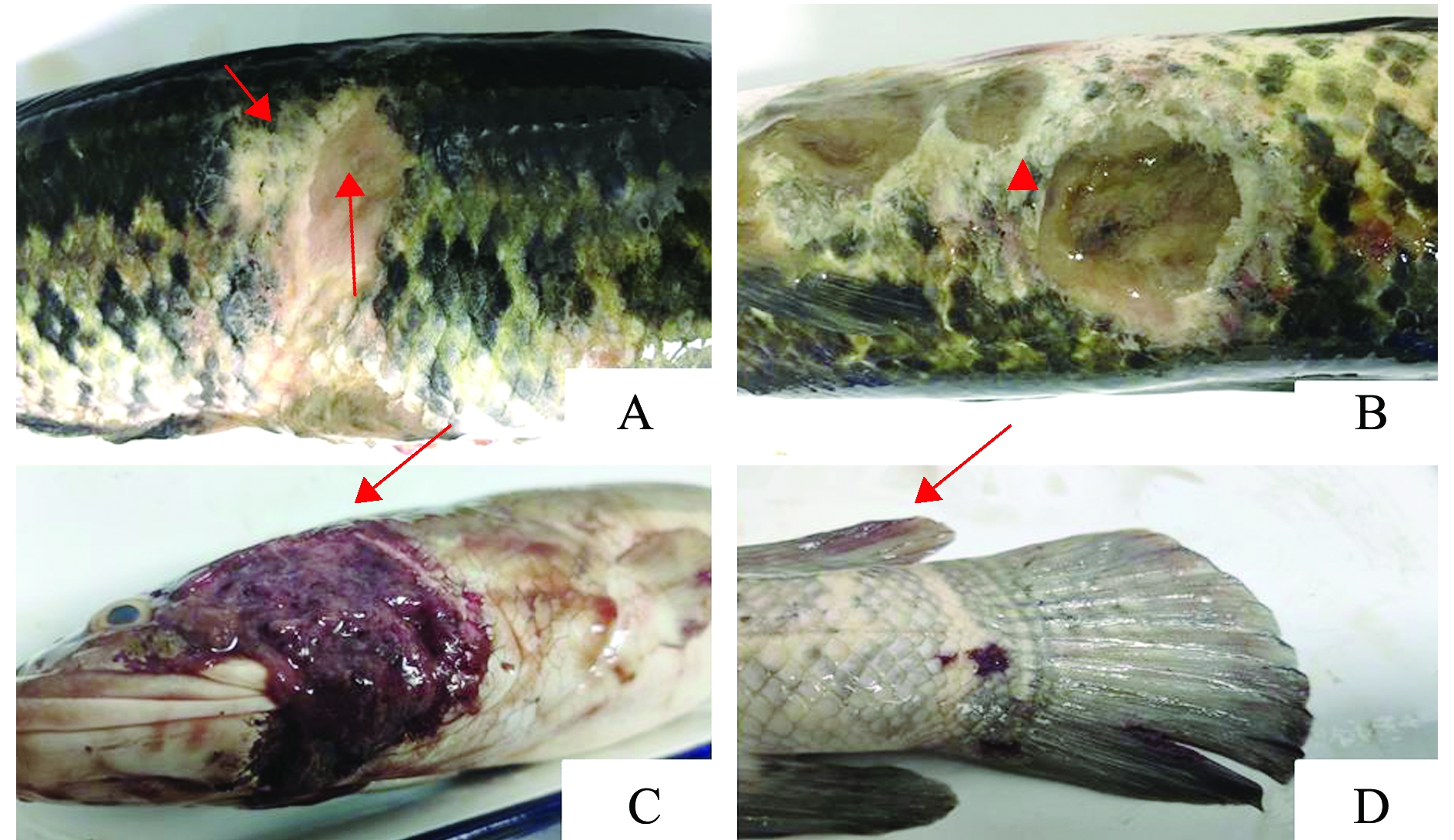
A—体表鳞片脱落(↑);B—体表溃疡灶(▲);C—鳃盖糜烂(↑);D—尾部出血点(↑)。
A—exfoliation of body surface scales(↑); B—ulcer focal in the skin(▲); C—gill erosion(↑); D—bleeding spots in fish tail(↑).
图1 患病乌鳢症状
Fig.1 Symptoms of sick Chinese snakehead Channa argus
2.2 病原菌的分离与革兰氏染色
从患烂身病乌鳢病灶处分离到一株优势菌,命名为ZS20200317。随后对该菌株进行革兰氏染色鉴定,发现该菌为革兰氏阴性菌。显微镜下观察该菌呈短杆状,边缘光滑整齐。
2.3 序列分析及系统发育树的构建
用细菌16S rRNA通用引物扩增菌株ZS20200317的16S rRNA基因, 并将其测序结果进行拼接,随后与GenBank数据库中已公布的其他菌株的16S rRNA基因序列进行比对,发现菌株ZS20200317与已知维氏气单胞菌一致性最高,为98.5%。选取NCBI中部分维氏气单胞菌16S rRNA 序列,并利用Mega 5.2软件,采用N-J法构建系统进化树,结果显示,菌株ZS20200317与维氏气单胞菌KC166864聚为一支,亲缘关系最近(图2)。
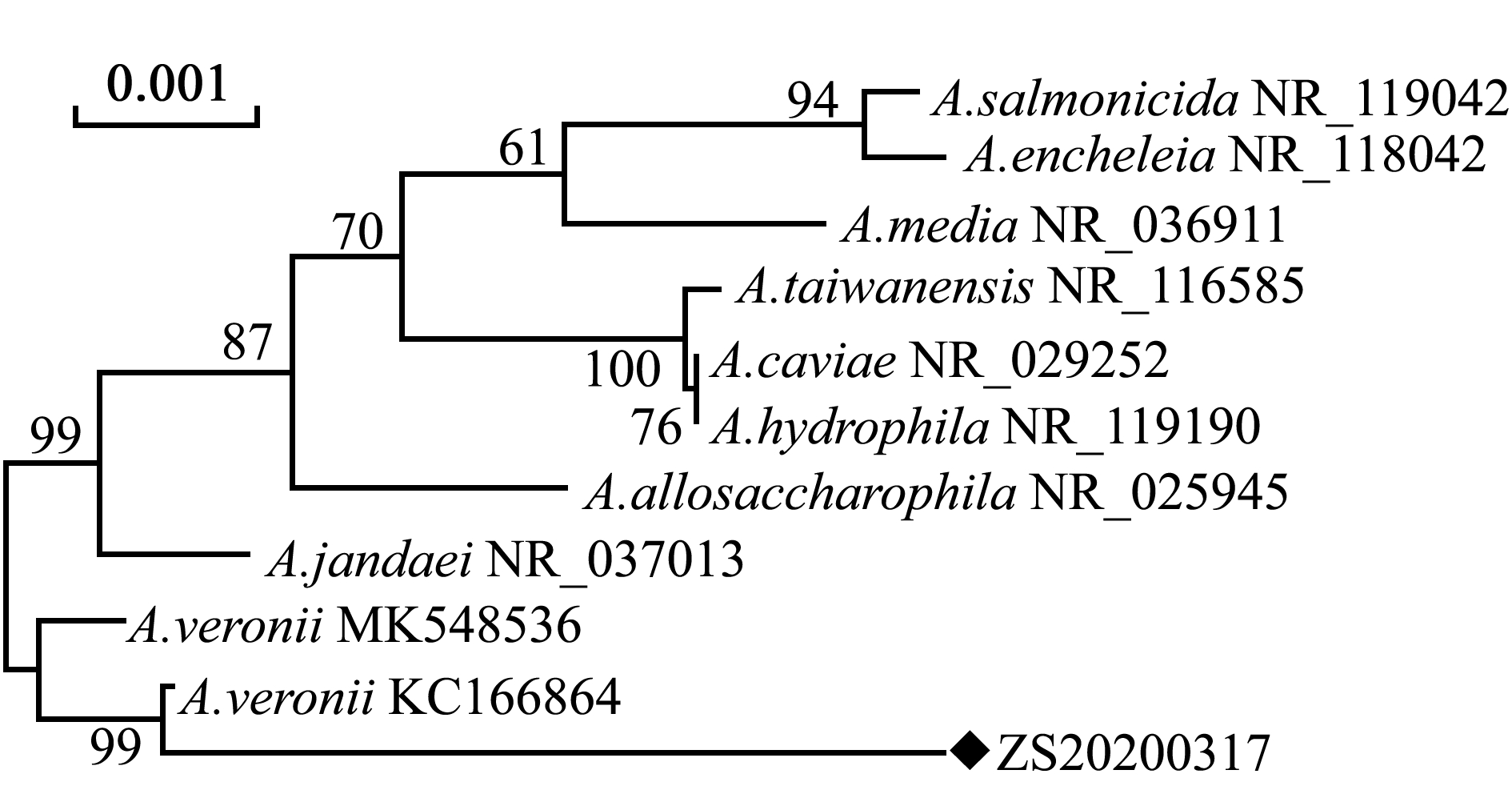
◆,分离菌株ZS20200317。
◆,Isolated bacterial strain SZ20200317.
图2 基于分离菌16S rRNA基因序列构建的系统进化树
Fig.2 Phylogenetic tree of isolated bacteria based on 16S rRNA gene sequence
2.4 分离株的生理生化鉴定
分离株ZS20200317经生理生化鉴定显示(表1),该菌的赖氨酸脱羧酶、氧化酶、VP试验、MR等生理生化反应为阳性,可利用覃糖、甘露醇、葡萄糖、蔗糖,不能分解乳糖,能直接生长在半固体琼脂上,三糖铁试验无法分解乳糖,产H2S气,该分离菌与本实验室分离的维氏气单胞菌的生理生化特性基本一致。
表1 分离菌的生理生化鉴定结果
Tab.1 Physiological and biochemical identification results of isolated bacteria

注:+表示阳性反应; -表示阴性反应。
Note:+,positive; -, negative.
生化试验biochemical test结果result菌株ZS20200317维氏气单胞菌A.veronii3%NaCl半固体琼脂NaCl (3%) motility test medium++3%NaCl赖氨酸脱羧酶NaCl (3%) lysine decarboxylase++3%NaCl葡萄糖(产气)NaCl (3%) glucose (gas production)--3%NaCl甘露醇 NaCl (3%) mannito++覃糖 trehalose anhydrous++β-半乳糖苷ONPG-+3%NaCl蔗糖 NaCl (3%) sucrose++M.R.反应 M.R.test++三铁糖试验TSI test+-0%NaCl胨水生长growth in NaCl (0%)++3%NaCl胨水生长growth in NaCl (3%)++6%NaCl胨水生长growth in NaCl (6%)--8%NaCl胨水生长growth in NaCl (8%)--10%NaCl胨水生长growth in NaCl(10%)--氧化酶活性oxase activity++V-P试验 V-P test++
综合形态学观察、革兰氏染色、16S rRNA及生理生化特性结果,可鉴定菌株ZS20200317为维氏气单胞菌。
2.5 药敏试验
菌株ZS20200317对30种抗生素药物敏感性结果显示(表2),该菌株对氨苄西林、苯唑西林、羧苄西林、青霉素G、麦迪霉素、万古霉素和克林霉素7种药物耐受;对新霉素、呋喃唑酮和复方新诺明中度敏感;对头孢他啶、多粘菌素B、四环素等20种药物敏感。
表2 药敏试验结果
Tab.2 Results of drug sensitivity test

注:R—耐药; I—中度敏感; S—敏感; △—禁用兽药,仅用于科研。
Note:R—resistant; I—intermediate; S—sensitive;△—forbidden veterinary drugs,for research only.
抗生素antibiotic剂量/(μg·disc-1)dose抑菌圈直径/mmdiameter of inhibition 药物敏感性drug sensitivity氨苄西林 Ampicillin100R头孢他啶 Ceftazidime3030S苯唑西林 Oxacillin10R羧苄西林 Carbenicillin1000R头孢氨苄 Cefalexin3020S青霉素G G-penicillin10 U0R头孢唑林 Cefazolin3020S头孢拉定 Cephradine3020S头孢呋辛 Cefuroxime3035S头孢哌酮 Cefoperazone75 30S丁胺卡那 Amikacin3022S头孢曲松 Cefatriaxone3050S哌拉西林 Piperacillin100 26S多西环素 Doxycycline3019S卡那霉素 Kanamycin3023S庆大霉素 Gentamycin10 22S新霉素 Neomycin30 20I四环素 Achromycin3022S米诺环素 Minocycline30 21S氧氟沙星Ofloxacin△520S诺氟沙星 Norfloxacin△1020S环丙沙星 Ciprofloxacin522S红霉素 Erythromycin1513S呋喃唑酮 Furazoli-done△10015I麦迪霉素 Midecamycin300R万古霉素 Vancomy-cin△300R多粘菌素B Polymixin B3012S克林霉素 Clindamycin20R复方新诺明 SMZ/tmpbactrim23.75 SMZ/1.25 TMP 14I氯霉素 Chloramghenicol△30 28S
2.6 人工回归感染试验
健康乌鳢在回归感染7 d内各组死亡情况见表3,感染期间,发现部分染病乌鳢活力减弱,食欲废绝,感染4 d后,高浓度组(2.0×107 CFU/mL)回归感染乌鳢全部死亡,无菌PBS对照组健康无死亡,这表明菌株ZS20200317对乌鳢有较强的致病性。同时,从回归感染濒死乌鳢体内再次分离细菌,发现重新分离到的病原菌与自然分离病原菌相同,这表明,本次自然分离菌株ZS20200317为此次乌鳢烂身病的疑似致病菌。
表3 乌鳢腹腔注射感染试验结果
Tab.3 Mortality of Chinese snakehead infected by intraperitoneal injection
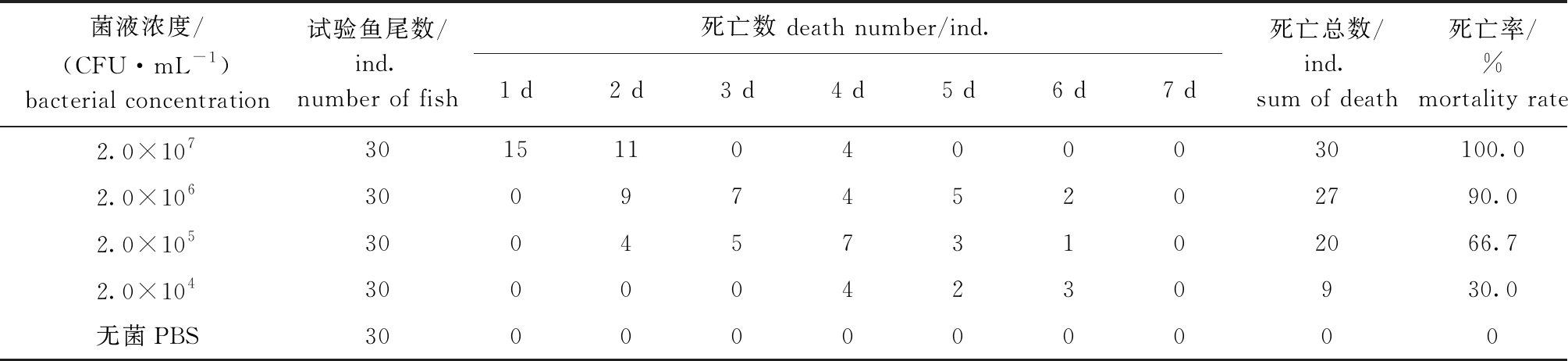
菌液浓度/(CFU·mL-1)bacterial concentration试验鱼尾数/ind.number of fish死亡数 death number/ind.1 d2 d3 d4 d5 d6 d7 d死亡总数/ind.sum of death死亡率/%mortality rate2.0×1073015110400030100.02.0×1063009745202790.02.0×1053004573102066.72.0×104300004230930.0无菌PBS30000000000
使用SPSS 12.0软件进行统计学分析后,计算得到菌株ZS20200317的LD50为7.25×104 CFU/mL。
2.7 组织病理学观察
观察自然患病乌鳢烂身病的病理组织切片,眼观体表病灶处从外到内可见皮肤鳞片脱落,表皮坏死消失,真皮层泛红,图3为自然患病乌鳢健康肌肉与病灶处肌肉组织H.E染色病理切片。病灶处肌肉组织中出现大量嗜酸性粒细胞和淋巴细胞浸润,肌细胞核溶解消失(图3B),并出现坏死脱落(图3C),部分肌纤维溶解,边界不清(图3D)。

A—健康肌肉组织; B—肌肉组织大量嗜酸性粒细胞和淋巴细胞浸润(↑), 肌纤维坏死,核溶解(▲); C—肌肉糜烂, 组织渗出坏死,出现炎症细胞,肌细胞坏死脱落(*) ; D—肌纤维变性溶解,边界不清(↑)。
A—healthy muscle tissue; B—infiltration of eosinophils and lymphocytes in muscle tissue(↑), myofibrillar necrosis, and nucleolysis(▲); C—muscle erosion, tissue exudation and necrosis, inflammatory cells, necrosis and abscission of muscle cells(*); D—degeneration and dissolution of muscle fiber, with unclear boundary(↑).
图3 患病乌鳢的病理组织学观察
Fig.3 Pathohistological observation of sick Chinese snakehead Channa argus
3 讨论
3.1 乌鳢烂身病病原诊断
目前,有关鱼类体表疾病研究报道较多,本研究中患病乌鳢体表出现溃烂坏死症状,与云斑尖塘鳢Oxyeleotris marmoratus[4]、大口黑鲈Micropterus salmoides[18]、鳢Channa maculata[6]和卵形鲳鲹Trachinotus ovatus[5]烂身病的临床症状相同,主要表现为鳍条损伤、肌肉糜烂、体表出现大量出血点等症状。根据以往研究表明[4,6,10,12,19-20],引起鱼类烂身病病原很多,其中大口黑鲈烂身病的病原是嗜水气单胞菌,卵形鲳鲹烂身病的病原是哈维氏弧菌QT520,丝囊霉菌则是引发冬春季鳢烂身病的主要病原,均与本研究中分离获得的病原不同。将本研究中分离纯化致病菌,进行16S rRNA 序列同源性比对及构建系统进化树,发现其与维气氏单胞菌具有98.5%的一致性,初步将该菌确定为维氏气单胞菌。回归感染试验验证了维气氏单胞菌为引发本次烂身病的病原。
3.2 乌鳢烂身病病原菌的致病性与致病机理
王旭等[20]研究表明,维氏气单胞菌主要感染体表肌肉及肝、肾等内脏器官,细菌通过体表病灶侵入其他组织,且细菌在其他组织中大量繁殖,引发进一步继发感染并导致死亡;杨移斌等[21]研究发现,从西伯利亚鲟和施氏鲟分离的维氏气单胞菌具有很强的致病性,人工感染96 h内的累计死亡率分别高达70%和80%;而刘亚等[22]对维氏气单胞菌感染达氏鲟Acipenser dabryanus造成的组织病理观察发现,其病理损伤多集中在肝脏和肠道等组织,肝脏是鱼体重要解毒器官,肠道主要功能是吸收营养促进机体发育,功能性器官组织的损伤,导致机体免疫力下降更易发生继发性感染而死亡。本研究中患病乌鳢病理损伤主要集中在体表,且体表肌肉病理切片结果显示,其上皮细胞及皮肤结缔组织坏死脱落,大量炎性细胞聚集,这与常藕琴等[6]对冬春季鳢体表溃疡的组织病理观察相似。
值得一提的是,本试验中初期使用维氏气单胞菌人工感染健康乌鳢,尚未出现明显烂身症状,但2 d内出现大量死亡,随后降低感染浓度,延长养殖周期,结果均不理想,依然无法复制烂身症状。在丝囊霉菌回归感染健康冬春季鳢时,也同样无法复制自然患病症状[6]。以往研究表明[4,20-21,23],烂身病可能不是由某一种病原引起,而是由于鱼类体表损伤使得水体中的病原菌能突破体表黏膜免疫后在局部繁殖,继而扩大损伤部位加剧感染,出现烂身及溃疡症状,最后细菌通过血液循环系统进入体内并大量繁殖,产生大量毒素造成机体死亡。但本研究中用维氏气单胞菌进行人工回归感染试验后,可以从患病个体中重新分离到该菌株,用SPSS 12.0软件进行统计分析,显示菌株ZS20200317的LD50为7.25×104 CFU/mL,具有较强致病性,为烂身病病原。
3.3 乌鳢烂身病的预防及控制方法
本试验中药敏试验显示,维氏气单胞菌对氯霉素、头孢他啶、头孢氨苄、头孢唑林、头孢拉定、头孢呋辛、头孢哌酮、丁胺卡那、头孢曲松、哌拉西林、多西环素、卡那霉素、庆大霉素、四环素、米诺环素、氧氟沙星、诺氟沙星、环丙沙星、红霉素、多粘菌素B等20种抗生素具有敏感性,这些试验结果能为该病治疗提供参考。然而其中氯霉素、氧氟沙星、诺氟沙星是中国农业农村部禁用兽药,严禁使用,在实际养殖过程中可以参考药敏结果中其他非禁用抗生素,严格按照剂量添加,严禁私自使用其他药物,同时做好日常消毒管理工作。
防控该病的主要方法是:1)通过调节水质保持养殖水体清洁;2)乌鳢生性凶猛,养殖过程中,可按照鱼体大小分拣后进行养殖,同时降低放养密度,避免因抢食造成鱼体受伤;3)定期清塘清淤,使用生石灰和漂白粉等对水体进行消毒;4)确保饵料干燥新鲜,按量投喂,减少残饵对水体的污染;5)适量使用“三黄散”(黄芩、黄檗、大黄、大青叶等)拌料投喂乌鳢,调节水质的同时也可预防烂身病暴发。
4 结论
1)从广东中山某养殖场患病乌鳢中分离到一株优势菌株ZS20200317,经过形态学、生理生化特征及16S rRNA 基因序列比对,将该菌株确定为维气氏单胞菌。
2)维气氏单胞菌ZS20200317对乌鳢的LD50为7.25×104 CFU/mL,具有较强致病性,属于强毒株型。
3)分离菌株ZS20200317对头孢他啶、头孢氨苄、头孢唑林和头孢拉定等20种抗生素药物敏感,对氨苄西林、苯唑西林、羧苄西林、青霉素G、麦迪霉素、万古霉素和克林霉素等7种药物具有耐药性。
[1] 杨丽专,刘付永忠,李文卫,等.乌鳢生态养殖技术研究[J].中国水产,2019(12):67-68.
YANG L Z,LIU F Y Z,LI W W,et al.Study on ecological culture technology of Channa argus[J].China Fisheries,2019(12):67-68.(in Chinese)
[2] 洪培辉.水库养殖乌鳢的病害发生原因及几种常见病的防治技术[J].农业与技术,2018,38(19):124-125.
HONG P H.Causes of diseases and control techniques of several common diseases of Channa argus in reservoir culture[J].Agriculture and Technology,2018,38(19):124-125.(in Chinese)
[3] 陈彦希,杨佰启,温贵兰,等.黄颡鱼源拟态弧菌的分离鉴定[J].动物医学进展,2020,41(4):53-57.
CHEN Y X,YANG B Q,WEN G L,et al.Isolation and identification of Vibrio mimicus GZ 201811 strain in Pelteobagrus fulvidraco[J].Progress in Veterinary Medicine,2020,41(4):53-57.(in Chinese)
[4] 麦耀宝,陈智光,陈灼均,等.云斑尖塘鳢烂身病病原分离鉴定及药敏试验[J].广东农业科学,2018,45(6):116-119.
MAI Y B,CHEN Z G,CHEN Z J,et al.Isolation,identification and drug susceptibility of Aeromonas veronii isolated from Oxyeleotris marmoratus[J].Guangdong Agricultural Sciences,2018,45(6):116-119.(in Chinese)
[5] 涂志刚,崔婧,严耿杰,等.网箱养殖卵形鲳鲹“烂身病”病原分离鉴定及药敏分析[J].水产科学,2018,37(5):634-639.
TU Z G,CUI J,YANG G J,et al.Isolation, identification and antibiotic sensitivity of bacterial pathogen in ovate pompano Trachinotus ovatus with rot body disease in deep-sea cage aquacutture[J].Fisheries Science,2018,37(5):634-639.(in Chinese)
[6] 常藕琴,石存斌,王亚军,等.鳢流行性溃疡综合征病原分离鉴定与病理形态学观察[J].中国水产科学,2019,26(6):1213-1220.
CHANG O Q,SHI C B,WANG Y J,et al.Isolation,identification, and histopathological observation of epizootic ulcerative syndrome cauesd by Aphanomyces invadans in Channa maculata[J].Journal of Fishery Sciences of China,2019,26(6):1213-1220.(in Chinese)
[7] 高金伟,梁利国,王亚冰,等.鳜源致病性维氏气单胞菌的鉴定及药敏试验[J].微生物学通报,2016,43(12):2686-2692.
GAO J W,LIANG L G,WANG Y B,et al.Identification and susceptibility test of pathogenic Aeromonas veronii isolated from Siniperca chuatsi [J].Microbiology China,2016,43(12):2686-2692.(in Chinese)
[8] LI T,RAZA S H,YANG B T,et al.Aeromonas veronii infection in commercial freshwater fish:a potential threat to public health[J].Animals,2020,10(4):608.
[9] 黄小丽,汪开毓.斑点叉尾鮰维氏气单胞菌病的诊断与防治[J].水产科技情报,2009,36(5):240-241.
HUANG X L,WANG K L.Diagnosis and control of Aeromonas veronica in channel catfish[J].Fisheries Science & Technology Information,2009,36(5):240-241.(in Chinese)
[10] 孙昌飞,祭仲石,韦艳,等.黄颡鱼烂身病病原菌的分离及药敏实验[J].渔业致富指南,2019(16):61-62.
SUN C F,JI Z S,WEI Y,et al.Isolation and drug sensitivity test of pathogens causing body rot disease of Pelteobagrus fulvidraco [J].Fishery Guide to be Rich,2019(16):61-62.(in Chinese)
[11] 龙波,王均,贺扬,等.加州鲈源维氏气单胞菌的分离、鉴定及致病性[J].中国兽医学报,2016,36(1):48-55.
LONG B,WANG J,HE Y,et al.Isolation, identification and pathogenicity of Aeromonas veronii isolated from Micropterus salmoides[J].Chinese Journal of Veterinary Science,2016,36(1):48-55.(in Chinese)
[12] 袁雪梅,姚嘉赟,蔺凌云,等.泥鳅致病性维氏气单胞菌的分离与鉴定[J].浙江农业学报,2018,30(5):730-737.
YUAN X M,YAO J Y,LIAN L Y,et al.Isolation and identification of pathogenic Aeromonas veronii from Misgurnus anguillicaudatus[J].Acta Agriculturae Zhejiangensis,2018,30(5):730-737.(in Chinese)
[13] 陈红莲,江河,胡王,等.黄鳝病原性维氏气单胞菌温和生物变种的分离与鉴定[J].生物技术通报,2014(3):130-136.
CHEN H L,JIANG H,HU W,et al.Isolation and identification of pathogenic Aeromonas veronii Biovar sobria from Monopterus albus[J].Biotechnology Bulletin,2014(3):130-136.(in Chinese)
[14] 杨求华,郭松林,关瑞章,等.鳗鲡病原性维氏气单胞菌的分离与鉴定[J].生物技术通报,2012(7):134-139.
YANG Q H,GUO S L,GUAN R Z,et al.Isolation and identification of pathogenic Aeromonas veronii from Anguilla japonica[J].Biotechnology Bulletin,2012(7):134-139.(in Chinese)
[15] 周光.团头鲂池塘维氏气单胞菌的致病性、耐药性、基因分型及其分布研究[D].上海:上海海洋大学,2012.
ZHOU G.Study of pathogenicity,drug resistance,ERIC-PCR and distribution of Aeromonas veroni isolated from Megalobrama amblycephala pond[D].Shanghai:Shanghai Ocean University,2012.(in Chinese)
[16] 陆梦莹,胡秀彩,吕爱军,等.鲶源维氏气单胞菌的分离鉴定及药敏特性[J].大连海洋大学学报,2017,32(5):563-567.
LU M Y,HU X C,LÜ A,et al.Isolation,identification and susceptibility of Aeromonas veronii from diseased northern sheatfish Silurus soldatovi [J].Journal of Dalian Ocean University,2017,32(5):563-567.(in Chinese)
[17] 黄浦江,程俊,冯卫权,等.草鱼源致病维氏气单胞菌的分离鉴定及药敏分析[J].基因组学与应用生物学,2019.http://kns.cnki.net/kcms/detail/45.1369.Q.20191210.1123.003.html.
HUANG P J,CHEN J,FENG W Q,et al.Identification and antibiotic sensitivity of a pathogenic Aeromonas veronii from Ctenopharyngodon idellus [J].Genomics and Applied Biology,2019.http://kns.cnki.net/kcms/detail/45.1369.Q.20191210.1123.003.html.(in Chinese)
[18] 刘春,李凯彬,王庆,等.大口黑鲈烂身病病原菌的分离、鉴定与特性分析[J].广东农业科学,2011,38(6):126-128.
LIU C,LI K B,WANG Q,et al.Identification and characterization of Aeromonas hydrophila isolated from Micropterus salmoides[J].Guangdong Agricultural Sciences,2011,38(6):126-128.(in Chinese)
[19] 宋丽芳,厉成新,朱海伟.一例鮰鱼种烂身病的治疗[J].科学养鱼,2019(3):52.
SONG L F,LI C X,ZHU H W.Treatment of a case of rotten body disease of channel catfish[J].Scientific Fish Farming,2019(3):52.(in Chinese)
[20] 王旭,颜其贵,陈玥,等.中国大鲵维氏气单胞菌病的组织病理学观察[J].中国兽医科学,2011,41(7):737-740.
WANG X,YAN Q G,CHEN Y,et al.Histopathological observation on Aeromonas veronii disease of Andrias davidianus[J].Chinese Veterinary Science,2011,41(7):737-740.(in Chinese)
[21] 杨移斌,夏永涛,邱军强,等.鲟源维氏气单胞菌分离鉴定及药敏特性研究[J].四川动物,2014,33(3):414-418.
YANG Y B,XIA Y T,QIU J Q,et al.Isolation, identification and drug densitivity of Aeromonas veronica from sturgeon [J].Sichuan Journal of Zoology,2014,33(3):414-418.(in Chinese)
[22] 刘亚,杨锐,陈叶雨,等.达氏鲟维氏气单胞菌的分离鉴定及病理组织学观察[J].南方农业学报,2018,49(6):1235-1241.
LIU Y,YANG R,CHEN Y,et al.Isolation,identification of Aeromonas veronii in Acipenser dabryanus and its histological observations [J].Journal of Southern Agriculture,2018,49(6):1235-1241.(in Chinese)
[23] 许政生,梁文浪,林伟强,等.加州鲈细菌性烂身病的治疗案例[J].海洋与渔业,2019(7):79.
XU Z S,LIANG W L,LIN W Q,et al.Treatment of bacterial rotting disease of Lateolabrax japonicus[J].Ocean and Fisheries,2019(7):79.