虹鳟Oncorhynchus mykiss是中国主要冷水鱼养殖品种,广泛分布在中国东北、西北、西南等冷水资源较发达的地区,在带动当地经济发展、促进渔民增收方面发挥了积极的作用。随着养殖规模的扩大、苗种的频繁流通,虹鳟病害频发,严重制约了冷水鱼养殖业的绿色健康发展。
传染性胰脏坏死病(infectious pancreatic necrosis,IPN)是一种全球流行性疾病,于20世纪50年代在美国开始流行[1],至今已传播到法国[2]、土耳其[3]、智利[4]、墨西哥[5]、芬兰[6]、挪威[7]、西班牙[8]、日本[9]、韩国[10]和伊朗[11]等国家,给鲑鳟鱼养殖业造成了较大的经济损失。该病是由传染性胰脏坏死病毒(infectious pancreatic necrosis virus,IPNV)引起的一种病毒性疾病,主要威胁鲑科鱼类。IPNV隶属于双RNA病毒科Birnavirdate水生双RNA病毒属Aquabirnavirus,其病毒粒子无囊膜包裹,呈二十面体。IPNV的基因组由A和B两条RNA组成。A链包含两个重叠的开放阅读框(open reading frame,ORF),其中较大的ORF编码外衣壳蛋白VP2、内衣壳蛋白VP3和蛋白酶VP4,小ORF编码非结构多肽VP5[12-13]。B链编码RNA依赖性RNA聚合酶VP1,用于转录和复制病毒基因组[14-15]。利用交叉中和测定法可将水生双RNA病毒分为A和B两个血清群(serogroup)[16],其中,血清群A包含9种血清型,即A1(West Buxton,WB)、A2(Spajarup,Sp)、A3(Abild,Ab)、A4(Hecht,He)、A5(Tellina,Te)、A6(Canada 1,C1)、A7(Canada 2,C2)、A8(Canada 3,C3)和A9(Jasper,Ja)[17],血清群B仅具有血清型B1。利用系统发育分析方法,可将水生双RNA病毒分为7个基因型,包括基因组Ⅰ~Ⅶ(genogroup Ⅰ~Ⅶ)。目前IPNV基因型主要分布在基因组Ⅰ~Ⅵ[18]。中国于20世纪80年代首次暴发IPN疫情。该病在中国已经流行了30余年,造成了巨大的经济损失,成为制约中国鲑鳟鱼产业发展的重要疫病之一。已知的中国境内分离的IPNV为基因组Ⅴ型和基因组Ⅰ型[19-23]。
2020年,中国西北某虹鳟养殖场幼鱼发生持续性死亡,死亡历程延续4个月之久,累计死亡率近20%。为探究造成虹鳟幼鱼死亡的病因,本研究团队开展了流行病学调查工作,本研究中对患病虹鳟进行了组织病理学观察,对病原进行分离鉴定,并进行了病毒分离株的系统发育分析、电镜观察及人工回归感染试验,以期为虹鳟养殖业中的疾病防控提供参考。
1 材料与方法
1.1 材料
大鳞大麻哈鱼胚胎细胞(chinook salmon embryo cells,CHSE-214)和胖头鱥上皮细胞(epithelioma papulosum cyprini, EPC)由中国水产科学研究院长江水产研究所鱼类病害教研室曾令兵研究员惠赠。PrimeScriptTM One Step RT-PCR Kit Ver.2试剂盒、Trizol试剂、DL2000 marker购自宝生物工程(大连)有限公司。胎牛血清(fetal bovine serum,FBS)、胰酶(体积分数0.25%的EDTA-Tyrisin)、M199培养基购自Gibco公司。健康虹鳟(平均体质量5 g)购自辽宁本溪艾格莫林实业有限公司。
1.2 方法
1.2.1 样本信息及组织病理学观察 本试验中共采集了3份患病虹鳟样品,分别取自发病养殖场的孵化车间(体质量3~5 g,命名为F1)及养殖区域的两个不同网箱(体质量20~30 g,分别命名为W1和W2)。分别取患病鱼的肝、脾及肾组织,使用波恩氏液进行固定。用石蜡包埋制作切片后进行H.E染色。采用中性树脂胶封片后,利用光学显微镜观察组织病理变化。
1.2.2 病毒的分离培养 取患病虹鳟的肝、脾、头肾组织混合匀浆,4 ℃下以12 000 r/min 离心5 min。用0.22 μm无菌过滤器对离心后的上清液进行无菌处理,然后用细胞维持液(含体积分数2%胎牛血清、100 IU/mL青霉素和链霉素的M199培养基)将无菌组织匀浆上清液稀释10倍接种于CHSE-214及EPC单层细胞,于15 ℃培养箱中吸附1 h后弃上清液,补加细胞维持液后置于15 ℃培养箱中培养。7 d内每天利用倒置显微镜观察细胞状态。若出现细胞病变(cytopathic effect,CPE),则待80%的细胞出现病变时,收获细胞培养物储存于-80 ℃超低温冰箱中;若未出现细胞病变,将细胞培养物进行盲传,如果7 d内观察到细胞病变则收获细胞培养液存于-80 ℃超低温冰箱中,若无细胞病变则判定该样本为目标病毒阴性。
1.2.3 病毒的RT-PCR鉴定 根据中华人民共和国国家标准传染性造血器官坏死病毒诊断规程(GB/T 15805.2—2017)[24]合成扩增传染性造血器官坏死病毒(infectious hematopoietic necrosis virus,IHNV)部分G基因的引物,其扩增片段大小为693 bp。根据文献[25]合成扩增IPNV部分VP2基因的引物,其扩增片段大小为584 bp。以Trizol试剂提取的上述细胞培养物总RNA为模板,使用One Step RT-PCR Kit,分别利用上述引物对细胞培养物进行鉴定。一步法RT-PCR扩增反应的步骤为:50 ℃反转录30 min;95 ℃下预变性4 min;95 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸60 s,共进行35个循环;最后在72 ℃下终延伸10 min。扩增产物用10 g/L琼脂糖凝胶电泳进行分析。阳性PCR样本由吉林省库美生物(中国长春)纯化并进行基因序列测定。利用National Center for Biotechnology Information(NCBI)中的BLAST对鉴定的基因序列进行比对分析。
1.2.4 IPNV系统发育分析 选用VP2基因序列,使用MEGA X软件中的最大似然法,采用自展值(bootstrap)为1 000[26],最佳核苷酸代替模型为GTR+G,对分离的IPNV毒株进行系统发育分析。利用Megalign软件计算本研究中分离的IPNV毒株与基因组Ⅰ~Ⅶ型水生双RNA病毒VP2基因序列的一致性。本研究中使用的参考毒株信息见表1。
表1 本研究所用的参考毒株
Tab.1 Reference virus strains used in this study
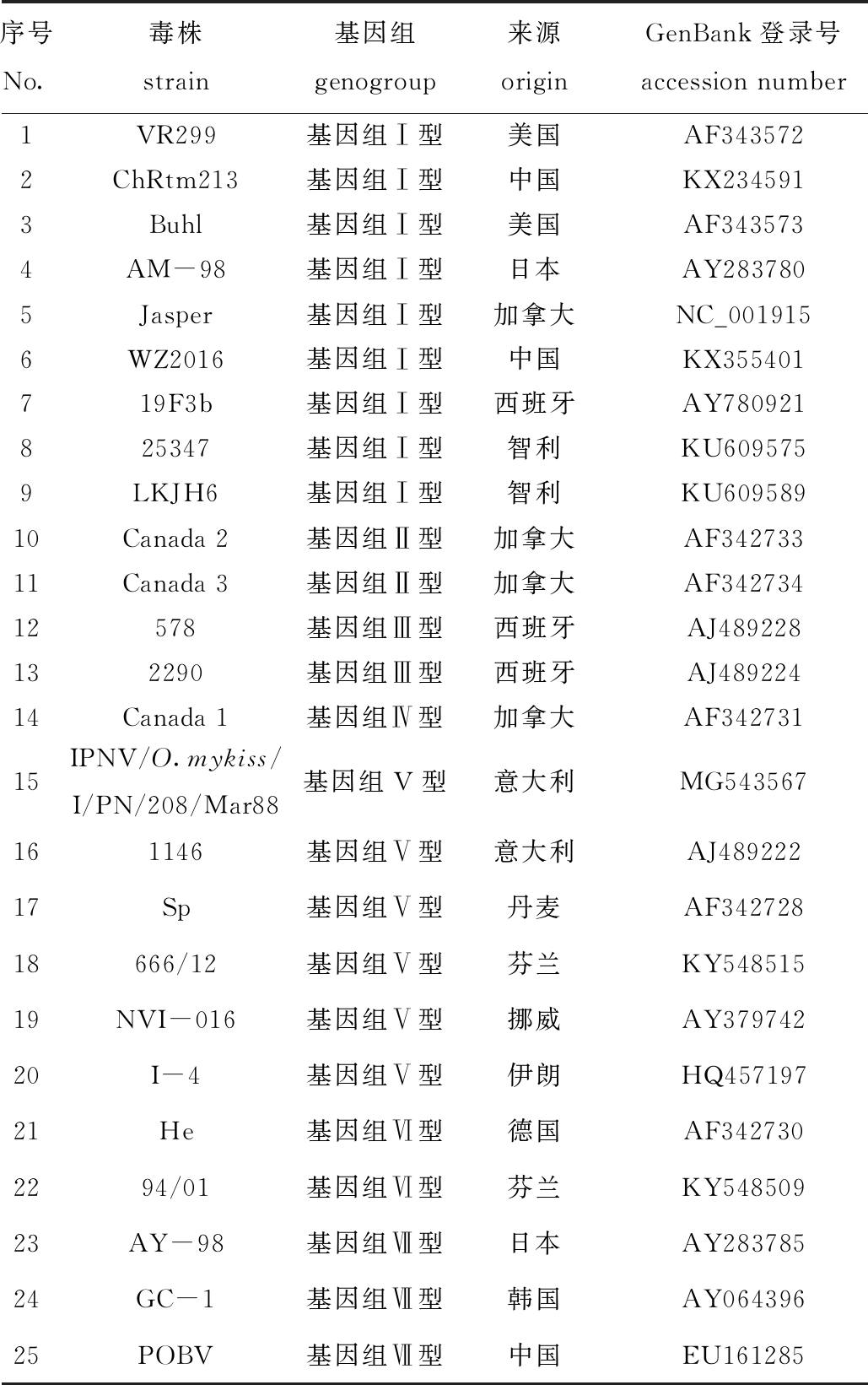
序号No.毒株strain基因组genogroup来源originGenBank登录号accession number1VR299基因组Ⅰ型美国AF3435722ChRtm213基因组Ⅰ型中国KX2345913Buhl基因组Ⅰ型美国AF3435734AM-98基因组Ⅰ型日本AY2837805Jasper基因组Ⅰ型加拿大NC_0019156WZ2016基因组Ⅰ型中国KX355401719F3b基因组Ⅰ型西班牙AY780921825347基因组Ⅰ型智利KU6095759LKJH6基因组Ⅰ型智利KU60958910Canada 2基因组Ⅱ型加拿大AF34273311Canada 3基因组Ⅱ型加拿大AF34273412578基因组Ⅲ型西班牙AJ489228132290基因组Ⅲ型西班牙AJ48922414Canada 1基因组Ⅳ型加拿大AF34273115IPNV/O.mykiss/I/PN/208/Mar88基因组V型意大利MG543567161146基因组Ⅴ型意大利AJ48922217Sp基因组Ⅴ型丹麦AF34272818666/12基因组Ⅴ型芬兰KY54851519NVI-016基因组Ⅴ型挪威AY37974220I-4基因组Ⅴ型伊朗HQ45719721He基因组Ⅵ型德国AF3427302294/01基因组Ⅵ型芬兰KY54850923AY-98基因组Ⅶ型日本AY28378524GC-1基因组Ⅶ型韩国AY06439625POBV基因组Ⅶ型中国EU161285
1.2.5 IPNV的电镜观察 收集出现细胞病变的CHSE-214细胞,用PBS磷酸缓冲溶液洗涤3次,用体积分数2.5%的戊二醛溶液在4 ℃下固定24 h。然后用体积分数1%的四氧化锇在25 ℃下固定70 min并使用乙醇溶液脱色。用丙酮冲洗细胞后,将其包埋在树脂中,用乙酸铀酰-柠檬酸铅染色,然后使用透射电子显微镜(Hitachi 7650,日本)对细胞内病毒粒子进行观察[27]。
1.2.6 IPNV滴度的测定 使用CHSE-214细胞对IPNV分离株的半数组织培养物感染剂量(tissue culture infective dose,TCID50)进行测定。具体方法如下:将CHSE-214细胞接种到96孔细胞培养板中,当细胞汇合成单层细胞,将体外传代3次的IPNV病毒悬液用细胞维持液进行10倍梯度稀释(10-1~10-8),接种于96孔细胞培养板,每个稀释度接8个孔,每孔接100 μL。同时设置只添加细胞维持夜的细胞作为阴性对照。将接种好的96孔细胞培养板置于15 ℃培养箱中培养7 d,对出现病变及未病变的细胞孔进行计数,并按Reed-Muench公式计算IPNV分离株的滴度。
1.2.7 人工回归感染试验 随机将虹鳟分为4组,每组30尾。攻毒组为健康虹鳟腹腔注射IPNV细胞培养物(0.1 mL/尾),对照组为健康虹鳟腹腔注射空白细胞培养物(0.1 mL/尾)。攻毒后将虹鳟置于15 ℃循环水族箱中隔离喂养,每天记录虹鳟的临床症状及死亡情况。分别在攻毒后的第30天和第60天,从每组取5尾鱼的肝、脾、头肾组织分别混合,按照每克组织加10 mL PBS溶液的比例进行匀浆,4 ℃下以12 000 r/min 离心10 min,组织匀浆上清用0.22 μm无菌滤膜过滤,进行10倍梯度稀释并接种于96孔细胞培养板,按“1.2.6节”中的方法测定IPNV在组织中的含量。
2 结果与分析
2.1 患病鱼临床症状及组织病理学观察
患病虹鳟表现为离群,上浮于水面,游动缓慢,出现眼球突出(图1A)、体色发黑(图1C)、腹部及脾脏肿大和肝脏苍白等症状(图1B)。组织病理学观察显示,患病鱼肝脾肾组织细胞广泛性坏死、空泡化、溶解,肾小球结构不完整,细胞溶解。

A~C—患病鱼临床症状;D—正常虹鳟的肝;E—正常虹鳟的脾;F—正常虹鳟的肾;G—患病虹鳟的肝;H—患病虹鳟的脾;I—患病虹鳟的肾。
A-C—clinical symptoms of sick rainbow trout; D—liver of normal rainbow trout; E—spleen of normal rainbow trout; F—kidney of normal rainbow trout; G—liver of diseased rainbow trout; H—spleen of diseased rainbow trout; I—kidney of diseased rainbow trout.
图1 患病虹鳟的组织病理切片
Fig.1 Histopathological lesion of diseased rainbow trout
2.2 病毒的细胞分离
取患病虹鳟的肝、脾、头肾组织制备匀浆后分别接种CHSE-214及EPC细胞,进行鲑鳟常见病毒分离。接种后48 h,各组CHSE-214细胞均出现明显病变,表现为细胞变薄、消融、出现圆形膜结构,而此时的EPC细胞则无任何病变;在接毒后72 h,各组CHSE-214细胞大面积崩解,脱落严重,80%以上的细胞出现崩解,接种W1和W2的EPC细胞开始变圆,部分脱落,而接种F1样品的EPC细胞盲传后仍无细胞病变(图2和图3);阴性对照CHSE-214和EPC细胞状态始终正常。

图2 接种IPNV后CHSE-214细胞的病变
Fig.2 Cytopathic effect of CHSE-214 cells post inoculation with IPNV

图3 接种IPNV后EPC细胞的病变
Fig.3 Cytopathic effect of CPC cells post inoculation with IPNV
2.3 病毒的RT-PCR鉴定
对出现细胞病变的细胞培养物(包括F1、W1和W2接种的CHSE-214细胞及W1和W2接种的EPC细胞)进行总RNA提取,利用IHNV和IPNV的鉴定引物进行一步法RT-PCR扩增。扩增产物经琼脂糖凝胶电泳分析显示,全部细胞培养物在IPNV鉴定中均获得了与目的条带大小相符的特异性条带(584 bp),而在IHNV鉴定中未观察到任何条带,阳性对照及阴性对照泳道均正常(图4)。测序结果显示,同一样品接种CHSE-214和EPC细胞分离获得的病毒株目的基因序列一致,而不同样品之间的目的基因序列不同。将扩增获得的基因序列在GenBank中进行BLAST比对,结果显示,上述基因序列与IPNV VP2基因的同源性最高,序列一致性高达99.81%~99.05%。将分离获得的病毒分别命名为IPNV-F1、IPNV-W1、IPNV-W2。
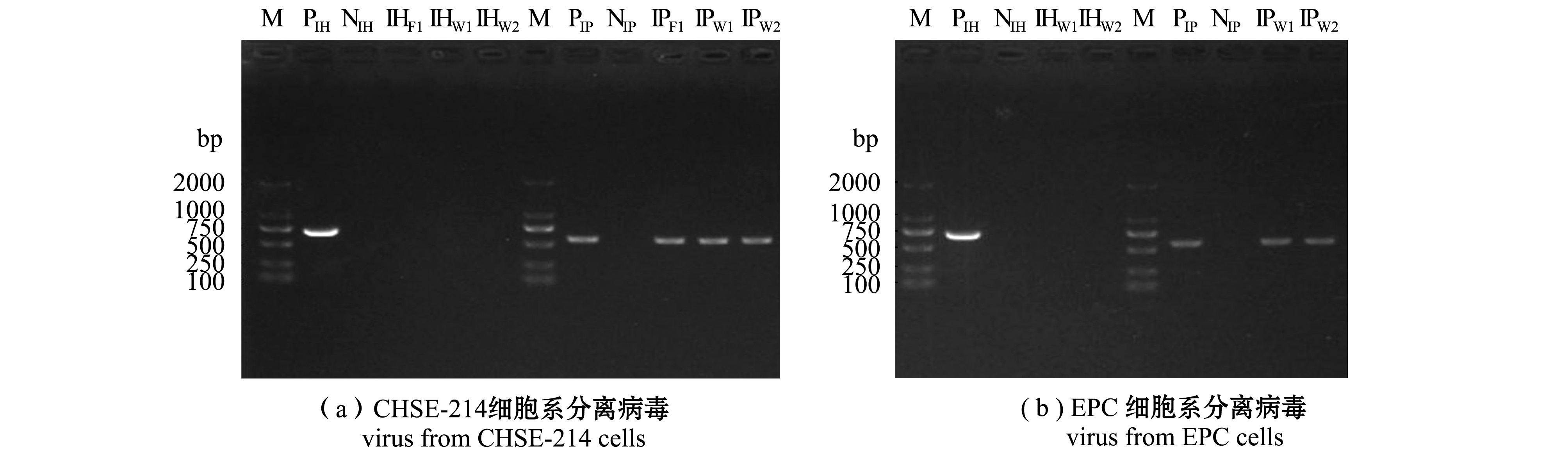
M—DL2000 DNA marker;P—阳性对照;N—阴性对照;IHF1、IHW1、IHW2—IHNV的鉴定;IPF1、IPW1、IPW2—IPNV的鉴定。
M—DL2000 DNA marker; P—positive control; N—negative control; IHF1, IHW1, IHW2—identification of IHNV; IPF1, IPW1, IPW2—identification of IPNV.
图4 CHSE-214和EPC细胞分离病毒的RT-PCR鉴定
Fig.4 RT-PCR identification of the isolated virus stains from CHSE-214 and EPC cells
2.4 系统发育分析
从GenBank中获取基因组Ⅰ~Ⅶ 型的水生双RNA病毒VP2基因序列,采用本研究中RT-PCR鉴定获得的IPNV VP2基因片段序列,对IPNV毒株进行系统发育分析。结果显示,本研究中分离的IPNV毒株分属两种不同的基因型,IPNV-F1和IPNV-W2属于基因组Ⅰ型,IPNV-W1属于基因组Ⅴ型;IPNV-F1和IPNV-W2分别与中国IPNV分离株WZ2016及ChRtm213具有最近的亲缘关系,VP2基因序列一致性分别为100%和98.5%;IPNV-W1与同属基因组Ⅴ型的意大利毒株IPNV/O.mykiss/I/PN/208/Mar88(MG543567)具有最近的亲缘关系,二者的VP2基因片段序列一致性为99.1%(图5)。
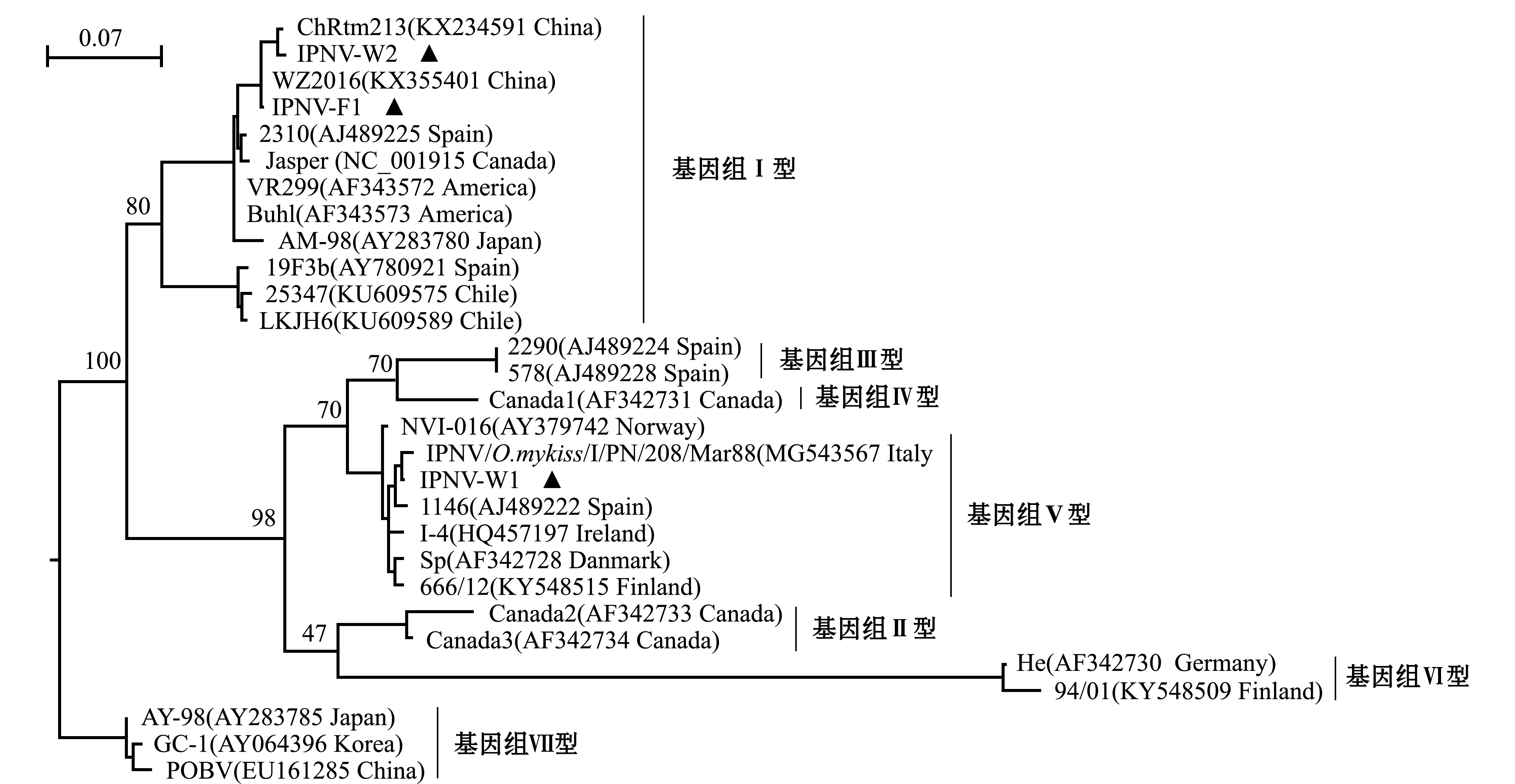
图5 基于VP2基因片段序列构建的水生双RNA病毒系统进化树
Fig.5 Phylogenetic tree of Aquabirnavirus based on VP2 gene fragment sequences
2.5 IPNV分离株的电镜观察
将IPNV分离株接种于CHSE-214细胞48 h后,制备超薄切片进行电镜观察。结果显示,在细胞质中观察到呈晶格状排列的无囊膜多面体IPNV病毒粒子,符合IPNV病毒粒子胞内排列特点(图6)。
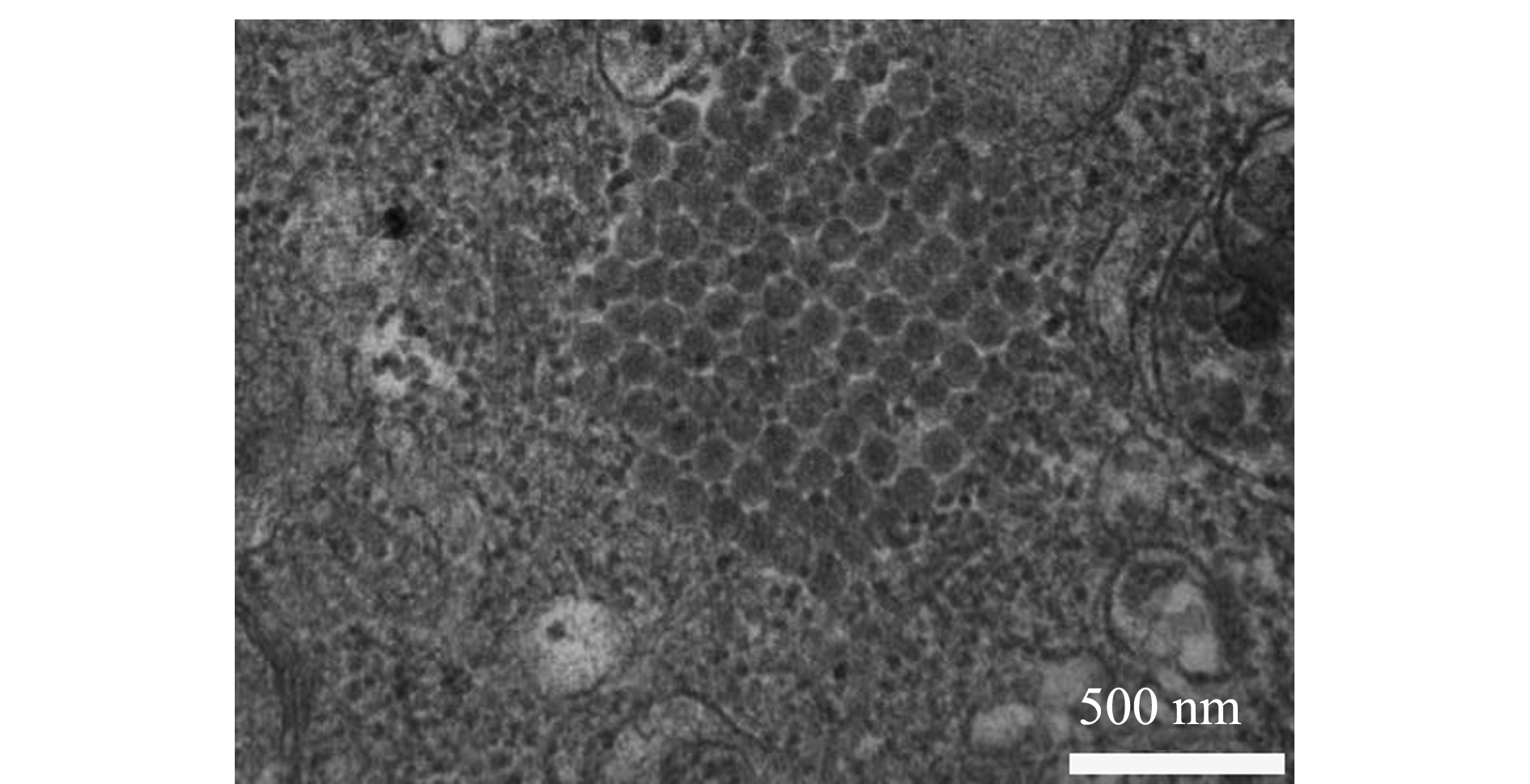
图6 IPNV分离株的电镜观察
Fig.6 Electron microscopy observation of isolated IPNV
2.6 IPNV分离株滴度的测定
将IPNV病毒悬液以10倍梯度稀释后接种于96孔细胞培养板,于15 ℃ CO2培养箱培养7 d后,记录病变及未病变细胞孔的数目,按照Reed Muench公式,计算出3株IPNV分离株的平均滴度分别为107.43 TCID50/0.1 mL(IPNV-F1)、107.30 TCID50/0.1 mL(IPNV-W1)和107.29 TCID50/0.1 mL(IPNV-W2)。
2.7 人工回归感染试验
将3株IPNV分离株分别以0.1 mL/尾的剂量腹腔注射健康虹鳟,观察到虹鳟体色发黑、眼球突出、拖管状透明粪便等临床症状,但是攻毒后60 d内未观察到虹鳟鱼死亡。对攻毒虹鳟肝、脾、肾组织内IPNV含量的测定发现,随着时间的延长,虹鳟组织中的病毒滴度逐渐下降,在攻毒后30 d,IPNV在虹鳟肝脾肾组织的平均滴度分别为104.50 TCID50/0.1 g组织(IPNV-F1)、105.38 TCID50/0.1 g组织(IPNV-W1)及104.13 TCID50/0.1 g组织(IPNV-W2),而在攻毒后60 d,IPNV在虹鳟组织中的平均滴度逐步下降为103.43 TCID50/0.1 g组织(IPNV-F1)、104.50 TCID50/0.1 g组织(IPNV-W1)及103.21 TCID50/0.1 g组织(IPNV-W2)。
3 讨论
3.1 中国养殖虹鳟病毒的流行病学调查
IHNV和IPNV是危害虹鳟的两种主要病毒,中国学者于20世纪80年代在国内养殖场便分离到了这两种病毒。目前,这两种病毒仍然是中国鲑鳟养殖环境最主要的病毒,并且自然条件下虹鳟能够共感染这两种病毒[28]。IHNV感染及IPNV感染均可导致虹鳟游动迟缓、离群,体色发黑、眼球突出,粪便呈管状透明白色等症状。本研究中采集的虹鳟样本临床症状与上述症状相符。综合以上因素,本研究中针对这两种病毒开展了分离鉴定工作,利用国家标准推荐的细胞系进行了病毒的分离,结果从该发病养殖场成功分离出IPNV毒株。本实验室人员此前曾从该养殖场网箱养殖虹鳟中分离出IHNV毒株,并且此次检测时该养殖场环境条件也符合IHNV发病条件,但是并未在患病鱼体内检测到IHNV,只检测到了IPNV。曾有学者发现,虹鳟共感染IPNV和IHNV时,IPNV对IHNV具有抑制作用[29]。本研究中未检测到IHNV可能与该抑制作用有关,但是有待进一步流行病学调查研究验证。本实验室曾检出过IHNV/IPNV共感染病例[30],当时共感染病例在一个月内累计死亡率高达80%以上。本次发病虹鳟4个月内累计死亡率仅为20%,远远低于已报道的IHNV感染病例或者IHNV/IPNV共感染病例。根据毒株、宿主种类及大小、环境因素的差异,IPNV感染可导致虹鳟截然不同的死亡率,因此,应进一步加强传染性胰脏坏死病的流行病学研究深度与广度,充分掌握其病原学数据,为传染性胰脏坏死病的科学防控提供参考。
3.2 中国IPNV毒株的基因型与血清型
VP2是IPNV病毒的主要结构蛋白,其上有中和抗体表位,能诱发宿主机体产生抗体免疫反应[31],根据该基因的不同,可将水生双RNA病毒分为7个基因型[18]。这7个基因型一共包含10种血清型。中国最初分离到的IPNV均为SP血清型[21-23]、基因组Ⅴ型,近年有报道称在国内虹鳟养殖场分离到了基因组Ⅰ型的IPNV[19-20]。本研究中,在同一养殖场同时获得了这两种基因型的IPNV毒株,进一步证明了相同的养殖环境可同时存在这两种基因型的IPNV。由于缺乏标准中和抗体,未对本研究中分离的IPNV毒株进行中和抗体试验,因此,其血清型仍然未知。本研究中所分离的IPNV-F1和IPNV-W2属于基因组Ⅰ型,其中IPNV-F1与中国IPNV分离株ChRtm213(云南省)同源性最高,IPNV-W2与中国IPNV分离株WZ2016(四川省)同源性最高,这两株IPNV与日本的AM-98(AY283780)具有较高的同源性。而IPNV-W1则属于基因组Ⅴ型,由于目前GenBank数据库中未收录中国基因组Ⅴ型IPNV毒株VP2基因序列,因此,无法得知该分离株与国内其他基因组Ⅴ型IPNV毒株的同源性,但是经过分析发现,该毒株与意大利毒株IPNV/O.mykiss/I/PN/208/Mar88同源性最高。同源性的高低一定程度上反映病毒进化来源关系,同源性越高表明来源自同一原始毒株的可能性越大。因此,中国IPNV毒株很可能与日本及意大利毒株来源于相同的原始祖先。由于IPNV能以水平传播的方式感染宿主,养殖场在引进种苗的过程中应加强对IPNV的监控力度,避免携带IPNV鱼苗的流通。
3.3 IPNV分离株的毒力特性
本研究中,利用CHSE-214及EPC细胞对组织病料进行病毒分离培养,结果发现,获得的IPNV分离株均能在CHSE-214细胞上生长并产生典型细胞病变,其中2株IPNV毒株可以在EPC细胞上生长并产生细胞病变。但是IPNV在EPC细胞上出现细胞病变所需时间较在CHSE-214细胞上出现细胞病变的时间长。该结果表明,CHSE-214更适合用作IPNV分离的敏感细胞系。因此,本研究中利用CHSE-214细胞对所获得IPNV分离株进行了滴度测定,结果发现,这3株IPNV分离株的细胞毒力无显著差异,均可达107 TCID50/0.1 mL。尽管各IPNV分离株在CHSE-214细胞上具有较高的滴度,采用0.1 mL/尾病毒原液的剂量对虹鳟进行人工回归感染试验,但仍未能造成虹鳟死亡。此前,有学者发现[32],对虹鳟进行攻毒,其死亡率较低且临床症状不明显。Bruslind等[33]的研究结果也发现,强毒株IPNV易感染鱼苗但未表现出临床症状,并且病毒在宿主中复制的能力与其对鱼的致死能力无关。由此可知,尽管自然暴发传染性胰脏坏死病会造成虹鳟大规模死亡,但是IPNV攻毒模型的建立仍然存在困难,因此,多数学者均采用测定试验动物体内病毒载量来对传染性胰脏坏死病疫苗效果进行评价[34]。但是该方法存在一定的局限性,无法直接反映疫苗的保护率。因此,今后应针对IPNV开展更深入的基础研究,为传染性胰腺坏死病的科学防控提供指导。
4 结论
1) 本研究首次从同一养殖场患病虹鳟体内分离到基因组Ⅰ型(命名为IPNV-W2和IPNV-F1)和基因组Ⅴ型(命名为IPNV-W1)的IPNV毒株,其中,IPNV-W2和IPNV-F1分别与中国IPNV分离株WZ2016(KX355401)和ChRtm213(KX234591)同源性最高,IPNV-W1与意大利的IPNV分离株同源性最高。
2) 尽管本研究中分离的IPNV毒株在CHSE-214细胞上具有较高的滴度,也能很好地在虹鳟体内繁殖,但人工回归感染并未造成虹鳟死亡。
[1] WOOD E M,SNIESZKO S F,YASUTAKE W T.Infectious pancreatic necrosis in brook trout[J].A.M.A.Archives of Pathology,1955,60(1):26-28.
[2] BLAKE S,MA J Y,CAPORALE D A,et al.Phylogenetic relationships of aquatic birnaviruses based on deduced amino acid sequences of genome segment A cDNA[J].Diseases of Aquatic Organisms,2001,45(2):89-102.
[3] BÜYÜKEKIZ A G,ALTUN S,HANSEN E F,et al.Infectious pancreatic necrosis virus (IPNV) serotype Sp is prevalent in Turkish rainbow trout farms[J].Journal of Fish Diseases,2017,41(1):95-104.
[4] JORQUERA E,MORALES P,TAPIA D,et al.Chilean IPNV isolates:robustness analysis of PCR detection[J].Electronic Journal of Biotechnology,2016,20:28-32.
[5] SALGADO-MIRANDA C,ROJAS-ANAYA E,GARC A-ESPINOSA G,et al.Virulence of infectious pancreatic necrosis virus (IPNV) isolates from Mexico[J].The Journal of Veterinary Medical Science,2020,82(3):394-398.
A-ESPINOSA G,et al.Virulence of infectious pancreatic necrosis virus (IPNV) isolates from Mexico[J].The Journal of Veterinary Medical Science,2020,82(3):394-398.
[6] ERIKSSON-KALLIO A M,HOLOPAINEN R,VILJAMAA-DIRKS S,et al.Infectious pancreatic necrosis virus (IPNV) strain with genetic properties associated with low pathogenicity at Finnish fish farms[J].Diseases of Aquatic Organisms,2016,118(1):21-30.
[7] SHIVAPPA R B,SONG H,YAO K,et al.Molecular characterization of Sp serotype strains of infectious pancreatic necrosis virus exhibiting differences in virulence[J].Diseases of Aquatic Organisms,2004,61(1/2):23-32.
[8] CUTR N J M,BARJA J L,NICHOLSON B L,et al.Restriction fragment length polymorphisms and sequence analysis:an approach for genotyping infectious pancreatic necrosis virus reference strains and other aquabirnaviruses isolated from northwestern Spain[J].Applied and Environmental Microbiology,2004,70(2):1059-1067.
N J M,BARJA J L,NICHOLSON B L,et al.Restriction fragment length polymorphisms and sequence analysis:an approach for genotyping infectious pancreatic necrosis virus reference strains and other aquabirnaviruses isolated from northwestern Spain[J].Applied and Environmental Microbiology,2004,70(2):1059-1067.
[9] NISHIZAWA T,KINOSHITA S,YOSHIMIZU M.An approach for genogrouping of Japanese isolates of aquabirnaviruses in a new genogroup,VII,based on the VP2/NS junction region[J].Journal of General Virology,2005,86(7):1973-1978.
[10] LEE H H,CHUNG H K,LEE S H.Nucleotide sequence analysis of the RNA-dependent RNA polymerase gene of infectious pancreatic necrosis virus DRT strain[J].Journal of Microbiology and Biotechnology,1994,4(4):264-269.
[11] SOLTANI M,ROUHOLAHI S,MOUSAVI H A E,et al.Genetic diversity of infectious pancreatic necrosis virus (IPNV) in farmed rainbow trout (Oncorhynchus mykiss) in Iran[J].Bulletin-European Association of Fish Pathologists,2014,34(5):155-164.
[12] DUNCAN R,NAGY E,KRELL P J,et al.Synthesis of the infectious pancreatic necrosis virus polyprotein,detection of a virus-encoded protease,and fine structure mapping of genome segment A coding regions[J].Journal of Virology,1987,61(12):3655-3664.
[13] HUANG M T,MANNING D S,WARNER M,et al.A physical map of the viral genome for infectious pancreatic necrosis virus Sp:analysis of cell-free translation products derived from viral cDNA clones[J].Journal of Virology,1986,60(3):1002-1011.
[14] DOBOS P.Protein-primed RNA synthesis in vitro by the virion-associated RNA polymerase of infectious pancreatic necrosis virus[J].Virology,1995,208(1):19-25.
[15] DUNCAN R,MASON C L,NAGY E,et al.Sequence analysis of infectious pancreatic necrosis virus genome segment B and its encoded VP1 protein:a putative RNA-dependent RNA polymerase lacking the Gly-Asp-Asp motif[J].Virology,1991,181(2):541-552.
[16] HILL B J,WAY K.Serological classification of infectious pancreatic necrosis (IPN) virus and other aquatic birnaviruses[J].Annual Review of Fish Diseases,1995,5:55-77.
[17] BAIN N,GREGORY A,RAYNARD R S.Genetic analysis of infectious pancreatic necrosis virus from Scotland[J].Journal of Fish Diseases,2008,31(1):37-47.
[18] PANZARIN V,HOLMES E C,ABBADI M,et al.Low evolutionary rate of infectious pancreatic necrosis virus (IPNV) in Italy is associated with reduced virulence in trout[J].Virus Evolution,2018,4(2):vey019.
[19] JI F,ZHAO J Z,LIU M,et al.Complete genomic sequence of an infectious pancreatic necrosis virus isolated from rainbow trout (Oncorhynchus mykiss) in China[J].Virus Genes,2017,53(2):215-225.
[20] 熊权鑫,朱玲,汪开毓,等.一株虹鳟源传染性胰腺坏死病病毒的分离与鉴定[J].水产学报,2018,42(7):1132-1139.
XIONG Q X,ZHU L,WANG K Y,et al.Isolation and identification of infectious pancreatic necrosis virus from rainbow trout (Oncorhynchus mykiss)[J].Journal of Fisheries of China,2018,42(7):1132-1139.(in Chinese)
[21] 江育林,徐佰亥,李伟,等.虹鳟传染性胰脏坏死病病毒(IPNV)的初步研究[J].水生生物学报,1989,13(4):353-358.
JIANG Y L,XU B H,LI W,et al.Isolation and identification of infectious pancreatic necrosis virus (IPNV) from imported rainbow trout (Salmo gairdneri) in P.R.China[J].Acta Hydrobiologica Sinica,1989,13(4):353-358.(in Chinese)
[22] 刘兴发,杨继林,钟志宏,等.虹鳟鱼传染性胰腺坏死及其综合防治[J].中国动物检疫,1997,14(1):19-21.
LIU X F,YANG J L,ZHONG Z H,et al.The pathogeny and comprehensive prevention and control of infectious pancreatic necrosis of rainbow trout[J].China Animal Health Inspection,1997,14(1):19-21.(in Chinese)
[23] 陈文义,孙颖杰,夏德昌,等.虹鳟鱼传染性胰脏坏死病的诊断[J].动物检疫,1992,9(4):17-18.
CHEN W Y,SUN Y J,XIA D C,et al.Isolation and identification of infectious pancreatic necrosis virus from rainbow trout[J].China Animal Health Inspection,1992,9(4):17-18.(in Chinese)
[24] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15805.2-2017 传染性造血器官坏死病诊断规程[S].北京:中国标准出版社,2017.
General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,Standardization and Administration.GB/T 15805.2-2017 Diagnosis of infectious haematopoietic necrosis[S].Beijing:Standards Press of China,2017.(in Chinese)
[25] 刘淼,徐黎明,赵景壮,等.虹鳟传染性胰脏坏死病毒的分离鉴定及聚类分析[J].大连海洋大学学报,2017,32(1):56-61.
LIU M,XU L M,ZHAO J Z,et al.Isolation, identification and cluster analysis of an infectious pancreatic necrosis virus[J].Journal of Dalian Ocean University,2017,32(1):56-61.(in Chinese)
[26] KUMAR S,STECHER G,TAMURA K.MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J].Molecular Biology and Evolution,2016,33(7):1870-1874.
[27] DONG Y,ZHAO J Z,CHEN X Y,et al.Autophagy induced by infectious pancreatic necrosis virus promotes its multiplication in the Chinook salmon embryo cell line CHSE-214[J].Fish & Shellfish Immunology,2020,97:375-381.
[28] ZHAO J Z,XU L M,LIU M,et al.Autophagy induced by infectious hematopoietic necrosis virus inhibits intracellular viral replication and extracellular viral yields in epithelioma Papulosum cyprini cell line[J].Developmental & Comparative Immunology,2017,77:88-94.
[29] BYRNE N,CASTRIC J,LAMOUR F,et al.Study of the viral interference between infectious pancreatic necrosis virus (IPNV) and infectious haematopoietic necrosis virus (IHNV) in rainbow trout (Oncorhynchus mykiss)[J].Fish & Shellfish Immunology,2008,24(5):489-497.
[30] XU L M,ZHAO J Z,REN G M,et al.Co-infection of infectious hematopoietic necrosis virus (IHNV) and infectious pancreatic necrosis virus (IPNV) caused high mortality in farmed rainbow trout (Oncorhynchus mykiss) in China[J].Aquaculture,2019,512:734286.
[31] 赵景壮,贺文斌,徐黎明,等.虹鳟IPNV分离株VP2蛋白的表达及免疫原性检测[J].大连海洋大学学报,2019,34(2):179-185.
ZHAO J Z,HE W B,XU L M,et al.Expression and immunogenicity analysis of VP2 protein of a Chinese infectious pancreatic necrosis virus from diseased rainbow trout Oncorhynchus mykiss[J].Journal of Dalian Ocean University,2019,34(2):179-185.(in Chinese)
[32] TAPIA D,BARR A A,KUZNAR J,et al.Comparison of mortality and viral load in rainbow trout (Oncorhynchus mykiss) infected with infectious pancreatic necrosis virus (IPNV) genogroups 1 and 5[J].Journal of Fish Diseases,2020,43(1):139-146.
A A,KUZNAR J,et al.Comparison of mortality and viral load in rainbow trout (Oncorhynchus mykiss) infected with infectious pancreatic necrosis virus (IPNV) genogroups 1 and 5[J].Journal of Fish Diseases,2020,43(1):139-146.
[33] BRUSLIND L D,RENO P W.Virulence comparison of three Buhl-subtype isolates of infectious pancreatic necrosis virus in brook trout fry[J].Journal of Aquatic Animal Health,2000,12(4):301-315.
[34] XU L M,ZHAO J Z,LIU M,et al.Bivalent DNA vaccine induces significant immune responses against infectious hematopoietic necrosis virus and infectious pancreatic necrosis virus in rainbow trout[J].Scientific Reports,2017,7(1):5700.