高血糖激素家族(CHH家族),又称为CHH/MIH/GIH肽家族,是X器官-窦腺(X organ-sinus gland,XO-SG)中最丰富的一类肽激素,具有热稳定性,在调节血糖水平及调控生殖、发育和蜕皮等生理活动中起着关键作用[1]。性腺抑制激素(gonad-inhibiting hormone,GIH)又称为卵黄生成抑制激素(vitellogenesis-inhibiting hormone, VIH),是CHH家族中重要的一员,属于Ⅱ型肽激素,由72~87个氨基酸构成,具有酸性等电点、热稳定性等特点,相对分子质量为3 000~11 000[2-3]。该激素由眼柄中X器官的神经分泌细胞分泌,经轴突神经束运送到窦腺暂时储存,之后进入血液循环,最终作用在肝胰腺、卵巢、大颚器和雄性的促雄性腺等组织。其既无种类特异性,也无性别特异性,具有抑制卵巢发育、雄性精巢发育与交配行为、大颚器官合成甲基法尼脂(MF,保幼激素类似物)及肝胰腺合成卵黄蛋白等作用[2]。目前,关于GIH基因在斑节对虾Penaeus monodon、日本沼虾Macrobrachium nipponensis、挪威海螯虾Nephrops norvegicus、欧洲螯龙虾Homarus gammarus等甲壳动物中的研究已经取得了不少进展。此外,有关光周期对龙虾性腺发育的影响也有一些报道,如Sachlikidis等[4]研究发现,锦绣龙虾Panulirus ornatus在夏季自然光周期条件下比冬季抱卵个数多,研究者认为光周期是龙虾性腺成熟和交配活动开始的主要因素。然而,有关波纹龙虾的相关研究报道则较少。
波纹龙虾Panulirus homarus隶属于十足目Decapoda腹胚亚目Pleocyemata龙虾科Palinuroidea龙虾属Panulirus,是中国东南沿海的地方经济种类[5-6],是中国两大主要龙虾养殖品种之一,同时也是世界龙虾养殖的主要品种。波纹龙虾具有生长快、个体大、抗病力强、经济价值高等优点[5]。目前,中国海区龙虾资源缺乏,超过80%的龙虾需要从国外进口。虽然各地水产部门对开展龙虾人工养殖高度重视,但以捕捞天然龙虾苗种进行人工养殖的模式已无法满足市场的长期需求[6-7]。因此,开展龙虾人工繁殖研究势在必行。目前,有关龙虾繁殖研究主要集中在营养[8] 、内分泌[9]和生态环境[10-11]等领域,对其分子生物学方面的研究较少。本研究中,利用cDNA末端快速扩增技术(rapid amplification of cDNA ends,RACE),基于广东海洋大学甲壳动物实验室提供的波纹龙虾眼柄转录组筛选克隆得到了PhGIH基因的全长cDNA序列,并进行了生物信息学分析,采用实时荧光定量PCR(quantitative real-time PCR,qPCR)方法检测了该基因在波纹龙虾不同卵巢时期和不同组织的表达情况,并通过为期92 d的光周期试验,研究了不同光周期对波纹龙虾卵巢发育的影响,利用qPCR检测眼柄PhGIH基因的表达情况,以期为该基因参与波纹龙虾性腺发育调控机制研究提供基础数据,同时也为龙虾的人工繁殖和甲壳动物CHH家族的研究提供新的材料。
1 材料与方法
1.1 材料
试验用波纹龙虾捕自中国海南省琼海市南海海区。选取体格均一、附肢完整、健康鲜活的波纹龙虾,在广东海洋大学东海岛生物研究基地暂养一段时间后用于试验。于2019年8月2日选取增殖期、发育期和成熟期3个不同卵巢发育时期的波纹龙虾在广东海洋大学甲壳动物实验室进行GIH基因(记为PhGIH)的克隆和时空表达分析。其中,波纹龙虾卵巢的发育阶段通过其卵巢色、形态、性腺发育指数(gonadosomatic index,GSI)和组织学特性[12-13]进行分期。
于2020年6月8日选取卵巢发育时期为增殖期、平均体质量为123.5 g 的波纹龙虾在广东海洋大学东海岛生物研究基地进行光周期试验。试验期间,波纹龙虾投喂近江牡蛎Crassostrea rivulari和波纹巴非蛤Paphia undulate。
基因克隆及组织表达试验选取眼柄、心脏、脑、肝胰腺、卵巢、肠、鳃等组织样品;光周期响应试验选取眼柄组织用于基因检测,卵巢组织经体积分数4%的多聚甲醛固定后用于石蜡组织切片观察。将波纹龙虾解剖后,用于基因克隆及检测的组织样品装入有RNA later试剂(Thermo Scientific)的冻存管中,之后放置于4 ℃过夜,再转移至-80 ℃下保存备用。
主要试剂盒:SanPrep柱式DNA胶回收试剂盒,购自生工生物工程(上海)股份有限公司;反转录试剂盒(EasyScript One-Step gDNA Removal and cDNA Synthesis Super Mix)、实时荧光定量试剂盒(PerfectStart Green qPCR SuperMix)、TransZol Up Plus RNA Kit和DH5α感受态细胞,均购自北京全式金生物技术有限公司;pMD-19T载体试剂盒和SMARTer® RACE试剂盒,购自TaKaRa公司。
1.2 方法
1.2.1 引物设计 应用Primer 5.0软件,根据波纹龙虾眼柄转录组筛选得到的一条与短沟对虾Penaeus semisulcatus GIH基因高度同源的1 182 bp的EST序列,设计该基因片段序列克隆引物和RACE特异性引物。根据PhGIH开放阅读框(open reading frame, ORF)片段和眼斑龙虾β-actin序列(GenBank登录号:GQ865599.1)设计实时荧光定量PCR(qPCR)引物。所有引物由生工生物工程(上海)股份有限公司合成,各引物及其序列如表1所示。
表1 试验用引物及序列
Tab.1 Primer and sequences used in the experiment

引物primer序列(5'-3')sequence(5'-3')用途functionGIH-FGGCGACACCCCCTTGCCTGATGIH-RGTCCCCAAGGTTTCAGCCTACTCC片段序列GIH-5'-outerATCGTGGATGCGGATGTCAGGAGIH-5'-innerGTGTCGCTGGTCAACTTCCTTCG5' RACEGIH-3'-outerGCCCATGATCTAACAACCATCAGGTGIH-3'-innerGCCCATAAACCATGCCAGATAACAG3' RACEGIH-qPCR-FACAATTACTTCTTCGTGTGCCTGIH-qPCR-RACCATCGTCCAGCGTTTAGqPCRβ-actin-FCCATCCAGGCTGTGCTCTCTβ-actin-RGCGGTGGTTGTTGAAGGTGqPCRM13-FCGCCAGGGTTTTCCCAGTCACGACM13-RAGCGGATAACAATTTCACACAGGA菌液PCR检测
1.2.2 总RNA提取及cDNA的制备 采用TransZol Up Plus RNA Kit提取上述样品的总RNA,用10 g/L琼脂糖凝胶电泳检测其完整性,经Nanodrop 2000超微量核酸测定仪(Thermo Scientific)检测其浓度和纯度。将上述样品所得总RNA按照反转录试剂盒说明书进行反转录,所得cDNA用于后续的qPCR模板,于-20 ℃保存备用。
将眼柄总RNA分别按照反转录试剂盒与SMARTer®RACE试剂盒说明书制备得到用于片段序列克隆的模板cDNA和RACE的模板cDNA。
1.2.3 PhGIH基因的全长cDNA克隆 将用于片段序列克隆的眼柄cDNA作为模板,利用引物GIH-F/R(表1)进行PCR技术扩增,得到包含该基因ORF的中间片段序列。以该中间片段序列为模板,设计5′RACE和3′RACE的特异性引物和巢式引物。将用于RACE的眼柄cDNA作为模板,通过RACE技术和巢式PCR技术扩增目的基因的3′末端。第一轮PCR引物使用GIH-3′-outer(表1)和接头通用引物UPM。反应条件:98 ℃下循环变性10 s,59.1 ℃下退火复性5 s,72 ℃下延伸5 s,共进行30个循环;72 ℃下再延伸5 min。取PCR产物0.5 μL进行巢式PCR,引物使用GIH-3′-inner(表1)和接头通用引物NUP。反应条件:95 ℃下预变性5 min;95 ℃下循环变性30 s,58.3 ℃下退火复性30 s,72 ℃下延伸1 min,共进行30个循环;72 ℃下再延伸10 min。目的基因的5′末端扩增与上述方法一致。
用10 g/L琼脂糖凝胶电泳检测巢式PCR扩增产物。切胶回收目的条带后与pMD-19T载体4 ℃下连接过夜,然后转化至DH5α大肠杆菌感受态细胞中,将转化后的菌液均匀涂布于含氨苄的固体培养基上,并倒置于37 ℃培养箱中培育12 h。之后筛选阳性克隆送生工生物工程(上海)股份有限公司进行测序。
1.2.4 PhGIH序列分析及系统进化树的构建
利用DNAMAN软件对测序结果序列进行拼接,获得PhGIH基因的全长cDNA序列。通过NCBI网站查找ORF序列,将预测的氨基酸序列与蛋白质数据库进行相似性比对分析;利用ExPASy ProtParam(https://web.expasy.org/protparam/)和ExPASy ProtScale(https://web.expasy.org/protscale/)预测蛋白质的理化性质和亲水性;利用PSORT Ⅱ Prediction(http://psort.hgc.jp/form2.html)预测亚细胞定位;利用SignalP 5.0 软件Server(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;利用TMHMM Server 2.0软件(http://www.cbs.dtu.dk/services/TMHMM)进行跨膜结构域分析;利用SMART 4.0软件(http://smart.embl-heidelberg.de/)进行蛋白质结构域分析;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)进行二级结构分析;利用SWISS-MOLDEL(http://www.swissmodel. expasy.org/)预测三级结构;运用ClustalX 1.83和ClustalW 2.1软件进行多重序列比对;使用MEGA 5.0软件,基于N-J(Neighbor-joining)法采用Bootstrap method重复计算1 000次构建系统进化树。
1.2.5 PhGIH基因在波纹龙虾中的时空表达分析根据克隆得到的PhGIH ORF序列设计其特异性qPCR引物GIH-qPCR-F/R和内参基因β-actin引物β-actin-F/R(表1)。在Roche light CyclerTM 96 实时荧光定量 PCR 仪(Roche)上进行 qPCR 分析,检测GIH在波纹龙虾不同卵巢发育时期、不同组织中的表达情况。以获得的波纹龙虾各组织样品cDNA作为qPCR模板,参照实时荧光定量试剂盒说明书进行PCR。qPCR反应体系(10 μL):上、下游引物各0.4 μL,Nuclease-free water 3.7 μL,cDNA模板0.5 μL,2×PerfectStartTM Green qPCR SuperMix 5 μL。反应程序:95 ℃下预变性30 s;95 ℃下循环变性5 s,60 ℃下退火复性15 s,72 ℃下延伸10 s,共进行40个循环。
1.2.6 光周期对波纹龙虾性腺发育和PhGIH基因表达的影响 波纹龙虾在南海中国近海繁殖期为4—9月[12],期间光周期变化为12L∶12D~13.25L∶10.75D。根据Matsuda等[10]研究发现,日本龙虾Panulirus japonicus在14L∶10D时卵巢发育速度最快,因此,结合中国本土光周期变化情况设置3个光周期试验组,分别为12L∶12D、13L∶11D和14L∶10D。以80 W节能灯作为发光源,通过数位式照度计(TES-1330A)检测水面的光照度为3 350 lx。用黑色遮阳布隔绝外界阳光的干扰,通过电源计时器控制开关灯时间,3个光周期试验组均从每日6:00开始光照。
选取23尾雌虾和6尾雄虾进行试验,试验期间水温为29~32 ℃,盐度为30。2020年6月8日,试验开始前随机抽取5尾雌虾解剖观察其卵巢发育情况,再将剩余雌虾随机分到3个试验组中。Matsuda等[10]试验证明,当日本龙虾雌雄比例为10∶3时,所有的雌虾均能成功产卵,因此,以6尾雌虾和2尾雄虾为一组,分别置于3个水深为0.5 m、体积为1 m3的无毒聚乙烯塑料桶中,每个桶均放置人工掩体。试验过程中记录龙虾的蜕壳、体质量、头胸甲长等变化情况。试验开始后分别在27、92 d时进行取样,记录头胸甲长、蜕壳时期、卵巢与输卵管的质量、颜色与形态,取少量卵巢进行石蜡组织切片,取眼柄进行qPCR分析,其分析方法与“1.2.5节”方法一致。
1.2.7 指标的测定与计算 光周期试验中,在解剖龙虾前通过游标卡尺记录其头胸甲长,切除卵巢和输卵管后在精密电子天平测量其湿质量。性腺发育指数(GSI)计算公式为
GSI=m ×105/L3。
其中:m为卵巢湿质量(g);L为头胸甲长度(mm)。
实时荧光定量PCR数据运用2-△△Ct法计算PhGIH的相对表达量。每个样品进行3次重复。
1.3 数据处理
采用 SPSS 23统计软件进行单因素方差分析(One-way ANOVA),采用新复极差法(SSR)进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 PhGIH基因的克隆及全长cDNA序列分析
利用RACE技术克隆得到的PhGIH基因(GenBank登录号:MN864537)cDNA序列全长为1 206 bp(图1),包含223 bp 的5′-UTR和629 bp 的3′-UTR,ORF长度为354 bp,可编码117个氨基酸。预测该蛋白质相对分子质量为13 400,理论等电点为6.22,酸性氨基酸(Asp+Glu)和碱性氨基酸(Arg+Lys)均有13个,不稳定系数为40.29,脂肪族氨基酸指数为83.33,具有疏水性。主要定位于内质网内(44.44%),该蛋白质含有一个信号肽,其信号肽切割位点位于A39与R40之间,在21~43 aa存在一个跨膜区,在48~114 aa有一个Pfam蛋白质家族功能结构域。

下划线表示起始密码子(ATG)、终止密码子(TAA);阴影区域为信号肽;方框部分为Pfam结构域;黑色方框为保守的半胱氨酸残基;波浪线表示α螺旋;斜体部分为Ploy(A)结构。
Initiation codon (ATG) and termination codon (TAA) are underlined; the signal peptide is shaded; Pfam domain is boxed; the conserved cysteine residues are boxed in dark; the alpha helices are wavy lined; the Poly A signal sequence is italicized.
图1 PhGIH基因的全长cDNA序列及其推导的氨基酸序列
Fig.1 Full-length cDNA sequence and deduced amino acid sequences of PhGIH gene
2.2 PhGIH蛋白质空间结构预测
PhGIH蛋白质二级结构预测结果表明,其由57个α-螺旋、39个无规则卷曲、16个延伸链和5个β-折叠组成,分别占总结构的48.72%、33.33%、13.68%和4.27%。
通过SWISS-MOLDEL软件以同源建模方法,构建了波纹龙虾GIH的三维结构模型(图2),其中,包含5个α-螺旋,以及由6个保守的半胱氨酸残基形成的3个二硫键锚定(图1和图3)。
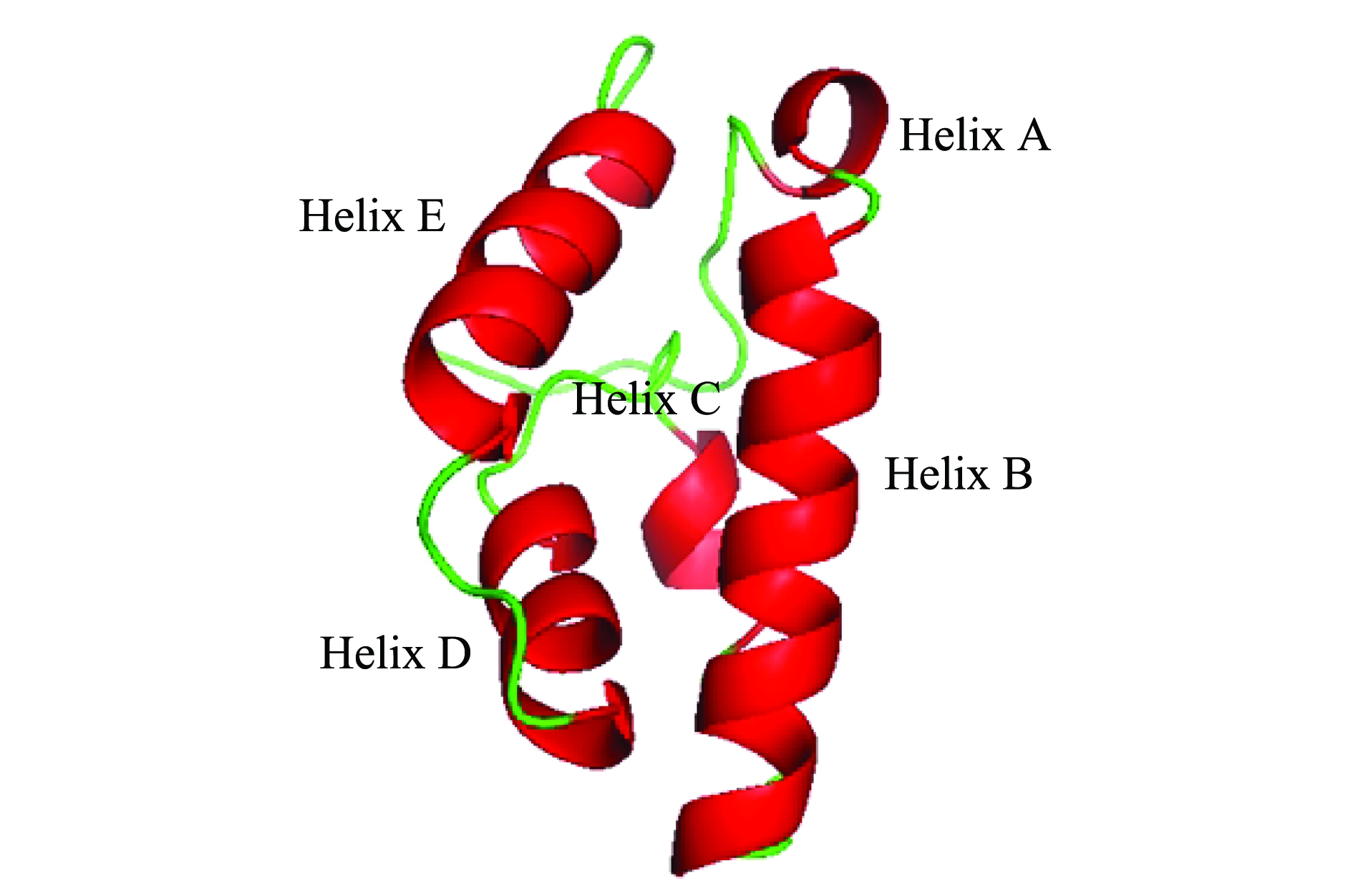
图2 PhGIH蛋白质三维结构模型
Fig.2 A 3-D protein model of PhGIH
2.3 PhGIH氨基酸序列同源性比较及系统进化树构建
将PhGIH氨基酸序列在NCBI上进行BLAST比对,发现与NCBI数据库中已公布的其他物种的GIH/MIH氨基酸序列同源性不高。利用ClustalX软件将PhGIH氨基酸序列与罗氏沼虾Macrobrachiumrosenbergii、日本沼虾、克氏原螯虾Procambarus clarkii、挪威海螯虾、欧洲螯龙虾、短沟对虾、斑节对虾Penaeus monodon、非洲龙虾Jasus lalandii、南美白对虾Penaeus vannamei和日本对虾Penaeus japonicus进行多重序列比对,结果显示,PhGIH氨基酸序列与其他物种相似度不高,仅有部分氨基酸残基和功能位点保守,其中,各氨基酸序列成熟肽有6个保守位置的半胱氨酸残基(图3)。利用ClustalW将上述氨基酸序列进行对比发现,PhGIH氨基酸序列与非洲龙虾的一致性最高(56.8%)(图3)。利用MEGA 5.0软件构建PhGIH和其他物种的系统进化树(图4),结果发现,波纹龙虾的分支较其他物种短,与南美白对虾、短沟对虾、斑节对虾和非洲龙虾同位于第一大支,其中与非洲龙虾聚为一支,bootstrap值为61,亲缘关系最近。

深灰色标记保守的氨基酸残基,浅灰色标记相似的氨基酸残基;下划线为5个α-螺旋序列。
The conserved amino acid residues are boxed in dark gray and similar amino acid residues are labeled in light gray; the helices are underlined.
图3 PhGIH多重序列比对
Fig.3 The multiple alignment of PhGIH gene

图4 基于N-J法构建的PhGIH氨基酸序列系统进化树
Fig.4 Phylogenetic tree of PhGIH amino acid sequences using Neighbor-joining method
2.4 不同卵巢发育时期PhGIH的组织表达分析
利用qPCR技术检测了GIH在波纹龙虾不同卵巢发育时期的组织表达情况。从图5可见:GIH在波纹龙虾各个组织均有表达,但表达量差异较大,眼柄表达量最高,其次为脑、肝胰腺和卵巢,眼柄组织与其他组织的GIH表达水平存在极显著性差异(P<0.01);3个卵巢发育时期中,增殖期的眼柄GIH表达量最高(P<0.05),随着卵巢的发育,眼柄GIH表达量逐渐下降。
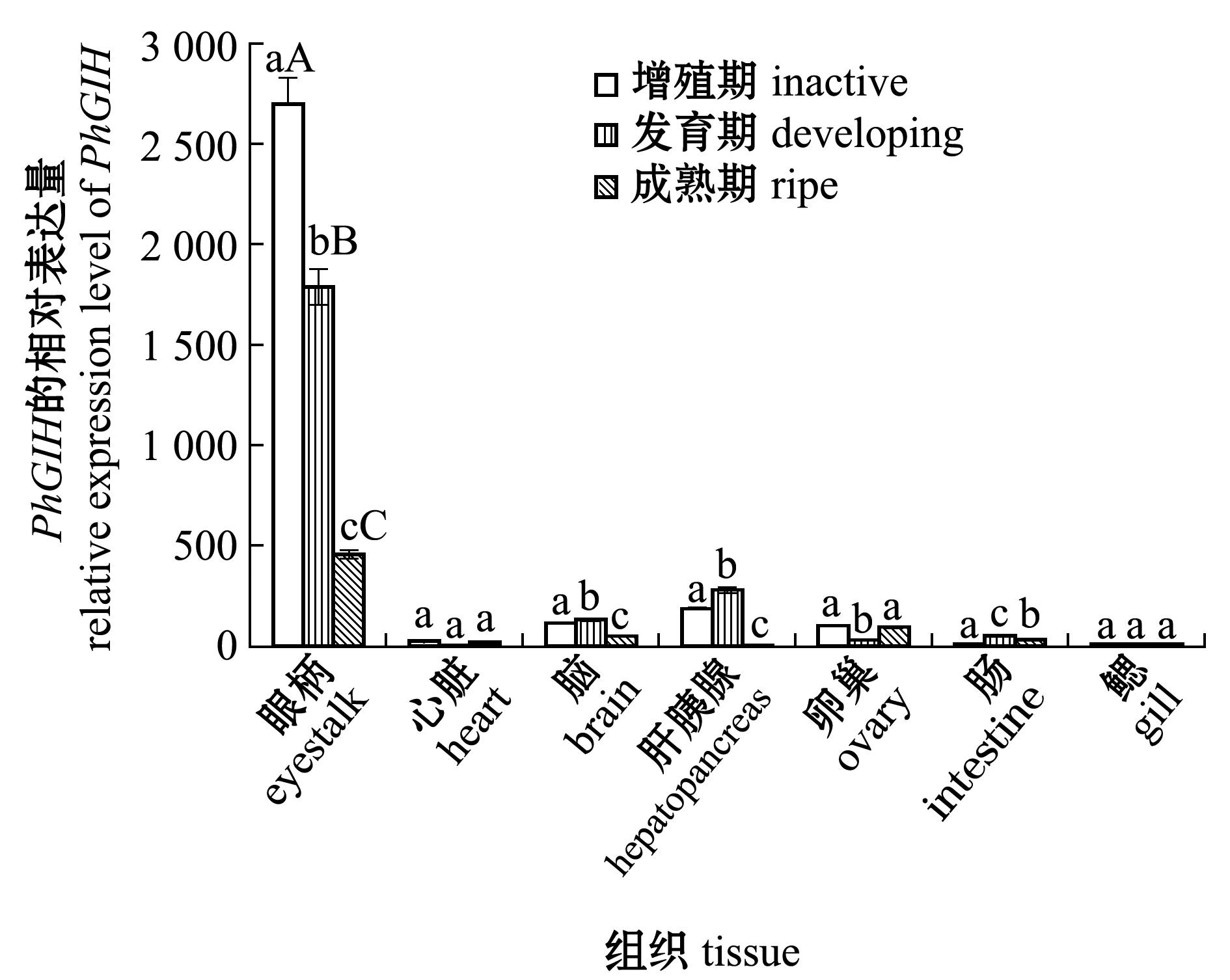
标有不同大写字母者表示同一组织不同卵巢发育时期有极显著性差异(P<0.01),标有不同小写字母者表示同一组织不同卵巢发育时期有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different capital letters in the same tissue are very significantly different in the different stages of ovarian development at the 0.01 probability level, the means with different letters in the same tissue are significantly different in the different stages of ovarian development at the 0.05 probability level,and the means with the same letter are not significant differences.
图5 卵巢不同发育时期PhGIH基因的组织表达
Fig. 5 Expression lever of PhGIH gene in different tissues at different developmental stages of ovary
2.5 不同光周期下波纹龙虾的卵巢发育和眼柄GIH基因表达变化
光周期处理波纹龙虾试验前,随机解剖了5尾雌虾,其性腺发育指数为0.32,卵巢颜色为白色,说明光周期试验中使用的雌虾在试验开始时卵巢均处于增殖期。光周期处理试验进行到第27、92天时,12L∶12D、13L∶11D和14L∶10D处理组的雌虾GSI值出现先下降后上升的趋势(图6),其中12L∶12D和13L∶11D处理组的GSI值变化幅度相近,此时,两组龙虾的卵巢形态极细,颜色均为白色,其石蜡组织切片如图7所示,卵巢主要由卵原细胞和卵黄板形成以前的卵母细胞组成,滤泡细胞较分散,呈椭圆形;在试验进行到第92天时,14L∶10D处理组的GSI值达到1.27,为三者中最高,且显著高于其他两组(P<0.05)(图6),此时,该组龙虾卵巢颜色呈橘红色,形态肥厚,其石蜡组织切片如图8所示,以成熟卵母细胞为主,细胞近椭圆形,图中可见大多数细胞无细胞核,且卵径较大。

标有不同字母者表示同一时间不同光周期处理间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters in the same time are significantly different in the different photoperiod treatments at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图6 不同光照周期波纹龙虾性腺发育指数的变化
Fig.6 Change in gonadosomatic index (GSI) of scalloped spiny lobster Panulirus homarus in different photoperiods
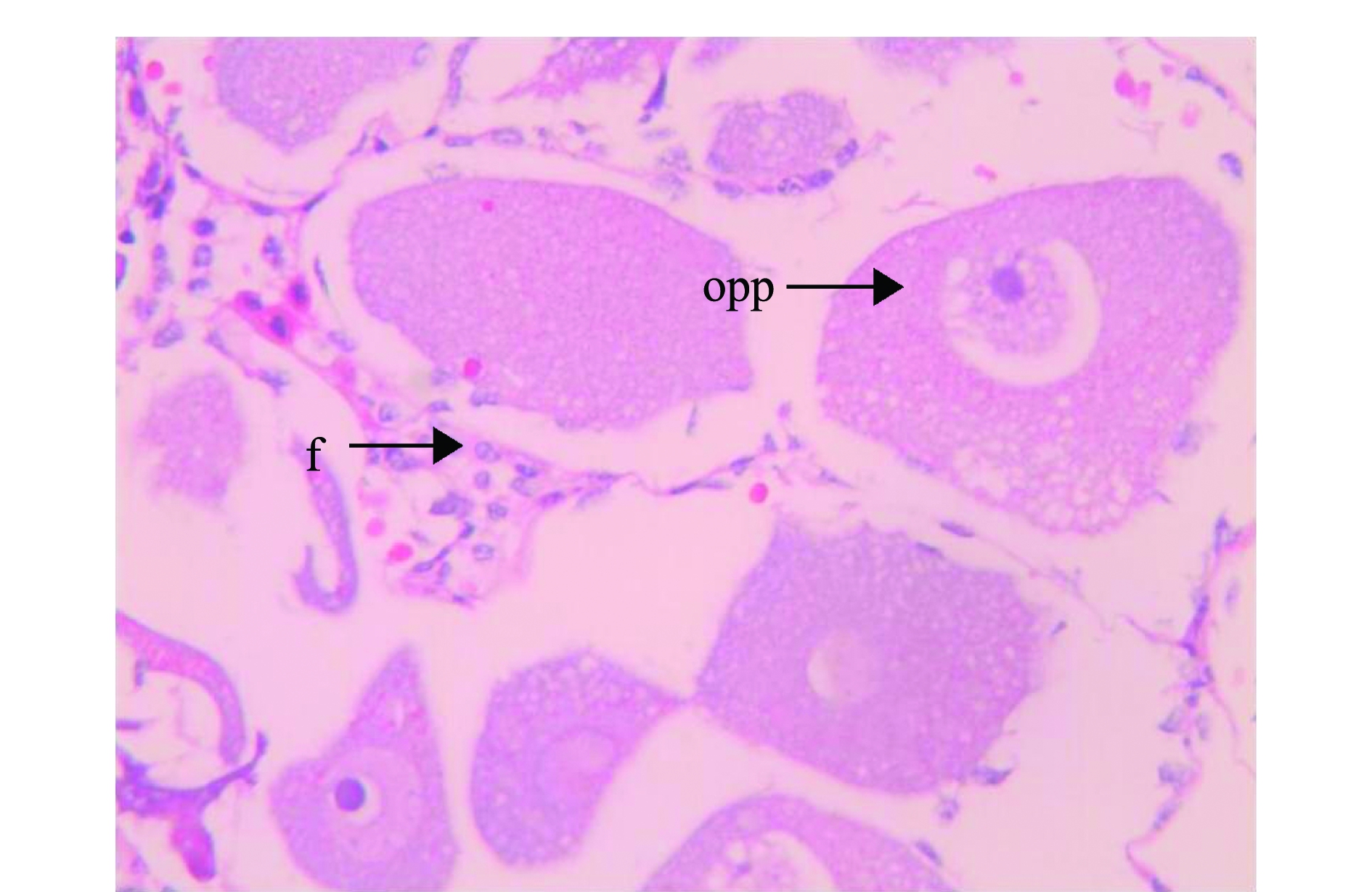
opp—卵黄板形成前期卵母细胞;f—滤泡细胞。
opp—oocyte at the pre-yolk platelet substage; f—follicle cell.
图7 12L∶12D光周期处理92 d时波纹龙虾卵巢的石蜡组织切片
Fig.7 Paraffin histological sections of the ovaries of scalloped spiny lobster Panulirus homarus at 12L∶12D for 92 days
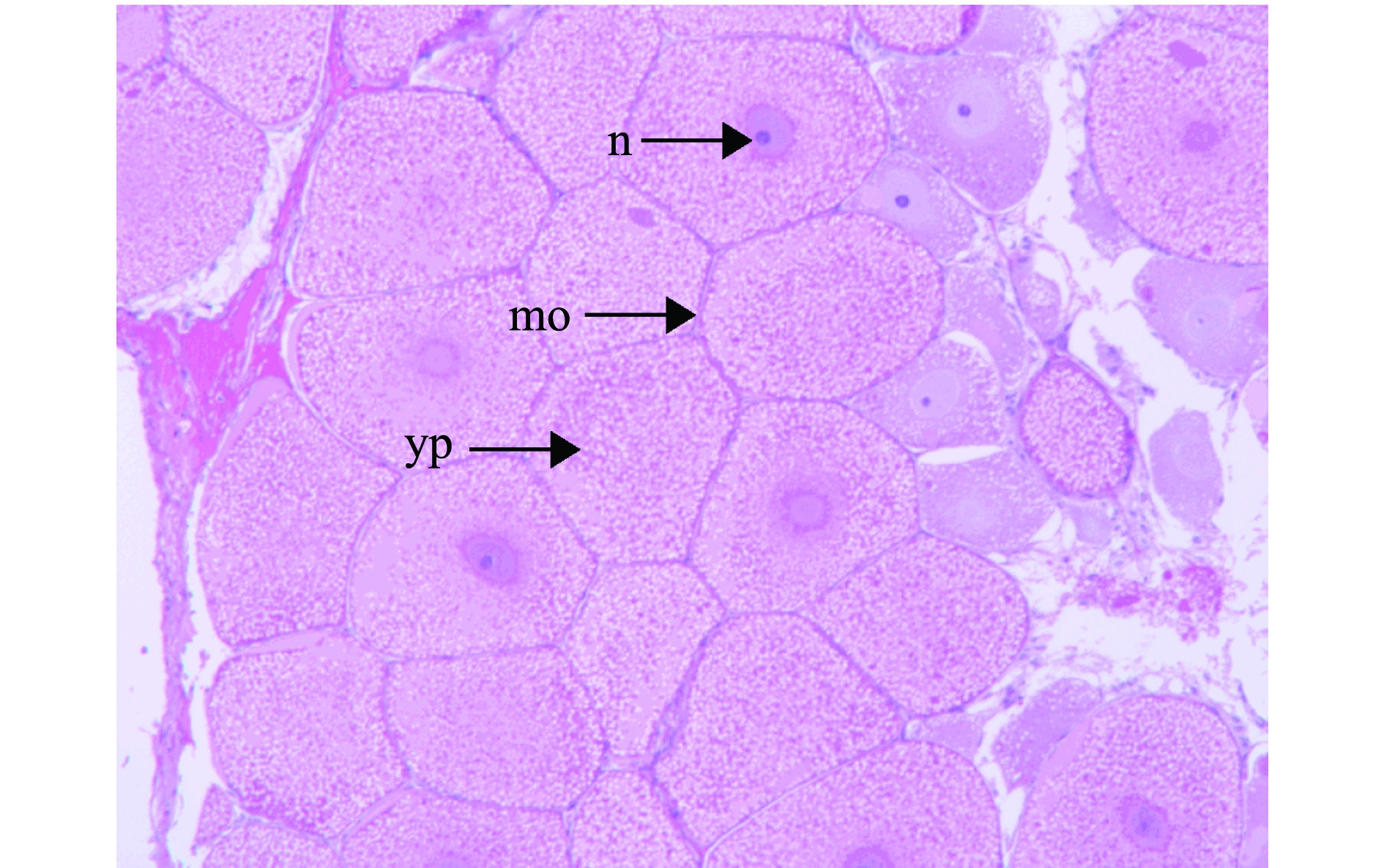
n—细胞核;mo—成熟卵母细胞;yp—卵黄板。
n—nucleus; mo—mature oocyte; yp—yolk platelet.
图8 14L∶10D光周期处理92 d时波纹龙虾卵巢的石蜡组织切片
Fig.8 Paraffin histological sections of the ovaries of scalloped spiny lobster Panulirus homarus at 14L∶10D for 92 days
利用qPCR技术检测了不同光周期处理0、27、92 d时雌虾眼柄PhGIH表达情况。从图9可见:3个光周期处理组的PhGIH表达量随时间变化均呈先上升后下降的趋势,与GSI值变化趋势相反;12L∶12D和13L∶11D处理组的PhGIH表达量变化幅度相近;第27天时,14L∶10D处理组的PhGIH表达量为3组中最高,且3组间存在显著性差异(P<0.05);第92天时,14L∶10D处理组为3组中最低,且与其余两组间存在显著性差异(P<0.05)。
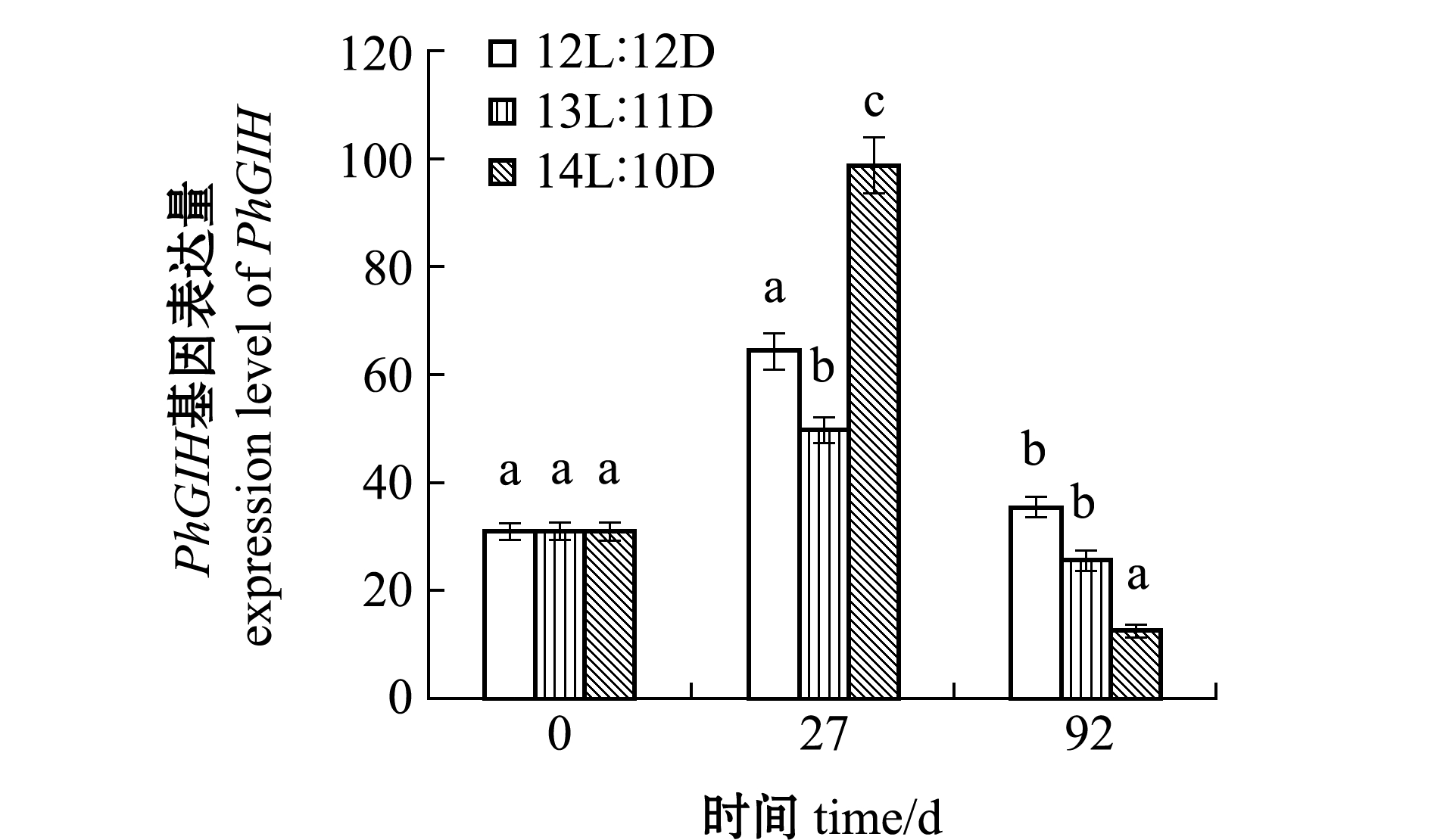
图9 不同光照周期眼柄PhGIH基因的表达量变化
Fig.9 Change in expression level of PhGIH gene in eyestalk in different photoperiods
3 讨论
3.1 PhGIH基因的序列分析
虾蟹类生殖发育的调控需要神经肽、激素和神经递质等多种调节因子的参与,涉及生殖细胞周期调控和卵黄发生等多种复杂有序的生物学过程[14]。性腺抑制激素是甲壳动物重要的神经内分泌多肽激素之一,其能抑制雌性和雄性性腺的发育及交配行为[15-17]。本研究中,克隆获得了PhGIH基因的全长cDNA序列1 206 bp,共编码117个氨基酸,分析表明,PhGIH氨基酸序列由39个氨基酸组成的信号肽与78个氨基酸组成的成熟肽直接相连,其成熟肽包含有6个保守位置的半胱氨酸残基(C46、C63、C66、C79、C83、C92),这6个半胱氨酸残基形成了3个链内二硫键(C46-C83、C63-C79、C66-C92)维持PhGIH蛋白质分子天然构象和稳定性;成熟肽的第12个氨基酸为甘氨酸残基,具有酸性等电点和热稳定性的特点,PhGIH前体缺少CHH前体相关肽(CPRP)。PhGIH的这些特征与眼柄Ⅱ型CHH/MIH/GIH家族神经肽该有的大部分特征相一致。经多重序列比对发现,PhGIH与其他物种同源性不高,与非洲龙虾同源性最高,为56.8%;仅有部分氨基酸和功能位点保守,保守区主要集中在成熟肽;系统进化树分析表明,PhGIH属于第一大支,与非洲龙虾亲缘关系最近,与多重序列比对结果吻合。
3.2 不同卵巢发育时期PhGIH基因的组织表达
本研究中,对PhGIH基因在波纹龙虾不同卵巢发育时期、不同组织的表达研究显示,PhGIH在各组织中广泛表达,在眼柄组织中表达量最高,脑、肝胰腺和卵巢次之。这表明,PhGIH主要在眼柄中合成分泌,且对肝胰腺和卵巢具有调控作用。其中,PhGIH基因在眼柄中不同卵巢发育时期表达量有显著性差异(P<0.05),且在卵巢增殖期表达量最高,表明X器官-窦腺复合体分泌大量PhGIH以抑制卵巢的发育。随着卵巢发育越成熟,PhGIH表达量越低,说明PhGIH对卵巢的抑制作用也逐渐变小。这一结果与其他已报道的X器官-窦腺复合体分泌GIH的观点一致。De Kleijn等[18]发现,在美洲螯龙虾中GIH的转录本和循环水平在未成熟和卵黄发生前期较高,而在成熟期间较低。Kulkarni等[19]发现,在卵巢发育的无活性阶段(Ⅰ期)和产后阶段,卵巢抑制激素的活性非常高,而在全卵黄形成阶段(Ⅳ期),抑制活性几乎可以忽略。De Kleijn等[20-21]通过Northern印迹技术验证了美洲螯龙虾GIH前激素原的mRNA在眼柄组织有最大量的表达,且雌雄眼柄的GIH表达量相同。姜姝娜[22]通过检测凡纳滨对虾GIH与Litβ-actin的积分吸光度比值,判定GIH基因在凡纳滨对虾眼柄中大量表达,脑中有少量表达。
3.3 光周期对波纹龙虾卵巢发育和眼柄PhGIH基因表达的影响
Sachlikidis等[4]研究发现,光周期是性腺成熟和交配活动开始的主要影响因素。Matsuda等[10]研究发现,光周期和温度是控制日本龙虾卵巢发育和产卵的重要因素,当温度为25 ℃、光周期为14L∶10D时卵巢发育速度最快,有更多的雌虾能抱卵。本研究中,通过电源计时器控制开关灯时间,研究了不同光周期对波纹龙虾卵巢发育的影响,在92 d的光周期处理后,仅有14L∶10D光周期处理组的大部分雌虾性腺成熟,而12L∶12D和13L∶11D光周期处理组的雌虾仍处于增殖期,表明波纹龙虾卵巢发育受光周期的影响,且当光周期为14L∶10D时卵巢发育速度最快,这与上述研究结果一致。本研究表明,不同光周期处理下眼柄PhGIH的表达量均呈现先上升后下降的趋势;当眼柄PhGIH表达量上升时,性腺发育指数下降,当眼柄PhGIH表达量下降时,性腺发育指数上升,说明PhGIH对波纹龙虾卵巢发育产生了抑制作用。由此推测,光周期通过对X器官-窦腺复合体产生影响,使得PhGIH表达量有所变化,从而调控波纹龙虾卵巢的发育。
4 结论
1) 使用RACE技术和反转录PCR技术克隆获得了全长为1 206 bp的波纹龙虾GIH cDNA序列,其具有CHH家族Ⅱ型肽激素的典型特征。
2) 波纹龙虾GIH基因在各组织中广泛表达,在眼柄中的表达量最高。
3) 波纹龙虾GIH基因在波纹龙虾卵巢发育至增殖期时表达量最高,随着卵巢的发育,其表达量下降。
4) 14L∶10D光周期处理对波纹龙虾卵巢发育的促进作用效果最明显。
[1] 王宁.青虾性腺抑制激素和高血糖激素基因全长cDNA的克隆及序列分析[D].南京:南京农业大学,2010.
WANG N.Cloning and sequence analysis of full length cDNA encoding gonad-inhibting hormone and crustacean hyperglycemic hormone in Macrobrachium nipponense[D].Nanjing:Nanjing Agricultural University,2010.(in Chinese)
[2] 张志甫.中华绒螯蟹性腺抑制激素基因的克隆与表达[D].保定:河北大学,2011.
ZHANG Z P.Clonging and expression of gonad-inhibiting hormone gene in Eriocheir sinensis[D].Baoding:Hebei University,2011.(in Chinese)
[3] 叶满.凡纳滨对虾性腺抑制激素定位及激素对性腺发育基因表达的影响[D].湛江:广东海洋大学,2014.
YE M.Localization of gonad-inhibiting hormone in the eyestalk and effects of hormones on gonad development related genes expression in Litopenaeus vannamei[D].Zhanjiang:Guangdong Ocean University,2014.(in Chinese)
[4] SACHLIKIDIS N G,JONES C M,SEYMOUR J E.Reproductive cues in Panulirus ornatus[J].New Zealand Journal of Marine and Freshwater Research,2005,39(2):305-310.
[5] 梁华芳,赵运添,黄东科.波纹龙虾耗氧率和窒息点的研究[J].水产养殖,2012,33(4):1-4.
LIANG H F,ZHAO Y T,HUANG D K.Study on the oxygen consumption rate and the asphyxiated point of Panulirus homarus [J].Journal of Aquaculture,2012,33(4):1-4.(in Chinese)
[6] 刘慧玲,李长玲,黄翔鹄,等.波纹龙虾胚胎的离体培养及发育观察[J].广东海洋大学学报,2008,28(4):45-48.
LIU H L,LI C L,HUANG X H,et al.In vitro incubation on the hatch of in vitro embryos and embryonic development of lobster Panulirus homarus [J].Journal of Guangdong Ocean University,2008,28(4):45-48.(in Chinese)
[7] 卓宏标,吴佳俊,梁华芳,等.切除眼柄与触角对波纹龙虾存活、蜕壳、摄食和生长的影响[J].大连海洋大学学报,2020,35(6):814-821.
ZHUO H B,WU J J,LIANG H F,et al.Effects of eyestalk and antenna ablation on survival,molt,feeding and growth of scalloped spiny lobster Panulirus homarus [J].Journal of Dalian Ocean University,2020,35(6):814-821.(in Chinese)
[8] 纪德华,陈昌生,周海荣,等.波纹龙虾早期叶状幼体摄食与饥饿的研究[J].集美大学学报(自然科学版),2004,9(1):11-16.
JI D H,CHEN C S,ZHOU H R,et al.Study of starvation and ingestion on the growth of phyllosoma of Panulirus homarus[J].Journal of Jimei University(Natural Science Edition),2004,9(1):11-16.(in Chinese)
[9] BELTZ B S.Crustacean neurohormones[M]//LAUFER H,DOWNER R G H.Endocrinology of selected invertebrate types.New York:Alan R.Liss Inc.,1988:235-258.
[10] MATSUDA H,TAKENOUCHI T,YAMAKAWA T.Effects of photoperiod and temperature on ovarian development and spawning of the Japanese spiny lobster Panulirus japonicus[J].Aquaculture,2002,205(3/4):385-398.
[11] SACHLIKIDIS N G,JONES C M,SEYMOUR J E.The effect of temperature on the incubation of eggs of the tropical rock lobster Panulirus ornatus[J].Aquaculture,2010,305(1/2/3/4):79-83.
[12] MINAGAWA M,SANO M.Oogenesis and ovarian development cycle of the spiny lobster Panulirus japonicus (Decapoda:Palinuridae)[J].Marine and Freshwater Research,1997,48(8):875-888.
[13] 刘慧玲,李长玲,黄翔鹄,等.波纹龙虾卵巢的解剖学与组织学研究[J].水产科学,2009,28(7):387-390.
LIU H L,LI C L,HUANG X H,et al.Ovary anatomy and histology in lobster Panulirus homarus[J].Fisheries Science,2009,28(7):387-390.(in Chinese)
[14] 王晓伟,张子平,王艺磊,等.虾蟹类卵巢发育调节机制研究进展[J].生物技术通报,2013(7):29-35.
WANG X W,ZHANG Z P,WANG Y L,et al.Research progress on regulation mechanism of ovary development in shrimps and crabs[J].Biotechnology Bulletin,2013(7):29-35.(in Chinese)
[15] 崔青曼,袁春营,吴婷婷.眼柄切除及注射黄体酮对中华绒螯蟹幼蟹卵巢发育的影响[J].海洋水产研究,2004,25(6):30-34.
CUI Q M,YUAN C Y,WU T T.Effects of eyestalk-ablated and injecting progesterone on the Chinese mitten-handed juvenile crab ovarian development[J].Marine Fisheries Research,2004,25(6):30-34.(in Chinese)
![]() T.Bihormonal control of sexual cycle in the freshwater crab,Potamon dehaani[J].Embryologia,1963,8(1):1-20.
T.Bihormonal control of sexual cycle in the freshwater crab,Potamon dehaani[J].Embryologia,1963,8(1):1-20.
[17] BOMIRSKI A,ARENDARCZYK M,KAWINSKA E,et al.Partial characterization of crustacean gonad-inhibiting hormone[J].International Journal of Invertebrate Reproduction,1981,3(4):213-219.
[18] DE KLEIJN D P V,JANSSEN K P C,WADDY S L,et al.Expression of the crustacean hyperglycaemic hormones and the gonad-inhibiting hormone during the reproductive cycle of the female American lobster Homarus americanus[J].Journal of Endocrinology,1998,156(2):291-298.
[19] KULKARNI G K,NAGABHUSHANAM R.Role of ovary-inhibiting hormone from eyestalks of marine penaeid prawns (Parapenaeopsis hardwickii) during ovarian developmental cycle[J].Aquaculture,1980,19(1):13-19.
[20] DE KLEIJN D P V,SLEUTELS F J G T,MARTENS G J M,et al.Cloning and expression of mRNA encoding prepro-gonad-inhibiting hormone (GIH) in the lobster Homarus americanus[J].FEBS Letters,1994,353(3):255-258.
[21] DE KLEIJN D P V,COENEN T,LAVERDURE A M,et al.Localization of messenger RNAs encoding crustacean hyperglycemic hormone and gonad inhibiting hormone in the X-organ sinus gland complex of the lobster Homarus americanus[J].Neuroscience,1992,51(1):121-128.
[22] 姜姝娜.凡纳滨对虾性腺抑制激素基因的克隆与表达[D].湛江:广东海洋大学,2011.
JIANG S N.Gih cDNA cloning and mrna expression in Litopenaeus vannamei[D].Zhanjiang:Guangdong Ocean University,2011.(in Chinese)