酵母菌是一类单细胞真核生物,广泛分布于自然界中,其细胞大多呈卵圆形、球形等,具有细胞壁、线粒体、细胞核等较为复杂的真核细胞结构,是较为高等的单细胞真核微生物。酵母菌不具备运动功能,其生长温度为0~47 ℃,pH为 3.0~7.5,最适生长温度为15~28 ℃,最适pH为4~6[1]。目前,已发现1 000多种酵母菌,其中大部分为有益菌,常应用于多种工业过程中,如酒精发酵、面包烘焙、食物或饲料,以及各种代谢产物的生产中[2-3]。而有些酵母菌则具有致病性,给人类和动植物的健康造成了威胁,如寄生在人体皮肤黏膜的新生隐球酵母菌Cryptococcus neoformans和白色假丝酵母菌Candida albicans等。已经发现的水产动物致病酵母菌种类不多,但分布广泛,可以侵染多种水产经济物种,在近几年水产养殖中发病率逐渐增高,且因尚无特效药物,导致该病治疗困难,造成了极大的经济损失,严重影响了水产养殖产业的健康发展[4]。
本研究中,主要对水产动物致病酵母菌的种类、主要危害、流行情况、传播途径、检测方法和防治技术等方面的研究进展进行了综述,以期为水产动物致病酵母菌的防治和科学研究提供参考。
1 水产动物致病酵母菌的种类、感染宿主及主要症状
水产动物致病酵母菌主要分为担子菌和子囊菌两大类,可侵染多种水产养殖经济物种。目前,发现的水产动物致病酵母菌有梅奇酵母属Metschnikowia、隐球菌属Cryptococcus、假丝酵母属Candida、毕赤酵母属Pichia、内孢酵母属Endomyces、德巴酵母属Debaryomyces和球拟酵母属Torulopsis等[5-17]。这些酵母菌可独自或与其他病原菌共侵染罗氏沼虾Macrobrachium rosenbergii[7,9]、中华绒螯蟹Eriocheir sinensis[5-6]、三疣梭子蟹Portunus trituberculatus[8,10-12]、大鳞大麻哈鱼Oncorhynchus tshawytscha[15]、天鹅绒蟹Necora puber[16]及欧洲食用蟹 Cancer pagurus[17]等多种水产经济动物。葡萄牙假丝酵母Candida lusitaniae为子囊菌类的假丝酵母,其规格为(1.3~6.5)μm×(2.3~7.8)μm,大多呈卵圆形,出芽生殖[10-12],具有假菌丝形态,能够侵染三疣梭子蟹等水生动物[8];莫格球拟酵母菌Torulopsis mogii属于担子菌类的隐球菌,其规格为(2.5~5.0)μm×(3.75~6.25)μm,大多呈卵圆形,菌体表面有荚膜,多边芽殖[9,18],其形态可在酵母状细胞到菌丝状细胞间转变,进而侵染罗氏沼虾等水生动物宿主[7,9,19-20]。水产动物致病酵母菌还可与其他病原菌协同侵染寄主,如二尖梅奇酵母Metschnikowia bicuspidata与屎肠球菌Enterococcus faecium共侵染罗氏沼虾,使其患病甚至死亡[13-14]。有些酵母菌与血卵涡鞭虫Hematodinium sp.共侵染欧洲食用蟹或天鹅绒蟹[16-17]。
致病酵母菌侵染水产动物后,酵母菌会在患病动物各组织中大量增殖,并引起组织发生以坏死为主的变质性病变,其病理特征主要表现为细胞变性、坏死,细胞核碎裂、崩解,严重时会导致机体死亡。因致病酵母种类不同及宿主的差异,常导致各种水产动物的患病症状存在明显差异。如感染葡萄牙假丝酵母的梭子蟹和感染二尖梅奇酵母的中华绒螯蟹血液均会出现严重乳化现象[5-6,8];而感染莫格球拟酵母Torulopsis mogii的罗氏沼虾和感染二尖梅奇酵母Debaryomyces hansenii的大鳞大麻哈鱼则无明显的外部临床症状[9,15,18];罗氏沼虾感染二尖梅奇酵母和汉斯德巴氏酵母Debaryomyces hansenii后则会表现出明显的外部临床症状[7](表1)。
表1 水产动物致病酵母菌种类及其引起的水产动物症状
Tab.1 Species of pathogenic yeasts and symptoms of the diseased animals caused by the pathogenic yeasts
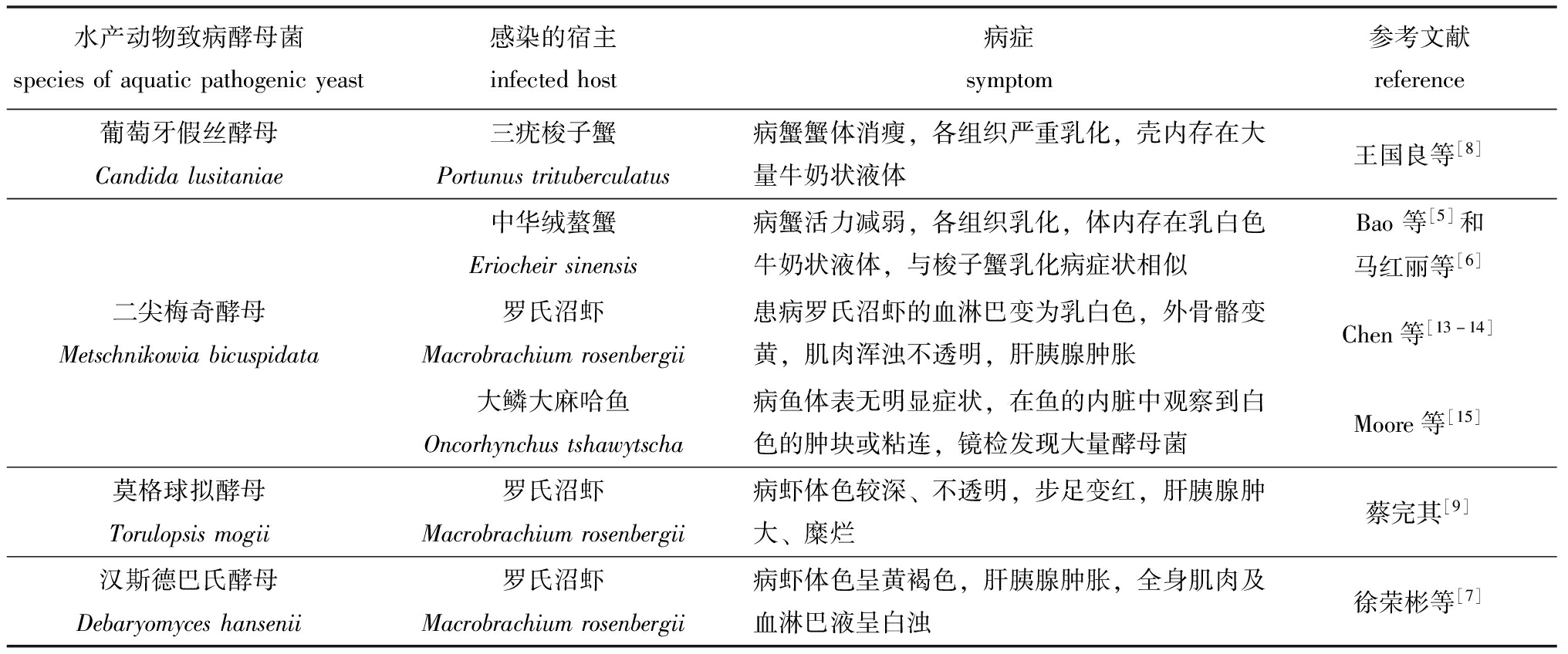
水产动物致病酵母菌speciesofaquaticpathogenicyeast感染的宿主infectedhost病症symptom参考文献reference葡萄牙假丝酵母Candidalusitaniae三疣梭子蟹Portunustrituberculatus病蟹蟹体消瘦,各组织严重乳化,壳内存在大量牛奶状液体王国良等[8]中华绒螯蟹Eriocheirsinensis病蟹活力减弱,各组织乳化,体内存在乳白色牛奶状液体,与梭子蟹乳化病症状相似Bao等[5]和马红丽等[6]二尖梅奇酵母Metschnikowiabicuspidata罗氏沼虾Macrobrachiumrosenbergii患病罗氏沼虾的血淋巴变为乳白色,外骨骼变黄,肌肉浑浊不透明,肝胰腺肿胀Chen等[13-14]大鳞大麻哈鱼Oncorhynchustshawytscha病鱼体表无明显症状,在鱼的内脏中观察到白色的肿块或粘连,镜检发现大量酵母菌Moore等[15]莫格球拟酵母Torulopsismogii罗氏沼虾Macrobrachiumrosenbergii病虾体色较深、不透明,步足变红,肝胰腺肿大、糜烂蔡完其[9]汉斯德巴氏酵母Debaryomyceshansenii罗氏沼虾Macrobrachiumrosenbergii病虾体色呈黄褐色,肝胰腺肿胀,全身肌肉及血淋巴液呈白浊徐荣彬等[7]
2 流行情况
目前,国内外均有关于酵母菌侵染水产动物的报道,水产动物致病酵母流行情况见表2。徐荣彬等[7]发现,汉斯德巴氏酵母菌和二尖梅奇酵母感染罗氏沼虾,该病的感染率和发病率在12月至翌年2月的低水温期最高,而在高温期6—9月间则无感染病例发生。蔡完其[9]报道,感染莫格球拟酵母菌的罗氏沼虾,其在1991年底—1992年初的上海市及1998年宁波奉化区亲虾越冬中均有发生,该病传染性极强,患病亲虾死亡率高达90%,严重影响虾苗的产量[9,18,20-21]。许文军等[10-12]曾报道,葡萄牙假丝酵母菌侵染梭子蟹导致其血淋巴乳化。早在20世纪90年代初便发现有患乳化病的梭子蟹,但由于病情及死亡状况不严重而未引起重视,但该病在2000—2002年舟山市、2002—2004年宁波市及浙江其他沿海地区流行,患病梭子蟹死亡率高达40%[8],病蟹即使不死也不具备商品价值,给梭子蟹养殖业造成了巨大经济损失[22]。也曾有中华绒螯蟹感染二尖梅奇酵母而导致“乳化病”的报道,该病在2018年冬季首次被发现,随后感染率逐年增加,目前呈全国蔓延趋势,辽宁、黑龙江、吉林、天津、新疆等地区均有发现,感染率已超过20%,给河蟹养殖产业带来了巨大损失[5-6]。除中国外,美国学者Moore等[15]也曾报道,美国大鳞大马哈鱼感染二尖梅奇酵母导致其死亡,死亡率高达34.5%。
3 传播途径和侵染机制
目前,关于水产动物致病酵母菌感染途径和侵染机制的报道较少,由于水产动物致病酵母种类和寄主种类的差异,每种水产养殖动物被酵母侵染时的传播途径和感染机制并不完全相同。从目前的研究来看,致病酵母菌主要以水平传播为主(表2)。如王国良等[8]发现,葡萄牙假丝酵母菌可以从梭子蟹的伤口进入体内,然后导致梭子蟹发病。董任彭等[20-21]发现,莫格球拟酵母菌侵染罗氏沼虾时,是由于养殖池底水泥面被破坏后,水漏到下面成为积水,病原菌在积水中大量繁殖,该病原菌从空隙进入池水中,通过水平传播进入虾体内,导致罗氏沼虾感染酵母菌而发病死亡。Lu等[19]发现,罗氏沼虾是由于鳃和口接触了池塘水体和底泥中的酵母菌而被感染。
表2 水产动物致病酵母菌流行情况
Tab.2 Epidemiological situation of pathogenic yeasts in aquaculture
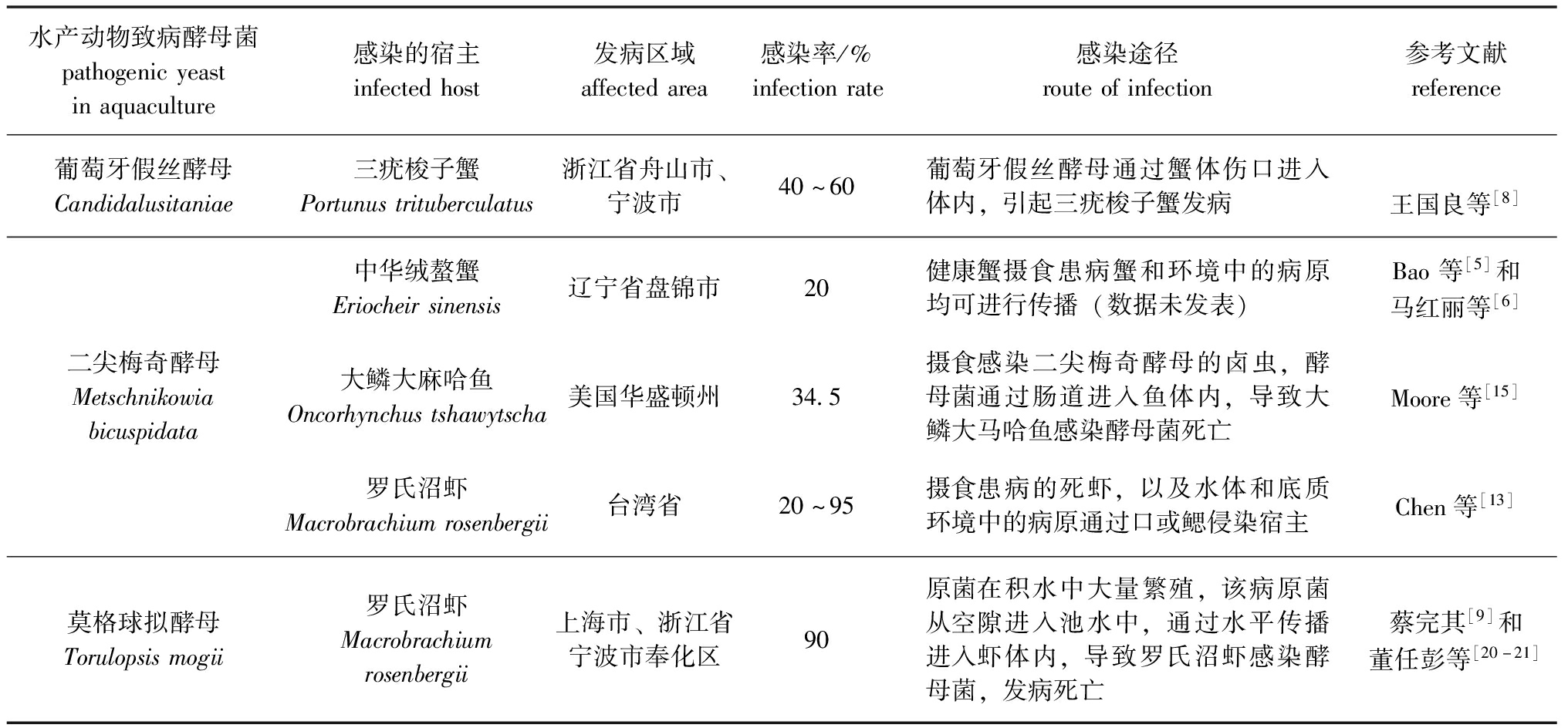
水产动物致病酵母菌pathogenicyeastinaquaculture感染的宿主infectedhost发病区域affectedarea感染率/%infectionrate感染途径routeofinfection参考文献reference葡萄牙假丝酵母Candidalusitaniae三疣梭子蟹Portunustrituberculatus浙江省舟山市、宁波市40~60葡萄牙假丝酵母通过蟹体伤口进入体内,引起三疣梭子蟹发病王国良等[8]中华绒螯蟹Eriocheirsinensis辽宁省盘锦市20健康蟹摄食患病蟹和环境中的病原均可进行传播(数据未发表)Bao等[5]和马红丽等[6]二尖梅奇酵母Metschnikowiabicuspidata大鳞大麻哈鱼Oncorhynchustshawytscha美国华盛顿州34.5摄食感染二尖梅奇酵母的卤虫,酵母菌通过肠道进入鱼体内,导致大鳞大马哈鱼感染酵母菌死亡Moore等[15]罗氏沼虾Macrobrachiumrosenbergii台湾省20~95摄食患病的死虾,以及水体和底质环境中的病原通过口或鳃侵染宿主Chen等[13]莫格球拟酵母Torulopsismogii罗氏沼虾Macrobrachiumrosenbergii上海市、浙江省宁波市奉化区90原菌在积水中大量繁殖,该病原菌从空隙进入池水中,通过水平传播进入虾体内,导致罗氏沼虾感染酵母菌,发病死亡蔡完其[9]和董任彭等[20-21]
关于致病酵母菌侵染机制的更多研究集中在植物和人类上,如Mayer等[23]发现,白色假丝酵母菌是条件致病菌,通常在其消化道及产道的黏膜上,并不引起明显的病理变化,但当宿主健康状况不良时,此病原菌将会严重侵害其黏膜组织,甚至可侵入血液并波及其他脏器。Reese等[24]通过将α葡聚糖合成酶基因敲除试验,发现α葡聚糖影响隐球菌毒力,突变株对宿主侵染能力降低,隐球菌会通过多糖荚膜锚定在宿主细胞表面,侵染宿主。O’meara等[25]发现,cAMP-PKA信号通路会调控Cryptococcus neoformans的Rim101转录因子,该转录因子参与了荚膜合成的调控及致病性。目前,对于水产动物致病酵母菌侵染机制的研究尚处于初始阶段,余贺[26]发现,莫格球拟酵母具有荚膜结构,可以保护酵母免受溶菌酶、白细胞、补体等杀菌物的杀菌作用,侵入的酵母越多,虾体中白细胞等杀菌物的杀菌作用越弱。许文军等[10-12]发现,三疣梭子蟹的乳化病发病机理是葡萄牙假丝酵母在梭子蟹免疫力低时,侵入其血淋巴细胞,并随血液循环进入各个组织中,侵染繁殖使梭子蟹发生病变。许文军还通过对病蟹养殖环境进行研究,认为梭子蟹发病原因与蟹的体质及环境因子有较大关系。Moore等[15]发现,大鳞大马哈鱼摄食了感染二尖梅奇酵母的卤虫,鱼体肠道消化二尖梅奇酵母子囊释放出的针状子囊孢子时,子囊孢子通过释放时的机械力穿透大马哈鱼肠道而进入其血液中,进而通过血液循环系统感染各组织。Lodder等[27]认为,子囊孢子以尖端纺锤或针叶形式存在,由于孢子的横截面直径较小,这一特性使得孢子更容易穿透宿主肠壁。有关水生动物酵母病的感染途径及发病机理仍需进一步研究,总体来说,水产动物致病酵母是条件致病菌,当宿主机体稳态失衡或外部环境发生显著变化时,病原酵母会通过水平传播,由破损皮肤或肠道等组织侵入机体体内,并随血液循环系统感染各组织,进而引发组织病变而导致其死亡。
4 检测方法
在鱼类和虾蟹类中均有因感染酵母菌而导致死亡的报道[7,9-12],近年来,水产养殖动物因酵母菌引起的疾病有增多的趋势,但病原个体微小,感染少量时各组织症状不明显,较难在现场确诊。虽然感染大量酵母菌的水产动物各组织病变症状明显,如葡萄牙假丝酵母侵染三疣梭子蟹导致其体液和肌肉出现不同程度乳化现象[10-12],但血卵涡鞭虫也可导致梭子蟹出现该患病症状,因此,无法通过症状直接确定病原为酵母菌。
4.1 染色法
采用苏木素-伊红染色(H.E)、Mayen氏黏液卡红染色等染色方法,染色后镜检可以初步判断为酵母,但镜检方法并不能明确酵母的具体种类,且传统的组织切片方法制作时间长、流程复杂,在致病酵母含量低的条件下不容易发现,不适合作为判断是否感染发病的技术手段。
4.2 平板法
平板培养法是酵母菌的传统检测方法,可通过形态观察和生理生化试验等,将分析结果与Kurtzman等[3]的标准分类系统进行比对,从而鉴定出菌株的种属,但这种方式费时费力,且重现性不好,一般需要5~7 d,耗时太长,不适用于快速检测。涂小林[28]曾用乳胶凝集试验检测莫格球拟酵母,但过程也比较复杂。
4.3 分子生物学方法
相比之下,分子生物学方法鉴定更为快速、准确,已成为实验室检测致病酵母菌的常规手段[29],目前常用的方法有普通PCR、实时荧光定量PCR(qPCR)等方法。
1)普通PCR(聚合酶链式反应)。PCR技术是最常用的酵母菌种类检测方法之一。目前,针对酵母菌的检测技术大多根据26S rDNA D1/D2和rDNA内转录间隔区(ITS rDNA)设计引物进行检测[30-32]。由于相近物种间序列较为接近,需要测序才能确定到种水平,因此,需要针对具体种类进行特异性引物筛选才能进行种类鉴定。普通PCR技术存在的另一个问题是灵敏度不高,低量感染时会出现假阴性。
2)实时荧光定量PCR(qPCR)。qPCR检测中常用的方法为染料法和探针法。染料法是根据SYBR Green染料与酵母菌的基因序列相结合,利用荧光显色检测模板含量,但该方法容易出现假阳性[33]。探针法的灵敏性及特异性比染料法好,但探针法检测酵母时,大多是根据一种引物探针检测一种酵母菌[34]。陈世琼等[35]利用酵母菌的基因保守序列,建立了针对酿酒酵母、斯巴达克毕赤酵母、鲁氏接合酵母和布鲁塞尔德克酵母的qPCR鉴定方法,但该法操作比较繁琐,工作效率低。余以刚等[34]通过设计酵母菌的通用型引物探针,建立了探针法,在特定酵母菌检测中效果较好。
综上所述,水产动物致病酵母菌的检测方法目前还不完善,需进一步优化特定酵母菌病原的荧光定量方法,筛选特异性引物,提高灵敏度及避免假阳性等问题。此外,还需开展环介导等温扩增(LAMP)、重组酶聚合酶扩增(RPA)等新的检测技术,可以快速准确地用于致病酵母菌的检测,以供水产养殖企业使用。
5 防治技术
目前,对于水产致病酵母菌的防治尚无有效药物,因此,在养殖过程中对致病酵母菌首要还是以预防为主。如葡萄牙假丝酵母侵染三疣梭子蟹导致其乳化病的重要原因就是由于养殖环境变化、运输中机械损伤、养殖密度过高、投饲不科学、池塘底质受到污染及水中有机质偏多等给病原菌提供了入侵机会,导致其发病[8]。预防方法应从改善养殖环境着手,如改善养殖池水质、定期捞取残饵、控制养殖密度、提高养殖动物免疫力等[10-12,36-37]。针对表2中罗氏沼虾感染莫格球拟酵母的相关途径,预防方法主要是虾池定期消毒、虾定期检疫、水质监测、水温控制、合理投喂和及时捞除残饵[9]。由于水产动物致病酵母多为机会性致病菌,养殖环节的管理不当均可能引起水产经济动物感染致病酵母菌,还需在养殖的各个环节实施多方面预防措施。
在药物治疗方面,许文军等[10-12]研究发现,制霉菌素、新洁尔灭和大蒜等药物对葡萄牙假丝酵母具有良好的抑菌效果。马红丽等[6]发现,二尖梅奇酵母对酮康唑、氟康唑、益康唑、克霉唑、两性霉素B、伊曲康唑、制霉菌素高度敏感。Zhang等[38]研究表明,马索亚内酯对不同二尖梅奇酵母菌株均有较好的杀灭效果,最小抑菌浓度和最小杀菌浓度仅分别为0.15、0.34 mg/mL,荧光显微镜观察发现,马索亚内酯能破坏酵母细胞的完整性进而杀死酵母细胞。此外,利用酵母分泌的毒素不同原理,一些学者筛选了能够杀灭致病酵母的海洋嗜杀酵母,并对毒素的分泌条件进行了研究,这些毒素对二尖梅奇酵母具有较好的杀灭作用[39-41]。目前,这些药物均在体外取得了较好效果,若能在感染后的水产动物体内依然有效,则对于二尖梅奇酵母等致病酵母菌病的有效治疗具有重要意义。
近期研究发现,抗菌肽[42]、微生态制剂[43]等也有较好的抑制酵母菌的作用。在药物筛选时既要考虑用药成本及对水产动物的安全性,也应考虑药物在体内的吸收、分布、代谢及药物残留等情况,只有在安全无毒、价格合理的情况下才能在养殖生产中进行应用。此外,酵母菌的致病机理复杂,往往可能表现出细菌与酵母菌共侵染或多种病原侵染的特点,生产上较难直接应用药物进行治疗。当水生动物出现酵母病症状时,病情往往已进入感染中后期阶段且难以治疗,所以要做到早发现、早处置。对于现阶段致病酵母菌的防治措施,应从改善养殖生态环境、控制养殖密度和加强水质管理等综合防治环节入手,在以后科研中需加强水生动物酵母病的早期检测与快速诊断技术,以及疾病综合防控措施的研究,减少因酵母病造成的经济损失。
6 存在的问题及展望
6.1 水产动物致病酵母菌研究中存在的问题
近年来,因致病酵母菌引起的水产动物病害不断增加,严重影响到产业的健康发展。目前,虽然在致病酵母菌的研究上取得了一些进展,但要真正解决病害暴发问题,还有很多关键技术需要解决。
1)水产动物致病酵母菌的传播途径尚不明确,如其如何侵染给水产动物,环境中有哪些生物可以携带这些病原,这些生物是否会传染给水产动物等。
2)致病酵母菌的流行规律尚不清楚,虽然知晓了该病的流行季节,但怎样的水体环境能够引起酵母菌发病还需深入阐明。
3)关于水产动物致病酵母菌的生活史和入侵机制研究还不深入,酵母菌进行无性繁殖或有性繁殖的条件、是否需要中间宿主,通过哪些组织入侵宿主体内及其入侵的手段,这些问题都需要深入研究以便于采取有利的应对措施。
4)目前尚无有效药物对致病酵母菌进行杀灭,配套的预防措施尚未建立。
6.2 未来重点研究方向
针对目前水产动物中致病酵母菌研究存在的问题,今后应重点在以下方面开展研究:
1)加强对致病酵母菌的流行病学和分子流行病学调查。了解致病酵母菌病原的种类、宿主范围、发生条件和流行规律、传播途径及变异情况等,明确这些问题有助于切断病原的传播途径。
2)加强致病酵母菌的生活史和入侵机制研究。明确致病酵母菌生活史包含的不同阶段,明晰其在环境中的存在形态及其形成不同形态结构的机制,以及是否需要中间宿主。目前,全基因组测序已被广泛应用于流行病学、疫苗开发、微生物进化等领域,为微生物特异性生物学研究提供了分子生物学基础,如致病机制、共生机制、独特的代谢机制等,也为病原-宿主相互作用的发病机制提供了有益借鉴。目前,在NCBI已公布了二尖梅奇酵母等水产动物致病酵母全基因组,结合其他动植物病原真菌基因组信息,可利用分子生物学手段探究酵母病原菌的病原特性;同时,利用多组学联合研究水产动物致病酵母菌的致病机理及其与寄主互作的分子机制,这对探索病害防控新策略具有重要指导意义。
3)随着有机农业理念的引入和保护环境意识的增强,仅依靠药物的单一水产病害防治技术迫切需要拓展和改进。基于改善宿主健康状况和养殖生态环境的免疫制剂、绿色生物渔药、绿色生态制品在水产中的开发和应用将逐步取代目前药物滥用的局面。目前,以健康养殖技术为基础的水生动物病害综合防疫体系是国际上普遍认可和接受的渔业病害防治技术系统。因此,今后建立一个对宿主和环境都有利的绿色综合防控技术,联合应用生物、免疫、生态技术加入水产动物致病酵母疫病的防控体系中是未来的发展趋势。
总之,酵母菌病的发生是病原、环境及养殖水产动物三者相互作用的结果,因此,明确致病酵母菌的传播途径、生活史、入侵机制及与宿主的互作等基础理论,加强抗病育种研究,提供良好的养殖环境,是解决致病酵母菌对水产动物危害的有效途径。
[1] 张煜,牛义然,詹吉东.酵母菌及其衍生物在水产养殖中的研究与应用[J].当代水产,2019,44(3):92-95.
ZHANG Y,NIU Y R,ZHAN J D.Research and application of yeast and its derivatives in aquaculture[J].Current Fisheries,2019,44(3):92-95.(in Chinese)
[2] 聂琴,杨凡,易建华,等.酵母源生物饲料在水产养殖中的应用[J].中国饲料,2015(15):35-40.
NIE Q,YANG F,YI J H,et al.Application of yeast derived biological feed in aquaculture[J].China Feed,2015(15):35-40.(in Chinese)
[3] KURTZMAN C P,FELL P,JACK W.The yeasts-a taxonomic study[M].Dordrecht:Kluwer Academic Publishers,2013.
[4] 张林,牛秋红,梁子安.致病酵母菌的种类、特点、侵染机制及其应用[J].国际免疫学杂志,2012,35(6):431-436.
ZHANG L,NIU Q H,LIANG Z A.Species,characteristics,infection mechanism and application of pathogenic yeasts[J].International Journal of Immunology,2012,35(6):431-436.(in Chinese)
[5] BAO J,JIANG H B,SHEN H B,et al.First description of milky disease in the Chinese mitten crab Eriocheir sinensis caused by the yeast Metschnikowia bicuspidata[J].Aquaculture,2021,532:735984.
[6] 马红丽,孙娜,陆晓岑,等.辽宁地区中华绒螯蟹“牛奶病”的病原分离与鉴定[J].大连海洋大学学报,2020,35(5):714-718.
MA H L,SUN N,LU X C,et al.Isolation and identification of pathogen in milky disease of Chinese mitten crab Eriocheir sinensis in Liaoning Province[J].Journal of Dalian Ocean University,2020,35(5):714-718.(in Chinese)
[7] 徐荣彬,刘正义.养殖淡水长脚大虾感染酵母菌之研究[C]//农委会渔业特刊第四十七号.鱼病研究专集,1994(15):55-68.
XU R B,LIU Z Y.Study on yeast infection in cultured Macrobrachium rosenbergii[C]//Fisheries special issue No.47.Monographic series of fish disease research,1994(15):55-68.(in Chinese)
[8] 王国良,金珊,陈寅儿,等.三疣梭子蟹肌肉乳化病的病原及其致病性研究[J].海洋科学进展,2006,24(4):526-531.
WANG G L,JIN S,CHEN Y E,et al.Study on pathogens and pathogenesis of emulsification disease of Portunus trituberculatus[J].Advance in Marine Science,2006,24(4):526-531.(in Chinese)
[9] 蔡完其.罗氏沼虾莫格球拟酵母病的病理研究[J].水产学报,1996,20(1):13-17.
CAI W Q.A study on pathology of the disease caused by Torulopsis mogii in giant freshwater prawn(Macrobrachium rosenbergii)[J].Journal of Fisheries of China,1996,20(1):13-17.(in Chinese)
[10] 许文军,徐汉祥,金海卫,等.梭子蟹“乳化病”病原的研究[J].浙江海洋学院学报(自然科学版),2003,22(3):209-213.
XU W J,XU H X,JIN H W,et al.Study of pathogen of“emulsification”disease of Portunus trituberculatus[J].Journal of Zhejiang Ocean University(Natural Science Edition),2003,22(3):209-213.(in Chinese)
[11] 许文军.国内首次发现梭子蟹酵母菌感染[J].现代渔业信息,2003,18(6):35.
XU W J.The first yeast infection in swimming crab in China[J].Fishery Information,2003,18(6):35.(in Chinese)
[12] 许文军.梭子蟹“乳化病”研究[D].青岛:中国海洋大学,2005.
XU W J.Study on pathogen and pathology of“emulsification”disease of Portunus trituberculatus[D].Qingdao: Ocean University of China,2005.(in Chinese)
[13] CHEN S C,CHEN Y C,KWANG J,et al.Metschnikowia bicuspidata dominates in Taiwanese cold-weather yeast infections of Macrobrachium rosenbergii[J].Diseases of Aquatic Organisms,2007,75(3):191-199.
[14] CHEN S C,CHEN T H,WANG P C,et al.Metschnikowia bicuspidata and Enterococcus faecium co-infection in the giant freshwater prawn Macrobrachium rosenbergii[J].Diseases of Aquatic Organisms,2003,55(2):161-167.
[15] MOORE M M,STROM M S.Infection and mortality by the yeast Metschnikowia bicuspidata var.bicuspidata in chinook salmon fed live adult brine shrimp(Artemia franciscana)[J].Aquaculture,2003,220(1/2/3/4):43-57.
[16] STENTIFORD G D,EVANS M,BATEMANK,et al.Co-infection by a yeast-like organism in Hematodinium-infected European edible crabs Cancer pagurus and velvet swimming crabs Necora puber from the English channel[J].Diseases of Aquatic Organisms,2003,54(3):195-202.
[17] STENTIFORD G D.Diseases of the European edible crab(Cancer pagurus):a review[J].ICES Journal of Marine Science,2008,65(9):1578-1592.
[18] 孙玉华,孙其焕.罗氏沼虾亲虾暴发性疾病病原的研究及防治[J].水产学报,1998,22(1):56-60.
SUN Y H,SUN Q H.Studies on pathogenic organnism and prevention and cure for explosive epidemic disease of parent prawn of Macrobrachium rosenbergii[J].Journal of Fisheries of China,1998,22(1):56-60.(in Chinese)
[19] LU C C,TANG K F J,CHEN S N.Identification and genetic characterization of yeasts isolated from freshwater prawns,Macrobrachium rosenbergii de Man,in Taiwan[J].Journal of Fish Diseases,1998,21(3):185-192.
[20] 董任彭,金红燕.罗氏沼虾莫格球拟酵母病的治疗试验[J].水产科技情报,2003,30(6):263-264.
DONG R P,JIN H Y.Experimental study on the treatment of Torulopsis mogii disease of Macrobrachium rosenbergii[J].Fisheries Science & Technology Information,2003,30(6):263-264.(in Chinese)
[21] 董任彭,金红燕.不同药物治疗罗氏沼虾莫格球拟酵母病的效果[J].齐鲁渔业,2004,21(6):42-43.
DONG R P,JIN H Y.Efficacy of different drugs in the treatment of Torulopsis mogii disease in Macrobrachium rosenbergii[J].Shandong Fisheries,2004,21(6):42-43.(in Chinese)
[22] 王永东.三疣梭子蟹秋季乳化病防治措施[J].科学养鱼,2012(1):60.
WANG Y D.Prevention and control measures of emulsification disease of Portunus trituberculatus in autumn[J].Scientific Fish Farming,2012(1):60.(in Chinese)
[23] MAYER F L,WILSON D,HUBE B.Candida albicans pathogenicity mechanisms[J].Virulence,2013,4(2):119-128.
[24] REESE A J,YONEDA A,BREGER J A,et al.Loss of cell wall alpha(1-3)glucan affects Cryptococcus neoformans from ultrastructure to virulence[J].Molecular Microbiology,2007,63(5):1385-1398.
[25] O’MEARA T R,NORTON D,PRICE M S,et al.Interaction of Cryptococcus neoformans Rim101 and protein kinase a regulates capsule[J].PLoS Pathogens,2010,6(2):e1000776.
[26] 余贺.医学微生物学及卫生细菌学[M].北京:人民卫生出版社,1958.
YU H.Medical microbiology and health bacteriology[M].Beijing: People’s Health Publishing House,1958.(in Chinese)
[27] LODDER J,KREGER-VAN R I J.The yeasts-a taxonomic study[M].2nd ed.Amsterdam:North-Holland,1970:470-527.
[28] 涂小林.乳胶凝集试验检测罗氏沼虾越冬亲虾暴发性病病原莫格球拟酵母[J].上海水产大学学报,1996,5(3):201-204.
TU X L.Latex agglutination test for the detection of pathogenic Torulopsis mogii from Macrobrachium rosenbergii[J].Journal of Shanghai Fisheries University,1996,5(3):201-204.(in Chinese)
[29] 杨静静,孟镇,钟其顶,等.分子生物学技术在酵母菌多相分类鉴定中的应用[J].中国酿造,2011(4):16-20.
YANG J J,MENG Z,ZHONG Q D,et al.Application of molecular biology technology in polyphasic classification and identification of yeast[J].China Brewing,2011(4):16-20.(in Chinese)
[30] 王凤梅.26S rDNA D1/D2区与5.8S-ITS rDNA序列分析法在酵母菌鉴定中的应用[J].现代农业,2016(12):96.
WANG F M.Application of 26S rDNA D1/D2 region and 5.8S-ITS rDNA sequence analysis in yeast identification[J].Modern Agriculture,2016(12):96.(in Chinese)
[31] 施慧,许文军,李鹏飞,等.应用PCR方法检测患“黄水病”锯缘青蟹中的血卵涡鞭虫[J].海洋渔业,2008,30(1):74-79.
SHI H,XU W J,LI P F,et al.PCR-techniques applied to detection of Hematodinium sp.infections of“yellow water”in mud crab Scylla serrata[J].Marine Fisheries,2008,30(1):74-79.(in Chinese)
[32] 唐玲,刘平,黄瑛,等.酵母的分子生物学鉴定[J].生物技术通报,2008(5):84-87.
TANG L,LIU P,HUANG Y,et al.Molecular biology identification for yeast[J].Biotechnology Bulletin,2008(5):84-87.(in Chinese)
[33] HIERRO N,ESTEVE-ZARZOSO B,GONZ LEZA,et al.Real-time quantitative PCR(QPCR)and reverse transcription-QPCR for detection and enumeration of total yeasts in wine[J].Applied and Environmental Microbiology,2006,72(11):7148-7155.
LEZA,et al.Real-time quantitative PCR(QPCR)and reverse transcription-QPCR for detection and enumeration of total yeasts in wine[J].Applied and Environmental Microbiology,2006,72(11):7148-7155.
[34] 余以刚,万松华,胡双芳,等.通用型酵母菌实时荧光PCR检测方法的建立[J].现代食品科技,2014,30(12):215-219,125.
YU Y G,WAN S H,HU S F,et al.Establishing a universal fluorescence real-time PCR method for the detection of yeast in food[J].Modern Food Science and Technology,2014,30(12):215-219,125.(in Chinese)
[35] 陈世琼,逄波,蔡雪凤,等.食品中腐败酵母的实时荧光PCR鉴定[J].食品与发酵工业,2013,39(7):185-187.
CHEN S Q,PANG B,CAI X F,et al.Identification of spoilage yeasts isolated from food by real-time PCR[J].Food and Fermentation Industries,2013,39(7):185-187.(in Chinese)
[36] 董莹,贺文斌,赵景壮,等.传染性胰脏坏死病酵母展示疫苗的免疫效果评价[J].大连海洋大学学报,2020,35(6):866-873.
DONG Y,HE W B,ZHAO J Z,et al.Evaluation of immune protection effect of a vaccine constructed using yeast display against infectious pancreatic necrosis[J].Journal of Dalian Ocean University,2020,35(6):866-873.(in Chinese)
[37] 柴静茹,王荻,卢彤岩,等.嗜冷黄杆菌及细菌性冷水病的研究进展[J].大连海洋大学学报,2020,35(5):755-761.
CHAI J R,WANG D,LU T Y,et al.Research progress on Flavobacterium psychrophilum and bacterial coldwater disease: a review[J].Journal of Dalian Ocean University,2020,35(5):755-761.(in Chinese)
[38] ZHANG H Q,CHI Z,LIU G L,et al.Metschnikowia bicuspidate associated with a milky disease in Eriocheir sinensis and its effectitve treatment by Massoia lactone[J].Microbiological Research,2021,242:126641.
[39] WANG L,YUE L X,CHI Z M,et al.Marine killer yeasts active against a yeast strain pathogenic to crab Portunus trituberculatus[J].Diseases of Aquatic Organisms,2008,80(3):211-218.
[40] WANG X H,CHI Z M,YUE L X,et al.A marine killer yeast against the pathogenic yeast strain in crab(Portunus trituberculatus)and an optimization of the toxin production[J].Microbiological Research,2007,162(1):77-85.
[41] TAN C M,WANG L,XUE Y,et al.Marine killer yeast Metschnikowia saccharicola active against pathogenic yeast in crab and an optimization of the toxin production[J].African Journal of Biotechnology,2018,17(21):668-679.
[42] 王亚平,余维维,秦梦茹,等.抗菌肽的作用机理及应用[J].湖北农业科学,2018,57(5):9-13,70.
WANG Y P,YU W W,QIN M R,et al.Antibacterial mechanism and application of antimicrobial peptides[J].Hubei Agricultural Sciences,2018,57(5):9-13,70.(in Chinese)
[43] 张倩.对虾养殖复合功能型微生态制剂的研制及应用[D].福州:福建师范大学,2019.
ZHANG Q.Development and application of compound functional microecological preparation for prawn aquaculture[D].Fuzhou: Fujian Normal University,2019.(in Chinese)