腐败希瓦氏菌Shewanella putrefaciens是鱼虾贝等新鲜水产品的典型腐败菌(specific spoilage organism)。在水产品冷藏期间,该菌在还原氧化三甲胺的同时产生H2S,进而使得这些冷藏水产品呈现出酸臭腐败味[1-4]。由于腐败希瓦氏菌在水产品表面产生被膜,且较难清除,给水产品加工与贮藏带来严重危害[5]。利用天然生物活性物质可以抑制富含蛋白质的水产品保鲜贮藏过程中的腐败希瓦氏菌[6-9]。因此,预防保鲜过程中腐败问题的关键是抑制腐败希瓦氏菌。
凝集素是一种非酶、非免疫球蛋白的多价糖结合蛋白或蛋白质。水生生物来源的凝集素具有抑菌活性,这对食品保鲜尤为重要,已经成为近年来的研究热点。Liu等[10]、Huang等[11]和Zhang等[12]研究发现,许多水生生物来源的凝集素具有较好的抑菌活性。但生物体内凝集素含量较低,且对其抑菌机制尚不明确,这阻碍了水生生物凝集素的实际应用。天然生物保鲜剂,尤其是水生生物来源的凝集素,是一种来源安全、潜在的可应用于水产品加工与贮藏中的天然生物抑菌剂。目前,已经发现的菲律宾蛤仔Ruditapes philippinarum多种凝集素为其天然免疫因子[13-21],对多种微生物具有天然抵抗防御作用。尽管有不少学者对菲律宾蛤仔凝集素与微生物相互作用进行了较多研究,但未见其抑制腐败希瓦氏菌机制的报道。本研究中,利用固相吸附分析了菲律宾蛤仔凝集素(MCL-T)与腐败希瓦氏菌外膜蛋白(outer membrane proteins, OMP)的相互作用,利用非标记定量蛋白质组方法分析了MCL-T作用前后腐败希瓦氏菌蛋白表达的变化,以期从分子水平上获得MCL-T抑菌机制,为MCL-T在水产品加工与贮藏中的应用提供基础数据。
1 材料与方法
1.1 材料
腐败希瓦氏菌模式菌株CICC22940由中国工业微生物菌种保藏管理中心提供。
试剂:无菌绵羊血(20%)(上海伊卡生物技术有限公司);辣根过氧化物酶(HRP)、牛血清蛋白(BSA)(北京索莱宝科技有限公司);胰蛋白胨大豆肉汤(TSB)(青岛海博生物技术有限公司);十二烷基硫酸钠(SDS)、尿素、二硫苏糖醇(DTT)、吲哚乙酸(IAA)(美国Bio-Rad公司);BCA定量试剂盒(上海碧云天生物技术有限公司);胰蛋白酶(Trypsin)(美国Promega公司);相对分子质量为10 000的超滤离心管(德国Sartorius公司);其他试剂均购自国药集团化学试剂有限公司。
仪器与设备:ZDP-A2160A型曲线控制恒温培养箱(上海智城分析仪器制造有限公司);Multiskan MK3型酶标仪(美国Thermo公司);5430R低温高速离心机、真空离心浓缩仪(德国Eppendordf公司);Triple TOF 6600 +质谱仪(美国AB SCIEX公司);Agilent 1290 Infinity LC超高压液相色谱仪(美国Agilent公司)。
1.2 方法
1.2.1 腐败希瓦氏菌体的制备 取腐败希瓦氏菌株,按照中国工业微生物菌种保藏管理中心提供的菌种说明书进行培养,培养后的菌悬液用生理盐水洗涤3次,每次均在4 ℃下以4 000 r/min离心10 min,收集菌体备用。
1.2.2 腐败希瓦氏菌刺激菲律宾蛤仔试验 将菌体用生理盐水悬溶,调节其OD600 nm分别为0.5、1.0、1.5、2.0、2.5,制成不同浓度的菌悬液,分别标记为s-0.5、s-1.0、s-1.5、s-2.0、s-2.5。将暂养1 d的菲律宾蛤仔(体质量8 g±1 g)分为7组,每组25只,分别放入盛有300 mL、(22±3)℃海水的洁净搪瓷托盘(20 cm×25 cm×4.5 cm)内。第1组不做任何处理作为空白组,第2~6组分别用1 mL无菌注射器向每只菲律宾蛤仔足肌中注射100 μL s-0.5、s-1.0、s-1.5、s-2.0、s-2.5的菌悬液,第7组海水中加入2.5 mL S-1.0菌悬液并记为浸泡组,每组试验设3个平行。在海水中培养12、24、36 h时,分别收集每组的海水,4 ℃下以9 000 r/min离心15 min,上清液用80%饱和度的硫酸铵盐析12 h,相同条件下再离心,取沉淀用去离子水溶解并透析、冻干,得到MCL-T冻干粉。试验过程中观察每组菲律宾蛤仔的死亡情况,试验结束时测定每组MCL-T冻干粉的质量。
按佟长青等[18]的方法检测各组MCL-T冻干粉对无菌绵羊血细胞的凝集活性。
1.2.3 MCL-T对腐败希瓦氏菌的抑制作用 取腐败希瓦氏菌株,按照菌种说明书进行培养,培养12 h后用无菌TSB培养液稀释1 000倍,混匀后分装12个锥形瓶中,分别加入不同量的MCL-T冻干粉,使其终浓度分别为0、0.01、0.1、1.0 mg/mL,相同培养条件下继续培养24 h,测定630 nm波长下各组的吸光度,检测MCL-T对腐败希瓦氏菌生长抑制情况。
1.2.4 MCL-T-HRP固相吸附试验 腐败希瓦氏菌外膜蛋白(outer membrane proteins, OMP)的制备与包被酶标板,以及MCL-T-HRP酶联物的制备参考文献[22-25]中的方法。
分别取稀释100、200、400、800、1 600倍的MCL-T-HRP酶联物稀释液(对应终浓度分别为55.56、27.78、13.89、6.94、3.47 μg/mL)各100 μL,加入包被后酶标板中,4 ℃过夜。用PBS洗液洗涤3次后,再加入100 μL新配制的0.4 mg/mL邻苯二胺(用pH 5.0的磷酸-柠檬酸配制)和15 μL H2O2溶液,于37 ℃下孵育10 min后,立即加入2 mol/L H2SO4终止反应,测定492 nm下的吸光度[22-24]。空白以BSA代替腐败希瓦氏菌OMP。试验设置 3个平行,测定MCL-T与腐败希瓦氏菌OMP的结合情况。
1.2.5 pH对MCL-T-HRP结合腐败希瓦氏菌OMP的影响 将包被后酶标板各孔内分别加入90 μL 0.05 mol/L的 HAc-NaAc(pH 5.0)、NaH2PO4-Na2HPO4(pH 6.0)、NaH2PO4-Na2HPO4(pH 7.0)、Tris-HCl(pH 8.0)、Gly-NaOH溶液(pH 9.0),然后再加入90 μL MCL-T-HRP,4 ℃下过夜。用PBS洗液洗涤3次,余下操作同固相吸附测试,考察不同pH条件下,MCL-T与腐败希瓦氏菌OMP的结合情况。
1.2.6 蛋白质组学分析样品的制备 将“1.2.3节”中测定吸光度后的0 mg/mL MCL-T组标记为C组,1.0 mg/mL MCL-T组标记为L组,离心,收集菌体,用生理盐水洗涤3次后,以SDT裂解液(40 g/L SDS, 100 mmol/L Tris/HCl,1 mmol/L DTT,pH 7.6)在沸水浴下裂解10 min,超声破碎细胞后离心,收集上清液,即为蛋白质组样品。
1.2.7 SDS-PAGE电泳 将蛋白质组样品与上样缓冲液混合后进行沸水浴5 min,将离心10 min(14 000 g)后的上清液进行SDS-PAGE。
1.2.8 样品酶解及酶解产物的LC-MS/MS鉴定 根据翟兴月等[25]的方法对L组和C组蛋白质组样品进行胰蛋白酶酶解,获得酶解液。取2 μg酶解产物(OD280 nm定量)进行LC-MS/MS分析[25]。
1.3 数据处理
将LC-MS/MS原始文件导入Maxquant软件1.3.0.5中进行查库和LFQ非标记定量分析,数据库为(uniprot_shewalla_126111_20161009.fasta)。
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 19.0软件进行单因素方差分析,用Duncan法进行组间多重比较。
2 结果与分析
2.1 腐败希瓦氏菌对菲律宾蛤仔产生凝集素的影响
将不同浓度的腐败希瓦氏菌注射入菲律宾蛤仔体内后,各组在海水中培养12、24、36 h后,蛤仔的死亡情况及养殖海水中收集的MCL-T冻干粉量如表1所示,随着养殖时间的延长,各组菲律宾蛤仔死亡率均明显上升,且在第36 h时死亡率为87%~100%,同时,从各组海水中收集的MCL-T冻干粉量也明显增加,表明菲律宾蛤仔在养殖过程中特别是死亡过程中分泌到体外的物质量增加。
表1 菲律宾蛤仔死亡率及养殖海水中MCL-T冻干粉量
Tab.1 Mortality of Manila clam Ruditapes philippinarum and amount of MCL-T lyophilized powder in the culture seawater
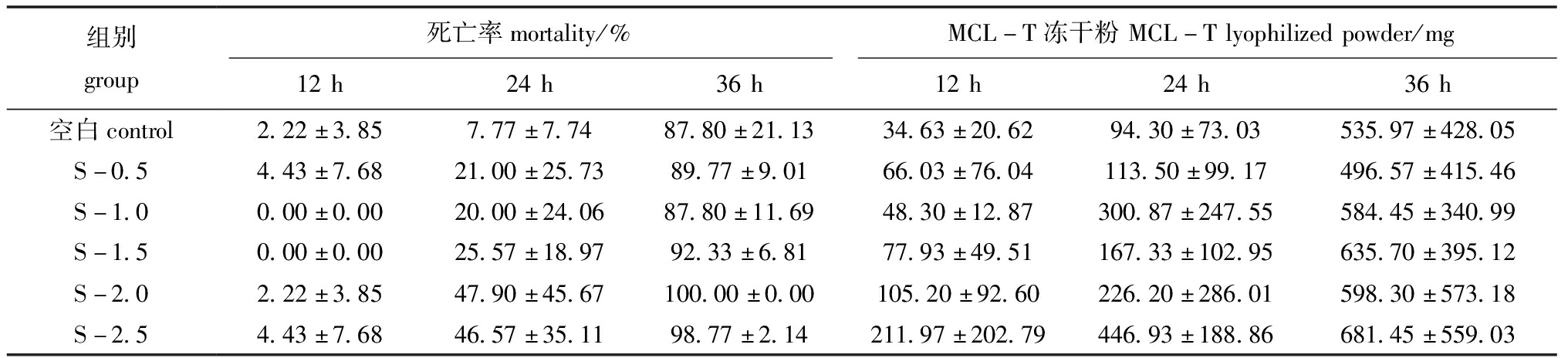
组别group死亡率mortality/%MCL-T冻干粉MCL-Tlyophilizedpowder/mg12h24h36h12h24h36h空白control2.22±3.857.77±7.7487.80±21.1334.63±20.6294.30±73.03535.97±428.05S-0.54.43±7.6821.00±25.7389.77±9.0166.03±76.04113.50±99.17496.57±415.46S-1.00.00±0.0020.00±24.0687.80±11.6948.30±12.87300.87±247.55584.45±340.99S-1.50.00±0.0025.57±18.9792.33±6.8177.93±49.51167.33±102.95635.70±395.12S-2.02.22±3.8547.90±45.67100.00±0.00105.20±92.60226.20±286.01598.30±573.18S-2.54.43±7.6846.57±35.1198.77±2.14211.97±202.79446.93±188.86681.45±559.03
对各组提取的MCL-T冻干粉进行凝集活性检测,结果显示,随着菲律宾蛤仔死亡率的增加,MCL-T凝集活性也略有增强,且S-1.0组凝集活性大于其他各组。
2.2 MCL-T的抑菌作用
从表2可见,低浓度(0.01 mg/mL)MCL-T对腐败希瓦氏菌的生长具有一定程度的抑制作用,但不显著(P>0.05),当MCL-T在培养液中浓度达到0.1 mg/mL以上时,其抑制作用显著增强(P<0.05)。在试验过程中还发现,含有高浓度MCL-T的培养液中,菌体量较少,且有部分团状物出现,但经剧烈振荡后,可以使团块分散。
表2 MCL-T对腐败希瓦氏菌的抑制作用
Tab.2 Inhibitory effect of MCL-T against Shewanella putrefaciens

MCL-T质量浓度concentrationofMCL-T/(mg·mL-1)00.010.11.0OD630nm0.141±0.006a0.135±0.004a0.121±0.008b0.093±0.008c
注:同行中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note: The means with different letters within the same line are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same line are not significant differences.
2.3 MCL-T与腐败希瓦氏菌外膜蛋白的相互作用
将腐败希瓦氏菌OMP与不同浓度MCL-T-HRP溶液在酶标板上的结合情况进行检测,结果如图1(a)所示,随着MCL-T浓度的增加,MCL-T与OMP结合的量也随之增加,表明两者结合具有浓度依赖关系。pH对MCL-T与OMP结合的影响如图1(b)所示,当pH为6时,MCL-T结合OMP的量最高,之后随着pH的升高,MCL-T与OMP结合能力逐步下降,表明MCL-T与OMP的结合受pH的影响。
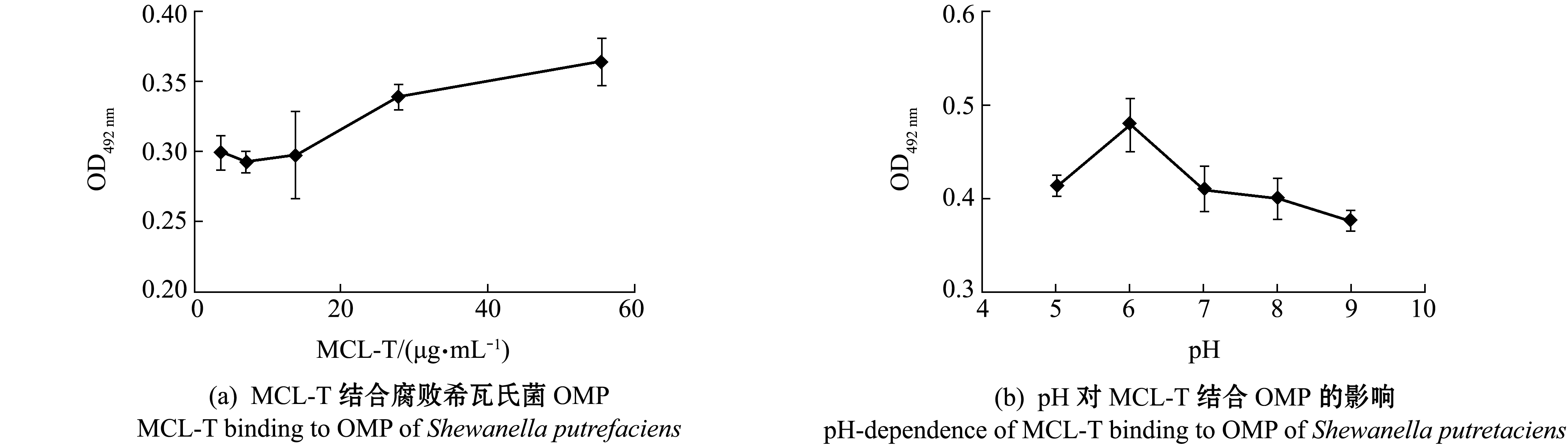
图1 MCL-T结合腐败希瓦氏菌的膜蛋白固相吸附测定
Fig.1 Binding ability of MCL-T to outer membrane proteins of Shewanella putrefaciens
2.4 差异蛋白质表达分析
通过SDS-PAGE对L和C组蛋白质表达平行性进行检验,结果显示,各样品条带分离清晰,样品组内平行性好(表2),表明蛋白质提取效果理想,可以继续用酶解产物质谱验证其平行性。蛋白质酶解产物的质谱检测结果显示,各组样品酶解和质谱鉴定效果理想(图3),可用于蛋白质组分析。
图3 腐败希瓦氏菌酶解产物的质谱图
Fig.3 Mass spectrogram of enzymatic hydrolysate of Shewanella putrefaciens
蛋白质定量分析结果表明,C组和L组鉴定得到蛋白质212个,其中,74个为差异表达蛋白质(平均蛋白质表达量之比≥2.0或≤0.5,且t检验中P≤0.05)。对这些差异表达蛋白质进行GO(gene ontology)功能注释(2水平),包括:70个参与代谢过程、69个参与细胞过程、19个参与单组织过程、16个参与生理调节、7个参与定位、6个参与应激响应等10个生物过程;63个具有催化活性、59个具有结合功能、4个具有转运活性等6种分子功能;55个位于细胞、22个位于大分子复合物、9个位于细胞器、6个位于膜上等6种细胞组分(表3)。以上结果表明,MCL-T加入培养基中与腐败希瓦氏菌共培养后,导致腐败希瓦氏菌中响应外界信号的蛋白质表达量出现显著变化,主要涉及细胞及大分子复合物中的具有催化活性和结合作用的蛋白质参与代谢过程和细胞过程。
表3 差异表达蛋白质GO功能注释
Tab.3 GO functional annotation analysis of differential proteins
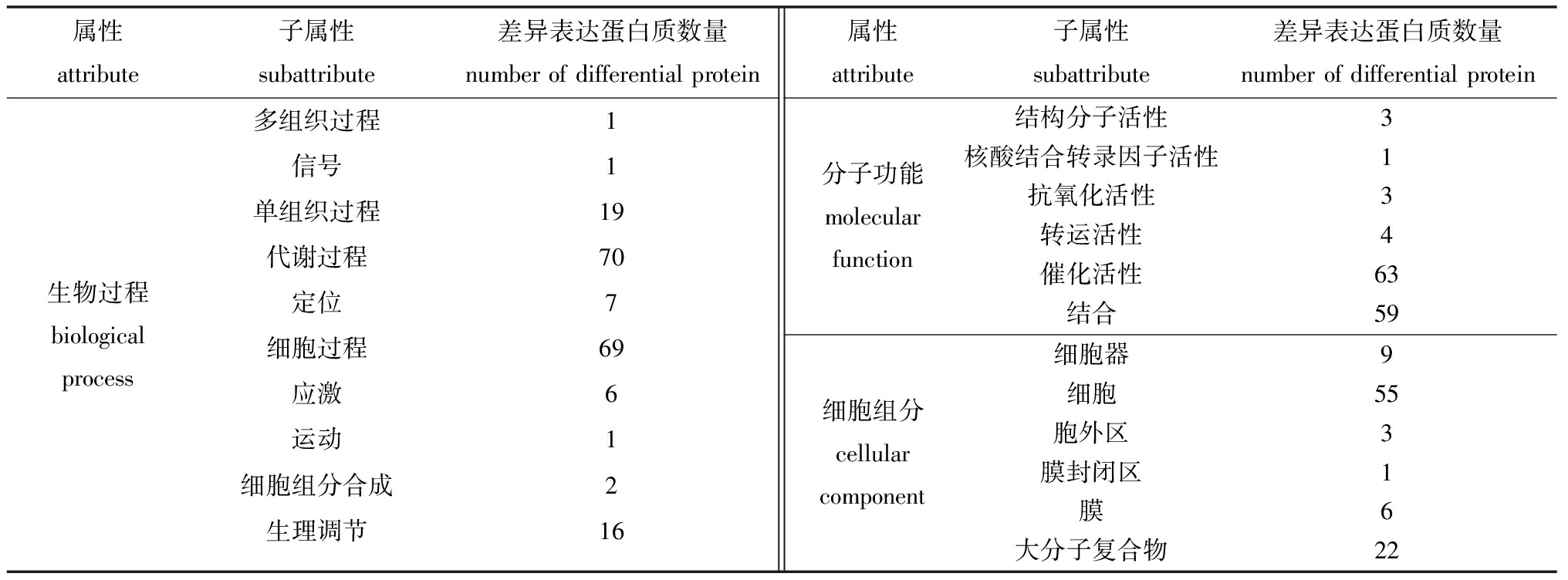
属性attribute子属性subattribute差异表达蛋白质数量numberofdifferentialprotein生物过程biologicalprocess多组织过程1信号1单组织过程19代谢过程70定位7细胞过程69应激6运动1细胞组分合成2生理调节16属性attribute子属性subattribute差异表达蛋白质数量numberofdifferentialprotein分子功能molecularfunction结构分子活性3核酸结合转录因子活性1抗氧化活性3转运活性4催化活性63结合59细胞组分cellularcomponent细胞器9细胞55胞外区3膜封闭区1膜6大分子复合物22

M—标准蛋白质;C1、C2和C3—C组3个平行样品;L1、L2和L3—L组3个平行样品。
M—standard protein; C1,C2 and C3—3 parallel samples in group C; L1,L2 and L3—3 parallel samples in group L.
图2 SDS-聚丙烯酰胺凝胶电泳
Fig.2 SDS-polyacrylamide gel electrophoresis
通过对74个差异表达蛋白质进行代谢通路分析,至少有2个差异表达蛋白质参与的代谢通路(图4)包括碳代谢、丙酮酸代谢、氨基酸生物合成、柠檬酸循环、丙酸代谢、糖酵解/糖异生、氨基酰-tRNA生物合成、乙醛酸和二羧酸代谢等。参与丙酮酸代谢、柠檬酸循环、氨基酸生物合成、氨基酰-tRNA生物合成的差异表达蛋白质如表4所示,13个参与丙酮酸代谢途径、12个参与柠檬酸循环、9个参与氨基酰-tRNA生物合成途径的差异表达蛋白质均下调;参与氨基酸生物合成途径的差异表达蛋白质中有2个上调、10个下调,这些差异表达蛋白质分别直接或间接影响着组氨酸(His)、酪氨酸(Tyr)、苯丙氨酸(Phe)、丝氨酸(Ser)、甘氨酸(Gly)、谷氨酸(Glu)、赖氨酸(Lys)和丙氨酸(Ala)等的生物合成。氨基酸合成、氨酰-tRNA合成与蛋白质翻译相关联[28]。表明MCL-T干扰了腐败希瓦氏菌的氨基酸代谢网络。此外,磷酸甘油酸激酶、丙酮酸激酶、丙酮酸脱氢酶E1组分、二氢硫辛酸脱氢酶、乌头酸水合酶、α-酮戊二酸脱氢酶E1组分、琥珀酰-CoA合成酶α亚基及苹果酸脱氢酶也处于碳代谢途径中,其表达量也显著下调。表明MCL-T是通过干扰腐败希瓦氏菌的氨基酸合成、抑制丙酮酸代谢途径和柠檬酸循环途径等从而实现抑菌作用。
表4 参与丙酮酸代谢、柠檬酸循环、氨基酸生物合成和氨酰-tRNA生物合成的差异表达蛋白质
Tab.4 Differential proteins in the pathway of pyruvate metabolism, citrate cycle, biosynthesis of amino acids and aminoacyl-tRNA biosynthesis
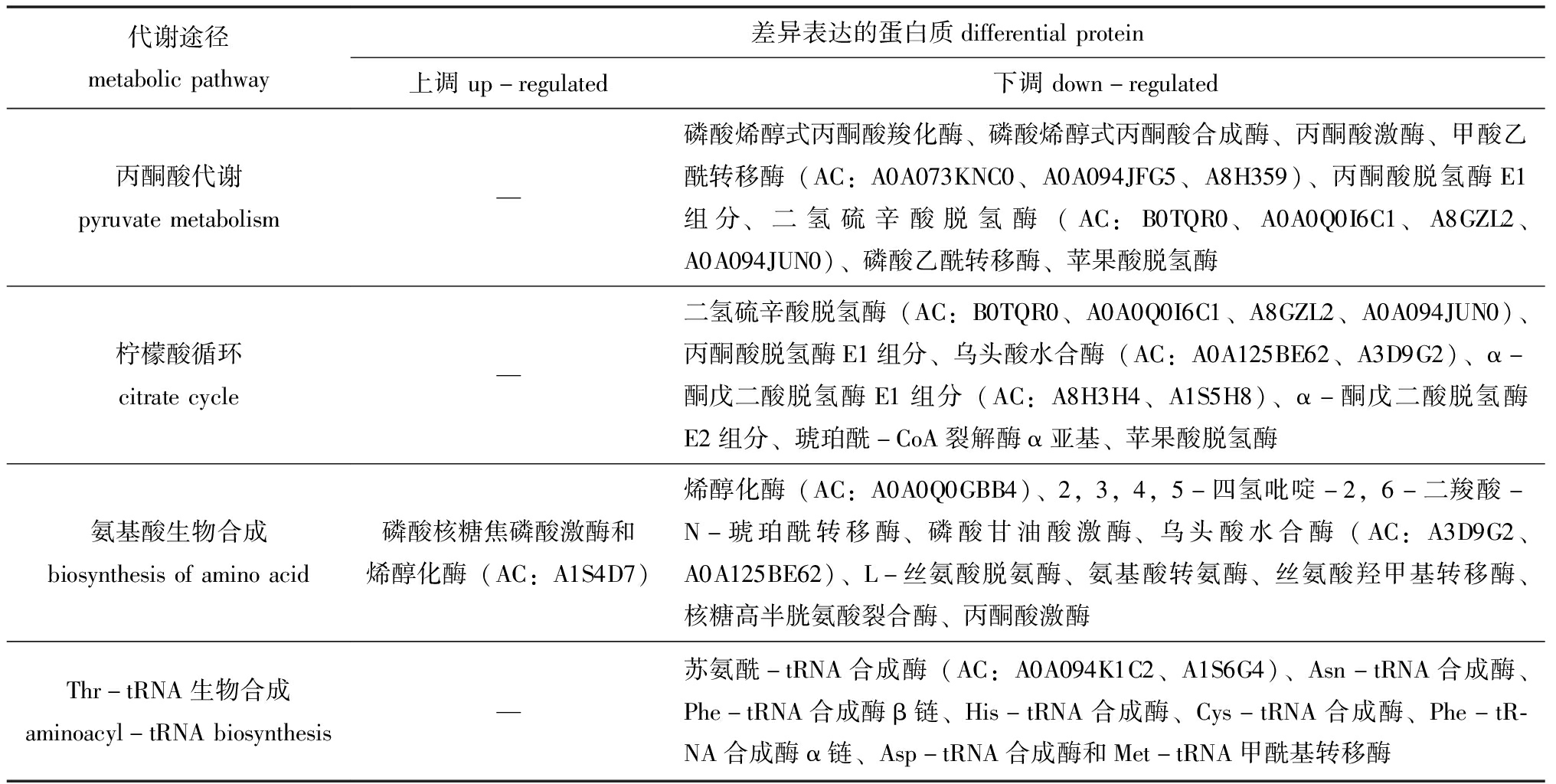
代谢途径metabolicpathway差异表达的蛋白质differentialprotein上调up-regulated下调down-regulated丙酮酸代谢pyruvatemetabolism—磷酸烯醇式丙酮酸羧化酶、磷酸烯醇式丙酮酸合成酶、丙酮酸激酶、甲酸乙酰转移酶(AC:A0A073KNC0、A0A094JFG5、A8H359)、丙酮酸脱氢酶E1组分、二氢硫辛酸脱氢酶(AC:B0TQR0、A0A0Q0I6C1、A8GZL2、A0A094JUN0)、磷酸乙酰转移酶、苹果酸脱氢酶柠檬酸循环citratecycle—二氢硫辛酸脱氢酶(AC:B0TQR0、A0A0Q0I6C1、A8GZL2、A0A094JUN0)、丙酮酸脱氢酶E1组分、乌头酸水合酶(AC:A0A125BE62、A3D9G2)、α-酮戊二酸脱氢酶E1组分(AC:A8H3H4、A1S5H8)、α-酮戊二酸脱氢酶E2组分、琥珀酰-CoA裂解酶α亚基、苹果酸脱氢酶氨基酸生物合成biosynthesisofaminoacid磷酸核糖焦磷酸激酶和烯醇化酶(AC:A1S4D7)烯醇化酶(AC:A0A0Q0GBB4)、2,3,4,5-四氢吡啶-2,6-二羧酸-N-琥珀酰转移酶、磷酸甘油酸激酶、乌头酸水合酶(AC:A3D9G2、A0A125BE62)、L-丝氨酸脱氨酶、氨基酸转氨酶、丝氨酸羟甲基转移酶、核糖高半胱氨酸裂合酶、丙酮酸激酶Thr-tRNA生物合成aminoacyl-tRNAbiosynthesis—苏氨酰-tRNA合成酶(AC:A0A094K1C2、A1S6G4)、Asn-tRNA合成酶、Phe-tRNA合成酶β链、His-tRNA合成酶、Cys-tRNA合成酶、Phe-tR-NA合成酶α链、Asp-tRNA合成酶和Met-tRNA甲酰基转移酶
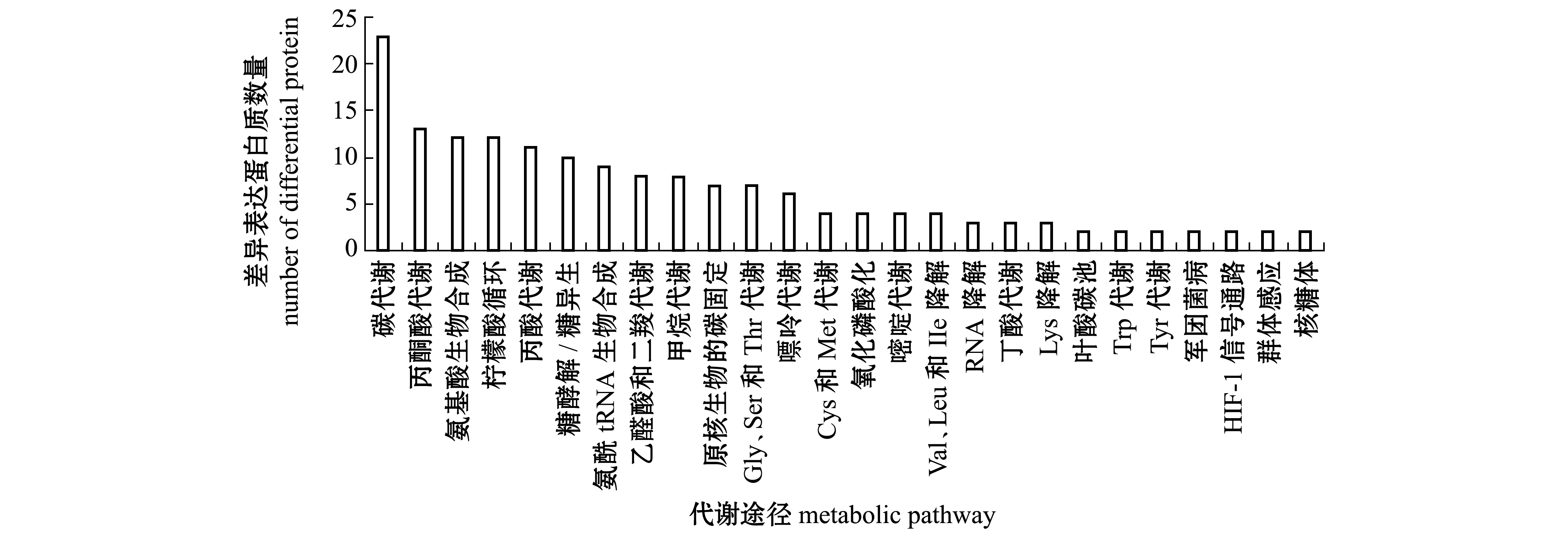
图4 至少2个差异表达蛋白质参与的代谢通路
Fig.4 Pathway with at least 2 differential proteins in Shewanella putrefaciens treated with MCL-T
3 讨论
3.1 菲律宾蛤仔产生凝集素的时间
凝集素是无脊椎动物的天然免疫因子,其在不同生理状态时体内存在的数量有较大差异。Zheng等[29]研究白斑综合征病毒侵染对虾48 h时发现,对虾C型凝集素CTL在肝胰腺中显著表达,但以副溶血性弧菌侵染则未出现此现象。Xing等[30]研究栉孔扇贝时发现,当以鳗弧菌感染12 h时,栉孔扇贝血细胞中的CTL表达量最高。Liang等[31]研究Vibrio parahaemolytics感染Onchidium reevesii时发现,其肝胰腺和神经节中CTL基因表达量从2 h时开始轻微上调,且在12 h时达最大表达量。此外,Li等[32]研究发现,菲律宾蛤仔受低温胁迫也可使其体内产生较多的CTL。本研究中发现,菲律宾蛤仔在实验室自然培育过程中,因受环境影响而逐渐死亡,并在这一过程中产生了凝集素。同时也发现,在有适量腐败希瓦氏菌刺激时,凝集素产量有增加趋势,这一结果与上述研究结果相似。
3.2 菲律宾蛤仔凝集素的抑菌作用
凝集素表面具有糖结合位点,不同凝集素往往具有不同糖特异性,从而具有抑制不同微生物的作用。Zhang等[33]研究发现,菲律宾蛤仔肝胰腺中存在有唾液酸特异性凝集素Sabl,当蛤仔受鳗弧菌侵染3 h后,该凝集素mRNA显著表达,但敲除该基因的蛤仔受鳗弧菌侵染后的存活率下降。Li等[34]研究发现,菲律宾蛤仔唾液酸特异凝集素Sabl-1具有凝集金黄色葡萄球菌、大肠埃希菌、鳗弧菌和哈维氏弧菌的作用,能显著抑制大肠杆菌生物膜的形成并抑制其生长。凝集素抑菌作用的关键一步,是与之结合,因此,明确其与细菌结合位点的特性,对于进一步研究其抑菌机制具有重要作用。本研究中,MCL-T抑制腐败希瓦氏菌生长,且MCL-T可以结合OMP,MCL-T与腐败希瓦氏菌共同孵育后,MCL-T结合腐败希瓦氏菌表面后进而抑制菌的生长。
3.3 腐败希瓦氏菌受抑制前后代谢酶表达量的变化
细菌分解代谢环境中的碳源、氮源构建其自身物质过程中需要大量的代谢酶,包括丙酮酸代谢、柠檬酸循环、氨基酸生物合成、氨基酰-tRNA生物合成等途径的多种酶。已有许多研究表明,抑菌剂起作用时会引起细菌内多种酶发生变化[35]。本研究中,腐败希瓦氏菌受菲律宾蛤仔凝集素作用前后部分酶的表达量出现了显著变化,其中,包括磷酸甘油酸激酶、丙酮酸激酶、丙酮酸脱氢酶复合物、丝氨酸羟甲基转移酶、氨基酸转氨酶、Thr-tRNA合成酶、Asn-tRNA合成酶、Phe-tRNA合成酶、His-tRNA合成酶、Cys-tRNA合成酶、Phe-tRNA合成酶、Asp-tRNA合成酶和Met-tRNA甲酰基转移酶等,这些酶参与了腐败希瓦氏菌多种代谢途径。在厌氧条件下,糖主要通过糖酵解途径中的1,3-二磷酸甘油酸和磷酸烯醇式丙酮酸分别转变为3-磷酸甘油酸和丙酮酸的过程中产生ATP,催化这两个过程的是磷酸甘油酸激酶和丙酮酸激酶。本研究中,这两种酶在腐败希瓦氏菌中的表达量均显著下调,表明其在厌氧条件下通过糖代谢,产生ATP受到抑制。丙酮酸脱氢酶复合物是催化丙酮酸转变为乙酰-CoA的关键酶,乙酰-CoA是生物体中脂肪酸从头合成的必要原料,其量的减少影响生物膜的生成,进而影响生物体的生长。细菌细胞壁中含有肽聚糖,其中含有大量的甘氨酸残基。丝氨酸羟甲基转移酶催化丝氨酸与甘氨酸的相互转变,当细菌中甘氨酸含量不足时,会抑制细胞壁肽聚糖的生成,使细菌细胞不完整,导致细菌易受环境不利因素影响并致其死亡。氨基酸转氨酶是多种酮酸转变为相应氨基酸的催化酶,氨酰-tRNA合成酶是催化蛋白质生物合成过程中相应氨酰-tRNA合成的催化剂,Met-tRNA甲酰基转移酶是催化Met-tRNA转变为绝大多数蛋白质生物合成所需要的起始肽链N-末端原料甲酰-甲硫氨酰-tRNA,当蛋白质合成原料——氨基酸、氨酰-tRNA、甲酰-Met-tRNA合成受抑制时,细菌因蛋白质缺失而停止生长直到死亡。这些结果表明,MCL-T改变了腐败希瓦氏菌基础代谢水平,从而使得腐败希瓦氏菌生长繁殖受到影响。这一结果与Pang等[37]、Zhang等[38]研究中得出的微生物受到不利因素影响会改变其基础代谢水平的结论一致。
4 结论
1)MCL-T具有抑制腐败希瓦氏菌的作用。MCL-T结合腐败希瓦氏菌外膜蛋白,是实现抑制作用的第一步,且MCL-T与腐败希瓦氏菌外膜蛋白的结合具有浓度依赖性。
2)MCL-T作用于腐败希瓦氏菌后,参与代谢途径的部分酶差异表达,包括参与氨基酸生物合成途径的磷酸核酶焦磷酸激酶、烯醇化酶的表达量上调,参与丙酮酸代谢途径、柠檬酸循环途径、氨基酰-tRNA生物合成途径、碳代谢途径的蛋白质表达量均下调。
[1] YANG Z Q,TAO X Y,ZHANG H,et al.Isolation and characterization of virulent phages infecting Shewanella baltica and Shewanella putrefaciens,and their application for biopreservation of chilled channel catfish(Ictalurus punctatus)[J].International Journal of Food Microbiology,2019,292:107-117.
[2] 张雯,卞丹,杨冬英,等.大黄鱼腐败菌的低温致腐性及相互作用[J].福州大学学报(自然科学版),2017,45(5):748-753.
ZHANG W,BIAN D Y,YANG D,et al.Spoilage ability and interactions between spoilage bacteria isolated from large yellow croaker in low temperature[J].Journal of Fuzhou University(Natural Science Edition),2017,45(5):748-753.(in Chinese)
[3] 谢晶,叶晶鑫,杨胜平,等.腐败希瓦氏菌和荧光假单胞菌对冷藏凡纳滨对虾虾汁品质的影响[J].食品科学,2018,39(3):1-6.
XIE J,YE J X,YANG S P,et al.Evaluation of the spoilage potential of Shewanella putrefaciens and Pseudomonas fluorescens on Pacific white shrimp(Litopenaeus vannamei)juice during cold storage[J].Food Science,2018,39(3):1-6.(in Chinese)
[4] 谢晶,程颖,杨胜平,等.腐败希瓦氏菌对凡纳滨对虾氨基酸及生物胺含量的影响[J].中国食品学报,2018,18(1):169-175.
XIE J,CHENG Y,YANG S P,et al.Effect of Shewanella putrefaciens on the amino acids metabolism and biogenic amines production in Litopenaeus vannamei[J].Journal of Chinese Institute of Food Science and Technology,2018,18(1):169-175.(in Chinese)
[5] 代悦,魏旭青,孙彤,等.ZnO薄膜微观形貌对腐败希瓦氏菌生物被膜形成的影响[J].中国食品学报,2019,19(11):170-178.
DAI Y,WEI X Q,SUN T,et al.Effect of the microtopography of ZnO films on the formation of Shewanella putrefaciens biofilm[J].Journal of Chinese Institute of Food Science and Technology,2019,19(11):170-178.(in Chinese)
[6] 郑洪伟,冯佳,吴杰,等.酸解法制备五倍子抗腐败希瓦氏菌活性物质的工艺[J].食品研究与开发,2020,41(2):40-44.
ZHENG H W,FENG J,WU J,et al.Process of antibacterial substances from Galla chinensis against Shewanella putrefaciens by acid hydrolysis[J].Food Research and Development,2020,41(2):40-44.(in Chinese)
[7] ZHANG N N,LAN W Q,WANG Q,et al.Antibacterial mechanism of Ginkgo biloba leaf extract when applied to Shewanella putrefaciens and Saprophytic staphylococcus[J].Aquaculture and Fisheries,2018,3(4):163-169.
[8] WRIGHT M H,SHALOM J,MATTHEWS B,et al.Terminalia ferdinandiana exell:extracts inhibit Shewanella spp.growth and prevent fish spoilage[J].Food Microbiology,2019,78:114-122.
[9] 孟玉霞.天然植物精油对冷藏海水养殖鱼类特定腐败菌的抑制作用及保鲜效果研究[D].大连:大连海洋大学,2018.
MENG Y X.Antimicrobial activities of essential oils against special spoilage bacteria isolated from marine-farming fish and evaluation of their fresh-keeping effects[D].Dalian:Dalian Ocean University,2018.(in Chinese)
[10] LIU X B,LI X M,PENG M T,et al.A novel C-type lectin from spotted knifejaw,Oplegnathus punctatus possesses antibacterial and anti-inflammatory activity[J].Fish & Shellfish Immunology,2019,92:11-20.
[11] HUANG X,HAN K K,LI T T,et al.Novel L-type lectin from fresh water prawn,Macrobrachium rosenbergii participates in antibacterial and antiviral immune responses[J].Fish & Shellfish Immunology,2018,77:304-311.
[12] ZHANG X W,MAN X,HUANG X,et al.Identification of a C-type lectin possessing both antibacterial and antiviral activities from red swamp crayfish[J].Fish & Shellfish Immunology,2018,77:22-30.
[13] BULGAKOV A A,PARK K I,CHOI K S,et al.Purification and characterisation of a lectin isolated from the Manila clam Ruditapes philippinarum in Korea[J].Fish & Shellfish Immunology,2004,16(4):487-499.
[14] KIM Y M,PARK K I,CHOI K S,et al.Lectin from the Manila clam Ruditapes philippinarum is induced upon infection with the protozoan parasite Perkinsus olseni[J].Journal of Biological Chemistry,2006,281(37):26854-26864.
[15] KANG Y S,KIM Y M,PARK K I,et al.Analysis of EST and lectin expressions in hemocytes of Manila clam(Ruditapes philippinarum)(Bivalvia:Mollusca)infected with Perkinsus olseni[J].Developmental & Comparative Immunology,2006,30(12):1119-1131.
[16] KIM J Y,KIM Y M,CHO S K,et al.Noble tandem-repeat galectin of Manila clam Ruditapes philippinarum is induced upon infection with the protozoan parasite Perkinsus olseni[J].Developmental & Comparative Immunology,2008,32(10):1131-1141.
[17] LI C H,YU S X,ZHAO J M,et al.Cloning and characterization of a sialic acid binding lectins(SABL)from Manila clam Venerupis philippinarum[J].Fish & Shellfish Immunology,2011,30(4/5):1202-1206.
[18] 佟长青,李琦,曲敏,等.菲律宾蛤仔凝集素抑菌机制的研究[J].大连海洋大学学报,2014,29(5):508-513.
TONG C Q,LI Q,QU M,et al.Antibacterial mechanism of short-neck clam Ruditapes philippinarum lectin(MCL-T)[J].Journal of Dalian Ocean University,2014,29(5):508-513.(in Chinese)
[19] LI D D,NIE H T,JAHAN K,et al.Expression analyses of C-type lectins(CTLs)in Manila clam under cold stress provide insights for its potential function in cold resistance of Ruditapes philippinarum[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2020,230:108708.
[20] ZHANG J N,ZHANG Y F,ZHANG L B,et al.A sialic acid-binding lectin with bactericidal and opsonic activities from Ruditapes philippinarum[J].Fish & Shellfish Immunology,2019,94:72-80.
[21] LI D D,NIE H T,DONG S S,et al.Molecular cloning and expression analysis of C-type lectin(RpCTL)in Manila clam Ruditapes philippinarum after lipopolysaccharide challenge[J].Fish & Shellfish Immunology,2019,86:981-993.
[22] 佟长青.两种海洋双壳贝类凝集素及其抑菌机制的研究[D].哈尔滨:东北林业大学,2013.
TONG C Q.Two lectins from marine bivalve mollusks and their antibacterial mechanism[D].Harbin:Northeast Forestry University,2013.(in Chinese)
[23] 刘帅,赵冠华,杨晴晴,等.青蛤凝集素CSL对酿酒酵母细胞形态的影响[J].食品工业科技,2017,38(24):114-119.
LIU S,ZHAO G H,YANG Q Q,et al.Effect of a lectin CSL on the morphology of yeast Saccharomyces cerevisiae[J].Science and Technology of Food Industry,2017,38(24):114-119.(in Chinese)
[24] MOLCHANOVA V,CHIKALOVETS I,LI W,et al.New GlcNAc/GalNAc-specific lectin from the ascidian Didemnum ternatanum[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2005,1723(1/2/3):82-90.
[25] 翟兴月,王庆辉,赵冠华,等.非标记定量蛋白质组方法分析鲟鱼肽抗D-半乳糖导致的小鼠衰老作用的研究[J].食品工业科技,2019,40(3):290-295.
ZHAI X Y,WANG Q H,ZHAO G H,et al.Label-free quantitative proteomic analysis of Acipenser schrenki Brandt peptides on aging mice induced by D-galactose[J].Science and Technology of Food Industry,2019,40(3):290-295.(in Chinese)
[26] 胡晓攀.细菌蛋白质组成的氨基酸代谢流量分析[D].武汉:华中农业大学,2013.
HU X P.Analysis of amino acid metabolic flux for bacterial protein composition[D].Wuhan:Huazhong Agricultural Univerisity,2013.(in Chinese)
[27] ZHENG J B,MAO Y,SU Y Q,et al.Identification and functional characterization of a novel C-type lectin from the kuruma shrimp,Marsupenaeus japonicas[J].Biochemical and Biophysical Research Communications,2020,530(3):547-553.
[28] XING J,LIU W J,TAN Y M,et al.Production and application of monoclonal antibodies against C-type lectins in scallop Chlamys farreri[J].Aquaculture,2019,512:734299.
[29] LIANG W,WU R Y,YANG T Z,et al.Effect of pathogenic bacteria on a novel C-type lectin,hemocyte and superoxide dismutase/alkaline phosphatase activity in Onchidium reevesii[J].Fish & Shellfish Immunology,2020,102:185-194.
[30] LI D,NIE H,JAHAN K,et al.Expression analyses of C-type lectins(CTLs)in Manila clam under cold stress provide insights for its potential function in cold resistance of Ruditapes philippinarum[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2020,230:108708.
[31] ZHANG J,ZHANG Y,ZHANG L,et al.A sialic acid-binding lectin with bactericidal and opsonic activities from Ruditapes philippinarum[J].Fish & Shellfish Immunology,2019,94:72-80.
[32] LI S Q,RUAN Z L,YANG X Y,et al.Immune recognition,antimicrobial and opsonic activities mediated by a sialic acid binding lectin from Ruditapes philippinarum[J].Fish & Shellfish Immunology,2019,93:66-72.
[33] 马伟虎,程红刚,耿楠楠,等.香豆素对灰葡萄孢霉菌的生长代谢及保护酶活性的影响[J].西北林学院学报,2020,35(5):134-138.
MA W H,CHENG H G,GENG N N,et al.Effects of coumarin on growth metabolism and protective enzyme activities of Botrytis cinerea[J].Journal of Northwest Forestry University,2020,35(5):134-138.(in Chinese)
[34] 葛达娥,魏照辉,图尔荪阿依·图尔贡,等.丁香酚对蓝莓链格孢霉的抑制作用[J].食品科学,2020,41(19):68-73.
GE D E,WEI Z H,TURGUN T,et al.Inhibitory effect of eugenol on Alternaria sp.isolated from blueberry[J].Food Science,2020,41(19):68-73.(in Chinese)
[35] PANG X Y,CHEN L,YUK H G.Stress response and survival of Salmonella enteritidis in single and dual species biofilms with Pseudomonas fluorescens following repeated exposure to quaternary ammonium compounds[J].International Journal of Food Microbiology,2020,325:108643.