虾夷扇贝Patinopecten yessoensis是中国重要的贝类经济养殖品种之一,据统计,2019年中国养殖贝类产量达1 457万t[1]。活品虾夷扇贝作为一种高端海产品,其品质一直备受关注,对捕后活品虾夷扇贝品质评价模式与变化机制的探究有助于提升产品品质,促进贝类产业发展。从海上采捕至陆基加工净化前为贝类的品质易逝期(quality determination period, QDP),根据本团队多年的调研与实践发现,该阶段的环境变化及处置方式对于后续活品贝类的品质贮藏稳定性具有十分重要的影响,且存在明显的延迟效应[2-3]。因此,有必要对品质易逝期虾夷扇贝活品的代谢特征与品质变化进行探究。
扇贝的风味品质与其生理状态密切相关,在活品贝类市场,扇贝开口率、闭合灵敏度及外套膜缩边等常常能够反映扇贝质量的好坏[4]。生化指标如pH、糖原、ATP关联物、K值等也被广泛用于贝类活力的评价[5-6]。此外,游离氨基酸、水溶性蛋白及免疫因子等亦可作为扇贝品质评价指标[7-9]。然而,这些传统的感官评价或单一理化指标往往灵敏度不够、品种针对性不强。目前,尚缺乏分子水平上虾夷扇贝代谢特征的全面分析。
代谢组学(metabolomics)是考察生物细胞、组织、器官或者生物体在不同状态下小分子物质种类、数量及其变化规律的科学[10]。其主要研究手段包括核磁共振谱(NMR)、气相色谱-质谱(GC-MS)和液相色谱-质谱(LC-MS)等方法[11],其中,超高效液相色谱-质谱(UPLC-MS)具有灵敏度高、选择性好、信息丰富等优点,被广泛应用于代谢组学研究中[12]。多元统计分析方法用于代谢组学的数据降维与信息挖掘,主要包括无监督的主成分分析法(PCA)与有监督的偏最小二乘法判别分析(PLS-DA)、正交偏最小二乘法判别分析(OPLS-DA)等[13]。近年来,代谢组学作为一种行之有效的方法应用于水产品的生理变化研究,如Pilditch等[14]研究了温度波动和食物供应对幼龄海扇贝Placopecten magellanicus生长和代谢的影响;Chen等[15]运用代谢组学方法研究了半无水保存期间栉孔扇贝Chlamys farreri的生理变化;Rochfort等[16]发现代谢组学方法可能有助于确定贻贝的产地;刘佳琳等[17]研究了褐牙鲆Paralichthys olivaceus幼鱼全组织在低盐胁迫后的代谢组变化。
本研究中,以虾夷扇贝为研究对象,利用UPLC-MS代谢组学技术,将捕后早期设定为36 h之内,分析了品质易逝期湿藏条件下虾夷扇贝闭壳肌的差异代谢物及代谢途径,探索了湿藏条件下活品虾夷扇贝的代谢模式,以期为活品贝类代谢组数据的准确分析提供参考依据。
1 材料与方法
1.1 材料
试验用虾夷扇贝于2019年12月购自大连市长兴水产品市场,壳高为(11.37±0.30)cm,壳长为(11.01±0.31)cm,壳宽为(2.27±0.08)cm,均为当日到货,采用泡沫箱密封(碎冰降温),于1 h内运至实验室,立即进行分选和贮藏处理,剔除活力弱或死亡的虾夷扇贝。试验在辽宁省水产设施养殖与装备技术工程研究中心循环海水系统中进行。
仪器设备:精密电子天平(BS224S型,北京赛多利斯仪器系统有限公司);离心机(Z326K型,德国HERMLE Labortechnik GmbH公司);超高压液相色谱仪(Agilent 1290 Infinity LC,美国Agilent公司);质谱仪(Triple TOF 5600,美国AB SCIEX公司);Waters ACQUITY UPLC BEH Amide(2.1 mm×100 mm,1.7 μm)色谱柱(美国Waters公司);PH计(PB-10,德国Sartori-us公司);水纯化系统(Milli-Q,美国Millipore公司)。
试剂:乙腈、甲醇、氨水为色谱级(德国Merck公司);乙酸铵为色谱级(德国Sigma公司)。
1.2 方法
1.2.1 试验设计及采样处理 运抵至实验室的虾夷扇贝活体原料处于急骤应激状态,立即置于循环海水系统中进行24 h缓冲,循环海水为经3次沉淀的自然海水,海水体积为0.91 m3,溶解氧质量浓度为6.3 mg/L,温度为6.9 ℃。缓冲后的扇贝作为模拟捕后的初始状态,即湿藏0 h,设为对照组(A);在海水中继续湿藏36 h,可看作虾夷扇贝品质易逝期阶段,设为湿藏组(C)。每组取10只扇贝用于代谢组学分析。此外,分别于湿藏0、3、6、12、24、36 h,从各组每个时间点取3只扇贝用于pH和糖原含量分析。
活贝样品经手工开壳,将闭壳肌与其他软体组织分离,取闭壳肌中心部位肌肉,立即用液氮处理后于-80 ℃超低温冰箱中保存。
1.2.2 生化指标的测定 参考田元勇等[18]的方法。试验设3个重复,每只扇贝取2.0 g虾夷扇贝闭壳肌,加入浓度20 mmol/L的碘乙酸钠10 mL,冰浴下用玻璃棒捣碎,静置25 min,冰浴条件下测定闭壳肌pH。
参考刘慧慧等[19]的方法。试验设3个重复,每只扇贝取2.0 g 闭壳肌,加入质量分数30%的氢氧化钾溶液,沸水浴中加热20 min,冷却后加入20 mL 无水乙醇,并在3 000 g 条件下离心15 min,取沉淀。采用蒽酮比色法于620 nm下测定吸光度,计算葡萄糖含量,糖原含量为葡萄糖含量的1.11倍。
1.2.3 代谢组学分析
1)样品处理。试验设10个重复,每只扇贝样品取100 mg闭壳肌,在液氮下研磨后,加入800 μL甲醇-乙腈-水(体积比为2∶2∶1)涡旋混匀,4 ℃下超声2次,每次30 min,然后在-20 ℃下孵育1 h沉淀蛋白质,4 ℃、13 000 g条件下离心15 min,取上清液冻干后于-80 ℃超低温冰箱中保存备用。质谱分析时加入100 μL乙腈水溶液(乙腈与水的体积比为1∶1)复溶,4 ℃下涡旋振荡,以14 000 g离心15 min,取上清液进行分析。为了对本次试验进行质量控制,制备了所有样品等量混合的样本(QC样本),用于平衡色谱-质谱系统及测定仪器状态,并用于整个试验过程中系统稳定性的评价。
2)LC-MS/MS分析。
色谱分离:色谱流动相A为水+25 mmol/L乙酸铵+25 mmol/L氨水,流动相B为乙腈,色谱梯度洗脱程序如表1所示。整个分析过程中样品置于4 ℃自动进样器中,进样量为10 μL,Waters Acquity BEH Amide(2.1 mm×100 mm,1.7 μm)色谱柱,柱温为25 ℃,流速为 0.3 mL/min;样本队列中插入 QC 样品,用于监测和评价系统的稳定性及试验数据的可靠性。
表1 HPLC梯度洗脱程序
Tab.1 Gradient elution program for HPLC
时间/mintime流动相A/%mobilephaseA流动相B/%mobilephaseB05950.55957.035659.0604010.0604011.159516.0595
质谱采集:采用电喷雾电离(ESI)进行正离子和负离子模式检测。条件如下:干燥气为60,辅助加热气为60,气帘气为30,毛细管温度为600 ℃,离子喷雾空载电压为±5 500 V;扫描范围为60 000~1 200 000(相对分子质量),扫描积累时间为0.15 s;二级质谱采用高灵敏度模式,扫描范围为25 000~1 200 000(相对分子质量),扫描积累时间为0.03 s,去簇电压为±60 V,碰撞能量为30 eV,IDA模式,同位素排除4 000之内,离子监测周期6。
1.3 数据处理
UPLC-MS分析的原始数据经ProteoWizard转换成.mzXML格式,然后采用XCMS程序进行峰对齐、保留时间校正和提取峰面积。对XCMS提取得到的数据,删除组内缺失值>50%的离子峰,应用软件SIMCA-P 14.1(Umetrics,Umea,Sweden)进行模式识别,数据经Pareto-scaling预处理后,进行多元统计分析,包括无监督的主成分分析(PCA)及有监督的偏最小二乘法判别分析(PLS-DA)、正交偏最小二乘法判别分析(OPLS-DA)等。代谢物结构鉴定通过峰的保留时间、精确质量数匹配(<25×10-6)和MS/MS二级谱图匹配的方式,检索实验室数据库进一步确认代谢物。代谢通路解析通过代谢通路数据库KEGG Pathways(KEGG,www.genome.jp/kegg)进行。
2 结果与分析
2.1 pH及糖原含量
从图1可见,品质易逝期湿藏条件下活品虾夷扇贝闭壳肌的pH变化不大,为7.29~7.38,糖原也维持在较高水平,为25.5~31.3 mg/g,说明扇贝状态较好,品质较高。
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences.
图1 品质易逝期湿藏条件下虾夷扇贝闭壳肌的pH与糖原含量
Fig.1 Levels of pH and glycogen of Yesso scallop Patinopecten yessoensis under immersion during QDP
2.2 代谢组学分析
2.2.1 多元统计分析 通过LC-MS/MS质谱检测,正离子模式下共获得了8 844个峰,在负离子模式下共获得了8 692个峰。将QC样本正、负离子检测模式下的质谱总离子流图(TIC)分别进行谱图叠加比较,各色谱峰的响应强度和保留时间基本重叠(图2(a)、(b));将所有试验样本和QC样本提取得到的峰,经Pareto-scaling处理后进行PCA分析,经7次循环交互验证得到PCA模型,图中的QC样品紧密聚集,说明整个试验过程中仪器误差引起的变异较小,试验数据可靠(图2(c)、(d))。

图2 QC样本的TIC重叠图谱与A、C和QC样本的PCA得分图
Fig.2 TIC overlap map of QC samples and PCA score plot of samples A, C and QC
去除QC样本,将对照组(A)与湿藏组(C)的样品进行PCA分析,结果显示,正负离子模式下,所有样本均出现在Hotelling T 2 95%置信区间的椭圆内,说明两组样本不存在异常值(图3),然而在PCA下组间样本并无良好的区分。采用有监督的偏最小二乘法判别分析(PLS-DA)和正交偏最小二乘判别分析(OPLS-DA)对两组样本进行进一步分析。结果显示,在两种模式下,虾夷扇贝A、C样本均发生组内聚集且组间分离趋势,且在OPLS-DA模式下该趋势更加明显(图4(a)、(c)和图5(a)、(c)),这说明海水湿藏36 h后虾夷扇贝的代谢模式发生改变。
图3 A组和C组样本的PCA得分图
Fig.3 PCA score plot of groups A and C
置换检验用于评价模型是否发生过拟合(图4(b)、(d)和图5(b)、(d)),当![]() <0.05时,表明该模型未发生过拟合[20],其中,虾夷扇贝的PLS-DA模型发生过拟合,而OPLS-DA模型可靠。两种模型分别经7次循环交互验证,参数R2和Q2用于判断模型的稳定性,R2X、R2Y表示模型解释率,Q2表示模型预测能力[21]。理论上,R2、Q2数值越接近1说明模型越好,通常情况下R2、Q2高于0.5较好,0.2亦可接受。模型评价参数见表2,因此,后续可选用OPLS-DA模型进行差异代谢物的筛选分析。
<0.05时,表明该模型未发生过拟合[20],其中,虾夷扇贝的PLS-DA模型发生过拟合,而OPLS-DA模型可靠。两种模型分别经7次循环交互验证,参数R2和Q2用于判断模型的稳定性,R2X、R2Y表示模型解释率,Q2表示模型预测能力[21]。理论上,R2、Q2数值越接近1说明模型越好,通常情况下R2、Q2高于0.5较好,0.2亦可接受。模型评价参数见表2,因此,后续可选用OPLS-DA模型进行差异代谢物的筛选分析。
表2 PLS-DA与OPLS-DA模型的评价参数
Tab.2 Parameters of PLS-DA and OPLS-DA
模型model样品比较samplecomparison离子模式ionmodeR2XR2YQ2R2interceptQ2interceptPLS-DAC与A正0.4610.9940.7740.9940.614负0.4840.9950.7790.9920.372OPLS-DAC与A正0.4610.9940.2920.994-0.028负0.4840.9950.5840.992-0.154
注:R2X、R2Y为模型解释率;Q2为模型预测能力;![]() 和
和![]() 分别为R2和Q2回归直线与Y轴的截距。
分别为R2和Q2回归直线与Y轴的截距。
Note: R2X and R2Y,the interpretation rate of model; Q2,the predictive ability of model; ![]() Y-axis intercept of regression line of R2 and Q2, respectively.
Y-axis intercept of regression line of R2 and Q2, respectively.
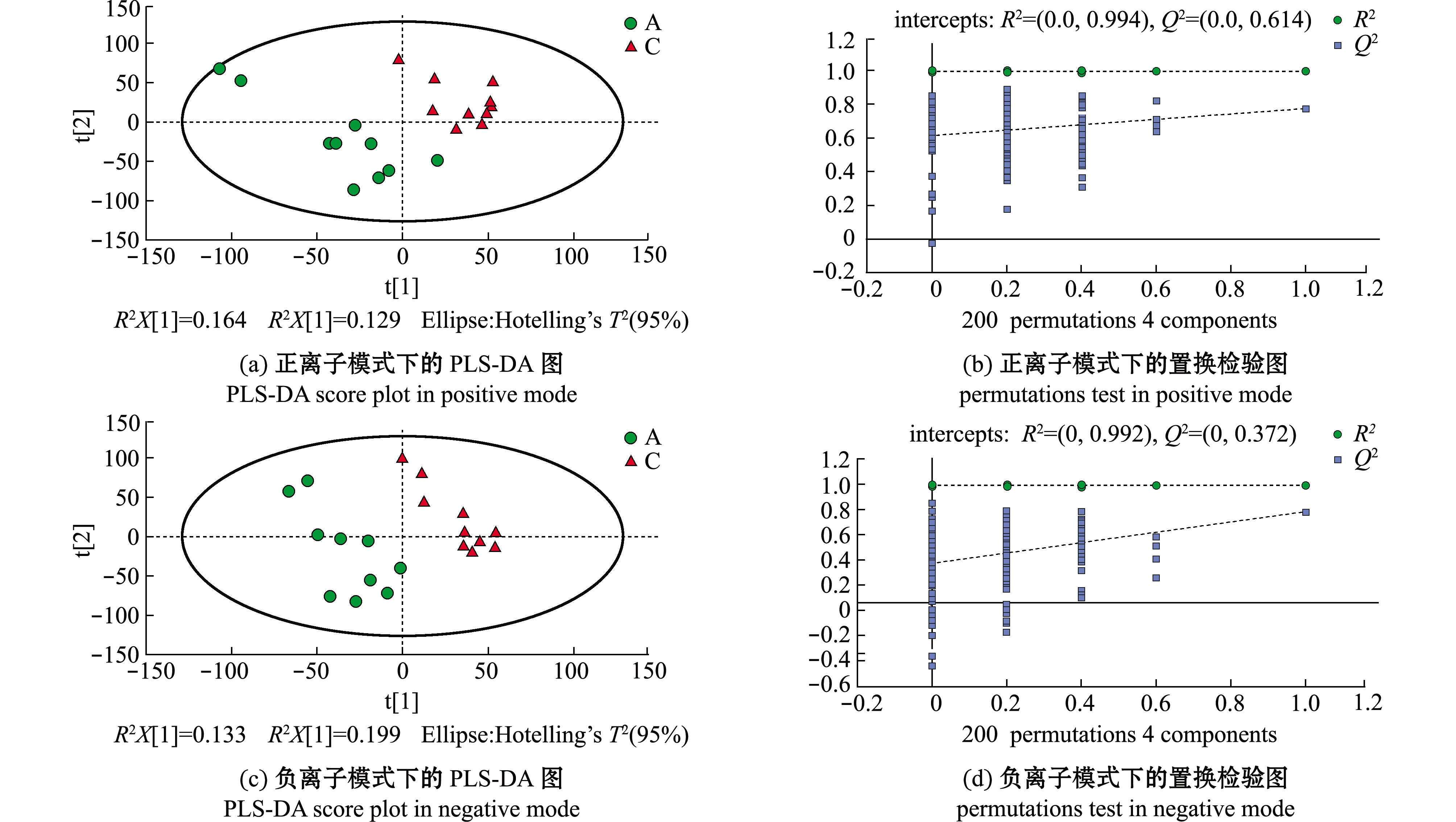
图4 A组和C组的PLS-DA得分图和置换检验图
Fig.4 PLS-DA score plot and the permutations test of groups A and C
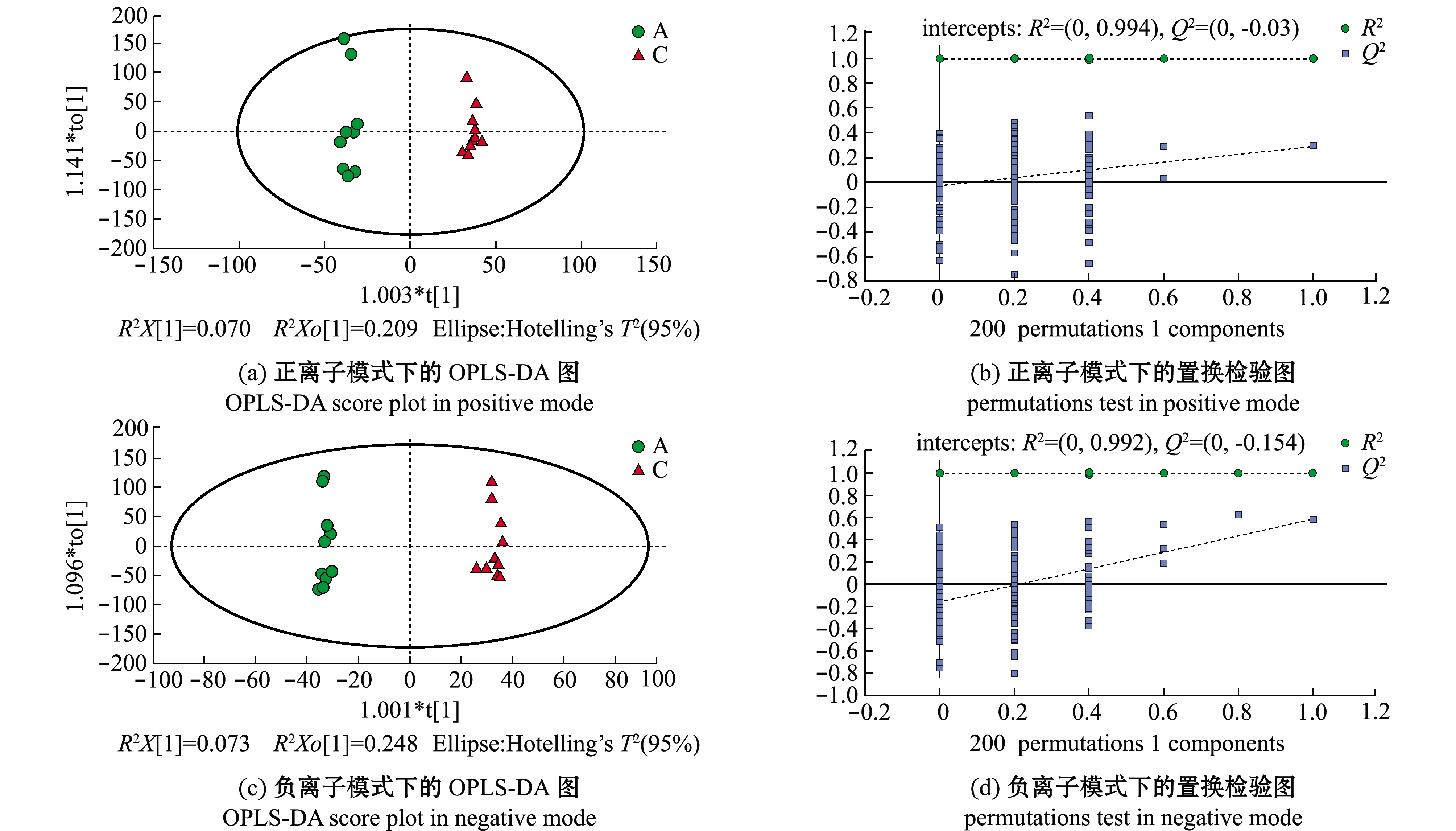
图5 A组和C组的OPLS-DA得分图和置换检验图
Fig.5 OPLS-DA score plot and the permutations test of groups A and C
2.2.2 差异代谢物的鉴定与通路分析 根据OPLS-DA 模型得到的变量权重值(variable importance for the projection, VIP)来衡量各代谢物的表达模式对各组样本分类判别的影响强度和解释能力,挖掘具有生物学意义的差异代谢物。本试验中,以VIP>1作为筛选标准,同时结合单变量分析方法差异倍数分析(fold change analysis,FC)和Student’s T,检验显示两组样本间代谢物变化的显著性,以 FC>2 或 FC<0.5 且 P<0.05 作为筛选标准,共筛选出7个显著性差异的代谢物(表3),包括二十二烷酸(behenic acid)、酪胺(tyramine)、脯氨酰谷氨酸(prolyl-glutamate)、二磷酸腺苷葡萄糖(ADP-glucose)、尿苷5-二磷酸(uridine 5′-diphosphate, UDP)、3-磷酸丝氨酸(3-phosphoserine)和柠檬酸(citrate)。
表3 湿藏36 h 虾夷扇贝的显著性差异代谢物
Tab.3 Discriminate metabolites of Yesso scollap Patinopecten yessoensis storage in immersion for 36 h
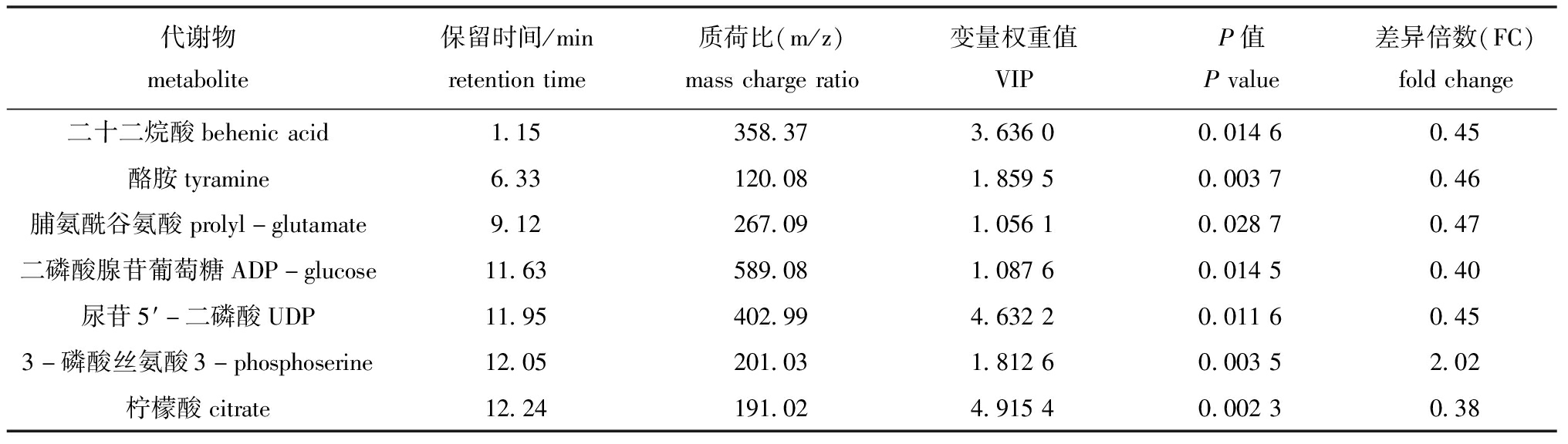
代谢物metabolite保留时间/minretentiontime质荷比(m/z)masschargeratio变量权重值VIPP值Pvalue差异倍数(FC)foldchange二十二烷酸behenicacid1.15358.373.63600.01460.45酪胺tyramine6.33120.081.85950.00370.46脯氨酰谷氨酸prolyl-glutamate9.12267.091.05610.02870.47二磷酸腺苷葡萄糖ADP-glucose11.63589.081.08760.01450.40尿苷5′-二磷酸UDP11.95402.994.63220.01160.453-磷酸丝氨酸3-phosphoserine12.05201.031.81260.00352.02柠檬酸citrate12.24191.024.91540.00230.38
各差异代谢物湿藏后的变化趋势如图6所示,其中,3-磷酸丝氨酸发生上调,其余6个差异代谢物则为下调。KEGG通路分析表明,三羧酸循环(TCA cycle)是最容易受到影响的代谢通路(图7)。
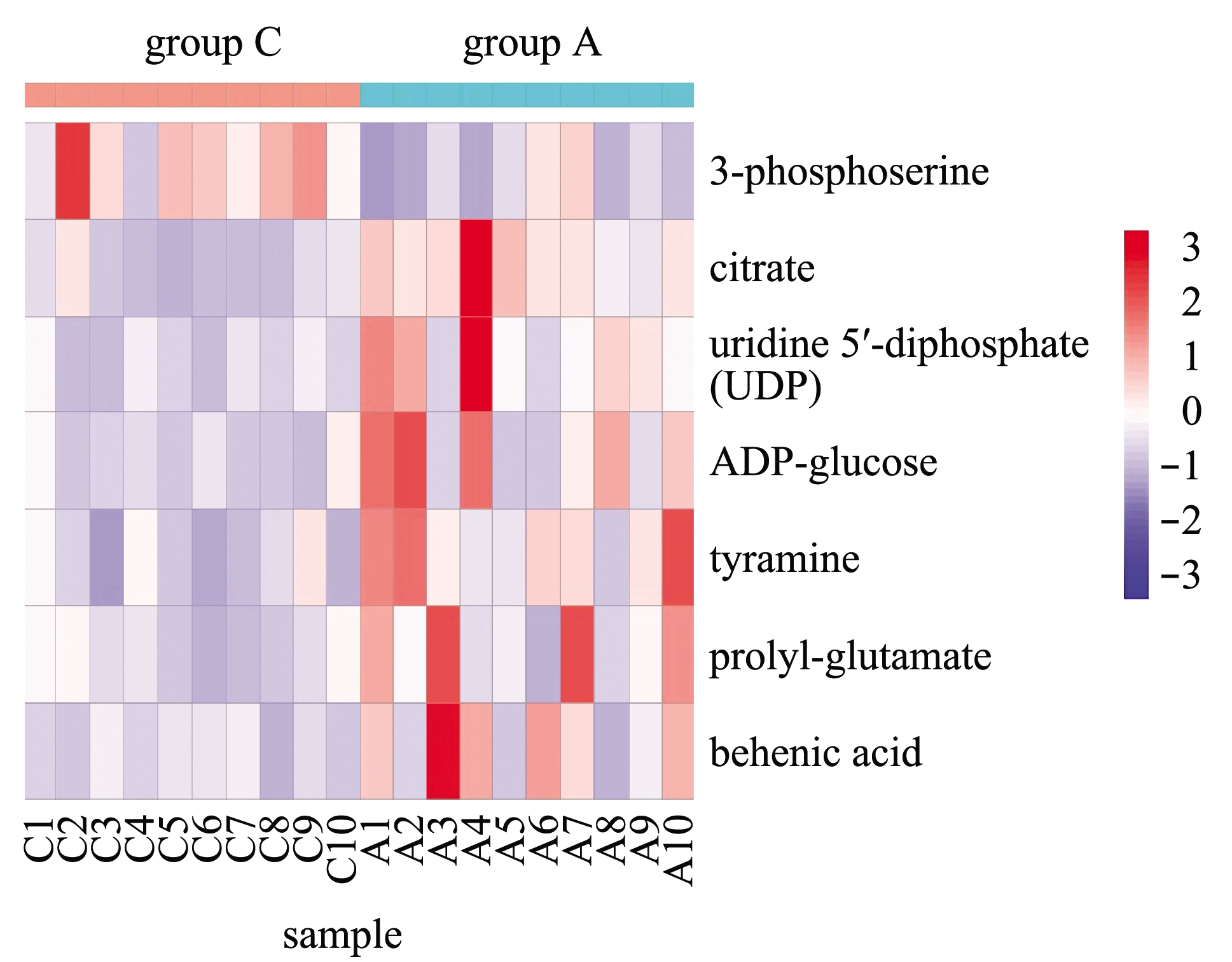
图6 对照组(A)和湿藏组(C)显著性差异代谢物热图
Fig.6 A heat map demonstrating the trend of variation discriminate metabolites in the control group(A)and immersed group(C)
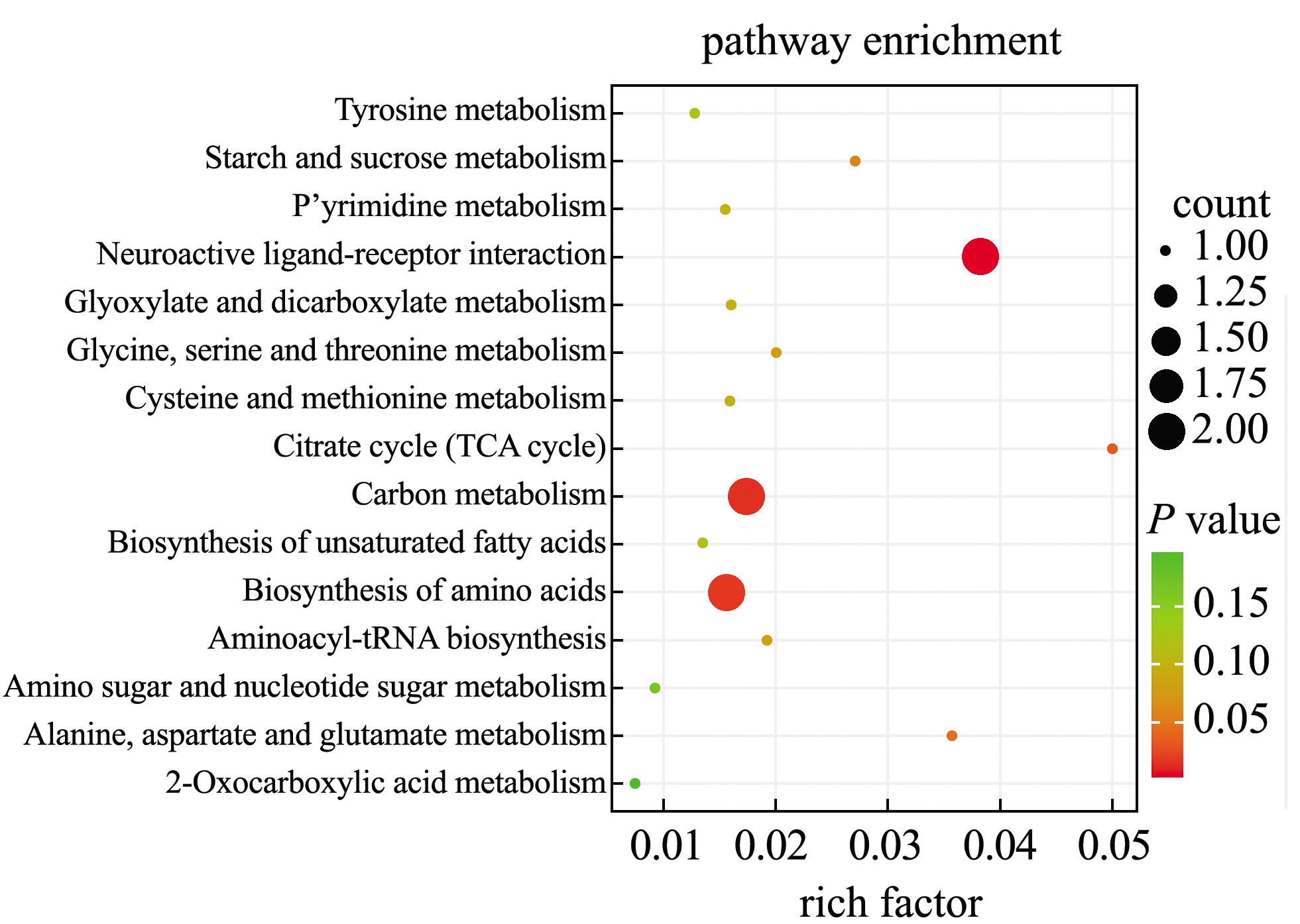
图7 差异代谢物的通路富集分析
Fig.7 Pathway enrichment of discriminate metabolites
3 讨论
3.1 代谢组学技术用于贝类活品品质评价方法的构建
扇贝作为活体生物,其生理代谢活动会随着环境影响发生变化,因此,扇贝的生理代谢及活力状态可以一定程度上反映扇贝的品质。pH和糖原是反映贝类生理状态的重要指标之一。糖原是扇贝主要的储能物质,也是扇贝重要的呈味物质[22]。传统的评价方法如pH、糖原等,都是以单一指标作为响应值。代谢组学是以组群指标分析为基础,针对生物样本内所有小分子代谢物进行分析,目的是从海量数据中发现潜在标志物。与传统生化指标相比,代谢组学技术更为全面灵敏。代谢组学数据处理通常采用PLS-DA或OPLS-DA进行多元统计分析。选取合适的模型有助于提高数据分析的准确性。OPLS-DA较PLS-DA增加了一个正交换算,可以把与模型分类不相干的信号过滤掉,因此,OPLS-DA解释能力更强,可更准确地筛选出组间差异[23]。相较于PLS-DA,OPLS-DA分析可以更好地避免过拟合现象,但与PLS-DA相比通常无预测性能的提升。本研究结果证明了这一点。
3.2 品质易逝期湿藏条件下活品虾夷扇贝的代谢特征
本研究表明,品质易逝期湿藏36 h活品虾夷扇贝闭壳肌中pH和糖原含量有所波动,但变化不大,两者的波动范围可说明此条件下扇贝状态良好,其中,糖原含量的变化相比于pH较明显。扇贝体内pH的改变通常与其代谢产物有关,乳酸、丙酮酸等无氧代谢产物的升高均可导致扇贝体内pH的降低[24]。品质易逝期湿藏的虾夷扇贝闭壳肌pH并无明显下降,这说明扇贝体内无氧代谢产物并未积累,而糖原含量波动则说明能量代谢途径的活跃。在代谢组学分析中,虾夷扇贝湿藏36 h后与初始扇贝的代谢存在差异,通过OPLS-DA分析筛选了7个显著差异代谢物,即2个氨基酸、2个有机酸、2个核苷酸和1个胺类物质。贝类中广泛存在着氨基酸、核苷酸等非挥发性含氮呈味物质[25],游离氨基酸被认为在新陈代谢中起重要作用,参与蛋白质的构建、渗透调节[26]及免疫反应[27]。在湿藏条件下,3-磷酸丝氨酸出现明显的上调趋势。根据KEGG代谢通路显示,该物质参与了甘氨酸、丝氨酸、苏氨酸、半胱氨酸和蛋氨酸等多种游离氨基酸的代谢,与氨基酸的合成密切相关。另有报道,肌球蛋白的调节功能可能与3-磷酸丝氨酸有关[28]。此外,酪胺和脯氨酰谷氨酸同样参与了氨基酸代谢。Aru等[29]对贻贝Mytilus galloprovincialis冰藏期间的NMR代谢组学分析显示,丙氨酸含量有降低;Chen等[15]对覆盖潮湿无纺纸的活扇贝Chlamys farreri的GC-MS代谢组学分析显示,谷氨酸、甘氨酸、脯氨酸含量有降低。以上研究说明,氨基酸物质的调节对于维持贝类生命代谢较为重要。此外,能量物质往往能够最直接地反映扇贝的生理状态。捕后早期湿藏条件下虾夷扇贝有氧呼吸代谢活跃,本研究中发现三羧酸循环通路的过程产物——柠檬酸出现下调趋势。能量代谢涉及高能磷酸盐的降解与合成[4, 30],本研究中二磷酸腺苷葡萄糖和尿苷5′-二磷酸的下调可能与该过程有关。二十二烷酸是一种脂肪酸类物质,它的前体物质为behenoyl-CoA,因此,二十二烷酸的减少也在一定程度上反映了能量物质的波动。这表明,三羧酸循环是最易受到影响的代谢通路。以上结果显示,品质易逝期湿藏条件下活品扇贝的有氧呼吸作用显著,与能量有关的代谢是最主要的代谢途径。
综上,传统的品质评价指标pH及糖原并不灵敏,代谢组学分析方法可以较为灵敏、全面地反映品质易逝期活品虾夷扇贝湿藏条件下的实时状态,这对探索高端贝类产品品质评价及变化机制具有较为重要的意义。
4 结论
本研究中以虾夷扇贝为研究对象,通过超高效液相色谱-质谱(UPLC-MS)法对其代谢组学进行分析,从分子层面探索了品质易逝期海水湿藏36 h活品虾夷扇贝的代谢特征。
1)本研究中详细描述了从数据采集、数据集预处理、模式识别到筛选差异代谢物的过程,通过OPLS-DA方法建立的模型表明,虾夷扇贝湿藏36 h后与初始扇贝的代谢存在显著差异。
2)经过筛选和鉴别,共发现7个显著差异代谢物,且三羧酸循环通路是最易受影响的代谢通路。品质易逝期湿藏条件下活品扇贝有氧呼吸作用显著,与能量有关的代谢是最主要的代谢途径。
3)代谢组学是一种较为灵敏的技术手段,可以用于贝类活品品质评价与变化机制的研究。本研究为活品贝类代谢组数据的分析方法与操作流程提供了参考依据,也为今后研究贝类的活力评价与品质调控提供了新的思路和方法。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2019中国渔业统计年鉴[M].北京:中国农业出版社,2019.
Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2019 China fishery statistical yearbook[M].Beijing: China Agriculture Press,2019.(in Chinese)
[2] 周晏琳,刘俊荣,田元勇,等.虾夷扇贝易逝期干露处置与活品复水性[J].水产学报,2020,44(6):1025-1035.
ZHOU Y L,LIU J R,TIAN Y Y,et al.Delayed influence of quality-determination-period emersion on the recovery of live scallop(Patinopecten yessoensis)re-immersed[J].Journal of Fisheries of China,2020,44(6): 1025-1035.(in Chinese)
[3] 李亚烜,刘俊荣,刘洋,等.易逝期胁迫强度对虾夷扇贝活力可恢复性的影响[J].大连海洋大学学报,2020,35(5):733-740.
LI Y X,LIU J R,LIU Y,et al.Re-immersion physiologic recovery of yesso scallop following different stress treatments in the quality determined period[J].Journal of Dalian Ocean University,2020,35(5): 733-740.(in Chinese)
[4] DUNCAN P F.Post-harvest physiology of the scallop Pecten maximus(L.)[D].Glasgow:University of Glasgow,1993.
[5] VALL M,MALLE P,BOUQUELET S.Evaluation of fish decomposition by liquid chromatographic assay of ATP degradation product[J].Journal of AOAC International,1998,81(3):571-578.
M,MALLE P,BOUQUELET S.Evaluation of fish decomposition by liquid chromatographic assay of ATP degradation product[J].Journal of AOAC International,1998,81(3):571-578.
[6] PACHECO-AGUILAR R,MARQUEZ-R OS E,LUGO-S
OS E,LUGO-S NCHEZ M E,et al.Postmortem changes in the adductor muscle of Pacific lions-paw scallop(Nodipecten subnodosus)during ice storage[J].Food Chemistry,2008,106(1):253-259.
NCHEZ M E,et al.Postmortem changes in the adductor muscle of Pacific lions-paw scallop(Nodipecten subnodosus)during ice storage[J].Food Chemistry,2008,106(1):253-259.
[7] 刘金洋,刘俊荣,田元勇,等.捕后处置对活品底播虾夷扇贝生化代谢的影响[J].水产学报,2017,41(1):81-87.
LIU J Y,LIU J R,TIAN Y Y,et al.Effects of post-harvest handling on biochemical metabolism of bottom cultured live scallop(Patinopecten yessoensis)[J].Journal of Fisheries of China,2017,41(1): 81-87.(in Chinese)
[8] 郑尧,刘俊荣,周晏琳,等.捕后虾夷扇贝闭壳肌免疫因子与活品品质评价初探[J].大连海洋大学学报,2017,32(2):217-223.
ZHENG Y,LIU J R,ZHOU Y L,et al.Immunologic factors in adductors and quality evaluation in live and air exposure and wet stored Yesso scallop Patinopecten yessoensis[J].Journal of Dalian Ocean University,2017,32(2): 217-223.(in Chinese)
[9] 杨婷婷,刘俊荣,俞微微,等.活品流通过程中虾夷扇贝风味品质的变化[J].水产学报,2015,39(1):136-146.
YANG T T,LIU J R,YU W W,et al.Flavor attributes of scallop Patinopecten yessoensis along the live supply chain[J].Journal of Fisheries of China,2015,39(1): 136-146.(in Chinese)
[10] NICHOLSON J K,LINDON J C,HOLMES E.‘Metabonomics’:understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J].Xenobiotica,1999,29(11):1181-1189.
[11] LENZ E M,WILSON I D.Analytical strategies in metabonomics[J].Journal of Proteome Research,2007,6(2):443-458.
[12] 徐天润,刘心昱,许国旺.基于液相色谱-质谱联用技术的代谢组学分析方法研究进展[J].分析测试学报,2020,39(1):10-18.
XU T R,LIU X Y,XU G W.Advances of analytical methods for liquid chromatography-mass spectrometry-based metabolomics[J].Journal of Instrumental Analysis,2020,39(1): 10-18.(in Chinese)
[13] TRYGG J,HOLMES E,LUNDSTEDT T.Chemometrics in metabonomics[J].Journal of Proteome Research,2007,6(2):469-479.
[14] PILDITCH C A,GRANT J.Effect of temperature fluctuations and food supply on the growth and metabolism of juvenile sea scallops(Placopecten magellanicus)[J].Marine Biology,1999,134(2):235-248.
[15] CHEN S Q,ZHANG C H,XIONG Y F,et al.A GC-MS-based metabolomics investigation on scallop(Chlamys farreri)during semi-anhydrous living-preservation[J].Innovative Food Science & Emerging Technologies,2015,31:185-195.
[16] ROCHFORT S J,EZERNIEKS V,MAHER A D,et al.Mussel metabolomics—species discrimination and provenance determination[J].Food Research International,2013,54(1):1302-1312.
[17] 刘佳琳,徐兰兰,路珍,等.基于核磁共振的褐牙鲆幼鱼组织代谢组学分析[J].海洋通报,2017,36(5):538-546.
LIU J L,XU L L,LU Z,et al.metabolomic analysis on the extracts of whole tissue from flounder Paralichthys olivaceus[J].Marine Science Bulletin,2017,36(5): 538-546.(in Chinese)
[18] 田元勇,刘金洋,刘慧慧,等.捕后暂养对虾夷扇贝闭壳肌硬化的影响[J].水产学报,2017,41(6):888-895.
TIAN Y Y,LIU J Y,LIU H H,et al.Effects of post-harvest handling on rigor of the Patinopecten yessoensis adductors[J].Journal of Fisheries of China,2017,41(6): 888-895.(in Chinese)
[19] 刘慧慧,周晏琳,张晴,等.菲律宾蛤仔捕后干露处置对其复水湿藏稳定性的影响[J].大连海洋大学学报,2018,33(2):244-250.
LIU H H,ZHOU Y L,ZHANG Q,et al.Effect of air exposure on biochemical metabolism of harvested Manila clam Ruditapes philippinarum during live wet storage[J].Journal of Dalian Ocean University,2018,33(2): 244-250.
[20] 彭岚.基于液质联用技术的重型再生障碍性贫血患者血浆代谢组学分析[D].天津:天津医科大学,2019.
PENG L.Plasma metabolomics in patients with severe aplastic anemia based on liquid chromatography-mass spectrometry[D].Tianjin: Tianjin Medical University,2019.(in Chinese)
[21] ELLIS J K,ATHERSUCH T J,THOMAS L D,et al.Metabolic profiling detects early effects of environmental and lifestyle exposure to cadmium in a human population[J].BMC Medicine,2012,10:61.
[22] PATTERSON M A,PARKER B C,NEVES R J.Glycogen concentration in the mantle tissue of freshwater mussels(Bivalvia:Unionidae)during starvation and controlled feeding[J].American Malacological Bulletin,1999,15(1):47-50.
[23] PINTO R C,TRYGG J,GOTTFRIES J.Advantages of orthogonal inspection in chemometrics[J].Journal of Chemometrics,2012,26(6):231-235.
[24] KAWABE S,TAKADA M,SHIBUYA R,et al.Biochemical changes in oyster tissues and hemolymph during long-term air exposure[J].Fisheries Science,2010,76(5):841-855.
[25] 刘云,宫向红,徐英江,等.烟台近海3种贝类中呈味核苷酸和氨基酸的测定及比较分析[J].中国水产科学,2014,21(2):351-360.
LIU Y,GONG X H,XU Y J,et al.Determination and comparative analysis of flavor-enhancing nucleotides and amino acids in three common shellfish from off shore Yantai[J].Journal of Fishery Sciences of China,2014,21(2): 351-360.(in Chinese)
[26] JI C L,WU H F,WEI L,et al.Proteomic and metabolomic analysis reveal gender-specific responses of mussel Mytilus galloprovincialis to 2,2’,4,4’-tetrabromodiphenyl ether(BDE 47)[J].Aquatic Toxicology,2013,140/141:449-457.
[27] XIANG Z,WANG X Q,CAI X J,et al.Metabolomics study on quality control and discrimination of three Curcuma species based on gas chromatograph-mass spectrometry[J].Phytochemical Analysis,2011,22(5):411-418.
[28] JAKES R,NORTHROP F,KENDRICK-JONES J.Calcium binding regions of myosin ‘Regulatory’ light chains[J].FEBS Letters,1976,70(1/2):229-234.
[29] ARU V,PISANO M B,SAVORANI F,et al.Metabolomics analysis of shucked mussels’ freshness[J].Food Chemistry,2016,205:58-65.
[30] D AZ-ENRICH M J,RAMOS-MART
AZ-ENRICH M J,RAMOS-MART NEZ J I,IBARGUREN I.Implication of guanosine 3’,5’-cyclic monophosphate,adenosine 3’,5’-cyclic monophosphate,adenosine 5’-mono-,di-and triphosphate and fructose-2,6-bisphosphate in the regulation of the glycolytic pathway in hypoxic/anoxic mussel,Mytilus galloprovincialis[J].Molecular and Cellular Biochemistry,2002,240:111-118.
NEZ J I,IBARGUREN I.Implication of guanosine 3’,5’-cyclic monophosphate,adenosine 3’,5’-cyclic monophosphate,adenosine 5’-mono-,di-and triphosphate and fructose-2,6-bisphosphate in the regulation of the glycolytic pathway in hypoxic/anoxic mussel,Mytilus galloprovincialis[J].Molecular and Cellular Biochemistry,2002,240:111-118.