红曲米(red koji rice)也称红曲,是以籼稻、粳稻、糯米等稻米为原料,经红曲霉菌(monascus)发酵而成的棕红色或紫红色的纯天然无污染米曲,具有良好的着色性和多种功能活性,红曲米包含多种功能成分,主要有洛伐他汀类(monacolin K,胆固醇降低剂)、红曲色素(食品着色剂)、二甲酸(一种抗氧化剂)、麦角甾醇(ergosterol)、抗菌活性物质、酶类活性物质和γ-氨基丁酸(一种抗高血压物质)等化合物[1-4],其中,红曲色素是一种安全性极高的天然食用色素及防腐剂,目前已被广泛用于食品、医药和化妆品等领域,被认为是化学防腐剂的最佳替代品之一[5-6]。洛伐他汀类是胆固醇生物合成的抑制剂,能够有效调节人和其他动物的血清胆固醇含量[7],在医学临床上具有广泛的用途,如洛伐他汀类是治疗人高胆固醇血症最有效的药物之一,还能防止或缓解动脉硬化和冠心病等[8]。此外,红曲米还兼具抗氧化、抗肿瘤、抗应激、预防癌症、增强免疫力等重要生物学功能[9]。目前,红曲米作为功能性饲料添加剂主要用于禽类养殖。研究证实,蛋鸡饲料中添加0.5%的富含红曲色素微生物发酵饲料可提高蛋鸡生产性能,改善鸡蛋品质[10]。此外,对海兰褐蛋鸡的研究也发现,添加0.5%红曲霉-中草药复合物(以红曲粉为主,与山药、神曲、山楂和红枣配伍而成)能有效缓解其产蛋后期生产性能下降的趋势,并有效增强蛋壳厚度,加深蛋黄色泽[11]。但在水产动物方面,仅见红曲米作为鱼类防腐剂或保鲜剂使用[12],尚缺乏红曲米作为饲料添加剂的使用研究。
锦鲤Cyprinus carpio因其体格健美、色彩艳丽、花纹多变而广受消费者喜爱,其观赏价值主要取决于体色和体型。目前,国内外对于锦鲤体色的研究已有一些报道[13-15],但关于红曲米作为饲料添加剂对锦鲤生长、着色、健康方面的影响尚未见报道。本试验中,以红白锦鲤幼鱼为研究对象,探讨不同红曲米添加量对幼鱼生长性能、色素积累及部分血液和肝胰脏生化指标等的影响,以期为红曲米作为锦鲤饲料添加剂的使用提供参考。
1 材料与方法
1.1 材料
试验用红白锦鲤幼鱼购自天津市隆锦水产养殖有限公司,试验在天津市隆锦水产养殖公司车间进行,红曲米购自西安泽邦生物科技有限公司。
1.2 方法
1.2.1 试验饲料配制 以鱼粉、玉米蛋白粉、豆粕、菜籽粕、棉籽粕等为蛋白源,大豆油为脂肪源,添加不同水平红曲米。
基础饲料原料组分为菜籽粕20%,豆粕18%,玉米蛋白粉15%,棉籽粕12%,面粉9.5%,小麦麸8%,鱼粉6%,豆油5%,预混料4%,微晶纤维素2%,氧化胆碱0.5%。其中,每千克预混料含维生素A≥25 000 IU,维生素D3 12 500~50 000 IU,维生素E≥800 IU,维生素K3≥100 mg,维生素B1≥60 mg,维生素B2≥160 mg,维生素B6≥200 mg,泛酸≥300 mg,叶酸≥11 mg,烟酸≥510 mg,锰60~800 mg,铁480~18 750 mg,锌500~5 000 mg,铜20~100 mg,硒2.5~12.5 mg。
在基础饲料中分别添加红曲米0(对照)、0.5、1.0、1.5、3.0 g/kg,配制成5组试验饲料。其中,红曲米为深红色精细粉末,洛伐他丁含量为1.3%。所有固体饲料原料均过198 μm筛,原料逐级放大混匀后,用双螺杆制粒机(华南理工大学机械工程研究所制造)制成颗粒饲料,每组饲料设两种规格(Φ=1.5、2.0 mm),在烘箱(DK400, YAMATO)中40 ℃下烘干2 h,取出后自然风干至水分为12%左右,于-20 ℃冰箱中保存,饲料营养水平见表1。
表1 饲料营养水平(风干基础)
Tab.1 Nutrient levels of the experimental diets(air-dry basis) w/%
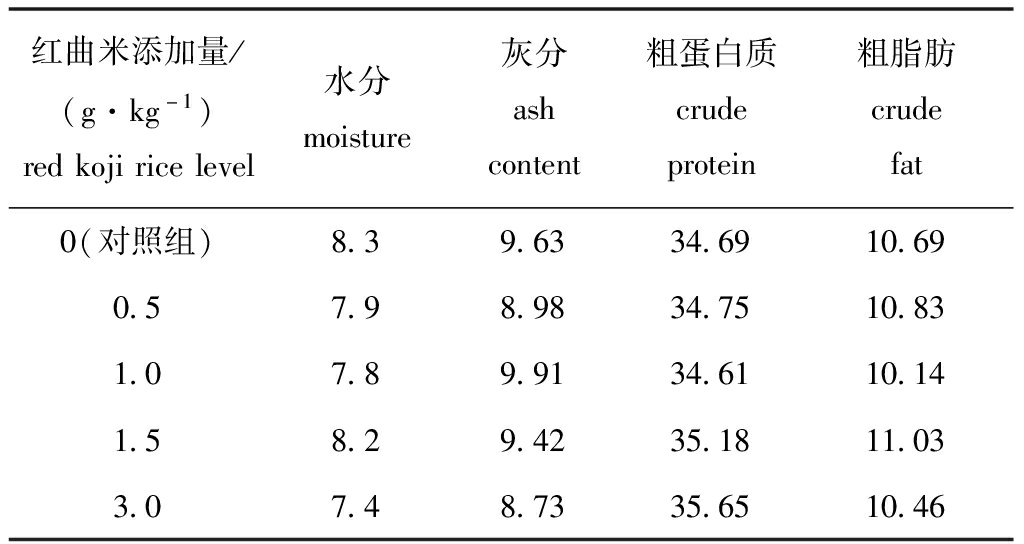
红曲米添加量/(g·kg-1)redkojiricelevel水分moisture灰分ashcontent粗蛋白质crudeprotein粗脂肪crudefat0(对照组)8.39.6334.6910.690.57.98.9834.7510.831.07.89.9134.6110.141.58.29.4235.1811.033.07.48.7335.6510.46
1.2.2 试验设计及饲养管理 试验开始前将红白锦鲤幼鱼暂养14 d以适应环境。暂养期间投喂不添加红曲米的基础饲料,暂养结束后,挑选身体健康、外表无伤、初始体质量为(8.79±1.80)g的红白锦鲤幼鱼450尾,随机分为5组,每组设置3个平行,每个平行组放置30尾鱼,饲喂含红曲米的饲料第56 天时,取样检测幼鱼生长、生化指标。而后,余下的鱼使用基础饲料继续投喂14 d,停喂红曲米饲料第0、7、14天时,取样检测体表色度值和各组织类胡萝卜素含量,养殖周期共为70 d。试验期间,每日8:00和16:30投喂,每日投喂量约为鱼体质量的3%,每日吸除缸底粪便和残饵,每日换水1次,每次换水量为总水量的1/3,所换水均经24 h曝气。试验期间水温为(25.0±1.0)℃,pH为7.6~7.8,氨氮含量≤0.05 mg/L,溶解氧含量≥6.0 mg/L。
1.2.3 样品采集 经56 d饲养后,试验鱼禁食24 h,经丁香酚(1∶10 000)麻醉后,称重并记录鱼的数量。从每只水槽随机取10尾试验鱼,测定其体表L*、a*、b*值(此为停喂0 d的色度值),于后尾部采血,将血液离心5 min(4 ℃,3 500 r/min),取上清液保存备用,用于检测血液生化指标;采血后的试验鱼于冰盘上解剖取其肝胰脏和皮肤,用于检测肝胰脏生化指标和类胡萝卜素含量(此为停喂0 d时的类胡萝卜素含量)。之后在停喂红曲米饲料的第7、14天时,从每槽随机取6尾试验鱼,测定其体表L*、a*、b*值,用上述方法采集皮肤、肝胰脏、肠道、眼组织,所有样品均于-80 ℃超低温冰箱中保存备用。
1.2.4 指标的测定与计算
1)生长指标的计算。计算公式为
增重率(WG)=(Wt-W0)/W0×100%,
(1)
特定生长率(SGR)=(ln WF-ln WI)/t×100%,
(2)
饲料效率(FE)=(Wt+Wd-W0)/C,
(3)
摄食率(FI)=C/[t(Wt+W0)/2]×100%,
(4)
成活率(SR)=成活数/总数×100%。
(5)
其中: W0为试验鱼初始总质量(g);Wt为试验鱼终末总质量(g);Wd为死亡试验鱼总质量(g);WI为鱼体初始平均质量(g);WF为鱼体终末平均质量(g);t为试验时间(d);C为摄饵量(干质量, g)。
2)一般营养成分的测定。采用恒重恒压干燥法(GB/T5009.3—2010)、杜马斯燃烧法(Thermo fisher scientific FLASH2000全自动蛋白测定仪)(GB/T24318—2009)、索氏抽提法(Gerhardt SOXTHERM)(GB/T5009.6—2010)、灼烧重量法(GB/T5009.4—2010),分别测定水分、粗蛋白质、粗脂肪和粗灰分含量。
3)血液和肝胰脏生化指标的测定。血清谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、血糖(blood glucose,Glu)、甘油三酯(triglyceride,TG)及总胆固醇(total cholesterol,Chol)送至天津市金域医学检验所检验,采用罗氏(Roche C311,German)全自动生化分析仪测定。
采用南京建成生物工程研究所试剂盒分别测定肝胰脏丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,T-SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)含量。
4)体表色度值的测定。采用色差仪(CR-400)测定锦鲤体表红质L*、a*、b*值。
5)类胡萝卜素含量的测定。取适量样品记录样品质量,对红白锦鲤红色的皮肤(带鳞片)、背鳍、尾鳍、眼、肝胰脏、肠道及饲料进行总类胡萝卜素含量(mg/kg)的测定,计算公式为
总类胡萝卜素含量=(A×K×V)/(E×G)。
(6)
其中:A为吸光度值;K为常数(104);V为提取液体积(mL);E为摩尔消光系数(2 500);G为样品质量(g)。
1.3 数据处理
试验数据均采用平均值±标准差(mean±S.D.)表示,采用SPSS 19.0软件进行单因素方差分析(ANOVA),采用Tukey法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 饲喂红曲米饲料56 d后幼鱼生长指标的变化
从表2可见:投喂红曲米饲料56 d后,各组试验鱼存活率为87.78%~100.00%,组间无显著性差异(P>0.05);饲料中添加红曲米均能显著提高试验鱼增重率、特定增长率及饲料效率(P<0.05),且添加量为1.5 g/kg时,各指标均达到最大值;而不同红曲米添加量对试验鱼摄食率无显著性影响(P>0.05)。
表2 饲喂56 d后不同红曲米添加量对红白锦鲤幼鱼生长指标的影响
Tab.2 Effects of different red koji rice levels on growth performance of the juvenile red-white koi carp fed for 56 d

红曲米添加量/(g·kg-1)redkojiricelevel增重率/%weightgainrate特定生长率/(%·d-1)specificgrowthrate饲料效率/%feedefficiency摄食率/%foodintake成活率/%survivalrate043.15±0.72a0.65±0.01a0.28±0.01a2.19±0.1593.33±6.670.574.34±6.38b1.01±0.07b0.44±0.03b2.20±0.0392.78±8.551.076.72±6.64b1.03±0.07b0.45±0.03b2.20±0.03100.00±0.001.584.25±9.78b1.11±0.10b0.50±0.05b2.12±0.0696.67±3.343.067.51±2.94b0.94±0.03b0.40±0.02b2.38±0.2387.78±5.09
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note: The means with different letters within the same column are significantly different among the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
2.2 饲喂红曲米饲料56 d后红白锦鲤幼鱼部分血液生化指标的变化
从表3可见,投喂红曲米饲料56 d后,与对照组(0 g/kg)相比,各试验组鱼体血糖含量及谷草转氨酶活性均显著降低(P<0.05),而各试验组鱼体甘油三酯、总胆固醇含量及谷丙转氨酶活性均无显著性变化(P>0.05)。
表3 饲喂56 d后不同红曲米添加量对红白锦鲤幼鱼部分血液指标的影响
Tab.3 Effects of different red koji rice levels on hematological characteristics of the juvenile red-white koi carp fed for 56 d
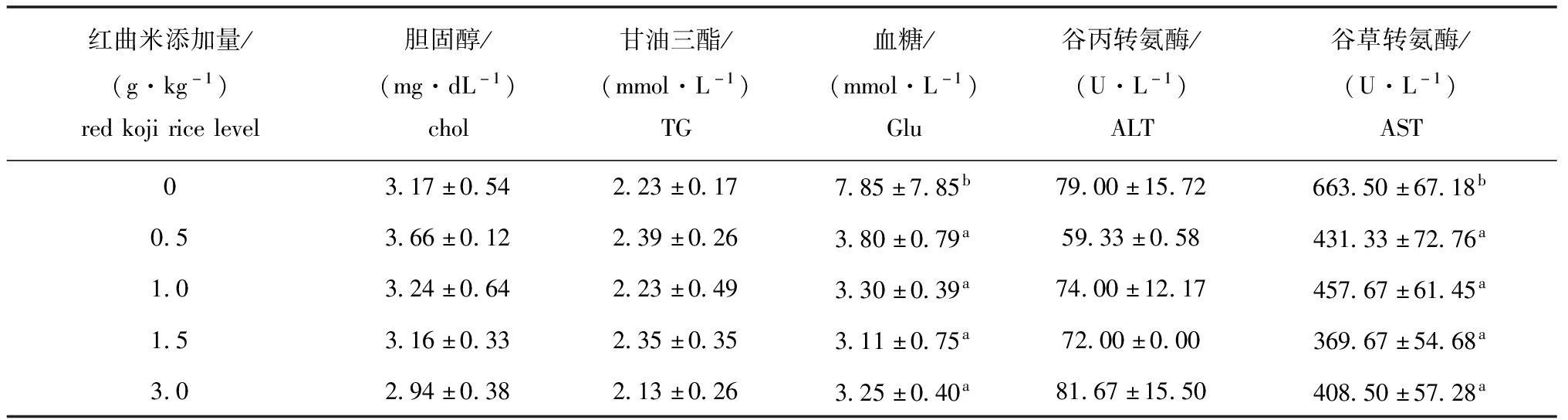
红曲米添加量/(g·kg-1)redkojiricelevel胆固醇/(mg·dL-1)chol甘油三酯/(mmol·L-1)TG血糖/(mmol·L-1)Glu谷丙转氨酶/(U·L-1)ALT谷草转氨酶/(U·L-1)AST03.17±0.542.23±0.177.85±7.85b79.00±15.72663.50±67.18b0.53.66±0.122.39±0.263.80±0.79a59.33±0.58431.33±72.76a1.03.24±0.642.23±0.493.30±0.39a74.00±12.17457.67±61.45a1.53.16±0.332.35±0.353.11±0.75a72.00±0.00369.67±54.68a3.02.94±0.382.13±0.263.25±0.40a81.67±15.50408.50±57.28a
2.3 饲喂红曲米饲料56 d后红白锦鲤幼鱼部分肝胰脏生化指标的变化
从表4可见:投喂红曲米饲料56 d后,饲料中红曲米添加量为1.5 g/kg时,试验鱼肝胰脏GSH-PX酶活力显著高于对照组及0.5、1.0 g/kg红曲米添加组(P<0.05);饲料中红曲米添加量为3.0 g/kg时,试验鱼MDA含量显著高于对照组(P<0.05);添加红曲米的试验鱼肝胰脏中SOD、CAT活性与对照组相比均无显著性差异(P>0.05)。
表4 饲喂56 d后不同红曲米添加量对红白锦鲤幼鱼部分肝胰脏生化指标的影响
Tab.4 Effects of different red koji rice levels on hepatopancreas biochemical indices of the juvenile red-white koi carp fed for 56 d
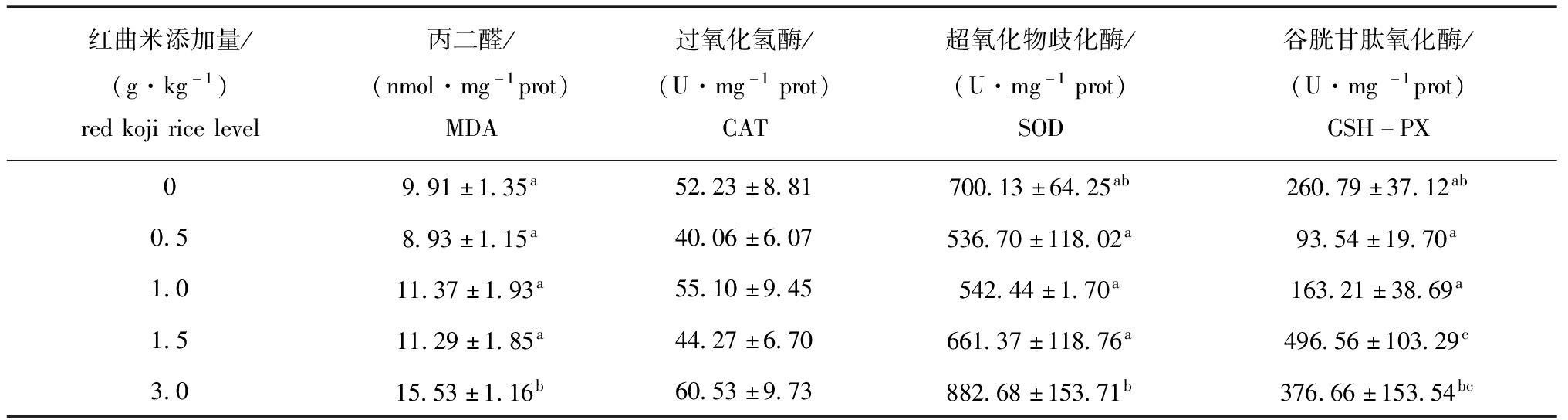
红曲米添加量/(g·kg-1)redkojiricelevel丙二醛/(nmol·mg-1prot)MDA过氧化氢酶/(U·mg-1prot)CAT超氧化物歧化酶/(U·mg-1prot)SOD谷胱甘肽氧化酶/(U·mg-1prot)GSH-PX09.91±1.35a52.23±8.81700.13±64.25ab260.79±37.12ab0.58.93±1.15a40.06±6.07536.70±118.02a93.54±19.70a1.011.37±1.93a55.10±9.45542.44±1.70a163.21±38.69a1.511.29±1.85a44.27±6.70661.37±118.76a496.56±103.29c3.015.53±1.16b60.53±9.73882.68±153.71b376.66±153.54bc
2.4 停喂红曲米后不同时期幼鱼体色的变化
2.4.1 体表L*、a*、b*值 从表5可见:停喂红曲米0 d时,随着红曲米添加量的增加,试验鱼体表a*值呈现先上升后下降的趋势,1.0 g/kg组的a*值达到最大且显著高于对照组(P<0.05);停喂7 d时,试验鱼体表a*值变化趋势与0 d时一致,峰值仍出现在1.0 g/kg组,且显著高于0、1.5 g/kg组(P<0.05);停喂14 d时,红曲米添加量为1.0 g/kg及以上时,试验鱼体表a*值显著高于对照组(P<0.05);而随着停喂时间的延长,除对照组a*值显著降低外(P<0.05),其余红曲米添加组均无显著性变化(P>0.05)。而不同红曲米添加量及停喂时间对红白锦鲤体表b*值、L*值均无显著性影响(P>0.05)。
表5 停喂红曲米0、7、14 d时锦鲤体表色度值的变化
Tab.5 Changes in the values of L*, a*and b* in skin of the juvenile red-white koi carp unfed the diets containing red koji rice for 0,7 and 14 days
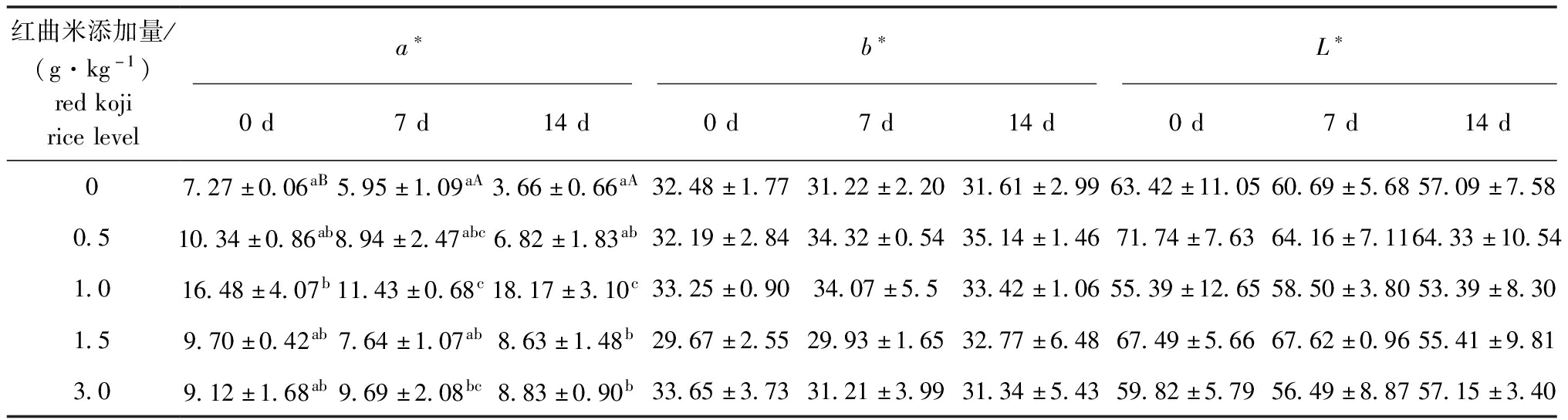
红曲米添加量/(g·kg-1)redkojiricelevela∗b∗L∗0d7d14d0d7d14d0d7d14d07.27±0.06aB5.95±1.09aA3.66±0.66aA32.48±1.7731.22±2.2031.61±2.9963.42±11.0560.69±5.6857.09±7.580.510.34±0.86ab8.94±2.47abc6.82±1.83ab32.19±2.8434.32±0.5435.14±1.4671.74±7.6364.16±7.1164.33±10.541.016.48±4.07b11.43±0.68c18.17±3.10c33.25±0.9034.07±5.533.42±1.0655.39±12.6558.50±3.8053.39±8.301.59.70±0.42ab7.64±1.07ab8.63±1.48b29.67±2.5529.93±1.6532.77±6.4867.49±5.6667.62±0.9655.41±9.813.09.12±1.68ab9.69±2.08bc8.83±0.90b33.65±3.7331.21±3.9931.34±5.4359.82±5.7956.49±8.8757.15±3.40
注: 标有不同小写字母者表示同一时间下不同组内有显著性差异(P<0.05),标有不同大写字母者表示同一组内不同时间下有显著差异(P<0.05),标有相同字母者或无字母者表示组间无显著性差异(P>0.05)。
Note: The means with different letters within the same time are significantly different in the different groups(P<0.05);The means with different capital letters or no letter within the same groups are significantly different in the different time(P<0.05);The means with same letter within the different groups are not significantly different(P>0.05).
2.4.2 皮肤中的类胡萝卜素含量 从表6可见:停喂红曲米0 d时,随着饲料中红曲米含量的增加,红白锦鲤皮肤中的类胡萝卜素含量呈现先上升后下降的趋势,添加量为1.0~1.5 g/kg时,锦鲤体表类胡萝卜素含量显著高于对照组(P<0.05);停喂7 d时,1.0 g/kg 组试验鱼皮肤中类胡萝卜素含量最高且显著高于对照组(P<0.05);停喂14 d时,各试验组鱼皮肤中的类胡萝卜素含量与对照组相比,均无显著性差异(P>0.05)。红曲米添加量为1.0~1.5 g/kg时,随着停喂时间的延长,试验鱼皮肤中类胡萝卜素含量显著降低(P<0.05)。
表6 停喂红曲米0、7、14 d时锦鲤皮肤组织中类胡萝卜素含量的变化
Tab.6 Changes in total carotenoid contents in skin of the juvenile red-white koi carp unfed the diets containing red koji rice for 0,7 and 14 days mg/kg

红曲米添加量/(g·kg-1)redkojiricelevel停喂红曲米时间dayinthefishfeddietwithoutredkojirice/d0714034.17±4.22a32.92±3.02a26.39±3.980.538.22±2.76ab45.12±6.31ab28.74±0.371.055.99±9.33bcB45.69±4.59bAB31.17±5.94A1.557.06±1.72cB34.3±5.77abA32.12±6.64A3.046.86±4.19abc38.53±0.4a30.98±7.92
2.4.3 其他组织器官中的类胡萝卜素含量 从表7可见:停喂红曲米7 d时,3.0 g/kg组锦鲤尾鳍、眼中类胡萝卜素含量显著高于对照组,肠道中类胡萝卜素含量则显著低于对照组(P<0.05),而添加红曲米未对试验鱼背鳍、肝胰脏中类胡萝卜素含量造成显著性影响(P>0.05);停喂14 d时,红曲米试验组间鱼眼及肝胰脏中的类胡萝卜素含量总体上与对照组相比无显著性差异(P>0.05),红曲米添加量为1.5 mg/kg 及以上时,试验鱼背鳍、尾鳍中的类胡萝卜素含量显著高于对照组(P<0.05),而肠道中类胡萝卜素含量则显著低于对照组(P<0.05)。
表7 停喂红曲米7、14 d时锦鲤其他组织器官中类胡萝卜素含量的变化
Tab.7 Changes in total carotenoid contents in other tissues of the juvenile red-white koi carp unfed the diets containing red koji rice for 7 and 14 days mg/kg
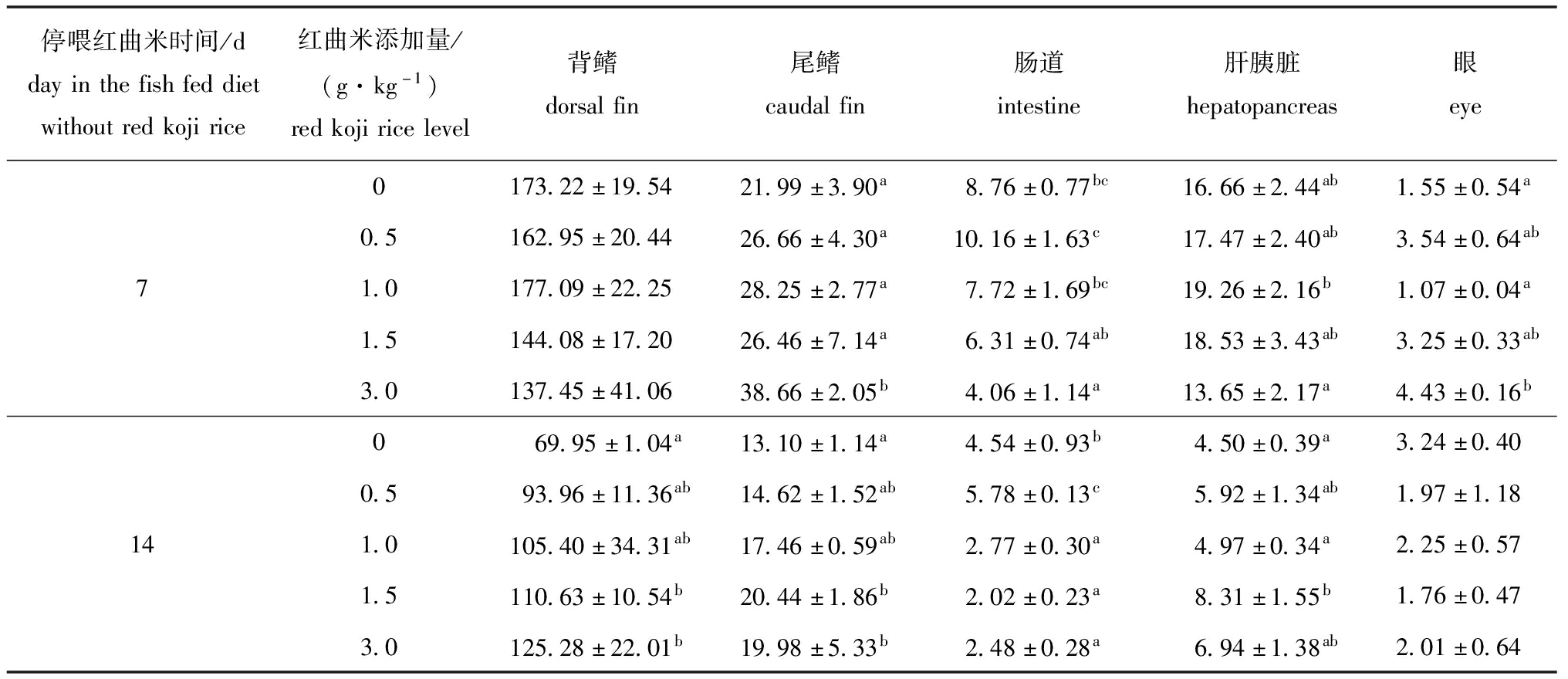
停喂红曲米时间/ddayinthefishfeddietwithoutredkojirice红曲米添加量/(g·kg-1)redkojiricelevel背鳍dorsalfin尾鳍caudalfin肠道intestine肝胰脏hepatopancreas眼eye0173.22±19.5421.99±3.90a8.76±0.77bc16.66±2.44ab1.55±0.54a0.5162.95±20.4426.66±4.30a10.16±1.63c17.47±2.40ab3.54±0.64ab71.0177.09±22.2528.25±2.77a7.72±1.69bc19.26±2.16b1.07±0.04a1.5144.08±17.2026.46±7.14a6.31±0.74ab18.53±3.43ab3.25±0.33ab3.0137.45±41.0638.66±2.05b4.06±1.14a13.65±2.17a4.43±0.16b069.95±1.04a13.10±1.14a4.54±0.93b4.50±0.39a3.24±0.400.593.96±11.36ab14.62±1.52ab5.78±0.13c5.92±1.34ab1.97±1.18141.0105.40±34.31ab17.46±0.59ab2.77±0.30a4.97±0.34a2.25±0.571.5110.63±10.54b20.44±1.86b2.02±0.23a8.31±1.55b1.76±0.473.0125.28±22.01b19.98±5.33b2.48±0.28a6.94±1.38ab2.01±0.64
3 讨论
3.1 红曲米对红白锦鲤幼鱼生长的影响
目前,有关红曲米作为饲料添加剂的报道主要集中在家禽饲料的研究上。付兴周等[16]研究发现,日粮中添加1%红曲复合添加剂对肉仔鸡的生长性能具有促进作用。对蛋鸡的研究结果显示,基础日粮中添加红曲霉发酵料能有效提高蛋鸡的产蛋率,降低料蛋比,提高蛋鸡生产性能[6]。本试验中,在饲料中添加红曲米后能显著提高各组试验鱼的增重率、特定生长率及饲料效率,这说明红曲米能够有效提高红白锦鲤幼鱼的生长性能和饲料利用。其原因有两方面:一是红曲霉在代谢过程中产生的多种酶类,如蛋白酶、淀粉酶、果胶酶、糖化酶、葡萄糖淀粉酶等,这些酶能够降解饲料中难以消化的大分子物质,有助于提高饲料中营养物质的消化率[11];二是红曲米中含有的抑菌活性物质可能对肠道菌群具有一定调节作用,从而对生长产生了一定影响。
3.2 红曲米对红白锦鲤幼鱼血液生化指标的影响
众多人和动物的试验结果表明,红曲米具有良好的降脂作用。Ross[17]临床研究中发现,红曲米可将人血清低密度脂蛋白水平降低10%~33%。对患高脂血症的大鼠[18]或仓鼠[19]研究显示,在摄入红曲米后,大鼠或仓鼠血清中甘油三酯、总胆固醇及低密度脂蛋白含量均显著降低,而低密度脂蛋白和总胆固醇能够影响VIIa-组织凝血活酶复合物的活性,进而影响血液的抗凝能力。类似结果也出现在对AS兔[20]及蛋鸡[6]的研究中。本试验中,添加红曲米对试验鱼血清胆固醇和甘油三酯均无显著性影响,说明红曲米对红白锦鲤幼鱼的降脂效果不明显,其原因可能与较多因素相关,如试验对象、试验饲料及养殖条件等,具体原因有待进一步试验证实。Shi等[21]在由链脲佐菌素(STC)诱导的糖尿病大鼠日料中添加红曲霉发酵产品,饲喂8周后发现,3种不同红曲霉发酵产品均能显著降低糖尿病大鼠的血糖含量,提高大鼠血清胰岛素水平,证实红曲制品对于降低血糖具有良好效果。Wang等[22]的研究结果也发现,红曲通过促进胰岛素分泌降低糖尿病小鼠的血糖水平。本试验与上述结果相类似,添加红曲米后,各组试验鱼血糖含量均显著降低,这说明对于红白锦鲤幼鱼而言,红曲米也具备良好的降糖效果。此外,本试验中各组试验鱼血清中谷草转氨酶活性显著降低,这与Lee等[19]对患高脂血症大鼠的研究结果相一致,这说明在饲料中添加红曲米会在一定程度上缓解肝脏损伤。
3.3 红曲米对红白锦鲤幼鱼肝胰脏生化指标的影响
SOD和CAT是机体抗氧化酶系统中重要的防御性抗氧化功能因子,能够清除机体内活性氧自由基,MDA是机体脂质过氧化程度的重要衡量指标,反映了机体肝脏损伤程度[23-24]。GSH-PX则是机体内广泛存在的一种重要的过氧化物分解酶,能够减少脂质过氧化物的生产,起到保护细胞膜结构和功能的作用[25]。本试验中,1.5 g/kg红曲米添加组试验鱼GSH-PX活性显著升高,这说明红曲米可能对提高红白锦鲤幼鱼的抗氧化能力有积极作用,这与对糖尿病大鼠[21]和蛋鸡[26]的研究结果相一致。而MDA含量在红曲米添加量为3.0 g/kg时显著升高,提示添加高浓度的红曲米可能对试验鱼的肝胰脏造成负面影响。
3.4 红曲米对红白锦鲤幼鱼体色的影响
本试验中,红曲米添加量为1.0 g/kg时,红白锦鲤幼鱼皮肤a*值及类胡萝卜素含量均显著升高,这说明红曲米对红白锦鲤幼鱼具有良好的增色效果,而随着红曲米添加量继续升高,皮肤a*值及类胡萝卜素含量反而下降到对照组水平,也表明了机体对类胡萝卜素的吸收有最大限度。这与笔者前期采用不同脂肪水平的螺旋藻饲料投喂锦鲤的研究结果相一致[27]。停喂红曲米饲料后,锦鲤体内各组织器官中类胡萝卜素含量均随停喂时间的延长而降低,但停喂7、14 d时,1.0 g/kg组红白锦鲤幼鱼皮肤a*值仍显著高于对照组,且锦鲤皮肤、背鳍、尾鳍中的类胡萝卜素含量相对较高。这与张春兰等[28]及姜志强等[13]发现的锦鲤吸收的色素主要沉积于体表的研究结果相一致。
4 结论
1)在饲料中添加红曲米可有效提高红白锦鲤幼鱼生长性能,降低血糖含量。
2)饲料中添加1.0 g/kg红曲米能有效改善红白锦鲤幼鱼的体色,可维持14 d不褪色。
3)饲料中添加红曲米对提高红白锦鲤幼鱼肝胰脏的抗氧化能力效果不明显。
综上所述,在本试验条件下,红曲米的最适宜添加量为1.0 g/kg,可维持14 d。
[1] HONG M Y,SEERAM N P,ZHANG Y J,et al.Anticancer effects of Chinese red yeast rice versus monacolin K alone on colon cancer cells[J].The Journal of Nutritional Biochemistry,2008,19(7):448-458.
[2] 彭月菊.红曲提取物影响HepG2脂类代谢机制的初步探究[D].天津:天津科技大学,2016.
PENG Y J.Preliminary study of monascus production extract on the effects of lipid metabolism in HepG2[D].Tianjin: Tianjin University of Science and Technolo,2016.(in Chinese)
[3] 刘战霞.基于转录组学研究红曲菌产莫纳克林K和色素的分子机理[D].石河子:石河子大学,2019.
LIU Z X.Investigation of biosynthetic mechanisms of monacolin K and pigments in Monascus purpureus based on transcriptomic analysis[D].Shihezi: Shihezi University,2019.(in Chinese)
[4] LIN Y L,WANG T H,LEE M H,et al.Biologically active components and nutraceuticals in the Monascus-fermented rice:a review[J].Applied Microbiology and Biotechnology,2008,77(5):965-973.
[5] AGBOYIBOR C,KONG W B,CHEN D,et al.Monascus pigments production,composition,bioactivity and its application:a review[J].Biocatalysis and Agricultural Biotechnology,2018,16:433-447.
[6] 陈冬.紫色红曲霉固态发酵玉米粉和豆粕产蛋鸡功能饲料的研究[D].兰州:西北师范大学,2019.
CHEN D.Production of laying hens functional feed with solid state fermentation of corn meal and soybean meal by Monascus purpureus[D].Lanzhou:Northwest Normal University,2019.(in Chinese)
[7] SRIANTA I,RISTIARINI S,NUGERAHANI I,et al.Recent research and development of Monascus fermentation products[J].International Food Research Journal,2014,21(1):1-12.
[8] PIRRO M,LUPATTELLI G,DEL GIORNO R,et al.Nutraceutical combination(red yeast rice,berberine and policosanols)improves aortic stiffness in low-moderate risk hypercholesterolemic patients[J].Pharma Nutrition,2013,1(2):73-77.
[9] SU N W,LIN Y L,LEE M H,et al.Ankaflavin from Monascus-fermented red rice exhibits selective cytotoxic effect and induces cell death on Hep G2 cells[J].Journal of Agricultural and Food Chemistry,2005,53(6):1949-1954.
[10] 李泳宁,朱宏阳,吴焜,等.一种富含红曲色素微生物发酵饲料在蛋鸡养殖中的应用[J].粮食与饲料工业,2015(2):52-54.
LI Y N,ZHU H Y,WU K,et al.Application of microbial fermenatation feed rich in Monasus pigment for laying hens[J].Cereal and Feed Industry,2015(2):52-54.(in Chinese)
[11] 金华莲,董玉影,张敏,等.红曲霉—中药复合制剂对蛋鸡生产性能及蛋常规品质的影响[J].延边大学农学学报,2012,34(4):293-298.
JIN H L,DONG Y Y,ZHANG M,et al.Effect of Monasus Chinese medical compound preparation on performance of laying hens and eggs conventional quality[J].Journal of Agricultural Science Yanbian University,2012,34(4):293-298.(in Chinese)
[12] 陈运中.红曲活性成分结构与功能评价—血脂调节、抗疲劳、脂蛋白脂酶mRNA及低密度脂蛋白受体mRNA基因表达[D].武汉:华中农业大学,2004.
CHEN Y Z.The structure of bioactive components of red kojic and its health-care function evaluation-expression of LPL mRNA and LDL-receptor mRNA,lipid metabolism adjusting and anti fatigue activity[D].Wuhan:Huazhong Agricultural University,2004.(in Chinese)
[13] 姜志强,崔培,秦强,等.类胡萝卜素在锦鲤组织器官中的沉积与分布[J].大连海洋大学学报,2012,27(1):22-26.
JIANG Z Q,CUI P,QIN Q,et al.Deposition and distribution of carotenoids in different tissues of ornamental carp Cyprinus carpio[J].Journal of Dalian Ocean University,2012,27(1):22-26.(in Chinese)
[14] 孙金辉,范泽,曲木,等.饲料中添加红辣椒粉对锦鲤生长和体色的影响[J].水产科技情报,2016,43(5):249-254.
SUN J H,FAN Z,QU M,et al.Effect of red pepper powder on growth performance and body color of koi[J].Fisheries Science & Technology Information,2016,43(5):249-254.(in Chinese)
[15] GOUVEIA L,REMA P,PEREIRA O,et al.Colouring ornamental fish(Cyprinus carpio and Carassius auratus)with microalgal biomass[J].Aquaculture Nutrition,2003,9(2):123-129.
[16] 付兴周,路志芳,李东.红曲复合添加剂对肉鸡生长性能及肉质性状的影响[J].中国畜牧兽医,2016,43(11):2951-2955.
FU X Z,LU Z F,LI D.Effect of Monasus compound additive on growth performance and meat quality of broiler[J].China Animal Husbandry & Veterinary Medicine,2016,43(11):2951-2955.(in Chinese)
[17] ROSS S M.Red yeast rice:efficacy and tolerability of Monascus purpureus yeast,for treatment of hyperlipidemia in patients with statin-associated myalgias[J].Holistic Nursing Practice,2012,26(3):173-175.
[18] LEE C I,SHIH C D,LEE C L,et al.Effect of red mold rice on blood coagulation and anticoagulation factors in a rat model of hyperlipidemia[J].Journal of Functional Foods,2013,5(4):1956-1965.
[19] LEE C L,TSAI T Y,WANG J J,et al.In vivo hypolipidemic effects and safety of low dosage Monascus powder in a hamster model of hyperlipidemia[J].Applied Microbiology and Biotechnology,2006,70(5):533-540.
[20] SETNIKAR I,SENIN P,ROVATI L C.Antiatherosclerotic efficacy of policosanol,red yeast rice extract and astaxanthin in the rabbit[J].Arzneimittel-Forschung,2005,55(6):312-317.
[21] SHI Y C,PAN T M.Antioxidant and pancreas-protective effect of red mold fermented products on streptozotocin-induced diabetic rats[J].Journal of the Science of Food and Agriculture,2010,90:2519-2525.
[22] WANG J,JIANG W M,ZHONG Y,et al.Xuezhikang attenuated the functional and morphological impairment of pancreatic islets in diabetic mice via the inhibition of oxidative stress[J].Journal of Cardiovascular Pharmacology,2014,63(3):282-289.
[23] GUEL S,BELGE-KURUTAS E,YILDIZ E,et al.Pollution correlated modifications of liver antioxidant systems and histopathology of fish(Cyprinidae)living in Seyhan Dam Lake,Turkey[J].Environment International,2004,30(5):605-609.
[24] MOURENTE G,TOCHER D R,DIAZ E,et al.Relationships between antioxidants,antioxidant enzyme activities and lipid peroxidation products during early development in Dentex dentex eggs and larvae[J].Aquaculture,1999,179(1/2/3/4):309-324.
[25] RAN Q T,LIANG H Y,IKENO Y.Reduction in glutathione peroxidase 4 increases life span through increased sensitivity to apoptosis[J].The Journals of Gerontology:Series A,2007,62(9):932-942.
[26] WANG J J,PAN T M,SHIEH M J,et al.Effect of red mold rice supplements on serum and meat cholesterol levels of broilers chicken[J].Applied Microbiology and Biotechnology,2006,71(6):812-818.
[27] 崔培,姜志强,韩雨哲,等.饲料脂肪水平对红白锦鲤体色、生长及部分生理生化指标的影响[J].天津农学院学报,2011,18(2):23-31.
CUI P,JIANG Z Q,HAN Y Z,et al.Effects of dietary lipid levels on body pigmentation,growth,partial physiological and biochemical indexes of ornamental carp(Cyprinus carpio L.)[J].Journal of Tianjin Agricultural University,2011,18(2):23-31.(in Chinese)
[28] 张春兰,赵文,徐立蒲,等.微生态制剂和着色剂对锦鲤体色的影响[J].大连海洋大学学报,2011,26(4):328-332.
ZHANG C L,ZHAO W,XU L P,et al.Effects of probiotics and coloring agents on body color of koi carp Cyprinus carpio[J].Journal of Dalian Ocean University,2011,26(4):328-332.(in Chinese)