单环刺螠Urechis unicinctus俗称海肠子,隶属于螠虫动物门Echiurioidea螠纲Echiurida无管螠目Xenopneusta刺螠科Urchidae刺螠属Urechis。单环刺螠自然分布于俄罗斯、朝鲜、日本等国海域,以及中国的黄、渤海沿岸,是生活在海边潮间带泥性底质或珊瑚礁区中的管状螠虫动物[1],因其肉味鲜美、营养丰富,被称为“裸体海参”[2],具有较大的养殖开发前景。有研究发现,单环刺螠体内存在多种生物活性物质,可为开发海洋生物药品、保健品提供新资源[3]。目前,单环刺螠的供应绝大部分依赖采捕野生资源,随着价格不断提高,采捕强度越来越大,野生资源衰退严重。因此,生产过程中非常有必要开展苗种规模化扩繁和增养殖工作。
目前,中国学者已在单环刺螠生态学[4-8]、繁殖发育生物学[9-10]等方面开展了相关研究,为开展养殖生产奠定了一定理论基础。一些科研单位和企业也尝试进行了单环刺螠的人工苗种繁育[2,11-13]及养殖试验[14-15],并获得了一定的养殖参数数据。常林瑞等[16]报道了饵料对单环刺螠幼体生长的影响,而有关饵料对单环刺螠幼虫生长发育及变态的影响研究尚未见报道。
饵料是动物生长与发育的营养基础,饵料品种的选择与科学投喂是经济物种苗种繁育成功与否的核心技术。本研究中,比较了不同饵料品种、饵料配比及饵料投喂方式对单环刺螠幼虫生长发育和变态的影响,旨在确定适宜幼虫生长和发育的最佳饵料系列及投喂方法,为单环刺螠规模化人工育苗生产提供饵料参考数据。
1 材料与方法
1.1 材料
试验用单环刺螠亲体取自“烟台海肠”地理标志保护范围内的烟台海域。为取得发育起点较同步的幼虫,本试验中通过解剖人工暂养的亲体获取精子和卵子,经人工授精并孵化,获得同源初孵担轮幼虫。
1.2 方法
1.2.1 幼虫培养 幼虫培育容器为玻璃水槽(50 cm×30 cm×40 cm),水深为33 cm,底面积为0.15 m2,试验水体体积为50 L。试验期间连续充气,水温控制在15.8~20.6 ℃,盐度为27.3~30.2,pH为7.8~8.2,光照强度为500 lx以下。幼虫初始培育密度为0.25 ind./mL。每个试验组设3个重复。每天上午换水1次,换水量为总水量的 1/2。在换水后进行投饵,日投喂2~3次。换水前观察幼虫摄食及活动情况。
投饵量的确定方法:投喂前检测水中存留饵料细胞的密度和幼虫胃饱满程度,以幼虫胃饱满时水中饵料细胞密度达到1×104 cells/mL左右为标准,确定适宜的投喂量。
变态底质的处理与投放:海沙曝晒2~3 d后,使用350 μm筛网过滤,去掉杂质和大颗粒物质;加入质量浓度为5×10-6 mg/L的高锰酸钾溶液浸泡12 h;反复用过滤海水冲洗干净后备用。在空水槽底部投放经处理的海沙作为变态底质,铺设厚度为2~3 cm,当幼体发育至蠕虫状幼虫阶段时,对幼虫进行收集并移入该水槽。
1.2.2 饵料种类 试验饵料包括活性饵料和人工代用饵料两大类,活性饵料为球等鞭金藻Isochrysis galbana(编号A)、小球藻Chlorella vulgaris(编号B)、小新月菱形藻Nitzschia closterium f.minutissima(编号C)和海洋红酵母(大连益参宝饲料有限公司)(编号D),人工代用饵料为活性干酵母(安琪酵母,湖北武汉)(编号E)。
1.2.3 单一饵料和混合饵料投喂试验 试验共设置11个试验组,分别记为A、B、C、D、E、A+B、B+C、D+E、A+B+C、A+B+D、A+B+E,分别投喂5种单一饵料和6种混合饵料。混合饵料投喂组中各组分均按细胞数等量使用,最终使每组细胞数量相同。试验幼虫种类包括从初孵担轮幼虫至蠕虫状幼虫的各阶段。
1.2.4 饵料配比及投喂方式试验 根据混合饵料投喂试验结果,确定最佳混合饵料品种。按照表1中的饵料配比和投喂方式设置各试验组,依据幼虫的生长速度与变态率确定最佳投喂方式和各发育阶段幼虫的适宜投喂量。试验幼虫种类包括从初孵担轮幼虫至蠕虫状幼虫的各阶段。
表1 饵料配比及投喂方式试验设计
Tab.1 Experimental design of food ratio and feeding mode

组别group小球藻、球等鞭金藻、酵母粉混合比例Chlorellavulgaris,Isochrysisgalbanaandyeastpowderratio投喂方式feedingmodeⅠ1∶1∶1同时搭配投喂Ⅱ2∶1∶1同时搭配投喂Ⅲ3∶1∶1同时搭配投喂Ⅳ1∶1∶1分期投喂,即前期只投喂小球藻+金藻,至担轮幼虫中后期增加酵母粉Ⅴ2∶1∶1分期投喂,即前期只投喂小球藻+金藻,至担轮幼虫中后期增加酵母粉Ⅵ3∶1∶1分期投喂,即前期只投喂小球藻+金藻,至担轮幼虫中后期增加酵母粉Ⅶ2∶1∶2分期投喂,即前期只投喂小球藻+金藻,至担轮幼虫中后期增加酵母粉Ⅷ2∶1∶2分期投喂,即前期只投喂小球藻+金藻,至体节幼虫时增加酵母粉
1.2.5 幼虫的收集与计数 单环刺螠担轮幼虫和体节幼虫均为浮游状态,使用75 μm筛绢获取;蠕虫状幼虫为底栖生活,获取方法如下:用水流冲击水槽底部,使幼苗与底质分离,将浮起的幼虫连同槽内海水一起倒入106 μm的网箱中,反复操作至底质内无幼苗为止,收集网箱内的幼苗并冲洗干净,沥水后测量体长并称其质量。随机取样3次,取平均值并计算出该水槽内的幼苗总数。
1.2.6 生长速度的测定 试验期间,使用目微尺分别检测初孵担轮幼虫和后期体节幼虫(12体节)的体长。每组随机抽取30个个体,并计算其平均值。体长日增长率计算公式为
体长日增长率=(后期体节幼虫体长-初孵担轮幼虫体长)/(初孵担轮幼虫体长×生长时间)×100%。
1.2.7 幼虫成活率及变态成活率的测定 当幼虫全部发育到体节幼虫时,测定幼虫成活率;当在水中无浮游幼虫5 d后,从底质中分离出蠕虫状幼虫幼苗,测定幼虫变态率。计算公式为
幼虫成活率![]()
幼虫变态率![]()
1.2.8 幼虫发育齐整度的测定 通过计算组内水中无浮游幼虫时间与最早出现蠕虫状幼虫时间之差,评估组内幼虫发育的整齐程度。
1.3 数据处理
采用SPSS 19.0软件对试验数据进行单因子方差分析,检验方差齐性,采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 关键节点幼虫的形态特征
受精约24 h后观察到早期担轮幼虫,营浮游生活(图1(a)),此时幼虫呈梨形,身体分上下两个半球,上半球顶部具顶纤毛束,在体围最大处有两个纤毛环,在虫体下半球靠近末端处,还有一圈尾端纤毛环,此时幼虫长×宽约144 μm×168 μm。
受精后8~15 d,发育至体节幼虫,幼虫陆续下沉并在底质表面爬行(图1(b)),后期体节幼虫体长896.5~939.2 μm不等。
当水体中基本无浮游幼虫时,从水槽底部沙床中收集的幼虫主要为蠕虫状幼虫,虫体呈透明状,消化道清晰可见(图1(c)),此时幼虫体长为2.1~5.0 mm,体质量为1.29~2.15 mg。


图1 早期担轮幼虫、体节幼虫和蠕虫状幼虫的显微观察
Fig.1 Microscopic observations of early trochophore, segmentation larva and worm-shaped larva
2.2 不同种类饵料对幼虫生长发育和存活的影响
不同种类饵料投喂对单环刺螠初孵担轮幼虫至体节幼虫期间的体长日增长率、体节幼虫体长和幼虫成活率(表2),以及对初孵担轮幼虫至出现蠕虫状幼虫的时间和幼虫变态率(表3)等均存在一定的影响。在单一饵料投喂组中,小球藻(B)和球等鞭金藻(A)投喂组幼虫体长日增长率显著高于其他单一饵料投喂组(P<0.05),但A组和B组间无显著性差异(P>0.05),在海洋红酵母(D)单一饵料投喂组中,单环刺螠初孵担轮幼虫未能成功发育成为体节幼虫;所有饵料投喂组幼虫生长的多重比较分析结果显示,A+B混合饵料和A+B+E(酵母粉)混合饵料组的初孵担轮幼虫至后期体节幼虫时的体长日增长率显著高于其他饵料组(P<0.05),但A+B组和A+B+E组间无显著性差异(P>0.05)(表2)。
从整个浮游期幼虫的成活率来看,A、B单一饵料投喂组的体节幼虫成活率显著高于其他单一饵料投喂组(P<0.05),但A、B饵料组间幼虫成活率无显著性差异(P>0.05);所有饵料投喂组幼虫成活率的多重比较分析结果显示,A、B饵料组及所有包含A+B的混合饵料组中体节幼虫成活率均在67%以上,且显著高于其他饵料组(P<0.05),其中,A+B混合饵料组的幼虫成活率最高(72.96%±1.27%),但与A+B+C、A+B+D和A+B+E混合饵料组相比无显著性差异(P>0.05)(表2)。
表2 不同饵料投喂组后期体节幼虫体长、初孵担轮幼虫至后期体节幼虫体长的日增长率及体节幼虫成活率
Tab.2 Body length of the postlarva of segmentation, daily growth rate of body length from the newly hatched trochophore to segmentation larva and survival rate of the segmentation larva in the different groups

类型type饵料种类foodspecies后期体节幼虫体长/μmbodylengthofthepostlarvaofsegmentation体长日增长率/(%·d-1)dailygrowthrateinbodylength体节幼虫成活率/%survivalrateofthesegmentationlarva球等鞭金藻Isochrysisgalbana(A)960.21±4.55b23.24±0.36b70.62±1.65a小球藻Chlorellavulgaris(B)962.07±4.23b24.14±0.32b69.13±2.45a单一饵料singlefood小新月菱形藻Nitzschiaclosteriumf.minutissima(C)954.92±6.89c19.96±0.45c46.47±0.42c海洋红酵母(D)——0活性干酵母(E)949.93±7.21d16.08±0.56d29.52±1.56eA+B970.40±3.56a29.42±0.28a72.96±1.27aB+C956.51±6.12c21.53±0.38c63.35±0.51b混合饵料mixedfoodD+E932.03±8.12e16.25±0.67d42.28±1.47dA+B+C958.05±4.26b22.39±0.41b67.29±0.89aA+B+D961.18±3.78b24.06±0.32b68.14±0.79aA+B+E972.97±3.21a27.37±0.28a71.43±1.18a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note: The means with different letters within same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
从初孵担轮幼虫至出现蠕虫状幼虫的发育时间分析,A和B两个单一饵料投喂组的初孵担轮幼虫至出现蠕虫状幼虫的时间显著短于其他单一饵料投喂组(P<0.05),但A、B组间无显著性差异(P>0.05),D单一投喂饵料组中,单环刺螠初孵担轮幼虫未能成功发育成为蠕虫状幼虫;所有饵料投喂组幼虫生长发育时间的多重比较分析结果显示,含有A和/或B的单一及混合饵料组的初孵担轮幼虫至出现蠕虫状幼虫时间均显著短于其他饵料组(P<0.05),尤其是A+B和A+B+E混合饵料组的初孵担轮幼虫至出现蠕虫状幼虫时间分别为(16.00±0.03)、(17.30±0.03)d,显著短于其他饵料组(P<0.05)(表3)。
表3 不同饵料投喂组初孵担轮幼虫至出现蠕虫状幼虫的时间及幼虫变态率
Tab.3 Development days and metamorphosis rates from the newly hatched trochophore to the worm-shaped larva in different groups
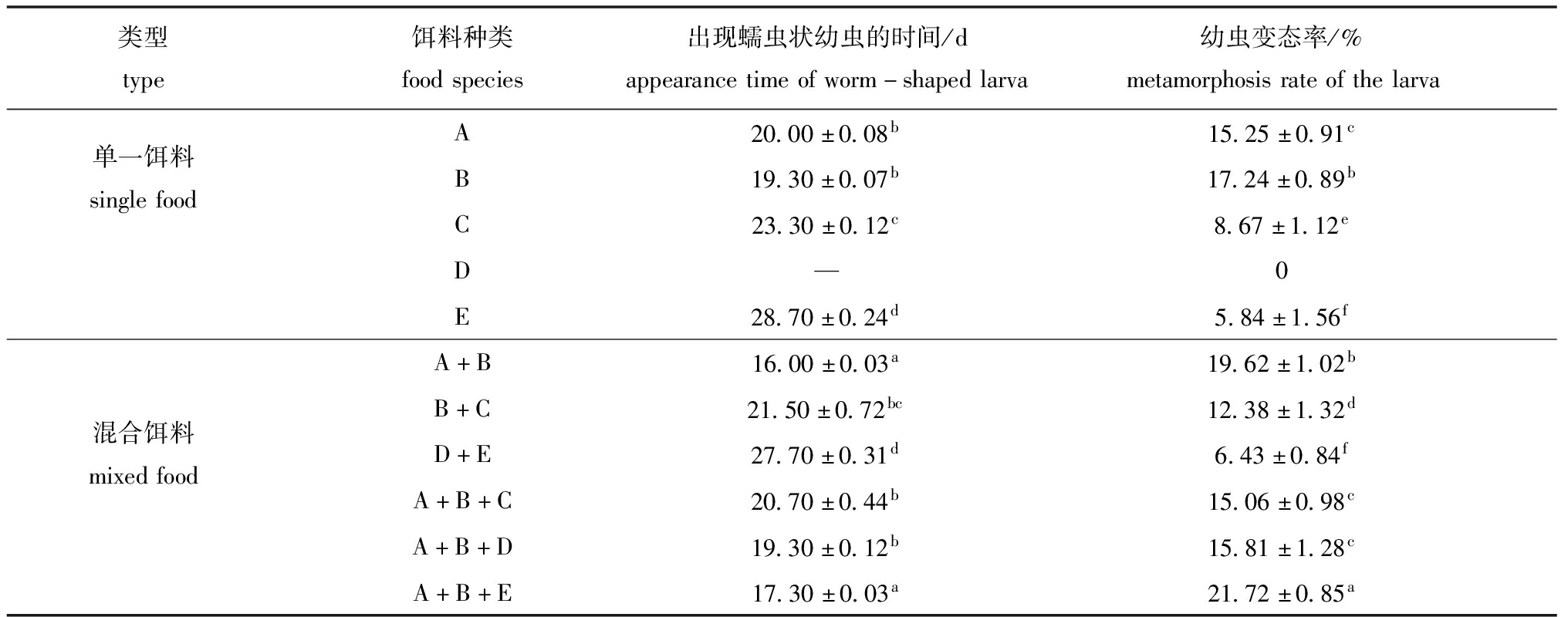
类型type饵料种类foodspecies出现蠕虫状幼虫的时间/dappearancetimeofworm-shapedlarva幼虫变态率/%metamorphosisrateofthelarvaA20.00±0.08b15.25±0.91c单一饵料singlefoodB19.30±0.07b17.24±0.89bC23.30±0.12c8.67±1.12eD—0E28.70±0.24d5.84±1.56fA+B16.00±0.03a19.62±1.02bB+C21.50±0.72bc12.38±1.32d混合饵料mixedfoodD+E27.70±0.31d6.43±0.84fA+B+C20.70±0.44b15.06±0.98cA+B+D19.30±0.12b15.81±1.28cA+B+E17.30±0.03a21.72±0.85a
从幼虫变态率来看,A、B两个单一饵料投喂组的幼虫变态率显著高于其他单一饵料投喂组(P<0.05),且A、B组间幼虫变态率有显著性差异(P<0.05);所有饵料投喂组幼虫变态率的多重比较分析结果显示,A、B及所有包含A+B的混合饵料组中幼虫变态率均在15%以上,且显著高于其他饵料组(P<0.05),其中,A+B+E投喂组幼虫变态率最高(21.72%±0.85%),显著高于其他饵料组(P<0.05)。
2.3 饵料配比和投喂方式对幼虫变态的影响
参考“2.2节”试验结果,综合考虑幼虫成活率和变态率情况,结果表明,小球藻+球等边金藻+酵母粉的混合饵料投喂组整体培育效果最佳。在此基础上,设计了该组3种饵料在不同配比和投喂方式下对幼虫变态的影响试验。结果显示,不同饵料配比和投喂方式对单环刺螠组内幼虫发育齐整度(水中无浮游幼虫时间与最早出现蠕虫状幼虫时间差)和变态率存在显著影响(表4)。从幼虫变态率来看,当投喂方式相同(即同时搭配投喂或分期投喂)、饵料配比不同时,小球藻、球等鞭金藻、酵母粉3种饵料按照2∶1∶1比例混合投喂试验组(Ⅱ、Ⅴ组)的幼虫变态率显著高于同种投喂方式下其他比例试验组(P<0.05);所有试验组幼虫变态率的多重比较分析结果显示,小球藻、球等鞭金藻、酵母粉3种饵料按照2∶1∶1比例混合,在担轮幼虫前期只投喂小球藻+金藻,至担轮幼虫中后期增加投喂酵母粉的试验组(V组)的幼虫变态率最高(24.73%±0.78%),且显著高于其他各组(P<0.05)(表4)。
表4 小球藻、球等鞭金藻、酵母粉3种饵料配比和2种投喂方式对初孵担轮幼虫至出现蠕虫状幼虫的时间、水中无浮游幼虫时间与最早出现蠕虫状幼虫时间差及幼虫变态率的影响
Tab.4 Time from the newly hatched trochophore to worm-shaped larva and the time between no planktonic larva in the water and the earliest worm-shaped larva appearance and metamorphosis rate of larva under different diet ratios of Chlorella vulgaris, Isochrysisgalbana and yeast powder

投喂方式feedingmode组别group饵料配比differentfeedratio出现蠕虫状幼虫的时间/dappearancetimeofworm-shapedlarva时间差/dtimedifference幼虫变态率/%metamorphosisrateofthelarvaⅠ1∶1∶116.70±0.54a3.80±0.23b20.19±0.89bcⅡ2∶1∶116.50±0.35a2.80±0.31a21.68±1.12b同时搭配投喂simultaneousfeedingⅢ3∶1∶118.30±0.63bc4.20±0.36c15.64±0.94dⅣ1∶1∶117.70±0.55ab3.60±0.38b22.05±0.84bⅤ2∶1∶117.30±0.32ab3.00±0.21a24.73±0.78aⅥ3∶1∶118.50±0.78bc4.80±0.60d17.28±0.97c分期投喂stagingfeedingⅦ2∶1∶218.30±0.69bc4.20±0.43c19.47±1.21cⅧ2∶1∶219.00±0.80c4.70±0.32d18.56±1.03c
从水中无浮游幼虫时间与最早出现蠕虫状幼虫时间差来看,当投喂方式相同,饵料配比不同时,小球藻、球等鞭金藻、酵母粉3种饵料按照2∶1∶1比例混合投喂试验组(II和V组)的水中无浮游幼虫时间与最早出现蠕虫状幼虫时间差显著小于同种投喂方式下的其他比例试验组(P<0.05);所有试验组水中无浮游幼虫时间与最早出现蠕虫状幼虫时间差的多重比较分析结果显示,II组和V组的水中无浮游幼虫时间与最早出现蠕虫状幼虫时间差分别为(2.8±0.31)、(3.0±0.21)d,两者均显著小于其他各组(P<0.05),但II和V组间无显著性差异(P>0.05)。水中无浮游幼虫时间与最早出现蠕虫状幼虫时间差越小,表明组内幼虫发育齐整程度越好。
2.4 不同发育阶段幼虫的适宜投喂量
参考“2.2节”和“2.3节”试验结果,综合考虑成活率和变态率均较高的投喂组为小球藻、球等鞭金藻、酵母粉3种饵料按照2∶1∶1比例混合,在担轮幼虫前期只投喂小球藻+金藻,至担轮幼虫中后期增加投喂酵母粉的试验组。进一步根据试验过程中对水中存留饵料细胞密度测量及对幼虫胃饱满程度观察,获得幼虫不同培育阶段适宜饵料日投喂量及投喂方法(表5)。初孵担轮幼虫期饵料日投喂量为2×104 cells/mL,随着幼虫发育饵料投喂量逐渐增加,当出现蠕虫状幼虫时,饵料投喂数量增加至10×104~12×104 cells/mL。
表5 幼虫不同培育阶段的饵料日投喂量及投喂方法
Tab.5 Daily feeding amount and feeding method of larvae at different cultivation stages

幼虫生长发育阶段larvalgrowthstage培育用水中饵料细胞数量/(cells·mL-1)numberoffoodcellsinculturewater投喂方法feedingmethod初孵担轮幼虫2×104保持该投喂量担轮幼虫中期3.5×104~4.0×104逐渐增加投喂量担轮幼虫后期4.5×104~5.0×104保持该投喂量中期体节幼虫7×104~8×104保持该投喂量出现蠕虫状幼虫时10×104~12×104保持该投喂量
3 讨论
3.1 搭配小球藻和球等鞭金藻的饵料更适合单环刺螠幼虫的生长发育
动物幼虫的生长发育受许多因素影响,合适的饵料是幼虫生长发育和提高存活率的重要影响因子
之一。饵料品种不适宜,会大大降低幼虫的生长发育速度,甚至导致幼虫变态失败和发育终止[17]。本研究结果显示,单一饵料投喂时,小球藻投喂组与球等鞭金藻投喂组的体节幼虫体长日增长率和幼虫成活率均显著高于其他单一饵料投喂组;混合饵料投喂结果显示,含有小球藻和/或球等鞭金藻的饵料混合组中体节幼虫的成活率和蠕虫状幼虫的变态率均显著高于其他饵料投喂组,其中,小球藻+球等边金藻+酵母粉的混合饵料投喂组整体培育效果最佳,这表明小球藻和球等鞭金藻是单环刺螠幼虫生长发育的较好鲜活饵料品种,同时考虑混合饵料可以更全面地提供幼虫发育所需要的营养,以及降低育苗成本,建议在单环刺螠苗种大规模繁育中使用小球藻+球等鞭金藻+酵母粉或其他低成本饵料。本研究中,混合饵料投喂可以更有效地促进幼虫生长和发育的结论与常林瑞等[16]报道的饵料对单环刺螠幼螠生长影响的研究结果一致。
3.2 不同发育阶段幼虫对饵料的选择不同
不同生物种类幼虫发育对饵料的选择是不同的,同种生物幼虫不同发育阶段对饵料的种类要求也不一样。如大多数贝类刚孵化的幼虫因口径较小,开口饵料一般会选择细胞较小的金藻或者小球藻等,当幼虫发育到口径较大的壳顶初期后,可投喂细胞较大的扁藻[18]。方格星虫的孵化幼虫因口径比较大,目前人工育苗常用的十几种单细胞藻类均可作为其开口饵料,但进一步研究显示,作为开口饵料投喂时,金藻试验组要比扁藻试验组获得的方格星虫日增长率更高[18]。本研究中单一饵料投喂结果显示,小球藻与球等鞭金藻投喂组的单环刺螠体节幼虫成活率和体长日增长率相当,但小球藻投喂组的蠕虫状幼虫变态率要显著高于球等鞭金藻投喂组,故用单一饵料投喂时,小球藻是作为单环刺螠开口饵料更好的选择。不同饵料配比及投喂方式对幼虫变态影响的试验结果显示,将小球藻、球等鞭金藻、酵母粉3种饵料按照2∶1∶1的比例混合搭配,在担轮幼虫前期只投喂小球藻+球等鞭金藻,至担轮幼虫中后期增加投喂酵母粉,能够获得较高的幼体成活率和变态率,故将其确定为单环刺螠幼虫不同发育阶段的最佳饵料投喂方案。
另外,本研究中不同饵料配比及投喂方式对幼虫发育和变态时间影响的试验结果显示,饵料中小球藻的投喂比例偏高或偏低时,水中无浮游幼虫时间与最早出现蠕虫状幼虫时间差均会延长,即幼虫发育齐整度会降低,将不利于幼虫变态集中进行;相同的饵料配比时,推迟使用酵母粉,幼虫发育及变态时间会有所延长;增加酵母粉使用比例,幼虫发育及变态时间也会相对延长。因此,合理控制饵料中小球藻的使用比例,并适时增加投喂酵母粉,对提高幼虫发育的齐整度及幼虫变态率可起到促进作用。以上研究结果均表明,饵料的营养效果与幼虫发育的阶段性需求有很大的关系[18]。建议在进行幼虫培育时,有必要根据幼虫的不同发育阶段适当调整饵料的品种和配比。
3.3 适宜投饵量应根据幼虫培育密度确定
除饵料品种外,饵料数量也是关系到幼虫培育成功的又一关键要素。幼虫发育进入一个新阶段,需要消耗大量的体能。在单环刺螠幼虫培育过程中,足量投喂适宜的饵料是苗种繁育工作成功的关键。本研究结果显示,当饵料品种适宜,但投喂量不足时,会致使幼虫生长缓慢,成活率与变态率大幅降低,在发育进入下一个阶段时,极易出现大量死亡甚至全部死亡的情况。这应该与幼虫营养储备不足有着直接关系。这与兰国宝等[18]对方格星虫幼体饵料研究的结果一致。但是,饵料密度并非越高越好,本研究中饵料数量对幼虫生长发育影响的试验结果,以及兰国宝等[18]对方格星虫幼体饵料研究的结果均表明,当投饵密度过高时,幼虫存活率也会下降。一般情况下,投饵量的多少应与幼虫培育密度有关。在人工培育过程中,幼虫的培育密度不宜过大,本研究中采取综合考虑培育水体中饵料细胞的数量和幼虫摄食情况两个方面,通过对投喂前水中存留的饵料细胞密度的测量及对幼虫胃饱满程度的观察,以幼虫胃饱满时水中饵料细胞密度达到1×104 cells/mL左右为标准,确定了不同幼虫生长阶段的饵料适宜日投喂量。
4 结论
本研究中通过一系列的对比试验,根据饵料品种及饵料配比对幼虫生长及变态率等的影响进行了分析,首次总结形成了单环刺螠幼虫培育的最佳饵料系列和最佳投喂方案,并确定了幼虫培育适宜的饵料投喂量,为单环刺螠规模化苗种繁育生产奠定了基础。
1)单一饵料投喂时,小球藻是单环刺螠幼虫培育较好的开口饵料。
2)混合饵料投喂时,小球藻+球等边金藻+酵母粉的饵料组合对单环刺螠幼虫培育效果最佳。
3)综合考虑成活率和变态率情况,单环刺螠幼虫培育的最佳饵料投喂方案为,将小球藻、球等鞭金藻、酵母粉3种饵料按照2∶1∶1比例混合,在担轮幼虫前期只投喂小球藻+球等鞭金藻,至担轮幼虫中后期增加投喂酵母粉。
4)不同发育阶段幼虫的适宜投喂量确定为:初孵担轮幼虫期饵料日投喂量为2×104 cells/mL,随着幼虫发育饵料投喂量逐渐增加,当出现蠕虫状幼虫时日投喂量应增加至10×104~12×104 cells/mL。
[1] 殷守仁.水生动物与人类健康[M].北京:中国农业出版社,2008.
YIN S R.Aquatic animals and human health[M].Beijing:China Agriculture Press,2008.(in Chinese)
[2] 许星鸿,朱佶轩,霍伟,等.单环刺螠人工育苗及养殖技术[J].海洋与渔业,2016(3):44-45.
XU X H,ZHU J X,HUO W,et al.Artificial seedling and breeding technology of Urechis unicinctus[J].Ocean and Fisheries,2016(3):44-45.(in Chinese)
[3] 王雷,刘海梅,彭鸽,等.单环刺螠营养成分及体内活性物质的研究进展[J].鲁东大学学报(自然科学版),2011,27(4):342-345.
WANG L,LIU H M,PENG G,et al.Research advance on the nutrient component and bioactive substance in Urechis unicinctus[J].Journal of Ludong University(Natural Science Edition),2011,27(4): 342-345.(in Chinese)
[4] 郑岩,白海娟,王亚平,等.单环刺螠对水温、盐度和pH的耐受性的研究[J].水产科学,2006,25(10):513-516.
ZHENG Y,BAI H J,WANG Y P,et al.Tolerance of Urechis unicoinctus juveniles to temperature,salinity and pH value[J].Fisheries Science,2006,25(10):513-516.(in Chinese)
[5] 王力勇,赵强,张玉恒,等.单环刺螠的生活习性及其对环境因子的耐受性试验[J].齐鲁渔业,2016,33(7):10-12.
WANG L Y,ZHAO Q,ZHANG Y H,et al.Habits and tolerance tests to environmental factors of Urechis unicoinctus[J].Qilu Fisheries,2016,33(7):10-12.(in Chinese)
[6] 刘峰,孙涛,纪元,等.单环刺螠生物学及生态学研究进展[J].海洋科学,2017,41(10):125-131.
LIU F,SUN T,JI Y,et al.Advances in studies on the biology and ecology of Urechis unicinctus[J].Marine Sciences,2017,41(10):125-131.(in Chinese)
[7] 李海涵,刘胥,孙娜,等.盐度和底质对单环刺螠幼螠生长及成活的影响[J].湖南农业科学,2019(4):85-88.
LI H H,LIU X,SUN N,et al.Effects of salinity and sediment on growth and survival of Urechis unicoinctus juveniles[J].Hunan Agricultural Science,2019(4):85-88.(in Chinese)
[8] 夏玉秀,申旭红,任爽宁,等.不同干露条件单环刺螠的耐受性及对体表黏液特性的影响[J].大连海洋大学学报,2019,34(4):538-544.
XIA Y X,SHEN X H,REN S N,et al.Air exposure tolerance and characteristics of surface mucus in echiuran worm Urechis unicinctus in wet sand with and without water[J].Journal of Dalian Ocean University,2019,34(4): 538-544.(in Chinese)
[9] 牛从从,张志峰,邵明瑜.单环刺螠虫精子生物学特性和环境因子的关系[J].中国水产科学,2005,12(5):556-561.
NIU C C,ZHANG Z F,SHAO M Y.Biological characteristics of Urechis uniconctus sperm and the effects of environmental factors on sperm vitality[J].Journal of Fishery Sciences of China,2005,12(5): 556-561.(in Chinese)
[10] 李昀,王航宁,邵明瑜,等.单环刺螠生殖腺的发生及雌体的生殖周期[J].中国海洋大学学报,2012,42(6):81-84.
LI Y,WANG H N,SHAO M Y,et al.Gonadal ontogenesis and annual development of ovary and oogenesisi in Urechis unicinctus[J].Periodical of Ocean University of China,2012,42(6): 81-84.(in Chinese)
[11] 唐永政,刘红梅,车育.单环刺螠人工育苗技术要点[J].中国水产,2007(3):56.
TANG Y Z,LIU H M,CHE Y.Artificial seedling technology of Urechis unicinctus[J].Chinese Aquaculture,2007(3):56.(in Chinese)
[12] 王力勇,胡丽萍,姜黎明,等.单环刺螠的人工苗种生产研究:Ⅰ.环境因子对单环刺螠受精与孵化的影响[J].中国渔业质量与标准,2017,7(4):37-44.
WANG L Y,HU L P,JIANG L M,et al.Artificial seed production of Urechis unicinctus I.influence of environmental factors on fertilization and hatching Urechis unicinctus[J].Chinese Fishery Quality and Standards,2017,7(4):37-44.(in Chinese)
[13] 刘学迁,刘志君,常林瑞,等.单环刺螠规模化人工育苗技术[J].河北渔业,2019(6):11-13.
LIU X Q,LIU Z J,CHANG L R,et al.Scaled artificial seedling raising technology of Urechis unicinctus[J].Hebei Fisheries,2019(6):11-13.(in Chinese)
[14] 郑岩,刘胥,李晓东,等.单环刺螠人工育苗与土池养殖技术[R].沈阳:辽宁省科技成果,2007.
ZHENG Y,LIU X,LI X D,et al.Artificial seedling raising and earthen pond breeding technology of Urechis unicinctus[R].Shenyang: Scientific and Technological Achievement of Liaoning Province,2007.(in Chinese)
[15] 王淑芬,唐永政,李德顺,等.单环刺螠与日本对虾池塘混养试验[J].中国水产,2016(2):85-86.
WANG S F,TANG Y Z,LI D S,et al.[J].Mixed culture experiment in pond between Urechis unicinctus and Penaeus japonicus[J].Chinese Aquaculture,2016(2): 85-86.(in Chinese)
[16] 常林瑞,李世顺,崔庆奎.单环刺螠幼体生长及摄食强度的研究[J].大连海洋大学学报,2018,33(3):336-340.
CHANG L R,LI S S,CUI Q K.Growth and feeding intensity of juvenile echiuran worm Urechis unicinctus[J].Journal of Dalian Ocean University,2018,33(3): 336-340.(in Chinese)
[17] 朱建新,刘慧,冷凯良,等.几种常用饵料对稚幼参生长影响的初步研究[J].海洋水产研究,2007,28(5):48-53.
ZHU J X,LIU H,LENG K L,et al.Studies on the effects of some common diets on the growth of Apostichopus japonicus[J].Marine Fisheries Research,2007,28(5):48-53.(in Chinese)
[18] 兰国宝,廖思明,阎冰,等.方格星虫幼体饵料研究[J].水产科学,2005,24(2):1-4.
LAN G B,LIAO S M,YAN B,et al.Natural food in larval peanut worm(Sipunculus nudus)[J].Fisheries Science,2005,24(2): 1-4.(in Chinese)