传染性胰脏坏死病毒(infectious pancreas necrosis virus,IPNV)属于双RNA病毒科Birnaviridae水生双RNA病毒属Aquabirnavirus,是引起传染性胰腺坏死病(infectious pancreatic necrosis,IPN)的病原体[1],其主要危害鲑鳟幼鱼,致死率高达70%以上[2],同时也可使成年鲑鳟及许多其他鱼类发生严重的急性感染,此外,在一些软体动物和甲壳动物中也分离到了IPNV[3]。传染性胰脏坏死病于20世纪50年代在美国首次暴发,目前,该病已在欧洲、亚洲和非洲广泛流行[4]。1986年在中国山西省某虹鳟Oncorhynchus mykiss渔场首次暴发传染性胰腺坏死病(IPN)[5],随后在甘肃[6]、山东[7]、辽宁[8]、云南[9]和四川[10]等省份接连暴发了该疫情,患病虹鳟死亡率高达90%,给鲑鳟养殖业带来了巨大的经济损失。
IPNV基因组由A、B两个线性dsRNA分子组成,A链编码非结构蛋白VP5和pVP2-VP4-VP3多聚蛋白前体[11],其中,VP4作为病毒蛋白酶将多聚蛋白切开释放结构蛋白VP2和VP3[12];B链编码聚合酶蛋白VP1[13]。许多学者已对VP2蛋白的结构和功能进行了研究,并首先确定了VP2蛋白是IPNV的主要保护性抗原[14-16]。Tarrab等[17]利用抗VP3单克隆抗体检测到病毒粒子表面有部分VP3蛋白存在;Park等[18]研究发现,VP3蛋白也存在中和抗原表位;Moon等[19]用纯化后的VP3和VP2蛋白分别免疫虹鳟,也证明VP3蛋白和VP2蛋白一样,具有中和抗原表位,且具有较好的免疫原性。因此,VP3蛋白也是IPNV重要的保护性抗原。
尽管IPNV在中国流行多年,但是目前中国仍无有效防控传染性胰脏坏死病的药物,对待该病的防控方法主要以切断病原传播为主,故而对IPNV的全面监测尤为重要。目前,全球IPNV可分为6个基因型(Genogroup Ⅰ~genogroup Ⅵ),共包含9个血清型[20-21],不同基因型IPNV毒株的基因序列差异较大,核酸检测方法在IPNV检测中具有一定的局限性,较难实现使用一对引物覆盖所有基因型的IPNV毒株。因此,极有必要丰富IPNV的检测方法,为IPNV的有效监测提供保障。本研究中,选取IPNV毒株ChRtm213[9],利用大肠杆菌对其VP3基因进行体外表达及纯化,同时制备鼠抗血清,并成功将该血清应用到中国不同地区Genogroup Ⅰ和Genogroup Ⅴ型IPNV分离株的免疫学鉴定,旨在为IPNV的监测提供保障。
1 材料与方法
1.1 材料
本研究中所用IPNV和传染性造血器官坏死病毒(IHNV)均由黑龙江省水产动物疾病与免疫技术重点实验室在中国养殖虹鳟流行病学调查过程中分离保存,其中,IPNV-QH、IPNV-LN和IPNV-GS的基因型为Genogroup Ⅴ,ChRtm213[9]、IPNV-JL和IPNV-HLJ的基因型为Genogroup Ⅰ。
病毒性出血性败血症病毒(VHSV)毒株购自中国典型培养物保藏中心。大鳞大麻哈鱼胚胎细胞(chinook salmon embryo cells,CHSE-214)由中国水产科学研究院长江水产研究所鱼类病害研究室曾令兵教授惠赠;大肠杆菌DH5α和Rosetta菌株及pET-32a表达载体均由本课题组保存。
pMD19-T simple载体、T4 DNA连接酶、限制性内切酶、PrimeScriptTM One Step RT-PCR Kit Ver 2.0均购自宝生物工程(大连)有限公司;PCR产物纯化及胶回收试剂盒、质粒提取试剂盒购自Omega公司;HRP标记的羊抗鼠IgG和FITC标记的羊抗鼠IgG购自Abcam公司;其他化学试剂均为分析纯。
1.2 方法
1.2.1 引物设计 根据IPNV ChRtm213毒株 VP3基因序列(NCBI登录号:KX234591),利用Primer Premier 5.0 软件设计扩增IPNV VP3基因的引物。上游引物VP3-F带有BamH Ⅰ酶切位点:5′ GGATCCATGGACGCAGAACTGCAAGGGCTGC 3′;下游引物VP3-R带有Sal Ⅰ酶切位点:5′ GTCGACCACTTCTCCGTCATCGCCGGAG 3′。引物均由哈尔滨博仕生物公司合成。
1.2.2 IPNV VP3 基因的克隆及表达载体构建 以实验室保存的IPNV(ChRtm213)RNA为模板,以VP3-F和VP3-R为引物,利用一步法RT-PCR试剂盒克隆获得VP3 ORF,胶回收纯化后与pMD19-T simple连接,菌液经PCR和测序鉴定后,将测序正确的质粒命名为pMD19-T-VP3。将pMD19-T-VP3和表达载体pET-32a分别利用BamH Ⅰ和Sal Ⅰ限制性内切酶消化并回收,将使用T4 DNA连接酶连接后的产物转化至大肠杆菌DH5α中,涂布于含氨苄西林的琼脂糖固体培养基,于37 ℃下过夜培养后挑取单菌落,进行菌液PCR鉴定,将鉴定正确的菌液扩大培养并提取质粒,对质粒进行BamH Ⅰ和Sal Ⅰ双酶切鉴定,鉴定正确的重组质粒命名为pET-32a-VP3。
1.2.3 IPNV VP3 蛋白的表达与纯化 将重组pET-32a-VP3质粒转入大肠杆菌Rosetta中,于37 ℃下以100 r/min振荡培养。当菌液OD600 nm值达到0.3~0.4时,加入IPTG诱导剂(终浓度为0.25 mmol/L)继续培养。诱导后5 h内每小时收集1 mL菌液,同时收集未诱导菌液作为阴性对照。经超声破碎后,将全菌、上清及沉淀样本用质量分数12%的SDS-PAGE凝胶进行电泳,以分析VP3蛋白的表达情况。
超声破碎后的上清液使用镍离子亲和层析柱纯化,依次使用含有10、20、30、40 mmol/L咪唑的洗涤液洗涤层析柱以去除杂蛋白,然后利用含有250 mmol/L咪唑的洗脱液收集目的蛋白,放入PBS溶液中(pH 8.0)透析24 h。透析结束后,于4 ℃下以12 000 r/min离心5 min,收获的上清液即为纯化的VP3蛋白,用紫外分光光度计测定纯化后蛋白的浓度。利用质量分数12%的SDS-PAGE电泳分析VP3蛋白的纯化情况。
1.2.4 IPNV VP3 蛋白抗血清的制备 将纯化后的VP3蛋白无菌过滤,采用0.5 mg/kg的免疫剂量,根据文献[14]中的方法对Balb/c小鼠进行皮下多点注射。将重组VP3蛋白与弗氏完全佐剂等体积混合,乳化后免疫小鼠;免疫10 d后进行第2次免疫,将重组VP3蛋白与弗氏不完全佐剂等体积混合,完全乳化后免疫小鼠;第2次免疫10 d后进行第3次免疫,免疫方式与第2次相同;第3次免疫10 d后,通过眼球取血的方式收集免疫小鼠血液,进行血清分离,同时以PBS替代抗原免疫的小鼠血液制备的抗血清作为阴性对照。
1.2.5 IPNV VP3 蛋白抗血清效价检测 用IPNV病毒悬液和重组VP3蛋白分别进行包被,根据文献[14]中的酶联免疫吸附法(ELISA)检测抗血清蛋白效价。将“1.2.4节”中制备的鼠抗血清进行梯度稀释(体积比分别为1∶500、1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000),与包被的酶标板于37 ℃下孵育1 h。然后与HRP标记的羊抗鼠IgG(1∶10 000,稀释)于37 ℃下孵育1 h,用PBS洗去未被吸附的二抗,最后加入TMB底物液进行显色,置于37 ℃暗箱中反应5 min,每孔加入50 μL终止液。终止反应后于490 nm下测定OD值。
阴性对照为免疫PBS与佐剂的鼠血清,空白对照为PBS。当OD490 nm所读数值符合(阳性孔-空白孔)/(阴性孔-空白孔)>2.1时,判定样本为阳性,阳性血清最大稀释倍数即为抗血清效价[14]。
1.2.6 抗血清的应用 将所制备的抗血清应用到中国不同地区分离到的不同基因型的IPNV分离株的间接免疫荧光抗体法(IFAT)检测中。在CHSE-214单层细胞爬片上接种本实验室分离的6株IPNV毒株和IHNV、VHSV,在接毒后72 h取出接毒细胞爬片。将制备好的接毒细胞爬片用体积分数为4%的多聚甲醛固定,用PBS(pH 7.0)缓冲液洗涤3次,用体积分数为0.3%的BSA染色溶液于37 ℃下封闭1 h,再用PBS缓冲液洗涤,加入500倍稀释的鼠抗VP3蛋白血清作为一抗,37 ℃下孵育1 h,再用PBS缓冲液洗涤,将FITC标记的羊抗鼠IgG抗体稀释500倍后作为二抗,37 ℃下避光孵育1 h[22]。最后用PBS缓冲液洗涤后置于荧光显微镜下观察。设置阴性血清孵育的细胞作为阴性对照。
2 结果与分析
2.1 VP3 基因的克隆及表达载体的构建
以IPNV ChRtm213 RNA为模板,VP3-F和VP3-R为引物扩增VP3 ORF,经10 g/L琼脂糖凝胶电泳,结果显示,获得了符合目片段大小的PCR产物(711 bp)(图1)。利用BamH Ⅰ和Sal Ⅰ对重组质粒pET-32a-VP3进行酶切鉴定,结果获得与VP3基因和表达载体pET-32a大小相符的特异性条带(图2),说明已成功构建了用于VP3原核表达的重组质粒。
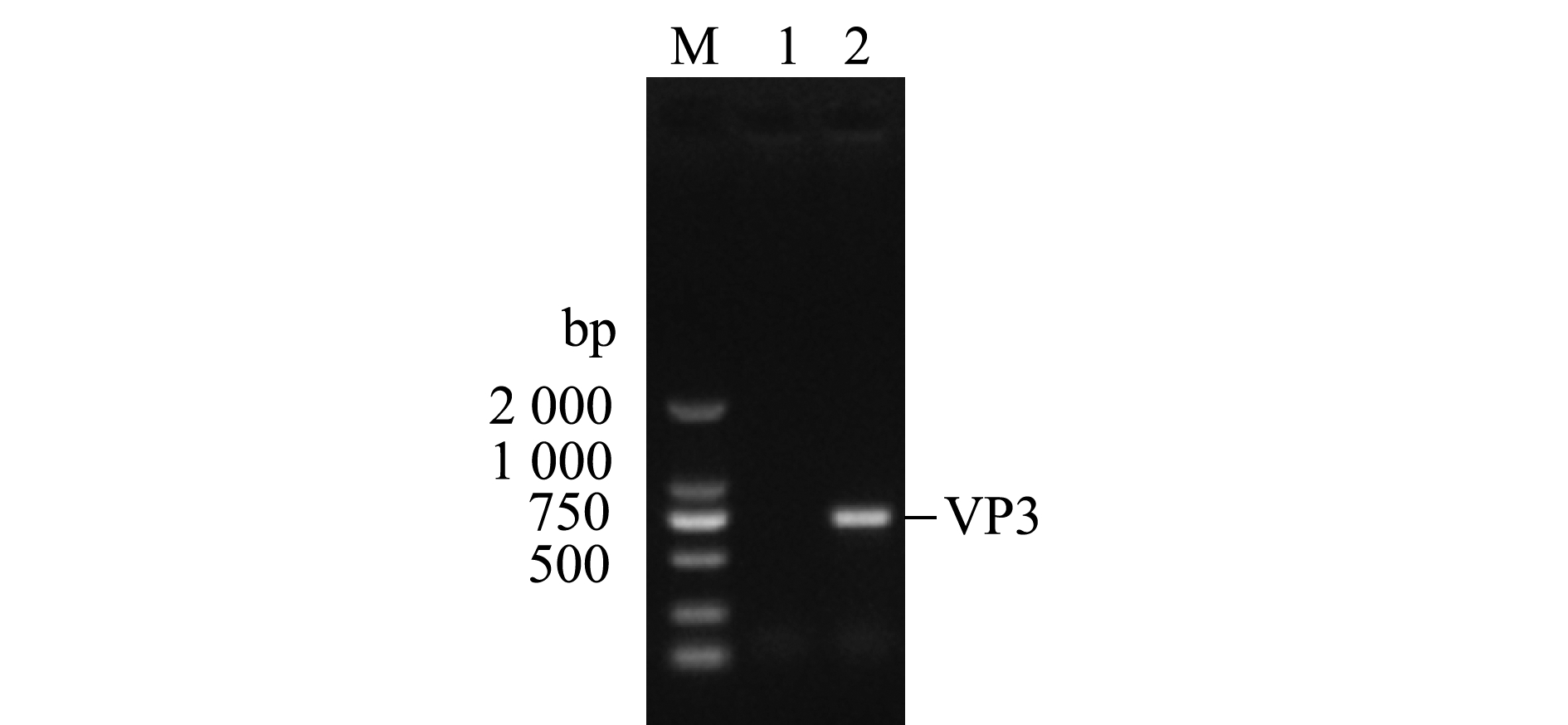
M—DL2000 DNA分子量标准;1—阴性对照;2—VP3基因的PCR产物。
M—DL2000 DNA marker;1—negative control;2—PCR product of VP3 gene.
图1 VP3基因的PCR扩增
Fig.1 Amplification of the VP3 gene
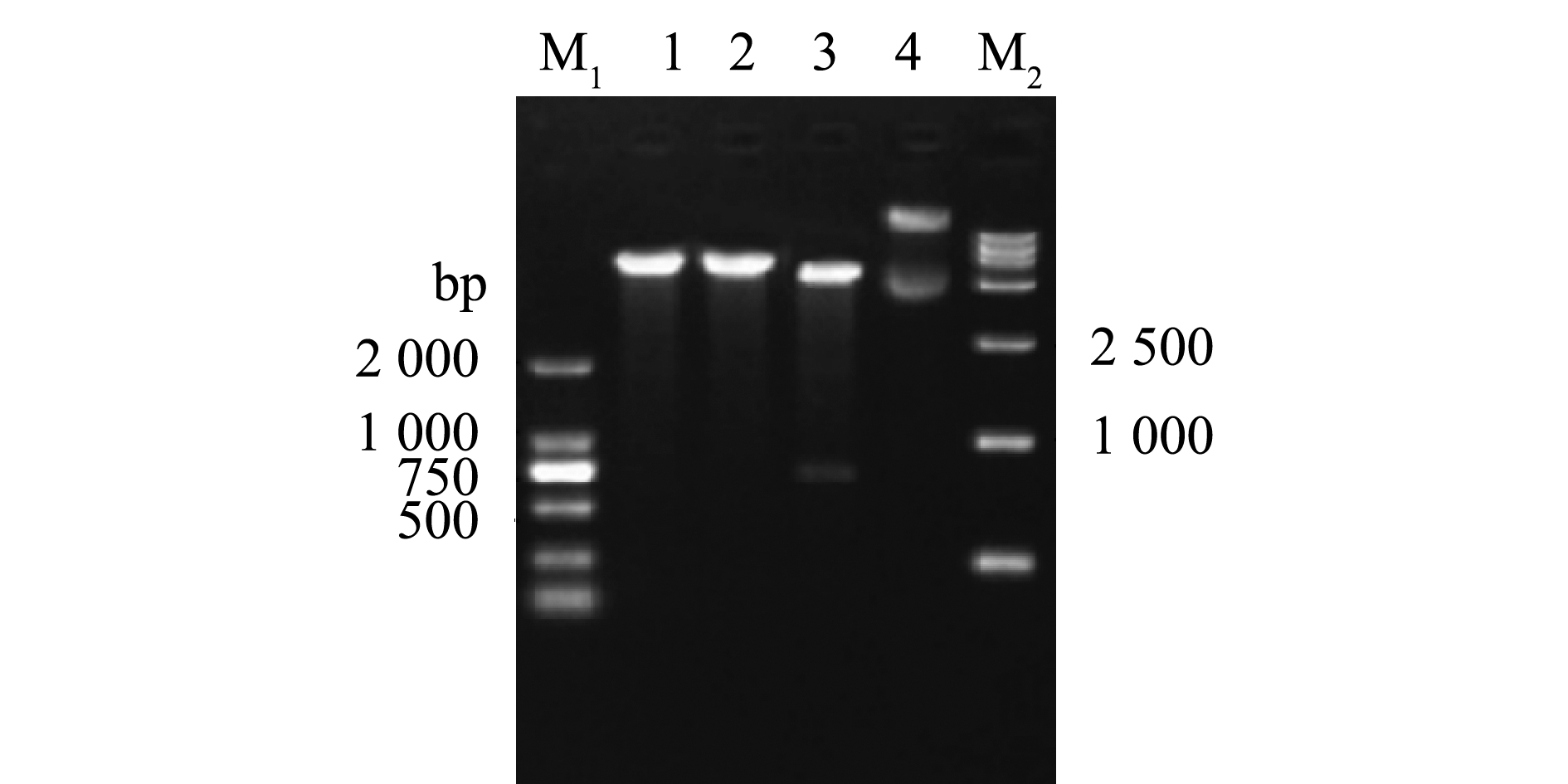
M1—DL2000 DNA分子量标准;M2—DL15000 DNA分子量标准;1—BamH Ⅰ单酶切; 2—Sal Ⅰ单酶切;3—BamH Ⅰ和Sal Ⅰ双酶切;4—pET-32a-VP3质粒。
M1—DL2000 DNA marker;M2—DL15000 DNA marker;1—single-digestion by BamH Ⅰenzyme; 2—single-digestion by Sal Ⅰenzyme;3—dual-digestion by BamH Ⅰenzyme and Sal Ⅰenzyme;4—pET-32a-VP3 plasmid.
图2 pET-32a-VP3重组质粒的酶切鉴定
Fig.2 Identification of pET-32a-VP3 by digestion
2.2 VP3 蛋白的诱导表达
将阳性pET-32a-VP3重组质粒转入大肠杆菌Rosetta进行诱导表达,对表达产物进行SDS-PAGE分析,结果显示,VP3蛋白成功获得表达,出现与目的条带大小相符的特异性蛋白条带(相对分子质量约为45 000),且随着诱导时间的延长,表达量逐渐上升(图3),在诱导后3 h表达量显著上升。此外,本研究中还发现,菌体破碎离心后的沉淀和上清液中均存在目的蛋白(图4),说明本研究中所表达的VP3蛋白以包涵体和可溶性蛋白两种形式存在。
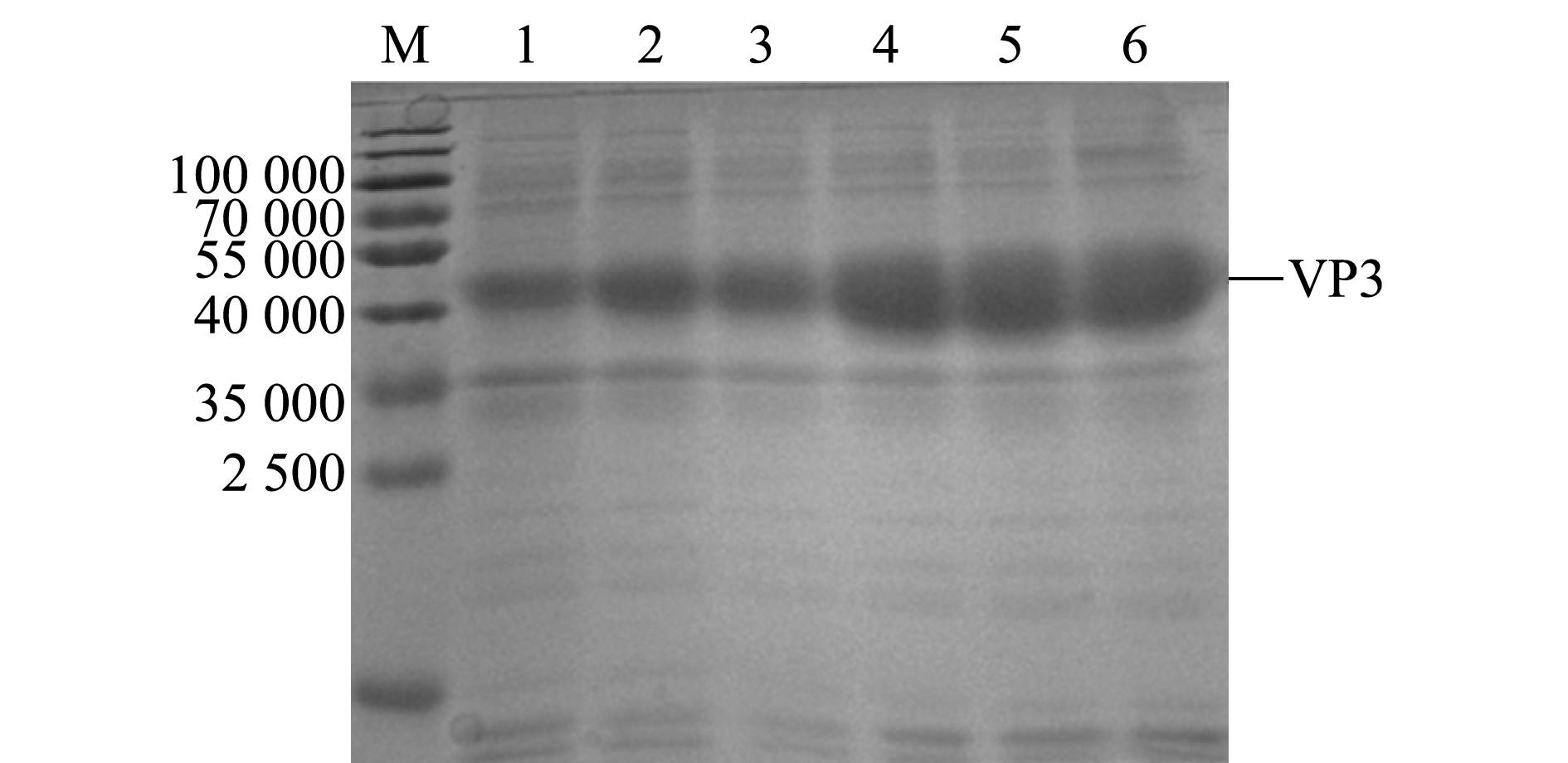
M—蛋白分子量标准;1—未诱导菌体;2~6—诱导1、2、3、4、5 h后菌体。
M—protein marker;1—uninduced bacteria;2-6—bacteria induced for 1,2,3,4 and 5 h.
图3 不同诱导时间下VP3蛋白的表达
Fig.3 VP3 protein expression induced for different hours
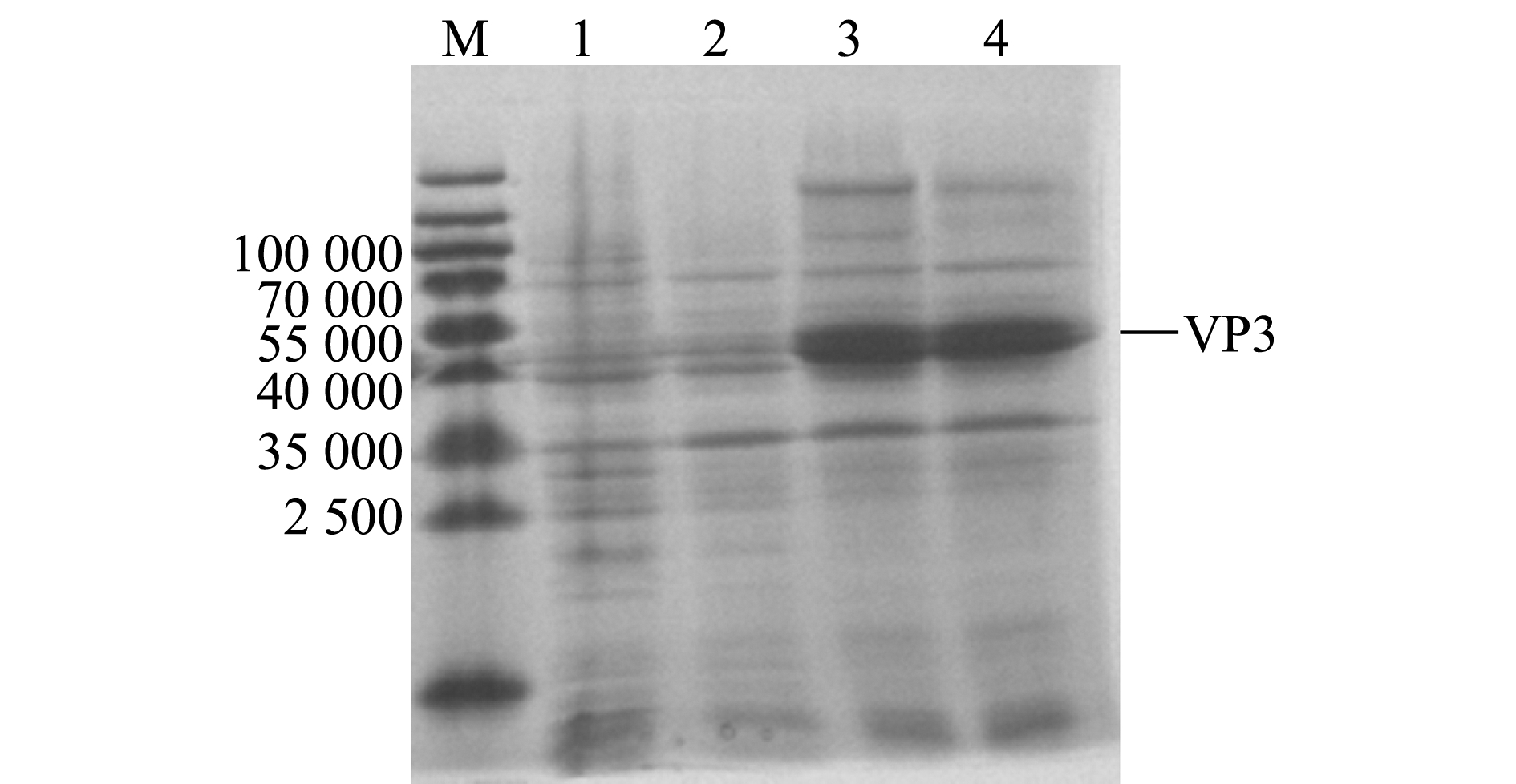
M—蛋白分子量标准;1—未诱导菌体破碎后上清;2—未诱导菌体破碎后沉淀;3—诱导后破碎菌体上清;4—诱导后破碎菌体沉淀。
M—protein marker;1—supernatant of uninduced crushing bacteria;2—sediment of uninduced crushing bacteria; 3—supernatant of induced crushing bacteria;4—sediment of induced crushing bacteria.
图4 VP3蛋白的可溶性分析
Fig.4 Solubility analysis of VP3 protein
2.3 VP3 蛋白的纯化
将超声破碎后所得上清经镍离子亲和层析柱纯化和PBS(pH 8.0)透析24 h后,对样品进行SDS-PAGE凝胶电泳分析,结果显示,纯化的VP3蛋白与目的条带大小相符且为单一条带,可用于VP3蛋白鼠抗血清的制备(图5)。
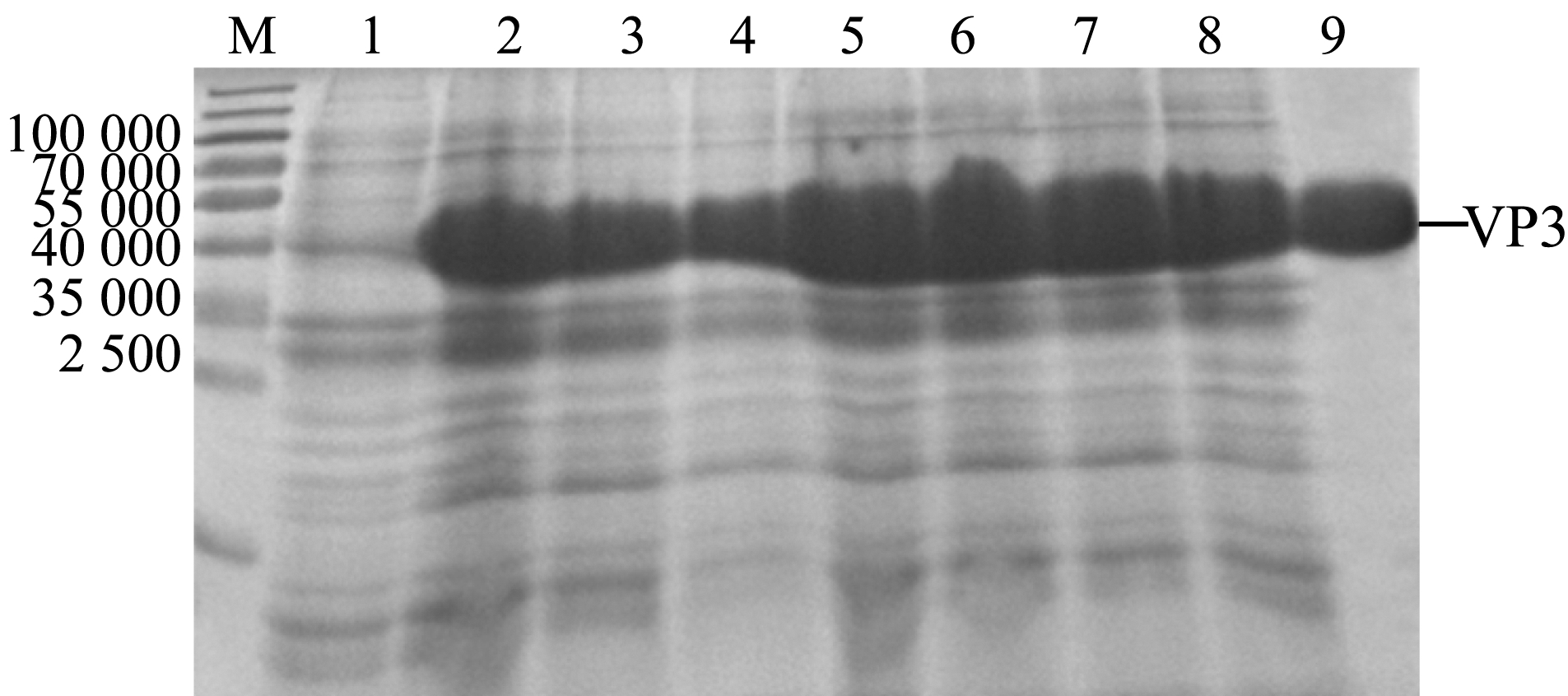
M—蛋白分子量标准;1—诱导前破碎菌体上清;2~8—诱导4 h破碎菌体上清;9—纯化后的VP3蛋白。
M—protein marker; 1—supernatant of uninduced crushing bacteria; 2-8—supernatant of crushing bacteria induced for 4 h;9—purified VP3 protein.
图5 VP3上清液蛋白纯化的SDS-PAGE分析
Fig.5 SDS-PAGE gel analysis of purified VP3 protein in supernatant
2.4 IPNV VP3 蛋白鼠抗血清效价的检测
利用本研究中所制备的抗血清对包被在酶标板上的IPNV和重组VP3蛋白进行酶联免疫吸附法检测。根据判定标准可知,该抗血清与IPNV的反应效价为16 000,与重组VP3蛋白的反应效价为32 000(图6)。这表明,本研究中所制备的抗血清不仅能与重组VP3蛋白发生特异性反应,还能与IPNV病毒粒子中的VP3蛋白发生特异性反应。证明本研究中所制备的重组VP3蛋白具有较好的免疫原性,所制备的抗VP3蛋白的鼠血清可以应用到IPNV的免疫学检测。
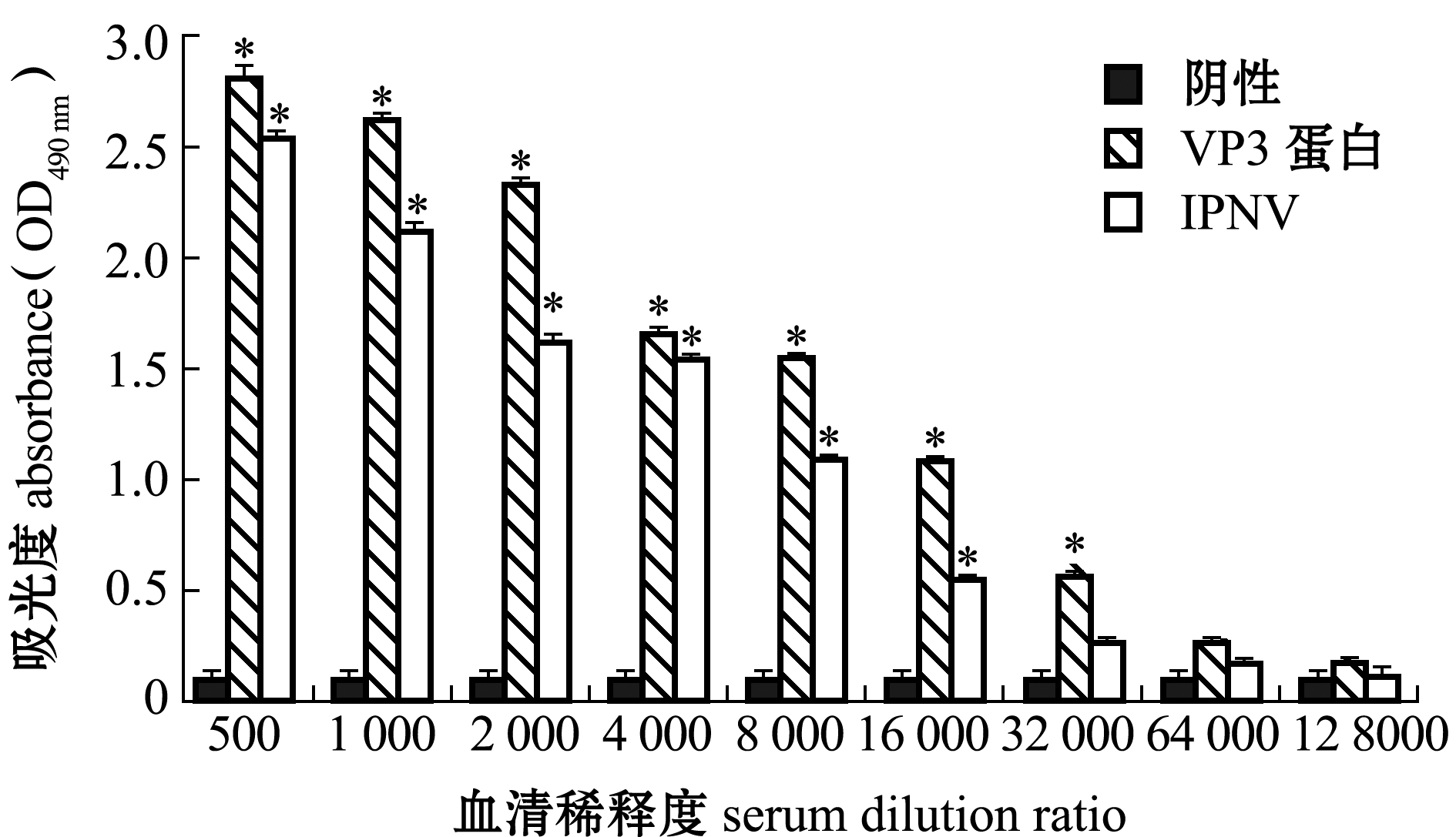
*表示与阴性对照组有显著性差异(P<0.05)。
* means significant difference compared with the negative control(P<0.05).
图6 抗血清效价的酶联免疫吸附法检测
Fig.6 ELISA analysis of serum titer
2.5 抗血清的应用
将制备的鼠抗血清应用到中国不同地区IPNV分离株的间接免疫荧光检测中,结果显示,抗血清与Genogroup Ⅰ型(IPNV-JL、IPNV-HLJ、ChRtm213)和Genogroup Ⅴ 型(IPNV-GS、IPNV-QH、IPNV-LN)的IPNV分离株均能发生特异性反应,呈现出特异性绿色荧光,而不能与IHNV和VHSV发生反应,无特异性荧光显色,阴性鼠血清孵育的病毒均无任何荧光(图7)。这表明,本研究中制备的鼠抗血清能够特异性识别不同地区基因型为Genogroup Ⅰ和Genogroup Ⅴ的IPNV分离株,且与其他鲑鳟常见病毒IHNV和VHSV均无交叉反应,可用于现行IPNV的监测。
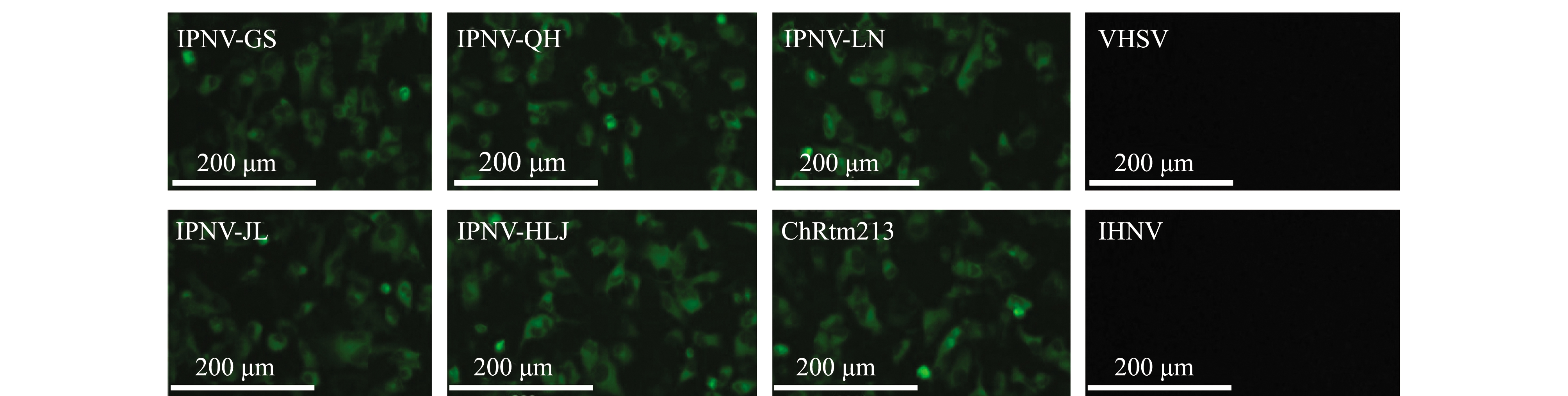
图7 VP3蛋白鼠抗血清的间接免疫荧光抗体检测结果
Fig.7 Indirect inmmunofluorescence antibody test(IFAT)result of the mice antisera against VP3 protein
3 讨论
传染性胰脏坏死病是鲑鳟鱼类最为严重的传染性疾病之一。根据毒株、宿主和环境因素的不同,传染性胰脏坏死病可造成患鱼10%~90%的死亡率[2,23],目前,中国尚无有效防控传染性胰脏坏死病的药物,该病的防控主要依赖切断病原的传播与扩散。由于IPNV血清型种类较多,且不同血清型毒株间免疫交叉反应程度不同。因此,针对中国现行IPNV的免疫学检测方法的建立对传染性胰脏坏死病的监测尤为重要。
3.1 中国现行IPNV的基因型
中国首次暴发传染性胰脏坏死病是在20世纪80年代,至今已有30余年。由于缺乏有效的防控药物与监管措施,IPNV在中国养殖环境中快速传播与扩散。流行病学调查显示,近年来,在中国东北、西北、西南等虹鳟主养区均有IPNV检出,给当地虹鳟养殖业造成了巨大的经济损失。从中国养殖环境中分离到的IPNV主要包含Genogroup Ⅰ型[9-10]和Genogroup Ⅴ型两种基因型,这两种基因型分别属于不同的血清型。本实验室近年在虹鳟流行病学调查过程中获得大量的Genogroup Ⅰ型IPNV分离株,因此,本研究中采用了课题组于2013年从中国某虹鳟养殖场分离的Genogroup Ⅰ型毒株制备了抗血清。为了检验该抗血清是否能应用到中国现存的两种基因型IPNV的监测,本研究中应用间接免疫荧光抗体法对抗血清识别IPNV分离株的能力进行了检验,结果发现,所制备的抗血清不但能够特异性识别Genogroup Ⅰ型IPNV毒株,而且能够特异性识别Genogroup Ⅴ型IPNV,并且该血清不与鲑鳟常见病毒IHNV和VHSV存在交叉反应。本研究中所制备的抗血清在IPNV的监测中将会发挥重要作用。
3.2 VP3蛋白在IPNV免疫学检测中的应用
VP2和VP3蛋白均为IPNV的主要结构蛋白,而VP2蛋白更多地被用于IPN的检测及免疫预防研究[24-28]。有研究表明,VP3和VP2蛋白同样具有抗原表位和中和抗体表位[17-18],且具有良好的免疫原性和反应原性[29]。因此,目前逐渐有学者开始利用VP3蛋白作为目标蛋白建立IPNV检测方法,如Espinoza等[30]和Milne等[25]利用VP3单克隆抗体分别建立了IPNV免疫印迹法和RT-PCR-ELISA法,均能实现IPNV的高效检测。此前,本课题组已制备了IPNV VP2蛋白的抗血清[14],且在本研究中表达了IPNV VP3蛋白,制备了VP3抗血清,不但丰富了IPNV免疫学检测手段,还可为VP3蛋白结构和功能的深入研究提供物质基础。
3.3 本研究中所制备的抗血清的应用价值
此前中国学者曾体外表达了Genogroup Ⅴ型IPNV的VP3蛋白[24],制备了单克隆抗体[31],成功将该抗体应用到Genogroup Ⅴ型IPNV的免疫学检测中,但并未验证其是否可应用于Genogroup Ⅰ型IPNV的检测。通过文献查阅可知,中国最初流行的IPNV为Genogroup Ⅴ型,Genogroup Ⅰ型的IPNV是近年分离鉴定的新毒株[9-10]。针对该现状,本研究中选择基因型为Genogroup Ⅰ的IPNV分离株,利用大肠杆菌Rosetta进行VP3蛋白的表达,经过镍离子亲和层析柱纯化,获得大量可溶性VP3蛋白,并成功制备了能够特异识别中国不同地区IPNV分离株的抗血清,该抗血清既可识别基因型为Genogroup Ⅰ的IPNV毒株,还可识别基因型为Genogroup Ⅴ的IPNV毒株,具有重要的现实意义。
4 结论
1)本研究中利用大肠杆菌Rosetta体外表达制备了Genogroup Ⅰ型IPNV ChRtm213毒株的重组VP3蛋白。
2)利用重组VP3蛋白制备了鼠抗血清,该血清不但能够特异性识别Genogroup Ⅰ型IPNV毒株,还能识别Genogroup Ⅴ型IPNV毒株,可用于IPNV的监测。
[1] 张奇亚.我国水生动物病毒病研究概况[J].水生生物学报,2002,26(1):89-101.
ZHANG Q Y.A Review of viral diseases of aquatic animals in China[J].Acta Hydrobiologica Sinica,2002,26(1):89-101.(in Chinese)
[2] ROBERTS R J,PEARSON M D.Infectious pancreatic necrosis in Atlantic salmon,Salmo salar L.[J].Journal of Fish Diseases,2005,28(7):383-390.
[3] JONKERS A R T,SHARKEY K J,THRUSH M A,et al.Epidemics and control strategies for diseases of farmed salmonids:a parameter study[J].Epidemics,2010,2(4):195-206.
[4] WOLF K,SNIESZKO S F,DUNBAR C E,et al.Virus nature of infectious pancreatic necrosis in trout[J].Proceedings of the Society for Experimental Biology and Medicine,1960,104(1):105-108.
[5] 江育林,徐伯亥,李伟,等.虹鳟传染性胰脏坏死病病毒(IPNV)的初步研究[J].水生生物学报,1989,13(4):353-358.
JIANG Y L,XU B H,LI W,et al.Isolation and identification of infectious pancreatic necrosis virus(IPNV)from imported rainbow trout(Salmon gairdneri)in P.R.China[J].Acta Hydrobiologica Sinica,1989,13(4):353-358.(in Chinese)
[6] 刘兴发,王熹洲,娄淑杰,等.虹鳟鱼传染性胰腺坏死病毒的分离与鉴定[J].中国兽医科技,1991,21(6):11-14.
LIIU X F,WANG X Z,LOU S J,et al.Isolation and identification of infectious pancreatic necrosis virus from rainbow trout[J].Chinese Journal of Veterinary Science and Tchenology,1991,21(6):11-14.(in Chinese)
[7] 童裳亮,HETRICK F M.山东虹鳟暴发传染性胰脏坏死病(IPN)[J].海洋通报,1989,8(1):118.
TONG S L,HETRICK F M.An outbreak of infectious pancreatic necrosis disease(IPN)in rainbow trout in Shandong Province[J].Marine Science Bulletin,1989,8(1):118.(in Chinese)
[8] 孙颖杰,陈文义,夏德昌,等.虹鳟鱼传染性胰脏坏死病毒的分离与鉴定[J].水产学杂志,1993,6(1):50-56.
SUN Y J,CHEN W Y,XIA D C,et al.Isolation and identification of infectious pancreatic necrosis virus from rainbow trout[J].Chinses Journal of Fisheries,1993,6(1):50-56.(in Chinese)
[9] JI F,ZHAO J Z,LIU M,et al.Complete genomic sequence of an infectious pancreatic necrosis virus isolated from rainbow trout(Oncorhynchus mykiss)in China[J].Virus Genes,2017,53(2):215-225.
[10] LING Z,WANG X L,WANG K Y,et al.Outbreak of infectious pancreatic necrosis virus(IPNV)in farmed rainbow trout in China[J].Acta Tropica,2017,170:63-69.
[11] OWERS R M,LAPATRA S E,DHAR A K.Detection and quantitation of infectious pancreatic necrosis virus by real-time reverse transcriptase-polymerase chain reaction using lethal and non-lethal tissue sampling[J].Journal of Virological Methods,2008,147(2):226-234.
[12] DOBOS P.The molecular biology of infectious pancreatic necrosis virus(IPNV)[J].Annual Review of Fish Diseases,1995,5:25-54.
[13] DUNCAN R,MASON C L,NAGY E,et al.Sequence analysis of infectious pancreatic necrosis virus genome segment B and its encoded VP1 protein:a putative RNA-dependent RNA polymerase lacking the Gly-Asp-Asp motif[J].Virology,1991,181(2):541-552.
[14] 赵景壮,贺文斌,徐黎明,等.虹鳟IPNV分离株VP2蛋白的表达及免疫原性检测[J].大连海洋大学学报,2019,34(2):179-185.
ZHAO J Z,HE W B,XU L M,et al.Expression and immunogenicity analysis of VP2 protein of a Chinese infectious pancreatic necrosis virus from diseased rainbow trout Oncorhynchus mykiss[J].Journal of Dalian Ocean University,2019,34(2):179-185.
[15] 刘淼,徐黎明,赵景壮,等.虹鳟传染性胰脏坏死病毒的分离鉴定及聚类分析[J].大连海洋大学学报,2017,32(1):56-61.
LIU M,XU L M,ZHAO J Z,et al.Isolation,identification and cluster analysis of an infectious pancreatic necrosis virus[J].Journal of Dalian Ocean University,2017,32(1):56-61.(in Chinese)
[16] 连科迅,赵丽丽,张琳琳,等.传染性胰腺坏死病毒VP2 COE蛋白单克隆抗体的制备与初步应用[J].水产学报,2013,37(8):1229-1235.
LIAN K X,ZHAO L L,ZHANG L L,et al.Preparation and preliminary application of monoclonal antibodies against VP2 COE protein of infectious pancreatic necrosis virus[J].Journal of Fisheries of China,2013,37(8):1229-1235.(in Chinese)
[17] TARRAB E,BERTHIAUME L,HEPPELL J,et al.Antigenic characterization of serogroup ‘A’ of infectious pancreatic necrosis virus with three panels of monoclonal antibodies[J].The Journal of General Virology,1993,74(Pt 9):2025-2030.
[18] PARK J W,JEONG G.Identification of VP3 as an important neutralising epitope from DRT strain,a Korean isolate of infectious pancreatic necrosis virus(IPNV)[J].Fish & Shellfish Immunology,1996,6(3):207-219.
[19] MOON C H,DO J W,CHA S J,et al.Comparison of the immunogenicity of recombinant VP2 and VP3 of infectious pancreatic necrosis virus and marine birnavirus[J].Archives of Virology,2004,149(10):2059-2068.
[20] BLAKE S,MA J Y,CAPORALE D A,et al.Phylogenetic relationships of aquatic birnaviruses based on deduced amino acid sequences of genome segment A cDNA[J].Diseases of Aquatic Organisms,2001,45(2):89-102.
[21] BAIN N,GREGORY A,RAYNARD R S.Genetic analysis of infectious pancreatic necrosis virus from Scotland[J].Journal of Fish Diseases,2008,31(1):37-47.
[22] 徐黎明,刘红柏,尹家胜,等.传染性造血器官坏死病毒糖蛋白原核表达及免疫原性分析[J].病毒学报,2013,29(5):529-534.
XU L M,LIU H B,YIN J S,et al.Prokaryotic expression and immunogenicity analysis of glycoprotein from infectious hematopoietic necrosis virus[J].Chinses Journal of Virology,2013,29(5):529-534.(in Chinses)
[23] BIERING E,VILLOING S,SOMMERSET I,et al.Update on viral vaccines for fish[J].Developments in Biologicals,2005,121:97-113.
[24] DIXON P F,HILL B J.Rapid detection of infectious pancreatic necrosis virus(IPNV)by the enzyme-linked immunosorbent assay(ELISA)[J].The Journal of General Virology,1983,64(Pt 2):321-330.
[25] MILNE S A,GALLACHER S,CASH P,et al.A reliable RT-PCR-ELISA method for the detection of infectious pancreatic necrosis virus(IPNV)in farmed rainbow trout[J].Journal of Virological Methods,2006,132(1/2):92-96.
[26] 王健楠.传染性胰腺坏死病毒VP2抗原表位区间接免疫荧光方法的建立[D].哈尔滨:东北农业大学,2012.
WANG J N.Establishment of indirect immunofluorescence assay(IFA)with epitope of VP2 of infectious pancreatic necrosis virus[D].Harbin:Northeast Agricultural University,2012.(in Chinese)
[27] 张琳琳,连科迅,张英,等.传染性胰坏死病毒双抗体夹心ELISA检测方法的建立[J].淡水渔业,2014,44(4):57-62,72.
ZHANG L L,LIAN K X,ZHANG Y,et al.Development of a double antibody sandwich ELISA for detection of infectious pancreatic necrosis virus[J].Freshwater Fisheries,2014,44(4):57-62,72.(in Chinese)
[28] 贺文斌.传染性胰脏坏死病毒VP2蛋白的酵母展示系统的建立和免疫保护效果初步评价[D].上海:上海海洋大学,2019.
HE W B.Establishment and preliminary protective effects evaluation of yeast surface display of infectious pancreatic necrosis virus VP2 protein[D].Shanghai:Shanghai Ocean University,2019.(in Chinese)
[29] 赵丽丽,刘敏,哈卓,等.传染性胰腺坏死病毒VP3蛋白的原核表达及抗原性分析[J].水产学报,2010,34(4):604-610.
ZHAO L L,LIU M,HA Z,et al.Prokaryotic expression of VP3 gene of infectious pancreatic necrosis virus and antigenicity of expressed product[J].Journal of Fisheries of China,2010,34(4):604-610.(in Chinese)
[30] ESPINOZA J C,KUZNAR J.Rapid simultaneous detection and quantitation of infectious pancreatic necrosis virus(IPNV)[J].Journal of Virological Methods,2002,105(1):81-85.
[31] 刘立月,刘巍巍,赵丽丽,等.抗传染性胰腺坏死病毒VP3蛋白单克隆抗体的制备[J].淡水渔业,2013,43(3):56-60.
LIU L Y,LIU W W,ZHAO L L,et al.Development of monoclonal antibodies against VP3 protein of infectious pancreatic necrosis virus[J].Freshwater Fisheries,2013,43(3):56-60.(in Chinese)