细菌性败血症是淡水鱼类养殖过程最常见的细菌性疾病之一,该病主要病原菌为气单胞菌属Aeromonas[1],其中,维氏气单胞菌Aeromonas veronii是近年来感染鱼类的主要病原菌之一。每年的夏秋等高温季节是该病暴发的高峰时期,一些重要的养殖经济鱼类品种如草鱼Ctenopharyngodon idellus、鲫Carassius aumtus、鳙Aristichthys nobilis、罗非鱼Oreochromis mossambicus、鲇Silurus soldatovi等均有暴发此类疾病的报道[2-6],该病常常造成养殖鱼类大规模发病死亡,给养殖户带来巨大的经济损失。
目前,诸多学者对多种鱼类进行了维氏气单胞菌疫苗免疫研究,并已取得了较好的预防效果[7-10],充分证明疫苗免疫对预防由维氏气单胞菌感染引起的细菌性败血症具有良好效用。因此,推进维氏气单胞菌疫苗的商品化、产业化进程,对于水产养殖业的健康发展和水产品安全具有十分重要的意义。
微生物发酵过程中液体培养基的组成、用量配比及发酵过程中接种量、温度、pH、转速等参数控制对微生物繁殖及代谢产物的累积均有直接的影响[11-14]。因此,若要提高微生物发酵的产量,在筛选出适宜发酵的培养基组成的同时,也需要对发酵的工艺参数进行优化。本研究中,通过单因素试验和响应面分析对维氏气单胞菌灭活疫苗的发酵参数进行优化,并比较了不同发酵条件对发酵菌液制备的灭活疫苗的安全性、免疫效力的影响,从而促使维氏气单胞菌灭活疫苗菌液活菌数增加产量并节约成本,旨在为产业化维氏气单胞菌灭活疫苗生产工艺提供科学参考。
1 材料与方法
1.1 材料
取健康异育银鲫Carassius auratus 600尾(体质量12~16 g)于水泥池中暂养,水温27~29 ℃的水环境下饲养7 d以上,用于后续安全性试验、免疫试验。
菌种:维氏气单胞菌CA07,由中国水产科学研究院珠江水产研究所从患细菌性败血病鲫肾脏中分离、鉴定和保存。
维氏气单胞菌LY02,由中国水产科学研究院珠江水产研究所从患细菌性败血病鲢Hypophthalmichthys molitrix肾脏中分离、鉴定和保存。
基础培养基(营养肉汤培养基NB):蛋白胨10.0 g/L、牛肉膏3.0 g/L和氯化钠5.0 g/L,固体培养基另加琼脂18.0 g/L。
发酵培养基:蛋白胨10.8 g/L、牛肉膏5.0 g/L、葡萄糖5.0 g/L、硫酸镁0.4 g/L、磷酸二氢钾2.0 g/L和氯化钠5.0 g/L。
仪器:恒温摇床(ZWY-211B,上海智诚分析仪器制造有限公司)、紫外分光光度计(UV1800PC,上海奥析科学仪器有限公司)。
1.2 方法
1.2.1 二级种子液制备 将维氏气单胞菌CA07菌种用营养肉汤培养基溶解后,划线接种于营养琼脂平板,28 ℃下培养 24 h,挑取典型菌落接种于含营养肉汤液体培养基中,于28 ℃条件下震荡培养18~20 h,作为一级种子液。
1.2.2 单因素试验 配制发酵培养基分装于三角瓶(300 mL/瓶)中,分别接种一级种子液,进行单因素试验时,其他发酵条件(接种量10%、培养基初始浓度7.5、温度31 ℃、转速200 r/min)保持不变,分别考察接种量(1%、5%、10%、15%、20%,均为体积分数,下同)、培养基初始pH(6.5、7.0、7.5、8.0、8.5)、温度(25、28、31、34、37 ℃)和转速(160、180、200、220、240 r/min)等发酵参数对维氏气单胞菌CA07生长的影响,得出最佳参数对活菌数的影响。
1.2.3 响应面试验对发酵培养基的优化 结合单因素试验结果,利用响应面Box-Behnken试验,设计温度、培养基初始pH、转速3因素3水平响应面试验方案,采用 Design Expert 12.0 软件进行响应面分析。
1.2.4 优化后发酵工艺验证试验 在响应面法优化的发酵条件下进行发酵试验,通过比较预测值和试验值验证模型的有效性。用优化后的发酵工艺,采用三角瓶发酵培养维氏气单胞菌CA07,培养结束后测定维氏气单胞菌CA07菌的活菌数。
1.2.5 安全性及免疫效力比较试验 筛选响应面试验中活菌数最低量组(L)、中位量组的发酵菌液(M)及优化后的验证试验发酵菌液组(H)分别添加甲醛溶液(甲醛溶液终体积分数为0.30%),37 ℃下灭活24 h制备灭活疫苗。将制备的灭活疫苗分为原液组、稀释组(原液组以灭菌生理盐水稀释)备用。
1)安全性试验。取健康鲫120 尾,随机分为4 组,每组30 尾。3个免疫组(L、M、H组)腹腔分别注射灭活菌液0.20 mL/尾,1个对照组腹腔注射生理盐水0.20 mL/尾,观察14 d,每日记录各组鱼的死亡数。
2)免疫效力比较试验。取健康鲫210 尾,随机分为7组,每组30 尾。6个免疫组(L、M、H原液组及L、M、H稀释组)腹腔分别注射灭活菌液0.20 mL/尾,1个对照组腹腔注射生理盐水0.20 mL/尾。免疫28 d后,免疫组和对照组各腹腔注射维氏气单胞菌CA07株菌液进行攻毒,攻毒后观察7 d,每日记录各组鱼的死亡数,比较不同发酵条件下CA07株疫苗的免疫效果。
取健康鲫120 尾,随机分为4 组,每组30 尾。2个免疫组腹腔分别注射CA07灭活菌液0.20 mL/尾(灭活前菌液活菌数约4.0×109 CFU/mL),2个对照组腹腔分别注射生理盐水0.20 mL/尾。免疫28 d后,免疫组和对照组分别以CA07株菌液、LY02株菌液进行攻毒,攻毒后观察7 d,每日记录各组鱼的死亡数,比较维氏气单胞菌不同菌株对CA07株疫苗的免疫交叉保护效果。疫苗相对免疫保护率(RPS,%)计算公式为
RPS=(1-免疫组死亡率/对照组死亡率)× 100%。
1.3 数据处理
单因素试验数据采用用SPSS 17软件进行统计和差异显著性分析,响应面试验数据采用 Design Expert 12.0 软件进行响应面分析。
2 结果与分析
2.1 接种量对维氏气单胞菌CA07生长的影响
从图1可见:维氏气单胞菌CA07在接种量为1%时,培养后活菌数最低,随着接种量体积的增加,活菌数也随之升高;当接种量提升为5%时,培养后活菌数最高(5.50×109 CFU/mL),活菌数增加显著(P<0.05),之后随着接种量的增加活菌数略有下降。考虑到规模化生产过程中节约成本等要求,因此,选择5%为最佳接种量。

标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.
图1 不同接种量对维氏气单胞菌CA07株生长的影响
Fig.1 Effects of inoculum amount on the growth of Aeromonas veronii CA07
2.2 培养基初始pH对维氏气单胞菌CA07生长的影响
从图2可见:发酵培养基中初始pH对维氏气单胞菌CA07菌液的浓度影响较大,当初始pH为6.5~8.5时,随着pH增大,维氏气单胞菌CA07菌液的活菌数呈先增加后减少的趋势;当初始pH为7.5时,活菌数达到最大(5.67×109 CFU/mL),活菌数增加显著(P<0.05)。这表明,过酸或偏碱性条件下会抑制该菌的生长。因此,选择7.5为最佳培养基初始pH。
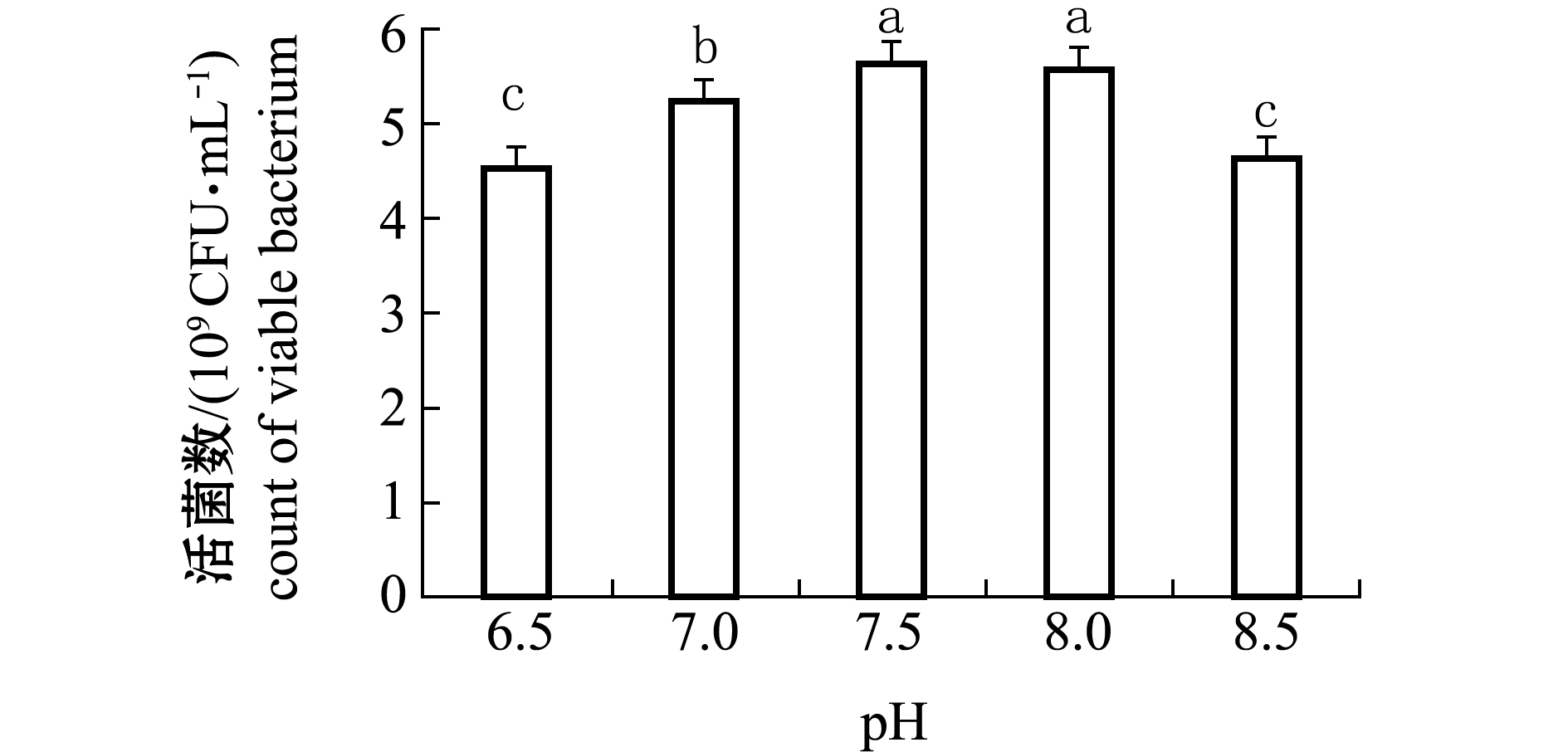
图2 不同pH对维氏气单胞菌CA07株生长的影响
Fig.2 Effects of pH on the growth of Aeromonas veronii CA07
2.3 温度对维氏气单胞菌CA07生长的影响
从图3可见:25 ℃时菌体生长较缓慢,发酵温度上升为28 ℃时活菌数显著提高(P<0.05),活菌数达到最大(6.07×109 CFU/mL);当温度升高至31 ℃时,活菌数开始下降。因此,选择28 ℃为最佳发酵温度。
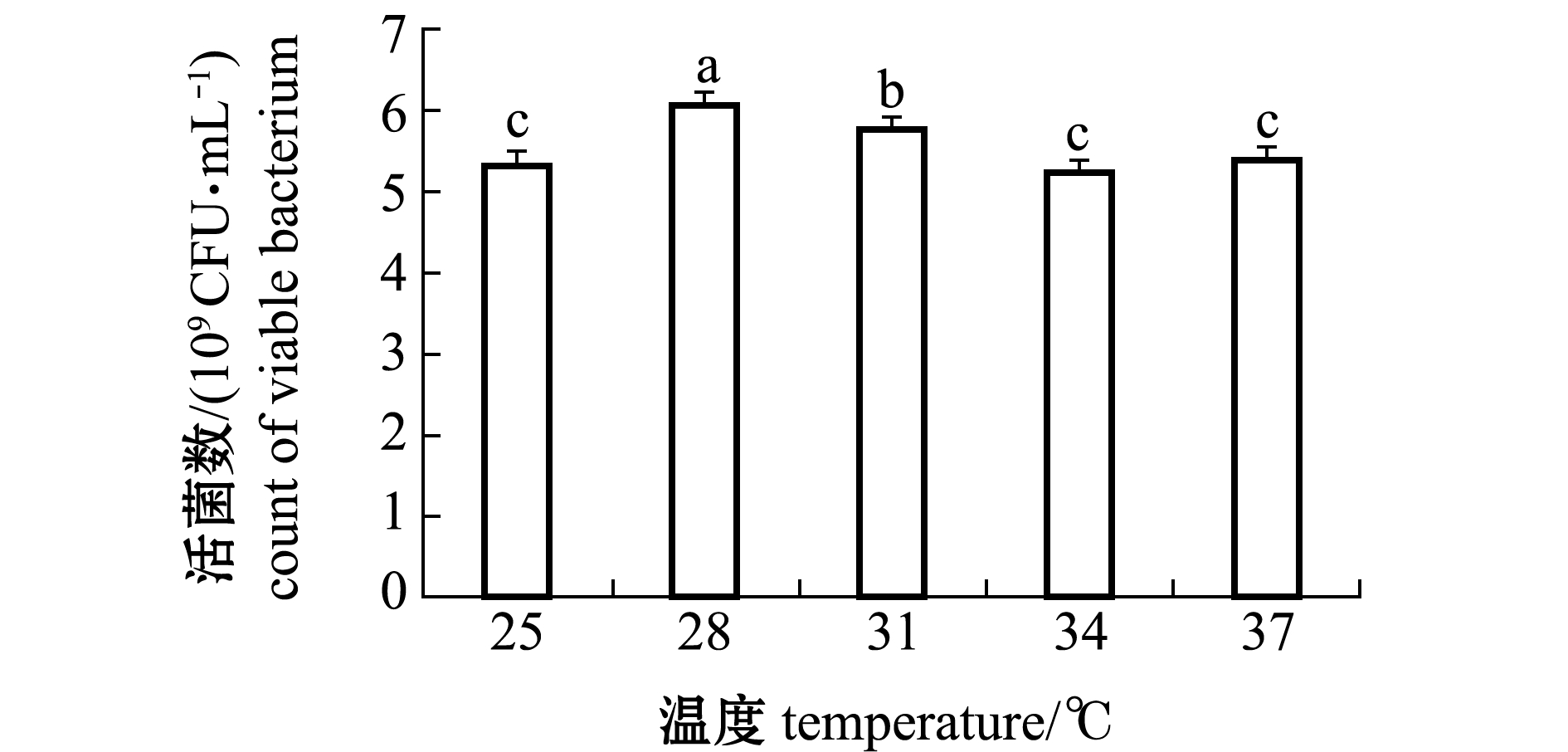
图3 不同温度对维氏气单胞菌CA07株生长的影响
Fig.3 Effects of temperature on the growth of Aeromonas veronii CA07
2.4 转速对维氏气单胞菌CA07生长的影响
从图4可见:当转速从160 r/min升至220 r/min时,维氏气单胞菌CA07发酵活菌数呈上升趋势;当转速达到220 r/min时,活菌数达最高(9.23×109 CFU/mL)活菌数增加显著(P<0.05);当转速达到240 r/min时,发酵菌液活菌数呈下降趋势。因此,选择220 r/min为最佳发酵转速。
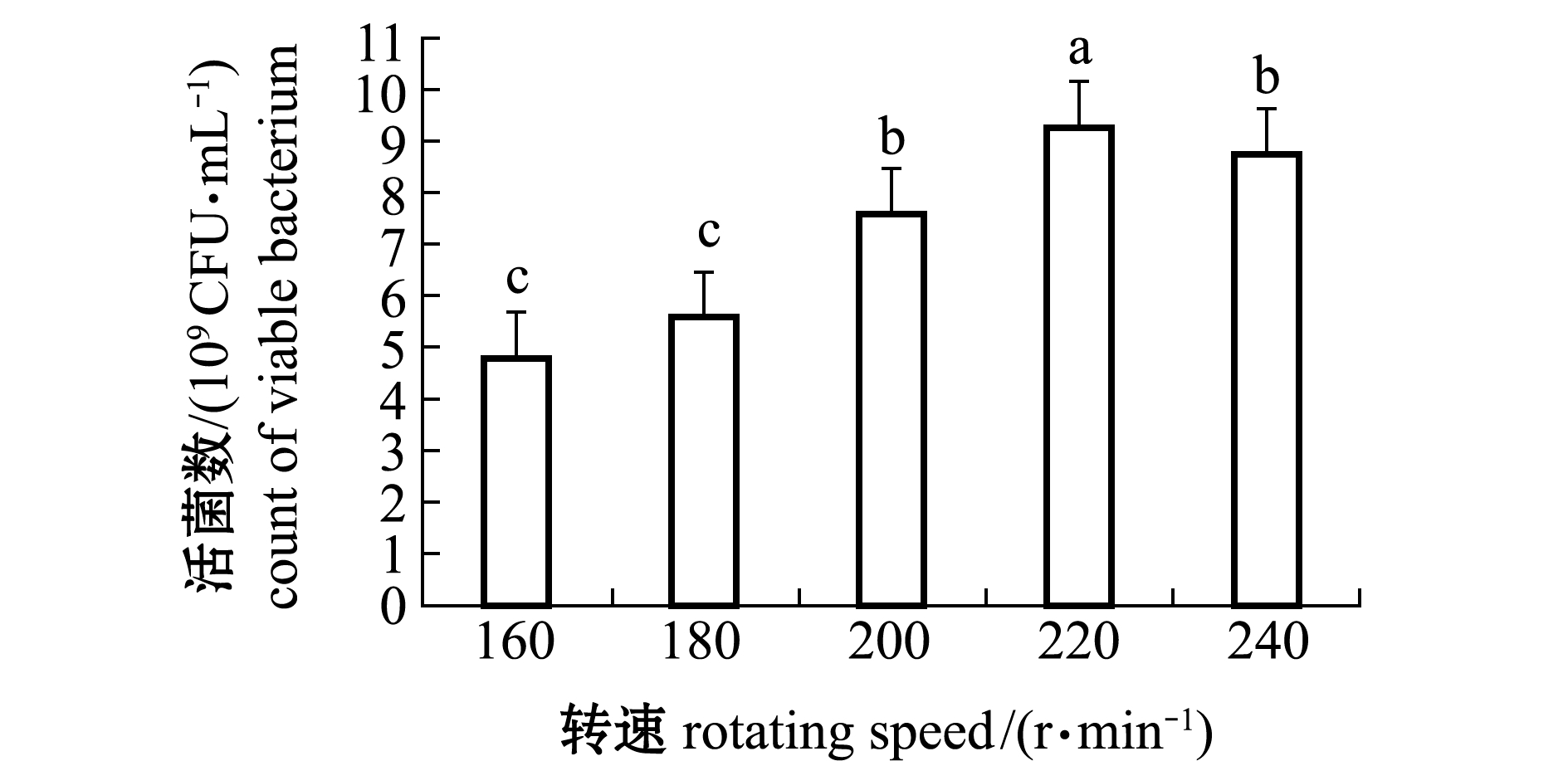
图4 不同转速对维氏气单胞菌CA07株生长的影响
Fig.4 Effects of rotating speed on the growth of Aeromonas veronii CA07
2.5 响应面优化试验
2.5.1 响应面优化试验设计及结果 根据单因素试验结果,选取温度(A)、pH(B)和转速(C)3个因素进行响应面优化设计(表1),以活菌数(Y)为响应值进行试验,维氏气单胞菌培养菌液Box-Behnken 试验结果如表2所示。
表1 响应面试验设计因素与水平
Tab.1 Factors and levels in response surface experimental design
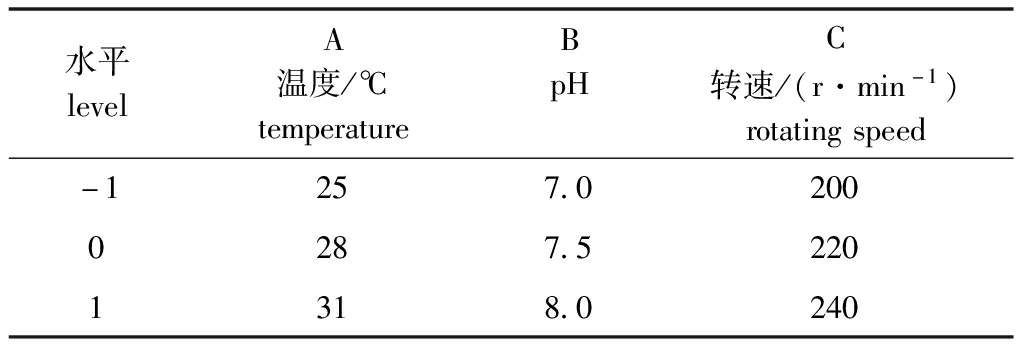
水平levelA温度/℃temperatureBpHC转速/(r·min-1)rotatingspeed-1257.02000287.52201318.0240
2.5.2 模型建立与方差分析 利用Design Expert 8.0软件对表2的结果进行回归分析,得到活菌数回归方程为
表2 Box-Behnken 试验设计及结果
Tab.2 Experimental design and results of Box-Behnken

试验号No.A温度BpHC转速活菌数/(109CFU·mL-1)countofviablebacterium1-1-106.4621-106.243-1106.7841107.475-10-16.75610-17.547-1018.1581018.4590-1-16.831001-17.16110-118.48120118.671300010.851400010.771500011.031600010.271700010.67
Y=10.72+0.32A+0.13B+0.68C-0.02AB-0.12AC-0.03BC-1.90A2-1.83B2-1.10C2。
决定系数R2=0.990 1,表示有99.01%的数据可以采用该模型解释,调整决定系数![]() 说明该方程的拟合性较好,可以用来进行分析。
说明该方程的拟合性较好,可以用来进行分析。
对回归方程进行方差分析显示:模型P<0.001,表明此模型达到极显著水平;回归方程中温度、转速的一次项达到了显著的水平(P<0.05),说明在试验范围内这两个因素对活菌数的积累有显著性影响;在交叉项中,温度、pH、转速三者的交互作用对活菌数无显著性影响(P>0.05);二次项中,温度、pH、转速三者对活菌数的积累均有极显著性影响(P<0.001)(表3)。
表3 响应面模型方差分析
Tab.3 ANOVA for response surface model
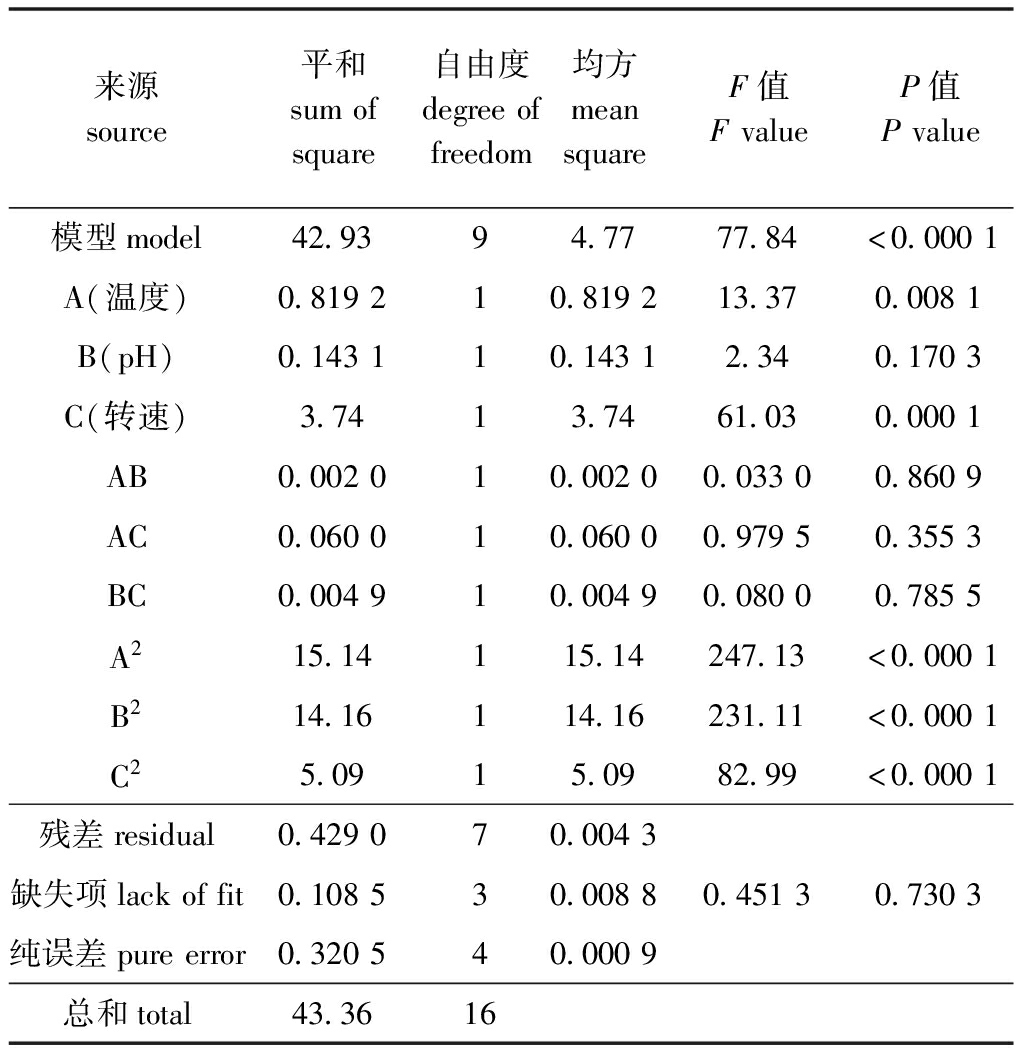
来源source平和sumofsquare自由度degreeoffreedom均方meansquareF值FvalueP值Pvalue模型model42.9394.7777.84<0.0001A(温度)0.819210.819213.370.0081B(pH)0.143110.14312.340.1703C(转速)3.7413.7461.030.0001AB0.002010.00200.03300.8609AC0.060010.06000.97950.3553BC0.004910.00490.08000.7855A215.14115.14247.13<0.0001B214.16114.16231.11<0.0001C25.0915.0982.99<0.0001残差residual0.429070.0043缺失项lackoffit0.108530.00880.45130.7303纯误差pureerror0.320540.0009总和total43.3616
2.5.3 响应面图分析 各因素交互作用对菌株发酵活菌数结果的影响见图5。若响应面曲面图的倾斜坡度陡峭,表明发酵条件的变化对响应值(活菌数)的影响显著;如果响应面曲面图的倾斜坡度相对平缓,则表明发酵条件的变化对响应值(活菌数)的影响不敏感。由图5可知,随着3个因素水平的逐渐增高,活菌数值呈先增后降的趋势,交互作用的3个响应面均出现极大值。
等高线的形状可反映出交互作用的显著性,等高线呈椭圆形表示两因素交互作用显著,等高线呈圆形表示交互作用不显著,因此,可以通过等高线图直观观察到A与B、A与C和B与C间相互作用的重要性。图5中,A(温度)、B(pH)、C(转速)均对响应指标(活菌数)有显著影响,其中AC(温度与转速)、BC(pH与转速)的交互作用相对较强,对活菌数的影响相对较大,呈现较大角度的椭圆形,而AB(温度与pH)次之,椭圆形的角度相对较小。以上结果与响应面二次模型的方差分析结果一致。

图5 各因素交互作用对活菌数影响的响应面
Fig.5 Response surface plots and contour lines of effects of interaction between various factors on count of viable bacterium
2.6 验证试验
根据响应面分析预测的最佳培养条件为温度28.22 ℃、pH 7.52、转速226.14 r/min,在此条件下预测的活菌数最大值为10.84×109 CFU/mL。为了验证模型预测的准确性,依据响应面试验优化得到的发酵条件,为方便操作,将上述发酵条件设定为温度28 ℃、pH 7.5、转速230 r/min,并进行验证性试验,得到活菌数为11.13×109 CFU/mL,较单因素试验最高活菌数值(9.23×109 CFU/mL)提高20.59%,与预测值基本相符。
2.7 发酵菌液灭活疫苗安全性试验
选取响应面试验结果中活菌数最低量2#组(L)、中位量8#组(M)及优化组(H)菌液进行疫苗安全性试验,结果显示,各试验组灭活疫苗注射鱼及对照组试验鱼均全部健活,免疫鱼未出现临床症状,摄食、游姿及体色均正常,注射部位无红肿,内脏器官无病变(表4),表明不同发酵条件下,发酵菌液制备的灭活疫苗安全性良好。
表4 不同发酵条件下菌液制备的疫苗安全性比较
Tab.4 Comparison of safety of vaccines prepared by different fermentation conditions

组别group免疫数/ind.immunenumber免疫疫苗浓度/(CFU·mL-1)immunevaccineconcentration死亡数/ind.deadnumber异常/病变abnormality/lesion2#(L)306.24×1090无8#(M)308.45×1090无优化组(H)3011.13×1090无对照组(生理盐水)control(normalsaline)3000无
2.8 发酵菌液灭活疫苗免疫效力的比较
对原液组、稀释组免疫后用CA07菌液进行攻毒试验,免疫结果显示:原液试验组相对免疫保护率在90%以上,随着疫苗活菌数增加,保护率可达到100%,表明优化发酵条件可提高发酵菌液制备灭活疫苗的活菌数,从而显著提高疫苗的相对保护率;稀释试验组中优化发酵菌液的灭活疫苗经过3倍稀释,相对免疫保护率仍然可以达到70%以上,不同发酵条件对疫苗的免疫效果未产生不利影响,这表明,通过优化发酵条件可以获得更高活菌数的菌液,在达到疫苗免疫效果要求的前提下,通过稀释可以显著节约成本,获得更高产量(表5)。
表5 不同发酵条件下菌液制备的疫苗免疫效力比较
Tab.5 Comparison of immune efficacy of vaccines prepared by different fermentation conditions
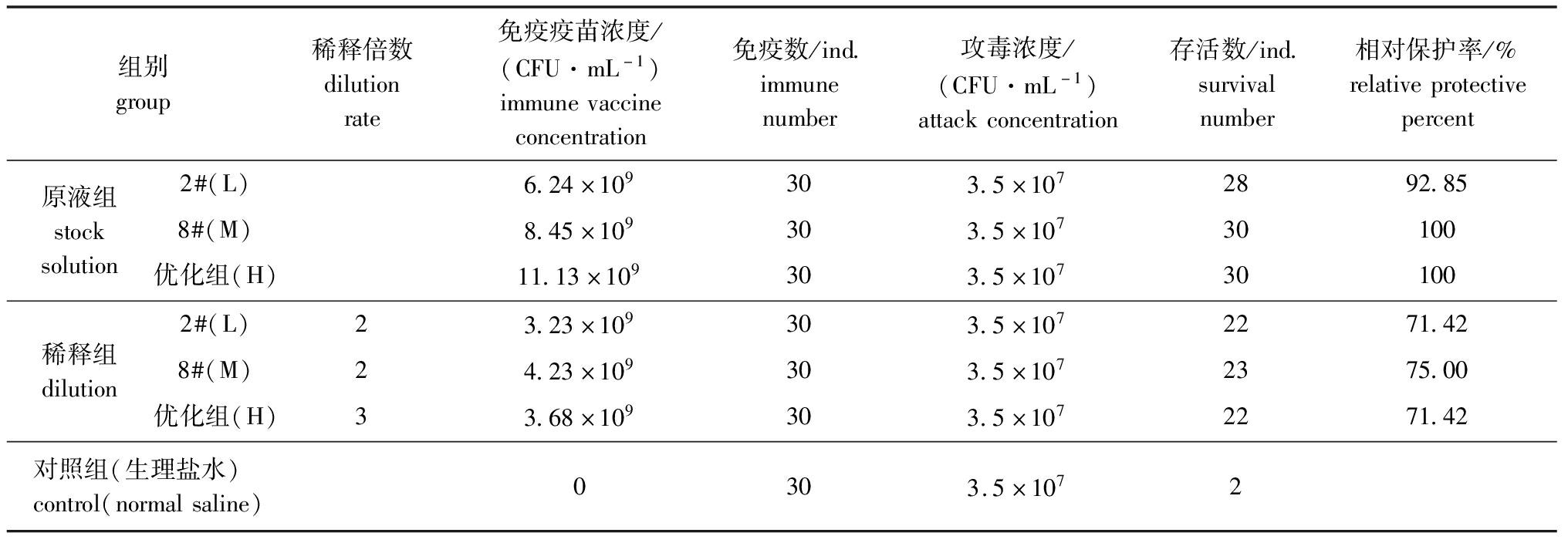
组别group稀释倍数dilutionrate免疫疫苗浓度/(CFU·mL-1)immunevaccineconcentration免疫数/ind.immunenumber攻毒浓度/(CFU·mL-1)attackconcentration存活数/ind.survivalnumber相对保护率/%relativeprotectivepercent原液组stocksolution2#(L)6.24×109303.5×1072892.858#(M)8.45×109303.5×10730100优化组(H)11.13×109303.5×10730100稀释组dilution2#(L)23.23×109303.5×1072271.428#(M)24.23×109303.5×1072375.00优化组(H)33.68×109303.5×1072271.42对照组(生理盐水)control(normalsaline)0303.5×1072
进一步通过试验对比维氏气单胞菌疫苗菌株CA07株与LY02株的交叉免疫效果,结果显示,CA07株对LY02株的相对保护率在42.31%,表明疫苗菌株CA07株与LY02株间存在一定的交叉保护作用(表6)。
表6 CA07株菌液制备的疫苗与LY02株交叉免疫效力比较
Tab.6 Comparison of cross immunization efficacy of CA07 strain vaccine between CA07 strain and LY02 strain
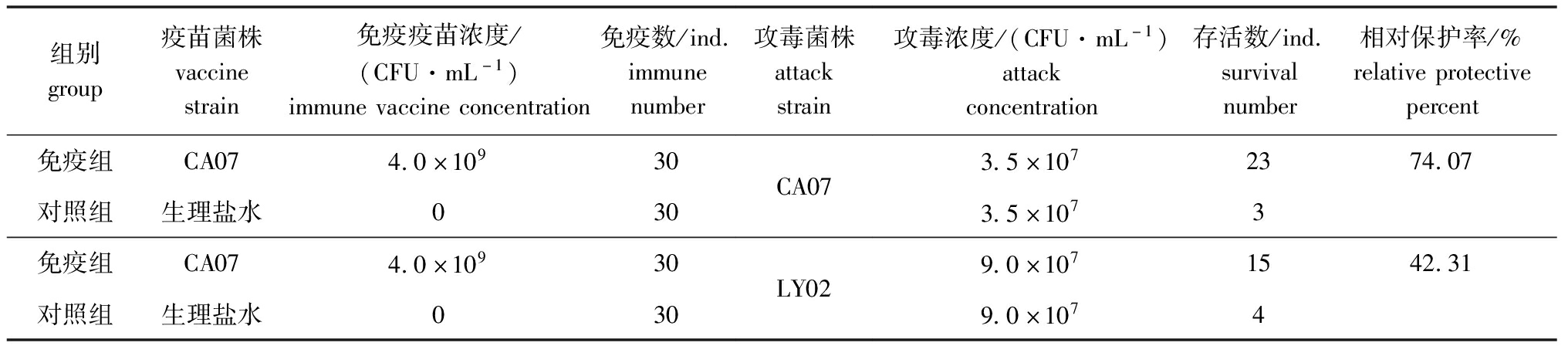
组别group疫苗菌株vaccinestrain免疫疫苗浓度/(CFU·mL-1)immunevaccineconcentration免疫数/ind.immunenumber攻毒菌株attackstrain攻毒浓度/(CFU·mL-1)attackconcentration存活数/ind.survivalnumber相对保护率/%relativeprotectivepercent免疫组CA074.0×10930对照组生理盐水030CA073.5×1072374.073.5×1073免疫组CA074.0×10930对照组生理盐水030LY029.0×1071542.319.0×1074
3 讨论
3.1 单因素试验
本研究中通过考察不同转速、温度、培养基初始pH和接种量对维氏气单胞菌CA07株发酵菌液活菌数的影响,结果表明,温度、转速、培养基初始pH较接种量对发酵菌液活菌数的影响更明显,这3个因素可以作为响应面考察因子进一步研究。相关研究中,张晓青等[15]通过单因素试验考察不同的转速、温度、初始pH和接种量对红球菌SY095发酵液表面张力的影响,通过单因素试验结果比较,选取转速、温度、初始pH作为响应面试验考察因子。韩旭东等[16]考察不同的发酵温度、培养基pH、接种量和发酵时间对芽孢杆菌ZYCHH-01发酵生产抑菌物质的影响,通过对单因素试验结果比较,选取了以发酵温度、培养基pH、发酵时间作为响应面试验考察因子。
3.2 响应面分析
目前,单因素法、正交试验法、响应面优化法已广泛应用于生产实践及对微生物发酵条件优化的科学研究中。其中,单因素法、正交试验法存在一些缺陷,如忽略了因素间的交互作用,无法找到整个区域的最优值等;而响应面优化法得到的数据更精确、更全面,对试验有显著影响的因素都可以用响应面优化法进行优化,在微生物发酵条件的优化中越来越多的应用[17]。有研究表明,通过响应面法优化后验证实测的结果与理论预测值接近,李书颖等[18]使用单因素试验和响应面法对解淀粉芽孢杆菌发酵参数进行优化,在优化条件下测定的OD600 nm平均值为1.747,与模型预测值相对误差约为1%。张安宁等[19]在香菇液态发酵单因素试验基础上,通过响应面法对发酵条件进行优化试验,按照最佳条件培养,菌丝生物量实测值为17.76 g/L,与理论值17.58 g/L相差1.02%。也有研究表明,响应面法优化后验证实测的结果较优化前增加显著,如王垚等[20]通过响应面法优化一株产纤维素酶嗜盐真菌产酶条件,优化后,纤维素酶活力由113.3 U/mL提高到302.8 U/mL,提高了167%;冒鑫哲等[21]通过单因素试验和响应面优化枯草芽孢杆菌工程菌产角蛋白酶发酵条件,优化后,摇瓶发酵24 h 角蛋白酶活性达到260 480 U/mL,较优化前提高了4.26 倍。韩学易等[22]利用响应面分析法(RSM)对基因工程菌WH320-pHIS1525-G7产纤维素酶发酵条件进行优化,优化发酵条件下测得纤维素酶活力为2.152 U/mL,比优化前摇瓶发酵酶活力提高了2倍。
本研究中,首先采用单因素试验方法确定出温度、培养基初始pH与转速为关键因素,然后通过响应面Box-Behnken试验分析确定出关键因素的最佳值,得到的最佳发酵工艺条件为温度28 ℃、pH 7.5、转速230 r/min,在此优化发酵条件下,试验得到的活菌数最大值为11.13×109 CFU/mL,较单因素试验最高活菌数值提高20.59%,与预测值基本相符。响应面Box-Behnken试验方法可以建立变量曲面模型和回归方程,根据响应面曲面图的倾斜坡度、等高线的形状,能够快速、有效地从发酵条件中筛选出影响活菌数的关键因素,并实现其优化得到最佳的发酵工艺条件,说明回归方程可较真实地反映各筛选因素的影响,同时证明用响应面法来寻找维氏气单胞菌的最佳发酵工艺条件是可行、有效的。
3.3 不同发酵条件对疫苗免疫效力的影响
本研究中,通过对比不同发酵条件下菌液制备维氏气单胞菌CA07株灭活疫苗的安全性试验,结果表明,发酵条件对维氏气单胞菌CA07株灭活疫苗的安全性无影响。在免疫效力方面,不同发酵条件下制备的疫苗,原液组随着活菌数的提高,相对免疫保护率也显著增加。稀释组免疫鲫,优化组即使稀释3倍,相对免疫保护率也达到70%以上。优化后发酵条件下可以获得更高浓度的活菌数,且制备疫苗可以显著节约成本,提高产量。维氏气单胞菌CA07株灭活疫苗免疫鲫后,以鲢源维氏气单胞菌LY02株攻毒,相对免疫保护率达42.31%,表明该菌株与LY02株具有较强的交叉免疫保护作用。
4 结论
1)通过单因素试验、响应面法优化维氏气单胞菌菌液发酵工艺,初步建立维氏气单胞菌灭活疫苗菌液发酵参数,即温度为28 ℃,pH为7.5,转速为230 r/min,接种量为5%,在此工艺下发酵的菌液活菌数达11.13×109 CFU/mL,较单因素试验最高活菌产量显著提高20.59%。
2)通过优化发酵工艺发酵菌液制备的灭活疫苗安全性良好,相对免疫保护率达到70%以上,与LY02株交叉免疫保护率达42.31%。
[1] 张德锋,刘礼辉,李宁求,等.我国南方地区鱼源气单胞菌不同种类的流行特征[J].水产科学,2015,34(11):673-682.
ZHANG D F,LIU L H,LI N Q,et al.Epidemic characteristics of different species of Aeromonas in diseased fish in southern China[J].Fisheries Science,2015,34(11): 673-682.(in Chinese)
[2] 高彩霞,任燕,王庆,等.草鱼源致病性维氏气单胞菌的分离鉴定及药物敏感性分析[J].安徽农业大学学报,2018,45(3):409-415.
GAO C X,REN Y,WANG Q,et al.Isolation,identification and antimicrobial susceptibility of pathogenic Aeromonas veronii isolated from grass carp[J].Journal of Anhui Agricultural University,2018,45(3):409-415.(in Chinese)
[3] 张冬星,康元环,田佳鑫,等.鲫鱼源致病性维氏气单胞菌的分离鉴定及药敏试验[J].中国兽医科学,2017,47(3):366-374.
ZHANG D X,KANG Y H,TIAN J X,et al.Isolation,identification and drug susceptibility of the pathogenic Aeromonas veronii from Carassius auratus[J].Chinese Veterinary Science,2017,47(3):366-374.(in Chinese)
[4] 朱若林,马腾,陈露,等.鳙鱼维氏气单胞菌的分离鉴定及其毒力基因检测[J].安徽农业大学学报,2017,44(2):229-233.
ZHU R L,MA T,CHEN L,et al.Isolation,identification and virulence genes detection of Aeromonas veronii from Aristichthys nobilis[J].Journal of Anhui Agricultural University,2017,44(2): 229-233.(in Chinese)
[5] 李聪,蔡岩,周永灿,等.海南罗非鱼致病性维氏气单胞菌分离鉴定及药敏特性研究[J].水产科学,2015,34(10):640-646.
LI C,CAI Y,ZHOU Y C,et al.Isolation,identification and antibiotic sensitivity of Aeromonas veronii from tilapia cultured in Hainan Province[J].Fisheries Science,2015,34(10):640-646.(in Chinese)
[6] 陆梦莹,胡秀彩,吕爱军,等.鲶源维氏气单胞菌的分离鉴定及药敏特性[J].大连海洋大学学报,2017,32(5):563-567.
LU M Y,HU X C,LÜ A J,et al.Isolation,identification and susceptibility of Aeromonas veronii from diseased northern sheatfish Silurus soldatovi[J].Journal of Dalian Ocean University,2017,32(5):563-567.(in Chinese)
[7] 任燕,时云朵,曾伟伟,等.维氏气单胞菌灭活疫苗对草鱼免疫相关基因表达的影响及其保护效果[J].中国生物制品学杂志,2019,32(7):726-731.
REN Y,SHI Y D,ZENG W W,et al.Expression of immunity-associated genes and protective effect in grass carps immunized by inactivated Aeromonas veronii vaccine[J].Chinese Journal of Biologicals,2019,32(7):726-731.(in Chinese)
[8] ZHANG H P,CHEN M Y,XU Y X,et al.An effective live attenuated vaccine against Aeromonas veronii infection in the loach(Misgurnus anguillicaudatus)[J].Fish & Shellfish Immunology,2020,104:269-278.
[9] SONG M F,KANG Y H,ZHANG D X,et al.Immunogenicity of extracellular products from an inactivated vaccine against Aeromonas veronii TH0426 in koi,Cyprinus carpio[J].Fish & Shellfish Immunology,2018,81:176-181.
[10] KONG Y D,KANG Y H,TIAN J X,et al.Oral immunization with recombinant Lactobacillus casei expressing flaB confers protection against Aeromonas veronii challenge in common carp,Cyprinus carpio[J].Fish & Shellfish Immunology,2019,87:627-637.
[11] 杨求华.渔源解淀粉芽孢杆菌CQN-2菌株培养基及发酵条件优化[J].渔业研究,2020,42(4):339-347.
YANG Q H.Optimization of culture medium and fermentation conditions of Bacillus amyloliquefaciens CQN-2 isolated from aquatic animal[J].Journal of Fisheries Research,2020,42(4):339-347.(in Chinese)
[12] 蒋晶晶,王春明,陈明,等.内生拮抗细菌X1-6-1的鉴定、发酵条件优化及抑菌作用研究[J].甘肃农业大学学报,2020,55(3):113-120.
JIANG J J,WANG C M,CHEN M,et al.Identification and optimized fermentation condition of an endophyte antagonisitic bacteria X1-6-1 and its antibacterial effects[J].Journal of Gansu Agricultural University,2020,55(3):113-120.(in Chinese)
[13] 贺晓凌,张先楠,孟红艳,等.响应面法优化产细菌纤维素菌发酵条件[J].天津工业大学学报,2020,39(3):54-60.
HE X L,ZHANG X N,MENG H Y,et al.Optimization of fermentation conditions for enhanced bacterial cellulose production by using response surface method[J].Journal of Tiangong University,2020,39(3):54-60.(in Chinese)
[14] 陈丹丹,李圆圆,齐素敏,等.一株青枯菌拮抗细菌M26的筛选、鉴定及其发酵条件优化[J].山东农业科学,2020,52(9):114-118.
CHEN D D,LI Y Y,QI S M,et al.Screening,identification and fermentation optimization of an antagonistic bacterium M26 to Ralstonia solanacearum[J].Shandong Agricultural Sciences,2020,52(9):114-118.(in Chinese)
[15] 张晓青,郝建安,司晓光,等.响应面法优化红球菌产生物表面活性剂的发酵条件[J].生物加工过程,2016,14(4):12-16.
ZHANG X Q,HAO J A,SI X G,et al.Optimization of biosurfactant production by Rhodococcus SY095 with response surface methodology[J].Chinese Journal of Bioprocess Engineering,2016,14(4):12-16.(in Chinese)
[16] 韩旭东,张玉苍,李瑞松,等.芽孢杆菌ZYCHH-01发酵条件优化及其抑菌物质的研究[J].中国酿造,2020,39(2):38-43.
HAN X D,ZHANG Y C,LI R S,et al.Fermentation optimization and antibacterial substances of Bacillus sp.ZYCHH-01[J].China Brewing,2020,39(2):38-43.(in Chinese)
[17] 刘杰,王延鹏,许晶,等.响应面法优化壳聚糖酶产生菌Mitsuaria sp.K1的产酶发酵条件[J].化工进展,2013,32(12):2946-2951.
LIU J,WANG Y P,XU J,et al.Optimization of fermentation conditions of Mitsuaria sp.K1 for chitosanase production by response surface methodology[J].Chemical Industry and Engineering Progress,2013,32(12):2946-2951.(in Chinese)
[18] 李书颖,朱天辉.响应面法优化杜仲黑斑病菌生防芽孢杆菌的发酵参数[J].植物保护,2020,46(5):133-141.
LI S Y,ZHU T H.Optimization of fermentation parameters of Bacillus amyloliquefaciens against Pestalotiopsis trachicarpicola by using response surface methodology[J].Plant Protection,2020,46(5):133-141.(in Chinese)
[19] 张安宁,刘连成.响应面法优化香菇液体发酵条件[J].江苏农业科学,2014,42(3):200-203.
ZHANG A N,LIU L C.Optimization of fermentation parameters of Lentinula edodes by using response surface methodology[J].Jiangsu Agricultural Sciences,2014,42(3):200-203.(in Chinese)
[20] 王垚,徐志鸿,虞泓,等.一株产纤维素酶嗜盐真菌的分离、鉴定及发酵条件优化[J].菌物学报,2019,38(3):393-402.
WANG Y,XU Z H,YU H,et al.Isolation and identification of a cellulase-produced halophilic fungus and process optimization of cellulase production[J].Mycosystema,2019,38(3):393-402.(in Chinese)
[21] 冒鑫哲,彭政,周冠宇,等.枯草芽孢杆菌高产角蛋白酶发酵条件优化[J].食品与发酵工业,2020,46(17):138-144.
MAO X Z,PENG Z,ZHOU G Y,et al.Optimized fermentation for improving keratinase production by Bacillus subtilis WB600[J].Food and Fermentation Industries,2020,46(17): 138-144.(in Chinese)
[22] 韩学易,唐自钟,胡云龙,等.响应面法优化巨大芽孢杆菌产纤维素酶发酵条件[J].四川农业大学学报,2013,31(3):319-321,334.
HAN X Y,TANG Z Z,HU Y L,et al.Optimization of Bacillus megaterium cellulase production for submerged fermentation by response surface methodology[J].Journal of Sichuan Agricultural University,2013,31(3):319-321,334.(in Chinese)